Method Article
작업 기반 기능적 자기 공명 영상(Task-based Functional Magnetic Resonance Imaging)을 사용하여 강박 장애에서 인지적 재평가의 신경 상관관계 탐색
요약
우리는 기능적 자기 공명 영상(functional magnetic resonance imaging)을 사용하여 인지 감정 조절 작업, 즉 인지 재평가의 신경 상관관계를 탐색하기 위한 프로토콜을 소개합니다. 이 프로토콜은 강박 장애 및 건강한 대조군이 있는 환자에게 사용되었지만 다른 임상 샘플에도 사용할 수 있습니다.
초록
강박 장애(OCD)가 있는 환자는 부정적인 감정에 직면했을 때 변연계 및 안와 전두엽 영역의 뇌 활동이 증가하며, 이는 감정 조절 기술의 손상과 관련이 있을 수 있습니다. 감정을 조절하는 능력은 정서적으로 고통스러운 상황에 직면했을 때 필요한 대처 메커니즘이며, 인지적 재평가와 같은 의도적인 감정 조절 전략이 일반 인구를 대상으로 광범위하게 연구되었습니다. 그럼에도 불구하고 강박장애 환자의 잠재적인 고의적 감정 조절 결핍 및 관련 신경 상관관계에 대해서는 알려진 바가 거의 없습니다. 여기에서는 강박장애 환자의 기능적 자기공명영상(fMRI)을 사용하여 일치하는 대조군 샘플과 비교하여 의도적인 감정 조절(인지 재평가)의 신경 상관관계를 조사하는 프로토콜에 대해 설명합니다. 이 프로토콜은 신경 영상 연구에 대한 현재의 황금 표준을 따르며 작업 활성화 및 연결성 분석(및 행동 데이터)을 모두 포함하여 보다 완전한 조사를 가능하게 합니다. 따라서 우리는 이것이 강박장애에서 감정(dys) 조절의 신경 상관관계에 대한 지식을 확장하는 데 기여할 것으로 기대하며, 다른 정신 장애의 감정 조절 결핍을 탐구하는 데에도 적용될 수 있습니다.
서문
기능적 자기공명영상(fMRI)은 연구자들이 상대적으로 높은 공간 해상도로 뇌 기능을 관찰할 수 있게 해주고 이러한 상태의 기저에 있는 신경 메커니즘에 대한 통찰력을 제공하기 때문에 정신 장애를 이해하는 강력한 도구입니다1. fMRI는 혈류의 변화를 감지함으로써 특정 작업 중 또는 특정 자극에 반응하는 뇌 영역을 정확히 찾아내어 우울증, 불안, 정신 분열증 및 양극성 장애와 같은 장애와 관련된 뇌 기능의 이상을 강조할 수 있습니다. 또한 fMRI는 뇌의 서로 다른 부분이 서로 어떻게 소통하는지 보여주는 기능적 연결 패턴을 밝힐 수 있으며, 이는 정신 장애에서 붕괴된 복잡한 네트워크를 이해하는 데 매우 중요합니다2. 이 비침습적 기법은 정신 질환 증상의 신경 상관관계를 확인하는 데 도움이 될 뿐만 아니라 증상 프로파일과 치료 효과의 기저에 있을 수 있는 심리적 과정을 탐색하는 데 도움이 된다3.
감정 조절은 새로운 감정 반응을 시작하거나 다양한 조절 과정을 통해 진행 중인 감정을 변경하는 것을 포함하는 과정 중 하나입니다. 감정 조절 전략에는 여러 가지 유형이 있는데, 여기에는 주의 집중 전개(attention deployment, 산만), 인지적 재평가(cognitive reappraisal, 자극에 대한 의미와 개인적 연결을 재해석), 정서적 경험이나 표현의 억제등이 있다 4,5. 재평가와 관련하여, 이전의 fMRI 연구는 재평가가 등쪽 전대상피질(ACC), 배측두엽 및 외측 전두엽 피질, 측두엽 및 두정엽 영역의 활성화와 관련이 있음을 발견했다 6,7. 이러한 전두엽 및 대상뇌 영역은 전두두정체 인지 제어 네트워크의 일부이며, 이는 노력 조절에 중요한 역할을 합니다. 재평가의 맥락에서, 이 네트워크는 자극의 부정적 정서적 의미를 보다 중립적인 용어로 인지적으로 재구성하는 데 도움이 된다8. 이 네트워크는 차례로 편도체와 같은 상향식 복부 및 변연계 영역을 제어하며, 이는 감정적 자극을 자동으로 평가하는 데 관여합니다9. 동적 인과 모델링 분석을 사용한 이전 연구에서는 fMRI를 사용하여 감정 조절 작업 중 이러한 등쪽과 복부 영역 간의 관계를 조사했습니다. 그들은 하전두회(inferior frontal gyrus, IFG)가 배외측 전전두피질(dorsolateral prefrontal cortex, PFC)과 밀접하게 연결되어 있는 반면, 복내측 PFC는 전전두엽 영역이 편도체에 직접 영향을 미치는 주요 경로를 나타낸다는 것을 발견했다10,11.
강박 장애(OCD)는 인구의 1-3%에 영향을 미치는 정신 장애로, 고통스럽고 반복적인 생각, 충동 또는 이미지(강박 관념)와 반복적인 정신적 또는 신체적 행동(강박)이 뒤따르는 것이 특징입니다12. 강박장애 환자는 장애와 관련된 자극에 노출되면 두려움, 불안, 혐오감 또는 죄책감과 같은 부정적인 감정을 경험한다13,14 와 함께 안와전두피질(orbitofrontal cortex, OFC), 상부 ACC 및 편도체(amygdala)와 같은 복부 전두엽 및 변연계 뇌 영역의 활동 증가15. 더욱이, 이전 연구에서는 강박장애 환자가 특히 인지적 재평가 전략을 사용할 때 감정 조절에 어려움을 겪는 것으로 나타났다16. 따라서 강박장애에서 발견되는 증강된 정서적 반응성은 이러한 감정 조절 장애와 관련이 있다는 가설이 있습니다 17,18,19. 실제로, 인지 행동 치료(강박장애20에 대한 1차 치료법)에는 환자가 부정적이고 증상을 유발하는 상황을 위협적이지 않은 것으로 인지적으로 재평가하는 데 도움이 되는 감정 조절 전략에 대한 교육을 포함합니다.
신경생물학적으로, 배쪽 네트워크와 등쪽 네트워크 사이의 역기능적 상호 작용은 다양한 정신 질환의 변화된 감정 처리 및 조절과 관련이 있는 것으로 생각됩니다 21,22,23. 강박장애의 경우, 기능적 및 구조적 신경영상 연구에서 이러한 네트워크와 연결된 뇌 영역의 손상이 밝혀졌으며 24,25,26 증상 개선 후 일부 기능적 결함이 정상화되는 것으로 나타났습니다27,28. 이 증거는 강박장애에서 발견되는 감정 조절 어려움이 등쪽 뇌 영역의 제어 기능 손상 및/또는 복부 시스템의 과활성화와 관련이 있을 수 있다는 생각을 뒷받침합니다. 따라서 인지적 재평가 훈련을 통해 이러한 네트워크 간의 균형을 회복하면 잠재적으로 환자의 증상을 개선할 수 있다29. 이러한 증거에도 불구하고, fMRI를 사용하여 강박장애에서 인지 감정 조절의 신경 상관관계를 탐구하는 이전 문헌은 부족합니다. 따라서 이 주제에 관심이 있는 모든 연구팀이 사용할 수 있는 표준화된 프로토콜의 정의는 이 연구 분야의 지식을 일관되고 강력한 방식으로 발전시킬 수 있습니다.
프로토콜
본 연구는 헬싱키 선언에 따라 수행되었으며, 브라가 병원(Hospital de Braga)과 민호 대학교(University of Minho, 포르투갈 브라가)의 기관 윤리 위원회(institutional Ethics Committee)의 승인을 받았다. 이 작업과 관련된 모든 절차는 관련 기관 및 국가 인체 실험 위원회의 윤리 기준과 2008년에 개정된 1975년 헬싱키 선언을 준수합니다.
1. 참가자
참고: 강박장애를 앓고 있는 성인(≥18세) 환자는 정기 상담을 통해 Hospital de Braga(포르투갈 브라가)의 정신의학과에서 모집되었습니다.
- 강박장애를 앓고 있는 성인 환자(≥18세)를 정기적인 상담을 통해 모집하여 표준 기준에 따라 경험 많은 정신과 의사의 진단을 받습니다( 자료표 참조). 다른 잠재적인 정신병리학적 상태를 평가하기 위해 Mini-International Neuropsychiatric Interview30 을 실시한다.
- 강박장애 환자와 관련하여 다른 정신과 진단(축 I 또는 축 II 장애)의 현재 존재 또는 현재 또는 과거의 주요 신경학적 또는 의학적 상태를 포함하도록 제외 기준을 설정합니다.
참고: 정신 약리학적 약물 사용은 제외 기준이 아니었습니다. 모집 당시 대부분의 환자(80.64%)는 약물을 투여받고 있었으며, 치료 방식은 연구 기간 내내 일관되게 유지되었습니다. - 기관의 메일링 리스트 및 소셜 네트워크를 통한 편의 표본추출과 연구자의 커뮤니티 연락처를 사용하여 동일한 사회 인구학적 배경을 가진 건강한 대조군(HC)을 모집합니다.
- HC가 현재 또는 과거에 신경학적, 정신과적 또는 주요 의학적 상태가 있거나 현재 또는 과거에 정신 약물 약물로 치료를 받은 경우 HC를 제외합니다.
- MRI(금속 임플란트 또는 폐소공포증) 수행에 대한 금기 사항을 모든 참가자에 대한 일반적인 제외 기준으로 간주합니다.
- 환자를 위한 정신과 상담 중 또는 HC를 위한 전화 인터뷰를 통해 포함/제외 기준을 확인합니다. 참가자가 포함 기준을 충족하고 참여에 동의하는 경우, 연구 참여 날짜를 예약합니다.
- 연구 당일, 연구 절차를 시작하기 전에 참가자에게 서면 동의서를 제시하고 설명하고 계속하기 전에 서면 동의서를 얻습니다.
2. 실험 프로토콜
참고: 심리 평가를 수행한 후 MRI 획득을 수행하며, 전체 실험 프로토콜은 총 1.5시간을 넘지 않습니다(그림 1).
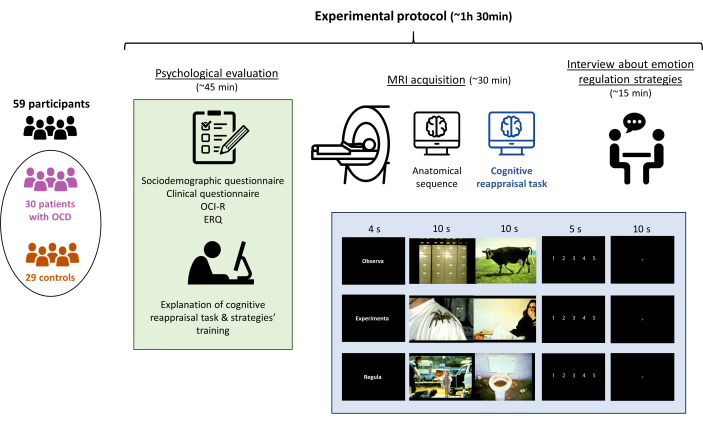
그림 1: 연구의 실험 프로토콜. 참가자들(강박장애를 앓고 있는 환자 30명과 대조군 29명)은 심리 평가를 받은 후 인지적 재평가 과제에 대한 설명, MRI 획득(과제 수행 포함), 마지막으로 과제가 적절하게 수행되었는지 확인하기 위한 인터뷰를 받았습니다. 전체 프로토콜은 약 90분 동안 진행되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 심리 측정 평가 (~45분)
- 각 인구 집단에서 검증된 다음 심리 측정 척도와 사회 인구 통계 및 임상 설문지를 다음 순서로 작성하십시오.
- 사회 인구학적 설문지: 성별/성별, 생년월일, 교육 기간, 주거 지역, 시민 상태, 가족 상태, 직업 상태 및 손 지배력에 대한 정보를 수집합니다. 이 연구에 사용된 설문지에 대해서는 보충 파일 1 을 참조하고 영어로 번역한 내용을 참조하십시오.
- 임상 설문지: 약물 사용(담배, 알코올 또는 기타 약물), 습관적인 약리학적 사용, 현재 신체 또는 정신 장애 진단, 정신 장애의 병력에 대한 정보를 수집합니다. 이 연구에 사용된 설문지에 대해서는 보충 파일 2 를 참조하고 영어로 번역한 내용을 참조하십시오.
- 강박적 인벤토리(OCI-R)에 응답합니다. 이 연구에 사용된 설문지에 대해서는 보충 파일 3 을 참조하고 영어로 번역한 내용을 참조하십시오.
참고: 이것은 강박장애와 HC 환자 모두에게 적용할 수 있는 18개 항목 목록이며 세척, 확인, 주문, 비축, 집착 및 중화의 6가지 증상 그룹을 측정합니다31,32. 세척 하위 척도에 대한 점수는 항목 5, 11 및 17의 점수를 더하여 얻습니다. 항목 2, 8 및 14를 확인하기 위해; 항목 3, 9 및 15 주문의 경우; 항목 1, 7 및 13을 사재기하는 경우; 항목 6, 12 및 18에 집착하는 경우; 항목 4, 10 및 16을 중화합니다. 총점은 모든 하위 척도의 점수를 더하여 얻을 수도 있습니다. - 감정조절 설문지(emotion regulation questionnaire, ERQ)를 적용하면 재평가(reappraisal)와 억제(suppression)라는 두 가지 감정조절 전략의 습관적 사용을 평가할 수 있다33,34. 항목 1, 3, 5, 7, 8 및 10의 점수를 더하여 재평가 하위 척도의 점수를 계산하고 항목 2, 4, 6 및 9의 점수를 더하여 억제 하위 척도의 점수를 계산합니다. 이 연구에 사용된 설문지에 대해서는 보충 파일 4를 참조하고 영어로 번역한 내용을 참조하십시오.
- 강박 및 강박 증상의 심각성을 측정하기 위해 강박 장애 환자가 모집 될 때 정신과 상담 중에 Yale-Brown Obsessive-Compulsive Scale (Y-BOCS)을 완료했는지 확인하십시오35, 36. 그렇지 않으면 심리 측정 평가 중에 이 정보를 수집하십시오. 이 연구에 사용된 설문지에 대해서는 보충 파일 5를 참조하십시오.
- 척도를 완성한 후 스캐너에서 수행해야 할 인지적 재평가 과제를 설명하고 사용할 감정 조절 전략에 대해 참가자를 교육합니다(섹션 2.3 참조).
참고: 인지적 재평가 작업이 척도의 반응에 영향을 미치지 않도록 MRI 획득 전에 항상 이러한 척도를 적용하는 것이 중요합니다.
- 각 인구 집단에서 검증된 다음 심리 측정 척도와 사회 인구 통계 및 임상 설문지를 다음 순서로 작성하십시오.
- 이미징 데이터 수집(~30분)
- 32채널 헤드 코일이 장착된 3T 스캐너( 재료 표 참조)에서 이미징 데이터를 획득합니다. MRI 촬영을 시작하기 전에 참가자들에게 스캐닝 침대에 누운 자세로 누워 있으라고 지시하고, 머리를 감싸는 쿠션을 추가하여 스캔 중 참가자가 편안함을 느낄 수 있도록 하여 움직임을 최소화합니다. 참가자에게 귀마개, 오른손에는 응답 상자(섹션 2.3 참조), 스캐너를 긴급하게 중지해야 하는 경우 왼손에는 비상 정지 버튼을 제공합니다.
- 모든 참가자가 스캐너 내부에서 인지적 재평가 작업을 수행하도록 합니다(아래 참조). 이 작업을 수행하는 동안 반복 시간(TR) = 1,000ms, 에코 시간(TE) = 27ms, 플립 각도(FA) = 62°, 2mm3 등각 복셀 크기, 200 x 200mm2의 매트릭스에 걸쳐 64개의 축 슬라이스.
- 스캐닝 세션에 등록 목적으로 시상면에서 해부학적 구배 에코 자화 준비 빠른 획득을 포함합니다(MPRAGE, TR = 2,420ms, TE = 4.12ms, FA = 9°, 시야(FOV) = 176 x 256 x 256mm3, 1mm3 등각 복셀 크기).
참고: 데이터 수집을 시작하기 전에 참가자가 스크린 프로젝션에서 자극 프레젠테이션을 명확하게 볼 수 있고 응답 버튼이 응답을 적절하게 수집하고 있는지 확인하십시오. 참가자가 올바른 방향으로 자극을 보고 있으며 뒤집히거나 반전되지 않는지 확인하십시오.
- fMRI 인지 재평가 과제
- 스캔하기 전에 참가자들에게 거리두기 및 재해석 전략을 교육합니다. 예를 들어, 충격적인 시나리오가 있는 사진을 보여주면서(이 연구에서 사용된 것은 보충 파일 6 참조), 다음 방법 중 하나로 장면을 인지적으로 재구성하여 자신의 감정을 재평가하도록 지시합니다: (i) 상황이 처음 나타난 것만큼 나쁘지 않은 경우(즉, 상황을 보다 긍정적인 시각으로 해석)(재해석); (ii) 시간이 지남에 따라 상황이 개선될 것(재해석); (iii) 묘사된 장면이 실제가 아닌 경우(예: 현장에 사람이 있는 경우 그들이 배우라고 생각) (거리두기) (iv) 장면에 보이는 사람들은 낯선 사람이므로 자신에게 영향을 미치지 않습니다 (거리두기). 구체적으로 참가자들에게 과제 중에 비인지적 전략(예: 시선을 돌리는 것)을 사용하지 않도록 지시합니다.
- fMRI 염기서열을 획득하는 동안 인지적 재평가 과제37 을 사용한다. 이 과제는 중립적 또는 부정적 그림 자극을 포함한 일련의 블록으로 구성되며, 참가자들은 다음을 요청받습니다.
- 관찰( 중립 자극을 수동적으로 관찰하다).
- 유지 (부정적인 자극에 의해 유발된 감정에 적극적으로 집중하고 시간이 지남에 따라 유지하는 것).
- 조절 (이전에 훈련된 인지적 재평가 전략을 사용하여 부정적인 자극에 의해 유발된 감정을 재평가하기 위해).
- International Affective Picture System(IAPS38)에서 가져온 다음 24개의 자극(사진)을 사용합니다.
- 관찰 상태(코드 1670, 5395, 5455, 5660, 5900, 6150, 7000, 7496, 보충 파일 7 참조)에서 8개의 중립 사진(예: 가정용 물건)을 제시합니다.
- 유지 관리(코드 2661, 3230, 3300, 6360, 6831, 9041, 9560, 9570, 9570, 보충 파일 8 참조) 및 규제(코드 2141, 3030, 6838, 7380, 9300, 9530, 9561, 9582, 보충 파일 9 참조) 조건에서 16개의 매우 불쾌하고 자극적인 사진(예: 절단)을 사용하십시오.
- 작업을 각 조건(관찰, 유지 관리 또는 조절)에 대해 4개의 블록, 12개의 블록으로 구성하도록 구성합니다. 지속적인 기분 상태를 유발하지 않도록 작업 전반에 걸쳐 지침을 의사 무작위화합니다.
참고: 이 실험의 조건 순서는 조절, 유지, 관찰, 유지, 조절, 관찰, 유지, 관찰, 관찰, 조절, 관찰, 유지, 조절, 관찰, 유지, 조절이었습니다. - 화면 중앙에 4초 동안 표시된 지침(관찰, 유지 관리 또는 조절)으로 각 블록을 시작합니다. 프롬프트가 끝나면 참가자들에게 각각 10초 동안 등가 원자가의 두 가지 다른 자극을 보여줍니다. 각 블록의 두 번째 자극을 제시한 후, 참가자들이 경험한 부정적인 감정의 강도를 1-5의 숫자 척도(1은 '중립적', 5는 '매우 부정적'인 느낌을 나타냄)로 스스로 평가하도록 합니다. 캐리오버 효과를 최소화하려면 각 블록이 끝난 후 10초 동안 화면 중앙에 고정 십자가를 표시합니다.
참고: 자극은 정서적 각성과 원자가에 대한 규범 점수에 따라 선택되었습니다. Maintain 및 Regulate 조건에 걸쳐 부정적인 그림의 감정적 내용의 균형을 맞추는 것은 이러한 속성의 차이로 인한 혼란 효과를 피하기 위해 신중하게 고려해야 합니다. - 참조된 소프트웨어39 ( 재료 표 참조) 및 MRI 호환 앵글 미러 시스템을 사용하여 작업 지침과 시각적 자극을 표시합니다.
- MRI 호환 응답 패드( 재료 표 참조)를 사용하여 스캐너 내 감정 등급을 기록합니다.
- MRI 세션 후 참가자를 인터뷰하여 지침을 따르고 작업을 적절하게 수행했는지 확인합니다. 사용된 감정 조절 전략의 유형(재해석, 거리두기 등)과 과제 중에 전략을 변경했는지 또는 자신에게 가장 잘 맞고 과제 전반에 걸쳐 일정하게 유지된 특정 전략이 있었는지 물어보십시오. 이 연구에 사용된 설문지에 대해서는 보충 파일 10 을 참조하고 영어로 번역한 내용을 참조하십시오.
- MRI 촬영 후 인터뷰의 정보를 사용하여 사용된 감정 조절 전략(거리두기, 재해석 또는 둘 다)에 따라 샘플을 여러 하위 그룹으로 분류하고 이러한 각 하위 그룹에 대해 개별적으로 후속 분석을 추가로 탐색합니다.
3. 데이터 분석
- 행동 분석
- 참조된 소프트웨어( 재료 표 참조)를 사용하여 통계 분석을 수행합니다.
- P 값이 통계적으로 유의< 0.05라고 가정합니다.
- Shapiro-Wilk의 정규성 검정을 사용하여 계량형 변수의 정규성을 확인하고, 결과에 따라 독립 표본 t-검정 또는 Mann-Whitney의 U 검정을 사용하여 이러한 변수의 그룹을 비교합니다.
- 카이 제곱 검정을 사용하여 그룹 간의 성/성별 분포를 비교합니다.
- 카이 제곱 검정을 사용하여 그룹 간의 감정 조절 전략 분포를 비교합니다.
- 2 x 3 반복 측정 ANOVA를 사용하여 두 그룹 간의 각 조건(관찰, 유지 및 조절) 스캐너 내 등급의 잠재적 차이를 분석합니다. 그런 다음 사후 검정을 사용하여 다중 비교에 대한 Holm의 보정을 포함하여 두 조건 간의 차이를 확인합니다. 전체 표본과 각 감정 조절 하위 그룹에 대해 이 작업을 수행합니다.
- 평균 Maintain ratings(평균 Maintain ratings)에서 평균 Regulate ratings(평균 Regulate ratings)를 빼서 스캐너 내 부정적 감정 경험을 줄이는 참가자의 성공을 계산하고(Success = Maintain - Regulate), 평균 Maintain ratings(반응성 = Maintain - Observe)에서 평균 Observe ratings를 빼서 감정 처리 중 참가자의 정서적 반응성을 계산합니다. 그런 다음, 데이터의 정규성에 따라 독립 표본 t-검정 또는 Mann-Whitney 검정을 사용하여 계산된 변수의 그룹을 비교합니다. 전체 표본과 각 감정 조절 하위 그룹에 대해 이 작업을 수행합니다.
참고: JASP에서 이러한 분석을 수행하는 방법을 보여주는 여러 인쇄 화면은 보충 파일 11에서 찾을 수 있습니다.
- 신경영상 데이터의 전처리
참고: 참조된 소프트웨어40,41을 사용하여 이미지를 전처리합니다(재료 표 참조). 이 소프트웨어는 기능 및 구조 데이터 모두에 대해 표준화되고 강력한 전처리 파이프라인을 수행하며, 사용자가 매개변수나 단계를 정의할 필요 없이 사용 가능하고 입력으로 사용되는 데이터 및 메타데이터에 따라 파이프라인을 조정합니다. 파이프라인에 대한 자세한 내용은 추가 파일 11 및 설명서의 workflows 섹션을 참조하세요.- 스캐너 내부의 움직임을 설명하기 위해 평균 프레임별 변위(FD) > 0.5mm의 제외 기준을 사용하여 전처리 소프트웨어에서 생성된 품질 검사 보고서에 포함된 평균 FD 값을 확인합니다.
참고: 이 연구에서 이 임계값을 초과하는 참가자는 없었습니다. 따라서 이로 인해 참가자를 제외할 필요가 없었습니다. - 또한 출력 보고서를 육안으로 검사하여 공동 정합의 정확성을 평가하고 전처리 파이프라인 중에 다른 잠재적인 문제를 식별합니다.
- 참조된 소프트웨어42(재료 표 참조)의 fslmaths 함수를 사용하여 8mm의 FWHM(Full-Width-at-Half-Maximum) 커널로 결과 시계열을 공간적으로 평활화합니다(이 연구에서 사용된 특정 명령은 보충 파일 11 참조).
- 스캐너 내부의 움직임을 설명하기 위해 평균 프레임별 변위(FD) > 0.5mm의 제외 기준을 사용하여 전처리 소프트웨어에서 생성된 품질 검사 보고서에 포함된 평균 FD 값을 확인합니다.
- fMRI 작업 활성화 분석
참고: 참조된 소프트웨어를 사용하여 작업 활성화 분석을 수행합니다( 재료 표 참조).- 예비 단계로, "MNI152_T1_2mm_brain.nii.gz" 템플릿을 마스터 이미지로 사용하여 참조된 소프트웨어(43)(재료 표 참조)의 3dresample 기능을 사용하여 소프트웨어 간의 호환성을 허용하기 위해 전처리로 인한 fMRI 시계열 데이터의 매트릭스 치수를 조정합니다(이 연구에서 사용된 특정 명령에 대해서는 보충 파일 11 참조).
- 1차 수준(단일 피험자) 분석의 경우, SPM12에서 다음과 같은 관심 대조를 정의합니다: 경험한 부정적인 감정과 관련된 활성화를 감지할 수 있는 Maintain > Observe와 인지 재평가 전략의 구현과 관련된 활성화를 식별하기 위한 조절 > 유지.
- 이미지가 화면에 표시되는 20초 동안의 모델링 조건(명령, 등급 및 교차 고정 기간 제외). 각 복셀에서 BOLD 응답을 표준 혈류역학적 응답 함수로 컨볼루션하고 128초 고역 통과 필터를 사용합니다.
- 평균 뇌척수액 및 백질 신호를 공변량으로 사용하고, fMRIprep 전처리 중에 계산된 움직임을 보정하기 위한 변수를 사용합니다. 이동 변수에는 FD 및 DVARS(복셀S에 대한 평균 제곱근 VARiance의 도함수) 외에도 처음 6개의 aCompCor 구성 요소가 포함되었습니다.
- 두 번째 수준(그룹) 분석의 경우 관심 있는 대비에서 그룹 간의 차이를 찾기 위해 2표본 t-검정을 사용합니다. 전체 표본과 각 감정 조절 하위 그룹에 대해 이 작업을 수행합니다. 클러스터 임계값 보정을 사용하여 전체 뇌 수준에서 데이터를 분석합니다: 복셀 p < 0.001 수정되지 않음 및 클러스터 p < 0.05 FWE(가족별 오류) 보정됨.
참고: 이 분석을 수행하기 위한 프로세스의 여러 인쇄 화면은 보충 파일 11에서 찾을 수 있습니다.
- 정신 생리학적 상호 작용 분석
- 서로 다른 작업 조건에 의해 자극되는 뇌 영역 간의 연결성을 탐색하려면 참조된 소프트웨어에서 정신 생리학적 상호 작용(PPI) 분석을 수행합니다.
- 이 분석을 수행하려면 적어도 두 가지 다른 접근 방식을 기반으로 하나 또는 여러 시드 영역을 선택하십시오 : 데이터 기반 접근 방식, 작업 활성화 분석에서 그룹간에 현저하게 다른 것으로 밝혀진 영역 선택; 또는 이전 문헌을 기반으로 씨앗을 선택하는 이론 기반 접근 방식. 이 연구를 위해 강박장애 환자의 감정 처리 변화에 대한 이전 문헌을 기반으로 PPI 시드를 선택합니다.
- 예를 들어, Picó-Pérez et al.15 메타 분석에서 HC와 비교하여 강박장애 환자의 감정 처리 중 과활성화가 확인된 다음 영역을 사용하십시오: 오른쪽 전방 인슐라에서 편도체 및 푸타멘까지 확장되는 클러스터, 왼쪽 각도 이랑, 왼쪽 편도체와 복부 푸타멘으로 구성된 클러스터, 왼쪽 전중심 이랑, 내측 전전두엽 피질(medial prefrontal cortex) 및 좌측 시상(left thalamus)을 포함한다(자세한 내용은 표 1 참조).
- 관심 대조('심리적' 요인)가 선택된 6개의 씨앗과 뇌의 다른 모든 영역('생리적' 요인) 사이의 시간 경과 상관 관계의 강도에 미치는 영향을 조사합니다.
- 각 대비와 각 시드에 대한 기능적 연결성 맵을 whole-brain linear regression 분석을 통해 추정합니다. 128초로 설정된 고역 통과 필터를 사용하여 약 0.008Hz 미만의 저주파 드리프트를 제거합니다. 시드 시계열과 뇌의 나머지 부분에서 오는 각 복셀 신호 사이의 회귀 계수를 추정하여 각 피험자에 대한 대비 이미지(1차 수준 분석)를 생성합니다.
- 그룹 차이를 평가하려면(2단계 분석) 각 대비에 대한 2표본 t-검정 분석에 이전 단계의 결과 이미지를 포함합니다. 전체 표본과 각 감정 조절 하위 그룹에 대해 이 작업을 수행합니다. fMRI 작업 활성화 분석에서와 동일한 유의성 임계값을 사용합니다. 또한 이러한 결과의 p-값에 Bonferroni 보정을 적용하여 탐색된 시드 수에 의한 다중 비교 보정을 고려합니다(p < 0.05 / 6 = p < 0.0083).
참고: 이 분석을 수행하기 위한 프로세스의 여러 인쇄 화면은 보충 파일 11에서 찾을 수 있습니다.
표 1: 정신 생리학적 상호 작용 분석에 사용된 씨앗. 약어: Ke, 복셀의 클러스터 범위; MNI, 몬트리올 신경학 연구소. 이 표를 다운로드하려면 여기를 클릭하십시오.
결과
표 2 에는 참가자의 임상 및 사회 인구 통계학적 정보에 대한 요약이 포함되어 있습니다. 이 연구에는 67명의 성인(강박장애 환자 34명, HC 31명)이 포함되었습니다. 그러나 6명의 참가자(환자 4명, 대조군 2명)는 MRI 아티팩트 또는 차선의 작업 수행으로 인해 제외되었습니다(마지막 인터뷰에서 2명의 참가자는 조절 전략이 적용되지 않았고 주의를 기울이지 않았다고 보고했습니다). 최종 표본은 강박장애 환자 30명(여성 17명; 평균 연령 = 28.97, SD = 11.14세)과 HC 환자 29명(여성 15명; 평균 연령 = 29.35, SD = 12.14세)으로 구성되었습니다. 두 그룹 모두 연령, 교육 기간, 성별/성별 분포 및 과제 중에 사용된 감정 조절 전략과 관련하여 일치했습니다. 표 2 는 또한 증상의 중증도, 발병 연령 및 투약 상태를 포함하여 강박장애 환자 그룹에 대한 임상 정보를 제시합니다.
전체 표본에 대한 작업 중 등급과 관련하여, 2 x 3 반복 측정 ANOVA가 구형도 가정을 위반했기 때문에 Huynh-Feldt 검정이 사용되었습니다. 상태의 주효과는 통계적으로 유의했으며(F(1.783, 98.067) = 112.728, p < .001), 사후 검정을 통해 유지 상태가 관찰 조건과 유의하게 다르며(두 그룹 모두에서 성공적인 부정적 감정 유도를 나타냄; t = -14.423, pholm < .001), 조절 조건이 유지 와 달랐으며(두 그룹 모두에서 성공적인 감정 조절을 나타냄; t = 3.597, pholm < .001) (그림 2). 그러나 집단의 주효과는 통계적으로 유의하지 않았으며(F(1, 55) = 0.155, p = .695), 집단과 조건 간에 유의한 상호작용도 없었다(F(1.783, 98.067) = 1.877, p = .163). 그러나 성공 변수는 그룹 간에 유의한 차이를 보였으며(t(55) = 2.15, p = .036), 대조군이 강박장애 환자보다 더 나은 조절을 보였다.
거리두기 하위 그룹에 대해 이를 탐색할 때 구형도의 가정도 위반되었으므로 Huynh-Feldt 검정을 2 x 3 반복 측정 ANOVA로 다시 사용했습니다. 조건의 주효과는 통계적으로 유의했으며(F(1.398, 27.961) = 35.704, p < 0.001), 사후 테스트에서는 유지 상태가 관찰 조건과 유의하게 다르지만(성공적인 부정적 감정 유도를 나타냄; t = -7.666, pholm < 0.001), 조절 조건은 더 이상 유지 조건과 크게 다르지 않았습니다 (감정을 성공적으로 조절하지 못했음을 가리킴; t = 0.755, pholm < 0.455) (그림 2). 집단의 주효과도 유의하지 않았으며(F(1, 20) = 0.887, p = 0.358), 집단과 조건 간의 상호작용도 마찬가지였다(F(1.398, 27.961) = 0.103, p = 0.832). 따라서 성공 변수도 그룹 간에 유의한 차이가 없었습니다(t(20) = -0.132, p = 0.896).
재해석 하위 그룹과 관련하여, 구형도 보정이 없는 2 x 3 반복 측정 ANOVA가 수행되었는데, 이는 구형도 가정을 위반하지 않았기 때문입니다. 상태의 주효과도 유의했으며(F(1.8, 23.404) = 28.355, p < 0.001), 사후 테스트에서는 유지 상태가 관찰 조건과 유의하게 다르며(성공적인 부정적 감정 유도를 가리킴; t = -7.48, pholm < 0.001), 조절 조건이 유지 와 다르며(성공적인 감정 조절을 나타냄; t = 2.983, pholm < 0.006) (그림 2)). 그러나 집단의 주효과는 통계적으로 유의하지 않았으며(F(1, 13) = 2.623, p = 0.129), 집단과 조건 간에 유의한 상호작용도 없었다(F(1.8, 23.404) = 2.312, p = 0.126). 그러나 성공 변수는 그룹 간에 유의한 차이를 보였으며(t(13) = 2.664, p = 0.019), 대조군이 강박장애 환자보다 더 나은 조절을 보였다.
마지막으로, Both strategies 하위 그룹과 관련하여, 구형도 가정을 위반하지 않았으므로 구형도 보정이 없는 2 x 3 반복 측정 ANOVA도 수행되었습니다. 조건의 주효과는 통계적으로 유의했으며(F(1.592, 22.294) = 27.772, p < 0.001), 사후 테스트에서는 유지 상태가 관찰 조건과 유의하게 다르지만(성공적인 부정적 감정 유도를 나타냄; t = -7.114, pholm < 0.001), 조절 조건은 더 이상 유지 조건과 유의하게 다르지 않았습니다 (감정을 성공적으로 조절하는 데 실패했음을 가리키며; t = 1.634, pholm < 0.114) (그림 2). 집단의 주효과는 통계적으로 유의하지 않았으며(F(1, 14) = 0.245, p = 0.629), 집단과 조건 간에 유의한 상호작용도 없었다(F(1.592, 22.294) = 0.143, p = 0.867). 마찬가지로, 성공 변수는 그룹 간에 유의한 차이가 없었습니다(t(13) = 0.597, p = 0.56).
전체적으로, 전체 표본을 고려했을 때, 부정적 감정 유도는 성공적이었고, 감정 조절은 두 그룹 모두에서 효과적이었지만, 성공 변수를 고려할 때 대조군이 강박장애 환자보다 더 나은 감정 조절을 보인 것으로 보였다. 특정 감정 조절 전략 하위 그룹과 관련하여, 부정적 감정 유도는 모든 하위 그룹에서 성공적이었던 반면, 감정 조절은 거리두기 및 두 전략 하위 그룹에서 실패한 것으로 보였으며 재해석 하위 그룹에서만 성공적이었습니다. 더욱이, 이 하위 그룹만이 성공 변수에서 유의미한 그룹 차이를 보였으며, 대조군은 강박장애 환자에 비해 더 나은 감정 조절을 보여주었습니다(전체 표본과 일치). 이는 일반적으로 성공적인 감정 조절을 보장하고 대조군과 환자 집단 간의 유의미한 차이를 감지하기 위해 이 작업에서 재해석 전략을 사용하는 것의 이점에 대한 증거를 제공합니다. 그러나 이러한 결과는 각 하위 그룹의 표본 크기가 감소하고 하위 그룹 분석을 수행할 때 관련 통계적 검정력 손실이 발생한다는 점을 감안할 때 주의해서 받아들여야 합니다.
심리 측정 척도와 관련하여, ERQ에서 그룹 간 유의미한 차이는 없었지만, OCD 환자는 OCI-R Hoarding을 제외한 모든 OCI-R 하위 척도에서 HC보다 유의하게 높은 점수를 받았습니다(표 2).
마지막으로, fMRI 작업 활성화 결과와 관련하여, 선택한 다중 비교 보정 임계값에서 유지 > 관찰 또는 조절 > 유지에 대한 전체 뇌 수준에서 전체 샘플에 대해 그룹 간에 유의미한 차이가 없었습니다. 그러나 사용된 감정 조절 전략에 따라 하위 그룹을 탐색할 때 재해석 및 두 전략 하위 그룹에 대해 그룹 간 상당한 차이가 나타났습니다. 특히, 재해석 하위 그룹의 경우, 대조군은 유지 > 관찰 대비에 대해 강박장애 환자보다 더 높은 활성화를 보였습니다. 반면에, Both strategies 하위 그룹의 경우, 강박장애 환자는 Maintain > Observe 조영제에 대해서도 우측 후방 인슐라와 양측 전중심회(precentral gyri)의 활성화가 증가한 것으로 나타났습니다( 표 3 및 그림 3 참조). 거리두기 하위 그룹 또는 조절 > 유지 대비에 대해서는 통계적으로 유의한 결과가 없었습니다.
또한, PPI 분석과 관련하여, 전체 샘플에서 좌측이랑씨와 좌복외측 PFC(vlPFC) 사이의 연결성이 대조군에서 강박>장애 환자에 비해 대조군에서 유의하게 높았으며, 대조군에서는 조절 > 유지(강박장애 환자의 연결성 증가)에서는 반대 패턴이 발견되었습니다. 다양한 전략 하위 그룹을 탐색할 때, 거리두기 하위 그룹과 Maintain > Observe 대비에 대해 왼쪽 편도체 씨앗과 오른쪽 하측두회(ITG) 및 왼쪽 중간 후두회(MOG) 사이의 연결성이 증가한 것으로 나타났습니다. 또한, 이 동일한 종자와 우측 배외측 PFC(dlPFC), 우측 미상꼬리 및 좌측 내측 PFC의 연결성은 Both strategies 하위 그룹 및 조절 > Maintain 조영제에 대한 환자에서도 증가했습니다. 마지막으로, 재해석 하위 그룹의 경우, 내측 PFC 종자와 우측 전중심회(right precentral gyrus) 사이의 연결성은 대조군에서 조영제 조절 > 유지(regulate maintain)에 대한 강박장애 환자에 비해 대조군에서 유의하게 높았습니다(표 3 및 그림 4).
요약하면, 전체 뇌 작업 활성화 분석은 전체 샘플에서 그룹 간에 유의미한 차이를 보여주지 않았지만 하위 그룹 분석은 채택된 감정 조절 전략과 관련된 특정 차이를 강조했습니다. 예를 들어, 재해석 전략은 강박장애 환자에서 전두엽 활성화가 감소한 것으로 나타난 반면, 두 전략 하위 그룹은 강박장애 환자에서 유지 > 관찰 대비를 위해 후방회와 전중심회와 같은 영역에서 활성화가 증가한 것으로 나타났습니다. 이러한 결과는 강박장애의 잠재적인 전략별 신경 변화를 가리키며, 흥미롭게도 이는 감정을 조절할 때(대조를 조절> 유지) 경험할 때(대조를 유지하고 관찰> 분명합니다). 이것은 감정 조절에 대한 다른 접근 방식을 갖는 것이 감정 처리에 대한 일반적인 영향을 나타냅니다. 기능적 연결성 분석(PPI)은 강박장애 환자의 변경된 연결성 패턴을 밝혀내는 추가 통찰력을 제공했습니다. 특히, 좌측이랑-vlPFC 네트워크는 Maintain > Observe 조영제에서 강박장애 환자의 연결성이 감소한 반면, Regulate > Maintain 조영제는 반대 패턴을 보였습니다. 하위 그룹 분석에서는 편도체 및 내측 PFC 시드와 연결된 연결성의 추가적인 중단을 확인했으며, 특히 재해석 전략에 참여할 때 주요 규제 네트워크에서 더 강력한 연결성을 보여주는 대조군이 나타났습니다.
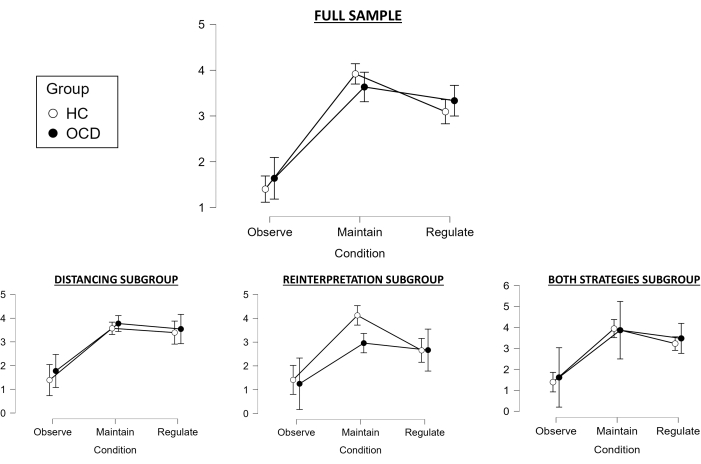
그림 2: 행동 결과. 각 그룹 및 각 조건(1은 '중립', 5는 '매우 부정적'), 전체 샘플(위) 및 사용된 감정 조절 전략에 따른 다른 하위 그룹(아래)에 대한 스캐너 내 감정 등급의 평균(95% 신뢰 구간). 약어: HC = 건강한 대조군; OCD = 강박 장애. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
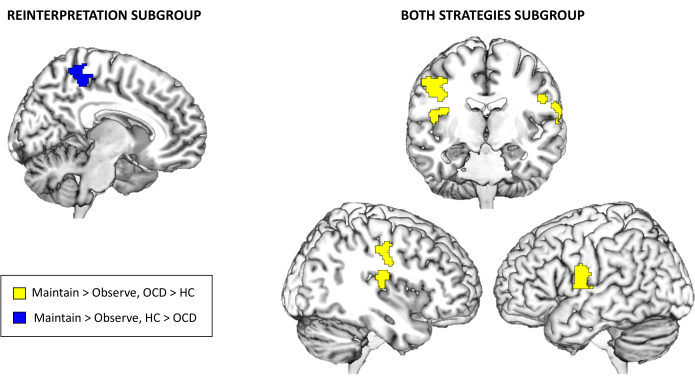
그림 3: fMRI 작업 활성화 결과. 재해석(Reinterpretation)을 위한 전뇌 활성화(whole-brain activation)의 그룹 간 차이(Betwe-group differences)와 유지(Maintain) 및 관찰(Observe) 대비를 위한 양(Both) 전략 하위 그룹> 차이. 연구 결과는 전체 뇌 수준 p < .05 FWE-cluster corrected에서 유의합니다 . 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
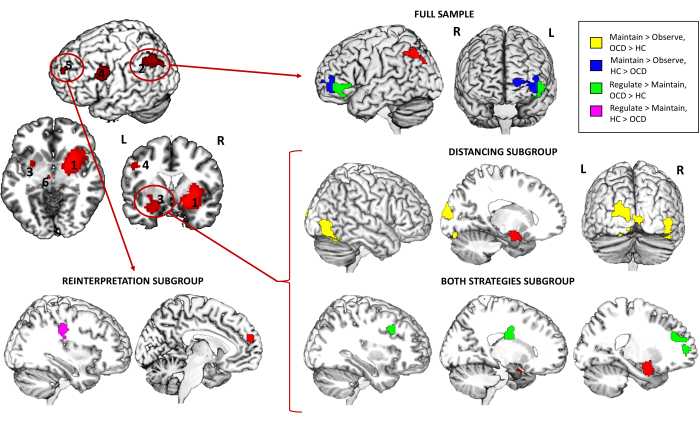
그림 4: fMRI 과제 정신생리학적 상호작용 결과. 전체 표본에 대한 전체 뇌 연결성의 그룹 간 차이와 좌측 각회(2), 왼쪽 편도체(3) 및 내측 PFC(5) 시드에 대한 다른 전략 하위 그룹. 시드는 빨간색으로 표시되며, 차등 연결성이 있는 영역은 Maintain > Observe 대비의 경우 노란색(OCD > HC) 또는 파란색(HC > OCD)으로, > Maintain 대비의 경우 녹색(OCD > HC) 또는 보라색(HC > OCD)으로 표시됩니다. 연구 결과는 전체 뇌 수준 p < .05 FWE-cluster corrected에서 유의합니다. 탐구된 종자의 수에 의한 추가적인 Bonferroni 보정에서 살아남은 결과에 대해서는 표 3을 참조하십시오. 약어: HC = 건강한 대조군; OCD = 강박 장애. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 2: 참가자의 사회인구학적 및 임상적 특성. 총 N = OCI-R 하위 척도의 경우 58, 스캐너 내 감정 등급의 경우 N = 57, 작업 중에 사용된 전략의 경우 N = 54입니다. 약어: AP = 항정신병 약물; Dist = 거리두기; ERQ = 감정 조절 설문지; HC = 건강한 대조군; OCD = 강박 장애; OCI-R = 강박적 인벤토리 수정; Reint = 재해석; SD = 표준 편차; SSRI = 선택적 세로토닌 재흡수 억제제; Y-BOCS = Yale-Brown 강박 척도. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 3: fMRI 작업 결과. 전체 샘플과 다른 전략 하위 그룹에 대한 작업 활성화 및 정신 생리학적 상호 작용 분석의 그룹 간 차이. 연구 결과는 전체 뇌 수준 p < .05 FWE-cluster corrected에서 유의합니다. *PPI 결과는 탐색된 종자의 수에 의해 추가적인 Bonferroni 수정 후에도 유의하게 남아 있습니다(p < .05 / 6 = p < .0083). 약어: dlPFC, dorsolateral prefrontal cortex; HC, 건강한 대조군; ITG, 하측두회(inferior temporal gyrus); Ke, 복셀의 클러스터 범위; MNI, 몬트리올 신경학 연구소; MOG, 중간 후두회; 강박장애, 강박장애; PFC, 전전두엽 피질; PPI, 정신 생리학적 상호 작용 분석; vlPFC, 복측 전전두엽 피질. 이 표를 다운로드하려면 여기를 클릭하십시오.
보충 파일 1: 사용된 사회인구학적 설문지(포르투갈어), 영어 번역본. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 2: 사용된 임상 설문지(포르투갈어)와 영어 번역본. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 3: OCI-R의 포르투갈어 버전이 사용되었으며, 영어 번역이 함께 제공되었다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 4: 사용된 ERQ의 포르투갈어 버전으로, 영어 번역이 함께 제공된다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 5: Y-BOCS의 포르투갈어 버전, 영어 번역본. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 6: 인지적 재평가 과제를 설명하고 참가자들에게 스캔하기 전에 거리두기 및 재해석 전략에 대해 교육하는 데 사용되는 프레젠테이션으로, 영어 번역과 함께 제공됩니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 7: 인지적 재평가 과제의 관찰 조건에 사용되는 IAPS 중립 그림. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 8: 인지적 재평가 과제의 상태 유지에 사용되는 IAPS 네거티브 사진. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 9: 인지적 재평가 과제의 조절 조건에 사용되는 IAPS 네거티브 사진. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 10: MRI 세션 후 참가자가 작업을 적절하게 수행했는지 확인하고 사용한 전략을 기록하기 위해 사용되는 설문지와 함께 영어 번역본. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 11: 이 연구에 포함된 다양한 데이터 분석을 위한 자세한 소프트웨어 단계. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
이 프로토콜을 통해 연구자들은 fMRI 인지 재평가 작업을 사용하여 대조군과 비교하여 강박장애 환자의 감정 조절의 신경 상관관계를 탐색할 수 있습니다. 이 디자인은 신중한 전략을 통해 감정을 조절하는 뇌의 메커니즘에 대한 이해를 높일 수 있는 잠재력을 보여주며 강박장애 환자와 다른 정신과 환자에게 사용할 수 있습니다. 또한 최신 신경영상 골드 스탠다드(예: 다중대역 염기서열, fMRIPrep 전처리 및 적절한 다중 비교 보정 방법)를 사용하여 프로토콜을 신중하게 설계했습니다. 두 참가자 그룹 모두 사회인구학적 변수에서 일치하고 품질이 낮은 데이터를 가진 참가자는 분석에서 제외되도록 특별히 주의를 기울였습니다.
이러한 모든 예방 조치에도 불구하고 일부 분석에서 부정적인 결과(즉, 그룹 간 차이 없음)가 나타났습니다. 행동 수준에서, 그룹 효과는 전체 표본에 대해 2 x 3 반복 측정 ANOVA를 사용하여 스캐너 내 등급을 분석할 때 유의하지 않았습니다. 이 발견은 정신과 인구 집단에 대한 이전의 메타 분석 및 체계적 문헌고찰과 일치하며,23,44 사회적 바람직성 효과, 스캐너 내 행동 평가 또는 정서적 경험에 대한 자기 인식 장애의 잠재적 영향을 시사한다. 그러나 성공 변수에서 유의미한 집단 차이가 나타났으며, 이는 강박장애를 가진 개인이 더 나쁜 감정 조절을 보였음을 나타냅니다. 따라서, 두 그룹에 대한 조건 간 등급 패턴의 전반적인 유사성에도 불구하고, 유지 및 규제 조건에만 집중할 때 변경은 여전히 관찰 가능합니다.
더욱이, 서로 다른 감정 조절 하위 그룹에 대해 이 분석을 반복할 때, 재해석 하위 그룹은 전체 표본과 동일한 패턴의 결과를 보인 유일한 그룹인 반면, 거리두기 및 양(Both) 전략 하위 그룹은 스캐너 내 등급에 기반한 성공적인 감정 조절을 보여주지 않았으며, 성공 변수에 대한 그룹 간에 통계적으로 유의미한 차이를 보여주지 않았습니다. 이는 이 작업 중에 재해석 전략을 사용하는 것이 일반적으로 성공적인 감정 조절을 보장하고 대조군과 환자 그룹 간의 유의미한 차이를 감지하는 데 유익한 영향을 미친다는 것을 시사합니다. 어쨌든, 일반적인 연구 결과는 강박장애 환자의 인지적 재평가 결핍에 대한 증거가 제한적임을 시사하며, 이는 증상에 특이적인 자극(예: 특정증상 내용이 있는 이미지)에 직면할 때 더 두드러질 수 있으며, 일반적인 부정적 내용의 자극에 노출되었을 때 상대적으로 보존된 재평가 능력과 대조를 이룬다.
감정 조절의 성공률에 대한 미미한 차이는 전체 샘플을 분석했을 때 뇌 활성화의 유의미한 차이와 일치하지 않았습니다. 그럼에도 불구하고, 특히 재해석 하위 그룹에 초점을 맞출 때, 강박장애 환자는 대조군에 비해 감정을 경험할 때 전두엽의 활성화가 감소한 것으로 나타났습니다. 디폴트 모드 네트워크(default mode network, DMN)의 일부인 프리큐네우스(precuneus)는 자기 참조 처리(self-referential processing)46에 결정적으로 관여하는 영역이며, 이는 재해석 전략을 사용하여 작업 요구에 적응하고 유지 상태(Maintain condition) 동안 정서적 처리에 적절하게 참여하는 대조군의 더 나은 능력을 반영할 수 있습니다(강박장애 환자는 그렇게 하지 못함). PPI 분석과 관련하여, 좌측 전두엽 네트워크 영역 간의 전체 샘플, 특히 선택적 주의, 인지 제어 및 작업 기억에 중요한 좌측 각도회와 좌측 vlPFC 영역 간의 연결성 차이를 밝혔습니다47,48. 전체 샘플에 대한 작업 관련 fMRI 활성화 차이의 부재와 전두두정체 네트워크의 상당한 연결성 변경이 처음에는 모순적으로 보일 수 있지만, 이는 다양한 신경 영상 분석을 사용하는 것의 관련성을 강조한다고 주장합니다. 이러한 접근 방식은 뚜렷한 통찰력을 제공하며, 특정 변화를 감지하기 위해 특정 신경 영상 양식과 분석 방법이 필요할 수 있음을 시사합니다. 더욱이, 감정 조절 하위 그룹 분석을 통해 더 많은 차이점이 발견되었는데, 편도체 및 내측 PFC 씨앗과 연결된 연결성의 추가적인 중단을 확인했으며, 특히 재해석 전략에 참여할 때 주요 조절 네트워크에서 더 강력한 연결성을 보여주는 대조군이 나타났습니다.
종합하면, 이러한 결과는 강박장애의 감정 조절 결핍이 전 세계적인 것이 아니라 맥락과 전략에 따라 다르다는 것을 시사합니다. 감정 조절을 지원하는 일부 신경망은 여전히 기능하는 반면, 다른 신경망은 특히 특정 전략에 대한 반응으로 뚜렷한 변화를 보입니다. 이러한 결과는 강박장애를 평가할 때 감정 조절 전략의 개인차와 이러한 과정의 기저에 있는 신경 메커니즘을 고려하는 것의 중요성을 강조합니다. 향후 연구에서는 증상에 특이적인 자극의 영향을 조사하고 이러한 중단된 네트워크를 대상으로 하는 잠재적인 치료 개입을 조사해야 한다.
추가 고려 사항은 본질적으로 감정을 경험하고 조절하는 데 참가자의 참여와 성과를 평가하는 데 어려움을 제기하기 때문에 과제의 설계 한계와 관련이 있습니다. 이러한 한계를 완화하기 위해 MRI 후 인터뷰를 실시하여 참가자들에게 과제 중 어떤 감정 조절 전략을 사용했는지 묻고 과제를 적절하게 수행하지 못한 참가자는 제외했습니다. 이와 관련하여, 유사한 설계를 사용하는 향후 연구는 심박 변이도와 같은 객관적인 정신 생리학적 측정을 통합함으로써 견고성을 향상시킬 수 있으며, 이는 감정 조절 수행에 대한 보다 신뢰할 수 있는 평가를 제공할 수 있습니다. 또한, 우리는 재해석 또는 거리두기 전략(또는 둘 다)을 사용하는 데 따른 차별적인 행동 및 신경 효과를 풀려고 시도했지만, 이러한 분석에 더 적합한 향후 연구는 우리의 예비 연구 결과의 견고성과 재현성을 밝혀줄 것입니다.
공개
지난 3년 동안 PM은 Angelini, AstraZeneca, Bial Foundation, Biogen, DGS-Portugal, FCT, FLAD, Janssen-Cilag, Gulbenkian Foundation, Lundbeck, Springer Healthcare, Tecnimede 및 2CA-Braga로부터 보조금, CME 관련 사례금 또는 컨설팅 비용을 받았습니다.
감사의 말
이 작업은 과학기술재단(FCT)을 통한 포르투갈 국가 기금의 자금 지원을 받았으며 프로젝트 UIDB/50026/2020 (DOI 10.54499/UIDB/50026/2020), UIDP/50026/2020 (DOI 10.54499/UIDP/50026/2020) 및 LA/P/0050/2020 (DOI 10.54499/LA/P/0050/2020) 프로젝트와 유럽 지역 개발 기금(ERDF)을 통한 포르투갈 2020 파트너십 협정에 따라 Norte Portugal Regional Operational Programme (NORTE 2020)의 지원을 받는 프로젝트 NORTE-01-0145-FEDER-000039의 지원을 받았습니다. MPP는 MCIN/AEI/10.13039/501100011033 및 "European Union NextGenerationEU/PRTR"이 자금을 지원하는 보조금 RYC2021-031228-I의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| AFNI | National Institute of Mental Health | RRID:SCR_005927 | https://afni.nimh.nih.gov/ |
| Diagnostic and Statistical Manual of Mental Disorders | American Psychiatric Association | 5th edition | |
| fMRIPrep | NiPreps Community | RRID:SCR_016216 | Based on Nipype (RRID:SCR_002502). Pipeline details: https://fmriprep.org/en/stable/workflows.html |
| FSL | FMRIB Software Library, Analysis Group, FMRIB, Oxford | ||
| JASP | JASP Team, University of Amsterdam, the Netherlands | ||
| Magnetic resonance imaging (MRI) scanner | Siemens | Verio 3T | |
| MRI-compatible response pad | Lumina–Cedrus Corporation | ||
| PsychoPy3 | University of Nottingham | ||
| SPM12 | Wellcome Trust Center for Neuroimaging | https://www.fil.ion.ucl. ac.uk/spm/ |
참고문헌
- Buckholtz, J. W., Meyer-Lindenberg, A. Psychopathology and the human connectome: toward a transdiagnostic model of risk for mental illness. Neuron. 74 (6), 990-1004 (2012).
- Menon, V. Large-scale brain networks and psychopathology: a unifying triple network model. Trends Cogn Sci. 15 (10), 483-506 (2011).
- Picó-Pérez, M., et al. Neural predictors of cognitive-behavior outcome in anxiety-related disorders: a meta-analysis of task-based fMRI studies. Psychol Med. 53 (8), 3387-3395 (2023).
- Gross, J. J. Antecedent- and response-focused emotion regulation: Divergent consequences for experience, expression, and physiology. J Pers Soc Psychol. 74 (1), 224-237 (1998).
- Ochsner, K., Silvers, J., Buhle, J. Functional imaging studies of emotion regulation: A synthetic review and evolving model of the cognitive control of emotion. Ann N Y Acad Sci. 1252, 1-35 (2012).
- Buhle, J. T., et al. Cognitive reappraisal of emotion: A meta-analysis of human neuroimaging studies. Cereb Cortex. 24 (11), 2981-2990 (2013).
- Frank, D. W., et al. Emotion regulation: Quantitative meta-analysis of functional activation and deactivation. Neurosci Biobehav Rev. 45, 202-211 (2014).
- Dosenbach, N. U. F., et al. Distinct brain networks for adaptive and stable task control in humans. Proc Natl Acad Sci USA. 104 (26), 11073-11078 (2007).
- Ochsner, K. N., Gross, J. J. The neural bases of emotion and emotion regulation: A valuation perspective. Gross, J. J. (ed) Handbook. , 23-42 (2014).
- Morawetz, C., Bode, S., Baudewig, J., Kirilina, E., Heekeren, H. R. Changes in effective connectivity between dorsal and ventral prefrontal regions moderate emotion regulation. Cereb Cortex. 26 (5), 1923-1937 (2016).
- Steward, T., et al. Dynamic neural interactions supporting the cognitive reappraisal of emotion. Cereb Cortex. 31 (2), 961-973 (2021).
- American Psychiatric Association. . Diagnostic and statistical manual of mental disorders. , (2013).
- Schienle, A., Schäfer, A., Stark, R., Walter, B., Vaitl, D. Neural responses of OCD patients towards disorder-relevant, generally disgust-inducing and fear-inducing pictures. Int J Psychophysiol. 57 (1), 69-77 (2005).
- vanden Heuvel, O. A., et al. Amygdala activity in obsessive-compulsive disorder with contamination fear: a study with oxygen-15 water positron emission tomography. Psychiatry Res Neuroimaging. 132 (3), 225-237 (2004).
- Picó-Pérez, M., et al. Modality-specific overlaps in brain structure and function in obsessive-compulsive disorder: Multimodal meta-analysis of case-control MRI studies. Neurosci Biobehav Rev. 112, 83-94 (2020).
- Goldberg, X., et al. Inter-individual variability in emotion regulation: Pathways to obsessive-compulsive symptoms. J Obsessive Compuls Relat Disord. 11, 105-112 (2016).
- Mataix-Cols, D., vanden Heuvel, O. A. Common and distinct neural correlates of obsessive-compulsive and related disorders. Psychiatr Clin North Am. 2 (2), 391-410 (2006).
- Milad, M. R., Rauch, S. L. Obsessive-compulsive disorder: beyond segregated cortico-striatal pathways. Trends Cogn Sci. 16 (1), 43-51 (2012).
- Paul, S., Simon, D., Endrass, T., Kathmann, N. Altered emotion regulation in obsessive-compulsive disorder as evidenced by the late positive potential. Psychol Med. 46 (1), 137-147 (2016).
- Franklin, M. E., Foa, E. B. Treatment of obsessive compulsive disorder. Annual review of clinical psychology. , 229-243 (2011).
- Hu, T., et al. Relation between emotion regulation and mental health: a meta-analysis review. Psychol Rep. 114 (2), 341-362 (2014).
- Phillips, M. L., Drevets, W. C., Rauch, S. L., Lane, R. Neurobiology of emotion perception II: implications for major psychiatric disorders. Biol Psychiatry. 54 (5), 515-528 (2003).
- Picó-Pérez, M., Radua, J., Steward, T., Menchón, J. M., Soriano-Mas, C. Emotion regulation in mood and anxiety disorders: A meta-analysis of fMRI cognitive reappraisal studies. Prog Neuro-Psychopharmacology Biol Psychiatry. 79, 96-104 (2017).
- de Wit, S. J., et al. Multicenter voxel-based morphometry mega-analysis of structural brain acans in obsessive-compulsive disorder. Am J Psychiatry. 171 (3), 340-349 (2014).
- Ferreira, S., et al. Frontoparietal hyperconnectivity during cognitive regulation in obsessive-compulsive disorder followed by reward valuation inflexibility. J Psychiatr Res. 137, 657-666 (2020).
- Menzies, L., et al. Integrating evidence from neuroimaging and neuropsychological studies of obsessive-compulsive disorder: The orbitofronto-striatal model revisited. Neurosci Biobehav Rev. 32 (3), 525-549 (2008).
- Huyser, C., Veltman, D. J., Wolters, L. H., De Haan, E., Boer, F. Functional magnetic resonance imaging during planning before and after cognitive-behavioral therapy in pediatric obsessive-compulsive disorder. J Am Acad Child Adolesc Psychiatry. 49 (12), 1238-1248 (2010).
- Vriend, C., et al. Switch the itch: A naturalistic follow-up study on the neural correlates of cognitive flexibility in obsessive-compulsive disorder. Psychiatry Res Neuroimaging. 213 (1), 31-38 (2013).
- Fink, J., Pflugradt, E., Stierle, C., Exner, C. Changing disgust through imagery rescripting and cognitive reappraisal in contamination-based obsessive-compulsive disorder. J Anxiety Disord. 54, 36-48 (2018).
- Sheehan, D. V., et al. The Mini-International Neuropsychiatric Interview (M.I.N.I.): The development and validation of a structured diagnostic psychiatric interview for DSM-IV and ICD-10. J Clin Psychiatry. 59, (1998).
- Foa, E. B., et al. The obsessive-compulsive inventory: Development and validation of a short version. Psychol Assess. 14 (4), 485-496 (2002).
- Varela Cunha, ., G, , et al. The Obsessive-Compulsive Inventory-Revised (OCI-R): Translation and validation of the European Portuguese version. Acta Med Port. 36 (3), 174-182 (2023).
- Gross, J. J., John, O. P. Individual differences in two emotion regulation processes: implications for affect, relationships, and well-being. J Pers Soc Psychol. 85 (2), 348-362 (2003).
- Vaz, F. M., Martins, C., Martins, E. C. Diferenciação emocional e regulação emocional em adultos portugueses. PSICOLOGIA. 22 (2), 123-135 (2008).
- Goodman, W. K., et al. The Yale-Brown Obsessive Compulsive Scale. Arch Gen Psychiatry. 46 (11), 1006 (1989).
- Castro-Rodrigues, P., et al. Criterion validity of the Yale-Brown Obsessive-Compulsive Scale second edition for diagnosis of obsessive-compulsive disorder in adults. Front Psychiatry. 9. 431, (2018).
- Phan, K. L., et al. Neural substrates for voluntary suppression of negative affect: A functional magnetic resonance imaging study. Biol Psychiatry. 57 (3), 210-219 (2005).
- Lang, P., Bradley, M., Cuthbert, B. International Affective Picture System (IAPS): Digitized photographs, instruction manual and affective ratings. Technical Report A-6. , (2005).
- Peirce, J. W. PsychoPy-Psychophysics software in Python. J Neurosci Methods. 162 (1-2), 8-13 (2007).
- Esteban, O., et al. fMRIPrep: a robust preprocessing pipeline for functional MRI. Nat Methods. 16 (1), 111-116 (2019).
- Esteban, O., et al. Analysis of task-based functional MRI data preprocessed with fMRIPrep. Nat Protoc. 15 (7), 2186-2202 (2020).
- Jenkinson, M., Beckmann, C. F., Behrens, T. E. J., Woolrich, M. W., Smith, S. M. FSL. NeuroImage. 62 (2), 782-790 (2012).
- Cox, R. W. AFNI: software for analysis and visualization of functional magnetic resonance neuroimages. Comput Biomed Res. 29 (29), 162-173 (1996).
- Zilverstand, A., Parvaz, M. A., Goldstein, R. Z. Neuroimaging cognitive reappraisal in clinical populations to define neural targets for enhancing emotion regulation. A systematic review. Neuroimage. 151, 105-116 (2017).
- Thorsen, A. L., et al. Emotion regulation in obsessive-compulsive disorder, unaffected siblings, and unrelated healthy control participants. Biol Psychiatry Cogn Neurosci Neuroimaging. 4 (4), 352-360 (2019).
- Utevsky, A. V., Smith, D. V., Huettel, S. A. Precuneus is a functional core of the default-mode network. J Neurosci. 34 (3), 932 (2014).
- Aron, A. R., Robbins, T. W., Poldrack, R. A. Inhibition and the right inferior frontal cortex: one decade on. Trends Cogn Sci. 18 (4), 177-185 (2014).
- Pessoa, L., Kastner, S., Ungerleider, L. G. Neuroimaging studies of attention: from modulation of sensory processing to top-down control. J Neurosci. 23 (10), 3990-3998 (2003).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유