Method Article
Exploración de los correlatos neuronales de la reevaluación cognitiva en el trastorno obsesivo-compulsivo mediante imágenes de resonancia magnética funcional basadas en tareas
En este artículo
Resumen
Presentamos un protocolo para explorar los correlatos neuronales de una tarea de regulación cognitiva de las emociones, a saber, la reevaluación cognitiva, utilizando imágenes de resonancia magnética funcional. Este protocolo se utilizó en pacientes con trastorno obsesivo-compulsivo y controles sanos, pero también se puede utilizar en otras muestras clínicas.
Resumen
Los pacientes con trastorno obsesivo-compulsivo (TOC) muestran una mayor actividad cerebral en las regiones límbica y orbitofrontal cuando se enfrentan a emociones negativas, lo que podría estar asociado con deficiencias en las habilidades de regulación emocional. La capacidad de regular las emociones es un mecanismo de afrontamiento necesario cuando se enfrentan situaciones emocionalmente angustiosas, y las estrategias deliberadas de regulación de las emociones, como la reevaluación cognitiva, se han estudiado ampliamente en la población general. A pesar de esto, se sabe poco sobre los posibles déficits deliberados de regulación emocional en pacientes con TOC y los correlatos neuronales asociados. Aquí, describimos un protocolo para investigar los correlatos neuronales de la regulación deliberada de las emociones (reevaluación cognitiva) utilizando imágenes de resonancia magnética funcional (fMRI) en pacientes con TOC en comparación con una muestra de control emparejada. Este protocolo sigue los estándares de oro actuales para los estudios de neuroimagen e incluye tanto la activación de tareas como el análisis de conectividad (así como datos de comportamiento) para permitir una investigación más completa. Por lo tanto, esperamos que contribuya a ampliar el conocimiento de los correlatos neuronales de la (dis)regulación de las emociones en el TOC, y también podría aplicarse para explorar los déficits de regulación de las emociones en otros trastornos psiquiátricos.
Introducción
La resonancia magnética funcional (fMRI) es una herramienta poderosa para comprender los trastornos psiquiátricos, ya que permite a los investigadores observar la función cerebral con una resolución espacial relativamente alta, lo que ofrece información sobre los mecanismos neuronales que subyacen aestas afecciones. Al detectar cambios en el flujo sanguíneo, la resonancia magnética funcional puede identificar regiones del cerebro que están más activas durante tareas específicas o en respuesta a estímulos particulares, destacando las anomalías en la función cerebral asociadas con trastornos como la depresión, la ansiedad, la esquizofrenia y el trastorno bipolar. Además, la resonancia magnética funcional puede revelar patrones de conectividad funcional, mostrando cómo las diferentes partes del cerebro se comunican entre sí, lo cual es crucial para comprender las complejas redes interrumpidas en los trastornos psiquiátricos. Esta técnica no invasiva no solo ayuda a identificar los correlatos neuronales de los síntomas psiquiátricos, sino que también ayuda a explorar los procesos psicológicos que podrían estar subyacentes tanto en los perfiles de síntomas como en la eficacia de los tratamientos3.
La regulación de las emociones es uno de esos procesos, que implica iniciar nuevas respuestas emocionales o alterar las continuas a través de diversos procesos de regulación. Existen varios tipos de estrategias de regulación de las emociones, como el despliegue atencional (distracción), la reevaluación cognitiva (reinterpretación del significado y la conexión personal con un estímulo) y la supresión de la experiencia o expresión emocional 4,5. En cuanto a la reevaluación, estudios previos de fMRI han encontrado que está relacionada con la activación en la corteza cingulada anterior dorsal (ACC), las cortezas dorsomedial y frontal lateral, así como en las regiones temporal y parietal 6,7. Estas regiones frontales y cinguladas del cerebro forman parte de la red de control cognitivo frontoparietal, que desempeña un papel en la regulación del esfuerzo. En el contexto de la reevaluación, esta red ayuda a replantear cognitivamente el significado afectivo negativo de un estímulo en términos más neutros8. Esta red, a su vez, controla las regiones ventral y límbica de abajo hacia arriba, como la amígdala, involucrada en la evaluación automática de los estímulos emocionales9. Estudios previos que utilizan el análisis de modelado causal dinámico han examinado la relación entre estas regiones dorsal y ventral durante las tareas de regulación de las emociones mediante fMRI. Descubrieron que, mientras que la circunvolución frontal inferior (IFG) está estrechamente conectada con la corteza prefrontal dorsolateral (PFC), la PFC ventromedial representa la vía principal a través de la cual las regiones prefrontales influyen directamente en la amígdala10,11.
El trastorno obsesivo-compulsivo (TOC) es un trastorno psiquiátrico que afecta al 1-3% de la población, caracterizado por pensamientos, impulsos o imágenes angustiantes y recurrentes (obsesiones), seguidos de comportamientos mentales o físicos repetitivos (compulsiones)12. Cuando se exponen a estímulos relevantes para el trastorno, los pacientes con TOC experimentan emociones negativas como miedo, ansiedad, disgusto o culpa13,14, junto con una mayor actividad en las regiones ventrales frontales y límbicas del cerebro como la corteza orbitofrontal (OFC), el ACC rostral y la amígdala15. Además, estudios previos han demostrado que los pacientes con TOC tienen dificultades en cuanto a la regulación de las emociones, particularmente cuando emplean estrategias de reevaluación cognitiva16. Por lo tanto, se plantea la hipótesis de que el aumento de la reactividad emocional que se encuentra en el TOC está relacionado con estos alteros de la regulación emocional 17,18,19. De hecho, la terapia cognitivo-conductual (un tratamiento de primera línea para el TOC20) incluye el entrenamiento de los pacientes en estrategias de regulación emocional para ayudarles a reevaluar cognitivamente las situaciones negativas que desencadenan los síntomas como no amenazantes.
Neurobiológicamente, se cree que la interacción disfuncional entre las redes ventral y dorsal está asociada con la alteración del procesamiento y la regulación emocional en diversos trastornos psiquiátricos 21,22,23. En el TOC, los estudios de neuroimagen funcional y estructural han revelado deficiencias en áreas cerebrales relacionadas con estas redes 24,25,26, con algunos déficits funcionales que se normalizan después de la mejoría de los síntomas27,28. Esta evidencia apoya la idea de que las dificultades de regulación emocional encontradas en el TOC podrían estar relacionadas con un deterioro del funcionamiento del control de las regiones dorsales del cerebro y/o una hiperactivación en el sistema ventral. Por lo tanto, restaurar el equilibrio entre estas redes a través del entrenamiento de reevaluación cognitiva puede mejorar potencialmente los síntomas de los pacientes29. A pesar de esta evidencia, existe una escasez de literatura previa que explore, mediante el uso de fMRI, los correlatos neuronales de la regulación cognitiva de las emociones en el TOC. Así, la definición de un protocolo estandarizado que pueda ser utilizado por todos los equipos de investigación interesados en este tema permitiría avanzar en el conocimiento en esta área de investigación de forma consistente y robusta.
Protocolo
El presente estudio se realizó de acuerdo con la Declaración de Helsinki y fue aprobado por el Comité de Ética institucional del Hospital de Braga y la Universidad de Minho (Braga, Portugal). Todos los procedimientos involucrados en este trabajo se adhieren a las normas éticas de los Comités Institucionales y Nacionales de Experimentación Humana pertinentes, así como a la Declaración de Helsinki de 1975, revisada en 2008.
1. Participantes
NOTA: Los pacientes adultos (≥18 años) con TOC fueron reclutados del Servicio de Psiquiatría del Hospital de Braga (Braga, Portugal) durante las consultas regulares.
- Reclutar pacientes adultos (≥18 años) con TOC durante consultas regulares donde son diagnosticados por un psiquiatra experimentado basado en criterios estándar (ver Tabla de Materiales). Realizar la Mini-Entrevista Neuropsiquiátrica Internacional30 para evaluar otras posibles condiciones psicopatológicas.
- Con respecto a los pacientes con TOC, establezca los criterios de exclusión para incluir la presencia actual de otros diagnósticos psiquiátricos (trastornos del Eje I o del Eje II) o afecciones neurológicas o médicas importantes actuales o pasadas.
NOTA: El uso de medicamentos psicofarmacológicos no fue un criterio de exclusión; La mayoría de los pacientes (80,64%) estaban medicados en el momento del reclutamiento, y los tratamientos se mantuvieron constantes durante todo el estudio. - Reclutar controles sanos (HC) del mismo contexto sociodemográfico, utilizando muestreos por conveniencia a través de las listas de correo y redes sociales de la institución, así como los contactos comunitarios de los investigadores.
- Excluir a los HC si tienen alguna afección neurológica, psiquiátrica o médica importante actual o pasada, o si tienen tratamiento actual o pasado con medicamentos psicofarmacológicos.
- Considerar las contraindicaciones para la realización de una resonancia magnética (implantes metálicos o claustrofobia) como un criterio de exclusión general para todos los participantes.
- Confirmar los criterios de inclusión/exclusión durante la consulta de psiquiatría para los pacientes o mediante una entrevista telefónica para el CS. Si los participantes cumplen con los criterios de inclusión y aceptan participar, programe una fecha para participar en el estudio.
- El día del estudio, antes de iniciar los procedimientos del estudio, presentar y explicar el formulario de consentimiento informado por escrito a los participantes y obtener su consentimiento informado por escrito antes de continuar.
2. Protocolo experimental
NOTA: Realizar una evaluación psicológica seguida de una resonancia magnética, con todo el protocolo experimental que no dure más de 1,5 h en total (Figura 1).
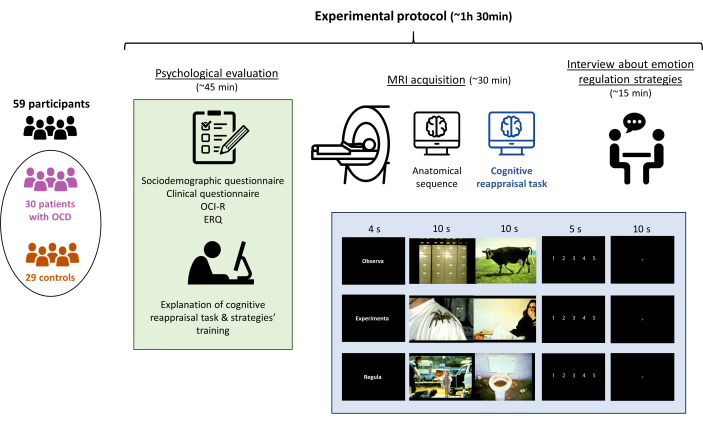
Figura 1: Protocolo experimental del estudio. Los participantes (30 pacientes con TOC y 29 controles emparejados) se sometieron a una evaluación psicológica, seguida de la explicación de la tarea de reevaluación cognitiva, la adquisición de la resonancia magnética (incluida la realización de la tarea) y, finalmente, una entrevista para confirmar que la tarea se realizó adecuadamente. Todo el protocolo duró aproximadamente 90 min. Haga clic aquí para ver una versión más grande de esta figura.
- Evaluación psicométrica (~45 min)
- Completar las siguientes escalas psicométricas, validadas en la población respectiva, así como cuestionarios sociodemográficos y clínicos, en el siguiente orden:
- Cuestionario sociodemográfico: Recoge información sobre sexo/género, año de nacimiento, años de escolaridad, zona de residencia, estado civil, estado familiar, situación laboral y dominancia de la mano. Véase el cuestionario utilizado en este estudio en el Fichero Complementario 1 , acompañado de una traducción al inglés.
- Cuestionario clínico: Recopila información sobre el consumo de sustancias (tabaco, alcohol u otras drogas), el uso farmacológico habitual, el diagnóstico actual de trastornos físicos o psiquiátricos y los antecedentes de trastornos psiquiátricos. Véase el cuestionario utilizado en este estudio en el Fichero Suplementario 2 , acompañado de una traducción al inglés.
- Responder al inventario obsesivo-compulsivo (OCI-R). Véase el cuestionario utilizado en este estudio, acompañado de una traducción al inglés.
NOTA: Se trata de un inventario de 18 ítems aplicable tanto a pacientes con TOC como a HC y mide seis grupos de síntomas: lavarse, revisar, ordenar, acumular, obsesionarse y neutralizar31,32. La puntuación de la subescala de lavado se obtiene sumando las puntuaciones de los ítems 5, 11 y 17; para la comprobación de los ítems 2, 8 y 14; para pedir los artículos 3, 9 y 15; para el acaparamiento de los artículos 1, 7 y 13; para obsesionarse con los ítems 6, 12 y 18; y para neutralizar los ítems 4, 10 y 16. También se puede obtener una puntuación total sumando las puntuaciones de todas las subescalas. - Aplicar el cuestionario de regulación emocional (ERQ), que evalúa el uso habitual de dos estrategias de regulación emocional: reevaluación y supresión33,34. Calcule las puntuaciones en la subescala de reevaluación sumando las puntuaciones de los ítems 1, 3, 5, 7, 8 y 10, y en la subescala de supresión sumando las puntuaciones de los ítems 2, 4, 6 y 9. Véase el cuestionario utilizado en este estudio en el Fichero Complementario 4, acompañado de una traducción al inglés.
- Para medir la gravedad de la obsesión y los síntomas compulsivos, asegúrese de que los pacientes con TOC hayan completado la Escala Obsesivo-Compulsiva de Yale-Brown (Y-BOCS) durante la consulta de psiquiatría cuando sean reclutados35,36. De lo contrario, recopile esta información durante la evaluación psicométrica. Véase el cuestionario utilizado en este estudio en el Fichero Complementario 5, acompañado de una traducción al inglés.
- Después de completar las escalas, explique la tarea de reevaluación cognitiva que se realizará en el escáner y entrene a los participantes en las estrategias de regulación emocional que se utilizarán (ver sección 2.3).
NOTA: Es importante tratar de aplicar siempre estas escalas antes de la adquisición de la resonancia magnética para asegurarse de que la tarea de reevaluación cognitiva no afecte las respuestas de las escalas.
- Completar las siguientes escalas psicométricas, validadas en la población respectiva, así como cuestionarios sociodemográficos y clínicos, en el siguiente orden:
- Adquisición de datos de imágenes (~30 min)
- Adquiera datos de imágenes en un escáner 3T (consulte la tabla de materiales), equipado con una bobina principal de 32 canales. Antes de comenzar con la adquisición de la resonancia magnética, indique a los participantes que se acuesten en decúbito supino en la cama de exploración y agregue un acolchado adicional para la cabeza para asegurarse de que los participantes se sientan cómodos durante la exploración, lo que minimizará el movimiento. Proporcione a los participantes protección para los oídos, una caja de respuesta en la mano derecha (consulte la sección 2.3) y un botón de parada de emergencia en la mano izquierda en caso de que tengan una necesidad urgente de detener el escáner.
- Pida a todos los participantes que realicen una tarea de reevaluación cognitiva dentro del escáner (ver más abajo). Durante esta tarea, adquiera una secuencia de imágenes ecoplanares (EPI) multibanda, (CMRREPI 2D) sensible a las fluctuaciones en el contraste del Nivel Dependiente de la Oxigenación Sanguínea (BOLD), con los siguientes parámetros (7,8 min): tiempo de repetición (TR) = 1.000 ms, tiempo de eco (TE) = 27 ms, ángulo de giro (FA) = 62°, tamaño de vóxel isométricode 2 mm 3 , 64 cortes axiales sobre una matriz de 200 x 200 mm2.
- Incluya en la sesión de escaneo un eco de gradiente anatómico preparado para la magnetización, adquisición rápida en el plano sagital con fines de registro (MPRAGE, TR = 2.420 ms, TE = 4,12 ms, FA = 9°, campo de visión (FOV) = 176 x 256 x 256 mm3, tamaño de vóxel isométrico de 1 mm3).
NOTA: Antes de comenzar la recolección de datos, asegúrese de que los participantes puedan ver claramente la presentación del estímulo en la proyección de la pantalla y que los botones de respuesta estén recopilando adecuadamente las respuestas. Asegúrese de que los participantes vean los estímulos en la orientación correcta y no volteados o invertidos.
- Tarea de reevaluación cognitiva de fMRI
- Antes de escanear, capacite a los participantes en estrategias de distanciamiento y reinterpretación. Por ejemplo, mientras muestra imágenes con escenarios perturbadores (consulte el Archivo Suplementario 6 para los utilizados en este estudio), indíqueles que reevalúen sus emociones reformulando cognitivamente la escena de una de las siguientes maneras: (i) la situación no es tan mala como parece a primera vista (es decir, interpretando la situación de una manera más positiva) (reinterpretación); (ii) la situación mejorará con el tiempo (reinterpretación); (iii) la escena representada no es real (por ejemplo, si hay personas en la escena, pensando que son actores) (distanciamiento); y (iv) las personas que se muestran en la escena son desconocidas, y por lo tanto no afectará a uno mismo (distanciamiento). Indique específicamente a los participantes que no utilicen estrategias no cognitivas (como mirar hacia otro lado) durante la tarea.
- Utilice la tarea de reevaluación cognitiva37 mientras adquiere la secuencia de resonancia magnética funcional. La tarea consiste en una serie de bloques, que incluyen estímulos de imagen neutros o negativos, que se les pide a los participantes:
- Observar (observar pasivamente estímulos neutros).
- Mantener (centrarse activamente en las emociones provocadas por los estímulos negativos, manteniéndolos en el tiempo).
- Regular (para reevaluar las emociones inducidas por los estímulos negativos utilizando las estrategias de reevaluación cognitiva previamente entrenadas).
- Utilice los siguientes 24 estímulos (fotografías) del Sistema Internacional de Imágenes Afectivas (IAPS38):
- Presente ocho imágenes neutras (por ejemplo, objetos domésticos) en la condición Observar (códigos 1670, 5395, 5455, 5660, 5900, 6150, 7000, 7496, véase el Archivo Complementario 7).
- Utilice 16 imágenes altamente desagradables y excitantes (por ejemplo, mutilaciones) en las condiciones Mantener (códigos 2661, 3230, 3300, 6360, 6831, 9041, 9560, 9570, ver Archivo Complementario 8) y Regular (códigos 2141, 3030, 6838, 7380, 9300, 9530, 9561, 9582, ver Archivo Complementario 9).
- Estructure la tarea para que conste de 12 bloques, cuatro bloques para cada condición (Observar, Mantener o Regular). Pseudoaleatorice las instrucciones a lo largo de la tarea para evitar inducir un estado de ánimo sostenido.
NOTA: Para este experimento, el orden de la condición fue Regular, Mantener, Observar, Mantener, Regular, Observar, Mantener, Observar, Regular, Observar, Mantener, Regular. - Comience cada bloque con la instrucción (Observar, Mantener o Regular) presentada durante 4 segundos en el centro de la pantalla. Después de la indicación, muestre a los participantes dos estímulos diferentes de valencia equivalente durante 10 s cada uno. Después de presentar el segundo estímulo de cada bloque, pida a los participantes que autoevalúen la intensidad de la emoción negativa experimentada en una escala numérica del 1 al 5 (donde 1 representa sentirse "neutral" y 5 "extremadamente negativo"). Para minimizar los efectos de arrastre, muestre una cruz de fijación en el centro de la pantalla durante 10 segundos después de cada bloque.
NOTA: Los estímulos se seleccionaron en función de sus puntuaciones normativas de excitación emocional y valencia. El equilibrio entre el contenido emocional de las imágenes negativas en las condiciones de Mantener y Regular debe considerarse cuidadosamente para evitar efectos de confusión debido a las diferencias en estas propiedades. - Utilice el software de referencia39 (ver Tabla de Materiales) y un sistema de espejo en ángulo compatible con resonancia magnética para mostrar las instrucciones de la tarea y los estímulos visuales.
- Utilice una almohadilla de respuesta compatible con resonancia magnética (consulte la Tabla de materiales) para registrar las calificaciones emocionales en el escáner.
- Después de la sesión de resonancia magnética, entreviste a los participantes para asegurarse de que siguieron las instrucciones y realizaron adecuadamente la tarea. Pregúnteles el tipo de estrategias de regulación emocional que se utilizaron (reinterpretación, distanciamiento u otras), y si cambiaron de estrategia durante la tarea o si hubo una estrategia específica que funcionó mejor para ellos y se mantuvo constante durante toda la tarea. Véase el cuestionario utilizado en este estudio en el Fichero Suplementario 10 , acompañado de una traducción al inglés.
- Utilice la información de la entrevista posterior a la resonancia magnética para categorizar la muestra en diferentes subgrupos en función de la estrategia de regulación emocional utilizada (distanciamiento, reinterpretación o ambas), y explore más a fondo los análisis posteriores por separado para cada uno de estos subgrupos.
3. Análisis de datos
- Análisis conductual
- Utilice el software de referencia (consulte la Tabla de materiales) para realizar los análisis estadísticos.
- Considere que los valores de P < 0,05 son estadísticamente significativos.
- Verifique la normalidad de las variables continuas utilizando la prueba de normalidad de Shapiro-Wilk y, en función de los resultados, compare los grupos de estas variables utilizando pruebas t de muestras independientes o pruebas U de Mann-Whitney.
- Utilice una prueba de chi cuadrado para comparar la distribución de sexo/género entre los grupos.
- Utilice una prueba de chi cuadrado para comparar la distribución de la estrategia de regulación emocional entre los grupos.
- Utilice un ANOVA de medidas repetidas de 2 x 3 para analizar las posibles diferencias en las calificaciones en el escáner de cada condición (Observar, Mantener y Regular) entre ambos grupos. A continuación, utilice pruebas post-hoc para comprobar las diferencias entre cada una de las dos condiciones, incluida la corrección de Holm para comparaciones múltiples. Haga esto para la muestra completa, así como para cada subgrupo de regulación de emociones.
- Calcule el éxito de los participantes en la disminución de su experiencia de emociones negativas en el escáner restando la media de las calificaciones de Regular de la media de las calificaciones de Mantener (Éxito = Mantener - Regular), y calcule la reactividad emocional de los participantes durante el procesamiento emocional restando las calificaciones medias de Observar de las calificaciones medias de Mantener (Reactividad = Mantener - Observar). A continuación, compare los grupos de las variables calculadas utilizando pruebas t de muestra independiente o pruebas de Mann-Whitney en función de la normalidad de los datos. Haga esto para la muestra completa, así como para cada subgrupo de regulación de emociones.
NOTA: En el Archivo Suplementario 11 se pueden encontrar varias pantallas de impresión que muestran cómo realizar estos análisis en JASP.
- Preprocesamiento de datos de neuroimagen
NOTA: Preprocese las imágenes utilizando el software de referencia40,41 (consulte la Tabla de Materiales). Este software realiza una canalización de preprocesamiento robusta y estandarizada para datos funcionales y estructurales y adapta su canalización en función de los datos y metadatos disponibles y que se utilizan como entrada, sin necesidad de definir ningún parámetro o paso por parte del usuario. Para obtener más información sobre la canalización, consulte el archivo complementario 11 y la sección de flujos de trabajo de la documentación.- Utilice un criterio de exclusión de desplazamiento medio de fotograma (FD) > 0,5 mm para tener en cuenta los movimientos en el escáner, observando los valores medios de FD incluidos en el informe de control de calidad generado por el software de preprocesamiento.
NOTA: No hubo participantes que superaran este umbral para este estudio; Por lo tanto, no se tuvo que excluir a ningún participante por este motivo. - Además, inspeccione visualmente los informes de salida para evaluar la precisión del corregistro e identificar cualquier otro problema potencial durante la canalización de preprocesamiento.
- Utilice la función fslmaths del software42 referenciado (consulte la Tabla de materiales) para suavizar espacialmente las series temporales resultantes con un núcleo de ancho completo a medio máximo (FWHM) de 8 mm (consulte el Archivo complementario 11 para el comando específico utilizado en este estudio).
- Utilice un criterio de exclusión de desplazamiento medio de fotograma (FD) > 0,5 mm para tener en cuenta los movimientos en el escáner, observando los valores medios de FD incluidos en el informe de control de calidad generado por el software de preprocesamiento.
- Análisis de activación de tareas de resonancia magnética funcional
NOTA: Realice el análisis de activación de tareas utilizando el software al que se hace referencia (consulte la Tabla de materiales).- Como paso preliminar, ajuste las dimensiones de la matriz de los datos de las series temporales de fMRI resultantes del preprocesamiento para permitir la compatibilidad entre el software que utiliza la función 3dresample del software referenciado43 (véase la Tabla de Materiales), con la plantilla "MNI152_T1_2mm_brain.nii.gz" como imagen maestra (véase el Archivo Suplementario 11 para el comando específico utilizado en este estudio).
- Para los análisis de primer nivel (de un solo sujeto), defina los siguientes contrastes de interés en SPM12: Mantener > Observar, que permite detectar activaciones asociadas a las emociones negativas experimentadas, y Regular > Mantener, con el fin de identificar activaciones relacionadas con la implementación de estrategias de reevaluación cognitiva.
- Condiciones del modelo para los 20 s en que las imágenes estuvieron en la pantalla, excluyendo los períodos de instrucción, clasificación y fijación cruzada. Convolumílle la respuesta BOLD en cada vóxel con la función de respuesta hemodinámica canónica y utilice un filtro de paso alto de 128 s.
- Utilice las señales medias del líquido cefalorraquídeo y la sustancia blanca como covariables, así como las variables para corregir el movimiento, calculadas durante el preprocesamiento de fMRIprep. Las variables de movimiento incluyeron los primeros seis componentes de aCompCor, además de FD y DVARS (Derivado de la raíz cuadrada media VARiance sobre voxelS).
- Para los análisis de segundo nivel (grupos), utilice pruebas t de dos muestras para buscar diferencias entre grupos en los contrastes de interés. Haga esto para la muestra completa, así como para cada subgrupo de regulación de emociones. Analice los datos a nivel de todo el cerebro, utilizando la corrección de umbrales de clúster: el vóxel p < 0,001 sin corregir y el clúster p < 0,05 error familiar (FWE) corregido.
NOTA: En el Archivo Suplementario 11 se pueden encontrar varias pantallas de impresión del proceso para realizar este análisis.
- Análisis de la interacción psicofisiológica
- Para explorar la conectividad entre las regiones cerebrales estimuladas por las diferentes condiciones de la tarea, realice un análisis de interacciones psicofisiológicas (PPI) en el software de referencia.
- Para realizar este análisis, seleccione una o varias regiones de inicialización basadas en al menos dos enfoques diferentes: un enfoque basado en datos, seleccionando regiones que se encuentren significativamente diferentes entre los grupos en el análisis de activación de tareas; o un enfoque basado en la teoría, seleccionando semillas en base a la literatura previa. Para este estudio, se eligieron las semillas de IBP basadas en la literatura previa sobre las alteraciones del procesamiento emocional en pacientes con TOC.
- Por ejemplo, utilice las siguientes regiones del metaanálisis de Picó-Pérez et al.15 , identificadas con hiperactivación durante el procesamiento emocional en pacientes con TOC en comparación con HC: un grupo que se extiende desde la ínsula anterior derecha hasta la amígdala y el putamen, el giro angular izquierdo, un grupo que comprende la amígdala izquierda y el putamen ventral, el giro precentral izquierdo, la corteza prefrontal medial y el tálamo izquierdo (ver Tabla 1 para más información).
- Explora la influencia de los contrastes de interés (el factor "psicológico") en la fuerza de las correlaciones de curso temporal entre las seis semillas seleccionadas y todas las demás regiones del cerebro (el factor "fisiológico").
- Estimar mapas de conectividad funcional para cada contraste y cada semilla mediante análisis de regresión lineal de todo el cerebro. Utilice un filtro de paso alto ajustado a 128 s para eliminar las derivas de baja frecuencia de menos de aproximadamente 0,008 Hz. Genere imágenes de contraste para cada sujeto (análisis de primer nivel) estimando el coeficiente de regresión entre la serie temporal inicial y la señal de cada vóxel del resto del cerebro.
- Para evaluar las diferencias entre los grupos (análisis de segundo nivel), incluya las imágenes resultantes del paso anterior en un análisis de prueba t de dos muestras para cada uno de los contrastes. Haga esto para la muestra completa, así como para cada subgrupo de regulación de emociones. Utilice el mismo umbral de significación que en el análisis de activación de tareas de resonancia magnética funcional. Además, aplique una corrección de Bonferroni al valor p de estos resultados para tener en cuenta la corrección de comparación múltiple por el número de semillas exploradas (p < 0.05 / 6 = p < 0.0083).
NOTA: En el Archivo Suplementario 11 se pueden encontrar varias pantallas de impresión del proceso para realizar este análisis.
Tabla 1: Semillas utilizadas en el análisis de la interacción psicofisiológica. Abreviaturas: Ke, extensión del clúster en vóxeles; MNI, Instituto Neurológico de Montreal. Haga clic aquí para descargar esta tabla.
Resultados
En la Tabla 2 se incluye un resumen de la información clínica y sociodemográfica de los participantes. El estudio incluyó a 67 individuos adultos (34 pacientes con TOC y 31 HC). Sin embargo, se excluyeron seis participantes (cuatro pacientes y dos controles) debido a artefactos de resonancia magnética o rendimiento subóptimo de las tareas (cuando se les entrevistó al final, dos participantes informaron que no se aplicaron estrategias de regulación y que no estaban prestando atención). La muestra final estuvo formada por 30 pacientes con TOC (17 mujeres; edad media = 28,97, DE = 11,14 años) y 29 HC (15 mujeres; edad media = 29,35, DE = 12,14 años). Ambos grupos fueron emparejados con respecto a la edad, los años de educación, la distribución por sexo/género y la estrategia de regulación emocional utilizada durante la tarea. La Tabla 2 también presenta información clínica para el grupo de pacientes con TOC, incluyendo la gravedad de los síntomas, la edad de inicio y el estado de la medicación.
En cuanto a las puntuaciones durante la tarea para la muestra completa, se utilizó la prueba de Huynh-Feldt, ya que nuestro ANOVA de medidas repetidas 2 x 3 violaba el supuesto de esfericidad. El efecto principal de la condición fue estadísticamente significativo (F(1.783, 98.067) = 112.728, p < .001), y las pruebas post-hoc revelaron que la condición de Mantener difiere significativamente de la condición de Observar (apuntando hacia una inducción exitosa de emociones negativas para ambos grupos; t = -14.423, pholm < .001), y que la condición de Regular difiere de la condición de Mantener (indicando también una regulación exitosa de las emociones para ambos grupos; t = 3.597, pholm < .001) (Figura 2). Sin embargo, el efecto principal del grupo no fue estadísticamente significativo (F(1, 55) = 0,155, p = 0,695), y tampoco hubo interacción significativa entre los grupos y las condiciones (F (1,783, 98,067) = 1,877, p = 0,163). Sin embargo, la variable Éxito difirió significativamente entre los grupos (t(55) = 2,15, p = 0,036), y los controles mostraron una mejor regulación que los pacientes con TOC.
Al explorar esto para el subgrupo de distanciamiento, también se violó la suposición de esfericidad, por lo que se utilizó nuevamente la prueba de Huynh-Feldt como nuestro ANOVA de medidas repetidas 2 x 3. El efecto principal de la condición fue estadísticamente significativo (F(1,398, 27,961) = 35,704, p < 0,001), y las pruebas post-hoc revelaron que la condición de Mantener difería significativamente de la condición de Observar (lo que indica una inducción exitosa de emociones negativas; t = −7,666, pholm < 0,001), pero con la condición de Regular ya no difiere significativamente de la condición de Mantener (apuntando hacia un fracaso en la regulación exitosa de las emociones; t = 0,755, pholm < 0,455) (Figura 2). El efecto principal del grupo tampoco fue significativo (F(1, 20) = 0,887, p = 0,358), y lo mismo ocurrió con la interacción entre el grupo y la condición (F (1,398, 27,961) = 0,103, p = 0,832). En consecuencia, la variable Éxito tampoco fue significativamente diferente entre los grupos (t(20) = -0,132, p = 0,896).
En cuanto al subgrupo de reinterpretación, se realizó un ANOVA de medidas repetidas 2 x 3 sin corrección de esfericidad, ya que no se violó el supuesto de esfericidad. El efecto principal de la condición también fue significativo (F(1.8, 23.404) = 28.355, p < 0.001), y las pruebas post-hoc revelaron que la condición de Mantener difiere significativamente de la condición de Observar (apuntando hacia una inducción exitosa de emociones negativas; t = −7.48, pholm < 0.001), y que la condición de Regular difiere de la condición de Mantener (indicando una regulación exitosa de las emociones; t = 2.983, pholm < 0.006) (Figura 2). Sin embargo, el efecto principal del grupo no fue estadísticamente significativo (F(1, 13) = 2,623, p = 0,129), y tampoco hubo interacción significativa entre los grupos y las condiciones (F (1,8, 23,404) = 2,312, p = 0,126). Sin embargo, la variable Éxito difirió significativamente entre los grupos (t(13) = 2,664, p = 0,019), y los controles mostraron una mejor regulación que los pacientes con TOC.
Finalmente, con respecto al subgrupo Ambas estrategias, también se realizó un ANOVA de medidas repetidas 2 x 3 sin corrección de esfericidad, ya que no se violó el supuesto de esfericidad. El efecto principal de la condición fue estadísticamente significativo (F(1,592, 22,294) = 27,772, p < 0,001), y las pruebas post-hoc revelaron que la condición de Mantener difería significativamente de la condición de Observar (lo que indica una inducción exitosa de emociones negativas; t = −7,114, pholm < 0,001), pero con la condición de Regular ya no difiere significativamente de la condición de Mantener (apuntando hacia un fracaso en la regulación exitosa de las emociones; t = 1,634, pholm < 0,114) (Figura 2). El efecto principal del grupo no fue estadísticamente significativo (F(1, 14) = 0,245, p = 0,629), y tampoco hubo interacción significativa entre los grupos y las condiciones (F (1,592, 22,294) = 0,143, p = 0,867). Del mismo modo, la variable Éxito no fue significativamente diferente entre los grupos (t(13) = 0,597, p = 0,56).
En general, al considerar la muestra completa, la inducción de emociones negativas fue exitosa y la regulación de las emociones fue efectiva en ambos grupos, aunque los controles parecieron mostrar una mejor regulación de las emociones que los pacientes con TOC al considerar la variable de éxito. En cuanto a los subgrupos específicos de la estrategia de regulación emocional, la inducción de emociones negativas fue exitosa para todos ellos, mientras que la regulación emocional pareció fallar para los subgrupos de estrategias de Distanciamiento y Ambos, siendo exitosa solo para el subgrupo de Reinterpretación. Además, solo este subgrupo mostró diferencias significativas entre los grupos en la variable de éxito, presentándose controles con una mejor regulación emocional en comparación con los pacientes con TOC (en línea con la muestra completa). Esto proporciona evidencia sobre los beneficios de emplear estrategias de reinterpretación en esta tarea, tanto para asegurar una regulación exitosa de las emociones en general como para detectar diferencias significativas entre los grupos de control y de pacientes. Sin embargo, estos hallazgos deben tomarse con precaución, dada la disminución del tamaño de la muestra de cada subgrupo y la pérdida asociada de poder estadístico al realizar los análisis de subgrupos.
En cuanto a las escalas psicométricas, no hubo diferencias significativas entre los grupos en el ERQ, pero los pacientes con TOC puntuaron significativamente más alto que los HC en todas las subescalas del OCI-R, a excepción del OCI-R Hoarding (Tabla 2).
Finalmente, con respecto a los resultados de la activación de la tarea de resonancia magnética funcional, no hubo diferencias significativas entre los grupos para la muestra completa a nivel de todo el cerebro para Mantener > Observar o Regular > Mantener en el umbral corregido de comparación múltiple seleccionado. Sin embargo, al explorar los subgrupos en función de la estrategia de regulación emocional utilizada, surgieron diferencias significativas entre los grupos para los subgrupos de estrategias de Reinterpretación y Ambos. En concreto, para el subgrupo de Reinterpretación, los controles presentaron mayor activación que los pacientes con TOC en el precúneo para el contraste Mantener > Observar. Por otro lado, para el subgrupo Ambas estrategias, los pacientes con TOC presentaron una mayor activación en la ínsula posterior derecha y en los giros precentrales bilaterales también para el contraste Mantener > Observar (ver Tabla 3 y Figura 3). No hubo hallazgos estadísticamente significativos para el subgrupo de Distanciamiento ni para el contraste Regular > Mantener.
Además, en cuanto al análisis de IBP, reveló que para la muestra completa, la conectividad entre la semilla de la circunvolución angular izquierda y el PFC ventrolateral izquierdo (vlPFC) fue significativamente mayor en los controles en comparación con los pacientes con TOC para el contraste Maintain > Observe, mientras que se encontró el patrón opuesto para Regular > Mantener (mayor conectividad en pacientes con TOC). Al explorar los diferentes subgrupos de estrategia, se encontró una mayor conectividad entre la semilla de la amígdala izquierda y la circunvolución temporal inferior derecha (ITG) y la circunvolución occipital media izquierda (MOG) para el subgrupo de Distanciamiento y el contraste Mantener > Observar. Además, la conectividad de esta misma semilla con la PFC dorsolateral derecha (dlPFC), la cola caudada derecha y la PFC medial izquierda también se incrementó en los pacientes del subgrupo Ambas estrategias y el contraste Regular > Mantener. Finalmente, para el subgrupo de Reinterpretación, la conectividad entre la semilla de PFC medial y la circunvolución precentral derecha fue significativamente mayor en los controles en comparación con los pacientes con TOC para el contraste Regular > Keep (Tabla 3 y Figura 4).
En resumen, el análisis de activación de tareas de todo el cerebro no mostró diferencias significativas entre los grupos para la muestra completa, pero los análisis de subgrupos destacaron diferencias específicas relacionadas con la estrategia de regulación emocional empleada. Por ejemplo, la estrategia de reinterpretación reveló una disminución de la activación del precúneo en los pacientes con TOC, mientras que el subgrupo de ambas estrategias mostró una mayor activación en regiones como la ínsula posterior y los giros precentrales en los pacientes con TOC para el contraste Mantener > Observar. Estos hallazgos apuntan a posibles alteraciones neuronales específicas de la estrategia en el TOC, que curiosamente no son evidentes cuando se regulan las emociones (Regular > Mantener contraste) sino cuando se experimentan (Mantener > Observar contraste). Esto apunta hacia un efecto general en el procesamiento emocional de tener diferentes enfoques para la regulación de las emociones. Los análisis de conectividad funcional (PPI) ofrecieron más información, revelando patrones de conectividad alterados en pacientes con TOC. En particular, la red de circunvolución angular izquierda-vlPFC mostró una conectividad reducida en los pacientes con TOC para el contraste Mantener > Observar, mientras que el contraste Regular > Mantener exhibió el patrón opuesto. Los análisis de subgrupos identificaron interrupciones adicionales en la conectividad relacionadas con la amígdala y las semillas de PFC medial, con controles que demostraron una conectividad más fuerte en redes regulatorias clave, particularmente cuando se participó en la estrategia de reinterpretación.
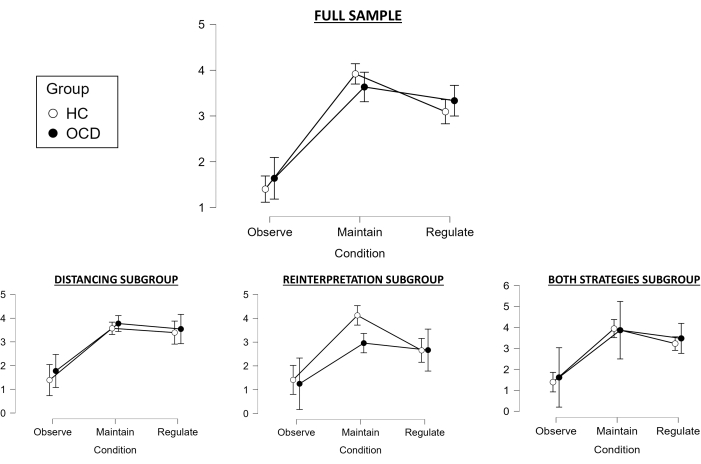
Figura 2: Resultados conductuales. Media (intervalo de confianza del 95%) de las puntuaciones emocionales en el escáner para cada grupo y cada condición (1 es "neutral" y 5 es "extremadamente negativa"), para la muestra completa (arriba), así como para los diferentes subgrupos en función de la estrategia de regulación emocional utilizada (abajo). Abreviaturas: HC = control sano; TOC = trastorno obsesivo-compulsivo. Haga clic aquí para ver una versión más grande de esta figura.
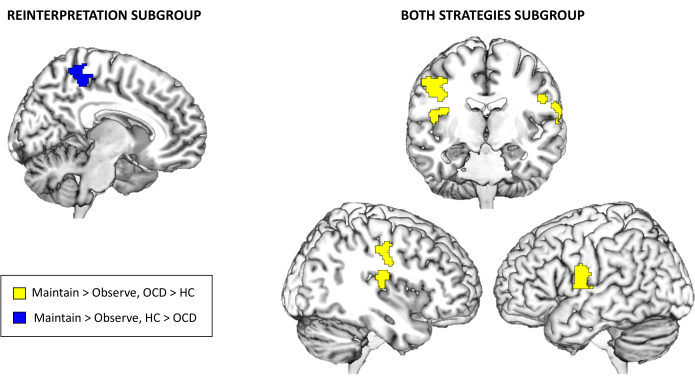
Figura 3: Resultados de la activación de la tarea de resonancia magnética funcional. Diferencias entre grupos en la activación de todo el cerebro para los subgrupos de Reinterpretación y Ambas estrategias para el contraste Mantener > Observar. Los hallazgos son significativos a nivel de todo el cerebro: p < .05 FWE-cluster corregido Haga clic aquí para ver una versión más grande de esta figura.
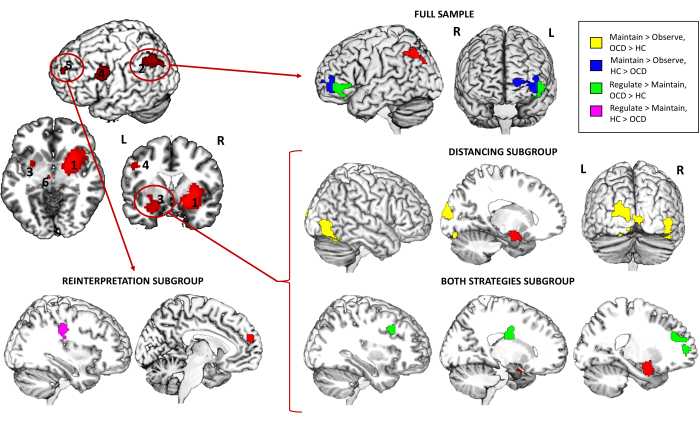
Figura 4: Resultados de la interacción psicofisiológica de la tarea de resonancia magnética funcional. Diferencias entre grupos en la conectividad de todo el cerebro para la muestra completa y los diferentes subgrupos de estrategia para las semillas de circunvolución angular izquierda (2), amígdala izquierda (3) y PFC medial (5). Las semillas se representan en rojo, mientras que las regiones con conectividad diferencial se representan en amarillo (OCD > HC) o azul (HC > OCD) para el contraste Mantener > Observar, y en verde (OCD > HC) o morado (HC > OCD) para el contraste Regular > Mantener. Los hallazgos son significativos a nivel de todo el cerebro: p < .05 FWE-cluster corregido. Véase la Tabla 3 para los hallazgos que sobrevivieron a una corrección adicional de Bonferroni por el número de semillas exploradas. Abreviaturas: HC = control sano; TOC = trastorno obsesivo-compulsivo. Haga clic aquí para ver una versión más grande de esta figura.
Tabla 2: Características sociodemográficas y clínicas de los participantes. N total = 58 para las subescalas OCI-R, N = 57 para las calificaciones emocionales en el escáner y N = 54 para la estrategia utilizada durante la tarea. Abreviaturas: AP = antipsicóticos; Dist = distanciamiento; ERQ = Cuestionario de Regulación de Emociones; HC = controles sanos; TOC = trastorno obsesivo-compulsivo; OCI-R = Inventario Obsesivo-Compulsivo-Revisado; Reint = reinterpretación; DE = desviación estándar; ISRS = inhibidores selectivos de la recaptación de serotonina; Y-BOCS = Escala Obsesivo-Compulsiva de Yale-Brown. Haga clic aquí para descargar esta tabla.
Tabla 3: Resultados de las tareas de resonancia magnética funcional. Diferencias entre grupos en la activación de tareas y el análisis de la interacción psicofisiológica para la muestra completa, así como para los diferentes subgrupos de estrategias. Los hallazgos son significativos a nivel de todo el cerebro: p < .05 FWE-cluster corregido. *Hallazgos de PPI que siguen siendo significativos después de una corrección adicional de Bonferroni por el número de semillas exploradas (p < .05 / 6 = p < .0083). Abreviaturas: dlPFC, corteza prefrontal dorsolateral; HC, controles sanos; ITG: circunvolución temporal inferior; Ke, extensión de clúster en vóxeles; MNI, Instituto Neurológico de Montreal; MOG: circunvolución occipital media; TOC, trastorno obsesivo-compulsivo; PFC: corteza prefrontal; PPI: análisis de interacciones psicofisiológicas; vlPFC: corteza prefrontal ventrolateral. Haga clic aquí para descargar esta tabla.
Ficha Suplementaria 1: Cuestionario sociodemográfico utilizado (en portugués), acompañado de una traducción al inglés. Haga clic aquí para descargar este archivo.
Archivo Suplementario 2: Cuestionario clínico utilizado (en portugués), acompañado de una traducción al inglés. Haga clic aquí para descargar este archivo.
Archivo complementario 3: versión portuguesa del OCI-R utilizada, acompañada de una traducción al inglés. Haga clic aquí para descargar este archivo.
Legajo Suplementario 4: Versión portuguesa del ERQ utilizada, acompañada de una traducción al inglés. Haga clic aquí para descargar este archivo.
Archivo complementario 5: versión portuguesa del Y-BOCS utilizada, acompañada de una traducción al inglés. Haga clic aquí para descargar este archivo.
Archivo complementario 6: Presentación utilizada para explicar la tarea de reevaluación cognitiva y capacitar a los participantes en estrategias de distanciamiento y reinterpretación antes de la exploración, acompañada de una traducción al inglés. Haga clic aquí para descargar este archivo.
Archivo complementario 7: Imágenes neutras de la IAPS utilizadas para la condición de observación de la tarea de reevaluación cognitiva. Haga clic aquí para descargar este archivo.
Archivo complementario 8: Imágenes negativas de IAPS utilizadas para la condición de mantenimiento de la tarea de reevaluación cognitiva. Haga clic aquí para descargar este archivo.
Ficha complementaria 9: Imágenes negativas de IAPS utilizadas para la condición de regulación de la tarea de reevaluación cognitiva. Haga clic aquí para descargar este archivo.
Ficha complementaria 10: Cuestionario utilizado después de la sesión de resonancia magnética para comprobar que los participantes realizaron adecuadamente la tarea y anotar las estrategias que utilizaron, acompañado de una traducción al inglés. Haga clic aquí para descargar este archivo.
Ficha complementaria 11: Pasos detallados del software para los diferentes análisis de datos incluidos en este estudio. Haga clic aquí para descargar este archivo.
Discusión
Este protocolo permite a los investigadores explorar los correlatos neuronales de la regulación de las emociones en pacientes con TOC en comparación con los controles, utilizando una tarea de reevaluación cognitiva de resonancia magnética funcional. Este diseño muestra potencial para mejorar nuestra comprensión de los mecanismos del cerebro para regular las emociones a través de estrategias deliberadas y se puede utilizar en pacientes con TOC, así como en otras poblaciones psiquiátricas. Además, diseñamos cuidadosamente el protocolo utilizando los últimos estándares de oro de neuroimagen (una secuencia multibanda, preprocesamiento de fMRIPrep y un método de corrección de comparación múltiple adecuado, por ejemplo). Se prestó especial atención a que ambos grupos de participantes coincidieran en las variables sociodemográficas y que los participantes con datos de mala calidad se excluyeran del análisis.
A pesar de todas estas precauciones, tuvimos hallazgos negativos (es decir, no hubo diferencias entre los grupos) en algunos de los análisis. A nivel conductual, el efecto del grupo no fue significativo en el análisis de las calificaciones en el escáner utilizando un ANOVA de medidas repetidas de 2 x 3 para la muestra completa. Este hallazgo se alinea con meta-análisis previos y revisiones sistemáticas en poblaciones psiquiátricas23,44, sugiriendo influencias potenciales de los efectos de deseabilidad social, evaluaciones conductuales intra-escáner o deterioro de la autoconciencia de la experiencia emocional. Sin embargo, surgieron diferencias significativas entre los grupos en la variable Éxito, lo que indica que los individuos con TOC exhibieron una peor regulación de las emociones. Por lo tanto, a pesar de una similitud general en el patrón de calificaciones entre las condiciones para ambos grupos, las alteraciones aún son observables cuando se concentra solo en las condiciones de Mantener y Regular.
Además, al repetir este análisis para los diferentes subgrupos de regulación emocional, el subgrupo de Reinterpretación fue el único que mostró el mismo patrón de hallazgos que para la muestra completa, mientras que los subgrupos Distanciamiento y Ambas estrategias no mostraron una regulación emocional exitosa basada en las calificaciones en el escáner, ni diferencias estadísticamente significativas entre los grupos para la variable de éxito. Esto apunta hacia un impacto beneficioso del uso de estrategias de reinterpretación durante esta tarea, tanto para asegurar una regulación exitosa de las emociones en general, como para detectar diferencias significativas entre los grupos de control y los de pacientes. En cualquier caso, los hallazgos generales sugieren evidencia limitada de déficits de reevaluación cognitiva en pacientes con TOC, que pueden ser más pronunciados cuando se enfrentan a estímulos específicos de síntomas (como imágenes con contenido de síntomas específicos45), en contraste con las capacidades de reevaluación relativamente conservadas cuando se exponen a estímulos de contenido negativo general.
La modesta diferencia en el éxito en la regulación de las emociones no se correspondió con diferencias significativas en la activación cerebral al analizar la muestra completa. Sin embargo, cuando se enfocaron específicamente en el subgrupo de Reinterpretación, los pacientes con TOC mostraron una disminución de la activación en el precúneo al experimentar emociones en comparación con los controles. El precúneo, como parte de la red de modo por defecto (DMN), es una región críticamente involucrada en el procesamiento autorreferencial46, y esto podría reflejar una mejor capacidad de los controles que utilizan estrategias de reinterpretación para adaptarse a las demandas de la tarea, participando adecuadamente en el procesamiento emocional durante la condición de Mantener (mientras que los pacientes con TOC no lo hacen). En cuanto al análisis de IBP, reveló diferencias de conectividad para toda la muestra entre regiones de la red frontoparietal izquierda, particularmente entre la circunvolución angular izquierda y las regiones vlPFC izquierdas críticas para la atención selectiva, el control cognitivo y la memoria de trabajo47,48. Si bien la ausencia de diferencias en la activación de la resonancia magnética funcional relacionada con la tarea para la muestra completa, junto con alteraciones significativas de la conectividad en la red frontoparietal, puede parecer inicialmente contradictoria, argumentamos que esto subraya la relevancia de emplear diferentes análisis de neuroimagen. Tales enfoques arrojan perspectivas distintas, lo que sugiere que ciertas modalidades de neuroimagen y métodos analíticos podrían ser necesarios para detectar alteraciones específicas. Además, se encontraron más diferencias en los análisis de los subgrupos de regulación de las emociones, identificando interrupciones adicionales en la conectividad relacionadas con las semillas de amígdala y PFC medial, con controles que demostraron una conectividad más fuerte en las redes reguladoras clave, particularmente cuando se participó en la estrategia de reinterpretación.
En conjunto, estos hallazgos sugieren que los déficits de regulación de las emociones en el TOC no son globales, sino que dependen del contexto y la estrategia. Mientras que algunas redes neuronales que apoyan la regulación de las emociones siguen funcionando, otras muestran alteraciones distintas, especialmente en respuesta a estrategias específicas. Estos resultados ponen de manifiesto la importancia de tener en cuenta las diferencias individuales en las estrategias de regulación de las emociones y los mecanismos neuronales que subyacen a estos procesos a la hora de evaluar el TOC. Los estudios futuros deben explorar el impacto de los estímulos específicos de los síntomas y examinar las posibles intervenciones terapéuticas dirigidas a estas redes interrumpidas.
Otra consideración se refiere a las limitaciones de diseño de la tarea, ya que inherentemente plantea un desafío para evaluar la participación y el desempeño de los participantes en la experiencia y regulación de las emociones. Para intentar mitigar esta limitación, realizamos una entrevista posterior a la resonancia magnética en la que se preguntó a los participantes qué estrategias de regulación emocional utilizaron durante la tarea y se excluyó a los participantes que no realizaron adecuadamente la tarea. En esta línea, futuros estudios que utilicen diseños similares podrían mejorar la robustez mediante la incorporación de medidas psicofisiológicas objetivas como la variabilidad de la frecuencia cardíaca, que podrían ofrecer evaluaciones más fiables del rendimiento de la regulación emocional. Además, intentamos desentrañar los efectos conductuales y neuronales diferenciales del uso de estrategias de reinterpretación o distanciamiento (o ambas), pero futuros estudios mejor potenciados para estos análisis arrojarán luz sobre la solidez y replicabilidad de nuestros hallazgos preliminares.
Divulgaciones
En los últimos 3 años, PM ha recibido subvenciones, honorarios relacionados con CME u honorarios de consultoría de Angelini, AstraZeneca, Bial Foundation, Biogen, DGS-Portugal, FCT, FLAD, Janssen-Cilag, Gulbenkian Foundation, Lundbeck, Springer Healthcare, Tecnimede y 2CA-Braga.
Agradecimientos
Este trabajo ha sido financiado por fondos nacionales portugueses a través de la Fundación para la Ciencia y la Tecnología (FCT) - proyecto UIDB/50026/2020 (DOI 10.54499/UIDB/50026/2020), UIDP/50026/2020 (DOI 10.54499/UIDP/50026/2020), y LA/P/0050/2020 (DOI 10.54499/LA/P/0050/2020), y por el proyecto NORTE-01-0145-FEDER-000039, apoyado por el Programa Operativo Regional Norte Portugal (NORTE 2020) en el marco del Acuerdo de Asociación PORTUGAL 2020 a través del Fondo Europeo de Desarrollo Regional (FEDER). El MPP contó con el apoyo de una subvención RYC2021-031228-I financiada por MCIN/AEI/10.13039/501100011033 y por el proyecto "European Union NextGenerationEU/PRTR".
Materiales
| Name | Company | Catalog Number | Comments |
| AFNI | National Institute of Mental Health | RRID:SCR_005927 | https://afni.nimh.nih.gov/ |
| Diagnostic and Statistical Manual of Mental Disorders | American Psychiatric Association | 5th edition | |
| fMRIPrep | NiPreps Community | RRID:SCR_016216 | Based on Nipype (RRID:SCR_002502). Pipeline details: https://fmriprep.org/en/stable/workflows.html |
| FSL | FMRIB Software Library, Analysis Group, FMRIB, Oxford | ||
| JASP | JASP Team, University of Amsterdam, the Netherlands | ||
| Magnetic resonance imaging (MRI) scanner | Siemens | Verio 3T | |
| MRI-compatible response pad | Lumina–Cedrus Corporation | ||
| PsychoPy3 | University of Nottingham | ||
| SPM12 | Wellcome Trust Center for Neuroimaging | https://www.fil.ion.ucl. ac.uk/spm/ |
Referencias
- Buckholtz, J. W., Meyer-Lindenberg, A. Psychopathology and the human connectome: toward a transdiagnostic model of risk for mental illness. Neuron. 74 (6), 990-1004 (2012).
- Menon, V. Large-scale brain networks and psychopathology: a unifying triple network model. Trends Cogn Sci. 15 (10), 483-506 (2011).
- Picó-Pérez, M., et al. Neural predictors of cognitive-behavior outcome in anxiety-related disorders: a meta-analysis of task-based fMRI studies. Psychol Med. 53 (8), 3387-3395 (2023).
- Gross, J. J. Antecedent- and response-focused emotion regulation: Divergent consequences for experience, expression, and physiology. J Pers Soc Psychol. 74 (1), 224-237 (1998).
- Ochsner, K., Silvers, J., Buhle, J. Functional imaging studies of emotion regulation: A synthetic review and evolving model of the cognitive control of emotion. Ann N Y Acad Sci. 1252, 1-35 (2012).
- Buhle, J. T., et al. Cognitive reappraisal of emotion: A meta-analysis of human neuroimaging studies. Cereb Cortex. 24 (11), 2981-2990 (2013).
- Frank, D. W., et al. Emotion regulation: Quantitative meta-analysis of functional activation and deactivation. Neurosci Biobehav Rev. 45, 202-211 (2014).
- Dosenbach, N. U. F., et al. Distinct brain networks for adaptive and stable task control in humans. Proc Natl Acad Sci USA. 104 (26), 11073-11078 (2007).
- Ochsner, K. N., Gross, J. J. The neural bases of emotion and emotion regulation: A valuation perspective. Gross, J. J. (ed) Handbook. , 23-42 (2014).
- Morawetz, C., Bode, S., Baudewig, J., Kirilina, E., Heekeren, H. R. Changes in effective connectivity between dorsal and ventral prefrontal regions moderate emotion regulation. Cereb Cortex. 26 (5), 1923-1937 (2016).
- Steward, T., et al. Dynamic neural interactions supporting the cognitive reappraisal of emotion. Cereb Cortex. 31 (2), 961-973 (2021).
- American Psychiatric Association. . Diagnostic and statistical manual of mental disorders. , (2013).
- Schienle, A., Schäfer, A., Stark, R., Walter, B., Vaitl, D. Neural responses of OCD patients towards disorder-relevant, generally disgust-inducing and fear-inducing pictures. Int J Psychophysiol. 57 (1), 69-77 (2005).
- vanden Heuvel, O. A., et al. Amygdala activity in obsessive-compulsive disorder with contamination fear: a study with oxygen-15 water positron emission tomography. Psychiatry Res Neuroimaging. 132 (3), 225-237 (2004).
- Picó-Pérez, M., et al. Modality-specific overlaps in brain structure and function in obsessive-compulsive disorder: Multimodal meta-analysis of case-control MRI studies. Neurosci Biobehav Rev. 112, 83-94 (2020).
- Goldberg, X., et al. Inter-individual variability in emotion regulation: Pathways to obsessive-compulsive symptoms. J Obsessive Compuls Relat Disord. 11, 105-112 (2016).
- Mataix-Cols, D., vanden Heuvel, O. A. Common and distinct neural correlates of obsessive-compulsive and related disorders. Psychiatr Clin North Am. 2 (2), 391-410 (2006).
- Milad, M. R., Rauch, S. L. Obsessive-compulsive disorder: beyond segregated cortico-striatal pathways. Trends Cogn Sci. 16 (1), 43-51 (2012).
- Paul, S., Simon, D., Endrass, T., Kathmann, N. Altered emotion regulation in obsessive-compulsive disorder as evidenced by the late positive potential. Psychol Med. 46 (1), 137-147 (2016).
- Franklin, M. E., Foa, E. B. Treatment of obsessive compulsive disorder. Annual review of clinical psychology. , 229-243 (2011).
- Hu, T., et al. Relation between emotion regulation and mental health: a meta-analysis review. Psychol Rep. 114 (2), 341-362 (2014).
- Phillips, M. L., Drevets, W. C., Rauch, S. L., Lane, R. Neurobiology of emotion perception II: implications for major psychiatric disorders. Biol Psychiatry. 54 (5), 515-528 (2003).
- Picó-Pérez, M., Radua, J., Steward, T., Menchón, J. M., Soriano-Mas, C. Emotion regulation in mood and anxiety disorders: A meta-analysis of fMRI cognitive reappraisal studies. Prog Neuro-Psychopharmacology Biol Psychiatry. 79, 96-104 (2017).
- de Wit, S. J., et al. Multicenter voxel-based morphometry mega-analysis of structural brain acans in obsessive-compulsive disorder. Am J Psychiatry. 171 (3), 340-349 (2014).
- Ferreira, S., et al. Frontoparietal hyperconnectivity during cognitive regulation in obsessive-compulsive disorder followed by reward valuation inflexibility. J Psychiatr Res. 137, 657-666 (2020).
- Menzies, L., et al. Integrating evidence from neuroimaging and neuropsychological studies of obsessive-compulsive disorder: The orbitofronto-striatal model revisited. Neurosci Biobehav Rev. 32 (3), 525-549 (2008).
- Huyser, C., Veltman, D. J., Wolters, L. H., De Haan, E., Boer, F. Functional magnetic resonance imaging during planning before and after cognitive-behavioral therapy in pediatric obsessive-compulsive disorder. J Am Acad Child Adolesc Psychiatry. 49 (12), 1238-1248 (2010).
- Vriend, C., et al. Switch the itch: A naturalistic follow-up study on the neural correlates of cognitive flexibility in obsessive-compulsive disorder. Psychiatry Res Neuroimaging. 213 (1), 31-38 (2013).
- Fink, J., Pflugradt, E., Stierle, C., Exner, C. Changing disgust through imagery rescripting and cognitive reappraisal in contamination-based obsessive-compulsive disorder. J Anxiety Disord. 54, 36-48 (2018).
- Sheehan, D. V., et al. The Mini-International Neuropsychiatric Interview (M.I.N.I.): The development and validation of a structured diagnostic psychiatric interview for DSM-IV and ICD-10. J Clin Psychiatry. 59, (1998).
- Foa, E. B., et al. The obsessive-compulsive inventory: Development and validation of a short version. Psychol Assess. 14 (4), 485-496 (2002).
- Varela Cunha, ., G, , et al. The Obsessive-Compulsive Inventory-Revised (OCI-R): Translation and validation of the European Portuguese version. Acta Med Port. 36 (3), 174-182 (2023).
- Gross, J. J., John, O. P. Individual differences in two emotion regulation processes: implications for affect, relationships, and well-being. J Pers Soc Psychol. 85 (2), 348-362 (2003).
- Vaz, F. M., Martins, C., Martins, E. C. Diferenciação emocional e regulação emocional em adultos portugueses. PSICOLOGIA. 22 (2), 123-135 (2008).
- Goodman, W. K., et al. The Yale-Brown Obsessive Compulsive Scale. Arch Gen Psychiatry. 46 (11), 1006 (1989).
- Castro-Rodrigues, P., et al. Criterion validity of the Yale-Brown Obsessive-Compulsive Scale second edition for diagnosis of obsessive-compulsive disorder in adults. Front Psychiatry. 9. 431, (2018).
- Phan, K. L., et al. Neural substrates for voluntary suppression of negative affect: A functional magnetic resonance imaging study. Biol Psychiatry. 57 (3), 210-219 (2005).
- Lang, P., Bradley, M., Cuthbert, B. International Affective Picture System (IAPS): Digitized photographs, instruction manual and affective ratings. Technical Report A-6. , (2005).
- Peirce, J. W. PsychoPy-Psychophysics software in Python. J Neurosci Methods. 162 (1-2), 8-13 (2007).
- Esteban, O., et al. fMRIPrep: a robust preprocessing pipeline for functional MRI. Nat Methods. 16 (1), 111-116 (2019).
- Esteban, O., et al. Analysis of task-based functional MRI data preprocessed with fMRIPrep. Nat Protoc. 15 (7), 2186-2202 (2020).
- Jenkinson, M., Beckmann, C. F., Behrens, T. E. J., Woolrich, M. W., Smith, S. M. FSL. NeuroImage. 62 (2), 782-790 (2012).
- Cox, R. W. AFNI: software for analysis and visualization of functional magnetic resonance neuroimages. Comput Biomed Res. 29 (29), 162-173 (1996).
- Zilverstand, A., Parvaz, M. A., Goldstein, R. Z. Neuroimaging cognitive reappraisal in clinical populations to define neural targets for enhancing emotion regulation. A systematic review. Neuroimage. 151, 105-116 (2017).
- Thorsen, A. L., et al. Emotion regulation in obsessive-compulsive disorder, unaffected siblings, and unrelated healthy control participants. Biol Psychiatry Cogn Neurosci Neuroimaging. 4 (4), 352-360 (2019).
- Utevsky, A. V., Smith, D. V., Huettel, S. A. Precuneus is a functional core of the default-mode network. J Neurosci. 34 (3), 932 (2014).
- Aron, A. R., Robbins, T. W., Poldrack, R. A. Inhibition and the right inferior frontal cortex: one decade on. Trends Cogn Sci. 18 (4), 177-185 (2014).
- Pessoa, L., Kastner, S., Ungerleider, L. G. Neuroimaging studies of attention: from modulation of sensory processing to top-down control. J Neurosci. 23 (10), 3990-3998 (2003).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados