Method Article
Explorando os correlatos neurais da reavaliação cognitiva no transtorno obsessivo-compulsivo usando ressonância magnética funcional baseada em tarefas
Neste Artigo
Resumo
Apresentamos um protocolo para explorar os correlatos neurais de uma tarefa de regulação emocional cognitiva, ou seja, reavaliação cognitiva, usando ressonância magnética funcional. Este protocolo foi utilizado em pacientes com transtorno obsessivo-compulsivo e controles saudáveis, mas também pode ser utilizado em outras amostras clínicas.
Resumo
Pacientes com transtorno obsessivo-compulsivo (TOC) apresentam atividade cerebral aumentada nas regiões límbica e orbitofrontal quando confrontados com emoções negativas, o que pode estar associado a prejuízos nas habilidades de regulação emocional. A capacidade de regular as emoções é um mecanismo de enfrentamento necessário ao enfrentar situações emocionalmente angustiantes, e estratégias deliberadas de regulação emocional, como a reavaliação cognitiva, têm sido extensivamente estudadas na população em geral. Apesar disso, pouco se sabe sobre potenciais déficits deliberados de regulação emocional em pacientes com TOC e os correlatos neurais associados. Aqui, descrevemos um protocolo para investigar os correlatos neurais da regulação emocional deliberada (reavaliação cognitiva) usando ressonância magnética funcional (fMRI) em pacientes com TOC em comparação com uma amostra de controle correspondente. Este protocolo segue os padrões ouro atuais para estudos de neuroimagem e inclui ativação de tarefas e análise de conectividade (bem como dados comportamentais) para permitir uma investigação mais completa. Portanto, esperamos que contribua para expandir o conhecimento dos correlatos neurais da (des)regulação emocional no TOC, e também possa ser aplicado para explorar déficits de regulação emocional em outros transtornos psiquiátricos.
Introdução
A ressonância magnética funcional (fMRI) é uma ferramenta poderosa para a compreensão dos transtornos psiquiátricos, pois permite que os pesquisadores observem a função cerebral com resolução espacial relativamente alta, oferecendo insights sobre os mecanismos neurais subjacentes a essas condições1. Ao detectar mudanças no fluxo sanguíneo, a fMRI pode identificar regiões do cérebro que são mais ativas durante tarefas específicas ou em resposta a estímulos específicos, destacando anormalidades na função cerebral associadas a distúrbios como depressão, ansiedade, esquizofrenia e transtorno bipolar. Além disso, a fMRI pode revelar padrões de conectividade funcional, mostrando como diferentes partes do cérebro se comunicam entre si, o que é crucial para a compreensão das redes complexas interrompidas nos transtornos psiquiátricos2. Essa técnica não invasiva não apenas ajuda a identificar os correlatos neurais dos sintomas psiquiátricos, mas também ajuda a explorar os processos psicológicos que podem estar subjacentes aos perfis de sintomas e à eficácia dos tratamentos3.
A regulação emocional é um desses processos, que envolve iniciar novas respostas emocionais ou alterar as contínuas por meio de vários processos regulatórios. Existem vários tipos de estratégias de regulação emocional, incluindo implantação de atenção (distração), reavaliação cognitiva (reinterpretação do significado e conexão pessoal com um estímulo) e supressão da experiência ou expressão emocional 4,5. Em relação à reavaliação, estudos anteriores de fMRI descobriram que ela está relacionada à ativação no córtex cingulado anterior dorsal (ACC), córtex frontal dorsomedial e lateral, bem como nas regiões temporal e parietal 6,7. Essas regiões cerebrais frontais e cinguladas fazem parte da rede de controle cognitivo frontoparietal, que desempenha um papel na regulação do esforço. No contexto da reavaliação, essa rede ajuda a reformular cognitivamente o significado afetivo negativo de um estímulo em termos mais neutros8. Essa rede, por sua vez, controla regiões ventrais e límbicas de baixo para cima, como a amígdala, envolvidas na avaliação automática de estímulos emocionais9. Estudos anteriores usando análise de modelagem causal dinâmica examinaram a relação entre essas regiões dorsal e ventral durante tarefas de regulação emocional usando fMRI. Eles descobriram que, enquanto o giro frontal inferior (IFG) está intimamente conectado com o córtex pré-frontal dorsolateral (PFC), o PFC ventromedial representa a principal via pela qual as regiões pré-frontais influenciam diretamente a amígdala10,11.
O transtorno obsessivo-compulsivo (TOC) é um transtorno psiquiátrico que afeta de 1 a 3% da população, caracterizado por pensamentos, impulsos ou imagens angustiantes e recorrentes (obsessões), seguidos de comportamentos mentais ou físicos repetitivos (compulsões)12. Quando expostos a estímulos relevantes para o transtorno, os pacientes com TOC experimentam emoções negativas, como medo, ansiedade, nojo ou culpa13,14, juntamente com aumento da atividade nas regiões frontal ventral e límbica do cérebro, como o córtex orbitofrontal (OFC), o ACC rostral e a amígdala15. Além disso, estudos anteriores mostraram que pacientes com TOC têm dificuldades em relação à regulação emocional, principalmente quando empregam estratégias de reavaliação cognitiva16. Assim, hipotetiza-se que a reatividade emocional aumentada encontrada no TOC esteja ligada a esses prejuízos na regulação emocional 17,18,19. De fato, a terapia cognitivo-comportamental (um tratamento de primeira linha para o TOC20) inclui o treinamento de pacientes em estratégias de regulação emocional para ajudá-los a reavaliar cognitivamente situações negativas e desencadeadoras de sintomas como não ameaçadoras.
Neurobiologicamente, acredita-se que a interação disfuncional entre as redes ventral e dorsal esteja associada a alterações no processamento e regulação emocional em vários transtornos psiquiátricos21 , 22 , 23 . No TOC, estudos de neuroimagem funcional e estrutural revelaram prejuízos em áreas cerebrais ligadas a essas redes 24,25,26, com alguns déficits funcionais normalizando após a melhora dos sintomas27,28. Essa evidência apóia a ideia de que as dificuldades de regulação emocional encontradas no TOC podem estar relacionadas ao funcionamento prejudicado do controle das regiões dorsais do cérebro e/ou hiperativação no sistema ventral. Assim, restaurar o equilíbrio entre essas redes por meio do treinamento de reavaliação cognitiva pode potencialmente melhorar os sintomas dos pacientes29. Apesar dessas evidências, há uma escassez de literatura anterior explorando, por meio do uso de fMRI, os correlatos neurais da regulação emocional cognitiva no TOC. Assim, a definição de um protocolo padronizado que pudesse ser utilizado por todas as equipes de pesquisa interessadas neste tema permitiria o avanço do conhecimento nesta área de pesquisa de forma consistente e robusta.
Protocolo
O presente estudo foi conduzido de acordo com a Declaração de Helsinque e foi aprovado pelo Comitê de Ética institucional do Hospital de Braga e da Universidade do Minho (Braga, Portugal). Todos os procedimentos envolvidos neste trabalho seguem os padrões éticos dos Comitês institucionais e Nacionais de Experimentação Humana relevantes, bem como a Declaração de Helsinque de 1975, revisada em 2008.
1. Participantes
NOTA: Pacientes adultos (≥18 anos) com TOC foram recrutados no Departamento de Psiquiatria do Hospital de Braga (Braga, Portugal) durante consultas regulares.
- Recrute pacientes adultos (≥18 anos) com TOC durante consultas regulares em que são diagnosticados por um psiquiatra experiente com base em critérios padrão (ver Tabela de Materiais). Realize a Mini-Entrevista Neuropsiquiátrica Internacional30 para avaliar outras condições psicopatológicas potenciais.
- Em relação aos pacientes com TOC, defina os critérios de exclusão para incluir a presença atual de outros diagnósticos psiquiátricos (transtornos do Eixo I ou Eixo II) ou condições neurológicas ou médicas importantes atuais ou passadas.
NOTA: O uso de medicamentos psicofarmacológicos não foi critério de exclusão; A maioria dos pacientes (80,64%) estava em uso de medicação no momento do recrutamento, com os tratamentos permanecendo consistentes durante todo o estudo. - Recrutar controles saudáveis (CS) da mesma formação sociodemográfica, utilizando amostragem de conveniência por meio das listas de discussão e redes sociais da instituição, bem como os contatos comunitários dos pesquisadores.
- Exclua o HC se ele tiver alguma condição neurológica, psiquiátrica ou médica importante atual ou passada, ou se tiver tratamento atual ou passado com medicação psicofarmacológica.
- Considere as contraindicações para a realização de uma ressonância magnética (implantes metálicos ou claustrofobia) como um critério geral de exclusão para todos os participantes.
- Confirmar os critérios de inclusão/exclusão durante a consulta de psiquiatria para os pacientes ou por entrevista telefônica para o HC. Se os participantes preencherem os critérios de inclusão e concordarem em participar, agende uma data para participação no estudo.
- No dia do estudo, antes de iniciar os procedimentos do estudo, apresente e explique o formulário de consentimento informado por escrito aos participantes e obtenha seu consentimento informado por escrito antes de continuar.
2. Protocolo experimental
NOTA: Realize uma avaliação psicológica seguida de uma aquisição de ressonância magnética, com todo o protocolo experimental com duração não superior a 1,5 h no total (Figura 1).
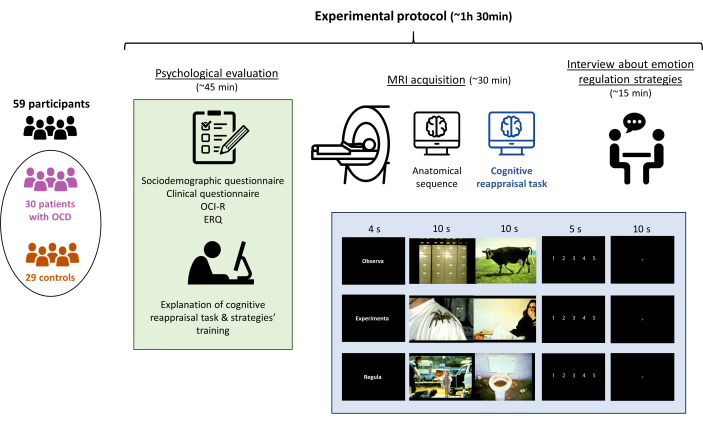
Figura 1: Protocolo experimental do estudo. Os participantes (30 pacientes com TOC e 29 controles pareados) foram submetidos a uma avaliação psicológica, seguida da explicação da tarefa de reavaliação cognitiva, da aquisição da ressonância magnética (incluindo a realização da tarefa) e, finalmente, uma entrevista para confirmar que a tarefa foi realizada adequadamente. Todo o protocolo durou aproximadamente 90 min. Clique aqui para ver uma versão maior desta figura.
- Avaliação psicométrica (~45 min)
- Preencher as seguintes escalas psicométricas, validadas na respetiva população, bem como questionários sociodemográficos e clínicos, pela seguinte ordem:
- Questionário sociodemográfico: Colete informações sobre sexo/gênero, ano de nascimento, anos de escolaridade, área residencial, estado civil, situação familiar, situação profissional e dominância da mão. Ver Arquivo Suplementar 1 para o questionário usado neste estudo, acompanhado de uma tradução para o inglês.
- Questionário clínico: Colete informações sobre o uso de substâncias (tabaco, álcool ou outras drogas), uso farmacológico habitual, diagnóstico atual de transtorno físico ou psiquiátrico e histórico de transtornos psiquiátricos. Ver Arquivo Suplementar 2 para o questionário usado neste estudo, acompanhado de uma tradução para o inglês.
- Responda ao inventário obsessivo-compulsivo (OCI-R). Ver Arquivo Suplementar 3 para o questionário usado neste estudo, acompanhado de uma tradução para o inglês.
NOTA: Este é um inventário de 18 itens aplicável a pacientes com TOC e HC e mede seis grupos de sintomas: lavar, verificar, ordenar, acumular, obcecar e neutralizar31,32. A pontuação para a subescala de lavagem é obtida pela soma dos escores dos itens 5, 11 e 17; para verificação dos itens 2, 8 e 14; para solicitar os itens 3, 9 e 15; para acumular itens 1, 7 e 13; para obsessão dos itens 6, 12 e 18; e para neutralizar os itens 4, 10 e 16. Uma pontuação total também pode ser obtida somando as pontuações de todas as subescalas. - Aplicar o questionário de regulação emocional (ERQ), que avalia o uso habitual de duas estratégias de regulação emocional: reavaliação e supressão33,34. Calcule os escores na subescala de reavaliação somando os escores dos itens 1, 3, 5, 7, 8 e 10, e na subescala de supressão somando os escores dos itens 2, 4, 6 e 9. Ver Arquivo Suplementar 4 para o questionário usado neste estudo, acompanhado de uma tradução para o inglês.
- Para medir a gravidade da obsessão e dos sintomas compulsivos, certifique-se de que os pacientes com TOC tenham preenchido a Escala Obsessivo-Compulsiva de Yale-Brown (Y-BOCS) durante a consulta de psiquiatria quando forem recrutados35,36. Caso contrário, colete essas informações durante a avaliação psicométrica. Ver Arquivo Suplementar 5 para o questionário usado neste estudo, acompanhado de uma tradução para o inglês.
- Depois de completar as escalas, explique a tarefa de reavaliação cognitiva a ser realizada no scanner e treine os participantes nas estratégias de regulação emocional a serem usadas (ver seção 2.3).
NOTA: É importante tentar sempre aplicar essas escalas antes da aquisição da ressonância magnética para garantir que a tarefa de reavaliação cognitiva não afete as respostas das escalas.
- Preencher as seguintes escalas psicométricas, validadas na respetiva população, bem como questionários sociodemográficos e clínicos, pela seguinte ordem:
- Aquisição de dados de imagem (~30 min)
- Adquira dados de imagem em um scanner 3T (consulte a Tabela de Materiais), equipado com uma bobina de cabeça de 32 canais. Antes de iniciar a aquisição da ressonância magnética, instrua os participantes a deitar em decúbito dorsal na cama de varredura e adicionar amortecimento adicional para a cabeça para garantir que os participantes estejam confortáveis durante a varredura, o que minimizará o movimento. Forneça aos participantes proteção para os ouvidos, uma caixa de resposta na mão direita (consulte a seção 2.3) e um botão de parada de emergência na mão esquerda, caso tenham uma necessidade urgente de parar o scanner.
- Peça a todos os participantes que realizem uma tarefa de reavaliação cognitiva dentro do scanner (veja abaixo). Durante esta tarefa, adquira uma sequência de imagem ecoplanar multibanda (EPI), (CMRREPI 2D) sensível a flutuações no contraste do Nível Dependente de Oxigenação do Sangue (BOLD), com os seguintes parâmetros (7,8 min): tempo de repetição (TR) = 1.000 ms, tempo de eco (TE) = 27 ms, ângulo de inversão (FA) = 62°, 2 mm3 tamanho de voxel isométrico, 64 cortes axiais sobre uma matriz de 200 x 200 mm2.
- Inclua na sessão de varredura um eco de gradiente anatômico Magnetização-Preparado aquisição rápida no plano sagital para fins de registro (MPRAGE, TR = 2.420 ms, TE = 4,12 ms, FA = 9°, campo de visão (FOV) = 176 x 256 x 256 mm3, 1 mm3 tamanho de voxel isométrico).
NOTA: Antes de iniciar a coleta de dados, certifique-se de que os participantes possam ver claramente a apresentação do estímulo na projeção da tela e que os botões de resposta estejam coletando as respostas adequadamente. Certifique-se de que os participantes estejam vendo os estímulos na orientação correta e não invertidos ou invertidos.
- Tarefa de reavaliação cognitiva de fMRI
- Antes de escanear, treine os participantes em estratégias de distanciamento e reinterpretação. Por exemplo, ao mostrar imagens com cenários perturbadores (consulte o Arquivo Suplementar 6 para os usados neste estudo), instrua-os a reavaliar suas emoções reformulando cognitivamente a cena de uma das seguintes maneiras: (i) a situação não é tão ruim quanto parece à primeira vista (ou seja, interpretando a situação sob uma luz mais positiva) (reinterpretação); (ii) a situação vai melhorar com o tempo (reinterpretação); (iii) a cena retratada não é real (por exemplo, se há pessoas em cena, pensando que são atores) (distanciamento); e (iv) as pessoas mostradas na cena são estranhas e, portanto, isso não afetará a si mesmo (distanciamento). Instrua especificamente os participantes a não usar estratégias não cognitivas (como desviar o olhar) durante a tarefa.
- Use a tarefa de reavaliação cognitiva37 enquanto adquire a sequência de fMRI. A tarefa consiste em uma série de blocos, incluindo estímulos de imagem neutros ou negativos, que os participantes são solicitados a:
- Observar (observar passivamente estímulos neutros).
- Manter (focar ativamente nas emoções provocadas pelos estímulos negativos, mantendo-as ao longo do tempo).
- Regular (para reavaliar as emoções induzidas pelos estímulos negativos usando as estratégias de reavaliação cognitiva previamente treinadas).
- Use os seguintes 24 estímulos (fotografias) do International Affective Picture System (IAPS38):
- Apresente oito imagens neutras (por exemplo, objetos domésticos) na condição de observação (códigos 1670, 5395, 5455, 5660, 5900, 6150, 7000, 7496, consulte o Arquivo Suplementar 7).
- Use 16 imagens altamente desagradáveis e excitantes (por exemplo, mutilações) nas condições Manter (códigos 2661, 3230, 3300, 6360, 6831, 9041, 9560, 9570, consulte o Arquivo Suplementar 8) e Regular (códigos 2141, 3030, 6838, 7380, 9300, 9530, 9561, 9582, consulte o Arquivo Suplementar 9).
- Estruture a tarefa para consistir em 12 blocos, quatro blocos para cada condição (Observar, Manter ou Regular). Pseudorandomize as instruções ao longo da tarefa para evitar induzir um estado de humor sustentado.
NOTA: Para este experimento, a ordem das condições foi Regular, Manter, Observar, Manter, Regular, Observar, Manter, Observar, Regular, Observar, Manter, Regular. - Comece cada bloco com a instrução (Observar, Manter ou Regular) apresentada por 4 s no meio da tela. Após o prompt, mostre aos participantes dois estímulos diferentes de valência equivalente por 10 s cada. Depois de apresentar o segundo estímulo de cada bloco, peça aos participantes que avaliem a intensidade da emoção negativa experimentada em uma escala numérica de 1 a 5 (onde 1 representa sentir-se "neutro" e 5 "extremamente negativo"). Para minimizar os efeitos de transição, mostre uma cruz de fixação no meio da tela por 10 s após cada bloco.
NOTA: Os estímulos foram selecionados com base em suas pontuações normativas para excitação emocional e valência. O equilíbrio do conteúdo emocional de imagens negativas entre as condições de Manutenção e Regulação deve ser cuidadosamente considerado para evitar efeitos de confusão devido a diferenças nessas propriedades. - Use o software referenciado39 (consulte a Tabela de Materiais) e um sistema de espelho angular compatível com ressonância magnética para exibir as instruções da tarefa e os estímulos visuais.
- Use um painel de resposta compatível com ressonância magnética (consulte Tabela de materiais) para registrar as classificações emocionais no scanner.
- Após a sessão de ressonância magnética, entreviste os participantes para garantir que eles seguiram as instruções e executaram adequadamente a tarefa. Pergunte a eles o tipo de estratégias de regulação emocional que foram usadas (reinterpretação, distanciamento ou outras) e se eles mudaram de estratégia durante a tarefa ou se houve uma estratégia específica que funcionou melhor para eles e foi mantida constante durante toda a tarefa. Ver Arquivo Suplementar 10 para o questionário usado neste estudo, acompanhado de uma tradução para o inglês.
- Use as informações da entrevista pós-ressonância magnética para categorizar a amostra em diferentes subgrupos, dependendo da estratégia de regulação emocional usada (distanciamento, reinterpretação ou ambas), e explore ainda mais as análises subsequentes separadamente para cada um desses subgrupos.
3. Análise dos dados
- Análise comportamental
- Use o software referenciado (consulte a Tabela de Materiais) para realizar as análises estatísticas.
- Considere-se que os valores de P < 0,05 estatisticamente significativos.
- Verificar a normalidade das variáveis contínuas usando o teste de normalidade de Shapiro-Wilk e, dependendo dos resultados, comparar os grupos dessas variáveis usando testes t de amostra independente ou testes U de Mann-Whitney.
- Use um teste qui-quadrado para comparar a distribuição de sexo/gênero entre os grupos.
- Use um teste qui-quadrado para comparar a distribuição da estratégia de regulação emocional entre os grupos.
- Use uma ANOVA de medidas repetidas 2 x 3 para analisar as diferenças potenciais nas classificações no scanner de cada condição (Observar, Manter e Regular) entre os dois grupos. Em seguida, use testes post-hoc para verificar se há diferenças entre cada duas condições, incluindo a correção de Holm para comparações múltiplas. Faça isso para a amostra completa, bem como para cada subgrupo de regulação emocional.
- Calcule o sucesso dos participantes em diminuir sua experiência emocional negativa no scanner subtraindo as classificações médias de Regular das classificações médias de Manter (Sucesso = Manter - Regular) e calcule a reatividade emocional dos participantes durante o processamento emocional subtraindo as classificações médias de Observação das classificações médias de Manter (Reatividade = Manter - Observar). Em seguida, compare os grupos nas variáveis computadas usando testes t de amostra independente ou testes de Mann-Whitney, dependendo da normalidade dos dados. Faça isso para a amostra completa, bem como para cada subgrupo de regulação emocional.
NOTA: Várias telas de impressão mostrando como realizar essas análises no JASP podem ser encontradas no Arquivo Suplementar 11.
- Pré-processamento de dados de neuroimagem
NOTA: Pré-processe as imagens usando o software referenciado40,41 (consulte a Tabela de Materiais). Este software executa um pipeline de pré-processamento robusto padronizado para dados funcionais e estruturais e adapta seu pipeline dependendo de quais dados e metadados estão disponíveis e são usados como entrada, sem a necessidade de definir quaisquer parâmetros ou etapas pelo usuário. Para obter mais detalhes sobre o pipeline, consulte o Arquivo Suplementar 11 e a seção de fluxos de trabalho na documentação.- Use um critério de exclusão de deslocamento médio (FD) > 0,5 mm para levar em conta os movimentos no scanner, observando os valores médios de FD incluídos no relatório de verificação de qualidade gerado pelo software de pré-processamento.
NOTA: Não houve participantes excedendo esse limite para este estudo; portanto, nenhum participante teve que ser excluído por causa disso. - Além disso, inspecione visualmente os relatórios de saída para avaliar a precisão do corregistro e identificar quaisquer outros problemas potenciais durante o pipeline de pré-processamento.
- Use a função fslmaths do software referenciado42 (consulte a Tabela de Materiais) para suavizar espacialmente a série temporal resultante com um kernel de largura total na metade do máximo (FWHM) de 8 mm (consulte o Arquivo Suplementar 11 para o comando específico usado neste estudo).
- Use um critério de exclusão de deslocamento médio (FD) > 0,5 mm para levar em conta os movimentos no scanner, observando os valores médios de FD incluídos no relatório de verificação de qualidade gerado pelo software de pré-processamento.
- Análise de ativação de tarefas de fMRI
NOTA: Execute a análise de ativação de tarefas usando o software referenciado (consulte a Tabela de Materiais).- Como etapa preliminar, ajuste as dimensões da matriz dos dados de séries temporais de fMRI resultantes do pré-processamento para permitir a compatibilidade entre o software que usa a função 3dresample do software referenciado43 (consulte a Tabela de Materiais), com o modelo "MNI152_T1_2mm_brain.nii.gz" como imagem mestre (consulte o Arquivo Suplementar 11 para o comando específico usado neste estudo).
- Para as análises de primeiro nível (sujeito único), defina os seguintes contrastes de interesse no SPM12: Manter > Observar, que permite detectar ativações associadas às emoções negativas vivenciadas, e Regular > Manter, a fim de identificar ativações relacionadas à implementação de estratégias de reavaliação cognitiva.
- Condições do modelo para os 20 s em que as imagens estavam na tela, excluindo os períodos de instrução, classificação e fixação cruzada. Envolva a resposta BOLD em cada voxel com a função de resposta hemodinâmica canônica e use um filtro passa-alta de 128 s.
- Use os sinais médios do líquido cefalorraquidiano e da substância branca como covariáveis, bem como variáveis para corrigir o movimento, calculadas durante o pré-processamento da fMRIprep. As variáveis de movimento incluíram os seis primeiros componentes aCompCor, além de DF e DVARS (derivada da raiz quadrada média VARiance sobre voxelS).
- Para as análises de segundo nível (grupo), use testes t de duas amostras para procurar diferenças entre os grupos nos contrastes de interesse. Faça isso para a amostra completa, bem como para cada subgrupo de regulação emocional. Analise os dados no nível de todo o cérebro, usando a correção do limite de cluster: voxel p < 0,001 não corrigido e cluster p < 0,05 erro familiar (FWE) corrigido.
NOTA: Várias telas de impressão do processo para realizar esta análise podem ser encontradas no Arquivo Suplementar 11.
- Análise da interação psicofisiológica
- Para explorar a conectividade entre as regiões cerebrais estimuladas pelas diferentes condições da tarefa, realize uma análise de interações psicofisiológicas (PPI) no software referenciado.
- Para realizar essa análise, selecione uma ou várias regiões de sementes com base em pelo menos duas abordagens diferentes: uma abordagem baseada em dados, selecionando regiões significativamente diferentes entre os grupos na análise de ativação de tarefas; ou uma abordagem orientada por teoria, selecionando sementes com base na literatura anterior. Para este estudo, escolha as sementes de IBP com base na literatura anterior sobre alterações do processamento emocional em pacientes com TOC.
- Por exemplo, use as seguintes regiões da meta-análise de Picó-Pérez et al.15 , identificadas como tendo hiperativação durante o processamento emocional em pacientes com TOC em comparação com HC: um cluster que se estende da ínsula anterior direita até a amígdala e putâmen, o giro angular esquerdo, um cluster compreendendo a amígdala esquerda e o putâmen ventral, o giro pré-central esquerdo, o córtex pré-frontal medial e o tálamo esquerdo (consulte a Tabela 1 para obter mais informações).
- Explore a influência dos contrastes de interesse (o fator 'psicológico') na força das correlações de curso de tempo entre as seis sementes selecionadas e todas as outras regiões do cérebro (o fator 'fisiológico').
- Estime mapas de conectividade funcional para cada contraste e cada semente por meio de análises de regressão linear de todo o cérebro. Use um filtro passa-alta definido em 128 s para remover desvios de baixa frequência de menos de aproximadamente 0,008 Hz. Gere imagens de contraste para cada assunto (análises de primeiro nível) estimando o coeficiente de regressão entre a série temporal inicial e o sinal de cada voxel do resto do cérebro.
- Para avaliar as diferenças de grupo (análises de segundo nível), inclua as imagens resultantes da etapa anterior em uma análise de teste t de duas amostras para cada um dos contrastes. Faça isso para a amostra completa, bem como para cada subgrupo de regulação emocional. Use o mesmo limite de significância da análise de ativação da tarefa de fMRI. Além disso, aplique uma correção de Bonferroni ao valor de p desses resultados para levar em consideração a correção de comparação múltipla pelo número de sementes exploradas (p < 0,05 / 6 = p < 0,0083).
NOTA: Várias telas de impressão do processo para realizar esta análise podem ser encontradas no Arquivo Suplementar 11.
Tabela 1: Sementes utilizadas na análise da interação psicofisiológica. Abreviaturas: Ke, extensão do cluster em voxels; MNI, Instituto Neurológico de Montreal. Clique aqui para baixar esta tabela.
Resultados
A Tabela 2 inclui um resumo das informações clínicas e sociodemográficas dos participantes. Participaram do estudo 67 indivíduos adultos (34 pacientes com TOC e 31 HC). No entanto, seis participantes (quatro pacientes e dois controles) foram excluídos devido a artefatos de ressonância magnética ou desempenho insuficiente em tarefas (quando entrevistados ao final, dois participantes relataram que nenhuma estratégia de regulação foi aplicada e que não estavam prestando atenção). A amostra final foi composta por 30 pacientes com TOC (17 mulheres; média de idade = 28,97, DP = 11,14 anos) e 29 HC (15 mulheres; média de idade = 29,35, DP = 12,14 anos). Ambos os grupos foram pareados em relação à idade, anos de escolaridade, distribuição de sexo/gênero e estratégia de regulação emocional usada durante a tarefa. A Tabela 2 também apresenta informações clínicas para o grupo de pacientes com TOC, incluindo gravidade dos sintomas, idade de início e status da medicação.
Em relação às classificações durante a tarefa para a amostra total, o teste de Huynh-Feldt foi usado, pois nossa ANOVA de medidas repetidas 2 x 3 violou a suposição de esfericidade. O principal efeito da condição foi estatisticamente significativo (F (1,783, 98,067) = 112,728, p < 0,001), e os testes post-hoc revelaram que a condição Manter diferiu significativamente da condição Observar (apontando para indução de emoção negativa bem-sucedida para ambos os grupos; t = −14,423, pholm < 0,001), e que a condição Regular diferiu de Manter (indicando também regulação emocional bem-sucedida para ambos os grupos; t = 3,597, pholm < 0,001) (Figura 2). No entanto, o efeito principal do grupo não foi estatisticamente significativo (F (1, 55) = 0,155, p = 0,695), e também não houve interação significativa entre os grupos e as condições (F (1,783, 98,067) = 1,877, p = 0,163). No entanto, a variável Sucesso diferiu significativamente entre os grupos (t(55) = 2,15, p = 0,036), com os controles apresentando melhor regulação do que os pacientes com TOC.
Ao explorar isso para o subgrupo Distanciamento, a suposição de esfericidade também foi violada, então o teste de Huynh-Feldt foi usado novamente como nossa ANOVA de medidas repetidas 2 x 3. O principal efeito da condição foi estatisticamente significativo (F (1,398, 27,961) = 35,704, p < 0,001), e os testes post-hoc revelaram que a condição Manter diferiu significativamente da condição Observar (indicando indução de emoção negativa bem-sucedida; t = −7,666, pholm < 0,001), mas com a condição Regular não diferindo mais significativamente de Manter (apontando para uma falha na regulação bem-sucedida das emoções; t = 0,755, pholm < 0,455) (Figura 2). O efeito principal do grupo também não foi significativo (F(1, 20) = 0,887, p = 0,358), e o mesmo em relação à interação entre grupo e condição (F (1,398, 27,961) = 0,103, p = 0,832). Assim, a variável Sucesso também não foi significativamente diferente entre os grupos (t(20) = -0,132, p = 0,896).
Em relação ao subgrupo Reinterpretação, foi realizada uma ANOVA de medidas repetidas 2 x 3 sem correção de esfericidade, uma vez que a suposição de esfericidade não foi violada. O efeito principal da condição também foi significativo (F (1,8, 23,404) = 28,355, p < 0,001), e os testes post-hoc revelaram que a condição Manter diferiu significativamente da condição Observar (apontando para indução de emoção negativa bem-sucedida; t = −7,48, pholm < 0,001) e que a condição Regular diferiu da condição Manter (indicando regulação emocional bem-sucedida; t = 2,983, pholm < 0,006) (Figura 2). No entanto, o efeito principal do grupo não foi estatisticamente significativo (F(1, 13) = 2,623, p = 0,129), e também não houve interação significativa entre os grupos e as condições (F (1,8, 23,404) = 2,312, p = 0,126). No entanto, a variável Sucesso diferiu significativamente entre os grupos (t(13) = 2,664, p = 0,019), com os controles apresentando melhor regulação do que os pacientes com TOC.
Por fim, em relação ao subgrupo Ambas as estratégias, também foi realizada uma ANOVA de medidas repetidas 2 x 3 sem correção de esfericidade, uma vez que a suposição de esfericidade não foi violada. O principal efeito da condição foi estatisticamente significativo (F (1,592, 22,294) = 27,772, p < 0,001), e os testes post-hoc revelaram que a condição Manter diferiu significativamente da condição Observar (indicando indução de emoção negativa bem-sucedida; t = −7,114, pholm < 0,001), mas com a condição Regular não diferindo mais significativamente de Manter (apontando para uma falha na regulação bem-sucedida das emoções; t = 1,634, pholm < 0,114) (Figura 2). O efeito principal do grupo não foi estatisticamente significativo (F(1, 14) = 0,245, p = 0,629), e também não houve interação significativa entre os grupos e as condições (F (1,592, 22,294) = 0,143, p = 0,867). Da mesma forma, a variável Sucesso não foi significativamente diferente entre os grupos (t(13) = 0,597, p = 0,56).
No geral, ao considerar a amostra completa, a indução de emoções negativas foi bem-sucedida e a regulação emocional foi eficaz em ambos os grupos, embora os controles parecessem apresentar melhor regulação emocional do que os pacientes com TOC ao considerar a variável sucesso. Em relação aos subgrupos específicos da estratégia de regulação emocional, a indução de emoções negativas foi bem-sucedida para todos eles, enquanto a regulação emocional pareceu falhar para os subgrupos Distanciamento e Ambas as estratégias, sendo bem-sucedida apenas para o subgrupo Reinterpretação. Além disso, apenas esse subgrupo apresentou diferenças significativas na variável sucesso, com os controles apresentando melhor regulação emocional em comparação aos pacientes com TOC (em consonância com a amostra completa). Isso fornece evidências dos benefícios de empregar estratégias de reinterpretação nessa tarefa, tanto para garantir a regulação emocional bem-sucedida em geral quanto para detectar diferenças significativas entre os grupos de controle e pacientes. No entanto, esses achados devem ser tomados com cautela, dada a diminuição do tamanho da amostra de cada subgrupo e a perda associada de poder estatístico ao realizar as análises de subgrupos.
Em relação às escalas psicométricas, não houve diferenças significativas entre os grupos no ERQ, mas os pacientes com TOC pontuaram significativamente mais alto do que o HC em todas as subescalas do OCI-R, com exceção do OCI-R Hoarding (Tabela 2).
Finalmente, com relação aos resultados da ativação da tarefa de fMRI, não houve diferenças significativas entre os grupos para a amostra completa no nível de todo o cérebro para Manter > Observar ou Regular > Manter no limite corrigido de comparação múltipla selecionado. No entanto, ao explorar os subgrupos dependendo da estratégia de regulação emocional utilizada, surgiram diferenças significativas entre os grupos para os subgrupos Reinterpretação e Ambas as estratégias. Especificamente, para o subgrupo Reinterpretação, os controles apresentaram maior ativação do que os pacientes com TOC no precuneus para o contraste Manter > Observar. Por outro lado, para o subgrupo Ambas as estratégias, os pacientes com TOC apresentaram ativação aumentada na ínsula posterior direita e nos giros pré-centrais bilaterais também para o contraste Manter > Observar (ver Tabela 3 e Figura 3). Não houve achados estatisticamente significativos para o subgrupo Distanciamento ou para o contraste Regular > Manter.
Além disso, em relação à análise do PPI, revelou que, para a amostra total, a conectividade entre a semente do giro angular esquerdo e o PFC ventrolateral esquerdo (vlPFC) foi significativamente maior nos controles em comparação com os pacientes com TOC para o contraste Manter > Observar, enquanto o padrão oposto foi encontrado para Regular > Manter (aumento da conectividade em pacientes com TOC). Ao explorar os diferentes subgrupos de estratégia, foi encontrada uma conectividade aumentada entre a semente da amígdala esquerda e o giro temporal inferior direito (ITG) e o giro occipital médio esquerdo (MOG) para o subgrupo Distanciamento e o contraste Manter > Observar. Além disso, a conectividade dessa mesma semente com o PFC dorsolateral direito (dlPFC), a cauda caudada direita e o PFC medial esquerdo também foi aumentada em pacientes para o subgrupo Ambas as estratégias e o contraste Regular > Manter. Finalmente, para o subgrupo Reinterpretação, a conectividade entre a semente do PFC medial e o giro pré-central direito foi significativamente maior nos controles em comparação com os pacientes com TOC para o contraste Regular > Manter (Tabela 3 e Figura 4).
Em resumo, a análise de ativação de tarefas de todo o cérebro não mostrou diferenças significativas entre os grupos para a amostra completa, mas as análises de subgrupos destacaram diferenças específicas ligadas à estratégia de regulação emocional empregada. Por exemplo, a estratégia de reinterpretação revelou diminuição da ativação do precuneus em pacientes com TOC, enquanto o subgrupo Ambas as estratégias mostrou aumento da ativação em regiões como a ínsula posterior e os giros pré-centrais em pacientes com TOC para o contraste Manter > Observar. Essas descobertas apontam para potenciais alterações neurais específicas da estratégia no TOC, que curiosamente são evidentes não ao regular as emoções (Regular > Manter o contraste), mas ao experimentá-las (Manter > Observar contraste). Isso aponta para um efeito geral no processamento emocional de ter diferentes abordagens para a regulação emocional. As análises de conectividade funcional (PPI) ofereceram mais informações, revelando padrões de conectividade alterados em pacientes com TOC. Notavelmente, a rede giro angular esquerdo-vlPFC mostrou conectividade reduzida em pacientes com TOC para o contraste Manter > Observar, enquanto o contraste Regular > Manter exibiu o padrão oposto. As análises de subgrupos identificaram interrupções adicionais na conectividade ligada à amígdala e às sementes PFC mediais, com controles demonstrando conectividade mais forte nas principais redes regulatórias, particularmente ao se envolver na estratégia de reinterpretação.
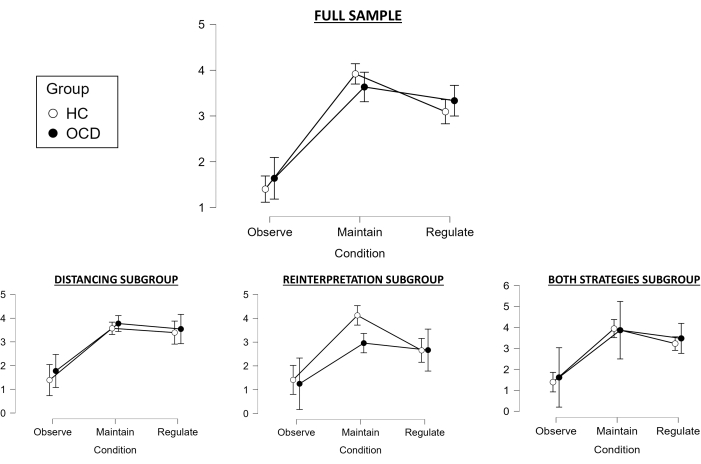
Figura 2: Resultados comportamentais. Média (intervalo de confiança de 95%) nas classificações emocionais no scanner para cada grupo e cada condição (1 sendo 'neutro' e 5 sendo 'extremamente negativo'), para a amostra completa (topo), bem como para os diferentes subgrupos, dependendo da estratégia de regulação emocional usada (abaixo). Abreviaturas: HC = controle saudável; TOC = transtorno obsessivo-compulsivo. Clique aqui para ver uma versão maior desta figura.
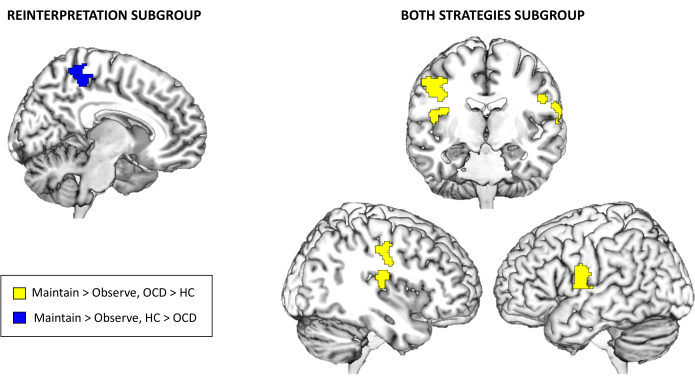
Figura 3: resultados da ativação da tarefa de fMRI. Diferenças entre os grupos na ativação de todo o cérebro para os subgrupos Reinterpretação e Ambas as estratégias para o contraste Manter > Observar. Os resultados são significativos no nível de todo o cérebro p < 0,05 FWE-cluster corrigido Clique aqui para ver uma versão maior desta figura.
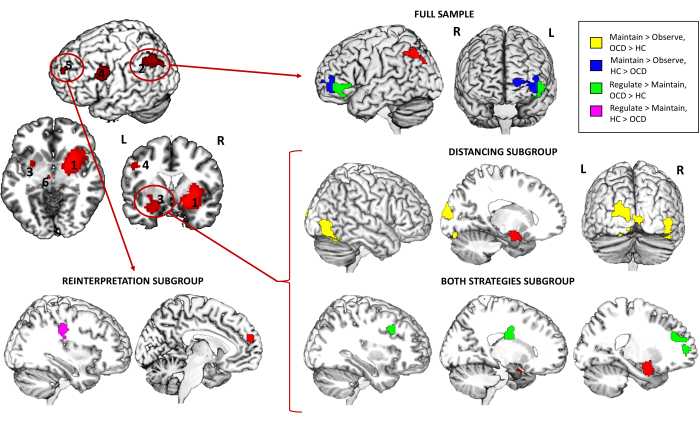
Figura 4: resultados da interação psicofisiológica da tarefa de fMRI. Diferenças entre grupos na conectividade de todo o cérebro para a amostra completa e os diferentes subgrupos de estratégia para o giro angular esquerdo (2), a amígdala esquerda (3) e as sementes PFC medial (5). As sementes são representadas em vermelho, enquanto as regiões com conectividade diferencial são representadas em amarelo (TOC > HC) ou azul (HC > TOC) para o contraste Manter > Observar, e em verde (TOC > HC) ou roxo (HC > TOC) para o contraste Regular > Manter. Os resultados são significativos no nível de todo o cérebro p < .05 FWE-cluster corrigido. Consulte a Tabela 3 para obter os achados que sobreviveram a uma correção adicional de Bonferroni pelo número de sementes exploradas. Abreviaturas: HC = controle saudável; TOC = transtorno obsessivo-compulsivo. Clique aqui para ver uma versão maior desta figura.
Tabela 2: Características sociodemográficas e clínicas dos participantes. Total N = 58 para as subescalas OCI-R, N = 57 para as classificações emocionais no scanner e N = 54 para a estratégia usada durante a tarefa. Abreviaturas: AP = antipsicóticos; Dist = distanciamento; ERQ = Questionário de Regulação Emocional; HC = controles saudáveis; TOC = transtorno obsessivo-compulsivo; OCI-R = Inventário Obsessivo-Compulsivo-Revisado; Reint = reinterpretação; DP = desvio padrão; ISRS = inibidores seletivos da recaptação da serotonina; Y-BOCS = Escala Obsessivo-Compulsiva de Yale-Brown. Clique aqui para baixar esta tabela.
Tabela 3: Resultados da tarefa de fMRI. Diferenças entre os grupos na ativação de tarefas e análise de interação psicofisiológica para a amostra completa, bem como para os diferentes subgrupos de estratégia. Os resultados são significativos no nível de todo o cérebro p < .05 FWE-cluster corrigido. * Achados de IBP que permanecem significativos após uma correção adicional de Bonferroni pelo número de sementes exploradas (p < 0,05 / 6 = p < 0,0083). Abreviaturas: dlPFC, córtex pré-frontal dorsolateral; HC, controles saudáveis; ITG, giro temporal inferior; Ke, extensão do cluster em voxels; MNI, Instituto Neurológico de Montreal; MOG, giro occipital médio; TOC, transtorno obsessivo-compulsivo; PFC, córtex pré-frontal; PPI, análise de interação psicofisiológica; vlPFC, córtex pré-frontal ventrolateral. Clique aqui para baixar esta tabela.
Ficha Suplementar 1: Questionário sociodemográfico utilizado (em português), acompanhado de tradução para inglês. Clique aqui para baixar este arquivo.
Ficha Suplementar 2: Questionário clínico utilizado (em português), acompanhado de tradução para inglês. Clique aqui para baixar este arquivo.
Arquivo Suplementar 3: Versão em português do OCI-R usada, acompanhada de uma tradução para o inglês. Clique aqui para baixar este arquivo.
Arquivo Suplementar 4: Versão em português do ERQ utilizado, acompanhada de uma tradução para o inglês. Clique aqui para baixar este arquivo.
Arquivo Suplementar 5: Versão em português do Y-BOCS usado, acompanhado de uma tradução para o inglês. Clique aqui para baixar este arquivo.
Arquivo Suplementar 6: Apresentação usada para explicar a tarefa de reavaliação cognitiva e treinar os participantes em estratégias de distanciamento e reinterpretação antes da digitalização, acompanhada de uma tradução para o inglês. Clique aqui para baixar este arquivo.
Arquivo Suplementar 7: Imagens neutras do IAPS usadas para a condição de observação da tarefa de reavaliação cognitiva. Clique aqui para baixar este arquivo.
Arquivo Suplementar 8: Imagens negativas do IAPS usadas para a condição de manutenção da tarefa de reavaliação cognitiva. Clique aqui para baixar este arquivo.
Arquivo Suplementar 9: Imagens negativas do IAPS usadas para a condição Regular da tarefa de reavaliação cognitiva. Clique aqui para baixar este arquivo.
Ficha Suplementar 10: Questionário utilizado após a sessão de RM para verificar se os participantes realizaram adequadamente a tarefa e anotar quais estratégias utilizaram, acompanhado de uma tradução para o inglês. Clique aqui para baixar este arquivo.
Arquivo Suplementar 11: Etapas detalhadas do software para as diferentes análises de dados incluídas neste estudo. Clique aqui para baixar este arquivo.
Discussão
Este protocolo permite que os pesquisadores explorem os correlatos neurais da regulação emocional em pacientes com TOC em comparação com os controles, usando uma tarefa de reavaliação cognitiva de fMRI. Este projeto mostra potencial para melhorar nossa compreensão dos mecanismos do cérebro para regular as emoções por meio de estratégias deliberadas e pode ser usado em pacientes com TOC, bem como em outras populações psiquiátricas. Além disso, projetamos cuidadosamente o protocolo usando os mais recentes padrões ouro de neuroimagem (uma sequência multibanda, pré-processamento fMRIPrep e um método apropriado de correção de comparação múltipla, por exemplo). Cuidados especiais foram tomados para garantir que ambos os grupos de participantes fossem pareados em variáveis sociodemográficas e que os participantes com dados de baixa qualidade fossem excluídos da análise.
Apesar de todas essas precauções, tivemos achados negativos (ou seja, sem diferenças entre os grupos) em algumas das análises. No nível comportamental, o efeito de grupo não foi significativo na análise das classificações no scanner usando uma ANOVA de medidas repetidas 2 x 3 para a amostra total. Esse achado se alinha com meta-análises anteriores e revisões sistemáticas em populações psiquiátricas23,44, sugerindo influências potenciais de efeitos de desejabilidade social, avaliações comportamentais intra-scanner ou autoconsciência prejudicada da experiência emocional. No entanto, surgiram diferenças significativas entre os grupos na variável Sucesso, indicando que os indivíduos com TOC exibiram pior regulação emocional. Assim, apesar de uma semelhança geral no padrão de classificações entre as condições para ambos os grupos, as alterações ainda são observáveis quando se concentra apenas nas condições Manter e Regular.
Além disso, ao repetir essa análise para os diferentes subgrupos de regulação emocional, o subgrupo Reinterpretação foi o único que apresentou o mesmo padrão de achados da amostra completa, enquanto os subgrupos Distanciamento e Ambas as estratégias não mostraram regulação emocional bem-sucedida com base nas classificações no scanner, nem diferenças estatisticamente significativas entre os grupos para a variável sucesso. Isso aponta para um impacto benéfico do uso de estratégias de reinterpretação durante esta tarefa, tanto para garantir a regulação emocional bem-sucedida em geral quanto para detectar diferenças significativas entre os grupos de controle e pacientes. De qualquer forma, os achados gerais sugerem evidências limitadas de déficits de reavaliação cognitiva em pacientes com TOC, que podem ser mais pronunciados ao confrontar estímulos específicos de sintomas (como imagens com conteúdo de sintomas específicos45), contrastando com habilidades de reavaliação relativamente preservadas quando expostos a estímulos de conteúdo negativo geral.
A modesta diferença no sucesso na regulação das emoções não correspondeu a diferenças significativas na ativação cerebral ao analisar a amostra completa. No entanto, ao focar especificamente no subgrupo Reinterpretação, os pacientes com TOC apresentaram diminuição da ativação no precuneus ao experimentar emoções em comparação com os controles. O precuneus, como parte da rede de modo padrão (DMN), é uma região criticamente envolvida no processamento autorreferencial46, e isso pode refletir uma melhor capacidade dos controles que utilizam estratégias de reinterpretação para se adaptarem às demandas da tarefa, engajando-se adequadamente no processamento emocional durante a condição de Manutenção (enquanto os pacientes com TOC não o fazem). Em relação à análise do PPI, revelou diferenças de conectividade para a amostra total entre as regiões da rede frontoparietal esquerda, particularmente entre o giro angular esquerdo e as regiões vlPFC esquerdas críticas para atenção seletiva, controle cognitivo e memória de trabalho47,48. Embora a ausência de diferenças de ativação de fMRI relacionadas à tarefa para a amostra completa, juntamente com alterações significativas de conectividade na rede frontoparietal, possa inicialmente parecer contraditória, argumentamos que isso ressalta a relevância de empregar diferentes análises de neuroimagem. Tais abordagens produzem insights distintos, sugerindo que certas modalidades de neuroimagem e métodos analíticos podem ser necessários para detectar alterações específicas. Além disso, outras diferenças foram encontradas pelas análises do subgrupo de regulação emocional, identificando interrupções adicionais na conectividade ligada à amígdala e às sementes PFC mediais, com controles demonstrando conectividade mais forte nas principais redes regulatórias, particularmente ao se envolver na estratégia de reinterpretação.
Em conjunto, esses achados sugerem que os déficits de regulação emocional no TOC não são globais, mas dependem do contexto e da estratégia. Enquanto algumas redes neurais que suportam a regulação emocional permanecem funcionais, outras exibem alterações distintas, particularmente em resposta a estratégias específicas. Esses resultados destacam a importância de considerar as diferenças individuais nas estratégias de regulação emocional e os mecanismos neurais subjacentes a esses processos ao avaliar o TOC. Estudos futuros devem explorar o impacto de estímulos específicos de sintomas e examinar possíveis intervenções terapêuticas direcionadas a essas redes interrompidas.
Uma consideração adicional diz respeito às limitações de design da tarefa, pois inerentemente representa um desafio para avaliar o envolvimento e o desempenho dos participantes em experimentar e regular a emoção. Para tentar mitigar essa limitação, realizamos uma entrevista pós-ressonância magnética perguntando aos participantes quais estratégias de regulação emocional eles usaram durante a tarefa e excluímos os participantes que não executaram adequadamente a tarefa. Nessa linha, estudos futuros usando projetos semelhantes podem aumentar a robustez incorporando medidas psicofisiológicas objetivas, como a variabilidade da frequência cardíaca, que podem oferecer avaliações mais confiáveis do desempenho da regulação emocional. Além disso, tentamos desvendar os efeitos comportamentais e neurais diferenciais do uso de estratégias de reinterpretação ou distanciamento (ou ambas), mas estudos futuros com melhor poder para essas análises lançarão luz sobre a robustez e replicabilidade de nossas descobertas preliminares.
Divulgações
Nos últimos 3 anos, o PM recebeu subsídios, honorários relacionados com CME ou honorários de consultoria da Angelini, AstraZeneca, Fundação Bial, Biogen, DGS-Portugal, FCT, FLAD, Janssen-Cilag, Fundação Gulbenkian, Lundbeck, Springer Healthcare, Tecnimede e 2CA-Braga.
Agradecimentos
Este trabalho foi financiado por fundos nacionais portugueses através da Fundação para a Ciência e a Tecnologia (FCT) - projeto UIDB/50026/2020 (DOI 10.54499/UIDB/50026/2020), UIDP/50026/2020 (DOI 10.54499/UIDP/50026/2020) e LA/P/0050/2020 (DOI 10.54499/LA/P/0050/2020), e pelo projeto NORTE-01-0145-FEDER-000039, apoiado pelo Programa Operacional Regional Norte Portugal (NORTE 2020) no âmbito do Acordo de Parceria PORTUGAL 2020 através do Fundo Europeu de Desenvolvimento Regional (FEDER). O MPP foi apoiado por uma subvenção RYC2021-031228-I financiada pelo MCIN/AEI/10.13039/501100011033 e pelo "European Union NextGenerationEU/PRTR".
Materiais
| Name | Company | Catalog Number | Comments |
| AFNI | National Institute of Mental Health | RRID:SCR_005927 | https://afni.nimh.nih.gov/ |
| Diagnostic and Statistical Manual of Mental Disorders | American Psychiatric Association | 5th edition | |
| fMRIPrep | NiPreps Community | RRID:SCR_016216 | Based on Nipype (RRID:SCR_002502). Pipeline details: https://fmriprep.org/en/stable/workflows.html |
| FSL | FMRIB Software Library, Analysis Group, FMRIB, Oxford | ||
| JASP | JASP Team, University of Amsterdam, the Netherlands | ||
| Magnetic resonance imaging (MRI) scanner | Siemens | Verio 3T | |
| MRI-compatible response pad | Lumina–Cedrus Corporation | ||
| PsychoPy3 | University of Nottingham | ||
| SPM12 | Wellcome Trust Center for Neuroimaging | https://www.fil.ion.ucl. ac.uk/spm/ |
Referências
- Buckholtz, J. W., Meyer-Lindenberg, A. Psychopathology and the human connectome: toward a transdiagnostic model of risk for mental illness. Neuron. 74 (6), 990-1004 (2012).
- Menon, V. Large-scale brain networks and psychopathology: a unifying triple network model. Trends Cogn Sci. 15 (10), 483-506 (2011).
- Picó-Pérez, M., et al. Neural predictors of cognitive-behavior outcome in anxiety-related disorders: a meta-analysis of task-based fMRI studies. Psychol Med. 53 (8), 3387-3395 (2023).
- Gross, J. J. Antecedent- and response-focused emotion regulation: Divergent consequences for experience, expression, and physiology. J Pers Soc Psychol. 74 (1), 224-237 (1998).
- Ochsner, K., Silvers, J., Buhle, J. Functional imaging studies of emotion regulation: A synthetic review and evolving model of the cognitive control of emotion. Ann N Y Acad Sci. 1252, 1-35 (2012).
- Buhle, J. T., et al. Cognitive reappraisal of emotion: A meta-analysis of human neuroimaging studies. Cereb Cortex. 24 (11), 2981-2990 (2013).
- Frank, D. W., et al. Emotion regulation: Quantitative meta-analysis of functional activation and deactivation. Neurosci Biobehav Rev. 45, 202-211 (2014).
- Dosenbach, N. U. F., et al. Distinct brain networks for adaptive and stable task control in humans. Proc Natl Acad Sci USA. 104 (26), 11073-11078 (2007).
- Ochsner, K. N., Gross, J. J. The neural bases of emotion and emotion regulation: A valuation perspective. Gross, J. J. (ed) Handbook. , 23-42 (2014).
- Morawetz, C., Bode, S., Baudewig, J., Kirilina, E., Heekeren, H. R. Changes in effective connectivity between dorsal and ventral prefrontal regions moderate emotion regulation. Cereb Cortex. 26 (5), 1923-1937 (2016).
- Steward, T., et al. Dynamic neural interactions supporting the cognitive reappraisal of emotion. Cereb Cortex. 31 (2), 961-973 (2021).
- American Psychiatric Association. . Diagnostic and statistical manual of mental disorders. , (2013).
- Schienle, A., Schäfer, A., Stark, R., Walter, B., Vaitl, D. Neural responses of OCD patients towards disorder-relevant, generally disgust-inducing and fear-inducing pictures. Int J Psychophysiol. 57 (1), 69-77 (2005).
- vanden Heuvel, O. A., et al. Amygdala activity in obsessive-compulsive disorder with contamination fear: a study with oxygen-15 water positron emission tomography. Psychiatry Res Neuroimaging. 132 (3), 225-237 (2004).
- Picó-Pérez, M., et al. Modality-specific overlaps in brain structure and function in obsessive-compulsive disorder: Multimodal meta-analysis of case-control MRI studies. Neurosci Biobehav Rev. 112, 83-94 (2020).
- Goldberg, X., et al. Inter-individual variability in emotion regulation: Pathways to obsessive-compulsive symptoms. J Obsessive Compuls Relat Disord. 11, 105-112 (2016).
- Mataix-Cols, D., vanden Heuvel, O. A. Common and distinct neural correlates of obsessive-compulsive and related disorders. Psychiatr Clin North Am. 2 (2), 391-410 (2006).
- Milad, M. R., Rauch, S. L. Obsessive-compulsive disorder: beyond segregated cortico-striatal pathways. Trends Cogn Sci. 16 (1), 43-51 (2012).
- Paul, S., Simon, D., Endrass, T., Kathmann, N. Altered emotion regulation in obsessive-compulsive disorder as evidenced by the late positive potential. Psychol Med. 46 (1), 137-147 (2016).
- Franklin, M. E., Foa, E. B. Treatment of obsessive compulsive disorder. Annual review of clinical psychology. , 229-243 (2011).
- Hu, T., et al. Relation between emotion regulation and mental health: a meta-analysis review. Psychol Rep. 114 (2), 341-362 (2014).
- Phillips, M. L., Drevets, W. C., Rauch, S. L., Lane, R. Neurobiology of emotion perception II: implications for major psychiatric disorders. Biol Psychiatry. 54 (5), 515-528 (2003).
- Picó-Pérez, M., Radua, J., Steward, T., Menchón, J. M., Soriano-Mas, C. Emotion regulation in mood and anxiety disorders: A meta-analysis of fMRI cognitive reappraisal studies. Prog Neuro-Psychopharmacology Biol Psychiatry. 79, 96-104 (2017).
- de Wit, S. J., et al. Multicenter voxel-based morphometry mega-analysis of structural brain acans in obsessive-compulsive disorder. Am J Psychiatry. 171 (3), 340-349 (2014).
- Ferreira, S., et al. Frontoparietal hyperconnectivity during cognitive regulation in obsessive-compulsive disorder followed by reward valuation inflexibility. J Psychiatr Res. 137, 657-666 (2020).
- Menzies, L., et al. Integrating evidence from neuroimaging and neuropsychological studies of obsessive-compulsive disorder: The orbitofronto-striatal model revisited. Neurosci Biobehav Rev. 32 (3), 525-549 (2008).
- Huyser, C., Veltman, D. J., Wolters, L. H., De Haan, E., Boer, F. Functional magnetic resonance imaging during planning before and after cognitive-behavioral therapy in pediatric obsessive-compulsive disorder. J Am Acad Child Adolesc Psychiatry. 49 (12), 1238-1248 (2010).
- Vriend, C., et al. Switch the itch: A naturalistic follow-up study on the neural correlates of cognitive flexibility in obsessive-compulsive disorder. Psychiatry Res Neuroimaging. 213 (1), 31-38 (2013).
- Fink, J., Pflugradt, E., Stierle, C., Exner, C. Changing disgust through imagery rescripting and cognitive reappraisal in contamination-based obsessive-compulsive disorder. J Anxiety Disord. 54, 36-48 (2018).
- Sheehan, D. V., et al. The Mini-International Neuropsychiatric Interview (M.I.N.I.): The development and validation of a structured diagnostic psychiatric interview for DSM-IV and ICD-10. J Clin Psychiatry. 59, (1998).
- Foa, E. B., et al. The obsessive-compulsive inventory: Development and validation of a short version. Psychol Assess. 14 (4), 485-496 (2002).
- Varela Cunha, ., G, , et al. The Obsessive-Compulsive Inventory-Revised (OCI-R): Translation and validation of the European Portuguese version. Acta Med Port. 36 (3), 174-182 (2023).
- Gross, J. J., John, O. P. Individual differences in two emotion regulation processes: implications for affect, relationships, and well-being. J Pers Soc Psychol. 85 (2), 348-362 (2003).
- Vaz, F. M., Martins, C., Martins, E. C. Diferenciação emocional e regulação emocional em adultos portugueses. PSICOLOGIA. 22 (2), 123-135 (2008).
- Goodman, W. K., et al. The Yale-Brown Obsessive Compulsive Scale. Arch Gen Psychiatry. 46 (11), 1006 (1989).
- Castro-Rodrigues, P., et al. Criterion validity of the Yale-Brown Obsessive-Compulsive Scale second edition for diagnosis of obsessive-compulsive disorder in adults. Front Psychiatry. 9. 431, (2018).
- Phan, K. L., et al. Neural substrates for voluntary suppression of negative affect: A functional magnetic resonance imaging study. Biol Psychiatry. 57 (3), 210-219 (2005).
- Lang, P., Bradley, M., Cuthbert, B. International Affective Picture System (IAPS): Digitized photographs, instruction manual and affective ratings. Technical Report A-6. , (2005).
- Peirce, J. W. PsychoPy-Psychophysics software in Python. J Neurosci Methods. 162 (1-2), 8-13 (2007).
- Esteban, O., et al. fMRIPrep: a robust preprocessing pipeline for functional MRI. Nat Methods. 16 (1), 111-116 (2019).
- Esteban, O., et al. Analysis of task-based functional MRI data preprocessed with fMRIPrep. Nat Protoc. 15 (7), 2186-2202 (2020).
- Jenkinson, M., Beckmann, C. F., Behrens, T. E. J., Woolrich, M. W., Smith, S. M. FSL. NeuroImage. 62 (2), 782-790 (2012).
- Cox, R. W. AFNI: software for analysis and visualization of functional magnetic resonance neuroimages. Comput Biomed Res. 29 (29), 162-173 (1996).
- Zilverstand, A., Parvaz, M. A., Goldstein, R. Z. Neuroimaging cognitive reappraisal in clinical populations to define neural targets for enhancing emotion regulation. A systematic review. Neuroimage. 151, 105-116 (2017).
- Thorsen, A. L., et al. Emotion regulation in obsessive-compulsive disorder, unaffected siblings, and unrelated healthy control participants. Biol Psychiatry Cogn Neurosci Neuroimaging. 4 (4), 352-360 (2019).
- Utevsky, A. V., Smith, D. V., Huettel, S. A. Precuneus is a functional core of the default-mode network. J Neurosci. 34 (3), 932 (2014).
- Aron, A. R., Robbins, T. W., Poldrack, R. A. Inhibition and the right inferior frontal cortex: one decade on. Trends Cogn Sci. 18 (4), 177-185 (2014).
- Pessoa, L., Kastner, S., Ungerleider, L. G. Neuroimaging studies of attention: from modulation of sensory processing to top-down control. J Neurosci. 23 (10), 3990-3998 (2003).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados