需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
用于评估小鼠模型中伤口闭合动力学的数字平面测量法
摘要
伤口是一项全球性的健康挑战。本研究开发了一个利用数字平面测量的标准化照相亭,以最大限度地减少伤口测量的可变性。监测小鼠伤口超过 14 天显示伤口面积和周长最初增加,然后逐渐闭合。这种方法可能有助于评估临床前模型中的伤口闭合动力学。
摘要
由于慢性伤口的患病率高,是一个严重的全球健康问题。有效的治疗策略可以显着加速愈合,从而降低并发症的风险并减轻医疗保健系统的经济负担。尽管许多实验研究调查了伤口愈合,但大多数都依赖于定性观察或定量直接测量。本研究的目的是使用数字平面测量法标准化间接伤口测量方法,并结合数字缩放和分割。这种方法解决了缺乏准确伤口评估的详细、循序渐进的方法的问题。设计并建造了一个照相记录室,并使用计算机辅助数字平面测量工具来最大限度地减少伤口区域、周长以及从伤口中心到其边缘的距离测量的可变性。在雄性 CD1 小鼠 (n = 4,10 周龄,30-35 g) 肩胛骨水平的背侧中线形成一个圆形创伤伤口 (直径 5 mm)。使用定制设计的照相亭对伤口演变进行了 14 天的照片记录,该照相亭控制照明条件、焦距和受试者位置。使用 ImageJ 软件中的分割进行缩放和伤口测量,并使用统计分析软件进行统计分析。伤口闭合动力学显示,在第 0 天和第 2 天之间,伤口大小和周长略有增加,然后逐渐减少,直到第 14 天完全闭合。照相记录室和计算机辅助数字平面测量法实现了可变性最小的定量测量。总之,这些工具为临床前模型中评估伤口闭合动力学提供了一种可靠且可重复的方法。
引言
创伤性伤口愈合大约需要 21 天,并且有一个明确的序列,分为四个不同的阶段:(1) 止血,(2) 炎症,(3) 增殖,和 (4) 重塑1。如果伤口愈合的任何阶段延长,都可能导致慢性伤口的发展1。由于它们的高患病率、潜在的并发症2 和巨大的经济负担,它们被认为是一个全球性的健康问题。
临床前研究旨在通过促进伤口全面再上皮化 3,4,5、预防并发症和降低治疗成本来实现更快的愈合。这些研究评估了各种策略,包括生物材料的开发、药物干预和其他再生医学程序 6,7,8,9。
已经开发了多种实验模型用于研究创伤性伤口。有些侧重于肉眼可见的定性特征,例如大小、炎症指标、肉芽组织的存在、分泌物和结痂形成5。其他研究则分析定量数据,包括面积、周长、半径、直径、颜色、深度以及从伤口中心到边缘的距离。
在这方面,大多数体内研究直接测量伤口半径和深度。然而,在宏观图像中手动描绘伤口边缘可能会在测量10 中引入偏差。其他研究使用机械平面测量法,使用透明的网格塑料片,其中伤口边缘是预先划定的;在这两种情况下,获取面积或周长都需要手动工具,例如尺子或数字平面尺。如今,计算机辅助数字平面测量法允许对伤口或塑料片的宏观图像进行计算机化分析。原位作和宏观图像的质量是一个限制,但是,该工具 11,12,13,14 大大减少了面积和周长测量之间的差异。
与现有技术相比,这种提出的方法在评估小鼠伤口闭合方面具有显着优势 15,16,17,18,19,20。虽然照片记录被认为是评估伤口闭合动力学的准确且一致的工具,但之前的研究21,22 强调了手动伤口测量的局限性,例如由于照明和相机定位不一致而导致的观察者偏差和可变性。目前的方法通过定制的展位标准化成像条件来解决这些问题,从而提高可重复性和精度。此外,计算机化数字平面测量法能够进行更准确的定量评估,加强对治疗干预的评估并最大限度地减少测量误差,正如其他比较手动和数字技术的研究所证明的那样12,22 使其特别适用于小鼠模型中伤口闭合动力学的研究,允许通过严格控制图像采集条件来精确评估治疗。
研究方案
所有涉及实验小鼠的实验程序均按照墨西哥官方标准 (NOM-062-ZOO-1999) 中制定的实验动物处理和护理的道德标准和规定进行。该方案由国家核研究所 (ININ) 的实验动物护理和使用内部委员会 (CICUAL) 审查和批准,参考编号为 CICUAL-01-23。本研究使用雄性 CD1 小鼠 (n = 4),10 周龄,体重在 28-32 g 之间。选择所有动物以确保品系、年龄、性别和体重的一致性,从而最大限度地减少实验结果的变异性。材料表中列出了所用试剂和所用设备的详细信息。
1. 用于采集宏观图像的照相亭建设
注意:使用许可的 SolidWorks 软件(2015 版)设计照相亭以消除外部光源。一个 40 厘米× 40 厘米的立方体是使用一英寸厚的白色铝型材构建的。立方体由三个部分组成,按顺序组装:屋顶、侧壁和地板(图 1A)。
- 屋顶施工
注意:屋顶被区域化为前边缘 (A)、后边缘 (B) 和侧边缘 (C 和 D) 以定向(图 1B)。- 在屋顶侧边(C 和 D)的内部区域固定一个 1.5 厘米宽、2.51 厘米厚和 34.9 厘米长的开槽铝型材(设计用于固定玻璃)(图 1B)。
- 将两块 34.5 厘米长 x 13 厘米宽的矩形铝板放在每个屋顶型材的凹槽中,中间有聚乙烯( 图 1C 中的板 1 和 2),以便滑过两个型材的凹槽。
- 使用双面胶带将色温范围为 2500-9000 K(图 1C)的 20 厘米 RGB LED 灯管以 45° 角安装在面板 1 的下侧边缘。
- 在屋顶板 1 和 2 上安装一个 32 厘米 x 12 厘米的矩形泡沫板,中央有一个直径为 7.82 厘米的圆形切口,以允许安装相机镜头(图 1C)。
- 地板的构造
- 将一块 40 厘米 x 40 厘米见方的白色泡沫板放在地板区域型材的顶部。从泡沫板的每个角切割边长为 2.54 厘米的正方形(图 1E)。
- 侧墙施工
- 切割四块 40 厘米 x 40 厘米的四边形泡沫板。
- 在 C 面和 D 面上用硅胶粘合两个面板,以形成左侧和右侧壁(图 1F)。
- 将钩环紧固件条连接到铝型材 A 和 B,以便轻松作内部照相亭元件。此外,将距离一排粘合紧固件边缘 1 厘米处连接到一侧的两个泡沫纸板方块上,并将它们放置在前后墙上(图 1F)。
- 参考基地的构建
注意:在麻醉期间和伤口演变的整个记录过程中,将鼠标保持在俯卧位需要一个参考基础。使用 PLA 材料和 3D 打印机 23,24 使用熔融沉积建模 (FDM) 技术设计和制造3D 组件。- 3D 打印底座宽、长、高为 2 cm 的面罩,并将其放置在距离预切的 40 cm x 28 cm 白色泡沫板矩形边缘 11.5 cm 处,以保持小鼠处于吸入麻醉状态(图 1D,红色)。
- 3D 打印具有四个挤压区域的矩形平台(9 厘米长、5 厘米宽、2.5 厘米高),以在图像采集过程中对齐鼠标背侧。这些区域支撑头部、四肢和腹部区域以保持俯卧位。将此平台粘在参考底座的中心(图 1D,绿色)。
- 3D 打印标尺块(2 厘米宽、8 厘米长、2.5 厘米高)并将其固定在距离鼠标底座左侧 1 厘米的位置,以放置数字图像处理所需的测量参考元件(图 1D,蓝色)。
- 将 15 厘米不锈钢刻度尺连接到标尺块上,并将整个参考底座安装在小屋内以进行图像缩放(图 1D)。

图 1:宏观图像采集柜的构造图。 (A) 机舱的各个部分(屋顶、侧壁、地板)。(二)形成屋顶的型材的方向;前 (A)、后 (B) 和侧面(截面内侧以红色“C,D”)显示。(C) 屋顶板 1 和 2、LED 灯管的安装、相机镜头板和地板的安装。(D) 安装麻醉面罩 (RED)、鼠标平台 (GREEN) 和矩形平台,用于将测量尺 (BLUE) 定位在参考底座上。(五) 引用基础的最终位置。(F) 侧面、前墙和后墙的安装。 请单击此处查看此图的较大版本。
2. 动物饲养
- 获得机构生物伦理委员会的动物试验授权。使用 CD1 小鼠 (n = 4),10 周龄,体重 28-32 g。
- 在标准条件下饲养小鼠:保持 21 °C 的温度,12/12 小时的光照/黑暗循环,45% 湿度, 并随意获取 水和食物,照片记录期间除外。
3. 创伤性伤口的产生
- 手术前将小鼠禁食 8 小时。用 65 mg/kg25 的腹膜内戊巴比妥钠麻醉小鼠(遵循机构批准的方案)。
- 通过检查指间捏合期间是否缺乏撤退反射来确认麻醉深度。将眼药膏涂抹在眼睛上,以防止麻醉时干燥。在手术和恢复期间(20 分钟),将小鼠保持在 37 °C 的稳定温度下。
- 将鼠标置于腹侧卧位,并使用手术刀片从颈部区域尾部剥离 2.5 厘米 x 3 厘米的区域。拉伸皮肤以避免撕裂伤。使用交替使用聚维酮碘和无菌水冲洗进行无菌和消毒。
- 使用无菌的 5 毫米活检打孔器,并以圆周运动施加压力,在肩胛骨水平创建一个真皮-表皮切口。用锯齿镊子取下皮瓣,用虹膜尖剪刀剪断(图 2A)。
- 如果伤口中存在出血点,请用电烙装置进行电工电击以实现止血。
- 使用 Jeweler 镊子在伤口上放置一层直径为 1 厘米的圆形真皮膜,以防止污染和收缩。
- 在无菌条件下进行所有存活手术。用聚维酮碘等消毒剂准备手术部位。戴上无菌手套和口罩,并在整个手术过程中使用无菌器械并尽量减少与非无菌表面的接触,以保持无菌。
- 手术后,将小鼠置于24°C的单个笼子中并监测它们,直到它们恢复足够的意识以维持胸骨位置。确保在手术期间和手术后控制体温,以通过使用外部热源防止体温过低。
- 通过在饮用水中以 5 mg/kg26 的浓度稀释酮咯酸,进行镇痛直至第 4 天。
- 14 天后,当健康啮齿动物的伤口通常达到愈合的晚期时,按照国际标准在 CO2 室中通过 O2 替代物对小鼠实施安乐死。这标志着研究的终点。
4. 宏观图像采集
- 连续 14 天每天采集伤口图像,以监测伤口闭合的连续动力学。使用半专业或专业相机;将镜头穿过照相亭屋顶上的圆形开口。
注意:根据实验条件根据需要调整时间表。 - 在相关色温 (CCT) 模式下使用 RGB LED 灯管,设置为 9000 K 和 100% 亮度进行照明。
- 将参考基座放在 Photo Booth 地板的中央。
- 将鼠标放入吸入麻醉室中 3 分钟(图 2B)。
- 诱导麻醉后,将鼠标俯卧置于鼠标平台上。将鼻子固定在七氟烷麻醉面罩内,以 1.5 L/min 的氧气流速输送 5% 七氟烷(图 2C)。
- 在拍摄图像之前,使用 Jeweller 镊子从伤口中取出真皮膜,并将参考底座与相机镜头对齐。
- 安装照相亭的前墙,使用以下设置拍摄宏观图像:光圈 f/3.2,曝光时间 1/200 秒,ISO 感光度 80,焦距 4mm。
- 使用 Jeweller 镊子,在取下麻醉面罩之前,在伤口上放置一层直径为 1 厘米的真皮膜。将小鼠转移到各个笼子中并观察直到运动恢复。
5. 图像处理
- 生成宏观图像的备份副本。使用 ImageJ 软件处理图像。
- 按照路径在 ImageJ 中打开备份图像: 文件 > 打开 > 搜索 在图像中,然后单击 打开.
- 按参考缩放图像:最大化图像,选择 直线 工具,使用 + 键放大鼠标旁边的标尺,在标尺图像上画一条 10 毫米的直线,然后转到 分析 > 设置比例 > 输入“10” 为 已知距离 > 将 长度单位 设置为 mm,然后单击 Ok.这决定了宏观图像的像素与距离比(图 2D)。
- 将伤口区域与图像分开:使用矩形工具选择伤口周围的区域(w = 150,h = 150)。记录 X 和 Y 值,右键单击 矩形 > 复制 > 命名主题 > 按 Enter。在新图像中,按 + 两次放大(图 2E)。
- 按照以下路径存储裁剪后的图像: 文件 > 另存为 > Tiff > 输入名称 > 存储。
- 创建裁剪图像的副本以避免在分割过程中进行修改:右键单击 裁剪后的图像> 复制 > 命名 ,方法是在末尾添加“分段”。接下来,按 Enter。在新图像中,按 + 两次可放大。
- 按照以下路径将图像分成颜色通道: 图像> Type > RGB Stack。在红色通道图像(1/3 红色)中,右键单击 复制,然后按 OK 在 复制 窗口中。
- 分割红色通道图像。单击红色通道图像, 图像>调整阈值>。接下来,选择 Default > Apply (图 2F)。
- 校正感兴趣区域 (ROI) 以确保伤口完全覆盖并避免分割失真。
注意:如果分割中不包括伤口周围的区域,请转到 处理 > 二进制 > 填充孔。要去除伤口外的黑点,请转到 处理 > 二进制> Erode。如果 Erode 命令减小了伤口大小,请使用 Process > Binary > Dilate 进行校正。 - 标记 ROI 的周长: Edit > Selection > Create Selection。ROI 将以黄色轮廓显示。按照 Edit > Selection > Add to Manager (图 2G)将其添加到 ROI Manager(图 2G)。
- 验证分段:打开 ROI Manager 窗口,然后选择要查看的 ROI:More > Translate。输入步骤 4 中记录的 X 和 Y 值,然后按 OK。
- 最大化原始图像,然后在 ROI 管理器中选择 ROI。使用箭头键调整 ROI,直到它与伤口对齐(图 2H)。如果 ROI 与伤口匹配,则分割成功。否则,请从步骤 2 开始重复。
- 确认分割后,获取伤口测量值: Analyze > Measure。结果表将显示面积、周长和 X/Y 位置值。将这些值复制到 SPSS 软件以进行记录和统计分析(图 2I)。
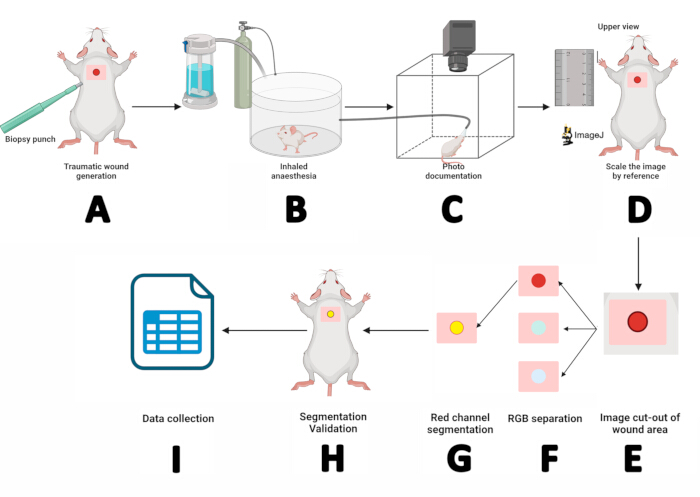
图 2:使用数字平面测量和分割技术的伤口测量工作流程。 (A) 使用无菌 5 mm 活检打孔器进行皮肤表皮切口。(B) 将鼠标置于吸入麻醉室中 3 分钟。(C) 通过将麻醉的鼠标放置在照相亭中并将其鼻子固定在七氟烷面罩内来进行照片记录。(D) 在 ImageJ 中打开获得的图像并使用标尺作为参考进行缩放。(E) 使用矩形工具提取伤口区域。(F) 将图像分离为 RGB 通道并处理红色通道。(G) 概述和管理感兴趣区域 (ROI)。(H) 通过将 ROI 与伤口匹配来验证分割。(I) 测量伤口参数并记录结果以进行统计分析。 请单击此处查看此图的较大版本。
6. 术后安乐死
注意:该研究在 14 天后结束,此时健康啮齿动物的伤口通常会达到愈合的高级阶段。在这个阶段,按照既定的机构批准的安乐死程序对小鼠进行人道安乐死。
- 准备设备。确保安乐死室清洁、干燥且大小合适,以容纳小鼠而不会过度拥挤。将腔室连接到带有流量调节器的医用级 CO2 供应。
- 轻轻地将小鼠转移到腔室中,以尽量减少压力。确保他们处于一个平静的环境中,外部干扰最小。
- 将 CO2 流速设置为每分钟腔室体积的 20%-30%,如 AVMA 动物安乐死指南所建议。逐渐增加 CO2 浓度,以避免引起小鼠的痛苦或不适。
- 在手术过程中密切观察小鼠。寻找逐渐失去意识的迹象,包括活动和呼吸减少,然后是呼吸暂停和心脏骤停。
- 一旦小鼠不再呼吸且没有运动迹象,确认死亡;再等待 1-2 分钟以确保重要功能完全停止。通过确认无反射(例如角膜反射)和心脏活动来验证死亡。
- 将尸体转移到指定的生物危险废物容器中。遵循安全处理动物遗骸的机构规程和国家准则。
- 记录被安乐死的动物数量、日期和任何相关观察结果,以确保符合道德和机构标准。
结果
在 ImageJ 软件中缩放图像后,通过数字分割获得伤口的平均周长(表 1)和面积(表 2)以及它们各自的标准差。这些值是从第 0 天到第 14 天 (D0-D14) 记录的。
| 日 | 周长 (mm) |
| 0 | 22.75 ± 0.8900 |
| 1 |
讨论
在临床前模型中,由于伤口大小、局部炎症反应34、位置和/或作等因素,定量分析临床前模型中创伤伤口的演变面临挑战。这些测量存在直接手动36 和间接数字11、16、37、38 平面测量方法。与使用手动方法的研究相比,手动方法经常受到观...
披露声明
作者声明与本研究不存在利益冲突。
致谢
作者要感谢 Consejo Nacional de Humanidades, Ciencias y Tecnologías (CONAHCyT, CVU: 933600) 通过赠款提供资金,并感谢 Laboratorio Nacional de Investigación y Desarrollo de Radiofármacos del Instituto Nacional de Investigaciones Nucleares (LANIDER-ININ) 的支持。此外,图 2 是在 BioRender 软件 (2020) 的帮助下准备的,该软件可在 BioRender.com/p67z056 上获得。
材料
| Name | Company | Catalog Number | Comments |
| 5 mm Biopsy Punch | MILTEX, USA | 33-35 | To mark the wound edges |
| Aluminum with polyethylene core | Alucobond,USA | Bright Silver 119 | For the construction of the macroscopic Image Acquisition Booth |
| Camera Lens | Sony, Japan | SEL2470Z | To focus the images to photograph |
| Electrocautery | Bonart, USA | ART-E1 | To eliminates bleeding points in the wound if present. |
| Hook and loop fastener strips | VELCRO | ||
| IBM SPSS Statistics Version 22 | IBM Corporation, USA | https://www.ibm.com/analytics/spss-statistics | Used for statistical analysis of wound measurements, including area and perimeter data. |
| ImageJ Version 1.53t | National Institutes of Health, USA | https://imagej.nih.gov/ij/ | Used for processing macroscopic images, including scaling, segmentation, and measurement of wound parameters. |
| Ketorolac | SIEGFRIED RHEIN, Mexico | 493977 | For postoperative pain management |
| Miltex Iris Scissors, 4-1/8" Curved | MILTEX, USA | V95-306 | To cut the wound flap generated with the biopsy punch |
| RGB LED Light Tube | ANDOER, China | B09F8RLMSY | To illuminate the Macroscopic Image Acquisition Booth |
| Semi profesional camera | Sony, Japan | DSC-HX300 | To take the photos |
| Serrated Forceps | MILTEX, USA | V96-118 | To hold the flap during the cut |
| Sevoflurane | Baxter, USA | AMX2L9117PR | For inhaled anaesthesia |
| Sodium Pentobarbital | Aranda, Mexico | 734.448.001.212 | For intraperitoneal anaesthesia |
| SolidWorks Version 2015 | Dassault Systèmes, France | https://www.solidworks.com/ | Used to design and create 3D models for constructing accessories for the photodocumentation booth. |
| Surgical blades | HERGOM, Mexico | H10 | To shave the hair in the area where the wound will be created |
| Transparent Adhesive Dressing | 3M, USA | F51CA07 | To cover the traumatic wound |
参考文献
- Martinengo, L., et al. Prevalence of chronic wounds in the general population: systematic review and meta-analysis of observational studies. Ann Epidemiol. 29, 8-15 (2019).
- Chen, X., Shi, X., Xiao, H., Xiao, D., Xu, X. Research hotspot and trend of chronic wounds: A bibliometric analysis from 2013 to 2022. Wound Repair Regen. 31 (5), 597-612 (2013).
- Gould, L., Li, W. W. Defining complete wound closure: Closing the gap in clinical trials and practice. Wound Repair Regen. 27 (3), 201-224 (2019).
- Baron, J. M., Glatz, M., Proksch, E. Optimal support of wound healing: New insights. Dermatology. 236 (6), 593-600 (2020).
- Tiwari, R., Pathak, K. Local drug delivery strategies towards wound healing. Pharmaceutics. 15 (2), 634 (2023).
- Gupta, B., Agarwal, R., Alam, M. S. Hydrogels for wound healing applications. Biomed Hydrogels. , 184-227 (2011).
- Pastar, I., et al. Pre-clinical models for wound-healing studies. Skin Tissue Models Regen Med. , 223-253 (2018).
- Shen, Z., Zhang, C., Wang, T., Xu, J. Advances in functional hydrogel wound dressings: A Review. Polymers (Basel). 15 (9), 2000 (2000).
- Wong, V. W., Sorkin, M., Glotzbach, J. P., Longaker, M. T., Gurtner, G. C. Surgical approaches to create murine models of human wound healing. J Biomed Biotechnol. 2011, 1-8 (2011).
- Peterson, N., Stevenson, H., Sahni, V. Size matters: How accurate is clinical estimation of traumatic wound size. Injury. 45 (1), 232-236 (2014).
- Öien, R. F., Håkansson, A., Hansen, B. U., Bjellerup, M. Measuring the size of ulcers by planimetry: a useful method in the clinical setting. J Wound Care. 11 (5), 165-168 (2002).
- Rogers, L. C., Bevilacqua, N. J., Armstrong, D. G., Andros, G. Digital planimetry results in more accurate wound measurements: a comparison to standard ruler measurements. J Diabetes Sci Technol. 4 (4), 799-802 (2010).
- Shamata, A., Thompson, T. Documentation and analysis of traumatic injuries in clinical forensic medicine involving structured light three-dimensional surface scanning versus photography. J Forensic Leg Med. 58, 93-100 (2018).
- Foltynski, P., Ladyzynski, P., Ciechanowska, A., Migalska-Musial, K., Judzewicz, G., Sabalinska, S. Wound area measurement with digital planimetry: Improved accuracy and precision with calibration based on 2 rulers. PLoS One. 10 (8), e0134622 (2015).
- Frank, S., Kämpfer, H. Excisional wound healing. Wound Healing: Methods Protoc. , 3-15 (2003).
- Dunn, L., et al. Murine model of wound healing. J Vis Exp. (75), e50265 (2013).
- Barakat, M., DiPietro, L. A., Chen, L. Limited Treatment options for diabetic wounds: Barriers to clinical translation despite therapeutic success in murine models. Adv Wound Care (New Rochelle). 10 (8), 436-460 (2021).
- Goh, C. C., et al. Inducing ischemia-reperfusion injury in the mouse ear skin for intravital multiphoton imaging of immune responses. J Vis Exp. (118), e54956 (2016).
- Wang, Y., et al. Autologous fat grafting promotes macrophage infiltration to increase secretion of growth factors and revascularization, thereby treating diabetic rat skin defect. Diabetes, Metab Syndr Obes: Targets and Therapy. 13, 4897-4908 (2020).
- Notodihardjo, S. C., et al. A comparison of the wound healing process after the application of three dermal substitutes with or without basic fibroblast growth factor impregnation in diabetic mice. J Plast Reconstr Aesthet Surg. 73 (8), 1547-1555 (2020).
- Thawer, H. A., Houghton, P. E., Woodbury, M. G., Keast, D., Campbell, K. A comparison of computer-assisted and manual wound size measurement. Ostomy Wound Manage. 48 (10), 46-53 (2002).
- Huang, C. X., et al. Comparison of digital and traditional skin wound closure assessment methods in mice. Lab Anim Res. 39 (1), 25 (2023).
- Subramaniam, S. R., et al. 3D printing: Overview of PLA progress. AIP Conf Proc. , 020015 (2019).
- Oleksy, M., Dynarowicz, K., Aebisher, D. Rapid prototyping technologies: 3D printing applied in medicine. Pharmaceutics. 15 (8), 2169 (2023).
- Gómez de Segura, &. #. 1. 9. 3. ;. I. Métodos de anestesia, analgesia y eutanasia. Métodos de anestesia, analgesia y eutanasia. 14, 97-127 (2016).
- Romero-Fernandez, W., et al. El 1, 2, 3 de la experimentación con animales de laboratorio. Rev Peru Med Exp Salud Publica. 33 (2), 288 (2016).
- Cukjati, D., Reberšek, S., Miklavčič, D. A reliable method of determining wound healing rate. Med Biol Eng Comput. 39 (2), 263-271 (2001).
- Payne, W. G., Bhalla, R., Hill, D. P., Pierpont, Y. N., Robson, M. C. Wound healing trajectories to determine pressure ulcer treatment efficacy. Wound Repair Regen. 11, e1 (2011).
- Cardinal, M., Eisenbud, D. E., Phillips, T., Harding, K. Early healing rates and wound area measurements are reliable predictors of later complete wound closure. Wound Repair Regen. 16 (1), 19-22 (2008).
- Tallman, P. Initial rate of healing predicts complete healing of venous ulcers. Arch Dermatol. 133 (10), 1231 (1997).
- Hopkins, N. F. G., Jamieson, C. W. Antibiotic concentration in the exudate of venous ulcers: The prediction of ulcer healing rate. Br J Surg. 70 (9), 532-534 (2005).
- Robson, M. C. Wound healing trajectories as predictors of effectiveness of therapeutic agents. Arch Surg. 135 (7), 773 (2000).
- Jessup, R. L. What is the best method for assessing the rate of wound healing? A comparison of 3 mathematical formulas. Wounds. 19 (3), 138-147 (2006).
- Landén, N. X., Li, D., Ståhle, M. Transition from inflammation to proliferation: A critical step during wound healing. Cell Mol Life Sci. 73 (20), 3861-3885 (2016).
- Szpaderska, A. M., DiPietro, L. A. Inflammation in surgical wound healing: Friend or foe. Surgery. 137 (5), 571-573 (2005).
- Hamed, E., Al Balah, O. F. A., Refaat, M., Badr, A. M., Afifi, A. Photodynamic therapy mediated by methylene blue-loaded PEG accelerates skin mouse wound healing: An immune response. Lasers in Med Sci. 39 (1), 141 (2024).
- Ibraheem, W. I., et al. Comparison of digital planimetry and ruler methods for the measurement of extraction socket wounds. Medicina (Kaunas). 59 (1), 135 (2023).
- Mayrovitz, H. N., Soontupe, L. B. Wound areas by computerized planimetry of digital images: accuracy and reliability. Wounds. 22 (5), 222-229 (2009).
- Galiano, R. D., Michaels, J., Dobryansky, M., Levine, J. P., Gurtner, G. C. Quantitative and reproducible murine model of excisional wound healing. Wound Repair Regen. 12 (4), 485-495 (2004).
- Price, A., Grey, J. E., Patel, G. K., Cbe, K. G. H. . ABC of wound healing. , 0470658975 (2022).
- Eming, S. A., Krieg, T., Davidson, J. M. Inflammation in wound repair: Molecular and cellular mechanisms. J Invest Dermatol. 127 (3), 514-525 (2007).
- Carmeliet, P. Angiogenesis in life, disease and medicine. Nature. 438 (7070), 932-936 (2005).
- López, N., Cervero, S., Jiménez, M. J., Sanchez, J. F. Cellular characterization of wound exudate as a predictor of wound healing phases. Wounds. 26 (4), 101-107 (2014).
- Liu, N. T., et al. Quantifying the effects of wound healing risk and potential on clinical measurements and outcomes of severely burned patients: A data-driven approach. Burns. 46 (2), 303-313 (2020).
- Han, C., Barakat, M., DiPietro, L. A. Angiogenesis in wound repair: Too much of a good thing. Cold Spring Harb Perspect Biol. 14 (10), a041225 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。