Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Bir Fare Modelinde Yara Kapanma Kinetiğini Değerlendirmek için Dijital Planimetri
Bu Makalede
Özet
Yaralar küresel bir sağlık sorununu temsil eder. Bu çalışma, yara ölçümü değişkenliğini en aza indirmek için dijital planimetri kullanan standart bir fotoğraf kabini geliştirdi. Farelerde yaraların 14 gün boyunca izlenmesi, yara alanı ve çevresinde başlangıçta bir artış olduğunu ve ardından kademeli olarak kapandığını ortaya koydu. Bu metodoloji, klinik öncesi modellerde yara kapatma kinetiğinin değerlendirilmesine yardımcı olabilir.
Özet
Kronik yaralar, yüksek prevalansı nedeniyle, ciddi bir küresel sağlık sorunudur. Etkili terapötik stratejiler iyileşmeyi önemli ölçüde hızlandırabilir, böylece komplikasyon riskini azaltabilir ve sağlık sistemleri üzerindeki ekonomik yükü hafifletebilir. Çok sayıda deneysel çalışma yara iyileşmesini araştırmış olsa da, çoğu kalitatif gözlemlere veya kantitatif doğrudan ölçümlere dayanır. Bu çalışmanın amacı, dijital ölçekleme ve segmentasyonu içeren dijital planimetri kullanılarak dolaylı bir yara ölçüm yöntemini standardize etmektir. Bu yaklaşım, doğru yara değerlendirmesi için ayrıntılı, adım adım metodolojilerin eksikliğini giderir. Bir fotodokümantasyon kabini tasarlandı ve inşa edildi ve yara alanı, çevresi ve yara merkezinden kenarlarına olan mesafenin ölçümlerindeki değişkenliği en aza indirmek için bilgisayar destekli dijital planimetri araçları kullanıldı. Erkek CD1 farelerinin (n = 4, 10 haftalık, 30-35 g) kürek kemiği seviyesinde dorsal orta hatta dairesel travmatik yara (5 mm çapında) oluşturuldu. Yara evrimi, aydınlatma koşullarını, odak mesafesini ve nesne konumlandırmasını kontrol eden özel olarak tasarlanmış fotoğraf kabini kullanılarak 14 gün boyunca fotoğrafla belgelendi. Ölçekleme ve yara ölçümleri ImageJ yazılımında segmentasyon kullanılarak, istatistiksel analiz yazılımı kullanılarak istatistiksel analiz yapıldı. Yara kapatma kinetiği, 0. gün ile 2. gün arasında yara boyutunda ve çevresinde hafif bir artış gösterdi, ardından 14. güne kadar tamamen kapanana kadar kademeli bir azalma gösterdi. Fotoğraf dokümantasyon kabini ve bilgisayar destekli dijital planimetri, minimum değişkenlikle kantitatif ölçümleri mümkün kıldı. Sonuç olarak, bu araçlar klinik öncesi modellerde yara kapatma kinetiğini değerlendirmek için güvenilir ve tekrarlanabilir bir yöntem sağlar.
Giriş
Travmatik yara iyileşmesi yaklaşık 21 gün sürer ve dört farklı aşamadan oluşan iyi tanımlanmış bir diziye sahiptir: (1) hemostaz, (2) iltihaplanma, (3) proliferasyon ve (4) yeniden şekillenme1. Yara iyileşmesinin herhangi bir aşaması uzarsa, kronik yaraların gelişmesine yol açabilir1. Yüksek prevalansı, potansiyel komplikasyonları2 ve önemli ekonomik yükleri nedeniyle küresel bir sağlık sorunu olarak kabul edilmektedirler.
Klinik öncesi çalışmalar, kapsamlı yara yeniden epitelizasyonunu 3,4,5 teşvik ederek, komplikasyonları önleyerek ve tedavi maliyetlerini azaltarak daha hızlı iyileşme sağlamayı amaçlamaktadır. Bu çalışmalar, biyomateryallerin geliştirilmesi, farmakolojik müdahaleler ve diğer rejeneratif tıp prosedürleri dahil olmak üzere çeşitli stratejileri değerlendirmektedir 6,7,8,9.
Travmatik yaraların incelenmesi için çok sayıda deneysel model geliştirilmiştir. Bazıları boyut, inflamasyon göstergeleri, granülasyon dokusunun varlığı, sekresyonlar ve kabuk oluşumu gibi makroskopik olarak görünür kalitatif özelliklere odaklanır5. Diğerleri, alan, çevre, yarıçap, çap, renk, derinlik ve merkezden yaraların kenarlarına olan mesafeler dahil olmak üzere nicel verileri analiz eder.
Bu bağlamda, çoğu in vivo araştırma doğrudan yara yarıçapını ve derinliğini ölçer. Bununla birlikte, makroskopik bir görüntüde yara kenarlarının manuel olarak tanımlanması, ölçümde10 sapmalara neden olabilir. Diğer çalışmalar, yara kenarlarının daha önce tanımlandığı şeffaf ızgaralı plastik tabakalar kullanarak mekanik planimetri kullanır; Her iki durumda da, alanı veya çevreyi elde etmek, cetveller veya dijital planimetreler gibi manuel aletler gerektirir. Günümüzde, bilgisayar destekli dijital planimetri, yaraların veya plastik tabakaların makroskopik görüntülerinin bilgisayarlı analizine izin vermektedir. Yerinde manipülasyon ve makroskopik görüntünün kalitesi bir sınırlamadır, ancak bu araç 11,12,13,14, alan ve çevre ölçümleri arasındaki değişkenliği önemli ölçüde azaltır.
Önerilen bu metodoloji, farelerde yara kapanmasını değerlendirmek için mevcut tekniklere göre önemli avantajlar sunmaktadır 15,16,17,18,19,20. Fotoğraf dokümantasyonu, yara kapatma kinetiğini değerlendirmek için doğru ve tutarlı bir araç olarak kabul edilirken, önceki çalışmalar21,22, gözlemci yanlılığı ve tutarsız aydınlatma ve kamera konumlandırmasından kaynaklanan değişkenlik gibi manuel yara ölçümünün sınırlamalarını vurgulamıştır. Mevcut yaklaşım, özel olarak oluşturulmuş bir kabin aracılığıyla görüntüleme koşullarını standartlaştırarak, tekrarlanabilirliği ve hassasiyeti artırarak bu sorunları ele almaktadır. Ayrıca, bilgisayarlı dijital planimetri, manuel ve dijital teknikleri karşılaştıran diğer çalışmalarda kanıtlandığı gibi, terapötik müdahalelerin değerlendirmesini geliştirerek ve ölçüm hatalarını en aza indirerek daha doğru kantitatif değerlendirmelere olanak tanır12,22 ve bu da onu özellikle fare modellerinde yara kapatma kinetiği çalışmaları için uygun hale getirir ve görüntü elde etme koşulları üzerinde sıkı kontrol sağlayarak tedavilerin hassas bir şekilde değerlendirilmesine olanak tanır.
Protokol
Laboratuvar farelerini içeren tüm deneysel prosedürler, laboratuvar hayvanlarının taşınması ve bakımı için Resmi Meksika Standardında (NOM-062-ZOO-1999) belirlenen etik standartlara ve düzenlemelere uygun olarak yürütülmüştür. Protokol, Ulusal Nükleer Araştırma Enstitüsü'nün (ININ) Laboratuvar Hayvanlarının Bakımı ve Kullanımı İç Komitesi (CICUAL) tarafından CICUAL-01-23 referans numarası altında gözden geçirildi ve onaylandı. Bu çalışmada vücut ağırlığı 28-32 g arasında değişen, 10 haftalık erkek CD1 fareleri (n = 4) kullanıldı. Tüm hayvanlar, deney sonuçlarındaki değişkenliği en aza indirerek suş, yaş, cinsiyet ve vücut ağırlığında tekdüzelik sağlamak için seçildi. Reaktiflerin ve kullanılan ekipmanın ayrıntıları Malzeme Tablosunda listelenmiştir.
1. Makroskopik görüntülerin elde edilmesi için fotoğraf kabini yapımı
NOT: Lisanslı SolidWorks yazılımı (sürüm 2015), harici aydınlatma kaynaklarını ortadan kaldırmak için bir fotoğraf kabini tasarlamak için kullanılmıştır. Bir inç kalınlığında beyaz alüminyum profil kullanılarak 40 cm × 40 cm'lik bir küp inşa edildi. Küp, sırayla monte edilen üç bölümden oluşuyordu: çatı, yan duvarlar ve zemin (Şekil 1A).
- Çatı konstrüksiyonu
NOT: Çatı, yönlendirmek için ön kenar (A), arka kenar (B) ve yan kenarlar (C ve D) olarak bölgeselleştirilmiştir (Şekil 1B).- Çatının yan kenarının (C ve D) iç alanına 1,5 cm genişliğinde, 2,51 cm kalınlığında ve 34,9 cm uzunluğunda oluklu bir alüminyum profil (cam tutmak için tasarlanmış) sabitleyin (Şekil 1B).
- 34,5 cm uzunluğunda x 13 cm genişliğinde, ortasında polietilen bulunan iki adet dikdörtgen alüminyum levhayı, her iki profilin oluğundan kaymayı sağlamak için her bir çatı profilinin oluğuna yerleştirin ( Şekil 1C'deki Levha 1 ve 2).
- Çift taraflı bant kullanarak panel 20'in alt kenarına 2500-9000 K (Şekil 1C) 45°'lik bir açıyla 1 cm RGB LED tüp ışığı takın.
- Kamera merceğinin takılmasına izin vermek için çatı panelleri 1 ve 2'ye, merkezi 7,82 cm çapında dairesel bir oyuğa sahip 32 cm x 12 cm dikdörtgen köpük levha paneline monte edin (Şekil 1C).
- Zeminin inşası
- Zemin alanı profillerinin üzerine 40 cm x 40 cm kare şeklinde bir beyaz köpük levha parçası yerleştirin. Köpük levhanın her köşesinden kenar uzunluğu 2,54 cm olan kareler kesin (Şekil 1E).
- Yan duvarların inşası
- Dört adet 40 cm x 40 cm dörtgen köpük levha panel kesin.
- Sol ve sağ yan duvarları oluşturmak için C ve D taraflarında silikonlu iki paneli yapıştırın (Şekil 1F).
- Dahili fotoğraf kabini elemanlarının kolay manipülasyonu için cırt cırtlı bağlantı şeritlerini alüminyum profiller A ve B'ye takın. Ek olarak, bir dizi yapışkan bağlantı elemanının kenarından 1 cm uzakta bir taraftaki iki köpük karton kareye takın ve bunları ön ve arka duvarlara yerleştirin (Şekil 1F).
- Referans tabanının inşası
NOT: Anestezi sırasında ve yara evriminin belgelenmesi boyunca fareyi yüzüstü pozisyonda tutmak için bir referans tabanı gerekliydi. 3D bileşenler, PLA malzeme ve bir 3D yazıcı ile Fused Deposition Modeling (FDM) tekniği kullanılarak tasarlanmış ve üretilmiştir23,24.- Maskeyi 2 cm genişliğinde, uzunluğunda ve yüksekliğinde bir tabanla 3D yazdırın ve fareleri inhalasyon anestezisi altında tutmak için önceden kesilmiş 40 cm x 28 cm beyaz köpük levha dikdörtgenin kenarından 11,5 cm uzağa yerleştirin (Şekil 1D, kırmızı renk).
- Görüntü alma sırasında fare sırtını hizalamak için dikdörtgen platformu (9 cm uzunluğunda, 5 cm genişliğinde, 2,5 cm yüksekliğinde) dört ekstrüde alanla 3D yazdırın. Bu alanlar, yüzüstü pozisyonu korumak için başı, uzuvları ve karın bölgesini destekledi. Bu platformu referans tabanının ortasına yapıştırın (Şekil 1D, yeşil renk).
- Cetvel bloğunu (2 cm genişliğinde, 8 cm uzunluğunda, 2,5 cm yüksekliğinde) 3D yazdırın ve dijital görüntü işleme için gerekli ölçüm referans öğesini yerleştirmek için fare tabanının sol tarafından 1 cm uzağa sabitleyin (Şekil 1D, mavi renk).
- Cetvel bloğuna 15 cm paslanmaz çelik dereceli bir cetvel takın ve görüntü ölçekleme için tüm referans tabanını kabinin içine takın (Şekil 1D).

Şekil 1: Makroskopik görüntü elde etme kabininin yapım şeması. (A) Kabinin bölümleri (çatı, yan duvarlar, zemin). (B)Çatıyı oluşturan profillerin oryantasyonu; ön (A), arka (B) ve yanlar (profillerin iç tarafı kırmızı "C,D"). (C) Çatı panelleri 1 ve 2, LED ışık tüpünün, kamera mercek plakasının montajı ve zemin montajı. (D) Anestezi maskesinin (KIRMIZI), fare platformunun (YEŞİL) ve ölçüm cetvelinin (MAVİ) referans tabanına yerleştirilmesi için dikdörtgen platformun montajı. (E) Referans tabanı için son konum. (F) Yanların, ön ve arka duvarların montajı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
2. Hayvan bakımı
- Hayvanlar üzerinde test yapmak için kurumun biyoetik komitesinden yetki alın. 10 haftalık, 28-32 g ağırlığında CD1 fareleri (n = 4) kullanın.
- Fareleri standart koşullar altında barındırın: 21 °C, 12/12 saat aydınlık/karanlık döngüleri, %45 nem oranını koruyun ve fotoğraf belgeleme oturumları dışında su ve yiyeceğe ad libitum erişim sağlayın.
3. Travmatik yara oluşumu
- İşlemden önce fareleri 8 saat aç bırakın. Fareleri intraperitoneal sodyum pentobarbital ile 65 mg / kg25'te anestezi yapın (kurumsal olarak onaylanmış protokolleri izleyerek).
- Interdigital bir tutam sırasında geri çekilme refleksi eksikliğini kontrol ederek anestezi derinliğini onaylayın. Anestezi sırasında kuruluğu önlemek için gözlere oftalmik merhem sürün. Ameliyat ve iyileşme sırasında fareleri 37 ° C'lik sabit bir sıcaklıkta tutun (20 dakika).
- Fareyi ventral dekübit pozisyonuna getirin ve cerrahi bıçaklar kullanarak servikal bölgeden kaudal olarak 2,5 cm x 3 cm'lik bir alanı epilasyon yapın. Yırtılmaları önlemek için cildi gerin. Alternatif povidon iyot ve steril su durulamaları kullanarak asepsi ve antisepsi gerçekleştirin.
- Steril 5 mm'lik bir biyopsi zımbası kullanın ve kürek kemiği seviyesinde dermo-epidermal bir kesi oluşturmak için dairesel hareketlerle basınç uygulayın. Tırtıklı forseps ile kanadı çıkarın ve iris uçlu makasla kesin (Şekil 2A).
- Yarada kanama noktalarının bulunması durumunda, hemostaz elde etmek için elektrokoter cihazı ile bir elektrikçi şoku uygulayın.
- Kontaminasyonu ve kasılmayı önlemek için Jeweler forseps kullanarak yaranın üzerine 1 cm çapında dairesel bir dermal film yerleştirin.
- Tüm sağkalım ameliyatlarını steril koşullar altında gerçekleştirin. Ameliyat bölgesini povidon-iyot gibi dezenfektanlarla hazırlayın. Steril eldiven ve maske takın ve steril aletler kullanarak ve steril olmayan yüzeylerle teması en aza indirerek prosedür boyunca steriliteyi koruyun.
- Ameliyattan sonra, fareleri 24 ° C'de ayrı kafeslere yerleştirin ve sternal pozisyonu korumak için yeterli bilinci yeniden kazanana kadar izleyin. Harici ısı kaynakları kullanarak hipotermiyi önlemek için ameliyat sırasında ve sonrasında vücut sıcaklığının kontrol edildiğinden emin olun.
- Ketorolakları içme suyunda 5 mg / kg26 oranında seyrelterek 4. güne kadar analjezi uygulayın.
- 14 gün sonra, sağlıklı kemirgenlerdeki yaralar tipik olarak iyileşmenin ileri aşamalarına ulaştığında, fareleri uluslararası standartlara uygun bir CO2 odasında O2 replasmanı ile ötenazi yapın. Bu, çalışmanın son noktasını işaret eder.
4. Makroskopik görüntü elde etme
- Yara kapanmasının sürekli kinetiğini izlemek için art arda 14 gün boyunca her gün yaraların görüntülerini yakalayın. Yarı profesyonel veya profesyonel bir kamera kullanın; Lensi, fotoğraf kabininin tavanındaki dairesel açıklıktan geçirin.
NOT: Deneysel koşullara göre programı gerektiği gibi ayarlayın. - Aydınlatma için 9000 K ve %100 parlaklığa ayarlanmış İlişkili Renk Sıcaklığı (CCT) modunda bir RGB LED ışık tüpü kullanın.
- Referans tabanını fotoğraf kabini tabanının ortasına yerleştirin.
- Fareyi 3 dakika boyunca solunan anestezi odasına yerleştirin (Şekil 2B).
- Anesteziyi indükledikten sonra, fareyi fare platformuna yüzüstü pozisyonda yerleştirin. Burnu sevofluran anestezi maskesi içinde sabitleyin ve 1.5 L / dk'lık bir oksijen akış hızında% 5 sevofluran verin (Şekil 2C).
- Görüntüleri yakalamadan önce, Jeweller forsepslerini kullanarak dermal filmi yaradan çıkarın ve referans tabanını kamera merceği ile hizalayın.
- Fotoğraf kabininin ön duvarını takın ve aşağıdaki ayarlarla makroskopik görüntüler yakalayın: diyafram açıklığı f/3.2, pozlama süresi 1/200s, ISO hızı 80, odak uzaklığı 4 mm.
- Kuyumcu forsepslerini kullanarak, anestezi maskesini çıkarmadan önce yaranın üzerine 1 cm çapında bir dermal film yerleştirin. Fareleri ayrı kafeslere aktarın ve motor iyileşene kadar gözlemleyin.
5. Görüntü işleme
- Makroskopik görüntülerin yedek bir kopyasını oluşturun. ImageJ yazılımını kullanarak görüntüleri işleyin.
- Aşağıdaki yolu izleyerek yedek görüntüyü ImageJ'de açın: Görüntülerde Dosya > Aç > Ara , ardından Aç'a tıklayın.
- Görüntüyü referansa göre ölçeklendirin: Görüntüyü büyütün, düz çizgi aracını seçin, + tuşunu kullanarak farenin yanındaki cetveli yakınlaştırın, cetvel görüntüsünün üzerine 10 mm'lik düz bir çizgi çizin, ardından Analiz Et > Ölçeği Ayarla'ya gidin > Bilinen mesafe için " 10" girin > Uzunluk birimini mm olarak ayarlayın ve ardından Tamam'a tıklayın. Bu, makroskopik görüntü için piksel-mesafe oranını belirler (Şekil 2D).
- Yara bölgesini görüntüden ayırın: Yaranın etrafındaki alanı seçmek için dikdörtgen aracını kullanın (g = 150, y = 150). X ve Y değerlerini kaydedin, dikdörtgene sağ tıklayın > Çoğaltın > Konuyu adlandırın > Enter'a basın. Yeni görüntüde, yakınlaştırmak için + düğmesine iki kez basın (Şekil 2E).
- Aşağıdaki yolu izleyerek kırpılan görüntüyü kaydedin: Dosya > > Tiff Olarak Kaydet > Kaydet'> adını girin.
- Segmentasyon sırasında değişiklik yapılmasını önlemek için kırpılan görüntünün bir kopyasını oluşturun: Kırpılan resme sağ tıklayın > Çoğaltın > sonuna "Segmentasyon" ekleyerek adlandırın. Ardından, Enter tuşuna basın. Yeni görüntüde, yakınlaştırmak için + tuşuna iki kez basın.
- Şu yolu izleyerek görüntüyü renk kanallarına ayırın: Görüntü > RGB Yığını > Yazın. Kırmızı kanal görüntüsünde (1/3 Kırmızı), Çoğalt'a sağ tıklayın ve Çoğalt penceresinde Tamam'a basın.
- Kırmızı kanal görüntüsünü bölümlere ayırın. Kırmızı kanal görüntüsüne, Görüntü'ye tıklayın > > Eşiğini Ayarlayın. Ardından, Varsayılan'ı seçin > Uygula'yı seçin (Şekil 2F).
- Tam yara kapsamını sağlamak ve segmentasyon bozulmalarını önlemek için İlgi Bölgesini (ROI) düzeltin.
NOT: Yaranın etrafındaki alanlar segmentasyona dahil değilse, Delikleri Doldurmak > İkili > İşlem'e gidin. Yaranın dışındaki siyah noktaları çıkarmak için > İkili > Aşındırma İşlemi'ne gidin. Aşındır komutu yara boyutunu küçültürse, İşlemle > İkili > Genişlet'i kullanarak düzeltin. - ROI'nin çevresini işaretleyin: Seçimi Düzenle > Seçim Oluştur>. Yatırım getirisi sarı renkle belirtilecektir. Düzenle > Seçimini izleyerek > Yöneticiye Ekle'yi izleyerek ROI Yöneticisi'ne ekleyin (Şekil 2G).
- Segmentasyonu doğrulayın: ROI Yöneticisi penceresini açın ve gözden geçirilecek ROI'yi seçin: Çeviri > Daha Fazlası. Adım 4'te kaydedilen X ve Y değerlerini girin ve Tamam'a basın.
- Orijinal görüntüyü büyütün, ardından ROI Yöneticisi'nde ROI'yi seçin. Yara ile hizalanana kadar ok tuşlarını kullanarak ROI'yi ayarlayın (Şekil 2H). ROI yara ile eşleşirse, segmentasyon başarılı olmuştur. Aksi takdirde, 2. adımdan itibaren tekrarlayın.
- Segmentasyon onaylandıktan sonra yara ölçümlerini alın: Analiz Edin > Ölçün. Bir sonuç tablosu alan, çevre ve X/Y konum değerlerini görüntüler. Dokümantasyon ve istatistiksel analiz için bu değerleri SPSS yazılımına kopyalayın (Şekil 2I).
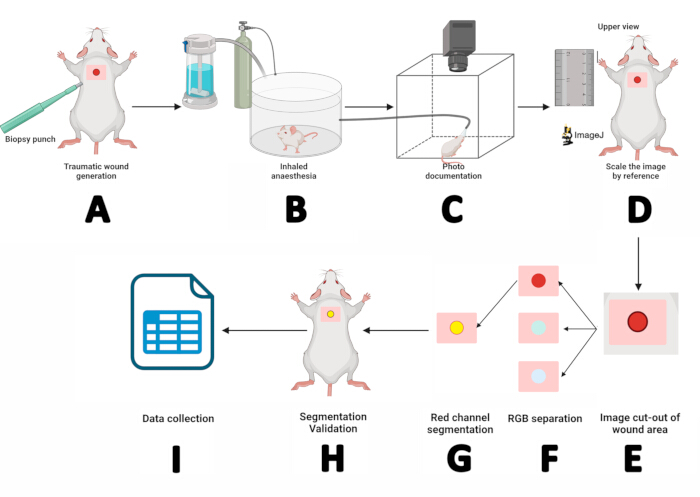
Şekil 2: Dijital planimetri ve segmentasyon teknikleri kullanılarak yara ölçümü iş akışı. (A) Steril 5 mm biyopsi punch kullanılarak dermo-epidermal insizyon. (B) Fareyi 3 dakika boyunca solunan bir anestezi odasına yerleştirmek. (C) Anestezi uygulanmış fareyi fotoğraf kabinine yerleştirerek ve burnunu bir sevofluran maskesi ile sabitleyerek fotoğraf dokümantasyonu. (D) Elde edilen görüntünün ImageJ'de açılması ve cetveli referans olarak kullanarak ölçeklendirilmesi. (E) Dikdörtgen aleti kullanarak yara bölgesini çıkarmak. (F) Görüntüyü RGB kanallarına ayırma ve kırmızı kanalı işleme. (G) İlgi bölgesinin (ROI) ana hatlarını belirlemek ve yönetmek. (H) ROI'yi yara ile eşleştirerek segmentasyonu doğrulamak. (I) Yara parametrelerinin ölçülmesi ve sonuçların istatistiksel analiz için kaydedilmesi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
6. İşlem sonrası ötenazi
NOT: Çalışma 14 gün sonra sona erer, bu noktada sağlıklı kemirgenlerdeki yaralar tipik olarak iyileşmenin ileri aşamalarına ulaşır. Bu aşamada, fareler, yerleşik kurumsal olarak onaylanmış ötenazi prosedürünü takiben insancıl bir şekilde ötenazi yapıldı.
- Ekipmanı hazırlayın. Ötenazi odasının temiz, kuru ve fareleri aşırı kalabalık olmadan yerleştirmek için uygun boyutta olduğundan emin olun. Odayı bir akış regülatörü ile tıbbi sınıf bir CO2 kaynağına bağlayın.
- Stresi en aza indirmek için fareleri yavaşça hazneye aktarın. Minimum dış rahatsızlık ile sakin bir ortamda olduklarından emin olun.
- CO2 akış hızını, Hayvanların Ötenazisi için AVMA Yönergeleri tarafından önerildiği gibi, odanın dakikadaki hacminin %20-30'una ayarlayın. Farelerde sıkıntı veya rahatsızlığa neden olmamak için CO2 konsantrasyonunu kademeli olarak artırın.
- İşlem sırasında fareleri yakından gözlemleyin. Azalmış aktivite ve solunum, ardından apne ve kalp durması dahil olmak üzere kademeli bilinç kaybı belirtileri arayın.
- Fareler artık nefes almadığında ve herhangi bir hareket belirtisi göstermediğinde ölümü onaylayın; Hayati fonksiyonların tamamen durmasını sağlamak için 1-2 dakika daha bekleyin. Reflekslerin (örneğin kornea refleksi) ve kardiyak aktivitenin olmadığını onaylayarak ölümü doğrulayın.
- Karkasları belirlenen Biyolojik Tehlikeli Atık konteynerlerine aktarın. Hayvan kalıntılarının güvenli bir şekilde imha edilmesi için kurumsal protokolleri ve ulusal yönergeleri izleyin.
- Etik ve kurumsal standartlara uygunluğu sağlamak için ötenazi yapılan hayvan sayısını, tarihi ve ilgili gözlemleri kaydedin.
Sonuçlar
Görüntüler ImageJ yazılımında ölçeklendikten sonra, yaraların ortalama çevresi (Tablo 1) ve alanı (Tablo 2), ilgili standart sapmaları ile birlikte dijital segmentasyon yoluyla elde edildi. Bu değerler sıfırıncı günden on dördüncü güne (D0-D14) kadar kaydedildi.
| Gün | Çevre (mm) |
Tartışmalar
Klinik öncesi modellerde, klinik öncesi modellerde travmatik yaraların evrimini kantitatif olarak analiz etmek, yara boyutu, lokalize inflamatuar yanıt34, konum ve/veya manipülasyon gibi faktörlerden kaynaklanan zorluklarla karşı karşıyadır. Bu ölçümler için direkt manuel36 ve dolaylı dijital 11,16,37,38 planimetri yöntemleri mevcuttur.<...
Açıklamalar
Yazarlar bu araştırma ile ilgili herhangi bir çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Yazarlar, finansman sağlama hibesi yoluyla Consejo Nacional de Humanidades, Ciencias y Tecnologías'a (CONAHCyT, CVU: 933600) ve destekleri için Laboratorio Nacional de Investigación y Desarrollo de Radiofármacos del Instituto Nacional de Investigaciones Nucleares'e (LANIDER-ININ) teşekkür eder. Ek olarak, Şekil 2, BioRender.com/p67z056'da bulunan BioRender yazılımı (2020) yardımıyla hazırlanmıştır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 5 mm Biopsy Punch | MILTEX, USA | 33-35 | To mark the wound edges |
| Aluminum with polyethylene core | Alucobond,USA | Bright Silver 119 | For the construction of the macroscopic Image Acquisition Booth |
| Camera Lens | Sony, Japan | SEL2470Z | To focus the images to photograph |
| Electrocautery | Bonart, USA | ART-E1 | To eliminates bleeding points in the wound if present. |
| Hook and loop fastener strips | VELCRO | ||
| IBM SPSS Statistics Version 22 | IBM Corporation, USA | https://www.ibm.com/analytics/spss-statistics | Used for statistical analysis of wound measurements, including area and perimeter data. |
| ImageJ Version 1.53t | National Institutes of Health, USA | https://imagej.nih.gov/ij/ | Used for processing macroscopic images, including scaling, segmentation, and measurement of wound parameters. |
| Ketorolac | SIEGFRIED RHEIN, Mexico | 493977 | For postoperative pain management |
| Miltex Iris Scissors, 4-1/8" Curved | MILTEX, USA | V95-306 | To cut the wound flap generated with the biopsy punch |
| RGB LED Light Tube | ANDOER, China | B09F8RLMSY | To illuminate the Macroscopic Image Acquisition Booth |
| Semi profesional camera | Sony, Japan | DSC-HX300 | To take the photos |
| Serrated Forceps | MILTEX, USA | V96-118 | To hold the flap during the cut |
| Sevoflurane | Baxter, USA | AMX2L9117PR | For inhaled anaesthesia |
| Sodium Pentobarbital | Aranda, Mexico | 734.448.001.212 | For intraperitoneal anaesthesia |
| SolidWorks Version 2015 | Dassault Systèmes, France | https://www.solidworks.com/ | Used to design and create 3D models for constructing accessories for the photodocumentation booth. |
| Surgical blades | HERGOM, Mexico | H10 | To shave the hair in the area where the wound will be created |
| Transparent Adhesive Dressing | 3M, USA | F51CA07 | To cover the traumatic wound |
Referanslar
- Martinengo, L., et al. Prevalence of chronic wounds in the general population: systematic review and meta-analysis of observational studies. Ann Epidemiol. 29, 8-15 (2019).
- Chen, X., Shi, X., Xiao, H., Xiao, D., Xu, X. Research hotspot and trend of chronic wounds: A bibliometric analysis from 2013 to 2022. Wound Repair Regen. 31 (5), 597-612 (2013).
- Gould, L., Li, W. W. Defining complete wound closure: Closing the gap in clinical trials and practice. Wound Repair Regen. 27 (3), 201-224 (2019).
- Baron, J. M., Glatz, M., Proksch, E. Optimal support of wound healing: New insights. Dermatology. 236 (6), 593-600 (2020).
- Tiwari, R., Pathak, K. Local drug delivery strategies towards wound healing. Pharmaceutics. 15 (2), 634 (2023).
- Gupta, B., Agarwal, R., Alam, M. S. Hydrogels for wound healing applications. Biomed Hydrogels. , 184-227 (2011).
- Pastar, I., et al. Pre-clinical models for wound-healing studies. Skin Tissue Models Regen Med. , 223-253 (2018).
- Shen, Z., Zhang, C., Wang, T., Xu, J. Advances in functional hydrogel wound dressings: A Review. Polymers (Basel). 15 (9), 2000 (2000).
- Wong, V. W., Sorkin, M., Glotzbach, J. P., Longaker, M. T., Gurtner, G. C. Surgical approaches to create murine models of human wound healing. J Biomed Biotechnol. 2011, 1-8 (2011).
- Peterson, N., Stevenson, H., Sahni, V. Size matters: How accurate is clinical estimation of traumatic wound size. Injury. 45 (1), 232-236 (2014).
- Öien, R. F., Håkansson, A., Hansen, B. U., Bjellerup, M. Measuring the size of ulcers by planimetry: a useful method in the clinical setting. J Wound Care. 11 (5), 165-168 (2002).
- Rogers, L. C., Bevilacqua, N. J., Armstrong, D. G., Andros, G. Digital planimetry results in more accurate wound measurements: a comparison to standard ruler measurements. J Diabetes Sci Technol. 4 (4), 799-802 (2010).
- Shamata, A., Thompson, T. Documentation and analysis of traumatic injuries in clinical forensic medicine involving structured light three-dimensional surface scanning versus photography. J Forensic Leg Med. 58, 93-100 (2018).
- Foltynski, P., Ladyzynski, P., Ciechanowska, A., Migalska-Musial, K., Judzewicz, G., Sabalinska, S. Wound area measurement with digital planimetry: Improved accuracy and precision with calibration based on 2 rulers. PLoS One. 10 (8), e0134622 (2015).
- Frank, S., Kämpfer, H. Excisional wound healing. Wound Healing: Methods Protoc. , 3-15 (2003).
- Dunn, L., et al. Murine model of wound healing. J Vis Exp. (75), e50265 (2013).
- Barakat, M., DiPietro, L. A., Chen, L. Limited Treatment options for diabetic wounds: Barriers to clinical translation despite therapeutic success in murine models. Adv Wound Care (New Rochelle). 10 (8), 436-460 (2021).
- Goh, C. C., et al. Inducing ischemia-reperfusion injury in the mouse ear skin for intravital multiphoton imaging of immune responses. J Vis Exp. (118), e54956 (2016).
- Wang, Y., et al. Autologous fat grafting promotes macrophage infiltration to increase secretion of growth factors and revascularization, thereby treating diabetic rat skin defect. Diabetes, Metab Syndr Obes: Targets and Therapy. 13, 4897-4908 (2020).
- Notodihardjo, S. C., et al. A comparison of the wound healing process after the application of three dermal substitutes with or without basic fibroblast growth factor impregnation in diabetic mice. J Plast Reconstr Aesthet Surg. 73 (8), 1547-1555 (2020).
- Thawer, H. A., Houghton, P. E., Woodbury, M. G., Keast, D., Campbell, K. A comparison of computer-assisted and manual wound size measurement. Ostomy Wound Manage. 48 (10), 46-53 (2002).
- Huang, C. X., et al. Comparison of digital and traditional skin wound closure assessment methods in mice. Lab Anim Res. 39 (1), 25 (2023).
- Subramaniam, S. R., et al. 3D printing: Overview of PLA progress. AIP Conf Proc. , 020015 (2019).
- Oleksy, M., Dynarowicz, K., Aebisher, D. Rapid prototyping technologies: 3D printing applied in medicine. Pharmaceutics. 15 (8), 2169 (2023).
- Gómez de Segura, &. #. 1. 9. 3. ;. I. Métodos de anestesia, analgesia y eutanasia. Métodos de anestesia, analgesia y eutanasia. 14, 97-127 (2016).
- Romero-Fernandez, W., et al. El 1, 2, 3 de la experimentación con animales de laboratorio. Rev Peru Med Exp Salud Publica. 33 (2), 288 (2016).
- Cukjati, D., Reberšek, S., Miklavčič, D. A reliable method of determining wound healing rate. Med Biol Eng Comput. 39 (2), 263-271 (2001).
- Payne, W. G., Bhalla, R., Hill, D. P., Pierpont, Y. N., Robson, M. C. Wound healing trajectories to determine pressure ulcer treatment efficacy. Wound Repair Regen. 11, e1 (2011).
- Cardinal, M., Eisenbud, D. E., Phillips, T., Harding, K. Early healing rates and wound area measurements are reliable predictors of later complete wound closure. Wound Repair Regen. 16 (1), 19-22 (2008).
- Tallman, P. Initial rate of healing predicts complete healing of venous ulcers. Arch Dermatol. 133 (10), 1231 (1997).
- Hopkins, N. F. G., Jamieson, C. W. Antibiotic concentration in the exudate of venous ulcers: The prediction of ulcer healing rate. Br J Surg. 70 (9), 532-534 (2005).
- Robson, M. C. Wound healing trajectories as predictors of effectiveness of therapeutic agents. Arch Surg. 135 (7), 773 (2000).
- Jessup, R. L. What is the best method for assessing the rate of wound healing? A comparison of 3 mathematical formulas. Wounds. 19 (3), 138-147 (2006).
- Landén, N. X., Li, D., Ståhle, M. Transition from inflammation to proliferation: A critical step during wound healing. Cell Mol Life Sci. 73 (20), 3861-3885 (2016).
- Szpaderska, A. M., DiPietro, L. A. Inflammation in surgical wound healing: Friend or foe. Surgery. 137 (5), 571-573 (2005).
- Hamed, E., Al Balah, O. F. A., Refaat, M., Badr, A. M., Afifi, A. Photodynamic therapy mediated by methylene blue-loaded PEG accelerates skin mouse wound healing: An immune response. Lasers in Med Sci. 39 (1), 141 (2024).
- Ibraheem, W. I., et al. Comparison of digital planimetry and ruler methods for the measurement of extraction socket wounds. Medicina (Kaunas). 59 (1), 135 (2023).
- Mayrovitz, H. N., Soontupe, L. B. Wound areas by computerized planimetry of digital images: accuracy and reliability. Wounds. 22 (5), 222-229 (2009).
- Galiano, R. D., Michaels, J., Dobryansky, M., Levine, J. P., Gurtner, G. C. Quantitative and reproducible murine model of excisional wound healing. Wound Repair Regen. 12 (4), 485-495 (2004).
- Price, A., Grey, J. E., Patel, G. K., Cbe, K. G. H. . ABC of wound healing. , 0470658975 (2022).
- Eming, S. A., Krieg, T., Davidson, J. M. Inflammation in wound repair: Molecular and cellular mechanisms. J Invest Dermatol. 127 (3), 514-525 (2007).
- Carmeliet, P. Angiogenesis in life, disease and medicine. Nature. 438 (7070), 932-936 (2005).
- López, N., Cervero, S., Jiménez, M. J., Sanchez, J. F. Cellular characterization of wound exudate as a predictor of wound healing phases. Wounds. 26 (4), 101-107 (2014).
- Liu, N. T., et al. Quantifying the effects of wound healing risk and potential on clinical measurements and outcomes of severely burned patients: A data-driven approach. Burns. 46 (2), 303-313 (2020).
- Han, C., Barakat, M., DiPietro, L. A. Angiogenesis in wound repair: Too much of a good thing. Cold Spring Harb Perspect Biol. 14 (10), a041225 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır