È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Planimetria digitale per la valutazione della cinetica di chiusura della ferita in un modello murino
In questo articolo
Riepilogo
Le ferite rappresentano una sfida sanitaria globale. Questo studio ha sviluppato una cabina fotografica standardizzata utilizzando la planimetria digitale per ridurre al minimo la variabilità della misurazione della ferita. Il monitoraggio delle ferite nei topi per 14 giorni ha rivelato un aumento iniziale dell'area e del perimetro della ferita, seguito da una chiusura graduale. Questa metodologia può aiutare a valutare la cinetica di chiusura della ferita in modelli preclinici.
Abstract
Le ferite croniche, a causa della loro elevata prevalenza, sono un serio problema di salute globale. Strategie terapeutiche efficaci possono accelerare significativamente la guarigione, riducendo così il rischio di complicanze e alleviando l'onere economico per i sistemi sanitari. Sebbene numerosi studi sperimentali abbiano indagato la guarigione delle ferite, la maggior parte si basa su osservazioni qualitative o misurazioni quantitative dirette. L'obiettivo di questo studio era quello di standardizzare un metodo di misurazione indiretta della ferita utilizzando la planimetria digitale, incorporando la scala e la segmentazione digitali. Questo approccio affronta la mancanza di metodologie dettagliate e graduali per una valutazione accurata delle ferite. È stata progettata e costruita una cabina di fotodocumentazione e sono stati impiegati strumenti di planimetria digitale assistita da computer per ridurre al minimo la variabilità nelle misurazioni dell'area della ferita, del perimetro e della distanza dal centro della ferita ai suoi bordi. Una ferita traumatica circolare (5 mm di diametro) è stata creata sulla linea mediana dorsale a livello della scapola di topi maschi CD1 (n = 4, 10 settimane, 30-35 g). L'evoluzione della ferita è stata fotodocumentata per 14 giorni utilizzando la cabina fotografica progettata su misura, che controllava le condizioni di illuminazione, la distanza focale e il posizionamento del soggetto. Le misurazioni del ridimensionamento e della ferita sono state eseguite utilizzando la segmentazione nel software ImageJ e l'analisi statistica è stata condotta utilizzando il software di analisi statistica. La cinetica di chiusura della ferita ha mostrato un leggero aumento delle dimensioni e del perimetro della ferita tra il giorno 0 e il giorno 2, seguito da una graduale diminuzione fino alla completa chiusura entro il giorno 14. La cabina di fotodocumentazione e la planimetria digitale assistita da computer hanno consentito misurazioni quantitative con una variabilità minima. In conclusione, questi strumenti forniscono un metodo affidabile e riproducibile per valutare la cinetica di chiusura della ferita in modelli preclinici.
Introduzione
La guarigione traumatica delle ferite richiede circa 21 giorni e ha una sequenza ben definita di quattro fasi distinte: (1) emostasi, (2) infiammazione, (3) proliferazione e (4) rimodellamento1. Se una qualsiasi fase della guarigione delle ferite è prolungata, può portare allo sviluppo di ferite croniche1. A causa della loro elevata prevalenza, delle potenziali complicanze2 e del significativo onere economico, sono considerati un problema di salute globale.
Gli studi preclinici mirano a ottenere una guarigione più rapida promuovendo la riepitelizzazione completa delle ferite 3,4,5, prevenendo le complicanze e riducendo i costi del trattamento. Questi studi valutano varie strategie, tra cui lo sviluppo di biomateriali, interventi farmacologici e altre procedure di medicina rigenerativa 6,7,8,9.
Sono stati sviluppati diversi modelli sperimentali per lo studio delle ferite traumatiche. Alcuni si concentrano su caratteristiche qualitative macroscopicamente visibili come dimensioni, indicatori di infiammazione, presenza di tessuto di granulazione, secrezioni e formazione di croste5. Altri analizzano dati quantitativi, tra cui area, perimetro, raggio, diametro, colore, profondità e distanze dal centro ai bordi delle ferite.
A questo proposito, la maggior parte delle indagini in vivo misura direttamente il raggio e la profondità della ferita. Tuttavia, la delineazione manuale dei bordi della ferita in un'immagine macroscopica può introdurre distorsioni nella misurazione10. Altri studi utilizzano la planimetria meccanica, utilizzando fogli di plastica reticolata trasparente, dove i bordi della ferita sono precedentemente delineati; In entrambi i casi, l'ottenimento dell'area o del perimetro richiede strumenti manuali come righelli o planimetri digitali. Al giorno d'oggi, la planimetria digitale computerizzata consente l'analisi computerizzata di immagini macroscopiche di ferite o fogli di plastica. La manipolazione in situ e la qualità dell'immagine macroscopica sono un limite, tuttavia, questo strumento 11,12,13,14 riduce notevolmente la variabilità tra le misure di area e perimetro.
Questa metodologia proposta offre vantaggi significativi rispetto alle tecniche esistenti per valutare la chiusura della ferita nei topi 15,16,17,18,19,20. Mentre la documentazione fotografica è stata considerata uno strumento accurato e coerente per valutare la cinetica di chiusura della ferita, studi precedenti21,22 hanno evidenziato i limiti della misurazione manuale della ferita, come la distorsione dell'osservatore e la variabilità dovuta all'illuminazione incoerente e al posizionamento della telecamera. L'approccio attuale affronta questi problemi standardizzando le condizioni di imaging attraverso una cabina costruita su misura, migliorando la riproducibilità e la precisione. Inoltre, la planimetria digitale computerizzata consente valutazioni quantitative più accurate, migliorando la valutazione degli interventi terapeutici e minimizzando gli errori di misurazione, come evidenziato in altri studi che confrontano tecniche manuali e digitali12,22 rendendola particolarmente adatta per studi di cinetica di chiusura delle ferite in modelli murini, consentendo una valutazione precisa dei trattamenti mantenendo uno stretto controllo sulle condizioni di acquisizione delle immagini.
Protocollo
Tutte le procedure sperimentali che coinvolgono topi da laboratorio sono state condotte in conformità con gli standard etici e le normative stabilite nello standard ufficiale messicano (NOM-062-ZOO-1999) per la manipolazione e la cura degli animali da laboratorio. Il protocollo è stato esaminato e approvato dal Comitato interno per la cura e l'uso degli animali da laboratorio (CICUAL) dell'Istituto nazionale per la ricerca nucleare (ININ) con il numero di riferimento CICUAL-01-23. In questo studio sono stati utilizzati topi maschi CD1 (n = 4), di 10 settimane, con un peso corporeo compreso tra 28 e 32 g. Tutti gli animali sono stati selezionati per garantire l'uniformità di ceppo, età, sesso e peso corporeo, riducendo al minimo la variabilità dei risultati sperimentali. I dettagli dei reagenti e delle attrezzature utilizzate sono elencati nella Tabella dei Materiali.
1. Costruzione di cabine fotografiche per l'acquisizione di immagini macroscopiche
NOTA: Il software SolidWorks con licenza (versione 2015) è stato utilizzato per progettare una cabina fotografica per eliminare le fonti di illuminazione esterne. Un cubo di 40 cm × 40 cm è stato costruito utilizzando un profilo di alluminio bianco spesso un pollice. Il cubo era costituito da tre sezioni, assemblate in sequenza: il tetto, le pareti laterali e il pavimento (Figura 1A).
- Costruzione del tetto
NOTA: Il tetto è stato regionalizzato come bordo anteriore (A), bordo posteriore (B) e bordi laterali (C e D) per orientarsi (Figura 1B).- Fissare sulla zona interna del bordo laterale del tetto (C e D) un profilo in alluminio scanalato (progettato per contenere il vetro) largo 1,5 cm, spesso 2,51 cm e lungo 34,9 cm (Figura 1B).
- Posizionare due piastre rettangolari in alluminio lunghe 34,5 cm x larghe 13 cm con polietilene al centro nella scanalatura di ciascun profilo del tetto (Piastra 1 e 2 nella Figura 1C) per consentire lo scorrimento attraverso la scanalatura di entrambi i profili.
- Installare un tubo LED RGB da 20 cm con un intervallo di temperatura di colore compreso tra 2500 e 9000 K (Figura 1C) con un angolo di 45° sul bordo inferiore del pannello 1 utilizzando del nastro biadesivo.
- Montare sui pannelli del tetto 1 e 2 un pannello rettangolare in schiuma di 32 cm x 12 cm con un'apertura circolare centrale di 7,82 cm di diametro per consentire l'installazione dell'obiettivo della telecamera (Figura 1C).
- Costruzione del pavimento
- Posizionare un pezzo quadrato di 40 cm x 40 cm di pannello di schiuma bianca sopra i profili della superficie del pavimento. Tagliare i quadrati con una lunghezza laterale di 2,54 cm da ciascun angolo del pannello di schiuma (Figura 1E).
- Costruzione di pareti laterali
- Tagliare quattro pannelli di pannelli quadrangolari in schiuma di 40 cm x 40 cm.
- Incollare due pannelli con silicone sui lati C e D per formare le pareti laterali sinistra e destra (Figura 1F).
- Fissare le strisce di fissaggio a strappo ai profili in alluminio A e B per una facile manipolazione degli elementi interni della cabina fotografica. Inoltre, attaccare 1 cm dal bordo di una linea di elementi di fissaggio adesivi a due quadrati di cartone espanso su un lato e posizionarli sulle pareti anteriore e posteriore (Figura 1F).
- Costruzione della base di riferimento
NOTA: Era necessaria una base di riferimento per mantenere il topo in posizione prona durante l'anestesia e durante tutta la documentazione dell'evoluzione della ferita. I componenti 3D sono stati progettati e fabbricati utilizzando la tecnica di modellazione a deposizione fusa (FDM) con materiale PLA e una stampante 3D23,24.- Stampa in 3D la maschera con una base di 2 cm di larghezza, lunghezza e altezza e posizionala a 11,5 cm dal bordo di un rettangolo di schiuma bianca pretagliato di 40 cm x 28 cm per mantenere i topi in anestesia per inalazione (Figura 1D, colore rosso).
- Stampa in 3D la piattaforma rettangolare (9 cm di lunghezza, 5 cm di larghezza, 2,5 cm di altezza) con quattro aree estruse per allineare il dorso del mouse durante l'acquisizione dell'immagine. Queste aree sostenevano la testa, gli arti e la regione addominale per mantenere la posizione prona. Incollare questa piattaforma al centro della base di riferimento (Figura 1D, colore verde).
- Stampa in 3D il blocco righello (2 cm di larghezza, 8 cm di lunghezza, 2,5 cm di altezza) e fissalo a 1 cm dal lato sinistro della base del mouse per posizionare l'elemento di riferimento della misurazione necessario per l'elaborazione digitale delle immagini (Figura 1D, colore blu).
- Collegare un righello graduato in acciaio inossidabile da 15 cm al blocco righello e installare l'intera base di riferimento all'interno della cabina per il ridimensionamento dell'immagine (Figura 1D).

Figura 1: Schema per la costruzione dell'armadio di acquisizione immagini macroscopiche. (A) Sezioni della cabina (tetto, pareti laterali, pavimento). (B)Orientamento dei profili che formano la copertura; anteriore (A), posteriore (B) e laterale (lato interno dei profili in rosso "C,D"). (C) Pannelli del tetto 1 e 2, installazione del tubo luminoso a LED, della piastra dell'obiettivo della telecamera e installazione a pavimento. (D) Installazione della maschera per anestesia (ROSSA), della piattaforma per mouse (VERDE) e della piattaforma rettangolare per il posizionamento del righello di misurazione (BLU) sulla base di riferimento. (E) Ubicazione finale per la base di riferimento. (F) Installazione delle pareti laterali, anteriori e posteriori. Clicca qui per visualizzare una versione più grande di questa figura.
2. Mantenimento degli animali
- Ottenere l'autorizzazione dal comitato di bioetica dell'istituto per la sperimentazione animale. Utilizzare topi CD1 (n = 4), di 10 settimane, del peso di 28-32 g.
- Alloggiare i topi in condizioni standard: mantenere una temperatura di 21 °C, cicli luce/buio 12/12 h, umidità del 45% e fornire accesso ad libitum all'acqua e al cibo, tranne durante le sessioni di fotodocumentazione.
3. Generazione di ferite traumatiche
- Digiunare i topi per 8 ore prima della procedura. Anestetizzare i topi con pentobarbital sodico intraperitoneale a 65 mg/kg25 (seguendo protocolli istituzionalmente approvati).
- Confermare la profondità dell'anestesia verificando la mancanza di riflesso di astinenza durante un pizzico interdigitale. Applicare un unguento oftalmico sugli occhi per prevenire la secchezza durante l'anestesia. Mantenere i topi a una temperatura stabile di 37 °C durante l'intervento chirurgico e il recupero (20 min).
- Posizionare il topo in posizione di decubito ventrale e depilare un'area di 2,5 cm x 3 cm dalla regione cervicale caudalmente utilizzando lame chirurgiche. Allungare la pelle per evitare lacerazioni. Eseguire asepsi e antisepsi utilizzando risciacqui alternati di iodio povidone e acqua sterile.
- Utilizzare un punzone per biopsia sterile da 5 mm e applicare pressione con movimenti circolari per creare un'incisione dermo-epidermica a livello della scapola. Rimuovere il lembo con una pinza seghettata e tagliare con le forbici a punta di iride (Figura 2A).
- In caso di presenza di punti di sanguinamento nella ferita, applicare una scarica da elettricista con un dispositivo di elettrocauterizzazione per ottenere l'emostasi.
- Posizionare un film dermico circolare di 1 cm di diametro sulla ferita utilizzando una pinza da gioielliere per prevenire la contaminazione e la contrazione.
- Eseguire tutti gli interventi chirurgici di sopravvivenza in condizioni sterili. Preparare il sito chirurgico con disinfettanti come lo iodio povidone. Indossare guanti sterili e una maschera e mantenere la sterilità durante tutta la procedura utilizzando strumenti sterili e riducendo al minimo il contatto con superfici non sterili.
- Dopo l'intervento chirurgico, posizionare i topi in gabbie individuali a 24 °C e monitorarli fino a quando non riacquistano sufficiente coscienza per mantenere la posizione sternale. Assicurarsi che la temperatura corporea sia controllata durante e dopo l'intervento chirurgico per prevenire l'ipotermia utilizzando fonti di calore esterne.
- Somministrare analgesia fino al giorno 4 diluendo ketorolac in acqua potabile a 5 mg/kg26.
- Dopo 14 giorni, quando le ferite nei roditori sani raggiungono tipicamente stadi avanzati di guarigione, sopprimere i topi mediante sostituzione di O2 in una camera di CO2 seguendo gli standard internazionali. Questo segna il punto finale dello studio.
4. Acquisizione macroscopica di immagini
- Acquisisci immagini delle ferite ogni giorno per 14 giorni consecutivi per monitorare la cinetica continua della chiusura della ferita. Utilizzare una fotocamera semi-professionale o professionale; Posizionare l'obiettivo attraverso l'apertura circolare nel tetto della cabina fotografica.
NOTA: Regolare il programma secondo necessità in base alle condizioni sperimentali. - Utilizza un tubo luminoso LED RGB in modalità Temperatura colore correlata (CCT), impostata su 9000 K e luminosità del 100% per l'illuminazione.
- Posizionare la base di riferimento al centro del pavimento della cabina fotografica.
- Posizionare il topo nella camera di anestesia inalata per 3 minuti (Figura 2B).
- Dopo aver indotto l'anestesia, posizionare il mouse in posizione prona sulla piattaforma del mouse. Fissare il muso all'interno della maschera per anestesia a base di sevoflurano, erogando il 5% di sevoflurano a una portata di ossigeno di 1,5 L/min (Figura 2C).
- Prima di acquisire le immagini, rimuovere la pellicola dermica dalla ferita utilizzando una pinza Jeweller e allineare la base di riferimento con l'obiettivo della fotocamera.
- Installa la parete frontale della cabina fotografica e acquisisci immagini macroscopiche con le seguenti impostazioni: apertura f/3.2, tempo di esposizione 1/200s, velocità ISO 80, lunghezza focale 4 mm.
- Utilizzando una pinza Jeweller, posizionare una pellicola dermica di 1 cm di diametro sulla ferita prima di rimuovere la maschera per anestesia. Trasferisci i topi in gabbie individuali e osserva fino al recupero motorio.
5. Elaborazione delle immagini
- Generare una copia di backup delle immagini macroscopiche. Elaborare le immagini utilizzando il software ImageJ.
- Aprire l'immagine di backup in ImageJ seguendo il percorso: File > Apri > Cerca nelle immagini, quindi fare clic su Apri.
- Ridimensiona l'immagine per riferimento: ingrandisci l'immagine, seleziona lo strumento linea retta , ingrandisci il righello accanto al mouse usando il tasto +, disegna una linea retta di 10 mm sull'immagine del righello, quindi vai su Analizza > Imposta scala > Inserisci "10" per Distanza nota > Imposta unità di lunghezza su mm, quindi fai clic su Ok. Questo determina il rapporto pixel/distanza per l'immagine macroscopica (Figura 2D).
- Separare l'area della ferita dall'immagine: utilizzare lo strumento rettangolo per selezionare l'area intorno alla ferita (w = 150, h = 150). Registra i valori X e Y, fai clic con il pulsante destro del mouse sul rettangolo > Duplica > assegna un nome all'oggetto > premi Invio. Nella nuova immagine, premere + due volte per ingrandire (Figura 2E).
- Salva l'immagine ritagliata seguendo il percorso: File > Salva con nome > Tiff > Inserisci il nome > Salva.
- Crea un duplicato dell'immagine ritagliata per evitare modifiche durante la segmentazione: fai clic con il pulsante destro del mouse sull'immagine ritagliata > Duplica > assegnale un nome aggiungendo "Segmentazione" alla fine. Quindi, premi Invio. Nella nuova immagine, premere + due volte per ingrandire.
- Separa l'immagine in canali di colore seguendo questo percorso: Tipo di immagine > > Stack RGB. Nell'immagine del canale rosso (1/3 Rosso), fare clic con il pulsante destro del mouse su Duplica e premere OK nella finestra Duplica.
- Segmenta l'immagine del canale rosso. Fare clic sull'immagine del canale rosso, Immagine > Regola > soglia. Quindi, selezionare Predefinito > Applica (Figura 2F).
- Rettificare la regione di interesse (ROI) per garantire una copertura completa della ferita ed evitare distorsioni della segmentazione.
NOTA: Se le aree intorno alla ferita non sono incluse nella segmentazione, andare su Elabora > binario > Riempi i fori. Per rimuovere i punti neri all'esterno della ferita, vai su Elabora > binario > Erode. Se il comando Erode riduce le dimensioni della ferita, correggerla utilizzando Elabora > binario > Dilate. - Segna il perimetro del ROI: Modifica > selezione > Crea selezione. Il ROI sarà delineato in giallo. Aggiungerlo a ROI Manager seguendo Modifica > Selezione > Aggiungi a Manager (Figura 2G).
- Convalida la segmentazione: apri la finestra ROI Manager e seleziona il ROI da esaminare: Altro > Traduci. Immettere i valori X e Y registrati al punto 4 e premere OK.
- Ingrandisci l'immagine originale, quindi seleziona il ROI in ROI Manager. Regolare la ROI utilizzando i tasti freccia fino a quando non si allinea con la ferita (Figura 2H). Se il ROI corrisponde alla ferita, la segmentazione è andata a buon fine. In caso contrario, ripetere dal passaggio 2.
- Una volta confermata la segmentazione, ottenere le misure della ferita: Analizza > Misura. Una tabella dei risultati mostrerà i valori dell'area, del perimetro e della posizione X/Y. Copiare questi valori nel software SPSS per la documentazione e l'analisi statistica (Figura 2I).
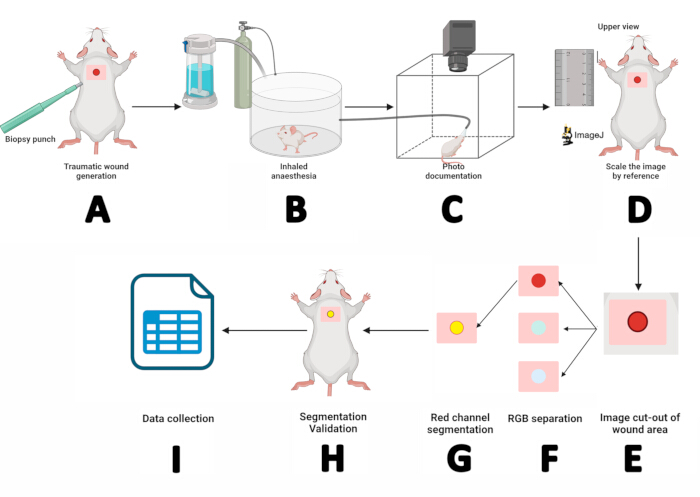
Figura 2: Flusso di lavoro della misurazione della ferita mediante planimetria digitale e tecniche di segmentazione. (A) Incisione dermo-epidermica mediante punzone bioptico sterile da 5 mm. (B) Posizionamento del topo in una camera di anestesia inalata per 3 minuti. (C) Documentazione fotografica posizionando il topo anestetizzato nella cabina fotografica e fissando il muso all'interno di una maschera di sevoflurano. (D) Apertura dell'immagine ottenuta in ImageJ e ridimensionamento utilizzando il righello come riferimento. (E) Estrazione dell'area della ferita utilizzando lo strumento rettangolo. (F) Separazione dell'immagine in canali RGB ed elaborazione del canale rosso. (G) Delineare e gestire la regione di interesse (ROI). (H) Convalidare la segmentazione abbinando il ROI con la ferita. (I) Misurazione dei parametri della ferita e registrazione dei risultati per l'analisi statistica. Clicca qui per visualizzare una versione più grande di questa figura.
6. Eutanasia post-processuale
NOTA: Lo studio si conclude dopo 14 giorni, a quel punto le ferite nei roditori sani raggiungono tipicamente stadi avanzati di guarigione. In questa fase, i topi sono stati sottoposti a eutanasia umana seguendo la procedura di eutanasia istituzionalmente approvata.
- Preparare l'attrezzatura. Assicurarsi che la camera di eutanasia sia pulita, asciutta e di dimensioni adeguate per ospitare i topi senza sovraffollamento. Collegare la camera a un'alimentazione di CO2 di grado medico con un regolatore di flusso.
- Trasferisci delicatamente i topi nella camera per ridurre al minimo lo stress. Assicurati che si trovino in un ambiente calmo con disturbi esterni minimi.
- Impostare la portata di CO2 al 20%-30% del volume della camera al minuto, come raccomandato dalle Linee Guida AVMA per l'Eutanasia degli Animali. Aumentare gradualmente la concentrazione di CO2 per evitare di indurre angoscia o disagio nei topi.
- Osserva attentamente i topi durante la procedura. Cerca segni di graduale perdita di coscienza, tra cui riduzione dell'attività e della respirazione, seguita da apnea e arresto cardiaco.
- Confermare la morte una volta che i topi non respirano più e non mostrano segni di movimento; Attendere altri 1-2 minuti per garantire una completa cessazione delle funzioni vitali. Verificare la morte confermando l'assenza di riflessi (ad esempio, riflesso corneale) e di attività cardiaca.
- Trasferire le carcasse negli appositi contenitori per rifiuti biologici pericolosi. Seguire i protocolli istituzionali e le linee guida nazionali per lo smaltimento sicuro dei resti animali.
- Registrare il numero di animali soppressi, la data e tutte le osservazioni pertinenti per garantire il rispetto degli standard etici e istituzionali.
Risultati
Dopo aver scalato le immagini nel software ImageJ, il perimetro medio (Tabella 1) e l'area (Tabella 2) delle ferite, insieme alle rispettive deviazioni standard, sono stati ottenuti attraverso la segmentazione digitale. Questi valori sono stati registrati dal giorno zero al quattordicesimo giorno (D0-D14).
| Giorno | Perimetro (mm... |
Discussione
Nei modelli preclinici, l'analisi quantitativa dell'evoluzione delle ferite traumatiche nei modelli preclinici affronta sfide dovute a fattori quali le dimensioni della ferita, la risposta infiammatoria localizzata34, la posizione e/o la manipolazione. Per queste misure esistono metodi di planimetria manuale diretta36 e digitale indiretta 11,16,37,38.
Divulgazioni
Gli autori dichiarano che non ci sono conflitti di interesse legati a questa ricerca.
Riconoscimenti
Gli autori ringraziano il Consejo Nacional de Humanidades, Ciencias y Tecnologías (CONAHCyT, CVU: 933600) attraverso la sovvenzione per l'erogazione del finanziamento, e il Laboratorio Nacional de Investigación y Desarrollo de Radiofármacos del Instituto Nacional de Investigaciones Nucleares (LANIDER-ININ) per il loro sostegno. Inoltre, la Figura 2 è stata preparata con l'assistenza del software BioRender (2020), disponibile all'indirizzo BioRender.com/p67z056.
Materiali
| Name | Company | Catalog Number | Comments |
| 5 mm Biopsy Punch | MILTEX, USA | 33-35 | To mark the wound edges |
| Aluminum with polyethylene core | Alucobond,USA | Bright Silver 119 | For the construction of the macroscopic Image Acquisition Booth |
| Camera Lens | Sony, Japan | SEL2470Z | To focus the images to photograph |
| Electrocautery | Bonart, USA | ART-E1 | To eliminates bleeding points in the wound if present. |
| Hook and loop fastener strips | VELCRO | ||
| IBM SPSS Statistics Version 22 | IBM Corporation, USA | https://www.ibm.com/analytics/spss-statistics | Used for statistical analysis of wound measurements, including area and perimeter data. |
| ImageJ Version 1.53t | National Institutes of Health, USA | https://imagej.nih.gov/ij/ | Used for processing macroscopic images, including scaling, segmentation, and measurement of wound parameters. |
| Ketorolac | SIEGFRIED RHEIN, Mexico | 493977 | For postoperative pain management |
| Miltex Iris Scissors, 4-1/8" Curved | MILTEX, USA | V95-306 | To cut the wound flap generated with the biopsy punch |
| RGB LED Light Tube | ANDOER, China | B09F8RLMSY | To illuminate the Macroscopic Image Acquisition Booth |
| Semi profesional camera | Sony, Japan | DSC-HX300 | To take the photos |
| Serrated Forceps | MILTEX, USA | V96-118 | To hold the flap during the cut |
| Sevoflurane | Baxter, USA | AMX2L9117PR | For inhaled anaesthesia |
| Sodium Pentobarbital | Aranda, Mexico | 734.448.001.212 | For intraperitoneal anaesthesia |
| SolidWorks Version 2015 | Dassault Systèmes, France | https://www.solidworks.com/ | Used to design and create 3D models for constructing accessories for the photodocumentation booth. |
| Surgical blades | HERGOM, Mexico | H10 | To shave the hair in the area where the wound will be created |
| Transparent Adhesive Dressing | 3M, USA | F51CA07 | To cover the traumatic wound |
Riferimenti
- Martinengo, L., et al. Prevalence of chronic wounds in the general population: systematic review and meta-analysis of observational studies. Ann Epidemiol. 29, 8-15 (2019).
- Chen, X., Shi, X., Xiao, H., Xiao, D., Xu, X. Research hotspot and trend of chronic wounds: A bibliometric analysis from 2013 to 2022. Wound Repair Regen. 31 (5), 597-612 (2013).
- Gould, L., Li, W. W. Defining complete wound closure: Closing the gap in clinical trials and practice. Wound Repair Regen. 27 (3), 201-224 (2019).
- Baron, J. M., Glatz, M., Proksch, E. Optimal support of wound healing: New insights. Dermatology. 236 (6), 593-600 (2020).
- Tiwari, R., Pathak, K. Local drug delivery strategies towards wound healing. Pharmaceutics. 15 (2), 634 (2023).
- Gupta, B., Agarwal, R., Alam, M. S. Hydrogels for wound healing applications. Biomed Hydrogels. , 184-227 (2011).
- Pastar, I., et al. Pre-clinical models for wound-healing studies. Skin Tissue Models Regen Med. , 223-253 (2018).
- Shen, Z., Zhang, C., Wang, T., Xu, J. Advances in functional hydrogel wound dressings: A Review. Polymers (Basel). 15 (9), 2000 (2000).
- Wong, V. W., Sorkin, M., Glotzbach, J. P., Longaker, M. T., Gurtner, G. C. Surgical approaches to create murine models of human wound healing. J Biomed Biotechnol. 2011, 1-8 (2011).
- Peterson, N., Stevenson, H., Sahni, V. Size matters: How accurate is clinical estimation of traumatic wound size. Injury. 45 (1), 232-236 (2014).
- Öien, R. F., Håkansson, A., Hansen, B. U., Bjellerup, M. Measuring the size of ulcers by planimetry: a useful method in the clinical setting. J Wound Care. 11 (5), 165-168 (2002).
- Rogers, L. C., Bevilacqua, N. J., Armstrong, D. G., Andros, G. Digital planimetry results in more accurate wound measurements: a comparison to standard ruler measurements. J Diabetes Sci Technol. 4 (4), 799-802 (2010).
- Shamata, A., Thompson, T. Documentation and analysis of traumatic injuries in clinical forensic medicine involving structured light three-dimensional surface scanning versus photography. J Forensic Leg Med. 58, 93-100 (2018).
- Foltynski, P., Ladyzynski, P., Ciechanowska, A., Migalska-Musial, K., Judzewicz, G., Sabalinska, S. Wound area measurement with digital planimetry: Improved accuracy and precision with calibration based on 2 rulers. PLoS One. 10 (8), e0134622 (2015).
- Frank, S., Kämpfer, H. Excisional wound healing. Wound Healing: Methods Protoc. , 3-15 (2003).
- Dunn, L., et al. Murine model of wound healing. J Vis Exp. (75), e50265 (2013).
- Barakat, M., DiPietro, L. A., Chen, L. Limited Treatment options for diabetic wounds: Barriers to clinical translation despite therapeutic success in murine models. Adv Wound Care (New Rochelle). 10 (8), 436-460 (2021).
- Goh, C. C., et al. Inducing ischemia-reperfusion injury in the mouse ear skin for intravital multiphoton imaging of immune responses. J Vis Exp. (118), e54956 (2016).
- Wang, Y., et al. Autologous fat grafting promotes macrophage infiltration to increase secretion of growth factors and revascularization, thereby treating diabetic rat skin defect. Diabetes, Metab Syndr Obes: Targets and Therapy. 13, 4897-4908 (2020).
- Notodihardjo, S. C., et al. A comparison of the wound healing process after the application of three dermal substitutes with or without basic fibroblast growth factor impregnation in diabetic mice. J Plast Reconstr Aesthet Surg. 73 (8), 1547-1555 (2020).
- Thawer, H. A., Houghton, P. E., Woodbury, M. G., Keast, D., Campbell, K. A comparison of computer-assisted and manual wound size measurement. Ostomy Wound Manage. 48 (10), 46-53 (2002).
- Huang, C. X., et al. Comparison of digital and traditional skin wound closure assessment methods in mice. Lab Anim Res. 39 (1), 25 (2023).
- Subramaniam, S. R., et al. 3D printing: Overview of PLA progress. AIP Conf Proc. , 020015 (2019).
- Oleksy, M., Dynarowicz, K., Aebisher, D. Rapid prototyping technologies: 3D printing applied in medicine. Pharmaceutics. 15 (8), 2169 (2023).
- Gómez de Segura, &. #. 1. 9. 3. ;. I. Métodos de anestesia, analgesia y eutanasia. Métodos de anestesia, analgesia y eutanasia. 14, 97-127 (2016).
- Romero-Fernandez, W., et al. El 1, 2, 3 de la experimentación con animales de laboratorio. Rev Peru Med Exp Salud Publica. 33 (2), 288 (2016).
- Cukjati, D., Reberšek, S., Miklavčič, D. A reliable method of determining wound healing rate. Med Biol Eng Comput. 39 (2), 263-271 (2001).
- Payne, W. G., Bhalla, R., Hill, D. P., Pierpont, Y. N., Robson, M. C. Wound healing trajectories to determine pressure ulcer treatment efficacy. Wound Repair Regen. 11, e1 (2011).
- Cardinal, M., Eisenbud, D. E., Phillips, T., Harding, K. Early healing rates and wound area measurements are reliable predictors of later complete wound closure. Wound Repair Regen. 16 (1), 19-22 (2008).
- Tallman, P. Initial rate of healing predicts complete healing of venous ulcers. Arch Dermatol. 133 (10), 1231 (1997).
- Hopkins, N. F. G., Jamieson, C. W. Antibiotic concentration in the exudate of venous ulcers: The prediction of ulcer healing rate. Br J Surg. 70 (9), 532-534 (2005).
- Robson, M. C. Wound healing trajectories as predictors of effectiveness of therapeutic agents. Arch Surg. 135 (7), 773 (2000).
- Jessup, R. L. What is the best method for assessing the rate of wound healing? A comparison of 3 mathematical formulas. Wounds. 19 (3), 138-147 (2006).
- Landén, N. X., Li, D., Ståhle, M. Transition from inflammation to proliferation: A critical step during wound healing. Cell Mol Life Sci. 73 (20), 3861-3885 (2016).
- Szpaderska, A. M., DiPietro, L. A. Inflammation in surgical wound healing: Friend or foe. Surgery. 137 (5), 571-573 (2005).
- Hamed, E., Al Balah, O. F. A., Refaat, M., Badr, A. M., Afifi, A. Photodynamic therapy mediated by methylene blue-loaded PEG accelerates skin mouse wound healing: An immune response. Lasers in Med Sci. 39 (1), 141 (2024).
- Ibraheem, W. I., et al. Comparison of digital planimetry and ruler methods for the measurement of extraction socket wounds. Medicina (Kaunas). 59 (1), 135 (2023).
- Mayrovitz, H. N., Soontupe, L. B. Wound areas by computerized planimetry of digital images: accuracy and reliability. Wounds. 22 (5), 222-229 (2009).
- Galiano, R. D., Michaels, J., Dobryansky, M., Levine, J. P., Gurtner, G. C. Quantitative and reproducible murine model of excisional wound healing. Wound Repair Regen. 12 (4), 485-495 (2004).
- Price, A., Grey, J. E., Patel, G. K., Cbe, K. G. H. . ABC of wound healing. , 0470658975 (2022).
- Eming, S. A., Krieg, T., Davidson, J. M. Inflammation in wound repair: Molecular and cellular mechanisms. J Invest Dermatol. 127 (3), 514-525 (2007).
- Carmeliet, P. Angiogenesis in life, disease and medicine. Nature. 438 (7070), 932-936 (2005).
- López, N., Cervero, S., Jiménez, M. J., Sanchez, J. F. Cellular characterization of wound exudate as a predictor of wound healing phases. Wounds. 26 (4), 101-107 (2014).
- Liu, N. T., et al. Quantifying the effects of wound healing risk and potential on clinical measurements and outcomes of severely burned patients: A data-driven approach. Burns. 46 (2), 303-313 (2020).
- Han, C., Barakat, M., DiPietro, L. A. Angiogenesis in wound repair: Too much of a good thing. Cold Spring Harb Perspect Biol. 14 (10), a041225 (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon