Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Planimetría digital para evaluar la cinética de cierre de heridas en un modelo de ratón
En este artículo
Resumen
Las heridas representan un desafío para la salud mundial. Este estudio desarrolló un fotomatón estandarizado que utiliza planimetría digital para minimizar la variabilidad de la medición de heridas. El seguimiento de las heridas en ratones durante 14 días reveló un aumento inicial en el área y el perímetro de la herida, seguido de un cierre gradual. Esta metodología puede ayudar a evaluar la cinética de cierre de heridas en modelos preclínicos.
Resumen
Las heridas crónicas, debido a su alta prevalencia, son un grave problema de salud mundial. Las estrategias terapéuticas eficaces pueden acelerar significativamente la curación, reduciendo así el riesgo de complicaciones y aliviando la carga económica de los sistemas sanitarios. Aunque numerosos estudios experimentales han investigado la cicatrización de heridas, la mayoría se basan en observaciones cualitativas o mediciones directas cuantitativas. El objetivo de este estudio fue estandarizar un método de medición de heridas indirectas utilizando planimetría digital, incorporando escalamiento y segmentación digital. Este enfoque aborda la falta de metodologías detalladas y paso a paso para una evaluación precisa de las heridas. Se diseñó y construyó una cabina de fotodocumentación, y se emplearon herramientas de planimetría digital asistida por computadora para minimizar la variabilidad en las mediciones del área de la herida, el perímetro y la distancia desde el centro de la herida hasta sus bordes. Se creó una herida traumática circular (5 mm de diámetro) en la línea media dorsal a nivel del omóplato de ratones machos CD1 (n = 4, 10 semanas de edad, 30-35 g). La evolución de la herida se fotodocumentó durante 14 días utilizando el fotomatón diseñado a medida, que controló las condiciones de iluminación, la distancia focal y la posición del sujeto. Las mediciones de raspado y heridas se realizaron mediante segmentación en el software ImageJ, y el análisis estadístico se realizó mediante el software de análisis estadístico. La cinética de cierre de la herida mostró un ligero aumento en el tamaño y el perímetro de la herida entre el día 0 y el día 2, seguido de una disminución gradual hasta el cierre completo el día 14. La cabina de fotodocumentación y la planimetría digital asistida por ordenador permitieron realizar mediciones cuantitativas con una variabilidad mínima. En conclusión, estas herramientas proporcionan un método fiable y reproducible para evaluar la cinética de cierre de heridas en modelos preclínicos.
Introducción
La cicatrización de heridas traumáticas tarda aproximadamente 21 días y tiene una secuencia bien definida de cuatro fases distintas: (1) hemostasia, (2) inflamación, (3) proliferación y (4) remodelación1. Si alguna fase de la cicatrización de la herida se prolonga, puede conducir al desarrollo de heridas crónicas1. Debido a su alta prevalencia, posibles complicaciones2 y una importante carga económica, se consideran un problema de salud mundial.
Los estudios preclínicos tienen como objetivo lograr una cicatrización más rápida al promover la reepitelización integral de la herida 3,4,5, prevenir complicaciones y reducir los costos del tratamiento. Estos estudios evalúan diversas estrategias, incluyendo el desarrollo de biomateriales, intervenciones farmacológicas y otros procedimientos de medicina regenerativa 6,7,8,9.
Se han desarrollado múltiples modelos experimentales para el estudio de las heridas traumáticas. Algunos se centran en las características cualitativas macroscópicamente visibles, como el tamaño, los indicadores de inflamación, la presencia de tejido de granulación, las secreciones y la formación de costras5. Otros analizan datos cuantitativos, como el área, el perímetro, el radio, el diámetro, el color, la profundidad y las distancias desde el centro hasta los bordes de las heridas.
En este sentido, la mayoría de las investigaciones in vivo miden directamente el radio y la profundidad de la herida. Sin embargo, la delineación manual de los bordes de la herida en una imagen macroscópica puede introducir sesgos en la medición10. Otros estudios utilizan planimetría mecánica, utilizando láminas de plástico cuadriculadas transparentes, donde se delinean previamente los bordes de la bobina; En ambos casos, la obtención del área o perímetro requiere de instrumentos manuales como reglas o planímetros digitales. Hoy en día, la planimetría digital asistida por ordenador permite el análisis computarizado de imágenes macroscópicas de heridas o láminas de plástico. La manipulación in situ y la calidad de la imagen macroscópica son una limitación, sin embargo, esta herramienta 11,12,13,14 reduce considerablemente la variabilidad entre las mediciones de área y perímetro.
Esta metodología propuesta ofrece ventajas significativas sobre las técnicas existentes para evaluar el cierre de heridas en ratones 15,16,17,18,19,20. Si bien la documentación fotográfica se ha considerado una herramienta precisa y consistente para evaluar la cinética de cierre de heridas, estudios previos21,22 han destacado las limitaciones de la medición manual de heridas, como el sesgo del observador y la variabilidad debido a la iluminación y el posicionamiento inconsistentes de la cámara. El enfoque actual aborda estos problemas mediante la estandarización de las condiciones de imagen a través de una cabina personalizada, lo que mejora la reproducibilidad y la precisión. Además, la planimetría digital computarizada permite evaluaciones cuantitativas más precisas, mejorando la evaluación de las intervenciones terapéuticas y minimizando los errores de medición, como se evidencia en otros estudios que comparan técnicas manuales y digitales12,22, lo que la hace particularmente adecuada para estudios de cinética de cierre de heridas en modelos murinos, permitiendo una evaluación precisa de los tratamientos al mantener un control estricto sobre las condiciones de adquisición de imágenes.
Protocolo
Todos los procedimientos experimentales con ratones de laboratorio se llevaron a cabo de acuerdo con las normas éticas y regulaciones establecidas en la Norma Oficial Mexicana (NOM-062-ZOO-1999) para el manejo y cuidado de animales de laboratorio. El protocolo fue revisado y aprobado por el Comité Interno para el Cuidado y Uso de Animales de Laboratorio (CICUAL) del Instituto Nacional de Investigaciones Nucleares (ININ) bajo el número de referencia CICUAL-01-23. En este estudio se utilizaron ratones machos CD1 (n = 4), de 10 semanas de edad, con un peso corporal que osciló entre 28 y 32 g. Todos los animales fueron seleccionados para asegurar la uniformidad en la cepa, edad, sexo y peso corporal, minimizando la variabilidad en los resultados experimentales. Los detalles de los reactivos y el equipo utilizado se enumeran en la Tabla de Materiales.
1. Construcción de fotomatón para la adquisición de imágenes macroscópicas
NOTA: Se utilizó el software con licencia SolidWorks (versión 2015) para diseñar un fotomatón con el fin de eliminar las fuentes de iluminación externas. Se construyó un cubo de 40 cm × 40 cm utilizando un perfil de aluminio blanco de una pulgada de grosor. El cubo constaba de tres secciones, ensambladas secuencialmente: el techo, las paredes laterales y el suelo (Figura 1A).
- Construcción de tejados
NOTA: El techo se regionalizó como borde delantero (A), borde trasero (B) y bordes laterales (C y D) para orientarse (Figura 1B).- Fije en el área interna del borde lateral del techo (C y D) un perfil de aluminio ranurado (diseñado para sostener vidrio) de 1,5 cm de ancho, 2,51 cm de espesor y 34,9 cm de largo (Figura 1B).
- Coloque dos placas rectangulares de aluminio de 34,5 cm de largo x 13 cm de ancho con polietileno en el centro en la ranura de cada perfil de techo (Placa 1 y 2 en la Figura 1C) para permitir el deslizamiento a través de la ranura de ambos perfiles.
- Instale un tubo de luz LED RGB de 20 cm con un rango de temperatura de color de 2500-9000 K (Figura 1C) en un ángulo de 45° en el borde inferior del panel 1 con cinta adhesiva de doble cara.
- Monte en los paneles de techo 1 y 2 un panel rectangular de tablero de espuma de 32 cm x 12 cm con un recorte circular central de 7,82 cm de diámetro para permitir la instalación de la lente de la cámara (Figura 1C).
- Construcción del suelo
- Coloque una pieza cuadrada de tablero de espuma blanca de 40 cm x 40 cm encima de los perfiles del área del piso. Corte cuadrados con una longitud lateral de 2,54 cm de cada esquina del tablero de espuma (Figura 1E).
- Construcción de muros laterales
- Corta cuatro paneles cuadrangulares de cartón pluma de 40 cm x 40 cm.
- Pegue dos paneles con silicona en los lados C y D para formar las paredes laterales izquierda y derecha (Figura 1F).
- Fije las tiras de cierre de gancho y bucle a los perfiles de aluminio A y B para facilitar la manipulación de los elementos internos del fotomatón. Además, fije a 1 cm del borde de una línea de sujetadores adhesivos a dos cuadrados de cartón espuma en un lado y colóquelos en las paredes delantera y trasera (Figura 1F).
- Construcción de la base de referencia
NOTA: Fue necesaria una base de referencia para mantener al ratón en posición prona durante la anestesia y durante toda la documentación de la evolución de la herida. Los componentes 3D se diseñaron y fabricaron utilizando la técnica de Modelado por Deposición Fundida (FDM) con material PLA y una impresora 3D 23,24.- Imprime en 3D la mascarilla con una base de 2 cm de ancho, largo y alto y colócala a 11,5 cm del borde de un rectángulo de cartón pluma blanco precortado de 40 cm x 28 cm para mantener a los ratones bajo anestesia inhalatoria (Figura 1D, color rojo).
- Imprime en 3D la plataforma rectangular (9 cm de largo, 5 cm de ancho, 2,5 cm de alto) con cuatro áreas extruidas para alinear el dorso del ratón durante la adquisición de la imagen. Estas áreas sostenían la cabeza, las extremidades y la región abdominal para mantener la posición prona. Pegue esta plataforma al centro de la base de referencia (Figura 1D, color verde).
- Imprima en 3D el bloque de la regla (2 cm de ancho, 8 cm de largo, 2,5 cm de alto) y fíjelo a 1 cm del lado izquierdo de la base del ratón para colocar el elemento de referencia de medición necesario para el procesamiento digital de la imagen (Figura 1D, color azul).
- Coloque una regla graduada de acero inoxidable de 15 cm en el bloque de la regla e instale toda la base de referencia dentro de la cabina para escalar la imagen (Figura 1D).

Figura 1: Diagrama para la construcción del gabinete de adquisición de imágenes macroscópicas. (A) Secciones de la cabina (techo, paredes laterales, piso). (B)Orientación de los perfiles que forman la cubierta; delantero (A), trasero (B) y laterales (lado interior de los perfiles en rojo "C,D"). (C) Paneles de techo 1 y 2, instalación del tubo de luz LED, placa de lente de la cámara e instalación en el piso. (D) Instalación de la máscara de anestesia (ROJA), la plataforma del ratón (VERDE) y la plataforma rectangular para el posicionamiento de la regla de medición (AZUL) en la base de referencia. (E) Ubicación final de la base de referencia. (F) Instalación de paredes laterales, frontales y traseras. Haga clic aquí para ver una versión más grande de esta figura.
2. Mantenimiento de animales
- Obtener la autorización del comité de bioética de la institución para la experimentación con animales. Utilice ratones CD1 (n = 4), de 10 semanas de edad, con un peso de 28-32 g.
- Aloje a los ratones en condiciones estándar: mantener una temperatura de 21 °C, ciclos de luz/oscuridad de 12/12 h, 45% de humedad y proporcionar acceso ad libitum al agua y a los alimentos, excepto durante las sesiones de fotodocumentación.
3. Generación de heridas traumáticas
- Ayuna a los ratones durante 8 h antes del procedimiento. Anestesiar a los ratones con pentobarbital sódico intraperitoneal a 65 mg/kg25 (siguiendo protocolos aprobados institucionalmente).
- Confirme la profundidad de la anestesia comprobando la falta de reflejo de retirada durante un pellizco interdigital. Aplique ungüento oftálmico en los ojos para prevenir la sequedad durante la anestesia. Mantener los ratones a una temperatura estable de 37 °C durante la cirugía y la recuperación (20 min).
- Coloque el ratón en posición de decúbito ventral y depílelo caudalmente en un área de 2,5 cm x 3 cm de la región cervical con cuchillas quirúrgicas. Estirar la piel para evitar laceraciones. Realizar asepsia y antisepsia alternando enjuagues con povidona yodada y agua estéril.
- Utilice un punzón de biopsia estéril de 5 mm y aplique presión con movimientos circulares para crear una incisión dermoepidérmica a nivel del omóplato. Retire el colgajo con pinzas dentadas y corte con unas tijeras con punta de iris (Figura 2A).
- En caso de presencia de puntos sangrantes en la herida, aplique una descarga eléctrica con un dispositivo de electrocauterización para lograr la hemostasia.
- Coloque una película dérmica circular de 1 cm de diámetro sobre la herida con pinzas Jeweler para evitar la contaminación y la contracción.
- Realizar todas las cirugías de supervivencia en condiciones estériles. Prepare el sitio quirúrgico con desinfectantes como povidona yodada. Use guantes estériles y una mascarilla, y mantenga la esterilidad durante todo el procedimiento mediante el uso de instrumentos estériles y minimizando el contacto con superficies no estériles.
- Después de la cirugía, coloque a los ratones en jaulas individuales a 24 °C y manténgalos monitoreados hasta que recuperen la conciencia suficiente para mantener la posición esternal. Asegúrese de controlar la temperatura corporal durante y después de la cirugía para prevenir la hipotermia mediante el uso de fuentes de calor externas.
- Administrar analgesia hasta el día 4 diluyendo ketorolaco en agua de bebida a 5 mg/kg26.
- Después de 14 días, cuando las heridas en roedores sanos suelen alcanzar etapas avanzadas de curación, se sacrifica a los ratones mediante un reemplazo deO2 en una cámara de CO2 siguiendo los estándares internacionales. Esto marca el punto final del estudio.
4. Adquisición de imágenes macroscópicas
- Capture imágenes de las heridas diariamente durante 14 días consecutivos para monitorear la cinética continua del cierre de la herida. Utilice una cámara semiprofesional o profesional; Coloque la lente a través de la abertura circular en el techo del fotomatón.
NOTA: Ajuste el horario según sea necesario en función de las condiciones experimentales. - Utilice un tubo de luz LED RGB en modo de temperatura de color correlacionada (CCT), ajustado a 9000 K y 100% de brillo para la iluminación.
- Coloque la base de referencia en el centro del suelo del fotomatón.
- Coloque al ratón en la cámara de anestesia inhalada durante 3 min (Figura 2B).
- Después de inducir la anestesia, coloque el ratón en posición prona sobre la plataforma del ratón. Asegure el hocico dentro de la máscara de anestesia de sevoflurano, administrando sevoflurano al 5% a un caudal de oxígeno de 1,5 L/min (Figura 2C).
- Antes de capturar imágenes, retire la película dérmica de la herida con pinzas Jeweller y alinee la base de referencia con la lente de la cámara.
- Instale la pared frontal del fotomatón y capture imágenes macroscópicas con los siguientes ajustes: apertura f/3.2, tiempo de exposición 1/200s, velocidad ISO 80, distancia focal 4mm.
- Con unas pinzas Jeweller, coloque una película dérmica de 1 cm de diámetro sobre la herida antes de retirar la mascarilla anestésica. Transfiera los ratones a jaulas individuales y observe hasta la recuperación motora.
5. Procesamiento de imágenes
- Genere una copia de seguridad de las imágenes macroscópicas. Procese las imágenes con el software ImageJ.
- Abra la imagen de copia de seguridad en ImageJ siguiendo la ruta: Archivo > Abrir > Buscar en las imágenes, luego haga clic en Abrir.
- Escalar la imagen por referencia: Maximice la imagen, seleccione la herramienta de línea recta , amplíe la regla junto al mouse con la tecla +, dibuje una línea recta de 10 mm en la imagen de la regla, luego vaya a Analizar > Establecer escala > Ingrese " 10" para Distancia conocida > Establecer Unidad de longitud en mm, y luego haga clic en Aceptar. Esto determina la relación píxeles-distancia de la imagen macroscópica (Figura 2D).
- Separe el área de la herida de la imagen: Utilice la herramienta de rectángulo para seleccionar el área alrededor de la herida (w = 150, h = 150). Registre los valores X e Y, haga clic con el botón derecho en el rectángulo > Duplicar > Asigne un nombre al asunto > presione Enter. En la nueva imagen, presione + dos veces para acercar (Figura 2E).
- Guarde la imagen recortada siguiendo la ruta: Archivo > Guardar como > Tiff > Introduzca el nombre > Guardar.
- Cree un duplicado de la imagen recortada para evitar modificaciones durante la segmentación: Haga clic con el botón derecho en la imagen recortada > Duplicar > asígnele un nombre agregando "Segmentación" al final. A continuación, presione Enter. En la nueva imagen, presione + dos veces para acercar.
- Separe la imagen en canales de color siguiendo esta ruta: Tipo de imagen > > pila RGB. En la imagen del canal rojo (1/3 rojo), haga clic con el botón derecho en Duplicar y presione OK en la ventana Duplicar.
- Segmente la imagen del canal rojo. Haga clic en la imagen del canal rojo, Imagen > Ajustar > umbral. A continuación, seleccione Predeterminado > Aplicar (Figura 2F).
- Rectifique la región de interés (ROI) para garantizar una cobertura completa de la herida y evitar distorsiones en la segmentación.
NOTA: Si las áreas alrededor de la herida no están incluidas en la segmentación, vaya a Procesar > Binario > Rellenar Agujeros. Para eliminar los puntos negros fuera de la herida, vaya a Procesar > Binario > Erosionar. Si el comando Erosionar reduce el tamaño de la herida, corríjalo utilizando Procesar > binario > dilatar. - Marque el perímetro del ROI: Editar > selección > Crear selección. El retorno de la inversión se delineará en amarillo. Agréguelo al Administrador de ROI siguiendo Editar > Selección > Agregar al Administrador (Figura 2G).
- Validar la segmentación: Abra la ventana Administrador de ROI y seleccione el ROI para revisar: Más > Traducir. Introduzca los valores X e Y registrados en el paso 4 y pulse OK.
- Maximiza la imagen original y, a continuación, selecciona el ROI en el Administrador de ROI. Ajuste el ROI con las teclas de flecha hasta que se alinee con la herida (Figura 2H). Si el retorno de la inversión coincide con la herida, la segmentación fue exitosa. De lo contrario, repita desde el paso 2.
- Una vez confirmada la segmentación, obtenga las medidas de la herida: Analizar > Medir. Una tabla de resultados mostrará los valores de área, perímetro y posición X/Y. Copie estos valores en el software SPSS para su documentación y análisis estadístico (Figura 2I).
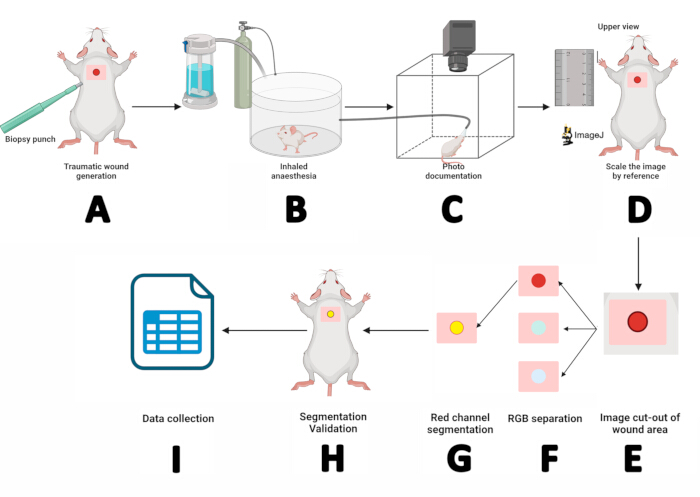
Figura 2: Flujo de trabajo de la medición de heridas mediante planimetría digital y técnicas de segmentación. (A) Incisión dermoepidérmica con un punzón de biopsia estéril de 5 mm. (B) Colocar al ratón en una cámara de anestesia inhalada durante 3 min. (C) Documentación fotográfica colocando el ratón anestesiado en el fotomatón y asegurando su hocico dentro de una máscara de sevoflurano. (D) Abrir la imagen obtenida en ImageJ y escalarla usando la regla como referencia. (E) Extracción del área de la herida con la herramienta de rectángulo. (F) Separar la imagen en canales RGB y procesar el canal rojo. (G) Esbozar y gestionar la región de interés (ROI). (H) Validar la segmentación haciendo coincidir el ROI con la herida. (I) Medición de los parámetros de la herida y registro de los resultados para el análisis estadístico. Haga clic aquí para ver una versión más grande de esta figura.
6. Eutanasia post-procedimiento
NOTA: El estudio concluye después de 14 días, momento en el que las heridas en roedores sanos suelen alcanzar etapas avanzadas de curación. En esta etapa, los ratones fueron sacrificados humanamente siguiendo el procedimiento de eutanasia establecido y aprobado institucionalmente.
- Prepara el equipo. Asegúrese de que la cámara de eutanasia esté limpia, seca y del tamaño adecuado para acomodar a los ratones sin hacinamiento. Conecte la cámara a un suministro deCO2 de grado médico con un regulador de flujo.
- Transfiera suavemente los ratones a la cámara para minimizar el estrés. Asegúrese de que estén en un ambiente tranquilo con mínimas perturbaciones externas.
- Ajuste el caudal de CO2 al 20%-30% del volumen de la cámara por minuto, según lo recomendado por las Directrices de la AVMA para la eutanasia de animales. Aumente gradualmente la concentración deCO2 para evitar inducir angustia o malestar en los ratones.
- Observe a los ratones de cerca durante el procedimiento. Busca signos de pérdida gradual del conocimiento, incluida la disminución de la actividad y la respiración, seguida de apnea y paro cardíaco.
- Confirmar la muerte una vez que los ratones ya no respiran y no muestran signos de movimiento; Espere 1-2 minutos adicionales para asegurar el cese completo de las funciones vitales. Verificar la muerte confirmando la ausencia de reflejos (p. ej., reflejo corneal) y actividad cardíaca.
- Transfiera los cadáveres a los contenedores designados para Desechos Biológicos Peligrosos. Seguir los protocolos institucionales y las directrices nacionales para la disposición segura de los restos de animales.
- Registre el número de animales sacrificados, la fecha y cualquier observación relevante para garantizar el cumplimiento de las normas éticas e institucionales.
Resultados
Después de escalar las imágenes en el software ImageJ, se obtuvo el perímetro promedio (Tabla 1) y el área (Tabla 2) de las heridas, junto con sus respectivas desviaciones estándar, mediante segmentación digital. Estos valores se registraron desde el día cero hasta el día catorce (D0-D14).
<...| Día | Perímetro (mm) |
Discusión
En los modelos preclínicos, el análisis cuantitativo de la evolución de las heridas traumáticas en modelos preclínicos se enfrenta a retos debido a factores como el tamaño de la herida, la respuesta inflamatoria localizada34, la localización y/o la manipulación. Existen métodos de planimetría manual directa36 e indirecta digital 11,16,37,38 para estas mediciones.
Divulgaciones
Los autores declaran que no existen conflictos de intereses relacionados con esta investigación.
Agradecimientos
Los autores agradecen al Consejo Nacional de Humanidades, Ciencias y Tecnologías (CONAHCyT, CVU: 933600) por la subvención para el financiamiento, y al Laboratorio Nacional de Investigación y Desarrollo de Radiofármacos del Instituto Nacional de Investigaciones Nucleares (LANIDER-ININ) por su apoyo. Además, la Figura 2 se preparó con la ayuda del software BioRender (2020), disponible en BioRender.com/p67z056.
Materiales
| Name | Company | Catalog Number | Comments |
| 5 mm Biopsy Punch | MILTEX, USA | 33-35 | To mark the wound edges |
| Aluminum with polyethylene core | Alucobond,USA | Bright Silver 119 | For the construction of the macroscopic Image Acquisition Booth |
| Camera Lens | Sony, Japan | SEL2470Z | To focus the images to photograph |
| Electrocautery | Bonart, USA | ART-E1 | To eliminates bleeding points in the wound if present. |
| Hook and loop fastener strips | VELCRO | ||
| IBM SPSS Statistics Version 22 | IBM Corporation, USA | https://www.ibm.com/analytics/spss-statistics | Used for statistical analysis of wound measurements, including area and perimeter data. |
| ImageJ Version 1.53t | National Institutes of Health, USA | https://imagej.nih.gov/ij/ | Used for processing macroscopic images, including scaling, segmentation, and measurement of wound parameters. |
| Ketorolac | SIEGFRIED RHEIN, Mexico | 493977 | For postoperative pain management |
| Miltex Iris Scissors, 4-1/8" Curved | MILTEX, USA | V95-306 | To cut the wound flap generated with the biopsy punch |
| RGB LED Light Tube | ANDOER, China | B09F8RLMSY | To illuminate the Macroscopic Image Acquisition Booth |
| Semi profesional camera | Sony, Japan | DSC-HX300 | To take the photos |
| Serrated Forceps | MILTEX, USA | V96-118 | To hold the flap during the cut |
| Sevoflurane | Baxter, USA | AMX2L9117PR | For inhaled anaesthesia |
| Sodium Pentobarbital | Aranda, Mexico | 734.448.001.212 | For intraperitoneal anaesthesia |
| SolidWorks Version 2015 | Dassault Systèmes, France | https://www.solidworks.com/ | Used to design and create 3D models for constructing accessories for the photodocumentation booth. |
| Surgical blades | HERGOM, Mexico | H10 | To shave the hair in the area where the wound will be created |
| Transparent Adhesive Dressing | 3M, USA | F51CA07 | To cover the traumatic wound |
Referencias
- Martinengo, L., et al. Prevalence of chronic wounds in the general population: systematic review and meta-analysis of observational studies. Ann Epidemiol. 29, 8-15 (2019).
- Chen, X., Shi, X., Xiao, H., Xiao, D., Xu, X. Research hotspot and trend of chronic wounds: A bibliometric analysis from 2013 to 2022. Wound Repair Regen. 31 (5), 597-612 (2013).
- Gould, L., Li, W. W. Defining complete wound closure: Closing the gap in clinical trials and practice. Wound Repair Regen. 27 (3), 201-224 (2019).
- Baron, J. M., Glatz, M., Proksch, E. Optimal support of wound healing: New insights. Dermatology. 236 (6), 593-600 (2020).
- Tiwari, R., Pathak, K. Local drug delivery strategies towards wound healing. Pharmaceutics. 15 (2), 634 (2023).
- Gupta, B., Agarwal, R., Alam, M. S. Hydrogels for wound healing applications. Biomed Hydrogels. , 184-227 (2011).
- Pastar, I., et al. Pre-clinical models for wound-healing studies. Skin Tissue Models Regen Med. , 223-253 (2018).
- Shen, Z., Zhang, C., Wang, T., Xu, J. Advances in functional hydrogel wound dressings: A Review. Polymers (Basel). 15 (9), 2000 (2000).
- Wong, V. W., Sorkin, M., Glotzbach, J. P., Longaker, M. T., Gurtner, G. C. Surgical approaches to create murine models of human wound healing. J Biomed Biotechnol. 2011, 1-8 (2011).
- Peterson, N., Stevenson, H., Sahni, V. Size matters: How accurate is clinical estimation of traumatic wound size. Injury. 45 (1), 232-236 (2014).
- Öien, R. F., Håkansson, A., Hansen, B. U., Bjellerup, M. Measuring the size of ulcers by planimetry: a useful method in the clinical setting. J Wound Care. 11 (5), 165-168 (2002).
- Rogers, L. C., Bevilacqua, N. J., Armstrong, D. G., Andros, G. Digital planimetry results in more accurate wound measurements: a comparison to standard ruler measurements. J Diabetes Sci Technol. 4 (4), 799-802 (2010).
- Shamata, A., Thompson, T. Documentation and analysis of traumatic injuries in clinical forensic medicine involving structured light three-dimensional surface scanning versus photography. J Forensic Leg Med. 58, 93-100 (2018).
- Foltynski, P., Ladyzynski, P., Ciechanowska, A., Migalska-Musial, K., Judzewicz, G., Sabalinska, S. Wound area measurement with digital planimetry: Improved accuracy and precision with calibration based on 2 rulers. PLoS One. 10 (8), e0134622 (2015).
- Frank, S., Kämpfer, H. Excisional wound healing. Wound Healing: Methods Protoc. , 3-15 (2003).
- Dunn, L., et al. Murine model of wound healing. J Vis Exp. (75), e50265 (2013).
- Barakat, M., DiPietro, L. A., Chen, L. Limited Treatment options for diabetic wounds: Barriers to clinical translation despite therapeutic success in murine models. Adv Wound Care (New Rochelle). 10 (8), 436-460 (2021).
- Goh, C. C., et al. Inducing ischemia-reperfusion injury in the mouse ear skin for intravital multiphoton imaging of immune responses. J Vis Exp. (118), e54956 (2016).
- Wang, Y., et al. Autologous fat grafting promotes macrophage infiltration to increase secretion of growth factors and revascularization, thereby treating diabetic rat skin defect. Diabetes, Metab Syndr Obes: Targets and Therapy. 13, 4897-4908 (2020).
- Notodihardjo, S. C., et al. A comparison of the wound healing process after the application of three dermal substitutes with or without basic fibroblast growth factor impregnation in diabetic mice. J Plast Reconstr Aesthet Surg. 73 (8), 1547-1555 (2020).
- Thawer, H. A., Houghton, P. E., Woodbury, M. G., Keast, D., Campbell, K. A comparison of computer-assisted and manual wound size measurement. Ostomy Wound Manage. 48 (10), 46-53 (2002).
- Huang, C. X., et al. Comparison of digital and traditional skin wound closure assessment methods in mice. Lab Anim Res. 39 (1), 25 (2023).
- Subramaniam, S. R., et al. 3D printing: Overview of PLA progress. AIP Conf Proc. , 020015 (2019).
- Oleksy, M., Dynarowicz, K., Aebisher, D. Rapid prototyping technologies: 3D printing applied in medicine. Pharmaceutics. 15 (8), 2169 (2023).
- Gómez de Segura, &. #. 1. 9. 3. ;. I. Métodos de anestesia, analgesia y eutanasia. Métodos de anestesia, analgesia y eutanasia. 14, 97-127 (2016).
- Romero-Fernandez, W., et al. El 1, 2, 3 de la experimentación con animales de laboratorio. Rev Peru Med Exp Salud Publica. 33 (2), 288 (2016).
- Cukjati, D., Reberšek, S., Miklavčič, D. A reliable method of determining wound healing rate. Med Biol Eng Comput. 39 (2), 263-271 (2001).
- Payne, W. G., Bhalla, R., Hill, D. P., Pierpont, Y. N., Robson, M. C. Wound healing trajectories to determine pressure ulcer treatment efficacy. Wound Repair Regen. 11, e1 (2011).
- Cardinal, M., Eisenbud, D. E., Phillips, T., Harding, K. Early healing rates and wound area measurements are reliable predictors of later complete wound closure. Wound Repair Regen. 16 (1), 19-22 (2008).
- Tallman, P. Initial rate of healing predicts complete healing of venous ulcers. Arch Dermatol. 133 (10), 1231 (1997).
- Hopkins, N. F. G., Jamieson, C. W. Antibiotic concentration in the exudate of venous ulcers: The prediction of ulcer healing rate. Br J Surg. 70 (9), 532-534 (2005).
- Robson, M. C. Wound healing trajectories as predictors of effectiveness of therapeutic agents. Arch Surg. 135 (7), 773 (2000).
- Jessup, R. L. What is the best method for assessing the rate of wound healing? A comparison of 3 mathematical formulas. Wounds. 19 (3), 138-147 (2006).
- Landén, N. X., Li, D., Ståhle, M. Transition from inflammation to proliferation: A critical step during wound healing. Cell Mol Life Sci. 73 (20), 3861-3885 (2016).
- Szpaderska, A. M., DiPietro, L. A. Inflammation in surgical wound healing: Friend or foe. Surgery. 137 (5), 571-573 (2005).
- Hamed, E., Al Balah, O. F. A., Refaat, M., Badr, A. M., Afifi, A. Photodynamic therapy mediated by methylene blue-loaded PEG accelerates skin mouse wound healing: An immune response. Lasers in Med Sci. 39 (1), 141 (2024).
- Ibraheem, W. I., et al. Comparison of digital planimetry and ruler methods for the measurement of extraction socket wounds. Medicina (Kaunas). 59 (1), 135 (2023).
- Mayrovitz, H. N., Soontupe, L. B. Wound areas by computerized planimetry of digital images: accuracy and reliability. Wounds. 22 (5), 222-229 (2009).
- Galiano, R. D., Michaels, J., Dobryansky, M., Levine, J. P., Gurtner, G. C. Quantitative and reproducible murine model of excisional wound healing. Wound Repair Regen. 12 (4), 485-495 (2004).
- Price, A., Grey, J. E., Patel, G. K., Cbe, K. G. H. . ABC of wound healing. , 0470658975 (2022).
- Eming, S. A., Krieg, T., Davidson, J. M. Inflammation in wound repair: Molecular and cellular mechanisms. J Invest Dermatol. 127 (3), 514-525 (2007).
- Carmeliet, P. Angiogenesis in life, disease and medicine. Nature. 438 (7070), 932-936 (2005).
- López, N., Cervero, S., Jiménez, M. J., Sanchez, J. F. Cellular characterization of wound exudate as a predictor of wound healing phases. Wounds. 26 (4), 101-107 (2014).
- Liu, N. T., et al. Quantifying the effects of wound healing risk and potential on clinical measurements and outcomes of severely burned patients: A data-driven approach. Burns. 46 (2), 303-313 (2020).
- Han, C., Barakat, M., DiPietro, L. A. Angiogenesis in wound repair: Too much of a good thing. Cold Spring Harb Perspect Biol. 14 (10), a041225 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados