JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
마우스 모델에서 상처 봉합 동역학을 평가하기 위한 디지털 플레니메트리
요약
상처는 전 세계적인 보건 문제를 나타냅니다. 이 연구는 상처 측정 변동성을 최소화하기 위해 디지털 플레니메트리를 활용한 표준화된 사진 부스를 개발했습니다. 14일 동안 생쥐의 상처를 모니터링한 결과, 처음에는 상처 부위와 둘레가 증가한 후 점차 봉합되는 것으로 나타났습니다. 이 방법론은 전임상 모델에서 상처 봉합 동역학을 평가하는 데 도움이 될 수 있습니다.
초록
만성 상처는 유병률이 높기 때문에 전 세계적으로 심각한 건강 문제를 야기합니다. 효과적인 치료 전략은 치유를 크게 가속화하여 합병증의 위험을 줄이고 의료 시스템에 대한 경제적 부담을 완화할 수 있습니다. 수많은 실험 연구가 상처 치유에 대해 조사했지만 대부분은 정성적 관찰 또는 정량적 직접 측정에 의존합니다. 이 연구의 목적은 디지털 스케일링 및 세분화를 통합한 디지털 플레니메트리를 사용하여 간접 상처 측정 방법을 표준화하는 것이었습니다. 이 접근법은 정확한 상처 평가를 위한 세부적이고 단계적인 방법론의 부족을 해결합니다. 사진 기록 부스가 설계 및 건설되었으며, 상처 부위, 둘레 및 상처 중심에서 가장자리까지의 거리 측정의 변동성을 최소화하기 위해 컴퓨터 지원 디지털 플리메닛 도구가 사용되었습니다. 수컷 CD1 마우스(n = 4, 10주령, 30-35g)의 견갑골 수준에서 등쪽 정중선에 원형 외상성 상처(직경 5mm)가 생성되었습니다. 상처 진화는 조명 조건, 초점 거리 및 피사체 위치를 제어하는 맞춤형으로 설계된 사진 부스를 사용하여 14일 동안 사진으로 기록되었습니다. 스케일링 및 상처 측정은 ImageJ 소프트웨어의 분할을 사용하여 수행되었으며 통계 분석은 통계 분석 소프트웨어를 사용하여 수행되었습니다. 상처 봉합의 역학은 0일째와 2일 사이에 상처 크기와 둘레가 약간 증가한 후 14일째에 완전히 봉합될 때까지 점진적으로 감소하는 것으로 나타났습니다. 사진 기록 부스와 컴퓨터 지원 디지털 플레니메트리를 통해 최소한의 변동성으로 정량적 측정이 가능했습니다. 결론적으로, 이러한 도구는 전임상 모델에서 상처 봉합 역학을 평가하기 위한 신뢰할 수 있고 재현 가능한 방법을 제공합니다.
서문
외상성 상처 치유는 약 21일이 소요되며 (1) 지혈, (2) 염증, (3) 증식, (4) 리모델링1의 4단계로 잘 정의된 순서로 진행됩니다. 상처 치유 단계가 길어지면 만성 상처가 발생할 수 있다1. 높은 유병률, 잠재적인 합병증2 및 상당한 경제적 부담으로 인해 전 세계적인 건강 문제로 간주된다.
전임상 연구는 포괄적인 상처 재상피화(re-epithelialization)를 촉진하고3,4,5 합병증을 예방하며, 치료 비용을 절감함으로써 더 빠른 치유를 달성하는 것을 목표로 한다. 이러한 연구는 생체 재료 개발, 약리학적 중재 및 기타 재생 의학 절차를 포함한 다양한 전략을 평가합니다 6,7,8,9.
외상성 상처 연구를 위해 여러 실험 모델이 개발되었습니다. 일부는 크기, 염증 지표, 육아 조직의 존재, 분비물 및 딱지 형성과 같은 거시적으로 볼 수 있는 질적 특성에 초점을 맞춥니다5. 다른 사람들은 면적, 둘레, 반경, 직경, 색상, 깊이 및 상처 중심에서 가장자리까지의 거리를 포함한 정량적 데이터를 분석합니다.
이와 관련하여, 대부분의 생체 내 연구는 상처 반경과 깊이를 직접 측정합니다. 그러나, 거시적 이미지에서 상처 가장자리를 수동으로 묘사하는 것은 측정10에 편향을 도입할 수 있습니다. 다른 연구에서는 투명 격자 플라스틱 시트를 사용하여 감긴 가장자리가 미리 묘사되어 있는 기계적 플레니메트리를 사용합니다. 두 경우 모두 면적 또는 둘레를 얻으려면 눈금자 또는 디지털 평면계와 같은 수동 도구가 필요합니다. 요즘에는 컴퓨터 보조 디지털 플레니메트리를 통해 상처나 플라스틱 시트의 거시적 이미지를 컴퓨터적으로 분석할 수 있습니다. 현장 조작 및 거시적 이미지의 품질은 한계이지만, 이 도구(11,12,13,14)는 면적과 둘레 측정 사이의 변동성을 상당히 감소시킵니다.
이 제안된 방법론은 마우스 15,16,17,18,19,20에서 상처 봉합을 평가하기 위한 기존 기술에 비해 상당한 이점을 제공합니다. 사진 기록은 상처 봉합 동역학을 평가하기 위한 정확하고 일관된 도구로 간주되어 왔지만, 이전 연구에서는 관찰자 편향 및 일관되지 않은 조명 및 카메라 위치로 인한 가변성과 같은 수동 상처 측정의 한계를 강조했습니다. 현재 접근 방식은 맞춤형 부스를 통해 이미징 조건을 표준화하여 재현성과 정밀도를 개선함으로써 이러한 문제를 해결합니다. 또한, 컴퓨터화된 디지털 플라니메트리는 보다 정확한 정량적 평가를 가능하게 하여 치료 개입의 평가를 강화하고 측정 오류를 최소화하며, 수동 및 디지털 기법을 비교하는 다른 연구에서 입증된 바와 같이12,22 쥐 모델의 상처 봉합 동역학 연구에 특히 적합하며, 이미지 획득 조건에 대한 엄격한 제어를 유지함으로써 치료의 정확한 평가를 가능하게 합니다.
프로토콜
실험용 쥐와 관련된 모든 실험 절차는 실험용 동물의 취급 및 관리에 대한 멕시코 공식 표준(NOM-062-ZOO-1999)에 제정된 윤리적 기준 및 규정에 따라 수행되었습니다. 이 프로토콜은 미국 국립핵연구소(ININ)의 실험동물 관리 및 사용 내부 위원회(CICUAL)에서 검토 및 승인되었습니다(참조 번호 CICUAL-01-23). 이 연구에는 체중이 28-32g 인 10 주 된 수컷 CD1 마우스 (n = 4)가 사용되었습니다. 모든 동물은 변형률, 연령, 성별 및 체중의 균일성을 보장하고 실험 결과의 변동성을 최소화하기 위해 선택되었습니다. 시약 및 사용된 장비에 대한 자세한 내용은 재료 표에 나열되어 있습니다.
1. 거시적 이미지 획득을 위한 포토 부스 공사
참고: 사용권이 부여된 SolidWorks 소프트웨어(버전 2015)는 외부 광원을 제거하기 위해 사진 부스를 설계하는 데 사용되었습니다. 40cm × 40cm 큐브는 1인치 두께의 흰색 알루미늄 프로파일을 사용하여 구성되었습니다. 큐브는 지붕, 측벽 및 바닥의 세 부분으로 구성되었습니다 (그림 1A).
- 지붕 공사
참고: 지붕은 방향을 정하기 위해 앞쪽 가장자리(A), 뒤쪽 가장자리(B) 및 측면 가장자리(C 및 D)로 지역화되었습니다(그림 1B).- 지붕의 측면 가장자리 내부 영역(C 및 D)에 너비 1.5cm, 두께 2.51cm, 길이 34.9cm의 홈이 있는 알루미늄 프로파일(유리를 고정하도록 설계됨)을 고정합니다(그림 1B).
- 각 지붕 프로파일( 그림 1C의 플레이트 1 및 2)의 홈에 중앙에 폴리에틸렌이 있는 34.5cm x 13cm 너비의 직사각형 알루미늄 플레이트 두 개를 배치하여 두 프로파일의 홈을 통해 미끄러질 수 있도록 합니다.
- 양면 테이프를 사용하여 패널 20의 아래쪽 가장자리에 2500-9000K(그림 1C)의 45° 각도로 색온도 범위의 1cm RGB LED 튜브 조명을 설치합니다.
- 카메라 렌즈를 설치할 수 있도록 중앙에 직경 7.82cm의 원형 컷아웃이 있는 32cm x 12cm 직사각형 폼 보드 패널인 지붕 패널 1 및 2에 장착합니다(그림 1C).
- 바닥의 건설
- 바닥 면적 프로파일 위에 40cm x 40cm 정사각형의 흰색 폼 보드를 놓습니다. 폼 보드의 각 모서리에서 한 변 길이가 2.54cm인 사각형을 자릅니다(그림 1E).
- 측벽의 건설
- 40cm x 40cm 사각형 폼 보드 패널 4개를 자릅니다.
- C면과 D면에 실리콘으로 두 패널을 붙여서 왼쪽과 오른쪽 벽을 형성합니다(그림 1F).
- 후크 및 루프 패스너 스트립을 알루미늄 프로파일 A와 B에 부착하여 내부 포토 부스 요소를 쉽게 조작할 수 있습니다. 또한 접착 패스너 라인의 가장자리에서 1cm를 한쪽에 있는 두 개의 폼 판지 사각형에 부착하고 전면 및 후면 벽에 배치합니다(그림 1F).
- 기준 기반의 구성
참고: 마취 중과 상처 진화에 대한 문서화 전반에 걸쳐 마우스를 엎드린 자세로 유지하기 위해 참조 기반이 필요했습니다. 3D 구성 요소는 PLA 재료 및 3D 프린터와 함께 FDM(Fused Deposition Modeling) 기술을 사용하여 설계 및 제작되었습니다23,24.- 바닥의 너비, 길이 및 높이가 2cm인 마스크를 3D 프린팅하고 미리 절단된 40cm x 28cm 흰색 폼 보드 직사각형의 가장자리에서 11.5cm 떨어진 곳에 배치하여 마우스가 흡입 마취 상태를 유지합니다(그림 1D, 빨간색).
- 4개의 돌출 영역이 있는 직사각형 플랫폼(길이 9cm, 너비 5cm, 높이 2.5cm)을 3D 프린팅하여 이미지 획득 중에 마우스 등쪽을 정렬합니다. 이 부위는 엎드린 자세를 유지하기 위해 머리, 팔다리, 복부 부위를 지지했습니다. 이 플랫폼을 기준 베이스의 중앙에 붙입니다(그림 1D, 녹색).
- 눈금자 블록(폭 2cm, 길이 8cm, 높이 2.5cm)을 3D 프린팅하고 마우스 베이스의 왼쪽에서 1cm 떨어진 곳에 고정하여 디지털 이미지 처리에 필요한 측정 참조 요소를 배치합니다(그림 1D, 파란색).
- 15cm 스테인리스 스틸 눈금자를 눈금자 블록에 부착하고 이미지 크기 조정을 위해 캐빈 내부에 전체 참조 베이스를 설치합니다(그림 1D).

그림 1: 거시적 이미지 획득 캐비닛의 구성 다이어그램. (A) 캐빈의 섹션(지붕, 측벽, 바닥). (나)지붕을 형성하는 프로파일의 방향; 전면(A), 후면(B) 및 측면(빨간색 "C,D"로 표시된 프로파일의 내부). (C) 지붕 패널 1 및 2, LED 조명 튜브 설치, 카메라 렌즈 플레이트 및 바닥 설치. (D) 기준 베이스에 측정 눈금자(BLUE)를 배치하기 위한 마취 마스크(RED), 마우스 플랫폼(GREEN) 및 직사각형 플랫폼 설치. (E) 참조 기준의 최종 위치입니다. (F) 측면, 전면 및 후면 벽의 설치. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 동물 관리
- 동물 실험에 대해 기관의 생명윤리위원회로부터 승인을 받습니다. 생후 10주, 체중 28-32g의 CD1 마우스(n = 4)를 사용합니다.
- 표준 조건에서 마우스를 수용합니다: 21°C의 온도, 12/12시간의 명암 주기, 45% 습도를 유지하고 사진 기록 세션 중을 제외하고 물과 음식에 대한 임시로 접근할 수 있습니다.
3. 외상성 상처 발생
- 시술 전 8시간 동안 마우스를 단식시킵니다. 복강내 펜토바르비탈 나트륨으로 마우스를 65mg/kg25 로 마취합니다(기관에서 승인된 프로토콜에 따름).
- 인터디지탈 핀치 동안 금단 반사가 부족한지 확인하여 마취 깊이를 확인합니다. 마취 중 건조를 방지하기 위해 눈에 안과 연고를 바르십시오. 수술 및 회복(20분) 동안 마우스를 37°C의 안정적인 온도로 유지합니다.
- 마우스를 복부 욕창 위치에 놓고 수술용 칼날을 사용하여 경추 부위에서 꼬리 방향으로 2.5cm x 3cm 영역을 제모합니다. 열상을 방지하기 위해 피부를 펴십시오. 포비돈, 요오드, 멸균 물 헹굼을 번갈아 사용하여 무균 및 방부제를 수행합니다.
- 멸균 5mm 생검 펀치를 사용하고 원을 그리며 압력을 가하여 견갑골 수준에서 피부-표피 절개를 만듭니다. 톱니 모양의 집게로 덮개를 제거하고 홍채 끝 가위로 자릅니다(그림 2A).
- 상처에 출혈 지점이 있는 경우 전기 소작 장치로 전기 충격을 가하여 지혈을 달성하십시오.
- 오염과 수축을 방지하기 위해 Jeweler 집게를 사용하여 상처 위에 직경 1cm의 원형 피부 필름을 놓습니다.
- 멸균 상태에서 모든 생존 수술을 수행합니다. 포비돈 요오드와 같은 소독제로 수술 부위를 준비하십시오. 멸균 장갑과 마스크를 착용하고 멸균 기구를 사용하고 비멸균 표면과의 접촉을 최소화하여 시술 내내 멸균 상태를 유지하십시오.
- 수술 후 쥐를 24°C의 개별 케이지에 놓고 흉골 위치를 유지할 수 있을 만큼 충분한 의식을 회복할 때까지 모니터링합니다. 외부 열원을 사용하여 저체온증을 예방하기 위해 수술 중과 수술 후에 체온을 조절하십시오.
- 케토롤락을 음용수에 5mg/kg으로 희석하여 4일째까지 진통제를 투여합니다26.
- 14일 후, 건강한 설치류의 상처가 일반적으로 치유의 진행 단계에 도달하면, 국제 표준에 따라 CO2 챔버에서 O2 대체로 마우스를 안락사시킵니다. 이는 스터디의 종료점을 표시합니다.
4. 거시적 이미지 획득
- 연속 14일 동안 매일 상처 이미지를 캡처하여 상처 봉합의 지속적인 동역학을 모니터링합니다. 세미 프로페셔널 또는 프로페셔널 카메라를 사용하십시오. 사진 부스 지붕의 원형 구멍을 통해 렌즈를 배치합니다.
참고: 실험 조건에 따라 필요에 따라 일정을 조정합니다. - 조명을 위해 9000K 및 100% 밝기로 설정된 CCT(Correlated Color Temperature) 모드에서 RGB LED 조명 튜브를 사용합니다.
- 참조 베이스를 사진 부스 바닥의 중앙에 배치합니다.
- 마우스를 흡입 마취실에 3분 동안 놓습니다(그림 2B).
- 마취를 유도한 후 마우스를 마우스 플랫폼에 엎드린 자세로 놓습니다. 세보플루란 마취 마스크 내의 주둥이를 고정하여 1.5L/min의 산소 유속으로 5% 세보플루란을 전달합니다(그림 2C).
- 이미지를 캡처하기 전에 보석상 집게를 사용하여 상처의 피부 필름을 제거하고 기준 베이스를 카메라 렌즈에 맞춥니다.
- 포토 부스의 전면 벽을 설치하고 조리개 f/3.2, 노출 시간 1/200초, ISO 속도 80, 초점 거리 4mm 설정으로 거시적 이미지를 캡처합니다.
- 주얼러 집게를 사용하여 마취 마스크를 제거하기 전에 상처 부위에 직경 1cm의 피부 필름을 놓습니다. 생쥐를 개별 케이지로 옮기고 모터가 회복될 때까지 관찰합니다.
5. 이미지 처리
- 거시적 이미지의 백업 복사본을 생성합니다. ImageJ 소프트웨어를 사용하여 이미지를 처리합니다.
- 이미지에서 File > Open > Search 경로를 따라 ImageJ에서 백업 이미지를 연 다음 Open을 클릭합니다.
- 참조로 이미지 크기 조정: 이미지를 최대화하고, 직선 도구를 선택하고, + 키를 사용하여 마우스 옆의 눈금자를 확대하고, 눈금자 이미지에 10mm 직선을 그린 다음 분석>으로 이동하여 배율 설정을 > 알려진 거리에 대해 "10"을 입력하고 길이 단위를 mm로 > 다음 확인을 클릭합니다. 이것은 거시적 이미지의 픽셀 대 거리 비율을 결정합니다(그림 2D).
- 이미지에서 상처 영역 분리: 사각형 도구를 사용하여 상처 주변 영역을 선택합니다(w = 150, h = 150). X 및 Y 값을 기록하고 사각형을 마우스 오른쪽 버튼으로 클릭하고 Duplicate(복제)>> 이름을 지정한 다음 제목> Enter 키를 누릅니다. 새 이미지에서 +를 두 번 눌러 확대합니다(그림 2E).
- File > Save As > Tiff > Enter the name > Save(저장) 경로를 따라 자른 이미지를 저장합니다.
- 세분화 중 수정을 피하기 위해 자른 이미지의 복제본 만들기: 잘라낸 이미지를 마우스 오른쪽 버튼으로 클릭하고 끝에 "Segmentation"을 추가하여 Duplicate> 이름을 지정합니다> . 그런 다음 Enter 키를 누릅니다. 새 이미지에서 +를 두 번 눌러 확대합니다.
- 이미지 > 유형 > RGB 스택 경로를 따라 이미지를 컬러 채널로 분리합니다. 빨간색 채널 이미지(1/3 빨간색)에서 Duplicate를 마우스 오른쪽 버튼으로 클릭하고 Duplicate 창에서 OK를 누릅니다.
- 빨간색 채널 이미지를 분할합니다. 빨간색 채널 이미지인 Image > Adjust > Threshold를 클릭합니다. 그런 다음 기본값 > 적용을 선택합니다(그림 2F).
- 관심 영역(ROI)을 수정하여 상처 부위를 완벽하게 커버하고 세분화 왜곡을 방지할 수 있습니다.
참고: 상처 주변 영역이 분할에 포함되지 않은 경우 > 이분법 처리 > 구멍 채우기로 이동합니다. 상처 바깥쪽의 검은 점을 제거하려면 Process > Binary > Erode로 이동합니다. Erode 명령이 상처 크기를 줄이면 Process > Binary > Dilate를 사용하여 상처 크기를 수정합니다. - ROI의 경계를 표시합니다: Edit > Selection > Create Selection. ROI는 노란색으로 표시됩니다. Edit > Selection > Add to Manager 에 따라 ROI Manager에 추가합니다(그림 2G).
- 세분화 검증: ROI Manager 창을 열고 검토할 ROI를 선택합니다. 번역 > 자세히 보기. 4단계에서 기록한 X 및 Y 값을 입력하고 OK를 누릅니다.
- 원본 이미지를 최대화한 다음 ROI Manager에서 ROI를 선택합니다. 감긴 부분과 정렬될 때까지 화살표 키를 사용하여 ROI를 조정합니다(그림 2H). ROI가 상처와 일치하면 세분화가 성공한 것입니다. 그렇지 않으면 2단계부터 반복합니다.
- 세분화가 확인되면 상처 측정값을 얻습니다. Analyze > Measure. 결과 테이블에는 영역, 둘레 및 X/Y 위치 값이 표시됩니다. 문서화 및 통계 분석을 위해 이 값을 SPSS 소프트웨어에 복사합니다(그림 2I).
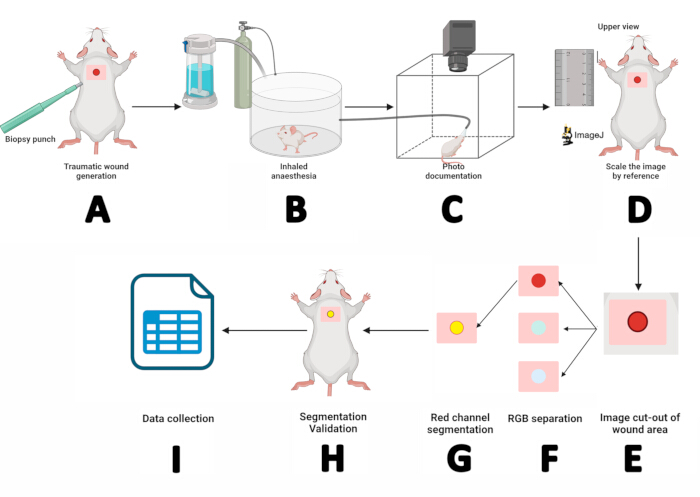
그림 2: 디지털 플레니메트리 및 분할 기술을 사용한 상처 측정 워크플로우. (A) 멸균 5mm 생검 펀치를 사용한 피부-표피 절개. (B) 마우스를 흡입 마취실에 3분 동안 배치.(C) 마취된 마우스를 사진 부스에 배치하고 주둥이를 세보플루란 마스크 내에 고정하여 사진 문서화. (D) 얻은 이미지를 ImageJ에서 열고 눈금자를 참조로 사용하여 크기를 조정합니다. (E) 사각형 도구를 사용하여 상처 부위를 추출합니다. (F) 이미지를 RGB 채널로 분리하고 적색 채널을 처리하는 단계. (G) 관심 영역(ROI)의 개요 및 관리. (H) ROI를 상처와 일치시켜 세분화를 검증합니다. (I) 상처 매개변수를 측정하고 통계 분석을 위해 결과를 기록합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
6. 시술 후 안락사
참고: 이 연구는 14일 후에 종료되며, 이 시점에서 건강한 설치류의 상처는 일반적으로 치유의 고급 단계에 도달합니다. 이 단계에서, 그 쥐들은 확립된 제도적으로 승인된 안락사 절차에 따라 인도적으로 안락사되었다.
- 장비를 준비합니다. 안락사 챔버가 깨끗하고 건조하며 과밀하지 않고 쥐를 수용할 수 있는 적절한 크기인지 확인하십시오. 유량 조절기를 사용하여 챔버를 의료용 CO2 공급 장치에 연결합니다.
- 스트레스를 최소화하기 위해 마우스를 챔버로 부드럽게 옮깁니다. 외부 방해가 최소화된 조용한 환경에 있는지 확인하십시오.
- CO2 유속을 동물 안락사에 대한 AVMA 지침에서 권장하는 대로 분당 챔버 부피의 20%-30%로 설정합니다. 마우스에게 고통이나 불편함을 유발하지 않도록CO2 농도를 점차적으로 증가시킵니다.
- 시술 중에 쥐를 자세히 관찰하십시오. 활동과 호흡 감소를 포함한 점진적인 의식 상실의 징후를 살피고 무호흡 및 심장 마비가 뒤따릅니다.
- 쥐가 더 이상 숨을 쉬지 않고 움직임의 징후를 보이지 않으면 죽음을 확인하십시오. 중요한 기능이 완전히 중단될 때까지 1-2분 더 기다리십시오. 반사 신경(예: 각막 반사)과 심장 활동의 부재를 확인하여 사망을 확인합니다.
- 사체를 지정된 생물학적 유해 폐기물 컨테이너로 옮깁니다. 동물 사체의 안전한 처리를 위한 제도적 프로토콜과 국가 지침을 따르십시오.
- 안락사된 동물의 수, 날짜 및 관련 관찰 사항을 기록하여 윤리적 및 제도적 기준을 준수하는지 확인합니다.
결과
ImageJ 소프트웨어에서 이미지를 확대한 후, 상처의 평균 둘레(표 1)와 면적(표 2)을 각각의 표준 편차와 함께 디지털 분할을 통해 얻었습니다. 이러한 값은 0일차부터 14일차(D0-D14)까지 기록되었습니다.
| 하루 | 둘레 (mm) |
| 0 | 22.75... |
토론
전임상 모델에서 외상성 상처의 진화를 정량적으로 분석하는 것은 상처 크기, 국소 염증 반응34, 위치 및/또는 조작과 같은 요인으로 인해 어려움에 직면해 있습니다. 이러한 측정을 위해 직접 수동36 및 간접 디지털 11,16,37,38 플레니메트리 방법이 존재합니?...
공개
저자는 이 연구와 관련된 이해 상충이 없다고 선언합니다.
감사의 말
저자는 기금 제공을 위한 보조금을 통해 Consejo Nacional de Humanidades, Ciencias y Tecnologías(CONAHCyT, CVU: 933600)와 Laboratorio Nacional de Investigación y Desarrollo de Radiofármacos del Instituto Nacional de Investigaciones Nucleares(LANIDER-ININ)에 감사의 뜻을 전합니다. 또한 그림 2는 BioRender.com/p67z056 에서 사용할 수 있는 BioRender 소프트웨어(2020)의 도움으로 준비되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 5 mm Biopsy Punch | MILTEX, USA | 33-35 | To mark the wound edges |
| Aluminum with polyethylene core | Alucobond,USA | Bright Silver 119 | For the construction of the macroscopic Image Acquisition Booth |
| Camera Lens | Sony, Japan | SEL2470Z | To focus the images to photograph |
| Electrocautery | Bonart, USA | ART-E1 | To eliminates bleeding points in the wound if present. |
| Hook and loop fastener strips | VELCRO | ||
| IBM SPSS Statistics Version 22 | IBM Corporation, USA | https://www.ibm.com/analytics/spss-statistics | Used for statistical analysis of wound measurements, including area and perimeter data. |
| ImageJ Version 1.53t | National Institutes of Health, USA | https://imagej.nih.gov/ij/ | Used for processing macroscopic images, including scaling, segmentation, and measurement of wound parameters. |
| Ketorolac | SIEGFRIED RHEIN, Mexico | 493977 | For postoperative pain management |
| Miltex Iris Scissors, 4-1/8" Curved | MILTEX, USA | V95-306 | To cut the wound flap generated with the biopsy punch |
| RGB LED Light Tube | ANDOER, China | B09F8RLMSY | To illuminate the Macroscopic Image Acquisition Booth |
| Semi profesional camera | Sony, Japan | DSC-HX300 | To take the photos |
| Serrated Forceps | MILTEX, USA | V96-118 | To hold the flap during the cut |
| Sevoflurane | Baxter, USA | AMX2L9117PR | For inhaled anaesthesia |
| Sodium Pentobarbital | Aranda, Mexico | 734.448.001.212 | For intraperitoneal anaesthesia |
| SolidWorks Version 2015 | Dassault Systèmes, France | https://www.solidworks.com/ | Used to design and create 3D models for constructing accessories for the photodocumentation booth. |
| Surgical blades | HERGOM, Mexico | H10 | To shave the hair in the area where the wound will be created |
| Transparent Adhesive Dressing | 3M, USA | F51CA07 | To cover the traumatic wound |
참고문헌
- Martinengo, L., et al. Prevalence of chronic wounds in the general population: systematic review and meta-analysis of observational studies. Ann Epidemiol. 29, 8-15 (2019).
- Chen, X., Shi, X., Xiao, H., Xiao, D., Xu, X. Research hotspot and trend of chronic wounds: A bibliometric analysis from 2013 to 2022. Wound Repair Regen. 31 (5), 597-612 (2013).
- Gould, L., Li, W. W. Defining complete wound closure: Closing the gap in clinical trials and practice. Wound Repair Regen. 27 (3), 201-224 (2019).
- Baron, J. M., Glatz, M., Proksch, E. Optimal support of wound healing: New insights. Dermatology. 236 (6), 593-600 (2020).
- Tiwari, R., Pathak, K. Local drug delivery strategies towards wound healing. Pharmaceutics. 15 (2), 634 (2023).
- Gupta, B., Agarwal, R., Alam, M. S. Hydrogels for wound healing applications. Biomed Hydrogels. , 184-227 (2011).
- Pastar, I., et al. Pre-clinical models for wound-healing studies. Skin Tissue Models Regen Med. , 223-253 (2018).
- Shen, Z., Zhang, C., Wang, T., Xu, J. Advances in functional hydrogel wound dressings: A Review. Polymers (Basel). 15 (9), 2000 (2000).
- Wong, V. W., Sorkin, M., Glotzbach, J. P., Longaker, M. T., Gurtner, G. C. Surgical approaches to create murine models of human wound healing. J Biomed Biotechnol. 2011, 1-8 (2011).
- Peterson, N., Stevenson, H., Sahni, V. Size matters: How accurate is clinical estimation of traumatic wound size. Injury. 45 (1), 232-236 (2014).
- Öien, R. F., Håkansson, A., Hansen, B. U., Bjellerup, M. Measuring the size of ulcers by planimetry: a useful method in the clinical setting. J Wound Care. 11 (5), 165-168 (2002).
- Rogers, L. C., Bevilacqua, N. J., Armstrong, D. G., Andros, G. Digital planimetry results in more accurate wound measurements: a comparison to standard ruler measurements. J Diabetes Sci Technol. 4 (4), 799-802 (2010).
- Shamata, A., Thompson, T. Documentation and analysis of traumatic injuries in clinical forensic medicine involving structured light three-dimensional surface scanning versus photography. J Forensic Leg Med. 58, 93-100 (2018).
- Foltynski, P., Ladyzynski, P., Ciechanowska, A., Migalska-Musial, K., Judzewicz, G., Sabalinska, S. Wound area measurement with digital planimetry: Improved accuracy and precision with calibration based on 2 rulers. PLoS One. 10 (8), e0134622 (2015).
- Frank, S., Kämpfer, H. Excisional wound healing. Wound Healing: Methods Protoc. , 3-15 (2003).
- Dunn, L., et al. Murine model of wound healing. J Vis Exp. (75), e50265 (2013).
- Barakat, M., DiPietro, L. A., Chen, L. Limited Treatment options for diabetic wounds: Barriers to clinical translation despite therapeutic success in murine models. Adv Wound Care (New Rochelle). 10 (8), 436-460 (2021).
- Goh, C. C., et al. Inducing ischemia-reperfusion injury in the mouse ear skin for intravital multiphoton imaging of immune responses. J Vis Exp. (118), e54956 (2016).
- Wang, Y., et al. Autologous fat grafting promotes macrophage infiltration to increase secretion of growth factors and revascularization, thereby treating diabetic rat skin defect. Diabetes, Metab Syndr Obes: Targets and Therapy. 13, 4897-4908 (2020).
- Notodihardjo, S. C., et al. A comparison of the wound healing process after the application of three dermal substitutes with or without basic fibroblast growth factor impregnation in diabetic mice. J Plast Reconstr Aesthet Surg. 73 (8), 1547-1555 (2020).
- Thawer, H. A., Houghton, P. E., Woodbury, M. G., Keast, D., Campbell, K. A comparison of computer-assisted and manual wound size measurement. Ostomy Wound Manage. 48 (10), 46-53 (2002).
- Huang, C. X., et al. Comparison of digital and traditional skin wound closure assessment methods in mice. Lab Anim Res. 39 (1), 25 (2023).
- Subramaniam, S. R., et al. 3D printing: Overview of PLA progress. AIP Conf Proc. , 020015 (2019).
- Oleksy, M., Dynarowicz, K., Aebisher, D. Rapid prototyping technologies: 3D printing applied in medicine. Pharmaceutics. 15 (8), 2169 (2023).
- Gómez de Segura, &. #. 1. 9. 3. ;. I. Métodos de anestesia, analgesia y eutanasia. Métodos de anestesia, analgesia y eutanasia. 14, 97-127 (2016).
- Romero-Fernandez, W., et al. El 1, 2, 3 de la experimentación con animales de laboratorio. Rev Peru Med Exp Salud Publica. 33 (2), 288 (2016).
- Cukjati, D., Reberšek, S., Miklavčič, D. A reliable method of determining wound healing rate. Med Biol Eng Comput. 39 (2), 263-271 (2001).
- Payne, W. G., Bhalla, R., Hill, D. P., Pierpont, Y. N., Robson, M. C. Wound healing trajectories to determine pressure ulcer treatment efficacy. Wound Repair Regen. 11, e1 (2011).
- Cardinal, M., Eisenbud, D. E., Phillips, T., Harding, K. Early healing rates and wound area measurements are reliable predictors of later complete wound closure. Wound Repair Regen. 16 (1), 19-22 (2008).
- Tallman, P. Initial rate of healing predicts complete healing of venous ulcers. Arch Dermatol. 133 (10), 1231 (1997).
- Hopkins, N. F. G., Jamieson, C. W. Antibiotic concentration in the exudate of venous ulcers: The prediction of ulcer healing rate. Br J Surg. 70 (9), 532-534 (2005).
- Robson, M. C. Wound healing trajectories as predictors of effectiveness of therapeutic agents. Arch Surg. 135 (7), 773 (2000).
- Jessup, R. L. What is the best method for assessing the rate of wound healing? A comparison of 3 mathematical formulas. Wounds. 19 (3), 138-147 (2006).
- Landén, N. X., Li, D., Ståhle, M. Transition from inflammation to proliferation: A critical step during wound healing. Cell Mol Life Sci. 73 (20), 3861-3885 (2016).
- Szpaderska, A. M., DiPietro, L. A. Inflammation in surgical wound healing: Friend or foe. Surgery. 137 (5), 571-573 (2005).
- Hamed, E., Al Balah, O. F. A., Refaat, M., Badr, A. M., Afifi, A. Photodynamic therapy mediated by methylene blue-loaded PEG accelerates skin mouse wound healing: An immune response. Lasers in Med Sci. 39 (1), 141 (2024).
- Ibraheem, W. I., et al. Comparison of digital planimetry and ruler methods for the measurement of extraction socket wounds. Medicina (Kaunas). 59 (1), 135 (2023).
- Mayrovitz, H. N., Soontupe, L. B. Wound areas by computerized planimetry of digital images: accuracy and reliability. Wounds. 22 (5), 222-229 (2009).
- Galiano, R. D., Michaels, J., Dobryansky, M., Levine, J. P., Gurtner, G. C. Quantitative and reproducible murine model of excisional wound healing. Wound Repair Regen. 12 (4), 485-495 (2004).
- Price, A., Grey, J. E., Patel, G. K., Cbe, K. G. H. . ABC of wound healing. , 0470658975 (2022).
- Eming, S. A., Krieg, T., Davidson, J. M. Inflammation in wound repair: Molecular and cellular mechanisms. J Invest Dermatol. 127 (3), 514-525 (2007).
- Carmeliet, P. Angiogenesis in life, disease and medicine. Nature. 438 (7070), 932-936 (2005).
- López, N., Cervero, S., Jiménez, M. J., Sanchez, J. F. Cellular characterization of wound exudate as a predictor of wound healing phases. Wounds. 26 (4), 101-107 (2014).
- Liu, N. T., et al. Quantifying the effects of wound healing risk and potential on clinical measurements and outcomes of severely burned patients: A data-driven approach. Burns. 46 (2), 303-313 (2020).
- Han, C., Barakat, M., DiPietro, L. A. Angiogenesis in wound repair: Too much of a good thing. Cold Spring Harb Perspect Biol. 14 (10), a041225 (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유