Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Digitale Planimetrie zur Beurteilung der Wundverschlusskinetik in einem Mausmodell
In diesem Artikel
Zusammenfassung
Wunden stellen eine globale gesundheitliche Herausforderung dar. In dieser Studie wurde eine standardisierte Fotokabine mit digitaler Planimetrie entwickelt, um die Variabilität der Wundmessung zu minimieren. Die Überwachung der Wunden bei Mäusen über einen Zeitraum von 14 Tagen zeigte eine anfängliche Zunahme der Wundfläche und des Wundumfangs, gefolgt von einem allmählichen Verschluss. Diese Methodik kann bei der Bewertung der Wundverschlusskinetik in präklinischen Modellen hilfreich sein.
Zusammenfassung
Chronische Wunden sind aufgrund ihrer hohen Prävalenz ein ernstes globales Gesundheitsproblem. Wirksame Therapiestrategien können die Heilung deutlich beschleunigen und damit das Risiko von Komplikationen verringern und die Gesundheitssysteme wirtschaftlich entlasten. Obwohl zahlreiche experimentelle Studien die Wundheilung untersucht haben, stützen sich die meisten auf qualitative Beobachtungen oder quantitative direkte Messungen. Ziel dieser Studie war es, eine indirekte Wundmessmethode mittels digitaler Planimetrie unter Einbeziehung digitaler Skalierung und Segmentierung zu standardisieren. Dieser Ansatz behebt den Mangel an detaillierten Schritt-für-Schritt-Methoden für eine genaue Wundbewertung. Es wurde eine Fotodokumentationskabine entworfen und gebaut, und computergestützte digitale Planimetrie-Tools wurden eingesetzt, um die Variabilität bei der Messung des Wundbereichs, des Umfangs und des Abstands von der Wundmitte zu ihren Rändern zu minimieren. Bei männlichen CD1-Mäusen (n = 4, 10 Wochen alt, 30-35 g) wurde eine kreisförmige traumatische Wunde (5 mm Durchmesser) an der dorsalen Mittellinie auf Höhe des Schulterblatts erzeugt. Die Entwicklung der Wunde wurde 14 Tage lang mit der speziell angefertigten Fotokabine fotografdokumentiert, die die Lichtverhältnisse, die Brennweite und die Positionierung des Motivs steuerte. Skalierungs- und Wundmessungen wurden durch Segmentierung in der ImageJ-Software durchgeführt, und die statistische Analyse wurde mit der statistischen Analysesoftware durchgeführt. Die Kinetik des Wundverschlusses zeigte eine leichte Zunahme der Wundgröße und des Wundumfangs zwischen Tag 0 und Tag 2, gefolgt von einer allmählichen Abnahme bis zum vollständigen Verschluss am Tag 14. Die Fotodokumentationskabine und die computergestützte digitale Planimetrie ermöglichten quantitative Messungen mit minimaler Variabilität. Zusammenfassend lässt sich sagen, dass diese Werkzeuge eine zuverlässige und reproduzierbare Methode zur Bewertung der Wundverschlusskinetik in präklinischen Modellen bieten.
Einleitung
Die traumatische Wundheilung dauert etwa 21 Tage und besteht aus einer genau definierten Abfolge von vier verschiedenen Phasen: (1) Hämostase, (2) Entzündung, (3) Proliferation und (4) Umbau1. Wenn eine Phase der Wundheilung verlängert wird, kann dies zur Entwicklung chronischer Wundenführen 1. Aufgrund ihrer hohen Prävalenz, ihrer potenziellen Komplikationen2 und ihrer erheblichen wirtschaftlichen Belastung gelten sie als globales Gesundheitsproblem.
Präklinische Studien zielen darauf ab, eine schnellere Heilung zu erreichen, indem sie eine umfassende Wundreepithelisierungfördern 3,4,5, Komplikationen verhindern und die Behandlungskosten senken. Diese Studien bewerten verschiedene Strategien, einschließlich der Entwicklung von Biomaterialien, pharmakologischen Interventionen und anderen Verfahren der regenerativen Medizin 6,7,8,9.
Für die Untersuchung traumatischer Wunden wurden mehrere experimentelle Modelle entwickelt. Einige konzentrieren sich auf makroskopisch sichtbare qualitative Merkmale wie Größe, Entzündungsindikatoren, Vorhandensein von Granulationsgewebe, Sekreten und Schorfbildung5. Andere analysieren quantitative Daten, einschließlich Fläche, Umfang, Radius, Durchmesser, Farbe, Tiefe und Abstände von der Mitte bis zu den Rändern von Wunden.
In diesem Zusammenhang wird bei den meisten in vivo-Untersuchungen der Wundradius und -tiefe direkt gemessen. Die manuelle Abgrenzung von Wundkanten in einem makroskopischen Bild kann jedoch zu Verzerrungen bei der Messungführen 10. Andere Studien verwenden mechanische Planimetrie unter Verwendung transparenter gerasterter Kunststoffplatten, bei denen die Wundränder zuvor abgegrenzt wurden; In beiden Fällen sind für die Ermittlung der Fläche oder des Umfangs manuelle Instrumente wie Lineale oder digitale Planimeter erforderlich. Heutzutage ermöglicht die computergestützte digitale Planimetrie die computergestützte Analyse von makroskopischen Bildern von Wunden oder Kunststoffplatten. Die In-situ-Manipulation und die Qualität des makroskopischen Bildes stellen eine Einschränkung dar, jedoch reduziert dieses Werkzeug 11,12,13,14 die Variabilität zwischen Flächen- und Umfangsmessungen erheblich.
Diese vorgeschlagene Methodik bietet signifikante Vorteile gegenüber bestehenden Techniken zur Bewertung des Wundverschlusses bei Mäusen 15,16,17,18,19,20. Während die Fotodokumentation als genaues und konsistentes Instrument zur Beurteilung der Wundverschlusskinetik angesehen wurde, haben frühere Studien21,22 die Grenzen der manuellen Wundmessung hervorgehoben, wie z. B. die Verzerrung des Beobachters und die Variabilität aufgrund inkonsistenter Beleuchtung und Kamerapositionierung. Der aktuelle Ansatz löst diese Probleme, indem er die Bildgebungsbedingungen durch eine speziell angefertigte Kabine standardisiert und so die Reproduzierbarkeit und Präzision verbessert. Darüber hinaus ermöglicht die computergestützte digitale Planimetrie genauere quantitative Bewertungen, verbessert die Bewertung therapeutischer Interventionen und minimiert Messfehler, wie in anderen Studien zum Vergleich manueller und digitaler Techniken gezeigtwurde 12,22, wodurch sie sich besonders für Studien zur Wundverschlusskinetik in Mausmodellen eignet und eine präzise Bewertung von Behandlungen ermöglicht, indem eine strenge Kontrolle über die Bildaufnahmebedingungen beibehalten wird.
Protokoll
Alle Versuchsverfahren mit Labormäusen wurden in Übereinstimmung mit den ethischen Standards und Vorschriften durchgeführt, die im offiziellen mexikanischen Standard (NOM-062-ZOO-1999) für den Umgang und die Pflege von Labortieren festgelegt sind. Das Protokoll wurde vom Internen Ausschuss für die Pflege und Verwendung von Labortieren (CICUAL) des Nationalen Instituts für Kernforschung (ININ) unter der Referenznummer CICUAL-01-23 geprüft und genehmigt. In dieser Studie wurden männliche CD1-Mäuse (n = 4) im Alter von 10 Wochen mit einem Körpergewicht von 28-32 g verwendet. Alle Tiere wurden so ausgewählt, dass sie in Bezug auf Stamm, Alter, Geschlecht und Körpergewicht einheitlich waren und die Variabilität der Versuchsergebnisse minimiert wurde. Einzelheiten zu den verwendeten Reagenzien und den verwendeten Geräten sind in der Materialtabelle aufgeführt.
1. Bau einer Fotokabine für die Aufnahme von makroskopischen Bildern
HINWEIS: Für die Konstruktion einer Fotokabine wurde die lizenzierte SolidWorks Software (Version 2015) verwendet, um externe Lichtquellen zu eliminieren. Ein 40 cm × 40 cm großer Würfel wurde aus einem ein Zoll dicken weißen Aluminiumprofil konstruiert. Der Kubus bestand aus drei Abschnitten, die nacheinander zusammengesetzt wurden: dem Dach, den Seitenwänden und dem Boden (Abbildung 1A).
- Dachkonstruktion
HINWEIS: Das Dach wurde zur Ausrichtung als Vorderkante (A), Hinterkante (B) und Seitenkanten (C und D) regionalisiert (Abbildung 1B).- Befestigen Sie im inneren Bereich der Seitenkante des Daches (C und D) ein geschlitztes Aluminiumprofil (für die Aufnahme von Glas) mit einer Breite, einer Dicke von 2,51 cm und einer Länge von 34,9 cm (Abbildung 1B).
- Platzieren Sie zwei 34,5 cm lange x 13 cm breite rechteckige Aluminiumplatten mit Polyethylen in der Mitte in der Nut jedes Dachprofils (Platte 1 und 2 in Abbildung 1C), um das Durchgleiten durch die Nut beider Profile zu ermöglichen.
- Installieren Sie eine 20 cm RGB-LED-Rohrleuchte mit einem Farbtemperaturbereich von 2500-9000 K (Abbildung 1C) in einem Winkel von 45° mit doppelseitigem Klebeband an der Unterkante von Panel 1.
- Montieren Sie auf den Dachpaneelen 1 und 2 eine 32 cm x 12 cm große rechteckige Schaumstoffplatte mit einem zentralen kreisförmigen Ausschnitt mit einem Durchmesser von 7,82 cm, um die Installation des Kameraobjektivs zu ermöglichen (Abbildung 1C).
- Aufbau des Fußbodens
- Legen Sie ein 40 cm x 40 cm großes quadratisches Stück weiße Schaumstoffplatte auf die Bodenflächenprofile. Schneiden Sie aus jeder Ecke der Schaumstoffplatte Quadrate mit einer Seitenlänge von 2,54 cm aus (Abbildung 1E).
- Aufbau von Seitenwänden
- Schneiden Sie vier viereckige Schaumstoffplatten von 40 cm x 40 cm zu.
- Kleben Sie zwei Paneele an den Seiten C und D mit Silikon zusammen, um die linke und rechte Seitenwand zu bilden (Abbildung 1F).
- Befestigen Sie Klettverschlüsse an den Aluminiumprofilen A und B, um die internen Elemente der Fotokabine einfach zu bearbeiten. Befestigen Sie zusätzlich 1 cm vom Rand einer Reihe von Klebebefestigungen entfernt an zwei Schaumstoffpappquadraten auf einer Seite und platzieren Sie sie an der Vorder- und Rückwand (Abbildung 1F).
- Aufbau der Referenzbasis
HINWEIS: Eine Referenzbasis war erforderlich, um die Maus während der Anästhesie und während der gesamten Dokumentation der Wundentwicklung in Bauchlage zu halten. 3D-Komponenten wurden unter Verwendung der Fused Deposition Modeling (FDM)-Technik mit PLA-Material und einem 3D-Drucker entworfen und hergestellt23,24.- Drucken Sie die Maske in 3D mit einer Basis von 2 cm in Breite, Länge und Höhe und platzieren Sie sie 11,5 cm vom Rand eines vorgeschnittenen 40 cm x 28 cm großen Rechtecks aus weißer Schaumstoffplatte, um die Mäuse unter Inhalationsnarkose zu halten (Abbildung 1D, rote Farbe).
- Drucken Sie die rechteckige Plattform (9 cm lang, 5 cm breit, 2,5 cm hoch) mit vier extrudierten Bereichen, um den Mausrücken während der Bildaufnahme auszurichten. Diese Bereiche stützten den Kopf, die Gliedmaßen und die Bauchregion, um die Bauchlage beizubehalten. Kleben Sie diese Plattform in die Mitte der Referenzbasis (Abbildung 1D, grüne Farbe).
- Drucken Sie den Linealblock (2 cm breit, 8 cm lang, 2,5 cm hoch) in 3D und befestigen Sie ihn 1 cm von der linken Seite der Mausbasis entfernt, um das für die digitale Bildverarbeitung benötigte Messreferenzelement zu platzieren (Abbildung 1D, blaue Farbe).
- Befestigen Sie ein 15 cm langes Graduiertenlineal aus Edelstahl am Linealblock und installieren Sie die gesamte Referenzbasis in der Kabine für die Bildskalierung (Abbildung 1D).

Abbildung 1: Schema für den Aufbau des makroskopischen Bildaufnahmeschranks. (A) Schnitte der Kabine (Dach, Seitenwände, Boden). (B)Ausrichtung der Profile, die das Dach bilden; vorne (A), hinten (B) und Seiten (Innenseite der Profile in rot "C,D"). (C) Dachpaneele 1 und 2, Installation des LED-Lichtrohrs, der Kameraobjektivplatte und der Bodeninstallation. (D) Installation der Anästhesiemaske (ROT), der Mausplattform (GRÜN) und der rechteckigen Plattform zur Positionierung des Messlineals (BLAU) auf der Referenzbasis. (E) Endgültige Position für die Referenzbasis. (F) Montage von Seiten-, Vorder- und Rückwänden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Erhaltung der Tiere
- Holen Sie die Genehmigung der Bioethikkommission der Institution für Tierversuche ein. Verwenden Sie CD1-Mäuse (n = 4), 10 Wochen alt und mit einem Gewicht von 28-32 g.
- Halten Sie die Mäuse unter Standardbedingungen unter: Halten Sie eine Temperatur von 21 °C aufrecht, 12/12 h Hell-Dunkel-Zyklen, 45 % Luftfeuchtigkeit und ermöglichen Sie ad libitum Zugang zu Wasser und Nahrung, außer während Fotodokumentationssitzungen.
3. Traumatische Wundentstehung
- Fasten Sie die Mäuse 8 Stunden vor dem Eingriff. Betäuben Sie die Mäuse mit intraperitonealem Natrium-Pentobarbital in einer Dosis von 65 mg/kg25 (nach institutionell anerkannten Protokollen).
- Bestätigen Sie die Tiefe der Anästhesie, indem Sie während einer interdigitalen Klemme auf einen fehlenden Entzugsreflex prüfen. Tragen Sie eine Augensalbe auf die Augen auf, um Trockenheit während der Anästhesie zu verhindern. Halten Sie die Mäuse während der Operation und der Genesung (20 min) auf einer stabilen Temperatur von 37 °C.
- Bringen Sie die Maus in eine ventrale Dekubitusposition und enthaaren Sie einen 2,5 cm x 3 cm großen Bereich von der Halsregion kaudal mit chirurgischen Klingen. Dehnen Sie die Haut, um Schnittwunden zu vermeiden. Führen Sie Asepsis und Antisepsis mit abwechselnd Povidon-Jod- und sterilen Wasserspülungen durch.
- Verwenden Sie einen sterilen 5-mm-Biopsiestanzer und üben Sie mit kreisenden Bewegungen Druck aus, um einen dermo-epidermalen Schnitt auf Höhe des Schulterblatts zu erstellen. Entfernen Sie die Klappe mit einer gezackten Pinzette und schneiden Sie sie mit einer Iris-Schere (Abbildung 2A).
- Im Falle des Vorhandenseins von Blutungspunkten in der Wunde wenden Sie einen Elektroschock mit einem Elektrokautergerät an, um eine Blutstillung zu erreichen.
- Legen Sie mit einer Juwelierzange einen kreisförmigen Hautfilm mit einem Durchmesser von 1 cm über die Wunde, um eine Kontamination und Kontraktion zu verhindern.
- Führen Sie alle Überlebensoperationen unter sterilen Bedingungen durch. Bereiten Sie das Operationsfeld mit Desinfektionsmitteln wie Povidon-Jod vor. Tragen Sie sterile Handschuhe und eine Maske und halten Sie die Sterilität während des gesamten Eingriffs aufrecht, indem Sie sterile Instrumente verwenden und den Kontakt mit unsterilen Oberflächen minimieren.
- Setzen Sie die Mäuse nach der Operation in einzelne Käfige bei 24 °C und überwachen Sie sie, bis sie wieder genügend Bewusstsein haben, um die sternale Position beizubehalten. Stellen Sie sicher, dass die Körpertemperatur während und nach der Operation kontrolliert wird, um eine Unterkühlung durch die Verwendung externer Wärmequellen zu vermeiden.
- Verabreichen Sie die Analgesie bis zum 4. Tag, indem Sie Ketorolac im Trinkwasser auf 5 mg/kg26 verdünnen.
- Nach 14 Tagen, wenn die Wunden bei gesunden Nagetieren in der Regel fortgeschrittene Stadien der Heilung erreichen, euthanasieren Sie die Mäuse durchO2-Ersatz in einer CO2 -Kammer nach internationalen Standards. Dies markiert den Endpunkt der Studie.
4. Makroskopische Bilderfassung
- Nehmen Sie täglich Bilder der Wunden an 14 aufeinanderfolgenden Tagen auf, um die kontinuierliche Kinetik des Wundverschlusses zu überwachen. Verwenden Sie eine semiprofessionelle oder professionelle Kamera; Positionieren Sie das Objektiv durch die kreisförmige Öffnung im Dach der Fotokabine.
HINWEIS: Passen Sie den Zeitplan je nach Versuchsbedingungen nach Bedarf an. - Verwenden Sie eine RGB-LED-Lichtröhre im CCT-Modus (Correlated Colour Temperature), der auf 9000 K und 100 % Helligkeit für die Beleuchtung eingestellt ist.
- Positionieren Sie die Referenzbasis in der Mitte des Bodens der Fotokabine.
- Legen Sie die Maus für 3 Minuten in die Inhalationsanästhesiekammer (Abbildung 2B).
- Platzieren Sie die Maus nach Einleitung der Anästhesie in Bauchlage auf der Mausplattform. Befestigen Sie die Schnauze in der Sevofluran-Anästhesiemaske und geben Sie 5 % Sevofluran bei einer Sauerstoffflussrate von 1,5 l/min ab (Abbildung 2C).
- Entfernen Sie vor der Aufnahme von Bildern den Hautfilm mit einer Jeweller-Pinzette von der Wunde und richten Sie die Referenzbasis mit dem Kameraobjektiv aus.
- Installieren Sie die Vorderwand der Fotokabine und nehmen Sie makroskopische Bilder mit den folgenden Einstellungen auf: Blende f/3.2, Belichtungszeit 1/200 s, ISO-Empfindlichkeit 80, Brennweite 4 mm.
- Legen Sie mit einer Jeweller-Pinzette einen Hautfilm mit einem Durchmesser von 1 cm auf die Wunde, bevor Sie die Anästhesiemaske entfernen. Bringen Sie die Mäuse in einzelne Käfige und beobachten Sie, bis sich der Motor erholt hat.
5. Bildverarbeitung
- Generieren Sie eine Sicherungskopie der makroskopischen Bilder. Verarbeiten Sie die Bilder mit der ImageJ-Software.
- Öffnen Sie das Backup-Image in ImageJ, indem Sie dem Pfad folgen: Datei > Öffnen > Suchen Sie in den Bildern und klicken Sie dann auf Öffnen.
- Skalieren Sie das Bild nach Referenz: Maximieren Sie das Bild, wählen Sie das geradlinige Werkzeug aus, vergrößern Sie das Lineal neben der Maus mit der Taste +, zeichnen Sie eine gerade Linie von 10 mm auf das Linealbild, gehen Sie dann zu Analysieren > Maßstab einstellen > geben Sie "10" für Bekannte Entfernung ein > Längeneinheit auf mm festlegen und klicken Sie dann auf OK. Dadurch wird das Pixel-zu-Entfernungs-Verhältnis für das makroskopische Bild bestimmt (Abbildung 2D).
- Wundbereich vom Bild trennen: Wähle mit dem Rechteckwerkzeug den Bereich um die Wunde aus (b = 150, h = 150). Notieren Sie die X- und Y-Werte, klicken Sie mit der rechten Maustaste auf das Rechteck > Duplizieren > benennen Sie das Motiv > drücken Sie die Eingabetaste. Drücken Sie im neuen Bild zweimal +, um die Ansicht zu vergrößern (Abbildung 2E).
- Speichern Sie das zugeschnittene Bild, indem Sie dem Pfad folgen: Datei > Speichern unter > Tiff > Geben Sie den Namen ein > Speichern.
- Erstellen Sie ein Duplikat des zugeschnittenen Bildes, um Änderungen während der Segmentierung zu vermeiden: Klicken Sie mit der rechten Maustaste auf das zugeschnittene Bild > Duplizieren > benennen Sie es, indem Sie am Ende "Segmentierung" hinzufügen. Drücken Sie anschließend die Eingabetaste. Drücken Sie im neuen Bild zweimal +, um die Ansicht zu vergrößern.
- Unterteilen Sie das Bild in Farbkanäle, indem Sie diesem Pfad folgen: Bild > Typ > RGB-Stapel. Klicken Sie im roten Kanalbild (1/3 Rot) mit der rechten Maustaste auf Duplizieren und drücken Sie OK im Duplizieren-Fenster.
- Segmentieren Sie das Bild des roten Kanals. Klicken Sie auf das rote Kanalbild, Bild > > Schwellenwert anpassen. Wählen Sie anschließend Standard > Apply (Standard) aus (Abbildung 2F).
- Korrigieren Sie den Region of Interest (ROI), um eine vollständige Wundabdeckung zu gewährleisten und Segmentierungsverzerrungen zu vermeiden.
HINWEIS: Wenn Bereiche um die Wunde herum nicht in die Segmentierung einbezogen werden, gehen Sie zu Prozess > Binär- > Fülllöchern. Um schwarze Punkte außerhalb der Wunde zu entfernen, gehen Sie zu Prozess > Binäres > Erodieren. Wenn der Befehl "Erodieren" die Wundgröße verringert, korrigieren Sie sie mit > "Binär verarbeiten" > "Dilatieren". - Markieren Sie den Umfang des ROI: Bearbeiten > Auswahl > Auswahl erstellen. Der ROI wird gelb umrandet. Fügen Sie es dem ROI-Manager hinzu, indem Sie > Auswahl bearbeiten > Zum Manager hinzufügen folgen (Abbildung 2G).
- Validieren der Segmentierung: Öffnen Sie das Fenster ROI-Manager und wählen Sie den ROI aus, den Sie überprüfen möchten: Mehr > Übersetzen. Geben Sie die in Schritt 4 aufgezeichneten X- und Y-Werte ein, und drücken Sie OK.
- Maximieren Sie das Originalbild und wählen Sie dann den ROI im ROI-Manager aus. Passen Sie den ROI mit den Pfeiltasten an, bis er mit der Wunde ausgerichtet ist (Abbildung 2H). Wenn der ROI mit der Wunde übereinstimmt, war die Segmentierung erfolgreich. Andernfalls wiederholen Sie den Vorgang ab Schritt 2.
- Sobald die Segmentierung bestätigt ist, erhalten Sie die Wundmessungen: Analysieren > Messen. In einer Ergebnistabelle werden die Werte für Fläche, Umfang und X/Y-Position angezeigt. Kopieren Sie diese Werte zur Dokumentation und statistischen Analyse in die SPSS-Software (Abbildung 2I).
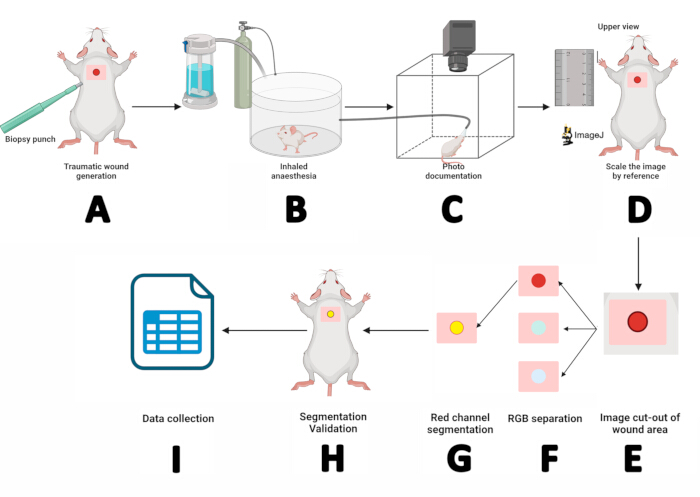
Abbildung 2: Arbeitsablauf der Wundmessung mittels digitaler Planimetrie und Segmentierungstechniken. (A) Dermo-epidermale Inzision mit einem sterilen 5-mm-Biopsiestanzer. (B) Platzieren der Maus in einer inhalativen Anästhesiekammer für 3 Minuten. (C) Fotodokumentation durch Positionieren der anästhesierten Maus in der Fotokabine und Befestigen der Schnauze in einer Sevofluran-Maske. (D) Öffnen Sie das erhaltene Bild in ImageJ und skalieren Sie es mit dem Lineal als Referenz. (E) Extrahieren des Wundbereichs mit dem Rechteckwerkzeug. (F) Aufteilen des Bildes in RGB-Kanäle und Verarbeiten des Rotkanals. (G) Skizzierung und Verwaltung der Region of Interest (ROI). (H) Validierung der Segmentierung, indem der ROI mit der Wunde abgeglichen wird. (I) Messung der Wundparameter und Aufzeichnung der Ergebnisse für die statistische Analyse. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
6. Sterbehilfe nach dem Verfahren
HINWEIS: Die Studie endet nach 14 Tagen, zu diesem Zeitpunkt erreichen die Wunden bei gesunden Nagetieren in der Regel fortgeschrittene Stadien der Heilung. Zu diesem Zeitpunkt wurden die Mäuse nach dem etablierten institutionell anerkannten Euthanasieverfahren human eingeschläfert.
- Bereiten Sie die Ausrüstung vor. Stellen Sie sicher, dass die Euthanasiekammer sauber, trocken und von angemessener Größe ist, um die Mäuse ohne Überfüllung unterzubringen. Schließen Sie die Kammer an eine medizinische CO2 -Versorgung mit einem Durchflussregler an.
- Bringen Sie die Mäuse vorsichtig in die Kammer, um den Stress zu minimieren. Stellen Sie sicher, dass sie sich in einer ruhigen Umgebung mit minimalen äußeren Störungen befinden.
- Stellen Sie die CO2 -Durchflussrate auf 20 % bis 30 % des Kammervolumens pro Minute ein, wie in den AVMA-Richtlinien für die Euthanasie von Tieren empfohlen. Erhöhen Sie allmählich die CO2 -Konzentration, um Stress oder Unbehagen bei den Mäusen zu vermeiden.
- Beobachten Sie die Mäuse während des Eingriffs genau. Achten Sie auf Anzeichen eines allmählichen Bewusstseinsverlusts, einschließlich verminderter Aktivität und Atmung, gefolgt von Apnoe und Herzstillstand.
- Bestätigen Sie den Tod, sobald die Mäuse nicht mehr atmen und keine Anzeichen von Bewegung zeigen. Warten Sie weitere 1-2 Minuten, um eine vollständige Beendigung der Vitalfunktionen zu gewährleisten. Überprüfen Sie den Tod, indem Sie das Fehlen von Reflexen (z. B. Hornhautreflex) und Herzaktivität bestätigen.
- Füllen Sie die Schlachtkörper in dafür vorgesehene Behälter für biologische Sonderabfälle um. Befolgen Sie die institutionellen Protokolle und nationalen Richtlinien für die sichere Entsorgung von Tierresten.
- Notieren Sie die Anzahl der eingeschläferten Tiere, das Datum und alle relevanten Beobachtungen, um die Einhaltung ethischer und institutioneller Standards sicherzustellen.
Ergebnisse
Nach dem Skalieren der Bilder in der ImageJ-Software wurden der durchschnittliche Umfang (Tabelle 1) und die Fläche (Tabelle 2) der Wunden zusammen mit ihren jeweiligen Standardabweichungen durch digitale Segmentierung ermittelt. Diese Werte wurden vom Tag Null bis zum vierzehnten Tag (D0-D14) aufgezeichnet.
| Tag | Umfang (mm) |
Diskussion
In präklinischen Modellen steht die quantitative Analyse der Entwicklung traumatischer Wunden in präklinischen Modellen vor Herausforderungen aufgrund von Faktoren wie Wundgröße, lokalisierte Entzündungsreaktion34, Lokalisation und/oder Manipulation. Für diese Messungen gibt es direkte manuelle36 und indirekte digitale11,16,37,38 ...
Offenlegungen
Die Autoren erklären, dass es keine Interessenkonflikte im Zusammenhang mit dieser Forschung gibt.
Danksagungen
Die Autoren danken dem Consejo Nacional de Humanidades, Ciencias y Tecnologías (CONAHCyT, CVU: 933600) für die Bereitstellung von Mitteln und dem Laboratorio Nacional de Investigación y Desarrollo de Radiofármacos del Instituto Nacional de Investigaciones Nucleares (LANIDER-ININ) für ihre Unterstützung. Darüber hinaus wurde Abbildung 2 mit Hilfe der BioRender-Software (2020) erstellt, die unter BioRender.com/p67z056 verfügbar ist.
Materialien
| Name | Company | Catalog Number | Comments |
| 5 mm Biopsy Punch | MILTEX, USA | 33-35 | To mark the wound edges |
| Aluminum with polyethylene core | Alucobond,USA | Bright Silver 119 | For the construction of the macroscopic Image Acquisition Booth |
| Camera Lens | Sony, Japan | SEL2470Z | To focus the images to photograph |
| Electrocautery | Bonart, USA | ART-E1 | To eliminates bleeding points in the wound if present. |
| Hook and loop fastener strips | VELCRO | ||
| IBM SPSS Statistics Version 22 | IBM Corporation, USA | https://www.ibm.com/analytics/spss-statistics | Used for statistical analysis of wound measurements, including area and perimeter data. |
| ImageJ Version 1.53t | National Institutes of Health, USA | https://imagej.nih.gov/ij/ | Used for processing macroscopic images, including scaling, segmentation, and measurement of wound parameters. |
| Ketorolac | SIEGFRIED RHEIN, Mexico | 493977 | For postoperative pain management |
| Miltex Iris Scissors, 4-1/8" Curved | MILTEX, USA | V95-306 | To cut the wound flap generated with the biopsy punch |
| RGB LED Light Tube | ANDOER, China | B09F8RLMSY | To illuminate the Macroscopic Image Acquisition Booth |
| Semi profesional camera | Sony, Japan | DSC-HX300 | To take the photos |
| Serrated Forceps | MILTEX, USA | V96-118 | To hold the flap during the cut |
| Sevoflurane | Baxter, USA | AMX2L9117PR | For inhaled anaesthesia |
| Sodium Pentobarbital | Aranda, Mexico | 734.448.001.212 | For intraperitoneal anaesthesia |
| SolidWorks Version 2015 | Dassault Systèmes, France | https://www.solidworks.com/ | Used to design and create 3D models for constructing accessories for the photodocumentation booth. |
| Surgical blades | HERGOM, Mexico | H10 | To shave the hair in the area where the wound will be created |
| Transparent Adhesive Dressing | 3M, USA | F51CA07 | To cover the traumatic wound |
Referenzen
- Martinengo, L., et al. Prevalence of chronic wounds in the general population: systematic review and meta-analysis of observational studies. Ann Epidemiol. 29, 8-15 (2019).
- Chen, X., Shi, X., Xiao, H., Xiao, D., Xu, X. Research hotspot and trend of chronic wounds: A bibliometric analysis from 2013 to 2022. Wound Repair Regen. 31 (5), 597-612 (2013).
- Gould, L., Li, W. W. Defining complete wound closure: Closing the gap in clinical trials and practice. Wound Repair Regen. 27 (3), 201-224 (2019).
- Baron, J. M., Glatz, M., Proksch, E. Optimal support of wound healing: New insights. Dermatology. 236 (6), 593-600 (2020).
- Tiwari, R., Pathak, K. Local drug delivery strategies towards wound healing. Pharmaceutics. 15 (2), 634 (2023).
- Gupta, B., Agarwal, R., Alam, M. S. Hydrogels for wound healing applications. Biomed Hydrogels. , 184-227 (2011).
- Pastar, I., et al. Pre-clinical models for wound-healing studies. Skin Tissue Models Regen Med. , 223-253 (2018).
- Shen, Z., Zhang, C., Wang, T., Xu, J. Advances in functional hydrogel wound dressings: A Review. Polymers (Basel). 15 (9), 2000 (2000).
- Wong, V. W., Sorkin, M., Glotzbach, J. P., Longaker, M. T., Gurtner, G. C. Surgical approaches to create murine models of human wound healing. J Biomed Biotechnol. 2011, 1-8 (2011).
- Peterson, N., Stevenson, H., Sahni, V. Size matters: How accurate is clinical estimation of traumatic wound size. Injury. 45 (1), 232-236 (2014).
- Öien, R. F., Håkansson, A., Hansen, B. U., Bjellerup, M. Measuring the size of ulcers by planimetry: a useful method in the clinical setting. J Wound Care. 11 (5), 165-168 (2002).
- Rogers, L. C., Bevilacqua, N. J., Armstrong, D. G., Andros, G. Digital planimetry results in more accurate wound measurements: a comparison to standard ruler measurements. J Diabetes Sci Technol. 4 (4), 799-802 (2010).
- Shamata, A., Thompson, T. Documentation and analysis of traumatic injuries in clinical forensic medicine involving structured light three-dimensional surface scanning versus photography. J Forensic Leg Med. 58, 93-100 (2018).
- Foltynski, P., Ladyzynski, P., Ciechanowska, A., Migalska-Musial, K., Judzewicz, G., Sabalinska, S. Wound area measurement with digital planimetry: Improved accuracy and precision with calibration based on 2 rulers. PLoS One. 10 (8), e0134622 (2015).
- Frank, S., Kämpfer, H. Excisional wound healing. Wound Healing: Methods Protoc. , 3-15 (2003).
- Dunn, L., et al. Murine model of wound healing. J Vis Exp. (75), e50265 (2013).
- Barakat, M., DiPietro, L. A., Chen, L. Limited Treatment options for diabetic wounds: Barriers to clinical translation despite therapeutic success in murine models. Adv Wound Care (New Rochelle). 10 (8), 436-460 (2021).
- Goh, C. C., et al. Inducing ischemia-reperfusion injury in the mouse ear skin for intravital multiphoton imaging of immune responses. J Vis Exp. (118), e54956 (2016).
- Wang, Y., et al. Autologous fat grafting promotes macrophage infiltration to increase secretion of growth factors and revascularization, thereby treating diabetic rat skin defect. Diabetes, Metab Syndr Obes: Targets and Therapy. 13, 4897-4908 (2020).
- Notodihardjo, S. C., et al. A comparison of the wound healing process after the application of three dermal substitutes with or without basic fibroblast growth factor impregnation in diabetic mice. J Plast Reconstr Aesthet Surg. 73 (8), 1547-1555 (2020).
- Thawer, H. A., Houghton, P. E., Woodbury, M. G., Keast, D., Campbell, K. A comparison of computer-assisted and manual wound size measurement. Ostomy Wound Manage. 48 (10), 46-53 (2002).
- Huang, C. X., et al. Comparison of digital and traditional skin wound closure assessment methods in mice. Lab Anim Res. 39 (1), 25 (2023).
- Subramaniam, S. R., et al. 3D printing: Overview of PLA progress. AIP Conf Proc. , 020015 (2019).
- Oleksy, M., Dynarowicz, K., Aebisher, D. Rapid prototyping technologies: 3D printing applied in medicine. Pharmaceutics. 15 (8), 2169 (2023).
- Gómez de Segura, &. #. 1. 9. 3. ;. I. Métodos de anestesia, analgesia y eutanasia. Métodos de anestesia, analgesia y eutanasia. 14, 97-127 (2016).
- Romero-Fernandez, W., et al. El 1, 2, 3 de la experimentación con animales de laboratorio. Rev Peru Med Exp Salud Publica. 33 (2), 288 (2016).
- Cukjati, D., Reberšek, S., Miklavčič, D. A reliable method of determining wound healing rate. Med Biol Eng Comput. 39 (2), 263-271 (2001).
- Payne, W. G., Bhalla, R., Hill, D. P., Pierpont, Y. N., Robson, M. C. Wound healing trajectories to determine pressure ulcer treatment efficacy. Wound Repair Regen. 11, e1 (2011).
- Cardinal, M., Eisenbud, D. E., Phillips, T., Harding, K. Early healing rates and wound area measurements are reliable predictors of later complete wound closure. Wound Repair Regen. 16 (1), 19-22 (2008).
- Tallman, P. Initial rate of healing predicts complete healing of venous ulcers. Arch Dermatol. 133 (10), 1231 (1997).
- Hopkins, N. F. G., Jamieson, C. W. Antibiotic concentration in the exudate of venous ulcers: The prediction of ulcer healing rate. Br J Surg. 70 (9), 532-534 (2005).
- Robson, M. C. Wound healing trajectories as predictors of effectiveness of therapeutic agents. Arch Surg. 135 (7), 773 (2000).
- Jessup, R. L. What is the best method for assessing the rate of wound healing? A comparison of 3 mathematical formulas. Wounds. 19 (3), 138-147 (2006).
- Landén, N. X., Li, D., Ståhle, M. Transition from inflammation to proliferation: A critical step during wound healing. Cell Mol Life Sci. 73 (20), 3861-3885 (2016).
- Szpaderska, A. M., DiPietro, L. A. Inflammation in surgical wound healing: Friend or foe. Surgery. 137 (5), 571-573 (2005).
- Hamed, E., Al Balah, O. F. A., Refaat, M., Badr, A. M., Afifi, A. Photodynamic therapy mediated by methylene blue-loaded PEG accelerates skin mouse wound healing: An immune response. Lasers in Med Sci. 39 (1), 141 (2024).
- Ibraheem, W. I., et al. Comparison of digital planimetry and ruler methods for the measurement of extraction socket wounds. Medicina (Kaunas). 59 (1), 135 (2023).
- Mayrovitz, H. N., Soontupe, L. B. Wound areas by computerized planimetry of digital images: accuracy and reliability. Wounds. 22 (5), 222-229 (2009).
- Galiano, R. D., Michaels, J., Dobryansky, M., Levine, J. P., Gurtner, G. C. Quantitative and reproducible murine model of excisional wound healing. Wound Repair Regen. 12 (4), 485-495 (2004).
- Price, A., Grey, J. E., Patel, G. K., Cbe, K. G. H. . ABC of wound healing. , 0470658975 (2022).
- Eming, S. A., Krieg, T., Davidson, J. M. Inflammation in wound repair: Molecular and cellular mechanisms. J Invest Dermatol. 127 (3), 514-525 (2007).
- Carmeliet, P. Angiogenesis in life, disease and medicine. Nature. 438 (7070), 932-936 (2005).
- López, N., Cervero, S., Jiménez, M. J., Sanchez, J. F. Cellular characterization of wound exudate as a predictor of wound healing phases. Wounds. 26 (4), 101-107 (2014).
- Liu, N. T., et al. Quantifying the effects of wound healing risk and potential on clinical measurements and outcomes of severely burned patients: A data-driven approach. Burns. 46 (2), 303-313 (2020).
- Han, C., Barakat, M., DiPietro, L. A. Angiogenesis in wound repair: Too much of a good thing. Cold Spring Harb Perspect Biol. 14 (10), a041225 (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten