Method Article
提取人输卵管上皮细胞用于单细胞分析的有效方法
摘要
该方案描述了一种用于分离人输卵管上皮细胞的一天方法。分离的上皮细胞可以接种在 2 维 (2D) 培养物中,也可以解离成单细胞悬液,并用于下游实验,包括流式细胞术和单细胞 RNA 测序。
摘要
人类输卵管是生殖的内在因素。输卵管的目的是允许精子、卵子和胚胎(如果受精成功)的运输。排列在输卵管内表面的上皮细胞是正常和异常输卵管过程(包括疾病发作)不可或缺的一部分。绝经后,输卵管在体内不再起重要作用,上皮内细胞组成发生变化。我们描述了一种方法,其中这些上皮细胞可以从新鲜的输卵管中分离出来,基质细胞污染最小,形成单细胞悬液。这些细胞可以在培养物中生长或用于进一步分析,例如流式细胞术和单细胞 RNA 测序。该分离方案可在 4-6 小时内实现,并产生可用于即时下游分析的活细胞。这种有效的方案有助于分离具有富集上皮细胞群的输卵管上皮细胞。
引言
输卵管由多个部分构成。从卵巢到子宫,输卵管由菌毛、壶腹、峡部和壁内部分组成。菌毛从输卵管末端延伸,在那里它们抓住卵巢释放的卵子。然后,卵子穿过最有可能受精的壶腹到达峡部,最后通过壁内部分转移到子宫1。促进卵子运输的输卵管最内层粘膜由一层管腔上皮组成,包括纤毛细胞和分泌细胞。纤毛细胞往往更集中在菌毛2 处。它们在将卵子通过输卵管从卵巢物理移动到子宫方面发挥着不可或缺的作用。它们的附属物不仅使纤毛细胞能够移动卵子,还可以清除排卵后的遗传毒性应激3。
分泌型输卵管上皮细胞分泌一种有助于营养和配子组装的液体4。在绝经后状态下,输卵管上皮沿纤毛细胞和分泌细胞的比例不同,纤毛细胞减少,因为输卵管不再在运输中发挥关键作用5。此外,在没有雌激素的情况下,输卵管被认为会退化 1,6。输卵管中纤毛细胞的这种丢失被认为会增加患浆液性癌的风险7。此外,输卵管分泌上皮细胞被认为会导致浆液性输卵管上皮内癌 (STIC) 病变,这是输卵管卵巢癌最具侵袭性亚型高级别浆液性癌的众所周知的前体 7,8。
该方案的目的是从人输卵管中分离上皮细胞并将其解离成单细胞悬液。该方案产生丰富的单细胞上皮细胞群,可用于多种分析。如本手稿所示,我们进行了流式细胞术分析,并在分离后将细胞接种在 2D 中。流式细胞术分析表明存在单细胞,这些细胞大多是活的,本质上是上皮细胞。在这些分析中,我们包括了四个标志物,e506 用于活力,EpCAM 用于上皮细胞,CD45 用于免疫细胞,CD10 用于基质细胞。使用 e506 活力标记物排除死细胞,并使用 CD45 门控免疫细胞。悬浮液可能具有免疫细胞群;然而,为了获得相对纯净的上皮细胞群,可以使用 CD45 去除试剂盒去除 CD45 阳性细胞。此外,当接种在培养物中时,CD45 阳性细胞通常不会增殖。通过该方法分离并以 2D 形式生长的细胞显示出粘附的鹅卵石样上皮细胞群。该方法可用于生成细胞制剂,这些制剂可以开发成单细胞 RNA 文库。
在过去四年中,定义输卵管上皮细胞谱系、生殖生活不同阶段这些谱系的改变以及导致恶性转化和发生的刺激事件的研究变得更加突出 6,9,10,11,12 .该协议通过提供一种有效的方法来分离输卵管上皮细胞并将其加工成单细胞,将极大地有利于该领域的研究。
研究方案
该方案改编自先前描述的子宫上皮细胞分离方法13,14。通过我们的加州大学洛杉矶分校 (UCLA) IRB 批准的方案 #10-0727 收集去标识化输卵管的新鲜标本,并在大约 4-6 小时内消化成单细胞悬液。
1. 输卵管收集和制备
- 在 15 mL 或 50 mL 试管中的解离培养基(含有 10% 胎牛血清 (FBS)、5 mL L-谷氨酰胺和 5 mL 青霉素/链霉素的 DMEM [4.5 g/L D-葡萄糖] 中收集新鲜的人输卵管(图 1A),并在冰上运输至实验室。
- 将输卵管转移到含有新鲜解离培养基的无菌培养皿中。
- 在解剖显微镜下,使用细尖镊子和 Vannas Tubingen 剪刀解剖脂肪、结缔组织和管周围的任何血管(图 1B)。
- 在解剖显微镜下,用剪刀切开输卵管的冠状面,形成小圆柱体,每个圆柱体的直径为 ~3-5 毫米(图 1C),使用细尖镊子稳定组织。
2. 上皮细胞分离和解离
- 小心地从培养皿中吸出解离介质。
- 用冷的 1x 磷酸盐缓冲盐水 (PBS) 洗涤组织块 2 次,轻轻移液 ~2 mL 以覆盖组织块并轻轻旋转板。
- 吸出最后的 1x PBS 洗涤液,在室温下将组织块在冷的 5 mM 乙二胺四乙酸 (EDTA) 中孵育 5 分钟,然后重复总共两次孵育。每次孵育后吸出 5 mM EDTA。
- 将组织碎片悬浮在冷的 1% 胰蛋白酶/Hanks 平衡盐溶液 (HBSS) 中,并在 4 °C 下孵育 40 分钟(图 1D)。
- 吸出 1% 胰蛋白酶/HBSS,并在冷解离培养基中洗涤组织块 2 次以灭活胰蛋白酶。
- 将组织片段在 2 mL 解离培养基中与 0.4 mg DNase 在室温下孵育至少 30 分钟。
注意:可能需要更长的孵育期,但在开始步骤 2.7 之前不要超过 45 分钟。 - 在解剖显微镜下,当仍在含有 DNase 的培养基中时,用镊子将输卵管的片段(管腔平行于培养皿底部)固定到位。另一只手用镊子反复按压输卵管片,将上皮细胞从输卵管腔中排出。确认当细胞从管腔中释放时,在组织周围可以看到细胞光晕。对培养皿中的每个输卵管片段重复(图 1E)。
- 将含有细胞的培养基转移到无菌的 15 mL 试管中,用解离培养基洗涤培养皿至少 2 次,然后将洗涤液混合到 15 mL 试管中。丢弃基质管片段。
- 通过在 500 × g 离心 5 分钟来收获细胞。吸出上清液并将沉淀重悬于 1 mL 解离培养基中。
- 通过分装 10 μL 细胞悬液并与台盼蓝以 1:1 混合来计数细胞。将 10 μL 混合物移液到腔室计数玻片中,然后将其插入细胞计数器(图 1F)。
3. 消化成单细胞悬液
- 将细胞重悬于 9 mL 解离培养基、1 mL 8 mg/mL 胶原酶(1 型)和 0.4 mg DNase 中。在 37 °C 下在轨道振荡器中以 200 rpm 孵育 30-45 分钟(图 1G)。
- 通过在 500 × g 离心 5 分钟来收获细胞。吸出上清液并将沉淀重悬于 5 mL 解离培养基中以洗去胶原酶。
- 将细胞悬液通过 100 μm 细胞过滤器放入 50 mL 管中(图 1H)。
- 通过在 500 × g 离心 5 分钟来收获细胞。
- 如果细胞沉淀呈红色,请按照步骤 3.6-3.8 中所述进行红细胞 (RBC) 裂解。如果细胞沉淀不是红色的,请跳至步骤 3.9。
- 在 4.5 mL 超纯水中稀释 500 μL RBC 裂解缓冲液。
- 吸出培养基,加入 5 mL 稀释的 RBC 裂解缓冲液,并在冰上孵育 3 分钟。
- 要停止 RBC 裂解,请向 50 mL 试管中加入 45 mL 的 1x PBS。
- 通过在 500 × g 离心 5 分钟来收获细胞。
- 通过分装 10 μL 细胞悬液并将其与台盼蓝 1:1 混合来计数细胞。将 10 μL 混合物移液到腔室计数载玻片中,然后将其插入细胞计数器(图 1I)。
4. 流式细胞术染色
- 将 250,000 个细胞分装到两个单独的 5 mL 聚苯乙烯圆底管中,用于一抗偶联抗体和同种型对照,用于表面标志物流式细胞分析。
注:可以使用更少的细胞来容纳下游分析所需的细胞计数和细胞数量。为了获得最佳流式细胞流式细胞,分析中至少应包括 50,000 个细胞。 - 根据制造商推荐的稀释度在 1x PBS 中稀释抗体(例如,抗人 EpCAM 和 CD10)和同种型。包括可固定活力染料 (e506) 和偶联的抗人 CD45 抗体,以阻挡活人免疫细胞。制备足够的抗体混合物,每管至少 50 μL。在冰上避光放置,直到第 4.4 步。
- 用 1 mL 的 1x PBS 洗涤细胞。通过在 4 °C 下以 500 × g 离心 5 分钟来收获细胞。
- 吸出 1x PBS。将沉淀重悬于抗体或同种型面板中,并在 4 °C 下避光孵育 15 分钟。
- 孵育后,在 1 mL 的 1x PBS 中稀释,并在 4 °C 下以 500 × g 离心 5 分钟收获细胞。
- 吸出 1x PBS 并将细胞沉淀重悬于 200 μL 的 1x PBS 中。
5. 流式细胞术数据收集
- 登录 FACS 机器。
注意:我们提出了使用参考流式细胞仪的方案(参见 材料表)。对于其他流式细胞仪,请遵循制造商的说明。流式细胞仪的电压设置已预先配置,可在人 PBMC 中实现最佳性能,无需在每次 FACS 运行前进行电压调整。 - 如果计算机处于采集模式,请跳至步骤 5.3。如果机器处于数据分析模式,请按右上角的电源按钮切换到采集模式。当显示弹出窗口时,按下显示 acquisition mode 的按钮。
- 在左下角,如果设备显示 Calibration Required(需要校准),则继续执行步骤 5.3.1。如果机器读取 Calibration ok(校准正常),请跳至步骤 5.4。
- 要校准机器,请将校准珠从 4 °C 冰箱中取出并涡旋。
- 将 1 滴校准微珠放入 5 mL 聚苯乙烯圆底管中,然后将试管放入单管支架中。
- 按下右上角的 条形码 按钮,扫描校准微珠瓶。将出现一个弹出窗口。如果所有内容都已设置完毕,请单击 Yes |确定 ,然后运行校准。
- 如果校准成功,请注销并重新登录 采集 模式。继续执行步骤 5.4。
- 单击左上角的 open | new workspace 。
- 选择 chill 5 机架;选择三个 Wells。选择第一个井并为其提供描述(例如,FTX Ab)。选择下一个井并为其提供唯一的描述(例如,FTX Iso)。选择最后一个井,并为其提供描述 bleach。
注:请务必在每 4-5 个实验样品后加入漂白剂样品,以确保及时清洁细胞样品。 - 选择所有孔并设置实验条件如下:仪器设置:人 PBMC; 流速:高; 混合样品:轻柔混合; 模式:标准;样品总体积 200 μL; 样品摄取量 150 μL;注释:输入抗体及其荧光团标记。
- 选择 edit | options 并在 description|apply | ok 下为文件命名。
- 从冰箱中取出架子,将其放在托盘上,条形码朝向机器。将样品管放在架子上以反映屏幕上的样品顺序,然后按 播放 按钮开始实验。
- 实验完成后,插入 USB,选择 “文件”|“复制”,展开“私有”文件夹,选择实验,然后单击 “复制并弹出”。
- 数据收集后,使用软件分析数据表。
- 从同种型对照开始。使用 多边形工具 选择前向散射 (FSC) 与侧向散射 (SSC) 图上的单元格。
- 通过将 Y 轴 更改为 e506 并将 X 轴 更改为 FSC 来选出死细胞。使用 多边形工具 选择 e506 阴性活细胞群。
- 双击选定的群体。将 Y 轴 更改为 人 CD45。使用 面工具 选择像元群。这是人类 CD45 阴性细胞群。
- 双击 CD45 阴性细胞群。将 Y 轴 更改为 直方图 ,将 X 轴 更改为 人类 EpCAM。使用 范围选择工具 单击直方图的末尾,然后选择直到图形末尾的空白区域。这代表 EpCAM 阳性群体。对人 CD10 染色重复此作。
- 将同种型门控拖动到抗体工作区下方。CD45 阳性细胞将被门控,并选择 EpCAM 阳性和 CD10 阳性群体。
- 要创建具有代表性的直方图,请选择 layout editor。将所需的直方图拖动到布局页面。要比较同种型和抗体染色,请将同种型直方图与抗体直方图叠加。根据同种型对照对阳性细胞进行门控。
6. 免疫细胞化学
- 在最终分离步骤后,在所需的腔室载玻片中培养细胞,直至汇合。
- 要固定细胞,加入 500 μL 冷的 4% 多聚甲醛 (PFA) 在室温下孵育 10 分钟。
- 吸出 4% PFA 并用 1x PBS 洗涤 3 次。
- 为了透化细胞,在 PBS 中加入至少 200 μL 的 0.25% Triton-X,并在室温下孵育 10 分钟。
- 在透化过程中,准备封闭缓冲液(4% 正常山羊血清 [NGS] 用于山羊中未产生的抗体)。
- 吸出 0.25% Triton-X 并用 1x PBS 洗涤 3 次。
- 添加至少 200 μL 封闭缓冲液(PBS 中的 4% NGS)。在室温下封闭 1 小时。
- 根据制造商的建议,在 1x PBS 中的 1% NGS 中制备一抗稀释液。
- 封闭后,加入至少 200 μL 的一抗溶液。在室温下孵育 2 小时。
注:一些一抗可能更喜欢 4 °C 过夜孵育;查看抗体数据表。 - 在 1x PBS 中的 1% NGS 中制备二抗溶液。用锡箔纸包裹试管并在黑暗中制备溶液,因为二抗对光敏感。避光存放直至准备好。
- 一抗孵育后,用 1x PBS 洗涤 3 次。
- 添加至少 200 μL 的二抗溶液。在室温下避光孵育 1 小时。
注意:在以下步骤中,请尽量将载玻片置于黑暗中。 - 二抗孵育后,用 1x PBS 洗涤 3 次。
- 只需用手取下腔室或使用载玻片随附的工具即可移除腔室。按照腔室载玻片包装上印制的说明进行拆卸。
- 加入一滴 4',6-二脒基-2-苯基吲哚 (DAPI) 封片血清,并在顶部放置盖玻片。限制气泡的数量并确保所有单元格都被覆盖。可选步骤:在边缘周围使用指甲油密封盖玻片。
- 将载玻片平放在载玻片盒中晾干,并置于 4 °C 直至成像。
- 在配备基于二抗偶联的正确荧光的显微镜上成像,以确保图像清晰。
结果
我们纳入了 7 个输卵管集合,我们在其中分离出丰富的上皮细胞群(图 2A 和 补充图 S1A)。为了评估这种单细胞悬悬法的活力和上皮细胞富集度,进行了流式细胞术。为了测量细胞活力,用活力标记物 e506 对细胞进行染色。这也允许在分析时选出所有碎片和死细胞。
为了确定通过该方法分离的细胞的组成,用上皮细胞标志物 (EpCAM) 、基质细胞标志物 (CD10) 和免疫细胞标志物 (CD45) 对样品进行染色。如图 2B 所示,我们从输卵管组织中分离出一个活的且丰富的上皮细胞群。样品活力平均为 82%。对于所有样品,在门控 CD45 阳性细胞后,我们观察到富集的上皮细胞群,其中 EpCAM 阳性细胞平均占样品的 80%。有一些基质细胞污染,但平均只有 7.8%。图 2C 显示了铺板后 4-6 天的 2D 分离细胞。很明显,上皮细胞是分离出来的,因为它们形成了一致的粘附鹅卵石状簇。在补充图 S1B 中,分离后对细胞进行铺板并培养 2-6 天。免疫细胞化学用于表征培养物中生长的细胞。培养物中的大多数细胞对 EpCAM 和分泌细胞标志物 PAX8 染色呈阳性。只有少数细胞被鉴定为波形蛋白阳性。在培养物中可以看到纤毛细胞,如视频 S1 所示。
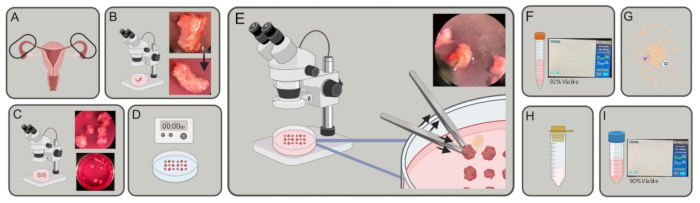
图 1:实验架构。 (A) 输卵管获得性。(B) 去除多余的脂肪和结缔组织。(C) 将试管切成 ~3-5 mm 的小块。(D) 将碎片在 PBS 中洗涤,然后在 EDTA 中孵育 2x 5 分钟,并在 4 °C 下在 1% 胰蛋白酶中孵育 40 分钟。(E) 使用两对镊子,一对握住,一对推动,将上皮细胞从输卵管碎片中排出。(F) 将细胞转移至 15 mL 试管中,离心并计数。(G) 重悬于 DMEM、胶原酶和 DNase 中。消化 30-45 分钟。(H) 用 100 μm 过滤器过滤。(I) 离心收获并计数。 请单击此处查看此图的较大版本。
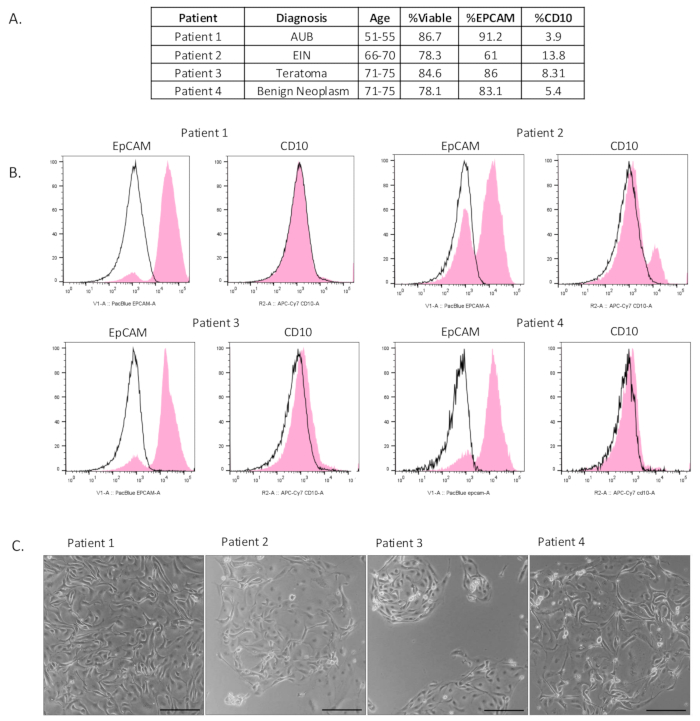
图 2:分离的上皮细胞的表征。 (A) 患者临床信息和流式细胞术结果表。(B) 分离后进行流式细胞术,显示已分离出富集的上皮细胞群 (EpCAM 阳性)。同种型阴性对照用黑色表示,实验结果用粉红色表示。(C) 分离后对细胞进行铺板。电镀后 4-6 天拍摄照片。比例尺 = 100 μm。缩写:AUB = 异常子宫出血;EIN = 子宫内膜上皮内瘤变。 请单击此处查看此图的较大版本。
补充 图 S1:培养物中分离的上皮细胞的额外表征。 (A) 患者临床信息表。(B) 分离的细胞在铺板后 2-6 天进行 EpCAM、分泌细胞标志物 (PAX8) 和基质细胞标志物 (Vimentin) 染色,以表征培养中的细胞类型。比例尺 = 50 μm。缩写: EIN:子宫内膜上皮内瘤变;DAPI = 4',6-二脒基-2-苯基吲哚。请按此下载此图。
补充视频 S1:以 30 倍放大倍率拍摄跳动纤毛细胞的视频,以展示培养中的纤毛细胞。请点击此处下载此视频。
讨论
人们对研究输卵管上皮细胞产生了相当大的兴趣,因为输卵管在生殖中起着重要作用,并且是大多数 HGSOC 的起源部位。为此,许多研究人员描述了在人和小鼠模型中分离输卵管细胞的方案10、11、12、15、16、17、18、19、20、21。我们描述的提取和富集输卵管上皮细胞的方法增加了现有的输卵管细胞分离方案。尽管这些方案中存在重叠,但在小鼠和人类中报告了两种一般类型的方法。第一个涉及切碎和酶消化整个输卵管,得到总细胞悬液 10,12,15,16,17。第二种涉及搅动或刮擦脱落,这会产生组织片 11,18,19,20,21。这两种方法都允许通过下游实验(如流式细胞术、测序和体外培养)分析上皮细胞。我们方法的一个主要优点是该方案产生了一组输卵管细胞,这些细胞已经通过酶消化和机械推动步骤富集了上皮细胞。这种富含上皮细胞的细胞群可以进一步消化,从而得到可用于流式细胞术、2D 培养、免疫细胞化学和单细胞 RNA 测序等许多应用的单细胞悬液。
我们发现影响细胞产量的关键步骤包括输卵管片段在 1% 胰蛋白酶/HBSS 和 DMEM/DNase 中孵育的持续时间。在任一溶液中过度孵育都会降解细胞并显著降低细胞的活力。然而,孵育时间不足会抑制研究人员在方案步骤 2.6 中推出许多上皮细胞的能力,因为它们将继续相互粘附。使用 1% 胰蛋白酶溶液也很重要,因为较低和较高浓度的胰蛋白酶溶液都会降低活的输卵管上皮细胞的产量。通过结合化学和机械分离以及消化步骤(方案步骤 3.1),我们可以成倍缩短从组织到单细胞悬液所需的时间。这确保了良好的活力和在同一天进行下游分析的时间。
在方案步骤 1.4 中,确保输卵管切口的块厚 3-5 毫米至关重要。如果碎片太大,将难以执行方案步骤 2.7 并最终降低细胞产量,因为需要在 DMEM/DNase 中孵育更长的时间。
尽管细胞悬液富含上皮细胞,但基质细胞污染是不可避免的。如果制备需要纯上皮细胞,则可以使用流式细胞术和我们描述的标记物进行分选,以分离上皮细胞并耗尽基质细胞。
本研究使用绝经后输卵管。然而,这种方法已经在我们的实验室中成功地用于绝经前输卵管。绝经前和绝经后输卵管的主要区别在于纤毛细胞和分泌上皮细胞的组成1。该协议适用于所有生殖阶段。
这种有效的方案将有助于研究输卵管上皮细胞的类型,包括描绘细胞谱系、它们在生殖周期期间和绝经后的动态变化,以及它们在引发高级别浆液性卵巢癌中的作用。
披露声明
作者没有需要声明的利益冲突。
致谢
作者 Ruegg L、James-Allan LB 和 DiBernardo G 得到了大洛杉矶退伍军人协会项目 1I01BX006019-01A2 和 I01BX006411-01 到 Memarzadeh S 的部分支持。作者 Ochoa C 得到了加州大学洛杉矶分校 Eli 和 Edythe Broad 再生医学中心以及干细胞研究中心 Rose Hills 基金会研究生奖学金培训计划的支持。我们要感谢加州大学洛杉矶分校的转化病理学核心实验室,特别是 Ko Kiehle 和 Chloe Yin 在组织采购方面的帮助。我们还要感谢 Ken Yamauchi 和 BSCRC 显微镜核心在成像方面的帮助。 图 1 是使用 BioRender.com(协议编号 JL27QWDYNT)创建的。最后,我们要感谢 Felicia Cordea 和 BSCRC 流式细胞术核心在流式细胞术方面的帮助。
材料
| Name | Company | Catalog Number | Comments |
| 1% Trypsin | Thermo Scientific | J63993.09 | |
| 100 µm Cell Strainer | Corning | 431752 | |
| 4% Paraformaldehyde | Electron Microscopy Sciences | 15710-S | |
| 5 mL round bottom tubes | Corning | 352008 | |
| 60 mm cell culture plate | Corning | CLS430589-500EA | |
| 6-well Cell Culture Plate | Corning | 353046 | |
| Anti-CD10 | BioLegend | 312212 | |
| Anti-CD326 (Ep-CAM) | BioLegend | 324218 | |
| Anti-CD45 | BioLegend | 304026 | |
| Anti-EpCAM | Abcam | ab223582 | |
| Anti-IgG2a PerCP | BioLegend | 400250 | |
| Anti-PAX8 | Sigma-Aldrich | 363M-15 | |
| Anti-Vimentin | Agilent Technologies | M072501-2 | |
| Chamber Slide System | Thermo Scientific | 154917PK | |
| Collagenase | Thermo Scientific | 17100017 | |
| DMEM | Thermo Scientific | 10569-010 | |
| DNase I | Sigma | 10104159001 | |
| EDTA | Sigma | 3690 | |
| eFluor 506 | Invitrogen | 65-0866-14 | |
| FBS | Sigma | F2442 | |
| Fine point forceps | VWR | 102091-526 | Any finepoint forceps of your choice will work |
| Fixable Viability Dye eFluor 506 | Invitrogen | 65-0866-14 | |
| FlowJo software version 9 | BD Biosciences | Data analysis software | |
| GlutaMAX | Gibco | 35050-061 | |
| HBSS | Thermo Scientific | 14175-095 | |
| MACSQuant Analyzer 10 flow cytometer | Miltenyi Biotec | ||
| MACSQuant Calibration Beads | Miltenyi Biotec | 130-093-607 | |
| Mammocult | Stemcell Technologies | 5620 | |
| Normal Goat Serum | Fisher Scientific | PI31873 | |
| PBS | Thermo Scientific | 14190-144 | |
| Penicillin-Streptomyocin | Gibco | 15140-122 | |
| PerCP Conjugated CD45 | BioLegend | 304026 | |
| Red Blood Cell lysis buffer | Tonbo Biosciences | TNB-4300-L100 | |
| Triton X-100 | Thermo Scientific | BP151-100 | |
| Vannas-Tubingen Spring Scissors | Fine Science Tools | 15003-08 | |
| VECTASHIELD with DAPI | Fisher Scientific | NC9524612 |
参考文献
- Crow, J., Amso, N. N., Lewin, J., Shaw, R. W. Morphology and ultrastructure of fallopian tube epithelium at different stages of the menstrual cycle and menopause. Hum Reprod. 9 (12), 2224-2233 (1994).
- Patek, E., Nilsson, L., Johannisson, E. Scanning electron microscopic study of the human fallopian tube. Report II. Fetal life, reproductive life, and postmenopause. Fert Steril. 23 (10), 719-733 (1972).
- Coan, M., et al. Exploring the role of fallopian ciliated cells in the pathogenesis of high-grade serous ovarian cancer. Int J Mol Sci. 19 (9), 2512(2018).
- Leese, H., Tay, J., Reischl, J., Downing, S. Formation of fallopian tubal fluid: role of a neglected epithelium. Reproduction. 121 (3), 339-346 (2001).
- Donnez, J., Casanas-Roux, F., Ferin, J., Thomas, K. Changes in ciliation and cell height in human tubal epithelium in the fertile and post-fertile years. Maturitas. 5 (1), 39-45 (1983).
- Lengyel, E., et al. A molecular atlas of the human postmenopausal fallopian tube and ovary from single-cell RNA and ATAC sequencing. Cell Rep. 41 (12), 111838-111838 (2022).
- Tao, T., et al. Loss of tubal ciliated cells as a risk for "ovarian" or pelvic serous carcinoma. Am J Cancer Res. 10 (11), 3815(2020).
- Li, J., Fadare, O., Xiang, L., Kong, B., Zheng, W. Ovarian serous carcinoma: recent concepts on its origin and carcinogenesis. J Hematol Oncol. 5 (1), 8(2012).
- Hu, Z., et al. The repertoire of serous ovarian cancer non-genetic heterogeneity revealed by single-cell sequencing of normal fallopian tube epithelial cells. Cancer Cell. 37 (2), 226-242.e7 (2020).
- Dinh, H. Q., et al. Single-cell transcriptomics identifies gene expression networks driving differentiation and tumorigenesis in the human fallopian tube. Cell Rep. 35 (2), 108978(2021).
- Ulrich, N., et al. Cellular heterogeneity of human fallopian tubes in normal and hydrosalpinx disease states identified using scRNA-seq. Dev Cell. 57 (7), 914-929.e7 (2022).
- Brand, J., et al. Fallopian tube single cell analysis reveals myeloid cell alterations in high-grade serous ovarian cancer. iScience. 27 (3), 108990-108990 (2024).
- Memarzadeh, S., et al. Cell-autonomous activation of the PI3-kinase pathway initiates endometrial cancer from adult uterine epithelium. Proc Natl Acad Sci USA. 107 (40), 17298-17303 (2010).
- Cunha, G. R. Stromal induction and specification of morphogenesis and cytodifferentiation of the epithelia of the mullerian ducts and urogenital sinus during development of the uterus and vagina in mice. J Exp Zool. 196 (3), 361-369 (1976).
- Xie, Y., Park, E. -S., Xiang, D., Li, Z. Long-term organoid culture reveals enrichment of organoid-forming epithelial cells in the fimbrial portion of mouse fallopian tube. Stem Cell Res. 32 (1873-5061), 51-60 (2018).
- Karst, A. M., Drapkin, R. Primary culture and immortalization of human fallopian tube secretory epithelial cells. Nat Protoc. 7 (9), 1755-1764 (2012).
- Ford, M. J., Harwalkar, K., Yamanaka, Y. Protocol to generate mouse oviduct epithelial organoids for viral transduction and whole-mount 3D imaging. STAR Protocols. 3 (1), 101164(2022).
- Radecki, K. C., Lorenson, M. Y., Carter, D. G., Walker, A. M. Microdissection and dissociation of the murine oviduct: Individual segment identification and single cell isolation. J Vis Exp. (177), e63168(2021).
- Feng, L., et al. Protocol for the detection of organoid-initiating cell activity in patient-derived single fallopian tube epithelial cells. Methods Mol Bio. 2429, 445-454 (2022).
- Kessler, M., et al. The Notch and Wnt pathways regulate stemness and differentiation in human fallopian tube organoids. Nat Commun. 6 (1), 8989(2015).
- Fotheringham, S., Levanon, K., Drapkin, R. Ex vivo culture of primary human fallopian tube epithelial cells. J Vis Exp. (51), e2728(2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。