Method Article
단세포 분석을 위한 인간 나팔관 상피를 추출하는 효율적인 방법
요약
이 프로토콜은 인간 나팔관 상피 세포를 분리하기 위한 1일 방법을 설명합니다. 분리된 상피 세포는 2차원(2D) 배양으로 도말링하거나 단일 세포 현탁액으로 해리할 수 있으며 유세포 분석 및 단일 세포 RNA 염기서열 분석을 포함한 다운스트림 실험에 활용할 수 있습니다.
초록
인간 나팔관은 생식에 내재되어 있습니다. 나팔관의 목적은 정자, 난자, 그리고 수정이 성공적일 경우 배아의 이동을 허용하는 것입니다. 나팔관의 내부 표면을 감싸고 있는 상피 세포는 질병 발병을 포함하여 정상 및 비정상 나팔관 과정 모두에 필수적입니다. 폐경기 이후에는 나팔관이 신체에서 중요한 역할을 하지 않게 되고 상피내 세포 구성이 바뀝니다. 우리는 이러한 상피 세포를 기질 세포 오염을 최소화하면서 신선한 나팔관에서 단일 세포 현탁액으로 분리할 수 있는 방법을 설명합니다. 이러한 세포는 배양에서 성장시키거나 유세포 분석 및 단일 세포 RNA 염기서열분석과 같은 추가 분석에 사용할 수 있습니다. 이 분리 프로토콜은 4-6시간 내에 달성할 수 있으며 즉각적인 다운스트림 분석에 사용할 수 있는 생존 가능한 세포를 생성합니다. 이 효율적인 프로토콜은 풍부한 상피 집단을 가진 나팔관 상피 세포의 분리를 용이하게 합니다.
서문
나팔관은 여러 부분으로 구성되어 있습니다. 난소에서 자궁까지 나팔관은 핌브리아(fimbriae), 앰풀라(ampulla), 협부(isthmus) 및 벽내 부분으로 구성됩니다. fimbriae는 난소에서 방출된 난자를 잡는 나팔관의 끝에서 뻗어 있습니다. 그런 다음 난자는 수정될 가능성이 가장 높은 앰풀라를 통해 지협으로 이동하고 최종적으로 벽내 부분1을 통해 자궁으로 전달됩니다. 난자 수송을 촉진하는 나팔관의 가장 안쪽 점막은 섬모 세포와 분비 세포를 포함한 내강 상피층으로 구성되어 있습니다. 섬모 세포는 fimbriae2에 더 집중되는 경향이 있습니다. 그들은 난소에서 자궁으로 나팔관을 통해 난자를 물리적으로 이동시키는 데 필수적인 역할을 합니다. 그들의 부속물은 섬모 세포가 난자를 따라 움직일 수 있도록 할 뿐만 아니라 배란 후 유전독성 스트레스를 제거할 수 있도록 합니다3.
분비된 나팔관 상피 세포는 영양과 배우자 조립을 돕는 액체를 분비합니다4. 나팔관 상피를 따라 있는 섬모 세포와 분비 세포의 비율은 폐경 후 상태에서 다르며, 나팔관이 더 이상 수송에서 중요한 기능을 수행하지 않기 때문에 섬모 세포의 감소와 함께 다르다5. 더욱이, 에스트로겐이 없으면 나팔관이 흔적이 되는 것으로 생각됩니다 1,6. 나팔관에서 섬모 세포가 손실되는 것은 장액성 암종의 발병 위험을 높이는 것으로 여겨진다7. 또한, 나팔관 분비 상피 세포는 난관암의 가장 공격적인 아형인 높은 등급의 장액성 암종의 전조인 장액성 난관내 암종(STIC) 병변을 유발하는 것으로 생각됩니다 7,8.
이 프로토콜의 목적은 인간 나팔관에서 상피 세포를 분리하고 단일 세포 현탁액으로 해리하는 것입니다. 이 프로토콜은 많은 분석에 사용할 수 있는 풍부한 단일 세포 상피 집단을 생성합니다. 이 원고에서 볼 수 있듯이 당사는 유세포 분석을 수행하고 분리 후 세포를 2D로 도금했습니다. 유세포 분석 분석은 대부분 생존 가능하고 본질적으로 상피인 단일 세포의 존재를 보여줍니다. 이 분석에는 생존력에 대한 e506, 상피 세포에 대한 EpCAM, 면역 세포에 대한 CD45, 기질 세포에 대한 CD10의 4가지 마커가 포함되었습니다. 죽은 세포는 e506 생존력 마커를 사용하여 배제하고 면역 세포는 CD45를 사용하여 게이 아웃했습니다. 현탁액이 면역 세포 집단을 가질 수 있습니다. 그러나 상대적으로 순수한 상피 세포 집단을 얻기 위해 CD45 고갈 키트를 사용하여 CD45 양성 세포를 고갈시킬 수 있습니다. 또한, 배양에서 도금될 때 CD45 양성 세포는 종종 증식하지 않습니다. 이 방법을 통해 분리되고 2D로 성장한 세포는 부착된 조약돌과 같은 상피 집단을 보여줍니다. 이 방법은 단일 세포 RNA 라이브러리로 개발할 수 있는 세포 제제를 생성하는 데 사용할 수 있습니다.
지난 4년 동안 나팔관 상피의 세포 계통, 생식 생활의 여러 단계에서 이러한 계통의 변화, 악성 변형 및 발생을 유발하는 사건을 정의하기 위한 연구가 더욱 두드러졌습니다 6,9,10,11,12 . 이 프로토콜은 나팔관 상피를 분리하고 단일 세포로 처리하는 효율적인 방법을 제공함으로써 이 분야의 연구에 상당한 도움이 될 것입니다.
프로토콜
이 프로토콜은 앞서 설명한 자궁 상피 세포 분리 방법으로부터 채택되었다13,14. 비식별화된 나팔관의 새로운 표본을 UCLA(University of California, Los Angeles) IRB 승인 프로토콜 #10-0727을 통해 수집하여 약 4-6시간 이내에 단일 세포 현탁액으로 소화했습니다.
1. 나팔관 채취 및 준비
- 15mL 또는 50mL 튜브에 담긴 해리 배지(10% 소 태아 혈청(FBS), 5mL L-글루타민 및 5mL의 페니실린/스트렙토마이신을 함유한 DMEM[4.5g/L D-포도당])에서 신선한 인간 나팔관(그림 1A)을 채취하여 얼음을 타고 실험실로 운반합니다.
- 나팔관을 신선한 해리 매체가 들어 있는 멸균 페트리 접시로 옮깁니다.
- 해부 현미경으로 미세한 집게와 Vannas Tubingen 가위를 사용하여 지방, 결합 조직 및 튜브를 둘러싼 혈관을 해부합니다(그림 1B).
- 해부 현미경 아래에서 가위로 나팔관의 관상평면을 절단하여 미세한 점 겸자를 사용하여 조직을 안정화하기 위해 각각 직경 ~3-5mm의 작은 실린더(그림 1C)를 만듭니다.
2. 상피 세포 분리 및 해리
- 접시에서 해리 매체를 조심스럽게 흡인합니다.
- ~2mL를 부드럽게 피펫팅하여 조각을 덮고 플레이트를 가볍게 회전시켜 차가운 1x 인산염 완충 식염수(PBS)로 조직 조각을 2x 세척합니다.
- 최종 1x PBS 세척을 흡인하고 실온에서 차가운 5mM 에틸렌디아민테트라아세트산(EDTA)에서 조직 조각을 5분 동안 배양하고 총 2회 배양 동안 반복합니다. 각 배양 후 5mM EDTA를 흡인합니다.
- 조직 조각을 차가운 1% Trypsin/Hanks' Balanced Salt Solution(HBSS)에 현탁시키고 4°C에서 40분 동안 배양합니다(그림 1D).
- 1% 트립신/HBSS를 흡인하고 조직 조각을 저온 해리 매체에서 2회 세척하여 트립신을 비활성화합니다.
- 실온에서 최소 30분 동안 0.4mg의 DNase와 함께 2mL의 해리 배지에 조직 조각을 배양합니다.
참고: 더 긴 배양 기간이 필요할 수 있지만 2.7단계를 시작하기 전에 45분을 초과하지 마십시오. - 해부 현미경으로 DNase가 있는 배지에 있는 동안 접시 바닥과 평행한 내강인 나팔관 조각을 집게로 제자리에 고정합니다. 다른 한편으로, 집게로 나팔관 조각을 반복적으로 눌러 관의 내강에서 상피 세포를 배출합니다. 세포가 튜브의 내강에서 방출될 때 조직 주위에 세포의 후광이 보이는지 확인합니다. 접시에 있는 나팔관의 각 조각에 대해 반복합니다(그림 1E).
- 세포가 포함된 배지를 멸균된 15mL 튜브로 옮기고, 해리 배지로 페트리 접시를 2회 이상 세척한 다음, 세척액을 15mL 튜브에 결합합니다. 기질 튜브 조각을 버립니다.
- 500 × g 에서 5분 동안 원심분리하여 세포를 수확합니다. 상등액을 흡입하고 펠릿을 1mL의 해리 배지에 재현탁합니다.
- 세포 현탁액 10μL를 분취하고 트리판 블루와 1:1로 혼합하여 세포 수를 계산합니다. 혼합물 10μL를 챔버 카운팅 슬라이드에 피펫팅하고 세포 카운터에 삽입합니다(그림 1F).
3. single-cell 현탁액에 대한 소화
- 9mL의 해리 배지, 1mL의 8mg/mL 콜라겐분해효소(유형 1) 및 0.4mg의 DNase에 세포를 재현탁합니다. 37°C에서 200rpm의 오비탈 쉐이커에서 30-45분 동안 배양합니다(그림 1G).
- 500 × g 에서 5분 동안 원심분리하여 세포를 수확합니다. 상등액을 흡입하고 펠릿을 5mL의 해리 매체에 재현탁시켜 콜라겐분해효소를 씻어냅니다.
- 100μm 세포 여과기를 통해 세포 현탁액을 50mL 튜브에 통과시킵니다(그림 1H).
- 500 × g 에서 5분 동안 원심분리하여 세포를 수확합니다.
- 세포 펠릿이 빨간색으로 나타나면 3.6–3.8단계에 설명된 대로 적혈구(RBC) 용해를 수행합니다. 셀 펠릿이 빨간색이 아닌 경우 3.9단계로 건너뜁니다.
- 500μL의 RBC 용해 완충액을 4.5mL의 초순수에 희석합니다.
- 배지를 흡인하고 희석된 RBC 용해 완충액 5mL를 추가한 다음 얼음에서 3분 동안 배양합니다.
- RBC 용해를 중지하려면 50mL 튜브에 1x PBS 45mL를 추가합니다.
- 500 × g 에서 5분 동안 원심분리하여 세포를 수확합니다.
- 세포 현탁액 10μL를 분주하고 트리판 블루와 1:1로 혼합하여 세포를 계산합니다. 혼합물 10μL를 챔버 카운팅 슬라이드에 피펫팅하고 세포 카운터에 삽입합니다(그림 1I).
4. 유세포 분석 염색
- 250,000개의 세포를 2개의 별도 5mL 폴리스티렌 원형 바닥 튜브로 분할하여 1차 접합 항체 및 isotype control을 통해 표면 마커 유세포 분석에 사용할 수 있습니다.
참고: 다운스트림 분석에 필요한 세포 수와 세포 수를 수용하기 위해 더 적은 수의 세포를 사용할 수 있습니다. 최적의 유동 결과를 얻으려면 최소 50,000개의 셀이 분석에 포함되어야 합니다. - 항체(예: anti-human EpCAM 및 CD10)와 isotype을 제조업체에서 권장하는 희석액에 따라 1x PBS로 희석합니다. 고정성 생존도 염료(e506)와 접합 항인간 CD45 항체를 포함하여 살아있는 인간 면역 세포를 차단합니다. 튜브당 최소 50μL의 항체 혼합물을 만듭니다. 4.4단계까지 얼음 위의 어둠 속에 두십시오.
- 1x PBS 1mL로 세포를 세척합니다. 500 × g 에서 4 °C에서 5 분 동안 원심 분리하여 세포를 수확합니다.
- 1x PBS를 흡인합니다. 펠릿을 항체 또는 동형 패널에 재현탁시키고 어둠 속에서 4°C에서 15분 동안 배양합니다.
- 배양 후 1x PBS 1mL에 희석하고 4°C에서 5분 동안 500× g 의 원심분리로 세포를 수확합니다.
- 1x PBS를 흡입하고 200μL의 1x PBS에 세포 펠릿을 재현탁합니다.
5. 유세포 분석 데이터 수집
- FACS 시스템에 로그인합니다.
참고: 참조된 유세포 분석기를 사용하는 프로토콜을 제시합니다( 재료 표 참조). 다른 유세포 분석기의 경우 제조업체의 지침을 따르십시오. 유세포 분석기의 전압 설정은 human PBMC에서 최적의 성능을 발휘할 수 있도록 사전 구성되어 있으므로 각 FACS 실행 전에 전압을 조정할 필요가 없습니다. - 컴퓨터가 획득 모드에 있는 경우 5.3단계로 건너뜁니다. 기기가 데이터 분석 모드에 있는 경우 오른쪽 상단의 전원 버튼을 눌러 수집 모드로 변경합니다. 팝업이 표시되면 획득 모드(Acquisition Mode)를 읽는 버튼을 누릅니다.
- 왼쪽 하단에서 기기에 Calibration Required(보정 필요)가 표시되면 5.3.1단계로 진행합니다. 기계에 Calibration(보정)이 확인되면 5.4단계로 건너뜁니다.
- 기계를 보정하려면 4°C 냉장고와 와류에서 보정 비드를 꺼냅니다.
- 5mL 폴리스티렌 원형 바닥 튜브에 보정 비드 1방울을 놓고 튜브를 단일 튜브 홀더에 넣습니다.
- 오른쪽 상단의 바코드 버튼을 누르고 보정 비드 병을 스캔합니다. 팝업이 나타납니다. 모든 것이 설정되었으면 예 | 확인을 클릭하고 보정을 실행합니다.
- 보정에 성공하면 로그아웃했다가 다시 수집 모드로 로그인합니다. 5.4단계로 진행합니다.
- 왼쪽 상단의 열기 | 새 작업 공간을 클릭합니다.
- 냉각 5 랙을 선택하십시오. 우물 중 세 개를 선택합니다. 첫 번째 웰을 선택하고 설명(예: FTX Ab)을 입력합니다. 다음 웰을 선택하고 고유한 설명(예: FTX Iso)을 지정합니다. 마지막 우물을 선택하고 표백제라는 설명을 지정하십시오.
참고: 세포 샘플을 적시에 세척할 수 있도록 4-5개의 실험 샘플마다 항상 표백제 샘플을 포함하십시오. - 모든 웰을 선택하고 다음과 같이 실험 조건을 설정합니다: 기기 설정: 인간 PBMC; 유속: 높음; 믹스 샘플 : 부드러운 혼합; 모드: 표준; 시료 총량 200 μL; 시료 흡수 150 μL; 주석: 입력 항체 및 형광단 라벨링.
- 편집 | 옵션을 선택하고 설명| 적용 | 확인 아래에 파일 이름을 지정합니다.
- 냉장고에서 랙을 꺼내 바코드가 기계를 향하도록 트레이에 놓습니다. 샘플 튜브를 랙에 놓아 샘플의 순서를 화면에 반영하고 재생 버튼을 눌러 실험을 시작합니다.
- 실험이 완료되면 USB를 연결하고, 파일 | 복사를 선택하고, 개인 폴더를 확장하고, 실험을 선택하고, 복사 및 꺼내기를 클릭합니다.
- 데이터 수집 후 소프트웨어를 사용하여 데이터 시트를 분석합니다.
- isotype 컨트롤로 시작합니다. 다각형 도구를 사용하여 전방 산점도(FSC) 대 측면 산란(SSC) 플롯에서 셀을 선택합니다.
- Y축을 e506으로, X축을 FSC로 변경하여 죽은 세포를 제거합니다. polygon 도구를 사용하여 e506 음성 라이브 셀 모집단을 선택합니다.
- 선택한 모집단을 두 번 클릭합니다. Y축을 human CD45로 변경합니다. 폴리곤 도구를 사용하여 세포 모집단을 선택합니다. 이것은 인간 CD45 음성 세포 집단입니다.
- CD45 음성 세포 집단을 두 번 클릭합니다. Y축을 히스토그램 으로, X축을 human EpCAM으로 변경합니다. 범위 선택 도구를 사용하여 히스토그램의 끝을 클릭하고 그래프 끝까지 빈 공간을 선택합니다. 이는 EpCAM 양성 모집단을 나타냅니다. 인간 CD10 염색에 대해 반복합니다.
- isotype 게이팅을 항체 작업 공간 아래로 드래그합니다. CD45 양성 세포는 게이트아웃되고 EpCAM 양성 및 CD10 양성 집단이 선택됩니다.
- 대표 히스토그램을 만들려면 레이아웃 편집기를 선택합니다. 원하는 히스토그램을 레이아웃 페이지로 드래그합니다. isotype과 항체 염색을 비교하려면 isotype 히스토그램을 항체 히스토그램과 오버레이합니다. isotype control을 기반으로 positive cells를 게이트합니다.
6. 면역세포화학(Immunocytochemistry)
- 원하는 챔버에서 최종 분리 단계 후 배양 세포는 합류할 때까지 유리로 미끄러집니다.
- 세포를 고정하기 위해 500μL의 차가운 4% 파라포름알데히드(PFA)를 첨가하고 실온에서 10분 동안 배양합니다.
- 4% PFA를 흡입하고 1x PBS로 3x 세척합니다.
- 세포를 투과화하려면 PBS에 0.25% Triton-X를 200μL 이상 첨가하고 실온에서 10분 동안 배양합니다.
- 투과화 과정에서 차단 완충액(염소에서 생성되지 않는 항체의 경우 4% 정상 염소 혈청[NGS])을 준비합니다.
- 0.25% Triton-X를 흡입하고 1x PBS로 3x 세척합니다.
- 최소 200μL의 차단 버퍼(PBS의 경우 4% NGS)를 추가합니다. 실온에서 1시간 동안 차단합니다.
- 제조업체의 권장 사항에 따라 1x PBS의 1% NGS로 1차 항체 희석액을 준비합니다.
- 차단 후 1차 항체 용액을 200μL 이상 첨가합니다. 실온에서 2시간 동안 배양합니다.
참고: 일부 1차 항체는 4°C의 야간 배양을 선호할 수 있습니다. 항체 데이터 시트를 확인하십시오. - 1x PBS에서 1% NGS로 2차 항체 용액을 준비합니다. 튜브를 은박지로 감싸고 2차 항체가 빛에 민감하므로 어두운 곳에서 용액을 준비합니다. 준비가 될 때까지 어두운 곳에 보관하십시오.
- 1차 항체 배양 후, 1x PBS로 3x 세척합니다.
- 200μL 이상의 2차 항체 용액을 추가합니다. 실온에서 1시간 동안 어두운 곳에서 배양합니다.
알림: 다음 단계에서는 슬라이드를 가능한 한 어두운 곳에 두십시오. - 2차 항체 배양 후, 1x PBS로 3x 세척합니다.
- 챔버를 손으로 제거하거나 슬라이드와 함께 제공된 도구를 사용하여 챔버를 제거하십시오. 챔버 슬라이드 포장에 인쇄된 지침을 따라 제거하십시오.
- 4',6-디아미디노-2-페닐린돌(DAPI) 마운팅 세럼 한 방울을 넣고 상단에 커버슬립을 놓습니다. 거품의 수를 제한하고 모든 셀이 덮여 있는지 확인하십시오. 선택 단계: 가장자리 주위에 매니큐어를 사용하여 커버슬립을 밀봉합니다.
- 슬라이드를 슬라이드 상자에 평평하게 놓아 건조시키고 이미징할 때까지 4°C에 놓습니다.
- 깨끗한 이미지를 보장하기 위해 2차 항체 접합을 기반으로 올바른 형광이 장착된 현미경의 이미지.
결과
우리는 농축된 상피 세포 집단을 분리한 7개의 나팔관 채취를 포함했습니다(그림 2A 및 보충 그림 S1A). 이 단일 세포 현탁 방법의 생존력과 상피 세포 농축을 평가하기 위해 유세포 분석이 수행되었습니다. 세포 생존율을 측정하기 위해 세포를 생존율 마커 e506으로 염색했습니다. 이를 통해 또한 분석 시 모든 파편과 죽은 세포를 제거할 수 있었습니다.
이 방법을 통해 분리된 세포의 구성을 결정하기 위해 샘플을 상피 세포 마커(EpCAM), 기질 세포 마커(CD10) 및 면역 세포 마커(CD45)로 염색했습니다. 그림 2B에서 볼 수 있듯이, 우리는 나팔관 조직에서 생존 가능하고 풍부한 상피 세포 집단을 분리했습니다. 샘플 생존율은 평균 82%였습니다. 모든 샘플에 대해 CD45 양성 세포를 게이팅한 후 샘플의 평균 80%를 차지하는 EpCAM 양성 세포가 있는 풍부한 상피 세포 집단을 관찰했습니다. 약간의 기질 세포 오염이 있었지만 평균적으로 7.8%에 불과했습니다. 그림 2C 는 도금 후 4-6일 후에 2D로 분리된 세포를 보여줍니다. 상피 세포가 일관되게 부착된 조약돌처럼 보이는 클러스터를 형성하면서 분리되었다는 것은 명백합니다. 보충 그림 S1B에서, 세포를 분리 후 도말하고 2-6일 동안 배양하였다. 배양에서 성장하는 세포를 특성화하기 위해 면역세포화학(Immunocytochemistry)을 사용했습니다. 배양액에 참여한 대부분의 세포는 EpCAM과 분비 세포 마커 PAX8에 대해 양성으로 염색되었습니다. 소수의 세포만이 비멘틴 양성으로 확인되었습니다. 섬모세포는 보충 비디오 S1에 표시된 비디오에 의해 포착된 바와 같이 배양에서 관찰되었습니다.
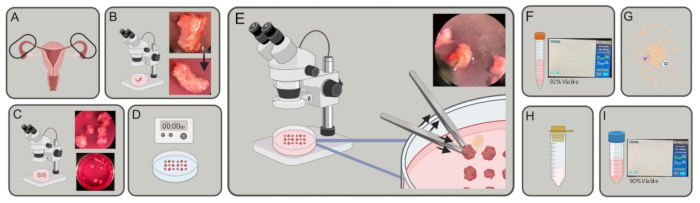
그림 1: 실험적 스키마. (A) 나팔관을 획득합니다. (B) 과도한 지방과 결합 조직이 제거됩니다. (C) 튜브는 ~ 3-5mm 조각으로 절단됩니다. (D) 조각을 PBS에서 세척 한 다음 EDTA 2x에서 5 분 동안 배양하고 4 ° C에서 40 분 동안 1 % 트립신에서 배양합니다. (E) 두 쌍의 집게를 사용하여 하나는 잡고 다른 하나는 밀어 나팔관 조각에서 상피 세포를 배출합니다. (F) 세포를 15mL 튜브로 옮기고 스핀 및 계수합니다. (G) DMEM, 콜라겐분해효소 및 DNase에서 재현탁. 30-45분 동안 분해합니다. (H) 100μm 스트레이너로 걸러냅니다. (I) 원심분리 및 계수에 의한 수확. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
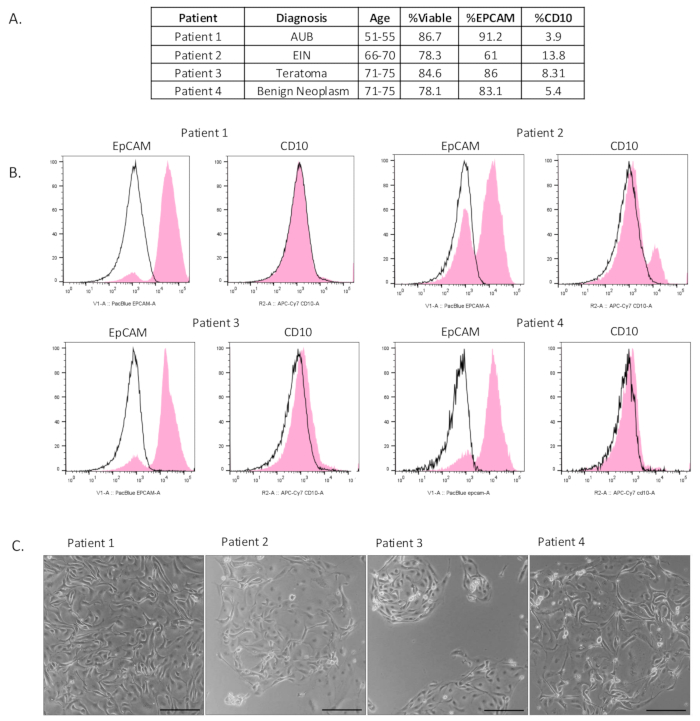
그림 2: 분리된 상피 세포의 특성화. (A) 환자 임상 정보 및 유세포 분석 결과 표. (B) 농축된 상피 세포 집단(EpCAM 양성)이 분리되었음을 보여주기 위해 분리 후 유세포 분석을 수행했습니다. Isotype negative control은 검은 색으로 표시되고 실험 결과는 분홍색으로 표시됩니다. (C) 세포는 분리 후 도말하였다. 사진은 도금 후 4-6일 후에 촬영했습니다. 스케일 바 = 100μm. 약어: AUB = 비정상적인 자궁 출혈; EIN = 자궁내막내 상피내 종양. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 S1: 배양에서 분리된 상피 세포의 추가 특성화. (A) 환자 임상 정보 표. (B) 배양 중인 세포 유형을 특성화하기 위해 도금 2-6일 후에 EpCAM, 분비 세포 마커(PAX8) 및 기질 세포 마커(Vimentin)에 대해 분리된 세포를 배양하고 염색했습니다. 눈금 막대 = 50μm. 약어: EIN: Endometrial intraepithelial neoplasia; DAPI = 4',6-디아미디노-2-페닐린돌. 이 그림을 다운로드하려면 여기를 클릭하십시오.
보충 비디오 S1: 배양에서 섬모 세포를 입증하기 위해 섬모 세포를 박동하는 비디오를 30배 배율로 촬영했습니다. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
토론
나팔관은 생식에 중요한 역할을 하고 대부분의 HGSOC의 기원 부위이기 때문에 나팔관 상피 연구에 상당한 관심이 있습니다. 이를 위해 많은 연구자들은 인간과 마우스 모델 모두에서 나팔관 세포를 분리하는 프로토콜을 설명했습니다 10,11,12,15,16,17,18,19,20,21. 나팔관 상피 세포를 추출하고 농축하기 위해 설명하는 방법은 기존 나팔관 세포 분리 프로토콜에 추가됩니다. 이러한 프로토콜 내에 중복이 존재하지만, 마우스와 인간에서 보고된 두 가지 일반적인 유형의 방법이 있습니다. 첫 번째는 전체 나팔관을 다지고 효소로 소화하여 총 세포 현탁 액 10,12,15,16,17을 제공하는 것입니다. 두 번째는 교반 또는 긁힘으로 벗겨내는 것과 관련이 있으며, 이로 인해 조직 시트가생성됩니다 11,18,19,20,21. 두 방법 모두 유세포 분석, 염기서열분석 및 체외 배양과 같은 다운스트림 실험을 통해 상피 세포를 분석할 수 있습니다. 우리 방법의 주요 장점은 프로토콜이 효소 분해 및 기계적 푸시 단계를 통해 상피 세포에 대해 이미 농축된 나팔관 세포 집단을 생성한다는 것입니다. 상피를 위해 농축된 이 집단은 추가로 소화될 수 있으며, 그 결과 유세포 분석, 2D 배양, 면역세포화학 및 단일 세포 RNA 염기서열 분석과 같은 많은 응용 분야에 사용할 수 있는 단일 세포 현탁액이 생성될 수 있습니다.
세포 수율에 영향을 미치는 것으로 밝혀진 주요 단계에는 나팔관 절편이 1% 트립신/HBSS 및 DMEM/DNase에서 배양하는 기간이 포함됩니다. 두 용액 중 하나에서 과도하게 배양하면 세포가 저하되고 세포의 생존력이 크게 감소합니다. 그러나 불충분한 배양 시간은 프로토콜 2.6 단계에서 많은 상피 세포가 서로 계속 부착되기 때문에 연구자가 많은 상피 세포를 밀어내는 능력을 저해합니다. 또한 1% 트립신 용액을 사용하는 것이 중요한데, 저농도 및 고농도의 트립신 용액 모두 생존 가능한 나팔관 상피 세포의 수율을 감소시켰기 때문입니다. 화학적 및 기계적 분리와 분해 단계(프로토콜 단계 3.1)를 결합하면 조직에서 단세포 현탁액으로 이동하는 데 걸리는 기간을 기하급수적으로 단축할 수 있습니다. 이를 통해 같은 날에 다운스트림 분석을 수행할 수 있는 우수한 실행 가능성과 시간을 보장할 수 있습니다.
프로토콜 단계 1.4에서는 절단된 나팔관 조각의 두께가 3-5mm인지 확인하는 것이 중요합니다. 조각이 너무 크면 프로토콜 단계 2.7을 수행하기 어렵고 DMEM/DNase에서 더 긴 배양 시간이 필요하기 때문에 궁극적으로 세포 수율을 감소시킬 수 있습니다.
세포 현탁액은 상피 세포에 대해 풍부하지만 기질 세포 오염은 불가피합니다. 순전히 상피 세포만을 사용해야 하는 경우, 유세포 분석과 앞서 설명한 마커를 사용하여 분류하여 상피 세포를 분리하고 기질 세포를 고갈시킬 수 있습니다.
이 연구에서는 폐경 후 나팔관이 사용되었습니다. 그러나 이 방법은 폐경 전 나팔관에 대한 실험실에서 성공적으로 활용되었습니다. 폐경 전과 폐경 후 나팔관의 주요 차이점은 섬모 상피 세포와 분비 상피 세포의 구성이다1. 이 프로토콜은 모든 생식 단계에서 작동합니다.
이 효율적인 프로토콜은 세포 계통을 묘사하는 것, 생식 주기 및 폐경 후 동안의 동적 변화, 고급 장액성 난소암을 시작하는 역할을 포함하여 나팔관 상피의 세포 유형을 조사하는 것을 용이하게 할 것입니다.
공개
저자는 선언할 이해 상충이 없습니다.
감사의 말
저자 Ruegg L, James-Allan LB 및 DiBernardo G는 Greater Los Angeles Veterans Association 프로젝트 1I01BX006019-01A2 및 I01BX006411-01 to Memarzadeh S.의 일부 지원을 받습니다. 저자 Ochoa C는 UCLA Eli 및 Edythe Broad Center of Regenerative Medicine and Stem Cell Research Rose Hills Foundation 대학원 장학금 교육 프로그램의 지원을 받습니다. UCLA의 중개 병리학 핵심 실험실(Translational Pathology Core Laboratory)과 특히 조직 조달에 도움을 준 Ko Kiehle과 Chloe Yin에게 감사드립니다. 또한 이미징에 도움을 주신 Ken Yamauchi와 BSCRC Microscopy core에도 감사드립니다. 그림 1 은 BioRender.com(계약 번호 JL27QWDYNT)를 사용하여 만들어졌습니다. 마지막으로, 유세포 분석에 도움을 주신 Felicia Cordea와 BSCRC 유세포 분석 코어에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 1% Trypsin | Thermo Scientific | J63993.09 | |
| 100 µm Cell Strainer | Corning | 431752 | |
| 4% Paraformaldehyde | Electron Microscopy Sciences | 15710-S | |
| 5 mL round bottom tubes | Corning | 352008 | |
| 60 mm cell culture plate | Corning | CLS430589-500EA | |
| 6-well Cell Culture Plate | Corning | 353046 | |
| Anti-CD10 | BioLegend | 312212 | |
| Anti-CD326 (Ep-CAM) | BioLegend | 324218 | |
| Anti-CD45 | BioLegend | 304026 | |
| Anti-EpCAM | Abcam | ab223582 | |
| Anti-IgG2a PerCP | BioLegend | 400250 | |
| Anti-PAX8 | Sigma-Aldrich | 363M-15 | |
| Anti-Vimentin | Agilent Technologies | M072501-2 | |
| Chamber Slide System | Thermo Scientific | 154917PK | |
| Collagenase | Thermo Scientific | 17100017 | |
| DMEM | Thermo Scientific | 10569-010 | |
| DNase I | Sigma | 10104159001 | |
| EDTA | Sigma | 3690 | |
| eFluor 506 | Invitrogen | 65-0866-14 | |
| FBS | Sigma | F2442 | |
| Fine point forceps | VWR | 102091-526 | Any finepoint forceps of your choice will work |
| Fixable Viability Dye eFluor 506 | Invitrogen | 65-0866-14 | |
| FlowJo software version 9 | BD Biosciences | Data analysis software | |
| GlutaMAX | Gibco | 35050-061 | |
| HBSS | Thermo Scientific | 14175-095 | |
| MACSQuant Analyzer 10 flow cytometer | Miltenyi Biotec | ||
| MACSQuant Calibration Beads | Miltenyi Biotec | 130-093-607 | |
| Mammocult | Stemcell Technologies | 5620 | |
| Normal Goat Serum | Fisher Scientific | PI31873 | |
| PBS | Thermo Scientific | 14190-144 | |
| Penicillin-Streptomyocin | Gibco | 15140-122 | |
| PerCP Conjugated CD45 | BioLegend | 304026 | |
| Red Blood Cell lysis buffer | Tonbo Biosciences | TNB-4300-L100 | |
| Triton X-100 | Thermo Scientific | BP151-100 | |
| Vannas-Tubingen Spring Scissors | Fine Science Tools | 15003-08 | |
| VECTASHIELD with DAPI | Fisher Scientific | NC9524612 |
참고문헌
- Crow, J., Amso, N. N., Lewin, J., Shaw, R. W. Morphology and ultrastructure of fallopian tube epithelium at different stages of the menstrual cycle and menopause. Hum Reprod. 9 (12), 2224-2233 (1994).
- Patek, E., Nilsson, L., Johannisson, E. Scanning electron microscopic study of the human fallopian tube. Report II. Fetal life, reproductive life, and postmenopause. Fert Steril. 23 (10), 719-733 (1972).
- Coan, M., et al. Exploring the role of fallopian ciliated cells in the pathogenesis of high-grade serous ovarian cancer. Int J Mol Sci. 19 (9), 2512(2018).
- Leese, H., Tay, J., Reischl, J., Downing, S. Formation of fallopian tubal fluid: role of a neglected epithelium. Reproduction. 121 (3), 339-346 (2001).
- Donnez, J., Casanas-Roux, F., Ferin, J., Thomas, K. Changes in ciliation and cell height in human tubal epithelium in the fertile and post-fertile years. Maturitas. 5 (1), 39-45 (1983).
- Lengyel, E., et al. A molecular atlas of the human postmenopausal fallopian tube and ovary from single-cell RNA and ATAC sequencing. Cell Rep. 41 (12), 111838-111838 (2022).
- Tao, T., et al. Loss of tubal ciliated cells as a risk for "ovarian" or pelvic serous carcinoma. Am J Cancer Res. 10 (11), 3815(2020).
- Li, J., Fadare, O., Xiang, L., Kong, B., Zheng, W. Ovarian serous carcinoma: recent concepts on its origin and carcinogenesis. J Hematol Oncol. 5 (1), 8(2012).
- Hu, Z., et al. The repertoire of serous ovarian cancer non-genetic heterogeneity revealed by single-cell sequencing of normal fallopian tube epithelial cells. Cancer Cell. 37 (2), 226-242.e7 (2020).
- Dinh, H. Q., et al. Single-cell transcriptomics identifies gene expression networks driving differentiation and tumorigenesis in the human fallopian tube. Cell Rep. 35 (2), 108978(2021).
- Ulrich, N., et al. Cellular heterogeneity of human fallopian tubes in normal and hydrosalpinx disease states identified using scRNA-seq. Dev Cell. 57 (7), 914-929.e7 (2022).
- Brand, J., et al. Fallopian tube single cell analysis reveals myeloid cell alterations in high-grade serous ovarian cancer. iScience. 27 (3), 108990-108990 (2024).
- Memarzadeh, S., et al. Cell-autonomous activation of the PI3-kinase pathway initiates endometrial cancer from adult uterine epithelium. Proc Natl Acad Sci USA. 107 (40), 17298-17303 (2010).
- Cunha, G. R. Stromal induction and specification of morphogenesis and cytodifferentiation of the epithelia of the mullerian ducts and urogenital sinus during development of the uterus and vagina in mice. J Exp Zool. 196 (3), 361-369 (1976).
- Xie, Y., Park, E. -S., Xiang, D., Li, Z. Long-term organoid culture reveals enrichment of organoid-forming epithelial cells in the fimbrial portion of mouse fallopian tube. Stem Cell Res. 32 (1873-5061), 51-60 (2018).
- Karst, A. M., Drapkin, R. Primary culture and immortalization of human fallopian tube secretory epithelial cells. Nat Protoc. 7 (9), 1755-1764 (2012).
- Ford, M. J., Harwalkar, K., Yamanaka, Y. Protocol to generate mouse oviduct epithelial organoids for viral transduction and whole-mount 3D imaging. STAR Protocols. 3 (1), 101164(2022).
- Radecki, K. C., Lorenson, M. Y., Carter, D. G., Walker, A. M. Microdissection and dissociation of the murine oviduct: Individual segment identification and single cell isolation. J Vis Exp. (177), e63168(2021).
- Feng, L., et al. Protocol for the detection of organoid-initiating cell activity in patient-derived single fallopian tube epithelial cells. Methods Mol Bio. 2429, 445-454 (2022).
- Kessler, M., et al. The Notch and Wnt pathways regulate stemness and differentiation in human fallopian tube organoids. Nat Commun. 6 (1), 8989(2015).
- Fotheringham, S., Levanon, K., Drapkin, R. Ex vivo culture of primary human fallopian tube epithelial cells. J Vis Exp. (51), e2728(2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유