Method Article
Um método eficiente para extrair o epitélio da trompa de Falópio humano para análises de célula única
Neste Artigo
Resumo
Este protocolo descreve um método de um dia para o isolamento de células epiteliais da trompa de Falópio humana. As células epiteliais isoladas podem ser plaqueadas em cultura bidimensional (2D) ou dissociadas em suspensões de célula única e utilizadas em experimentos a jusante, incluindo citometria de fluxo e sequenciamento de RNA de célula única.
Resumo
As trompas de falópio humanas são intrínsecas à reprodução. O objetivo das trompas de falópio é permitir o trânsito de espermatozoides, óvulos e, se a fertilização for bem-sucedida, do embrião. As células epiteliais que revestem a superfície interna das trompas de Falópio são parte integrante dos processos normais e anormais das trompas de Falópio, incluindo o início da doença. Após a menopausa, as trompas de falópio deixam de ter um papel significativo no corpo e a composição das células intraepiteliais muda. Descrevemos um método no qual essas células epiteliais podem ser isoladas de trompas de falópio frescas com contaminação mínima de células estromais em uma suspensão de célula única. Essas células podem ser cultivadas em cultura ou usadas para análises posteriores, como citometria de fluxo e sequenciamento de RNA de célula única. Este protocolo de isolamento pode ser alcançado em 4-6 h e produz células viáveis que podem ser usadas para análise imediata a jusante. Este protocolo eficiente facilita o isolamento de células epiteliais da trompa de Falópio com uma população epitelial enriquecida.
Introdução
As trompas de falópio são construídas de várias partes. Do ovário ao útero, a trompa de Falópio é composta pelas fímbrias, ampola, istmo e porção intramural. As fímbrias se estendem desde o final da trompa de Falópio, onde capturam o óvulo liberado pelo ovário. O óvulo então viaja através da ampola, onde é mais provável que seja fertilizado, até o istmo e, finalmente, é transferido para o útero através da porção intramural1. A mucosa mais interna da trompa de Falópio que facilita o transporte do óvulo é composta por uma camada de epitélio luminal, incluindo células ciliadas e secretoras. As células ciliadas tendem a estar mais concentradas nas fímbrias2. Eles desempenham um papel fundamental na movimentação física do óvulo através da trompa de Falópio do ovário para o útero. Seus apêndices permitem que as células ciliadas não apenas movam o óvulo, mas também eliminem o estresse genotóxico após a ovulação3.
As células epiteliais secretoras da trompa de Falópio secretam um fluido que auxilia na nutrição e na montagem dos gametas4. A proporção de células ciliadas e secretoras ao longo do epitélio da trompa de Falópio difere no estado pós-menopausa com uma diminuição das células ciliadas, pois a trompa de Falópio não desempenha mais uma função crítica no transporte5. Além disso, na ausência de estrogênio, acredita-se que as trompas de Falópio se tornem vestigiais 1,6. Essa perda de células ciliadas na trompa de Falópio aumenta o risco de desenvolver carcinomas serosos7. Além disso, acredita-se que as células epiteliais secretoras da trompa de Falópio dêem origem a lesões serosas de carcinoma intraepitelial tubário (STIC), um precursor bem conhecido do subtipo mais agressivo de câncer de ovário tubular, o carcinoma seroso de alto grau 7,8.
O objetivo deste protocolo é isolar células epiteliais de trompas de falópio humanas e dissociá-las em suspensões unicelulares. Este protocolo produz uma população epitelial unicelular enriquecida que pode ser usada para muitas análises. Conforme mostrado neste manuscrito, realizamos análises de citometria de fluxo e células plaqueadas em 2D após o isolamento. A análise por citometria de fluxo demonstra a presença de células únicas, que são em sua maioria viáveis e de natureza epitelial. Nessas análises, incluímos quatro marcadores, e506 para viabilidade, EpCAM para células epiteliais, CD45 para células imunes e CD10 para células estromais. As células mortas foram excluídas usando o marcador de viabilidade e506 e as células imunes foram bloqueadas usando CD45. É possível que a suspensão tenha uma população de células imunes; no entanto, para atingir uma população relativamente pura de células epiteliais, as células CD45-positivas podem ser esgotadas usando um kit de depleção de CD45. Além disso, quando plaqueadas em cultura, as células CD45-positivas geralmente não proliferam. As células isoladas por meio desse método e cultivadas em 2D mostram populações epiteliais aderentes semelhantes a paralelepípedos. Este método pode ser usado para gerar preparações celulares, que podem ser desenvolvidas em bibliotecas de RNA de célula única.
Pesquisas para definir a linhagem celular do epitélio da trompa de Falópio, alterações nessas linhagens durante diferentes fases da vida reprodutiva e eventos incitantes que levam à transformação maligna e gênese tornaram-se mais proeminentes nos últimos quatro anos 6,9,10,11,12 . Este protocolo beneficiará significativamente a pesquisa nesta área, fornecendo uma maneira eficiente de isolar o epitélio das trompas de Falópio e processá-lo em células únicas.
Protocolo
Esse protocolo foi adaptado de um método de isolamento de células epiteliais uterinas descrito anteriormente13,14. Amostras frescas de trompas de falópio não identificadas foram coletadas por meio de nosso protocolo # 10-0727 aprovado pelo IRB da Universidade da Califórnia, Los Angeles (UCLA) e digeridas em uma suspensão de célula única em aproximadamente 4 a 6 h.
1. Coleta e preparação das trompas de Falópio
- Colete trompas de falópio humanas frescas (Figura 1A) em meios de dissociação (DMEM [4,5 g / L de D-glicose] contendo 10% de soro fetal bovino (FBS), 5 mL de L-glutamina e 5 mL de penicilina / estreptomicina) em tubos de 15 mL ou 50 mL e transporte em gelo para o laboratório.
- Transfira as trompas de falópio para uma placa de Petri estéril contendo meios de dissociação frescos.
- Sob um microscópio de dissecação, disseque a gordura, o tecido conjuntivo e quaisquer vasos ao redor dos tubos usando uma pinça de ponta fina e uma tesoura Vannas Tubingen (Figura 1B).
- Sob o microscópio de dissecação, corte o plano coronal das trompas de Falópio com uma tesoura para formar pequenos cilindros, ~ 3–5 mm cada um de diâmetro (Figura 1C), usando a pinça de ponta fina para estabilizar o tecido.
2. Isolamento e dissociação de células epiteliais
- Aspire cuidadosamente o meio de dissociação do prato.
- Lave os pedaços de tecido 2x com solução salina tamponada com fosfato (PBS) fria pipetando suavemente ~ 2 mL para cobrir os pedaços e girando levemente a placa.
- Aspire a lavagem final de 1x PBS, incube os pedaços de tecido por 5 min em ácido etilenodiaminotetracético (EDTA) frio a 5 mM em temperatura ambiente e repita por um total de duas incubações. Aspire o EDTA 5mM após cada incubação.
- Suspenda os fragmentos de tecido em solução salina balanceada fria de tripsina a 1% / Hanks (HBSS) e incube a 4 ° C por 40 min ( Figura 1D ).
- Aspire a tripsina a 1% / HBSS e lave os pedaços de tecido 2x em meio de dissociação fria para inativar a tripsina.
- Incube os fragmentos de tecido em 2 mL de meio de dissociação com 0,4 mg de DNase por pelo menos 30 min em temperatura ambiente.
NOTA: Um período de incubação mais longo pode ser necessário, mas não exceda 45 min antes de iniciar a etapa 2.7. - Sob um microscópio de dissecação, ainda no meio com DNase, segure um fragmento da trompa de Falópio, o lúmen paralelo ao fundo do prato, no lugar com uma pinça. Com a outra mão, pressione repetidamente a trompa de Falópio com uma pinça para expelir as células epiteliais do lúmen da trompa. Confirme se um halo de células é visto ao redor do tecido à medida que as células são liberadas do lúmen do tubo. Repita para cada fragmento de trompa de Falópio no prato (Figura 1E).
- Transfira o meio contendo células para um tubo estéril de 15 mL, lave a placa de Petri com meio de dissociação pelo menos 2x e combine as lavagens no tubo de 15 mL. Descarte os fragmentos do tubo estromal.
- Colha as células por centrifugação a 500 × g por 5 min. Aspire o sobrenadante e ressuspenda o pellet em 1 mL de meio de dissociação.
- Contar as células aliquotando 10 μL da suspensão celular e misturando 1:1 com azul de tripano. Pipetar 10 μL da mistura para uma lâmina de contagem de câmaras e inseri-la num contador de células (figura 1F).
3. Digestão em suspensão unicelular
- Ressuspenda as células em 9 mL de meio de dissociação, 1 mL de 8 mg / mL de colagenase (tipo 1) e 0,4 mg de DNase. Incubar a 37 °C durante 30–45 min num agitador orbital a 200 rpm (Figura 1G).
- Colha as células por centrifugação a 500 × g por 5 min. Aspire o sobrenadante e ressuspenda o pellet em 5 mL de meio de dissociação para lavar a colagenase.
- Passe a suspensão celular através de um filtro de células de 100 μm para um tubo de 50 mL (Figura 1H).
- Colha as células por centrifugação a 500 × g por 5 min.
- Se o grânulo celular aparecer vermelho, realize a lise dos glóbulos vermelhos (RBC) conforme descrito nas etapas 3.6 a 3.8. Se o pellet da célula não estiver vermelho, pule para a etapa 3.9.
- Dilua 500 μL de tampão de lise de hemácias em 4,5 mL de água ultrapura.
- Aspire o meio, adicione 5 mL do tampão de lise de hemácias diluído e incube no gelo por 3 min.
- Para interromper a lise de hemácias, adicione 45 mL de 1x PBS ao tubo de 50 mL.
- Colha as células por centrifugação a 500 × g por 5 min.
- Contar as células aliquotando 10 μL da suspensão celular e misturando-a 1:1 com azul de tripano. Pipetar 10 μL da mistura para uma lâmina de contagem em câmara e inseri-la no contador de células (figura 1I).
4. Coloração por citometria de fluxo
- Alíquota de 250.000 células em dois tubos de fundo redondos de poliestireno de 5 mL separados para anticorpo conjugado primário e controle de isotipo para uso em citometria de fluxo de marcador de superfície.
NOTA: Menos células podem ser usadas para acomodar a contagem de células e o número de células necessárias para a análise a jusante. Para obter resultados de fluxo ideais, um mínimo de 50.000 células deve ser incluído na análise. - Dilua o anticorpo (por exemplo, EpCAM anti-humano e CD10) e o isotipo de acordo com a diluição recomendada pelo fabricante em 1x PBS. Inclua corante de viabilidade fixável (e506) e um anticorpo anti-CD45 humano conjugado para bloquear células imunes humanas vivas. Faça uma mistura de anticorpos suficiente para pelo menos 50 μL por tubo. Deixe no escuro no gelo até a etapa 4.4.
- Lave as células com 1 mL de 1x PBS. Colher as células por centrifugação a 500 × g durante 5 min a 4 °C.
- Aspire o PBS 1x. Ressuspender o sedimento no painel de anticorpos ou isotipos e incubar a 4 °C durante 15 minutos no escuro.
- Após a incubação, diluir em 1 mL de PBS 1x e colher as células por centrifugação a 500 × g por 5 min a 4 °C.
- Aspire o PBS 1x e ressuspenda o pellet celular em 200 μL de PBS 1x.
5. Coleta de dados de citometria de fluxo
- Faça login na máquina FACS.
NOTA: Apresentamos o protocolo utilizando o citômetro de fluxo referenciado (consulte a Tabela de Materiais). Para outros citômetros de fluxo, siga as instruções do fabricante. A configuração de tensão do citômetro de fluxo foi pré-configurada para desempenho ideal com PBMCs humanos, eliminando a necessidade de ajustes de tensão antes de cada execução do FACS. - Se a máquina estiver no modo de aquisição , pule para a etapa 5.3. Se a máquina estiver no modo de análise de dados , mude para o modo de aquisição pressionando o botão liga/desliga no canto superior direito. Quando um pop-up for exibido, pressione o botão que lê o modo de aquisição.
- No canto inferior esquerdo, se a máquina ler Calibração necessária, prossiga para a etapa 5.3.1. Se a máquina ler Calibração ok, pule para a etapa 5.4.
- Para calibrar a máquina, retire as esferas de calibração do refrigerador e do vórtice a 4 °C.
- Coloque 1 gota de grânulos de calibração em um tubo inferior redondo de poliestireno de 5 mL e coloque o tubo no suporte de tubo único.
- Pressione o botão de código de barras no canto superior direito e escaneie o frasco de esferas de calibração. Um pop-up aparecerá. Se tudo estiver configurado, clique em Sim | OK e deixe a calibração funcionar.
- Se a calibração for bem-sucedida, faça logout e login novamente no modo de aquisição . Prossiga para a etapa 5.4.
- Clique em abrir | novo espaço de trabalho no canto superior esquerdo.
- Selecione chill 5 rack; Selecione três dos poços. Selecione o primeiro poço e dê uma descrição (por exemplo, FTX Ab). Selecione o próximo poço e dê a ele uma descrição exclusiva (por exemplo, FTX Iso). Selecione o último poço e dê a ele a descrição alvejante.
NOTA: Sempre inclua uma amostra de alvejante a cada 4–5 amostras experimentais para garantir a limpeza oportuna das amostras de células. - Selecione todos os poços e configure as condições experimentais da seguinte forma: configurações do instrumento: PBMCs humanos; Taxa de fluxo: alta; Amostra de mistura: mistura suave; Modo: padrão; Volume total da amostra 200 μL; Captação da amostra 150 μL; Anotação: anticorpos de entrada e sua marcação de fluoróforo.
- Selecione editar | opções e dê um nome ao arquivo em descrição | aplicar | ok.
- Retire o rack da geladeira e coloque-o na bandeja com o código de barras voltado para a máquina. Coloque os tubos de amostra no rack para refletir a ordem das amostras na tela e pressione o botão play para iniciar o experimento.
- Quando o experimento terminar, conecte o USB, selecione Arquivo | copiar, expanda a pasta privada, selecione o experimento e clique em copiar e ejetar.
- Após a coleta de dados, use um software para analisar a planilha de dados.
- Comece com o controle de isotipo. Use a ferramenta de polígono para selecionar células no gráfico de dispersão direta (FSC) versus dispersão lateral (SSC).
- Bloqueie as células mortas alterando o eixo Y para e506 e o eixo X para FSC. Use a ferramenta polígono para selecionar a população de células vivas e506-negativas.
- Clique duas vezes na população selecionada. Altere o eixo Y para CD45 humano. Use a ferramenta de polígono para selecionar a população de células. Esta é a população de células CD45 negativas humanas.
- Clique duas vezes na população de células CD45 negativas. Altere o eixo Y para histograma e o eixo X para EpCAM humano. Use a ferramenta de seleção de intervalo para clicar no final do histograma e selecione o espaço vazio até o final do gráfico. Isso representa a população positiva para EpCAM. Repita para a coloração humana de CD10.
- Arraste o bloqueio de isotipo sob o espaço de trabalho de anticorpos. As células CD45-positivas serão fechadas e as populações EpCAM-positivas e CD10-positivas serão selecionadas.
- Para criar histogramas representativos, selecione editor de layout. Arraste os histogramas desejados para a página de layout. Para comparar a coloração de isotipo e anticorpo, sobreponha o histograma de isotipo ao histograma de anticorpos. Gate as células positivas com base no controle do isotipo.
6. Imunocitoquímica
- As células de cultura após a etapa final de isolamento no vidro da câmara desejada deslizam até ficarem confluentes.
- Para fixar as células, adicione 500 μL de Paraformaldeído (PFA) frio a 4% Incube em temperatura ambiente por 10 min.
- Aspire o PFA a 4% e lave 3x com 1x PBS.
- Para permeabilizar as células, adicione pelo menos 200 μL de Triton-X a 0,25% em PBS e incube em temperatura ambiente por 10 min.
- Durante a permeabilização, prepare o tampão de bloqueio (4% de soro de cabra normal [NGS] para anticorpos não produzidos em cabras).
- Aspire o Triton-X 0,25% e lave 3x com 1x PBS.
- Adicione pelo menos 200 μL de tampão de bloqueio (4% NGS em PBS). Bloquear durante 1 h à temperatura ambiente.
- Prepare diluições de anticorpos primários em 1% NGS em 1x PBS de acordo com as recomendações do fabricante.
- Após o bloqueio, adicione pelo menos 200 μL da solução primária de anticorpo. Incubar à temperatura ambiente durante 2 h.
NOTA: Alguns anticorpos primários podem preferir uma incubação noturna a 4 °C; Verifique a folha de dados do anticorpo. - Prepare soluções de anticorpos secundários em 1% NGS em 1x PBS. Embrulhe os tubos em papel alumínio e prepare as soluções no escuro, pois os anticorpos secundários são sensíveis à luz. Guarde no escuro até que esteja pronto.
- Após a incubação do anticorpo primário, lave 3x com 1x PBS.
- Adicione pelo menos 200 μL da solução secundária de anticorpos. Incube no escuro em temperatura ambiente por 1 h.
NOTA: Durante as etapas a seguir, tente manter o slide no escuro o máximo possível. - Após a incubação secundária de anticorpos, lave 3x com 1x PBS.
- Remova as câmaras, simplesmente removendo-as manualmente ou usando a ferramenta que acompanha as lâminas. Siga as instruções impressas na embalagem da lâmina da câmara para remoção.
- Adicione uma gota de soro de montagem 4',6-diamidino-2-fenilindol (DAPI) e coloque uma lamínula no topo. Limite o número de bolhas e certifique-se de que todas as células estejam cobertas. Etapa opcional: use esmalte nas bordas para selar a lamínula.
- Coloque a lâmina plana em uma caixa de lâminas para secar e coloque a 4 °C até a geração de imagens.
- Imagem em um microscópio equipado com fluorescência correta com base na conjugação de anticorpos secundários para garantir uma imagem limpa.
Resultados
Incluímos sete coleções de trompas de Falópio onde isolamos uma população de células epiteliais enriquecida (Figura 2A e Figura Suplementar S1A). Para avaliar a viabilidade e o enriquecimento de células epiteliais desse método de suspensão de célula única, foi realizada citometria de fluxo. Para medir a viabilidade celular, as células foram coradas com o marcador de viabilidade, e506. Isso também permitiu a eliminação de todos os detritos e células mortas quando analisados.
Para determinar a composição das células isoladas por esse método, as amostras foram coradas com um marcador de células epiteliais (EpCAM), um marcador de células estromais (CD10) e um marcador de células imunes (CD45). Como visto na Figura 2B, isolamos uma população de células epiteliais viável e enriquecida do tecido da trompa de Falópio. A viabilidade da amostra foi em média de 82%. Para todas as amostras, após a eliminação de células CD45-positivas, observamos uma população de células epiteliais enriquecida com células positivas para EpCAM em média 80% da amostra. Houve alguma contaminação das células estromais, mas apenas 7,8% em média. A Figura 2C mostra células isoladas em 2D 4-6 dias após o plaqueamento. É evidente que as células epiteliais foram isoladas à medida que formavam aglomerados aderentes consistentes com aparência de paralelepípedos. Na Figura Suplementar S1B, as células foram plaqueadas após o isolamento e cultivadas por 2-6 dias. A imunocitoquímica foi usada para caracterizar as células que crescem em cultura. A maioria das células na cultura corou positivo para EpCAM e o marcador de células secretoras, PAX8. Apenas algumas células foram identificadas como positivas para vimentina. As células ciliadas foram vistas em cultura conforme capturado pelo vídeo, mostrado no Vídeo Suplementar S1.
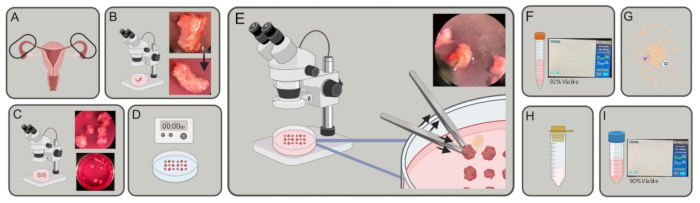
Figura 1: Esquema experimental. (A) As trompas de Falópio são adquiridas. (B) O excesso de gordura e tecido conjuntivo são removidos. (C) Os tubos são cortados em pedaços de ~ 3-5 mm. (D) As peças são lavadas em PBS, depois incubadas em EDTA 2x por 5 min e incubadas em tripsina a 1% por 40 min a 4 °C. (E) Usando dois pares de pinças, uma para segurar e outra para empurrar, expulse as células epiteliais dos pedaços da trompa de Falópio. (F) Transfira as células para um tubo de 15 mL, gire e conte. (G) Ressuspender em DMEM, colagenase e DNase. Digerir durante 30-45 min. (H) Coar com um coador de 100 μm. (I) Colheita por centrifugação e contagem. Clique aqui para ver uma versão maior desta figura.
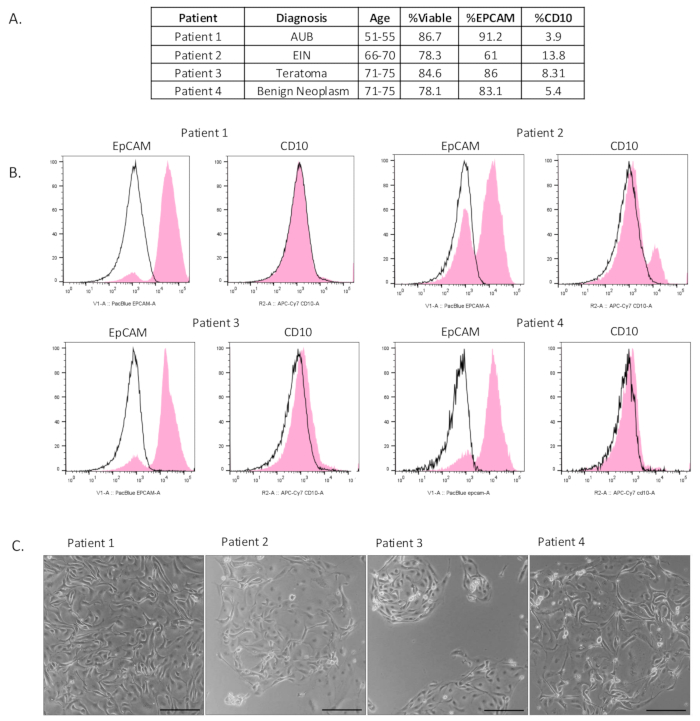
Figura 2: Caracterização das células epiteliais isoladas. (A) Tabela de informações clínicas do paciente e resultados da citometria de fluxo. (B) A citometria de fluxo foi realizada após o isolamento para mostrar que uma população enriquecida de células epiteliais (EpCAM-positiva) havia sido isolada. O controle negativo do isotipo é indicado em preto e o resultado experimental é indicado em rosa. (C) As células foram plaqueadas após o isolamento. As fotos foram tiradas 4-6 dias após o revestimento. Barras de escala = 100 μm. Abreviaturas: AUB = Sangramento uterino anormal; EIN = Neoplasia intraepitelial endometrial. Clique aqui para ver uma versão maior desta figura.
Figura suplementar S1: Caracterização adicional de células epiteliais isoladas em cultura. (A) Tabela de informações clínicas do paciente. (B) As células isoladas foram cultivadas e coradas para EpCAM, um marcador de células secretoras (PAX8) e um marcador de células estromais (Vimentina) 2-6 dias após o plaqueamento para caracterizar o tipo de célula em cultura. Barras de escala = 50 μm. Abreviaturas: EIN: Neoplasia intraepitelial endometrial; DAPI = 4',6-diamidino-2-fenilindo. Clique aqui para baixar esta figura.
Vídeo suplementar S1: Um vídeo de células ciliadas batendo foi feito com ampliação de 30x para demonstrar células ciliadas em cultura. Clique aqui para baixar este vídeo.
Discussão
Há um interesse considerável em estudar o epitélio das trompas de Falópio, pois as trompas de Falópio desempenham um papel significativo na reprodução e são o local de origem da maioria dos HGSOC. Para esse fim, muitos pesquisadores descreveram protocolos para isolar células das trompas de Falópio em modelos humanos e de camundongos 10,11,12,15,16,17,18,19,20,21. O método que descrevemos para extrair e enriquecer as células epiteliais da trompa de Falópio se soma aos protocolos existentes de isolamento de células da trompa de Falópio. Embora existam sobreposições nesses protocolos, existem dois tipos gerais de métodos relatados em camundongos e humanos. O primeiro envolve picar e digerir enzimaticamente toda a trompa de Falópio, o que dá uma suspensão celular total 10,12,15,16,17. O segundo envolve descamação com agitação ou raspagem, o que resulta em folhas de tecido 11,18,19,20,21. Ambos os métodos permitem que as células epiteliais sejam analisadas por meio de experimentos a jusante, como citometria de fluxo, sequenciamento e cultura in vitro. Uma grande vantagem do nosso método é que o protocolo produz uma população de células da trompa de Falópio que já são enriquecidas para células epiteliais por meio de digestão enzimática e etapas mecânicas. Essa população enriquecida para epitélio pode ser digerida posteriormente, resultando em uma suspensão de célula única que pode ser usada para muitas aplicações, como citometria de fluxo, cultura 2D, imunocitoquímica e sequenciamento de RNA de célula única.
As principais etapas que encontramos para impactar o rendimento celular incluem a duração pela qual os fragmentos da trompa de Falópio incubam em 1% de tripsina / HBSS e DMEM / DNase. A incubação excessiva em qualquer solução degradará as células e diminuirá significativamente a viabilidade das células. No entanto, o tempo de incubação insuficiente inibirá a capacidade do pesquisador de expulsar muitas células epiteliais durante a etapa 2.6 do protocolo, pois elas continuarão a aderir umas às outras. Também é importante usar uma solução de tripsina a 1%, pois concentrações mais baixas e mais altas de soluções de tripsina reduziram o rendimento de células epiteliais viáveis da trompa de Falópio. Ao combinar o isolamento químico e mecânico e uma etapa de digestão (etapa 3.1 do protocolo), podemos encurtar exponencialmente o período necessário para ir do tecido à suspensão unicelular. Isso garante boa viabilidade e tempo para realizar análises downstream no mesmo dia.
Na etapa 1.4 do protocolo, é fundamental garantir que os pedaços de corte da trompa de Falópio tenham 3-5 mm de espessura. Se as peças forem muito grandes, será difícil executar a etapa 2.7 do protocolo e, em última análise, diminuir o rendimento da célula, pois será necessário um tempo de incubação mais longo em DMEM/DNase.
Embora a suspensão celular seja enriquecida para células epiteliais, a contaminação das células estromais é inevitável. Se a preparação precisar ser puramente de células epiteliais, a classificação usando citometria de fluxo e os marcadores que descrevemos pode ser realizada para isolar células epiteliais e esgotar as células estromais.
Trompas de falópio na pós-menopausa foram utilizadas neste estudo. No entanto, este método foi utilizado com sucesso em nosso laboratório em trompas de falópio na pré-menopausa. A principal diferença entre as trompas de Falópio pré e pós-menopausa é a composição das células epiteliais ciliadas e secretoras1. Este protocolo funciona para todos os estágios reprodutivos.
Este protocolo eficiente facilitará a investigação dos tipos de células do epitélio da trompa de Falópio, incluindo o delineamento de linhagens celulares, suas mudanças dinâmicas durante os ciclos reprodutivos, bem como após a menopausa, e seu papel no início do câncer de ovário seroso de alto grau.
Divulgações
Os autores não têm conflitos de interesse a declarar.
Agradecimentos
Os autores Ruegg L, James-Allan LB e DiBernardo G são parcialmente apoiados pelos projetos da Associação de Veteranos da Grande Los Angeles 1I01BX006019-01A2 e I01BX006411-01 para Memarzadeh S. O autor Ochoa C é apoiado pela UCLA Eli e Edythe Broad Center of Regenerative Medicine and Stem Cell Research Rose Hills Foundation Graduate Scholarship Training Program. Queremos agradecer ao Laboratório Central de Patologia Translacional da UCLA e, especificamente, a Ko Kiehle e Chloe Yin pela assistência na aquisição de tecidos. Também queremos agradecer a Ken Yamauchi e ao núcleo de Microscopia do BSCRC por sua assistência na imagem. A Figura 1 foi criada com BioRender.com (número de concordância JL27QWDYNT). Por fim, gostaríamos de agradecer a Felicia Cordea e ao núcleo de citometria de fluxo do BSCRC pela assistência na citometria de fluxo.
Materiais
| Name | Company | Catalog Number | Comments |
| 1% Trypsin | Thermo Scientific | J63993.09 | |
| 100 µm Cell Strainer | Corning | 431752 | |
| 4% Paraformaldehyde | Electron Microscopy Sciences | 15710-S | |
| 5 mL round bottom tubes | Corning | 352008 | |
| 60 mm cell culture plate | Corning | CLS430589-500EA | |
| 6-well Cell Culture Plate | Corning | 353046 | |
| Anti-CD10 | BioLegend | 312212 | |
| Anti-CD326 (Ep-CAM) | BioLegend | 324218 | |
| Anti-CD45 | BioLegend | 304026 | |
| Anti-EpCAM | Abcam | ab223582 | |
| Anti-IgG2a PerCP | BioLegend | 400250 | |
| Anti-PAX8 | Sigma-Aldrich | 363M-15 | |
| Anti-Vimentin | Agilent Technologies | M072501-2 | |
| Chamber Slide System | Thermo Scientific | 154917PK | |
| Collagenase | Thermo Scientific | 17100017 | |
| DMEM | Thermo Scientific | 10569-010 | |
| DNase I | Sigma | 10104159001 | |
| EDTA | Sigma | 3690 | |
| eFluor 506 | Invitrogen | 65-0866-14 | |
| FBS | Sigma | F2442 | |
| Fine point forceps | VWR | 102091-526 | Any finepoint forceps of your choice will work |
| Fixable Viability Dye eFluor 506 | Invitrogen | 65-0866-14 | |
| FlowJo software version 9 | BD Biosciences | Data analysis software | |
| GlutaMAX | Gibco | 35050-061 | |
| HBSS | Thermo Scientific | 14175-095 | |
| MACSQuant Analyzer 10 flow cytometer | Miltenyi Biotec | ||
| MACSQuant Calibration Beads | Miltenyi Biotec | 130-093-607 | |
| Mammocult | Stemcell Technologies | 5620 | |
| Normal Goat Serum | Fisher Scientific | PI31873 | |
| PBS | Thermo Scientific | 14190-144 | |
| Penicillin-Streptomyocin | Gibco | 15140-122 | |
| PerCP Conjugated CD45 | BioLegend | 304026 | |
| Red Blood Cell lysis buffer | Tonbo Biosciences | TNB-4300-L100 | |
| Triton X-100 | Thermo Scientific | BP151-100 | |
| Vannas-Tubingen Spring Scissors | Fine Science Tools | 15003-08 | |
| VECTASHIELD with DAPI | Fisher Scientific | NC9524612 |
Referências
- Crow, J., Amso, N. N., Lewin, J., Shaw, R. W. Morphology and ultrastructure of fallopian tube epithelium at different stages of the menstrual cycle and menopause. Hum Reprod. 9 (12), 2224-2233 (1994).
- Patek, E., Nilsson, L., Johannisson, E. Scanning electron microscopic study of the human fallopian tube. Report II. Fetal life, reproductive life, and postmenopause. Fert Steril. 23 (10), 719-733 (1972).
- Coan, M., et al. Exploring the role of fallopian ciliated cells in the pathogenesis of high-grade serous ovarian cancer. Int J Mol Sci. 19 (9), 2512(2018).
- Leese, H., Tay, J., Reischl, J., Downing, S. Formation of fallopian tubal fluid: role of a neglected epithelium. Reproduction. 121 (3), 339-346 (2001).
- Donnez, J., Casanas-Roux, F., Ferin, J., Thomas, K. Changes in ciliation and cell height in human tubal epithelium in the fertile and post-fertile years. Maturitas. 5 (1), 39-45 (1983).
- Lengyel, E., et al. A molecular atlas of the human postmenopausal fallopian tube and ovary from single-cell RNA and ATAC sequencing. Cell Rep. 41 (12), 111838-111838 (2022).
- Tao, T., et al. Loss of tubal ciliated cells as a risk for "ovarian" or pelvic serous carcinoma. Am J Cancer Res. 10 (11), 3815(2020).
- Li, J., Fadare, O., Xiang, L., Kong, B., Zheng, W. Ovarian serous carcinoma: recent concepts on its origin and carcinogenesis. J Hematol Oncol. 5 (1), 8(2012).
- Hu, Z., et al. The repertoire of serous ovarian cancer non-genetic heterogeneity revealed by single-cell sequencing of normal fallopian tube epithelial cells. Cancer Cell. 37 (2), 226-242.e7 (2020).
- Dinh, H. Q., et al. Single-cell transcriptomics identifies gene expression networks driving differentiation and tumorigenesis in the human fallopian tube. Cell Rep. 35 (2), 108978(2021).
- Ulrich, N., et al. Cellular heterogeneity of human fallopian tubes in normal and hydrosalpinx disease states identified using scRNA-seq. Dev Cell. 57 (7), 914-929.e7 (2022).
- Brand, J., et al. Fallopian tube single cell analysis reveals myeloid cell alterations in high-grade serous ovarian cancer. iScience. 27 (3), 108990-108990 (2024).
- Memarzadeh, S., et al. Cell-autonomous activation of the PI3-kinase pathway initiates endometrial cancer from adult uterine epithelium. Proc Natl Acad Sci USA. 107 (40), 17298-17303 (2010).
- Cunha, G. R. Stromal induction and specification of morphogenesis and cytodifferentiation of the epithelia of the mullerian ducts and urogenital sinus during development of the uterus and vagina in mice. J Exp Zool. 196 (3), 361-369 (1976).
- Xie, Y., Park, E. -S., Xiang, D., Li, Z. Long-term organoid culture reveals enrichment of organoid-forming epithelial cells in the fimbrial portion of mouse fallopian tube. Stem Cell Res. 32 (1873-5061), 51-60 (2018).
- Karst, A. M., Drapkin, R. Primary culture and immortalization of human fallopian tube secretory epithelial cells. Nat Protoc. 7 (9), 1755-1764 (2012).
- Ford, M. J., Harwalkar, K., Yamanaka, Y. Protocol to generate mouse oviduct epithelial organoids for viral transduction and whole-mount 3D imaging. STAR Protocols. 3 (1), 101164(2022).
- Radecki, K. C., Lorenson, M. Y., Carter, D. G., Walker, A. M. Microdissection and dissociation of the murine oviduct: Individual segment identification and single cell isolation. J Vis Exp. (177), e63168(2021).
- Feng, L., et al. Protocol for the detection of organoid-initiating cell activity in patient-derived single fallopian tube epithelial cells. Methods Mol Bio. 2429, 445-454 (2022).
- Kessler, M., et al. The Notch and Wnt pathways regulate stemness and differentiation in human fallopian tube organoids. Nat Commun. 6 (1), 8989(2015).
- Fotheringham, S., Levanon, K., Drapkin, R. Ex vivo culture of primary human fallopian tube epithelial cells. J Vis Exp. (51), e2728(2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados