Method Article
Эффективный метод извлечения эпителия фаллопиевых труб человека для анализа отдельных клеток
В этой статье
Резюме
Этот протокол описывает однодневный метод выделения эпителиальных клеток фаллопиевых труб человека. Выделенные эпителиальные клетки могут быть покрыты в 2-мерной (2D) культуре или диссоциированы в одиночные клеточные суспензии и использованы в последующих экспериментах, включая проточную цитометрию и секвенирование РНК одиночных клеток.
Аннотация
Фаллопиевы трубы человека неотъемлемо связаны с репродуктивной функцией. Цель фаллопиевых труб заключается в том, чтобы обеспечить транзит сперматозоидов, яйцеклетки и, в случае успешного оплодотворения, эмбриона. Эпителиальные клетки, выстилающие внутреннюю поверхность фаллопиевых труб, являются неотъемлемой частью как нормальных, так и аномальных процессов в фаллопиевых трубах, включая начало заболевания. После менопаузы маточные трубы перестают играть значимую роль в организме и меняется состав интраэпителиальных клеток. Мы описываем метод, при котором эти эпителиальные клетки могут быть выделены из свежих фаллопиевых труб с минимальным загрязнением стромальными клетками в одноклеточную суспензию. Эти клетки могут быть выращены в культуре или использованы для дальнейшего анализа, такого как проточная цитометрия и секвенирование РНК отдельных клеток. Этот протокол выделения может быть достигнут за 4-6 часов и позволяет получить жизнеспособные клетки, которые можно использовать для немедленного последующего анализа. Этот эффективный протокол облегчает выделение эпителиальных клеток фаллопиевых труб с обогащенной эпителиальной популяцией.
Введение
Фаллопиевы трубы состоят из нескольких частей. От яичника до матки фаллопиева труба состоит из фимбрий, ампулы, перешейка и интрамуральной части. Фимбрии простираются от конца фаллопиевой трубы, где они захватывают яйцеклетку, высвобождаемую яичником. Затем яйцеклетка проходит через ампулу, где она, скорее всего, будет оплодотворена, к перешейку и, наконец, переносится в матку через интрамуральную часть1. Самая внутренняя слизистая оболочка фаллопиевой трубы, которая способствует транспортировке яйцеклеток, состоит из слоя люминального эпителия, включающего реснитчатые и секреторные клетки. Реснитчатые клетки, как правило, более сконцентрированы в фимбриях2. Они играют неотъемлемую роль в физическом перемещении яйцеклетки по фаллопиевой трубе из яичника в матку. Их придатки позволяют реснитчатым клеткам не только перемещать яйцеклетку, но и выводить генотоксический стресс после овуляции.
Секреторные эпителиальные клетки фаллопиевых труб выделяют жидкость, которая способствует питанию и сборке гамет4. Соотношение реснитчатых и секреторных клеток вдоль эпителия фаллопиевой трубы различается в постменопаузальном состоянии с уменьшением реснитчатых клеток, поскольку фаллопиева труба больше не выполняет критическую функцию в транспортировке5. Кроме того, считается, что при отсутствии эстрогена фаллопиевы трубы становятся рудиментарными 1,6. Предполагается, что эта потеря реснитчатых клеток в фаллопиевой трубе повышает риск развития серозных карцином7. Кроме того, считается, что секреторные эпителиальные клетки фаллопиевых труб приводят к поражениям серозной внутриэпителиальной карциномы труб (STIC), хорошо известной предыстории наиболее агрессивного подтипа рака яичников тубо, серозной карциномывысокой степени 7,8.
Целью этого протокола является выделение эпителиальных клеток из фаллопиевых труб человека и их диссоциация на одноклеточные суспензии. Этот протокол позволяет получить обогащенную популяцию эпителия одиночных клеток, которая может быть использована для многих анализов. Как показано в этой рукописи, мы выполнили анализ проточной цитометрии и поместили клетки в 2D после выделения. Анализ проточной цитометрии демонстрирует наличие одиночных клеток, которые в основном жизнеспособны и эпителиальны по своей природе. В эти анализы мы включили четыре маркера: e506 для жизнеспособности, EpCAM для эпителиальных клеток, CD45 для иммунных клеток и CD10 для стромальных клеток. Мертвые клетки были исключены с помощью маркера жизнеспособности e506, а иммунные клетки были закрыты с помощью CD45. Суспензия может иметь популяцию иммунных клеток; однако для получения относительно чистой популяции эпителиальных клеток CD45-положительные клетки могут быть истощены с помощью набора для истощения CD45. Кроме того, при посеве CD45-положительные клетки часто не пролиферируют. Клетки, выделенные с помощью этого метода и выращенные в 2D, демонстрируют адгезивные эпителиальные популяции, похожие на булыжники. Этот метод может быть использован для получения клеточных препаратов, которые могут быть преобразованы в библиотеки РНК отдельных клеток.
Исследования по определению клеточной линии эпителия фаллопиевых труб, изменений в этих линиях на разных этапах репродуктивной жизни и провоцирующих событий, которые приводят к злокачественной трансформации и генезу, стали более заметными за последние четыре года 6,9,10,11,12 . Этот протокол принесет значительную пользу исследованиям в этой области, обеспечивая эффективный способ выделения эпителия фаллопиевых труб и их переработки в отдельные клетки.
протокол
Этот протокол был адаптирован из метода выделения эпителиальных клеток матки, описанного ранее 13,14. Свежие образцы деидентифицированных фаллопиевых труб были собраны в соответствии с протоколом #10-0727, одобренным IRB нашего Калифорнийского университета в Лос-Анджелесе (UCLA), и расщеплены в одноклеточную суспензию в течение примерно 4–6 часов.
1. Забор и подготовка маточных труб
- Соберите свежие человеческие фаллопиевы трубы (рис. 1A) в диссоциативных средах (DMEM [4,5 г/л D-глюкозы], содержащей 10% фетальной бычьей сыворотки (FBS), 5 мл L-глутамина и 5 мл пенициллина/стрептомицина) в 15 мл или 50 мл пробирок и транспортируйте на льду в лабораторию.
- Переложите фаллопиевы трубы в стерильную чашку Петри, содержащую свежие диссоциативные среды.
- Под препарирующим микроскопом удалите жир, соединительную ткань и любые сосуды, окружающие трубки, с помощью тонких щипцов и ножниц Vannas Tubingen (рис. 1B).
- Под препарирующим микроскопом разрезать ножницами корональную плоскость фаллопиевых труб для формирования небольших цилиндров, диаметром ~3–5 мм каждый (рис. 1В), используя тонконаправленные щипцы для стабилизации ткани.
2. Выделение и диссоциация эпителиальных клеток
- Тщательно отсасывайте диссоциативные среды из посуды.
- Промойте кусочки салфетки 2 раза холодным 1x фосфатно-соевым буфером (PBS), аккуратно пипетируя ~2 мл для покрытия кусочков и слегка вращая пластину.
- Отсадите заключительную промывку PBS, инкубируйте кусочки ткани в течение 5 минут в холодной 5 мМ этилендиаминтетрауксусной кислоте (ЭДТА) при комнатной температуре и повторите в общей сложности два инкубации. Аспирируйте 5mM EDTA после каждой инкубации.
- Суспендируйте фрагменты ткани в холодном 1% сбалансированном растворе соли трипсина/Ганкса (HBSS) и инкубируйте при температуре 4 °C в течение 40 минут (рис. 1D).
- Аспирируйте 1% трипсин/HBSS и промойте кусочки ткани 2 раза в холодной диссоциативной среде, чтобы инактивировать трипсин.
- Фрагменты ткани инкубируют в 2 мл диссоциативной среды с 0,4 мг ДНКазы в течение не менее 30 мин при комнатной температуре.
ПРИМЕЧАНИЕ: Может потребоваться более длительный инкубационный период, но не более 45 минут до начала шага 2.7. - Под препарирующим микроскопом, еще находясь в среде с ДНКазой, удерживают фрагмент маточной трубы, просвет которого параллельен дну чашки, на месте с помощью щипцов. Другой рукой многократно надавливайте щипцами на кусочек маточной трубы, чтобы изгнать эпителиальные клетки из просвета трубы. Убедитесь, что вокруг ткани виден ореол клеток по мере высвобождения клеток из просвета трубки. Повторите для каждого фрагмента фаллопиевой трубы в чашке (рисунок 1E).
- Переложите клетки, содержащие среды, в стерильную пробирку объемом 15 мл, промойте чашку Петри диссоциативной средой не менее 2 раз и объедините промывки в пробирке объемом 15 мл. Отбраковывайте фрагменты стромальной трубы.
- Соберите клетки центрифугированием при 500 × г в течение 5 мин. Аспирируйте надосадочную жидкость и ресуспендируйте гранулу в 1 мл диссоциативной среды.
- Подсчитайте клетки, аликвотируя 10 мкл клеточной суспензии и смешав 1:1 с трипановым синим. Нанесите пипеткой 10 мкл смеси в камеру счетного стекла и вставьте ее в счетчик ячеек (рис. 1F).
3. Разложение до одноклеточной суспензии
- Ресуспендируют клетки в 9 мл диссоциативных сред, 1 мл 8 мг/мл коллагеназы (тип 1) и 0,4 мг ДНКазы. Инкубировать при 37 °C в течение 30–45 мин в орбитальном вибростенде со скоростью 200 об/мин (рис. 1G).
- Соберите клетки центрифугированием при 500 × г в течение 5 минут. Аспирируйте надосадочную жидкость и ресуспендируйте гранулу в 5 мл диссоциативной среды, чтобы смыть коллагеназу.
- Пропустите клеточную суспензию через клеточный фильтр 100 мкм в пробирку объемом 50 мл (рисунок 1H).
- Соберите клетки центрифугированием при 500 × г в течение 5 минут.
- Если клеточная гранула выглядит красной, проведите лизис эритроцитов (эритроцитов), как описано в шагах 3.6–3.8. Если гранула ячейки не красная, перейдите к шагу 3.9.
- Разведите 500 мкл буфера для лизиса эритроцитов в 4,5 мл ультрачистой воды.
- Отсадите среду, добавьте 5 мл разбавленного буфера для лизиса эритроцитов и инкубируйте на льду в течение 3 минут.
- Чтобы остановить лизис эритроцитов, добавьте 45 мл 1x PBS в 50 мл пробирки.
- Соберите клетки центрифугированием при 500 × г в течение 5 минут.
- Подсчитайте клетки, выделив 10 мкл клеточной суспензии и смешав ее в соотношении 1:1 с трипановым синим. Пипеткой нанесите 10 мкл смеси в камеру счетного стекла и вставьте ее в счетчик ячеек (рисунок 1I).
4. Окрашивание методом проточной цитометрии
- Aliquot 250 000 клеток в две отдельные полистирольные пробирки с круглым дном объемом 5 мл для первичного конъюгированного антитела и контроля изотипа для использования в поверхностной маркерной проточной цитометрии.
ПРИМЕЧАНИЕ: Можно использовать меньшее количество ячеек для размещения количества клеток и количества клеток, необходимых для последующего анализа. Для достижения оптимальных результатов потока в анализ должно быть включено не менее 50 000 ячеек. - Разбавьте антитело (например, античеловеческий EpCAM и CD10) и изотип в соответствии с рекомендованным производителем разведением в 1x PBS. Включите в состав корректируемый краситель жизнеспособности (e506) и конъюгированное антитело против человеческого CD45 для вытеснения живых иммунных клеток человека. Приготовьте достаточное количество смеси антител не менее чем на 50 мкл на пробирку. Оставьте в темноте на льду до шага 4.4.
- Промойте клетки 1 мл 1x PBS. Соберите клетки центрифугированием при 500 × г в течение 5 мин при 4 °C.
- Аспирируйте 1x PBS. Повторно суспендируйте гранулу в панели антител или изотипа и инкубируйте при 4 °C в течение 15 минут в темноте.
- После инкубации разведите в 1 мл 1x PBS и соберите клетки центрифугированием при 500 × г в течение 5 мин при 4 °C.
- Аспирируйте 1x PBS и ресуспендируйте клеточную гранулу в 200 мкл 1x PBS.
5. Сбор данных проточной цитометрии
- Войдите в аппарат FACS.
ПРИМЕЧАНИЕ: Мы представляем протокол с использованием эталонного проточного цитометра (см. Таблицу материалов). Для других проточных цитометров придерживайтесь инструкций производителя. Настройка напряжения проточного цитометра была предварительно настроена для оптимальной работы с человеческими PBMC, что устраняет необходимость регулировки напряжения перед каждым запуском FACS. - Если машина находится в режиме сбора данных , перейдите к шагу 5.3. Если аппарат находится в режиме анализа данных , переключитесь в режим сбора данных , нажав кнопку питания в правом верхнем углу. Когда появится всплывающее окно, нажмите кнопку с надписью «Режим захвата».
- В левом нижнем углу, если машина считывает сообщение «Требуется калибровка», перейдите к шагу 5.3.1. Если устройство показывает Калибровка в порядке, перейдите к шагу 5.4.
- Чтобы откалибровать машину, достаньте калибровочные шарики из холодильника с температурой 4 °C и завихрите.
- Поместите 1 каплю калибровочных шариков в полистирольную пробирку с круглым дном объемом 5 мл и поместите пробирку в держатель для одиночной пробирки.
- Нажмите кнопку со штрих-кодом в правом верхнем углу и отсканируйте флакон с калибровочным шариком. Появится всплывающее окно. Если все настроено, нажмите Да | OK и дайте выполнить калибровку.
- Если калибровка прошла успешно, выйдите из системы и снова войдите в режим сбора данных . Перейдите к шагу 5.4.
- Нажмите «Открыть | новое рабочее пространство » в левом верхнем углу.
- Выберите стойку chill 5; Выберите три скважины. Выберите первую лунку и дайте ей описание (например, FTX Ab). Выберите следующую лунку и дайте ей уникальное описание (например, FTX Iso). Выберите последнюю лунку и придайте ей описание отбеливателя.
ПРИМЕЧАНИЕ: Всегда включайте образец отбеливателя после каждых 4–5 экспериментальных образцов, чтобы обеспечить своевременную очистку образцов клеток. - Выберите все скважины и настройте условия эксперимента следующим образом: настройки прибора: МПМП человека; Расход: высокий; Образец смеси: бережное перемешивание; Режим: стандартный; Общий объем образца 200 μл; Забор образца 150 μл; Аннотация: входные антитела и их флуорофорное мечение.
- Выберите edit | options и присвойте файлу имя в разделе description| apply | ok.
- Достаньте решетку из холодильника и поставьте ее на поднос штрих-кодом лицом к машине. Поместите пробирки с образцами в штатив, чтобы отобразить порядок образцов на экране, и нажмите кнопку воспроизведения , чтобы начать эксперимент.
- После завершения эксперимента подключите USB-накопитель, выберите Файл | копировать, разверните личную папку, выберите эксперимент и нажмите кнопку Копировать и извлечь.
- После сбора данных используйте программное обеспечение для анализа листа данных.
- Начните с управления изотипом. Используйте инструмент полигон для выбора ячеек на графике прямого рассеяния (FSC) и бокового рассеяния (SSC).
- Удалите мертвые клетки, изменив ось Y на e506 , а ось X на FSC. Используйте инструмент полигон для выбора популяции e506-отрицательных живых клеток.
- Дважды щелкните по выбранной популяции. Измените ось Y на человеческий CD45. Используйте инструмент полигон для выбора популяции ячеек. Это популяция CD45-отрицательных клеток человека.
- Дважды щелкните по популяции CD45-отрицательных клеток. Измените ось Y на гистограмму , а ось X на EpCAM человека. С помощью инструмента выбора диапазона нажмите на конец гистограммы и выделите пустое место до конца графика. Это представляет собой EpCAM-положительную популяцию. Повторите для окрашивания CD10 человека.
- Перетащите стробирование изотипа под рабочую область антитела. CD45-положительные клетки будут закрыты, и для них будут отобраны EpCAM-положительные и CD10-положительные популяции.
- Чтобы создать репрезентативные гистограммы, выберите редактор компоновки. Перетащите нужные гистограммы на страницу макета. Чтобы сравнить окрашивание изотипа и антител, наложите гистограмму изотипа на гистограмму антитела. Вентиль для положительных клеток на основе контроля изотипа.
6. Иммуноцитохимия
- Культивируемые клетки после заключительного этапа выделения в нужной камере стеклу скользят до слияния.
- Для фиксации клеток добавьте 500 мкл холодного 4% параформальдегида (PFA) Инкубируйте при комнатной температуре в течение 10 минут.
- Отасуньте 4% PFA и промойте 3x 1x PBS.
- Для проникновения клеток добавьте не менее 200 мкл 0,25% Triton-X в PBS и инкубируйте при комнатной температуре в течение 10 минут.
- Во время пермеабилизации приготовьте блокирующий буфер (4% нормальная сыворотка крови коз [NGS] для антител, не вырабатываемых у коз).
- Отсадите 0,25% Triton-X и промойте 3 раза с 1x PBS.
- Добавьте не менее 200 мкл блокирующего буфера (4% NGS в PBS). Заблокируйте на 1 ч при комнатной температуре.
- Готовят первичные разведения антител в 1% NGS в 1x PBS в соответствии с рекомендациями производителя.
- После блокировки добавьте не менее 200 мкл первичного раствора антитела. Выдерживать при комнатной температуре в течение 2 ч.
ПРИМЕЧАНИЕ: Некоторые первичные антитела могут предпочесть инкубацию при температуре 4 °C в течение ночи; Проверьте паспорт антител. - Готовят вторичные растворы антител в 1% NGS в 1x PBS. Оберните пробирки в оловянную фольгу и готовьте растворы в темноте, так как вторичные антитела чувствительны к свету. Хранить в темноте до готовности.
- После первичной инкубации антител промойте 3 раза 1x PBS.
- Добавьте не менее 200 мкл раствора вторичного антитела. Выдерживать в темноте при комнатной температуре в течение 1 ч.
ПРИМЕЧАНИЕ: Во время следующих шагов старайтесь как можно дольше держать предметное стекло в темноте. - После инкубации вторичных антител промойте 3 раза 1x PBS.
- Снимите камеры, просто сняв их вручную или с помощью инструмента, который идет в комплекте со слайдами. Следуйте инструкциям, напечатанным на упаковке предметного стекла камеры, для извлечения.
- Добавьте каплю монтажной сыворотки 4',6-диамидино-2-фенилиндол (DAPI) и наденьте сверху покровную крышку. Ограничьте количество пузырьков и убедитесь, что все ячейки закрыты. Дополнительный шаг: используйте лак для ногтей по краям, чтобы запечатать покровное стекло.
- Положите предметное стекло в коробку для высыхания и поместите при температуре 4 °C до получения изображения.
- Изображение на микроскопе оснащено правильной флуоресценцией на основе вторичной конъюгации антител для обеспечения чистоты изображения.
Результаты
Мы включили семь коллекций фаллопиевых труб, в которых мы выделили обогащенную популяцию эпителиальных клеток (рисунок 2A и дополнительный рисунок S1A). Для оценки жизнеспособности и обогащения эпителиальных клеток этим методом суспензии одиночных клеток была проведена проточная цитометрия. Для измерения жизнеспособности клеток клетки окрашивали маркером жизнеспособности e506. Это также позволило отсеять весь мусор и мертвые клетки при анализе.
Чтобы определить состав клеток, выделенных с помощью этого метода, образцы окрашивали эпителиальным клеточным маркером (EpCAM), маркером стромальных клеток (CD10) и маркером иммунных клеток (CD45). Как видно на рисунке 2B, мы выделили жизнеспособную и обогащенную популяцию эпителиальных клеток из ткани фаллопиевой трубы. Жизнеспособность образца составила в среднем 82%. Для всех образцов, после гейтирования CD45-положительных клеток, мы наблюдали обогащенную популяцию эпителиальных клеток с EpCAM-положительными клетками, составляющими в среднем 80% образца. Наблюдалась некоторая контаминация стромальных клеток, но в среднем только 7,8%. На рисунке 2C показаны изолированные клетки в 2D через 4-6 дней после осаждения. Очевидно, что эпителиальные клетки были изолированы, поскольку они образовывали последовательные адгезивные кластеры, похожие на булыжник. На дополнительном рисунке S1B клетки были покрыты после выделения и культивировались в течение 2-6 дней. Для характеристики клеток, растущих в культуре, использовали иммуноцитохимию. Большинство клеток в культуре были окрашены положительно на EpCAM и маркер секреторных клеток, PAX8. Только несколько клеток были идентифицированы как виментин-положительные. Реснитчатые клетки были замечены в культуре, как это было снято на видео, показанном в дополнительном видео S1.
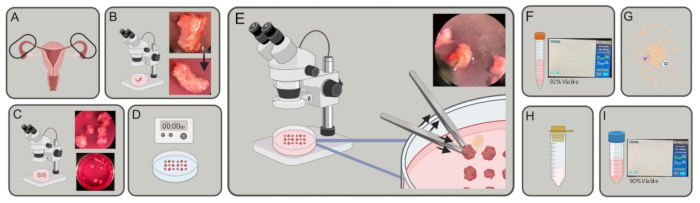
Рисунок 1: Экспериментальная схема. (А) Приобретаются фаллопиевы трубы. (Б) Удаляются излишки жира и соединительной ткани. (C) Трубки разрезаются на кусочки ~3-5 мм. (D) Кусочки промывают в PBS, затем инкубируют в ЭДТА 2x в течение 5 минут и инкубируют в 1% трипсине в течение 40 минут при 4 °C. (E) С помощью двух пар щипцов, одну для удержания, а другую для надавливания, изгоните эпителиальные клетки из частей фаллопиевой трубы. (F) Перенесите клетки в пробирку объемом 15 мл, вращайтесь и считайте. (G) Ресуспендия в ДМЭМ, коллагеназе и ДНКазе. Варить в течение 30-45 мин. (H) Процедить через ситечко 100 мкм. (I) Сбор урожая методом центрифугирования и подсчета. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
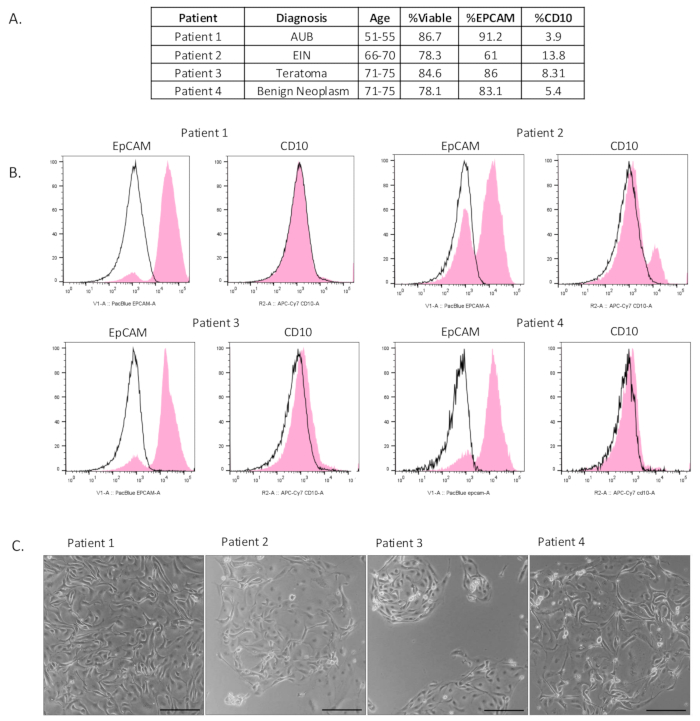
Рисунок 2: Характеристика выделенных эпителиальных клеток. (A) Таблица клинической информации о пациенте и результаты проточной цитометрии. (B) Проточная цитометрия была проведена после выделения, чтобы показать, что была выделена обогащенная популяция эпителиальных клеток (EpCAM-положительная). Отрицательный контроль изотипа обозначен черным цветом, а экспериментальный результат – розовым. (C) Клетки были покрыты плацированием после выделения. Фотографии были сделаны через 4-6 дней после нанесения покрытия. Масштабные линейки = 100 μм. Сокращения: AUB = Аномальное маточное кровотечение; EIN = Интраэпителиальная неоплазия эндометрия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Дополнительный рисунок S1: Дополнительная характеристика изолированных эпителиальных клеток в культуре. (А) Таблица клинической информации о пациенте. (B) Выделенные клетки культивировали и окрашивали на EpCAM, маркер секреторных клеток (PAX8) и маркер стромальных клеток (Vimentin) через 2-6 дней после посева для характеристики типа клеток в культуре. Масштабные линейки = 50 μм. Сокращения: EIN: Интраэпителиальная неоплазия эндометрия; DAPI = 4',6-диамидино-2-фенилиндол. Пожалуйста, нажмите здесь, чтобы скачать этот рисунок.
Дополнительное видео S1: Видео битья реснитчатых клеток было снято при 30-кратном увеличении, чтобы продемонстрировать реснитчатые клетки в культуре. Пожалуйста, нажмите здесь, чтобы скачать это видео.
Обсуждение
Существует значительный интерес к изучению эпителия фаллопиевых труб, поскольку фаллопиевы трубы играют значительную роль в размножении и являются местом происхождения большинства HGSOC. С этой целью многие исследователи описали протоколы по выделению клеток фаллопиевых труб в моделях человека и мышей 10,11,12,15,16,17,18,19,20,21. Описываемый нами метод извлечения и обогащения эпителиальных клеток фаллопиевых труб дополняет существующие протоколы выделения клеток фаллопиевых труб. Несмотря на то, что в этих протоколах существуют совпадения, существуют два основных типа методов, описанных на мышах и людях. Первый включает в себя измельчение и ферментативное переваривание всей фаллопиевой трубы, что дает общую клеточную суспензию 10,12,15,16,17. Второй включает в себя шелушение с перемешиванием или соскабливанием, в результате чего образуются листы ткани 11,18,19,20,21. Оба метода позволяют анализировать эпителиальные клетки с помощью последующих экспериментов, таких как проточная цитометрия, секвенирование и культивирование in vitro. Основным преимуществом нашего метода является то, что протокол позволяет получить популяцию клеток фаллопиевых труб, которые уже обогащены эпителиальными клетками за счет ферментативного расщепления и механического проталкивания. Эта популяция, обогащенная эпителием, может быть дополнительно расщеплена в результате получения суспензии для одной клетки, которую можно использовать для многих приложений, таких как проточная цитометрия, 2D-культура, иммуноцитохимия и секвенирование РНК одиночных клеток.
Мы обнаружили, что ключевые факторы, влияющие на выход клеток, включают продолжительность, в течение которой фрагменты фаллопиевых труб инкубируются в 1% трипсина/HBSS и DMEM/ДНКазы. Чрезмерная инкубация в любом растворе приведет к деградации клеток и значительному снижению жизнеспособности клеток. Тем не менее, недостаточное время инкубации будет препятствовать способности исследователя выталкивать многие эпителиальные клетки во время этапа протокола 2.6, поскольку они будут продолжать прилипать друг к другу. Также важно использовать 1% раствор трипсина, так как как более низкие, так и более высокие концентрации растворов трипсина снижают выход жизнеспособных эпителиальных клеток фаллопиевых труб. Комбинируя химическую и механическую изоляцию и стадию разложения (протокол 3.1), мы можем экспоненциально сократить период, необходимый для перехода от ткани к суспензии одиночных клеток. Это обеспечивает хорошую жизнеспособность и время для выполнения анализа в тот же день.
На этапе протокола 1.4 очень важно убедиться, что толщина отрезков маточной трубы составляет 3-5 мм. Если кусочки слишком большие, будет трудно выполнить этап протокола 2.7 и, в конечном итоге, снизить выход клеток, поскольку потребуется более длительное время инкубации в DMEM/DNase.
Несмотря на то, что клеточная суспензия обогащена эпителиальными клетками, контаминация стромальных клеток неизбежна. Если препарат должен быть чисто эпителиальными клетками, можно провести сортировку с помощью проточной цитометрии и описанных нами маркеров для выделения эпителиальных клеток и истощения стромальных клеток.
В данном исследовании использовались фаллопиевы трубы в постменопаузе. Тем не менее, этот метод был успешно использован в нашей лаборатории на фаллопиевых трубах в пременопаузе. Основным различием между фаллопиевыми трубами в пре- и постменопаузе является состав реснитчатых и секреторных эпителиальных клеток1. Этот протокол работает на всех репродуктивных стадиях.
Этот эффективный протокол облегчит исследование типов клеток эпителия фаллопиевых труб, включая разграничение клеточных линий, их динамические изменения во время репродуктивных циклов, а также после менопаузы, а также их роль в инициировании серозного рака яичников высокой степени злокачественности.
Раскрытие информации
У авторов нет конфликта интересов, о котором можно было бы заявить.
Благодарности
Авторы Руэгг Л., Джеймс-Аллан Л.Б. и ДиБернардо Г. частично поддержаны проектами Ассоциации ветеранов Большого Лос-Анджелеса 1I01BX006019-01A2 и I01BX006411-01 Мемарзаде С. Автор Очоа С. Поддерживается Калифорнийским университетом в Лос-Анджелесе и Центром регенеративной медицины и исследований стволовых клеток Эдит Броуд Фондом Роуз Хиллз Стипендиальная программа для выпускников. Мы хотим поблагодарить Центральную лабораторию трансляционной патологии в Калифорнийском университете в Лос-Анджелесе и, в частности, Ко Киле и Хлою Инь за помощь в закупке тканей. Мы также хотим поблагодарить Кена Ямаути и ядро микроскопии BSCRC за их помощь в визуализации. Рисунок 1 был создан с BioRender.com (договор No JL27QWDYNT). Наконец, мы хотели бы поблагодарить Фелицию Кордеа и ядро проточной цитометрии BSCRC за помощь в проведении проточной цитометрии.
Материалы
| Name | Company | Catalog Number | Comments |
| 1% Trypsin | Thermo Scientific | J63993.09 | |
| 100 µm Cell Strainer | Corning | 431752 | |
| 4% Paraformaldehyde | Electron Microscopy Sciences | 15710-S | |
| 5 mL round bottom tubes | Corning | 352008 | |
| 60 mm cell culture plate | Corning | CLS430589-500EA | |
| 6-well Cell Culture Plate | Corning | 353046 | |
| Anti-CD10 | BioLegend | 312212 | |
| Anti-CD326 (Ep-CAM) | BioLegend | 324218 | |
| Anti-CD45 | BioLegend | 304026 | |
| Anti-EpCAM | Abcam | ab223582 | |
| Anti-IgG2a PerCP | BioLegend | 400250 | |
| Anti-PAX8 | Sigma-Aldrich | 363M-15 | |
| Anti-Vimentin | Agilent Technologies | M072501-2 | |
| Chamber Slide System | Thermo Scientific | 154917PK | |
| Collagenase | Thermo Scientific | 17100017 | |
| DMEM | Thermo Scientific | 10569-010 | |
| DNase I | Sigma | 10104159001 | |
| EDTA | Sigma | 3690 | |
| eFluor 506 | Invitrogen | 65-0866-14 | |
| FBS | Sigma | F2442 | |
| Fine point forceps | VWR | 102091-526 | Any finepoint forceps of your choice will work |
| Fixable Viability Dye eFluor 506 | Invitrogen | 65-0866-14 | |
| FlowJo software version 9 | BD Biosciences | Data analysis software | |
| GlutaMAX | Gibco | 35050-061 | |
| HBSS | Thermo Scientific | 14175-095 | |
| MACSQuant Analyzer 10 flow cytometer | Miltenyi Biotec | ||
| MACSQuant Calibration Beads | Miltenyi Biotec | 130-093-607 | |
| Mammocult | Stemcell Technologies | 5620 | |
| Normal Goat Serum | Fisher Scientific | PI31873 | |
| PBS | Thermo Scientific | 14190-144 | |
| Penicillin-Streptomyocin | Gibco | 15140-122 | |
| PerCP Conjugated CD45 | BioLegend | 304026 | |
| Red Blood Cell lysis buffer | Tonbo Biosciences | TNB-4300-L100 | |
| Triton X-100 | Thermo Scientific | BP151-100 | |
| Vannas-Tubingen Spring Scissors | Fine Science Tools | 15003-08 | |
| VECTASHIELD with DAPI | Fisher Scientific | NC9524612 |
Ссылки
- Crow, J., Amso, N. N., Lewin, J., Shaw, R. W. Morphology and ultrastructure of fallopian tube epithelium at different stages of the menstrual cycle and menopause. Hum Reprod. 9 (12), 2224-2233 (1994).
- Patek, E., Nilsson, L., Johannisson, E. Scanning electron microscopic study of the human fallopian tube. Report II. Fetal life, reproductive life, and postmenopause. Fert Steril. 23 (10), 719-733 (1972).
- Coan, M., et al. Exploring the role of fallopian ciliated cells in the pathogenesis of high-grade serous ovarian cancer. Int J Mol Sci. 19 (9), 2512 (2018).
- Leese, H., Tay, J., Reischl, J., Downing, S. Formation of fallopian tubal fluid: role of a neglected epithelium. Reproduction. 121 (3), 339-346 (2001).
- Donnez, J., Casanas-Roux, F., Ferin, J., Thomas, K. Changes in ciliation and cell height in human tubal epithelium in the fertile and post-fertile years. Maturitas. 5 (1), 39-45 (1983).
- Lengyel, E., et al. A molecular atlas of the human postmenopausal fallopian tube and ovary from single-cell RNA and ATAC sequencing. Cell Rep. 41 (12), 111838-111838 (2022).
- Tao, T., et al. Loss of tubal ciliated cells as a risk for "ovarian" or pelvic serous carcinoma. Am J Cancer Res. 10 (11), 3815 (2020).
- Li, J., Fadare, O., Xiang, L., Kong, B., Zheng, W. Ovarian serous carcinoma: recent concepts on its origin and carcinogenesis. J Hematol Oncol. 5 (1), 8 (2012).
- Hu, Z., et al. The repertoire of serous ovarian cancer non-genetic heterogeneity revealed by single-cell sequencing of normal fallopian tube epithelial cells. Cancer Cell. 37 (2), 226-242.e7 (2020).
- Dinh, H. Q., et al. Single-cell transcriptomics identifies gene expression networks driving differentiation and tumorigenesis in the human fallopian tube. Cell Rep. 35 (2), 108978 (2021).
- Ulrich, N., et al. Cellular heterogeneity of human fallopian tubes in normal and hydrosalpinx disease states identified using scRNA-seq. Dev Cell. 57 (7), 914-929.e7 (2022).
- Brand, J., et al. Fallopian tube single cell analysis reveals myeloid cell alterations in high-grade serous ovarian cancer. iScience. 27 (3), 108990-108990 (2024).
- Memarzadeh, S., et al. Cell-autonomous activation of the PI3-kinase pathway initiates endometrial cancer from adult uterine epithelium. Proc Natl Acad Sci USA. 107 (40), 17298-17303 (2010).
- Cunha, G. R. Stromal induction and specification of morphogenesis and cytodifferentiation of the epithelia of the mullerian ducts and urogenital sinus during development of the uterus and vagina in mice. J Exp Zool. 196 (3), 361-369 (1976).
- Xie, Y., Park, E. -. S., Xiang, D., Li, Z. Long-term organoid culture reveals enrichment of organoid-forming epithelial cells in the fimbrial portion of mouse fallopian tube. Stem Cell Res. 32 (1873-5061), 51-60 (2018).
- Karst, A. M., Drapkin, R. Primary culture and immortalization of human fallopian tube secretory epithelial cells. Nat Protoc. 7 (9), 1755-1764 (2012).
- Ford, M. J., Harwalkar, K., Yamanaka, Y. Protocol to generate mouse oviduct epithelial organoids for viral transduction and whole-mount 3D imaging. STAR Protocols. 3 (1), 101164 (2022).
- Radecki, K. C., Lorenson, M. Y., Carter, D. G., Walker, A. M. Microdissection and dissociation of the murine oviduct: Individual segment identification and single cell isolation. J Vis Exp. (177), e63168 (2021).
- Feng, L., et al. Protocol for the detection of organoid-initiating cell activity in patient-derived single fallopian tube epithelial cells. Methods Mol Bio. 2429, 445-454 (2022).
- Kessler, M., et al. The Notch and Wnt pathways regulate stemness and differentiation in human fallopian tube organoids. Nat Commun. 6 (1), 8989 (2015).
- Fotheringham, S., Levanon, K., Drapkin, R. Ex vivo culture of primary human fallopian tube epithelial cells. J Vis Exp. (51), e2728 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены