Method Article
ヒト卵管上皮をシングルセル解析で効率的に抽出する方法
要約
このプロトコルは、ヒト卵管上皮細胞を単離するための1日法を説明しています。単離された上皮細胞は、2次元(2D)培養でプレーティングするか、シングルセル懸濁液に解離して、フローサイトメトリーやシングルセルRNAシーケンシングなどのダウンストリーム実験に利用できます。
要約
人間の卵管は生殖に内在しています。卵管の目的は、精子、卵子、そして受精が成功した場合は胚の通過を可能にすることです。卵管の内面を覆う上皮細胞は、病気の開始を含む正常な卵管プロセスと異常な卵管プロセスの両方に不可欠です。閉経後、卵管は体内で重要な役割を果たすのをやめ、上皮内細胞の構成が変化します。これらの上皮細胞を新鮮な卵管から分離し、間質細胞の汚染を最小限に抑えて単一細胞懸濁液にする方法を説明します。これらの細胞は、培養で増殖させたり、フローサイトメトリーやシングルセルRNAシーケンシングなどのさらなる解析に使用したりできます。この単離プロトコルは4-6時間で達成でき、即時ダウンストリーム分析に使用できる生細胞が得られます。この効率的なプロトコルは、濃縮された上皮集団を持つ卵管上皮細胞の単離を容易にします。
概要
卵管は複数の部品で構成されています。卵巣から子宮まで、卵管は線毛、膨大部、峡部、および壁内部分で構成されています。線毛は卵管の端から伸びており、そこで卵巣から放出された卵子をつかみます。その後、卵子は膨大部を通って受精する可能性が最も高い峡部に移動し、最終的に壁内部分1を介して子宮に移されます。卵子の輸送を促進する卵管の最も内側の粘膜は、繊毛細胞と分泌細胞を含む管腔上皮の層で構成されています。繊毛細胞は線毛2により集中する傾向があります。それらは、卵子を卵管を通して卵巣から子宮に物理的に移動させる上で不可欠な役割を果たします。それらの付属物により、繊毛細胞は卵子を移動させるだけでなく、排卵後の遺伝毒性ストレスを取り除くこともできます3。
分泌型卵管上皮細胞は、栄養と配偶子の組み立てを助ける液体を分泌します4。卵管上皮に沿った繊毛細胞と分泌細胞の割合は、閉経後の状態では異なり、卵管が輸送において重要な機能を果たさなくなるため、繊毛細胞が減少します5。さらに、エストロゲンがないと、卵管は痕跡になると考えられています1,6。この卵管内の繊毛細胞の喪失は、漿液性癌を発症するリスクを高めると仮定されています7。さらに、卵管分泌上皮細胞は、卵管卵巣癌の最も攻撃的なサブタイプである高悪性度漿液性癌7,8のよく知られた前駆体である漿液性卵管上皮内癌(STIC)病変を引き起こすと考えられています。
このプロトコルの目的は、ヒト卵管から上皮細胞を単離し、それらを単一細胞懸濁液に解離することです。このプロトコルにより、多くの分析に使用できる濃縮された単一細胞上皮集団が得られます。本稿で示したように、単離後にフローサイトメトリー解析を行い、細胞を2次元でプレーティングしました。フローサイトメトリー解析では、ほとんどが生存可能で上皮性である単一細胞の存在が示されています。これらの解析には、生存率のe506、上皮細胞のEpCAM、免疫細胞のCD45、間質細胞のCD10の4つのマーカーを含めました。死細胞はe506生存率マーカーを用いて排除し、免疫細胞はCD45を用いてゲートアウトした。懸濁液が免疫細胞集団を有することが可能である。しかしながら、比較的純粋な上皮細胞集団を達成するために、CD45陽性細胞は、CD45枯渇キットを用いて枯渇させることができる。さらに、培養物に播種すると、CD45陽性細胞は増殖しないことがよくあります。この方法で単離され、2Dで増殖した細胞は、付着性の丸石のような上皮集団を示します。この方法は、細胞調製物の生成に使用でき、細胞調製物をシングルセルRNAライブラリーに開発することができます。
卵管上皮の細胞系統、生殖生活のさまざまな段階でのこれらの系統の変化、および悪性形質転換と起源につながるイベントの誘発を定義するための研究は、過去4年間でより顕著になっています6,9,10,11,12 .このプロトコルは、卵管上皮を分離し、それらを単一細胞に処理する効率的な方法を提供することにより、この分野の研究に大いに役立ちます。
プロトコル
このプロトコルは、前述の子宮上皮細胞単離法から適応されました13,14。匿名化された卵管の新鮮な標本は、カリフォルニア大学ロサンゼルス校(UCLA)のIRB承認プロトコル#10-0727を通じて収集され、約4〜6時間以内に単一細胞懸濁液に消化されました。
1.卵管の収集と準備
- 解離培地(10%ウシ胎児血清(FBS)、5 mL L-グルタミン、5 mL のペニシリン/ストレプトマイシンを含むDMEM [4.5 g/L D-グルコース])に新鮮なヒト卵管(図 1A)を 15 mL または 50 mL チューブで採取し、氷上で実験室に輸送します。
- 卵管を新鮮な解離媒体を含む滅菌ペトリ皿に移します。
- 解剖顕微鏡下で、細い先端鉗子とVannas Tubingenハサミを使用して、脂肪、結合組織、およびチューブを囲む血管を解剖します(図1B)。
- 解剖顕微鏡下で、ハサミで卵管の冠状面を切断し、細い点の鉗子を使用して直径各 3 ~ 5 mm の小さな円柱を形成します (図 1C)。
2. 上皮細胞の単離と解離
- ディッシュから解離媒体を慎重に吸引します。
- ティッシュペーパー片を冷たい1倍リン酸緩衝生理食塩水(PBS)で2回洗浄し、~2 mLを静かにピペッティングして覆い、プレートを軽く回転させます。
- 最後の1x PBS洗浄液を吸引し、組織片を室温で冷たくした5 mMエチレンジアミン四酢酸(EDTA)で5分間インキュベートし、合計2回のインキュベーションを繰り返します。各インキュベーション後に5mM EDTAを吸引します。
- 組織断片を冷たい1%トリプシン/ハンクス平衡塩溶液(HBSS)に懸濁し、4°Cで40分間インキュベートします(図1D)。
- 1%トリプシン/ HBSSを吸引し、組織片を冷解離培地で2回洗浄してトリプシンを不活性化します。
- 組織断片を2 mLの解離培地に0.4 mgのDNaseを入れて、室温で少なくとも30分間インキュベートします。
注:より長いインキュベーション期間が必要な場合がありますが、ステップ2.7を開始する前に45分を超えないようにしてください。 - 解剖顕微鏡下で、DNaseを含む培地にまだいる間に、卵管の断片、皿の底に平行な内腔を鉗子で所定の位置に保持します。一方、鉗子で卵管片を繰り返し押して、管の内腔から上皮細胞を排出します。細胞がチューブの内腔から放出されるときに、組織の周りに細胞のハローが見られることを確認します。皿の中の卵管の各断片について繰り返します(図1E)。
- 細胞を含む培地を滅菌済みの15 mLチューブに移し、ペトリ皿を解離培地で少なくとも2回洗浄し、洗浄液を15 mLチューブに結合します。間質管の破片を廃棄します。
- 500 × g で5分間遠心分離することにより、細胞を回収します。上清を吸引し、ペレットを1 mLの解離培地に再懸濁します。
- 細胞懸濁液10 μLを分注し、トリパンブルーと1:1を混合して細胞をカウントします。混合物10μLをチャンバー計数スライドにピペットで移し、セルカウンターに挿入します(図1F)。
3. 単一細胞懸濁液への消化
- 細胞を9 mLの解離培地、1 mLの8 mg/mLコラゲナーゼ(1型)、および0.4 mgのDNaseに再懸濁します。37°Cで30〜45分間、オービタルシェーカーで200 rpmでインキュベートします(図1G)。
- 細胞を500 × g で5分間遠心分離して回収します。上清を吸引し、ペレットを5 mLの解離培地に再懸濁してコラゲナーゼを洗い流します。
- 細胞懸濁液を100 μmの細胞ストレーナーに通し、50 mLのチューブに入れます(図1H)。
- 細胞を500 × g で5分間遠心分離して回収します。
- 細胞ペレットが赤く見える場合は、ステップ3.6〜3.8で説明されているように赤血球(RBC)溶解を行います。セルペレットが赤でない場合は、ステップ3.9にスキップします。
- 500 μL の RBC 溶解バッファーを 4.5 mL の超純水で希釈します。
- 培地を吸引し、希釈したRBC溶解バッファー5 mLを加え、氷上で3分間インキュベートします。
- RBCの溶解を止めるには、50 mLチューブに45 mLの1x PBSを加えます。
- 細胞を500 × g で5分間遠心分離して回収します。
- 細胞懸濁液10μLを分注し、トリパンブルーと1:1で混合して細胞をカウントします。混合物10μLをチャンバー計数スライドにピペットで移し、セルカウンターに挿入します(図1I)。
4. フローサイトメトリー染色
- 250,000個の細胞を2つの別々の5 mLポリスチレン丸底チューブに分注し、一次標識抗体および表面マーカーフローサイトメトリーに使用するアイソタイプコントロールに使用します。
注:ダウンストリーム解析に必要なセル数とセル数に対応するために、使用するセル数を減らすことができます。最適なフロー結果を得るには、最低 50,000 個の細胞を解析に含める必要があります。 - 抗体(抗ヒトEpCAMやCD10など)とアイソタイプを、メーカーが推奨する希釈度に従って1x PBSで希釈します。固定可能な生存率色素(e506)と結合抗ヒトCD45抗体を含めて、生きたヒト免疫細胞をゲートアウトします。チューブあたり少なくとも50μLの抗体混合物を十分に調製してください。ステップ4.4まで氷の上の暗闇に置きます。
- 1x PBSの1mLで細胞を洗浄します。細胞を500 × g で4°Cで5分間遠心分離して回収します。
- 1x PBSを吸引します。ペレットを抗体またはアイソタイプパネルに再懸濁し、暗所で4°Cで15分間インキュベートします。
- インキュベーション後、1x PBS1 mLで希釈し、500 × g 、4°Cで5分間遠心分離して細胞を回収します。
- 1x PBSを吸引し、細胞ペレットを1x PBSの200 μLに再懸濁します。
5. フローサイトメトリーのデータ収集
- FACSマシンにログインします。
注:参照されたフローサイトメーターを使用したプロトコールを示します( 材料の表を参照)。その他のフローサイトメーターについては、製造元の指示に従ってください。フローサイトメーターの電圧設定は、ヒトPBMCで最適なパフォーマンスを発揮するようにあらかじめ設定されているため、各FACSの実行前に電圧を調整する必要がありません。 - マシンが取得モードの場合は、手順5.3に進みます。本機がデータ分析モードの場合は、右上の電源ボタンを押して取得モードに切り替えます。ポップアップが表示されたら、取得モードと表示されているボタンを押します。
- 左下のマシンに 「キャリブレーションが必要」と表示されている場合は、手順5.3.1に進みます。マシンが キャリブレーションOKと表示された場合は、手順5.4にスキップします。
- 機械を校正するには、校正ビーズを4°C冷蔵庫と渦から取り出します。
- 5 mLのポリスチレン丸底チューブに1滴のキャリブレーションビーズを入れ、チューブをシングルチューブホルダーに入れます。
- 右上の バーコード ボタンを押して、キャリブレーションビーズボトルをスキャンします。ポップアップが表示されます。すべてが設定されている場合は、[ はい] |OK して、キャリブレーションを実行します。
- キャリブレーションが成功した場合は、ログアウトして 再度取得 モードにログインします。手順 5.4 に進みます。
- 左上の [開く] | [新しいワークスペース ] をクリックします。
- チル5ラックを選択します。ウェルを 3 つ選択します。最初のウェルを選択し、説明を入力します(例:FTX Ab)。次のウェルを選択し、一意の説明(FTX Isoなど)を付けます。最後のウェルを選択し、説明に漂白剤を付けます。
注:細胞サンプルのタイムリーな洗浄を確実にするために、4〜5個の実験サンプルごとに常に漂白剤サンプルを含めます。 - すべてのウェルを選択し、実験条件を次のように設定します: 機器の設定: ヒトPBMC; 流量:高; ミックスサンプル:穏やかな混合。 モード:標準; サンプル総量200μL; サンプル摂取量150μL; アノテーション:インプット抗体とその蛍光色素の標識。
- [編集] メニューの [オプション] を選択し、[description] の [適用] | [OK] でファイルに名前を付けます。
- ラックを冷蔵庫から取り出し、バーコードを機械に向けてトレイに置きます。サンプルチューブをラックにセットして、画面上のサンプルの順序を反映させ、 再生 ボタンを押して実験を開始します。
- 実験が終了したら、USB を接続し、[ ファイル] メニューの [コピー] を選択し、プライベート フォルダーを展開して実験を選択し、[ コピーして取り出し] をクリックします。
- データ収集後、ソフトウェアを使用してデータシートを分析します。
- アイソタイプコントロールから始めます。 ポリゴン ツールを使用して 、前方散乱 (FSC) と側面散乱 (SSC) のプロットでセルを選択します。
- Y軸をe506に、X軸をFSCに変更して、デッドセルをゲートアウトします。ポリゴンツールを使用して、e506陰性の生細胞集団を選択します。
- 選択した母集団をダブルクリックします。 Y軸 を ヒトCD45に変更します。 ポリゴンツールを使用して 、セル母集団を選択します。これがヒトCD45陰性細胞集団です。
- CD45陰性細胞集団をダブルクリックします。 Y 軸 を ヒストグラム に、 X 軸 を Human EpCAM に変更します。 範囲選択ツールを使用して ヒストグラムの末尾をクリックし、グラフの末尾までの空白スペースを選択します。これは、EpCAM陽性の集団を表しています。ヒトCD10染色についても繰り返します。
- アイソタイプゲーティングを抗体ワークスペースの下にドラッグします。CD45陽性細胞はゲートアウトされ、EpCAM陽性およびCD10陽性の集団が選択されます。
- 代表的なヒストグラムを作成するには、 レイアウトエディタを選択します。目的のヒストグラムをレイアウトページにドラッグします。アイソタイプ染色と抗体染色を比較するには、アイソタイプヒストグラムを抗体ヒストグラムに重ね合わせます。アイソタイプコントロールに基づいて陽性細胞をゲートします。
6. 免疫細胞化学
- 最終単離ステップの後、目的のチャンバーガラススライドで細胞をコンフルエントになるまで培養します。
- 細胞を固定するには、500 μLの冷4%パラホルムアルデヒド(PFA)を加え、室温で10分間インキュベートします。
- 4% PFA を吸引し、1x PBS で 3 回洗浄します。
- 細胞を透過処理するには、PBSに0.25% Triton-Xを少なくとも200 μL加え、室温で10分間インキュベートします。
- 透過処理中に、ブロッキングバッファー(ヤギで産生されていない抗体については4%正常ヤギ血清[NGS])を調製します。
- 0.25%Triton-Xを吸引し、1x PBSで3回洗浄します。
- 少なくとも 200 μL のブロッキングバッファー (PBS 中 4% NGS) を添加します。室温で1時間ブロックします。
- 1% NGS中、1x PBS中の一次抗体希釈液を、メーカーの推奨に従って調製します。
- ブロッキング後、少なくとも200 μLの一次抗体溶液を添加します。室温で2時間インキュベートします。
注:一部の一次抗体は、4°Cの一晩のインキュベーションを好む場合があります。抗体のデータシートを確認してください。 - 1x PBS中の1% NGS中の二次抗体溶液を調製します。チューブをスズ箔で包み、二次抗体は光感受性であるため、暗所で溶液を調製します。準備ができるまで暗闇で保管してください。
- 一次抗体のインキュベーション後、1x PBSで3回洗浄します。
- 二次抗体溶液を少なくとも200 μL加えます。暗所で室温で1時間インキュベートします。
注意: 次の手順では、スライドをできるだけ暗く保つようにしてください。 - 二次抗体インキュベーション後、1x PBSで3回洗浄します。
- チャンバーを手で取り外すか、スライドに付属のツールを使用して、チャンバーを取り外します。チャンバースライドパッケージに印刷されている指示に従って取り外します。
- 4',6-ジアミジノ-2-フェニルインドール(DAPI)マウンティングセラムを一滴加え、上部にカバースリップを置きます。バブルの数を制限し、すべてのセルが覆われていることを確認します。オプションの手順:カバースリップをシールするために、端の周りにマニキュアを使用します。
- スライドをスライドボックスに平らに置いて乾燥させ、イメージングするまで4°Cに置きます。
- 二次抗体標識に基づく正しい蛍光を備えた顕微鏡で画像を取得し、クリーンな画像を確保します。
結果
濃縮された上皮細胞集団を単離した7つの卵管コレクションを含めました(図2A および 補足図S1A)。このシングルセル懸濁法の生存率と上皮細胞の濃縮を評価するために、フローサイトメトリーを実施しました。細胞生存率を測定するために、細胞を生存率マーカーe506で染色しました。これにより、分析時にすべての破片や死細胞をゲートアウトすることもできました。
この方法で単離した細胞の組成を決定するために、サンプルを上皮細胞マーカー(EpCAM)、間質細胞マーカー(CD10)、および免疫細胞マーカー(CD45)で染色しました。図2Bに見られるように、卵管組織から生存可能で濃縮された上皮細胞集団を単離しました。サンプルの生存率は平均82%でした。すべてのサンプルについて、CD45陽性細胞をゲートアウトした後、サンプルの平均80%のEpCAM陽性細胞を含む濃縮された上皮細胞集団を観察しました。間質細胞の汚染はありましたが、平均でわずか7.8%でした。図2Cは、めっき後4-6日後の2Dで単離された細胞を示しています。上皮細胞が一貫した付着性の丸石のようなクラスターを形成したため、上皮細胞が単離されたことは明らかです。補足図S1Bでは、細胞を単離後にプレーティングし、2〜6日間培養しました。免疫細胞化学を使用して、培養中で増殖する細胞の特性評価を行いました。培養中のほとんどの細胞は、EpCAMおよび分泌細胞マーカーであるPAX8に対して陽性でした。ビメンチン陽性と同定された細胞はごくわずかでした。繊毛細胞は、ビデオでキャプチャされたように培養中に見られました(補足ビデオS1に示されています)。
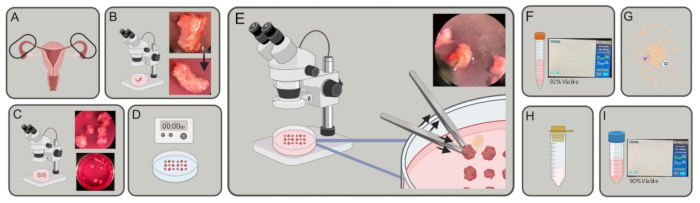
図1:実験的なスキーマ。 (A)卵管が取得されます。(B)余分な脂肪と結合組織が除去されます。(C) チューブを3~5mmにカットします。(D)ピースをPBSで洗浄し、EDTA 2xで5分間インキュベートし、1%トリプシンで40分間4°Cでインキュベートします。(E)2対の鉗子(1つは保持し、もう1つは押す)を使用して、卵管片から上皮細胞を排出します。(F)細胞を15mLチューブに移し、遠心してカウントします。(G)DMEM、コラゲナーゼ、およびDNaseに再懸濁します。30-45分間消化します (H) 100μmのストレーナーでひずみ。(I)遠心分離機で収穫し、カウントします。 この図の拡大版を表示するには、ここをクリックしてください。
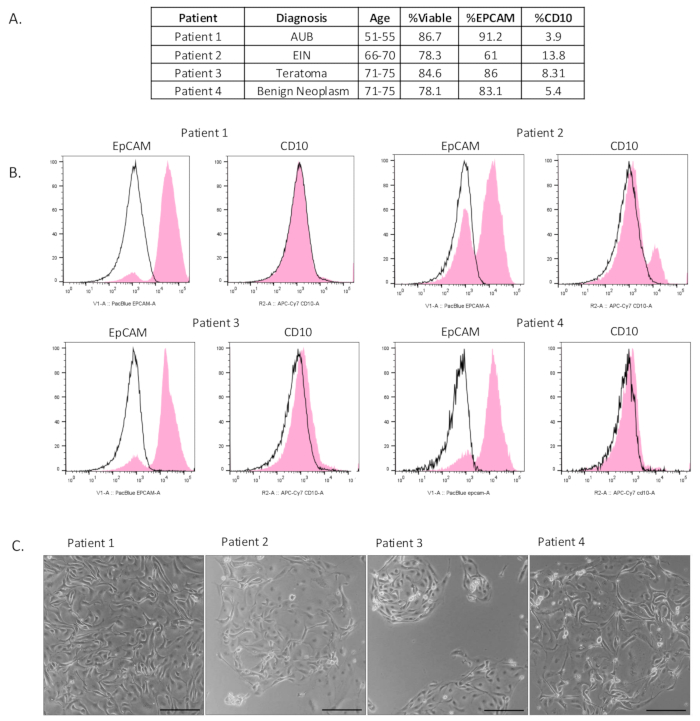
図2:単離された上皮細胞の特性評価。 (A)患者の臨床情報とフローサイトメトリーの結果の表。(B)単離後にフローサイトメトリーを行い、濃縮された上皮細胞集団(EpCAM陽性)が単離されたことを示しました。アイソタイプネガティブコントロールは黒色で、実験結果はピンク色で示しています。(C)細胞は単離後に播種した。写真はメッキ後4〜6日で撮影しました。スケールバー = 100 μm。略語:AUB =異常な子宮出血;EIN = 子宮内膜上皮内腫瘍。 この図の拡大版を表示するには、ここをクリックしてください。
補足 図S1:培養中の単離された上皮細胞の追加の特性評価。 (A)患者の臨床情報の表。(B)単離した細胞を、プレーティングの2〜6日後にEpCAM、分泌細胞マーカー(PAX8)、および間質細胞マーカー(ビメンチン)について培養および染色し、培養中の細胞タイプを特徴付けました。スケールバー = 50 μm。略語:EIN:子宮内膜上皮内腫瘍;DAPI=4',6-ジアミジノ-2-フェニルインドール。この図をダウンロードするには、ここをクリックしてください。
補足ビデオS1:繊毛細胞を叩くビデオを30倍倍で撮影し、培養中の繊毛細胞を示しました。このビデオをダウンロードするには、ここをクリックしてください。
ディスカッション
卵管は生殖に重要な役割を果たし、ほとんどのHGSOCの起源部位であるため、卵管上皮の研究にかなりの関心が寄せられています。そのために、多くの研究者は、ヒトおよびマウスモデル10,11,12,15,16,17,18,19,20,21の両方で卵管細胞を単離するためのプロトコルを記載している。卵管上皮細胞の抽出と濃縮を説明する方法は、既存の卵管細胞単離プロトコルに追加されます。これらのプロトコル内には重複する部分がありますが、マウスとヒトで報告されている方法には一般的な2つのタイプがあります。1つ目は、卵管全体を細かく刻み、酵素的に消化することで、総細胞懸濁液10,12,15,16,17が得られます。2つ目は、攪拌または掻き取りによる脱落を含み、その結果、ティッシュのシート11,18,19,20,21が得られます。どちらの方法も、フローサイトメトリー、シーケンシング、in vitro培養などの下流実験を通じて上皮細胞を解析することができます。私たちの方法の主な利点は、プロトコルが酵素消化と機械的なプッシュステップを通じて上皮細胞のためにすでに濃縮されている卵管細胞の集団をもたらすことです。上皮に富んだこの集団は、さらに消化することができ、フローサイトメトリー、2D培養、免疫細胞化学、シングルセルRNAシーケンシングなどの多くのアプリケーションに使用できるシングルセル懸濁液が得られます。
細胞収量に影響を与えることがわかった主なステップには、卵管フラグメントが1%トリプシン/HBSSおよびDMEM/DNaseでインキュベートする時間が含まれます。いずれの溶液でも過剰にインキュベートすると、細胞が分解され、細胞の生存率が大幅に低下します。しかし、インキュベーション時間が不十分な場合、プロトコールステップ2.6で多くの上皮細胞が互いに接着し続けるため、研究者が多くの上皮細胞を押し出す能力が阻害されます。また、低濃度と高濃度の両方のトリプシン溶液が生存可能な卵管上皮細胞の収量を減少させたため、1%トリプシン溶液を使用することも重要です。化学的および機械的単離と消化ステップ(プロトコールステップ3.1)を組み合わせることで、組織から単一細胞懸濁液に移行するまでの時間を指数関数的に短縮できます。これにより、良好な生存率と、同じ日にダウンストリーム分析を実行する時間を確保できます。
プロトコールステップ1.4では、卵管カットのピースが3〜5mmの厚さであることを確認することが重要です。断片が大きすぎると、プロトコールステップ2.7の実行が困難になり、DMEM/DNaseでのインキュベーション時間が長くなるため、最終的には細胞収量が減少します。
細胞懸濁液は上皮細胞に富んでいますが、間質細胞の汚染は避けられません。調製物を純粋に上皮細胞にする必要がある場合は、フローサイトメトリーと説明したマーカーを使用した選別を行い、上皮細胞を単離し、間質細胞を枯渇させることができます。
この研究では、閉経後の卵管が使用されました。しかし、この方法は、閉経前の卵管に関する私たちの研究室で成功裏に利用されています。閉経前と閉経後の卵管の主な違いは、繊毛上皮細胞と分泌上皮細胞の組成です1。このプロトコルは、すべての生殖段階で機能します。
この効率的なプロトコルは、細胞系統の描写、生殖周期中および閉経後の動的変化、および高悪性度の漿液性卵巣癌の開始におけるそれらの役割を含む、卵管上皮の細胞タイプの調査を容易にします。
開示事項
著者は、宣言する利益相反を持っていません。
謝辞
著者Ruegg L、James-Allan LBとDiBernardo Gは、部分的にグレーターロサンゼルス退役軍人協会のプロジェクト1I01BX006019-01A2とI01BX006411 Memarzadeh S.著者Ochoa Cは、UCLAイーライと再生医療と幹細胞研究のEdythe Broad Center of Regenerative Medicineと幹細胞研究ローズヒルズ財団大学院奨学金トレーニングプログラムによってサポートされています。UCLAのTranslational Pathology Core Laboratory、特に組織調達の支援を提供してくださったKo Kiehle氏とChloe Yin氏に感謝します。また、Ken Yamauchi氏とBSCRC Microscopy coreのイメージング支援に感謝します。 図 1 は、BioRender.com (契約番号 JL27QWDYNT) を使用して作成されました。最後に、フローサイトメトリーの支援について、Felicia Cordea氏とBSCRCフローサイトメトリーコアに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 1% Trypsin | Thermo Scientific | J63993.09 | |
| 100 µm Cell Strainer | Corning | 431752 | |
| 4% Paraformaldehyde | Electron Microscopy Sciences | 15710-S | |
| 5 mL round bottom tubes | Corning | 352008 | |
| 60 mm cell culture plate | Corning | CLS430589-500EA | |
| 6-well Cell Culture Plate | Corning | 353046 | |
| Anti-CD10 | BioLegend | 312212 | |
| Anti-CD326 (Ep-CAM) | BioLegend | 324218 | |
| Anti-CD45 | BioLegend | 304026 | |
| Anti-EpCAM | Abcam | ab223582 | |
| Anti-IgG2a PerCP | BioLegend | 400250 | |
| Anti-PAX8 | Sigma-Aldrich | 363M-15 | |
| Anti-Vimentin | Agilent Technologies | M072501-2 | |
| Chamber Slide System | Thermo Scientific | 154917PK | |
| Collagenase | Thermo Scientific | 17100017 | |
| DMEM | Thermo Scientific | 10569-010 | |
| DNase I | Sigma | 10104159001 | |
| EDTA | Sigma | 3690 | |
| eFluor 506 | Invitrogen | 65-0866-14 | |
| FBS | Sigma | F2442 | |
| Fine point forceps | VWR | 102091-526 | Any finepoint forceps of your choice will work |
| Fixable Viability Dye eFluor 506 | Invitrogen | 65-0866-14 | |
| FlowJo software version 9 | BD Biosciences | Data analysis software | |
| GlutaMAX | Gibco | 35050-061 | |
| HBSS | Thermo Scientific | 14175-095 | |
| MACSQuant Analyzer 10 flow cytometer | Miltenyi Biotec | ||
| MACSQuant Calibration Beads | Miltenyi Biotec | 130-093-607 | |
| Mammocult | Stemcell Technologies | 5620 | |
| Normal Goat Serum | Fisher Scientific | PI31873 | |
| PBS | Thermo Scientific | 14190-144 | |
| Penicillin-Streptomyocin | Gibco | 15140-122 | |
| PerCP Conjugated CD45 | BioLegend | 304026 | |
| Red Blood Cell lysis buffer | Tonbo Biosciences | TNB-4300-L100 | |
| Triton X-100 | Thermo Scientific | BP151-100 | |
| Vannas-Tubingen Spring Scissors | Fine Science Tools | 15003-08 | |
| VECTASHIELD with DAPI | Fisher Scientific | NC9524612 |
参考文献
- Crow, J., Amso, N. N., Lewin, J., Shaw, R. W. Morphology and ultrastructure of fallopian tube epithelium at different stages of the menstrual cycle and menopause. Hum Reprod. 9 (12), 2224-2233 (1994).
- Patek, E., Nilsson, L., Johannisson, E. Scanning electron microscopic study of the human fallopian tube. Report II. Fetal life, reproductive life, and postmenopause. Fert Steril. 23 (10), 719-733 (1972).
- Coan, M., et al. Exploring the role of fallopian ciliated cells in the pathogenesis of high-grade serous ovarian cancer. Int J Mol Sci. 19 (9), 2512 (2018).
- Leese, H., Tay, J., Reischl, J., Downing, S. Formation of fallopian tubal fluid: role of a neglected epithelium. Reproduction. 121 (3), 339-346 (2001).
- Donnez, J., Casanas-Roux, F., Ferin, J., Thomas, K. Changes in ciliation and cell height in human tubal epithelium in the fertile and post-fertile years. Maturitas. 5 (1), 39-45 (1983).
- Lengyel, E., et al. A molecular atlas of the human postmenopausal fallopian tube and ovary from single-cell RNA and ATAC sequencing. Cell Rep. 41 (12), 111838-111838 (2022).
- Tao, T., et al. Loss of tubal ciliated cells as a risk for "ovarian" or pelvic serous carcinoma. Am J Cancer Res. 10 (11), 3815 (2020).
- Li, J., Fadare, O., Xiang, L., Kong, B., Zheng, W. Ovarian serous carcinoma: recent concepts on its origin and carcinogenesis. J Hematol Oncol. 5 (1), 8 (2012).
- Hu, Z., et al. The repertoire of serous ovarian cancer non-genetic heterogeneity revealed by single-cell sequencing of normal fallopian tube epithelial cells. Cancer Cell. 37 (2), 226-242.e7 (2020).
- Dinh, H. Q., et al. Single-cell transcriptomics identifies gene expression networks driving differentiation and tumorigenesis in the human fallopian tube. Cell Rep. 35 (2), 108978 (2021).
- Ulrich, N., et al. Cellular heterogeneity of human fallopian tubes in normal and hydrosalpinx disease states identified using scRNA-seq. Dev Cell. 57 (7), 914-929.e7 (2022).
- Brand, J., et al. Fallopian tube single cell analysis reveals myeloid cell alterations in high-grade serous ovarian cancer. iScience. 27 (3), 108990-108990 (2024).
- Memarzadeh, S., et al. Cell-autonomous activation of the PI3-kinase pathway initiates endometrial cancer from adult uterine epithelium. Proc Natl Acad Sci USA. 107 (40), 17298-17303 (2010).
- Cunha, G. R. Stromal induction and specification of morphogenesis and cytodifferentiation of the epithelia of the mullerian ducts and urogenital sinus during development of the uterus and vagina in mice. J Exp Zool. 196 (3), 361-369 (1976).
- Xie, Y., Park, E. -. S., Xiang, D., Li, Z. Long-term organoid culture reveals enrichment of organoid-forming epithelial cells in the fimbrial portion of mouse fallopian tube. Stem Cell Res. 32 (1873-5061), 51-60 (2018).
- Karst, A. M., Drapkin, R. Primary culture and immortalization of human fallopian tube secretory epithelial cells. Nat Protoc. 7 (9), 1755-1764 (2012).
- Ford, M. J., Harwalkar, K., Yamanaka, Y. Protocol to generate mouse oviduct epithelial organoids for viral transduction and whole-mount 3D imaging. STAR Protocols. 3 (1), 101164 (2022).
- Radecki, K. C., Lorenson, M. Y., Carter, D. G., Walker, A. M. Microdissection and dissociation of the murine oviduct: Individual segment identification and single cell isolation. J Vis Exp. (177), e63168 (2021).
- Feng, L., et al. Protocol for the detection of organoid-initiating cell activity in patient-derived single fallopian tube epithelial cells. Methods Mol Bio. 2429, 445-454 (2022).
- Kessler, M., et al. The Notch and Wnt pathways regulate stemness and differentiation in human fallopian tube organoids. Nat Commun. 6 (1), 8989 (2015).
- Fotheringham, S., Levanon, K., Drapkin, R. Ex vivo culture of primary human fallopian tube epithelial cells. J Vis Exp. (51), e2728 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved