Method Article
שיטה יעילה לחילוץ אפיתל חצוצרות אנושיות לאנליזות של תאים בודדים
In This Article
Summary
פרוטוקול זה מתאר שיטה חד-יומית לבידוד תאי אפיתל חצוצרות אנושיים. תאי אפיתל מבודדים יכולים להיות מצופים בתרבית דו-ממדית (2D) או לפרק אותם לתרחיפים של תא בודד ולהשתמש בהם בניסויים במורד הזרם, כולל זרימה ציטומטרית וריצוף RNA של תא בודד.
Abstract
חצוצרות אנושיות הן מהותיות לרבייה. מטרת החצוצרות היא לאפשר מעבר של זרע, ביצית, ואם ההפריה מצליחה, העובר. תאי האפיתל המרפדים את המשטח הפנימי של החצוצרות הם חלק בלתי נפרד מתהליכים נורמליים וחריגים של החצוצרות, כולל התחלת מחלות. לאחר גיל המעבר, החצוצרות מפסיקות למלא תפקיד משמעותי בגוף והרכב התאים התוך-אפיתל משתנה. אנו מתארים שיטה שבה ניתן לבודד את תאי האפיתל הללו מחצוצרות טריות עם זיהום מינימלי של תאי סטרומה לתרחיף של תא בודד. ניתן לגדל תאים אלה בתרבית או להשתמש בהם לניתוח נוסף כגון זרימה ציטומטרית וריצוף RNA של תא בודד. ניתן להשיג פרוטוקול בידוד זה תוך 4-6 שעות ומניב תאים ברי קיימא שניתן להשתמש בהם לניתוח מיידי במורד הזרם. פרוטוקול יעיל זה מקל על בידוד תאי אפיתל חצוצרות עם אוכלוסיית אפיתל מועשרת.
Introduction
החצוצרות בנויות ממספר חלקים. מהשחלה ועד הרחם, החצוצרה מורכבת מהפימבריה, האמפולה, האיסטמוס והחלק התוך-מורלי. הפימבריה משתרעת מקצה החצוצרה שם הם תופסים את הביצית המשתחררת מהשחלה. לאחר מכן הביצית עוברת דרך האמפולה, שם סביר להניח שהיא מופרית, אל המצר ולבסוף מועברת לרחם דרך החלק התוך-מורלי1. הרירית הפנימית ביותר של החצוצרה המאפשרת הובלת ביצית מורכבת משכבת אפיתל לומינלית, כולל תאים ריסניים ומפרישים. תאים ריסניים נוטים להיות מרוכזים יותר בפימבריה2. הם ממלאים תפקיד אינטגרלי בהעברה פיזית של הביצית דרך החצוצרה מהשחלה לרחם. הנספחים שלהם מאפשרים לתאים הריסים לא רק להזיז את הביצית אלא גם לנקות מתח גנוטוקסי לאחר הביוץ3.
תאי אפיתל חצוצרות מפרישים מפרישים נוזל המסייע בתזונה ובהרכבת גמטות4. שיעור התאים הריסים והמפרישים לאורך אפיתל החצוצרה שונה במצב שלאחר גיל המעבר עם ירידה בתאים ריסניים מכיוון שהחצוצרה כבר לא משרתת תפקיד קריטי בהובלה5. יתר על כן, בהיעדר אסטרוגן, החצוצרות נחשבות לשרידים 1,6. אובדן זה של תאים ריסניים בחצוצרה צפוי להגביר את הסיכון לפתח קרצינומות סרוסיות7. בנוסף, תאי אפיתל מפרישי חצוצרות נחשבים כגורמים לנגעים של קרצינומה תוך-אפיתליאלית של חצוצרות (STIC), מבשר ידוע לתת-הסוג האגרסיבי ביותר של סרטן שחלות טובו, קרצינומה סרוסית בדרגה גבוהה 7,8.
מטרת פרוטוקול זה היא לבודד תאי אפיתל מחצוצרות אנושיות ולפרק אותם לתרחיפים חד-תאיים. פרוטוקול זה מניב אוכלוסיית אפיתל מועשרת של תא בודד שניתן להשתמש בה לניתוחים רבים. כפי שמוצג בכתב יד זה, ביצענו ניתוח ציטומטריית זרימה וציפינו תאים בדו-ממד לאחר בידוד. ניתוח ציטומטריית זרימה מדגים את נוכחותם של תאים בודדים, שהם בעיקר ברי קיימא ואפיתל באופיים. בניתוחים אלה, כללנו ארבעה סמנים, e506 עבור כדאיות, EpCAM עבור תאי אפיתל, CD45 עבור תאי חיסון ו-CD10 עבור תאי סטרומל. תאים מתים נשללו באמצעות סמן הכדאיות e506, ותאי חיסון הוצאו החוצה באמצעות CD45. ייתכן שלתרחיף תהיה אוכלוסיית תאים חיסונית; עם זאת, כדי להשיג אוכלוסייה טהורה יחסית של תאי אפיתל, ניתן לרוקן תאים חיוביים ל-CD45 באמצעות ערכת דלדול CD45. יתר על כן, כאשר הם מצופים בתרבית, התאים החיוביים ל-CD45 לרוב אינם מתרבים. תאים שבודדו בשיטה זו וגדלו בדו-ממד מראים אוכלוסיות אפיתל דמויות אבן. ניתן להשתמש בשיטה זו ליצירת תכשירים תאיים, אותם ניתן לפתח לספריות RNA חד-תאיות.
מחקר להגדרת השושלת התאית של אפיתל החצוצרות, שינויים בשושלות אלה במהלך שלבים שונים של חיי הרבייה, ואירועים מסיתים המובילים לטרנספורמציה ממאירה והיווצרות הפכו בולטים יותר בארבע השנים האחרונות 6,9,10,11,12 . פרוטוקול זה יועיל משמעותית למחקר בתחום זה על ידי מתן דרך יעילה לבודד אפיתל חצוצרות ולעבד אותם לתאים בודדים.
Protocol
פרוטוקול זה הותאם משיטת בידוד תאי אפיתל ברחם שתוארה קודם לכן13,14. דגימות טריות של חצוצרות לא מזוהות נאספו באמצעות פרוטוקול IRB שאושר על ידי אוניברסיטת קליפורניה, לוס אנג'לס (UCLA) #10-0727 ועוכלו לתרחיף חד-תאי תוך כ-4-6 שעות.
1. איסוף והכנה של חצוצרות
- אסוף חצוצרות אנושיות טריות (איור 1A) במצע דיסוציאציה (DMEM [4.5 גרם/ליטר D-גלוקוז] המכיל 10% סרום בקר עוברי (FBS), 5 מ"ל L-גלוטמין ו-5 מ"ל פניצילין/סטרפטומיצין) בצינורות של 15 מ"ל או 50 מ"ל והובלה על קרח למעבדה.
- העבירו את החצוצרות לצלחת פטרי סטרילית המכילה חומר דיסוציאציה טרי.
- תחת מיקרוסקופ מנתח, נתחו שומן, רקמת חיבור וכל כלי דם שמקיפים את הצינורות באמצעות מלקחיים דקים ומספריים של Vannas Tubingen (איור 1B).
- מתחת למיקרוסקופ הניתוח, חתכו את מישור העטרה של החצוצרות בעזרת מספריים כדי ליצור גלילים קטנים, בקוטר של ~3-5 מ"מ כל אחד (איור 1C), באמצעות מלקחיים עדינים כדי לייצב את הרקמה.
2. בידוד ודיסוציאציה של תאי אפיתל
- שאפו בזהירות את אמצעי הדיסוציאציה מהצלחת.
- שטפו את חתיכות הרקמה פי 2 עם מי מלח קרים 1x חוצץ פוספט (PBS) על ידי פיפטינג בעדינות ~2 מ"ל כדי לכסות את החלקים וסיבוב קל של הצלחת.
- שאפו את שטיפת ה-PBS הסופית 1x, דגרו על חתיכות הרקמה למשך 5 דקות בחומצה אתילנדיאמינטטראצטית קרה של 5 מ"מ (EDTA) בטמפרטורת החדר, וחזרו על הפעולה בסך הכל שתי דגירות. שאפו את ה-EDTA של 5 מ"מ לאחר כל דגירה.
- השעו את שברי הרקמה בתמיסת מלח מאוזנת של טריפסין/הנקס (HBSS) ודגרו בטמפרטורה של 4 מעלות צלזיוס למשך 40 דקות (איור 1D).
- שאפו את הטריפסין/HBSS 1% ושטפו את חתיכות הטישו פעמיים באמצעי דיסוציאציה קרים כדי לנטרל את הטריפסין.
- דגרו את שברי הרקמה ב-2 מ"ל של מדיה דיסוציאציה עם 0.4 מ"ג DNase למשך 30 דקות לפחות בטמפרטורת החדר.
הערה: ייתכן שיהיה צורך בתקופת דגירה ארוכה יותר, אך אל תעלה על 45 דקות לפני תחילת שלב 2.7. - תחת מיקרוסקופ מנתח, בעודכם בתקשורת עם DNase, החזיקו שבר מהחצוצרה, הלומן המקביל לתחתית המנה, במקומו בעזרת מלקחיים. ביד השנייה, לחץ שוב ושוב על חתיכת החצוצרה בעזרת מלקחיים כדי להוציא תאי אפיתל מלומן הצינור. ודא שהילה של תאים נראית סביב הרקמה כאשר תאים משתחררים מלומן הצינור. חזור על הפעולה עבור כל שבר של חצוצרה בצלחת (איור 1E).
- העבירו את המדיה המכילה תאים לצינור סטרילי של 15 מ"ל, שטפו את צלחת הפטרי באמצעי דיסוציאציה לפחות פי 2, ושלבו את השטיפות לתוך צינור 15 מ"ל. השלך את שברי צינור הסטרום.
- קצרו תאים על ידי צנטריפוגה בחום של 500 × גרם למשך 5 דקות. שאפו את הסופרנטנט והשעו מחדש את הגלולה ב-1 מ"ל של מדיה דיסוציאציה.
- ספור תאים על ידי ציטוט של 10 מיקרוליטר של תרחיף התא וערבוב 1:1 עם טריפאן כחול. פיפטה 10 מיקרוליטר של התערובת לתוך שקופית ספירת תא והכניסה אותה לתוך מונה תאים (איור 1F).
3. עיכול לתרחיף חד תאי
- השעו מחדש את התאים ב-9 מ"ל של מדיה דיסוציאציה, 1 מ"ל של 8 מ"ג/מ"ל קולגנאז (סוג 1) ו-0.4 מ"ג של DNase. דגירה ב-37 מעלות צלזיוס למשך 30-45 דקות בשייקר מסלולי ב-200 סל"ד (איור 1G).
- קצרו את התאים על ידי צנטריפוגה בחום של 500 × גרם למשך 5 דקות. שאפו את הסופרנטנט והשעו מחדש את הכדור ב-5 מ"ל של חומר דיסוציאציה כדי לשטוף את הקולגנאז.
- העבירו את מתלה התא דרך מסננת תאים של 100 מיקרומטר לתוך שפופרת של 50 מ"ל (איור 1H).
- קצרו את התאים על ידי צנטריפוגה בחום של 500 × גרם למשך 5 דקות.
- אם כדור התא נראה אדום, בצע ליזה של תאי דם אדומים (RBC) כמתואר בשלבים 3.6-3.8. אם גלולת התא אינה אדומה, דלג לשלב 3.9.
- לדלל 500 מיקרוליטר של מאגר ליזה RBC ב-4.5 מ"ל של מים טהורים במיוחד.
- שאפו את המדיה, הוסיפו 5 מ"ל ממאגר הליזיס המדולל של RBC ודגרו על קרח למשך 3 דקות.
- כדי לעצור ליזה של RBC, הוסף 45 מ"ל של 1x PBS לצינור של 50 מ"ל.
- קצרו את התאים על ידי צנטריפוגה בחום של 500 × גרם למשך 5 דקות.
- ספור את התאים על ידי ציטוט של 10 מיקרוליטר של תרחיף התא וערבוב 1:1 עם טריפאן כחול. פיפטה 10 מיקרוליטר של התערובת לתוך שקופית ספירת תא והכניסו אותה לתוך מונה התאים (איור 1I).
4. צביעת ציטומטריית זרימה
- יש לצרף 250,000 תאים לשני צינורות תחתונים עגולים נפרדים של 5 מ"ל פוליסטירן לבקרת נוגדנים מצומדים ראשוניים ואיזוטיפים לשימוש לציטומטריית זרימת סמן פני השטח.
הערה: ניתן להשתמש בפחות תאים כדי להתאים לספירת התאים ולמספר התאים הדרושים לניתוח במורד הזרם. כדי להשיג תוצאות זרימה מיטביות, יש לכלול מינימום של 50,000 תאים בניתוח. - יש לדלל את הנוגדן (למשל, EpCAM ו-CD10 אנטי-אנושיים) ואת האיזוטיפ בהתאם לדילול המומלץ של היצרן ב-1x PBS. כלול צבע כדאיות הניתן לתיקון (e506) ונוגדני CD45 אנטי-אנושיים מצומדים כדי להוציא תאי חיסון אנושיים חיים. הכינו מספיק תערובת נוגדנים לפחות 50 מיקרוליטר לכל צינור. השאירו בחושך על קרח עד שלב 4.4.
- שוטפים את התאים עם 1 מ"ל של 1x PBS. קצרו את התאים על ידי צנטריפוגה בחום של 500 × גרם למשך 5 דקות בטמפרטורה של 4 מעלות צלזיוס.
- שאפו את ה-PBS 1x. השעו מחדש את הגלולה בלוח הנוגדן או האיזוטיפ ודגרו בטמפרטורה של 4 מעלות צלזיוס למשך 15 דקות בחושך.
- לאחר הדגירה, יש לדלל ב-1 מ"ל של 1x PBS ולקצור את התאים על ידי צנטריפוגה ב-500 × גרם למשך 5 דקות ב-4 מעלות צלזיוס.
- שאפו את ה-1x PBS והשעו מחדש את גלולת התא ב-200 מיקרוליטר של 1x PBS.
5. איסוף נתוני ציטומטריית זרימה
- היכנס למכשיר ה-FACS.
הערה: אנו מציגים את הפרוטוקול תוך שימוש בציטומטר הזרימה המוזכר (ראה טבלת החומרים). עבור ציטומטרים זרימה אחרים, הקפידו על הוראות היצרן. הגדרת המתח של ציטומטר הזרימה הוגדרה מראש לביצועים מיטביים עם PBMCs אנושיים, ומבטלת את הצורך בהתאמות מתח לפני כל ריצת FACS. - אם המכשיר נמצא במצב רכישה , דלג לשלב 5.3. אם המכונה נמצאת במצב ניתוח נתונים , עבור למצב רכישה על ידי לחיצה על לחצן ההפעלה בפינה השמאלית העליונה. כאשר מוצג חלון קופץ, לחץ על הכפתור שקורא את מצב הרכישה.
- בפינה השמאלית התחתונה, אם המכונה קוראת נדרש כיול, המשך לשלב 5.3.1. אם המכשיר קורא כיול תקין, דלג לשלב 5.4.
- כדי לכייל את המכונה, הוציאו את חרוזי הכיול מהמקרר והמערבולת של 4 מעלות צלזיוס.
- הנח טיפה אחת של חרוזי כיול בצינור תחתון עגול מפוליסטירן בנפח 5 מ"ל והנח את הצינור במחזיק הצינור היחיד.
- לחץ על לחצן הברקוד בפינה השמאלית העליונה וסרוק את בקבוק חרוז הכיול. יופיע חלון קופץ. אם הכל מוגדר, לחץ על כן | בסדר ותן לכיול לפעול.
- אם הכיול הצליח, התנתק והיכנס שוב למצב רכישה . המשך לשלב 5.4.
- לחץ על Open | New workspace בפינה הימנית העליונה.
- בחר מתלה צ'יל 5; בחר שלוש מהבארות. בחר את הבאר הראשונה ותן לה תיאור (למשל, FTX Ab). בחר את הבאר הבאה ותן לה תיאור ייחודי (למשל, FTX Iso). בחר את הבאר האחרונה ותן לה את התיאור אקונומיקה.
הערה: כלול תמיד דגימת אקונומיקה לאחר כל 4-5 דגימות ניסוי כדי להבטיח ניקוי בזמן של דגימות התאים. - בחר את כל הבארות והגדר את תנאי הניסוי באופן הבא: הגדרות מכשירים: PBMCs אנושיים; קצב זרימה: גבוה; מדגם ערבוב: ערבוב עדין; מצב: סטנדרטי; נפח כולל של דגימה 200 מיקרוליטר; ספיגת דגימה 150 מיקרוליטר; הערות: נוגדני קלט ותיוג הפלואורופור שלהם.
- בחר אפשרויות עריכה | ותן לקובץ שם תחת תיאור| החל | אישור.
- מוציאים את המתלה מהמקרר ומניחים אותו על המגש כשהברקוד פונה למכונה. הנח את צינורות הדגימה במדף כדי לשקף את סדר הדגימות על המסך ולחץ על כפתור ההפעלה כדי להתחיל את הניסוי.
- לאחר סיום הניסוי, חבר את ה-USB, בחר קובץ | העתק, הרחב את התיקייה הפרטית, בחר את הניסוי ולחץ על העתק והוצא.
- לאחר איסוף הנתונים, השתמש בתוכנה כדי לנתח את גיליון הנתונים.
- התחל עם בקרת האיזוטיפ. השתמש בכלי המצולע כדי לבחור תאים בתרשים פיזור קדימה (FSC) לעומת פיזור צדדי (SSC).
- שער החוצה תאים מתים על ידי שינוי ציר ה-Y ל-e506 וציר ה-X ל-FSC. השתמש בכלי המצולע כדי לבחור את אוכלוסיית התאים החיים שליליים e506.
- לחץ פעמיים על האוכלוסייה שנבחרה. שנה את ציר ה-Y ל-CD45 אנושי. השתמש בכלי המצולע כדי לבחור את אוכלוסיית התאים. זוהי אוכלוסיית התאים האנושית שלילית CD45.
- לחץ פעמיים על אוכלוסיית התאים השלילית CD45. שנה את ציר Y להיסטוגרמה ואת ציר X ל- EpCAM אנושי. השתמש בכלי בחירת הטווח כדי ללחוץ על סוף ההיסטוגרמה ולבחור את השטח הריק עד סוף התרשים. זה מייצג את האוכלוסייה החיובית ל-EpCAM. חזור על הפעולה עבור כתם CD10 אנושי.
- גרור שער איזוטיפ מתחת לסביבת העבודה של הנוגדנים. תאים חיוביים ל-CD45 יהיו מגודרים החוצה וייבחרו אוכלוסיות חיוביות ל-EpCAM ו-CD10 חיוביות.
- ליצירת היסטוגרמות מייצגות, בחר עורך הפריסה. גרור את ההיסטוגרמות הרצויות לדף הפריסה. כדי להשוות איזוטיפ וצביעה של נוגדנים, שכב את היסטוגרמה של האיזוטיפ עם היסטוגרמה של הנוגדנים. שער התאים החיוביים על סמך בקרת האיזוטיפ.
6. אימונוציטוכימיה
- תאי תרבית לאחר שלב הבידוד הסופי בתא הרצוי מחליקים, עד להתכנסות.
- כדי לתקן את התאים, הוסף 500 מיקרוליטר של פרפורמלדהיד קר 4% (PFA) דגירה בטמפרטורת החדר למשך 10 דקות.
- שאפו את ה-4% PFA ושטפו 3x עם 1x PBS.
- כדי לחדור לתאים, הוסף לפחות 200 מיקרוליטר של 0.25% טריטון-X ב- PBS ודגר בטמפרטורת החדר למשך 10 דקות.
- במהלך החדירה, הכינו את המאגר החוסם (4% סרום עיזים רגיל [NGS] לנוגדנים שאינם מיוצרים בעז).
- שאפו את ה-0.25% Triton-X ושטפו 3x עם 1x PBS.
- הוסף לפחות 200 מיקרוליטר של מאגר חוסם (4% NGS ב-PBS). חוסמים למשך שעה בטמפרטורת החדר.
- הכן דילול נוגדנים ראשוני ב-1% NGS ב-1x PBS בהתאם להמלצות היצרן.
- לאחר החסימה, יש להוסיף לפחות 200 מיקרוליטר מתמיסת הנוגדנים הראשונית. דגירה בטמפרטורת החדר למשך שעתיים.
הערה: חלק מהנוגדנים העיקריים עשויים להעדיף דגירה של 4 מעלות צלזיוס למשך הלילה; בדוק את גיליון הנתונים של נוגדנים. - הכן תמיסות נוגדנים משניות ב-1% NGS ב-1x PBS. עטפו את הצינורות בנייר כסף והכינו תמיסות בחושך מכיוון שהנוגדנים המשניים רגישים לאור. מאחסנים בחושך עד שמוכן.
- לאחר הדגירה הראשונית של הנוגדנים, יש לשטוף 3 פעמים עם PBS 1x.
- הוסף לפחות 200 מיקרוליטר מתמיסת הנוגדנים המשנית. דגירה בחושך בטמפרטורת החדר למשך שעה.
הערה: במהלך השלבים הבאים, נסה להשאיר את השקופית בחושך ככל האפשר. - לאחר דגירה משנית של נוגדנים, יש לשטוף 3 פעמים עם 1x PBS.
- הסר את התאים, פשוט על ידי הסרתם ביד או באמצעות הכלי המצורף למגלשות. עקוב אחר ההוראות המודפסות על אריזת שקופית החדר להסרה.
- הוסף טיפה של סרום הרכבה 4',6-diamidino-2-phenylindole (DAPI) והנח כיסוי בחלק העליון. הגבל את מספר הבועות וודא שכל התאים מכוסים. שלב אופציונלי: השתמש בלק סביב הקצוות כדי לאטום את הכיסוי.
- הנח את השקופית שטוחה בקופסת שקופיות לייבוש והניח בטמפרטורה של 4 מעלות צלזיוס עד להדמיה.
- תמונה במיקרוסקופ המצויד בפלואורסצנטיות נכונה המבוססת על צימוד נוגדנים משני כדי להבטיח תמונה נקייה.
תוצאות
כללנו שבעה אוספים של חצוצרות שבהם בודדנו אוכלוסיית תאי אפיתל מועשרת (איור 2A ואיור משלים S1A). כדי להעריך את הכדאיות והעשרת תאי האפיתל של שיטת השעיה חד-תאית זו, בוצעה ציטומטריית זרימה. כדי למדוד את כדאיות התא, התאים נצבעו בסמן הכדאיות, e506. זה גם איפשר להוציא את כל הפסולת והתאים המתים בעת הניתוח.
כדי לקבוע את הרכב התאים שבודדו בשיטה זו, הדגימות נצבעו בסמן תאי אפיתל (EpCAM), סמן תאי סטרומה (CD10) וסמן תאי חיסון (CD45). כפי שניתן לראות באיור 2B, בודדנו אוכלוסיית תאי אפיתל בת קיימא ומועשרת מרקמת החצוצרה. כדאיות המדגם הייתה בממוצע של 82%. עבור כל הדגימות, לאחר הוצאת תאים חיוביים ל-CD45, ראינו אוכלוסיית תאי אפיתל מועשרת עם תאים חיוביים ל-EpCAM בממוצע 80% מהדגימה. היה זיהום מסוים בתאי סטרומה אך רק 7.8% בממוצע. איור 2C מציג תאים מבודדים בדו-ממד 4-6 ימים לאחר הציפוי. ניכר שתאי אפיתל בודדו כאשר הם יצרו אשכולות עקביים דבוקים למראה. באיור משלים S1B, התאים צופו לאחר בידוד ותרבו במשך 2-6 ימים. אימונוציטוכימיה שימשה לאפיון התאים הגדלים בתרבית. רוב התאים בתרבית נצבעו כחיוביים ל-EpCAM ולסמן התאים המפרישים, PAX8. רק תאים בודדים זוהו כחיוביים לווימנטין. תאים ריסניים נראו בתרבית כפי שצולמו בווידאו, המוצג בסרטון משלים S1.
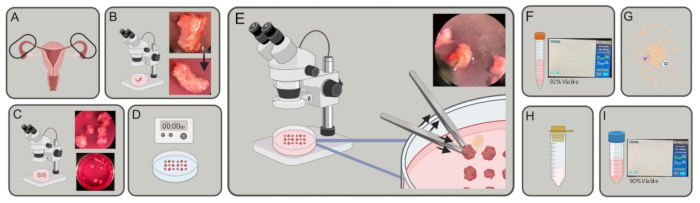
איור 1: סכימה ניסויית. (A) חצוצרות נרכשות. (B) עודפי שומן ורקמות חיבור מוסרים. (C) צינורות נחתכים לחתיכות של ~3-5 מילימטרים. (D) החתיכות נשטפות ב-PBS, ואז מודגרות ב-EDTA פעמיים למשך 5 דקות, ומודגרות ב-1% טריפסין למשך 40 דקות ב-4 מעלות צלזיוס. (E) שימוש בשני זוגות מלקחיים, אחד לאחיזה ואחד לדחיפה, מוציאים תאי אפיתל מחלקי החצוצרה. (F) העבירו את התאים לצינור של 15 מ"ל, סובבו וספרו. (ז) השעיה מחדש ב-DMEM, קולגנאז ו-DNase. לעכל במשך 30-45 דקות. (H) מסננים עם מסננת של 100 מיקרומטר. (I) קציר על ידי צנטריפוגה וספירה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
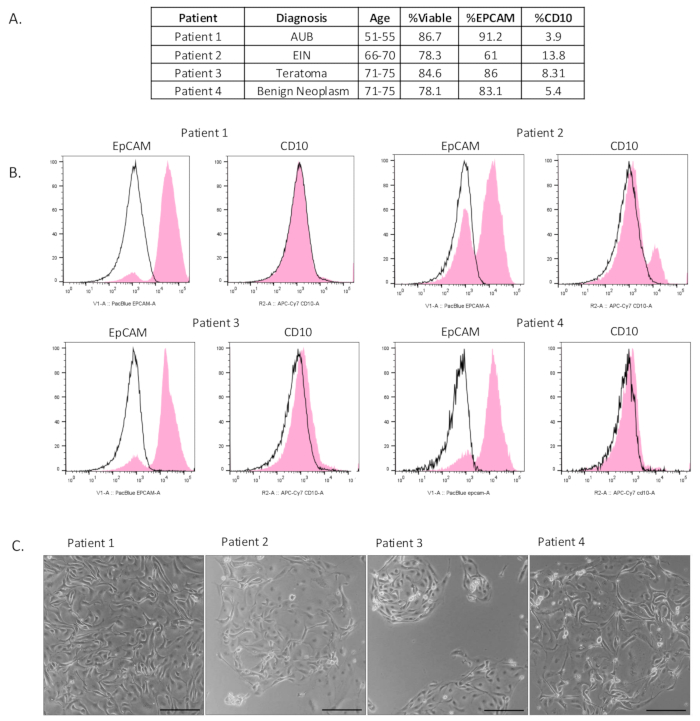
איור 2: אפיון של תאי אפיתל מבודדים. (A) טבלת המידע הקליני של המטופל ותוצאות ציטומטריית זרימה. (B) זרימה ציטומטרית בוצעה לאחר בידוד כדי להראות שאוכלוסייה מועשרת של תאי אפיתל (חיוביים ל-EpCAM) בודדה. בקרה שלילית של איזוטיפ מסומנת בשחור, ותוצאת הניסוי מסומנת בוורוד. (C) התאים צופו לאחר בידוד. התמונות צולמו 4-6 ימים לאחר הציפוי. פסי קנה מידה = 100 מיקרומטר. קיצורים: AUB = דימום רחמי חריג; EIN = ניאופלזיה תוך-אפיתליאלית של רירית הרחם. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
איור משלים S1: אפיון נוסף של תאי אפיתל מבודדים בתרבית. (א) טבלת המידע הקליני של המטופל. (B) תאים מבודדים עברו תרבית ונצבעו עבור EpCAM, סמן תא הפרשה (PAX8), וסמן תאי סטרומה (וימנטין) 2-6 ימים לאחר הציפוי כדי לאפיין את סוג התא בתרבית. פסי קנה מידה = 50 מיקרומטר. קיצורים: EIN: ניאופלזיה תוך-אפיתליאלית של רירית הרחם; DAPI = 4',6-דיאמידינו-2-פנילינדול. אנא לחץ כאן כדי להוריד איור זה.
סרטון משלים S1: סרטון של תאים ריסניים פועמים צולם בהגדלה של פי 30 כדי להדגים תאים ריסניים בתרבית. אנא לחץ כאן להורדת סרטון זה.
Discussion
יש עניין רב בחקר אפיתל החצוצרות שכן חצוצרות ממלאות תפקיד משמעותי ברבייה והן אתר המוצא של רוב HGSOC. לשם כך, חוקרים רבים תיארו פרוטוקולים לבידוד תאי חצוצרות במודלים אנושיים ועכברים כאחד 10,11,12,15,16,17,18,19,20,21. השיטה שאנו מתארים למיצוי והעשרה של תאי אפיתל חצוצרות מוסיפה לפרוטוקולי בידוד תאי החצוצרות הקיימים. למרות שקיימות חפיפות בתוך פרוטוקולים אלה, ישנם שני סוגים כלליים של שיטות המדווחות בעכברים ובבני אדם. הראשון כולל טחינה ועיכול אנזימטי של כל החצוצרה שנותנת תרחיף תאים כולל 10,12,15,16,17. השני כרוך בהחלקה עם תסיסה או גירוד, מה שמביא ליריעות רקמה 11,18,19,20,21. שתי השיטות מאפשרות לנתח תאי אפיתל באמצעות ניסויים במורד הזרם כגון ציטומטריית זרימה, ריצוף ותרבית במבחנה. יתרון מרכזי של השיטה שלנו הוא שהפרוטוקול מניב אוכלוסייה של תאי חצוצרות שכבר מועשרים לתאי אפיתל באמצעות עיכול אנזימטי ושלבי דחיפה מכניים. אוכלוסייה זו המועשרת לאפיתל ניתנת לעיכול נוסף וכתוצאה מכך מתלה תא בודד שיכול לשמש ליישומים רבים כגון ציטומטריית זרימה, תרבית דו-ממדית, אימונוציטוכימיה וריצוף RNA של תא בודד.
הצעדים העיקריים שמצאנו כדי להשפיע על תפוקת התאים כוללים את משך הזמן שבו שברי החצוצרות דוגרים ב-1% טריפסין/HBSS ו-DMEM/DNase. דגירה יתר בכל אחת מהתמיסות תפרק את התאים ותפחית משמעותית את כדאיות התאים. עם זאת, זמן דגירה לא מספיק יעכב את יכולתו של החוקר לדחוף החוצה תאי אפיתל רבים במהלך שלב פרוטוקול 2.6 מכיוון שהם ימשיכו להיצמד זה לזה. חשוב גם להשתמש בתמיסת טריפסין של 1%, שכן ריכוזים נמוכים וגבוהים יותר של תמיסות טריפסין הפחיתו את התפוקה של תאי אפיתל חצוצרות ברי קיימא. על ידי שילוב של בידוד כימי ומכני ושלב עיכול (שלב פרוטוקול 3.1), אנו יכולים לקצר באופן אקספוננציאלי את הזמן שלוקח לעבור מרקמה לתרחיף של תא בודד. זה מבטיח כדאיות טובה וזמן לביצוע ניתוח במורד הזרם באותו יום.
בשלב פרוטוקול 1.4, קריטי לוודא שחתיכות החצוצרה חתוכות בעובי 3-5 מ"מ. אם החלקים גדולים מדי, יהיה קשה לבצע את שלב פרוטוקול 2.7 ובסופו של דבר להפחית את תפוקת התאים מכיוון שיהיה צורך בזמן דגירה ארוך יותר ב-DMEM/DNase.
למרות שתרחיף התאים מועשר לתאי אפיתל, זיהום תאי סטרומה הוא בלתי נמנע. אם התכשיר צריך להיות תאי אפיתל בלבד, ניתן לבצע מיון באמצעות ציטומטריית זרימה והסמנים שתיארנו כדי לבודד תאי אפיתל ולרוקן תאי סטרומל.
במחקר זה נעשה שימוש בחצוצרות לאחר גיל המעבר. עם זאת, שיטה זו שימשה בהצלחה במעבדה שלנו על חצוצרות לפני גיל המעבר. ההבדל העיקרי בין חצוצרות לפני ואחרי גיל המעבר הוא הרכב תאי האפיתל הריסיים והמפרישים1. פרוטוקול זה עובד עבור כל שלבי הרבייה.
פרוטוקול יעיל זה יקל על חקירת סוגי התאים של אפיתל החצוצרות, כולל תיחום שושלות תאיות, השינויים הדינמיים שלהם במהלך מחזורי הרבייה כמו גם לאחר גיל המעבר, ותפקידם בהתחלת סרטן שחלות סרוסי בדרגה גבוהה.
Disclosures
למחברים אין ניגודי אינטרסים להצהיר עליהם.
Acknowledgements
המחברים Ruegg L, James-Allan LB ו-DiBernardo G נתמכים באופן חלקי על ידי הפרויקטים של איגוד הוותיקים של לוס אנג'לס רבתי 1I01BX006019-01A2 ו-I01BX006411-01 ל-Memarzadeh S. המחבר אוצ'ואה סי נתמך על ידי UCLA Eli ו-Edythe Broad Center of Regenerative Medicine and Stem Cell Research Rose Hills Foundation Rose Hills Scholarship Training Program. אנו רוצים להודות למעבדת הליבה לפתולוגיה תרגומית ב-UCLA ובמיוחד לקו קיהלה וקלואי יין על הסיוע ברכישת רקמות. אנו רוצים גם להודות לקן ימאוצ'י וליבת המיקרוסקופיה של BSCRC על עזרתם בהדמיה. איור 1 נוצר עם BioRender.com (מספר הסכם JL27QWDYNT). לבסוף, ברצוננו להודות לפלישיה קורדאה וליבת ציטומטריית הזרימה BSCRC על הסיוע בזרימה ציטומטרית.
Materials
| Name | Company | Catalog Number | Comments |
| 1% Trypsin | Thermo Scientific | J63993.09 | |
| 100 µm Cell Strainer | Corning | 431752 | |
| 4% Paraformaldehyde | Electron Microscopy Sciences | 15710-S | |
| 5 mL round bottom tubes | Corning | 352008 | |
| 60 mm cell culture plate | Corning | CLS430589-500EA | |
| 6-well Cell Culture Plate | Corning | 353046 | |
| Anti-CD10 | BioLegend | 312212 | |
| Anti-CD326 (Ep-CAM) | BioLegend | 324218 | |
| Anti-CD45 | BioLegend | 304026 | |
| Anti-EpCAM | Abcam | ab223582 | |
| Anti-IgG2a PerCP | BioLegend | 400250 | |
| Anti-PAX8 | Sigma-Aldrich | 363M-15 | |
| Anti-Vimentin | Agilent Technologies | M072501-2 | |
| Chamber Slide System | Thermo Scientific | 154917PK | |
| Collagenase | Thermo Scientific | 17100017 | |
| DMEM | Thermo Scientific | 10569-010 | |
| DNase I | Sigma | 10104159001 | |
| EDTA | Sigma | 3690 | |
| eFluor 506 | Invitrogen | 65-0866-14 | |
| FBS | Sigma | F2442 | |
| Fine point forceps | VWR | 102091-526 | Any finepoint forceps of your choice will work |
| Fixable Viability Dye eFluor 506 | Invitrogen | 65-0866-14 | |
| FlowJo software version 9 | BD Biosciences | Data analysis software | |
| GlutaMAX | Gibco | 35050-061 | |
| HBSS | Thermo Scientific | 14175-095 | |
| MACSQuant Analyzer 10 flow cytometer | Miltenyi Biotec | ||
| MACSQuant Calibration Beads | Miltenyi Biotec | 130-093-607 | |
| Mammocult | Stemcell Technologies | 5620 | |
| Normal Goat Serum | Fisher Scientific | PI31873 | |
| PBS | Thermo Scientific | 14190-144 | |
| Penicillin-Streptomyocin | Gibco | 15140-122 | |
| PerCP Conjugated CD45 | BioLegend | 304026 | |
| Red Blood Cell lysis buffer | Tonbo Biosciences | TNB-4300-L100 | |
| Triton X-100 | Thermo Scientific | BP151-100 | |
| Vannas-Tubingen Spring Scissors | Fine Science Tools | 15003-08 | |
| VECTASHIELD with DAPI | Fisher Scientific | NC9524612 |
References
- Crow, J., Amso, N. N., Lewin, J., Shaw, R. W. Morphology and ultrastructure of fallopian tube epithelium at different stages of the menstrual cycle and menopause. Hum Reprod. 9 (12), 2224-2233 (1994).
- Patek, E., Nilsson, L., Johannisson, E. Scanning electron microscopic study of the human fallopian tube. Report II. Fetal life, reproductive life, and postmenopause. Fert Steril. 23 (10), 719-733 (1972).
- Coan, M., et al. Exploring the role of fallopian ciliated cells in the pathogenesis of high-grade serous ovarian cancer. Int J Mol Sci. 19 (9), 2512(2018).
- Leese, H., Tay, J., Reischl, J., Downing, S. Formation of fallopian tubal fluid: role of a neglected epithelium. Reproduction. 121 (3), 339-346 (2001).
- Donnez, J., Casanas-Roux, F., Ferin, J., Thomas, K. Changes in ciliation and cell height in human tubal epithelium in the fertile and post-fertile years. Maturitas. 5 (1), 39-45 (1983).
- Lengyel, E., et al. A molecular atlas of the human postmenopausal fallopian tube and ovary from single-cell RNA and ATAC sequencing. Cell Rep. 41 (12), 111838-111838 (2022).
- Tao, T., et al. Loss of tubal ciliated cells as a risk for "ovarian" or pelvic serous carcinoma. Am J Cancer Res. 10 (11), 3815(2020).
- Li, J., Fadare, O., Xiang, L., Kong, B., Zheng, W. Ovarian serous carcinoma: recent concepts on its origin and carcinogenesis. J Hematol Oncol. 5 (1), 8(2012).
- Hu, Z., et al. The repertoire of serous ovarian cancer non-genetic heterogeneity revealed by single-cell sequencing of normal fallopian tube epithelial cells. Cancer Cell. 37 (2), 226-242.e7 (2020).
- Dinh, H. Q., et al. Single-cell transcriptomics identifies gene expression networks driving differentiation and tumorigenesis in the human fallopian tube. Cell Rep. 35 (2), 108978(2021).
- Ulrich, N., et al. Cellular heterogeneity of human fallopian tubes in normal and hydrosalpinx disease states identified using scRNA-seq. Dev Cell. 57 (7), 914-929.e7 (2022).
- Brand, J., et al. Fallopian tube single cell analysis reveals myeloid cell alterations in high-grade serous ovarian cancer. iScience. 27 (3), 108990-108990 (2024).
- Memarzadeh, S., et al. Cell-autonomous activation of the PI3-kinase pathway initiates endometrial cancer from adult uterine epithelium. Proc Natl Acad Sci USA. 107 (40), 17298-17303 (2010).
- Cunha, G. R. Stromal induction and specification of morphogenesis and cytodifferentiation of the epithelia of the mullerian ducts and urogenital sinus during development of the uterus and vagina in mice. J Exp Zool. 196 (3), 361-369 (1976).
- Xie, Y., Park, E. -S., Xiang, D., Li, Z. Long-term organoid culture reveals enrichment of organoid-forming epithelial cells in the fimbrial portion of mouse fallopian tube. Stem Cell Res. 32 (1873-5061), 51-60 (2018).
- Karst, A. M., Drapkin, R. Primary culture and immortalization of human fallopian tube secretory epithelial cells. Nat Protoc. 7 (9), 1755-1764 (2012).
- Ford, M. J., Harwalkar, K., Yamanaka, Y. Protocol to generate mouse oviduct epithelial organoids for viral transduction and whole-mount 3D imaging. STAR Protocols. 3 (1), 101164(2022).
- Radecki, K. C., Lorenson, M. Y., Carter, D. G., Walker, A. M. Microdissection and dissociation of the murine oviduct: Individual segment identification and single cell isolation. J Vis Exp. (177), e63168(2021).
- Feng, L., et al. Protocol for the detection of organoid-initiating cell activity in patient-derived single fallopian tube epithelial cells. Methods Mol Bio. 2429, 445-454 (2022).
- Kessler, M., et al. The Notch and Wnt pathways regulate stemness and differentiation in human fallopian tube organoids. Nat Commun. 6 (1), 8989(2015).
- Fotheringham, S., Levanon, K., Drapkin, R. Ex vivo culture of primary human fallopian tube epithelial cells. J Vis Exp. (51), e2728(2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved