Method Article
体内研究成年果蝇味觉诱导神经反应的钙成像
摘要
钙成像方法可以记录清醒的果蝇大脑中味觉诱导的反应,同时将溶液应用于标签。以果 蝇黑腹果蝇 中的初级味觉反应为例,但该方案可以适用于研究下游神经元或其他物种。
摘要
近二十年来, 体内 钙成像一直是测量果蝇模式生物黑 腹果蝇中细胞对味觉刺激反应的有效方法。这种方法的一个关键优势是它能够在不需要麻醉的情况下记录清醒动物的味觉诱导的神经反应。这种方法采用二元表达系统(例如 Gal4-UAS)在感兴趣的特定神经元中表达钙指示剂 GCaMP。该协议描述了一个程序,其中表达 GCaMP 的果蝇被安装,标签被安全定位,能够在共聚焦显微镜下以毫秒级分辨率记录大脑中的荧光,同时将溶液应用于标签,刺激所有标签味觉敏感器。提供的示例侧重于 黑腹果蝇原代味觉受体神经元中的钙反应。然而,这种方法可以适应于记录果 蝇 或其他昆虫物种大脑内其他感兴趣的神经元。这种成像方法使研究人员能够同时记录来自标签上味觉神经元组的集体钙反应,补充了量化单个神经元动作电位的电生理学尖端记录。此处概述的 体内 钙成像技术有助于揭示化学感觉的分子和细胞机制、识别初级味觉神经元中的独特时间反应模式、研究味觉调节机制以及探索下游回路中的味觉加工。
引言
果蝇 (Drosophila melanogaster) 以其模式生物中强大的遗传研究工具而闻名。这些工具提供了轻松作目标细胞中特定基因的能力,使其成为探索基本神经回路(如视觉和化学感觉)的理想选择 1,2,3。味觉通过接触化学感觉,是调节进食、交配、繁殖以及最终动物生存和健康行为的关键神经通路 4,5,6,7,8,9。了解这些重要的化学感应信息是如何编码和传递的,需要描述由味觉刺激激活的回路中神经元的活动。
在 D. melanogaster 中,外部味觉受体神经元 (GRN) 位于前腿、喙和翅膀上10,11。喙末端的标签包含称为感器的毛发状结构,可以根据其大小通过它们的形态进行映射:长(L 型)、中间(I 型)和短(S 型)10。大多数 GRN 集中在这个感觉器官上,每个感器包含 2-4 种不同类型的 GRN,因此每种味觉模式都分布在标签12、13、14、15 上。虽然电生理学尖端记录可用于量化来自单个感器中 GRN 的动作电位16,但在体内,钙成像可用于隔离特定类型 GRN 在整个标签中的活性14,17。这种相同的钙成像技术也可用于研究下游味觉回路中的神经反应 18,19,20。钙成像需要二元表达系统,例如 Gal4-UAS 21,22,23,并将包含细胞特异性转录激活因子的驱动线穿过效应线,以在感兴趣的神经元中表达 GCaMP。当细胞内钙水平升高时,这些基因编码的钙指示剂的荧光强度增加,因此荧光水平与神经元活动的变化相关24,25。
在这里,描述了一种使用钙成像观察体内神经对味觉刺激的反应的方法。该方法的总体目标是仅刺激标记 GRN 以量化清醒果蝇大脑中味觉诱导的神经反应。提供了使用这种方法记录黑腹果蝇标签初级 GRN 响应的示例,并讨论了使用这种方法的好处和挑战。开发这种制剂是为了让实验者能够在共聚焦显微镜下将品尝溶液涂抹到固定的果蝇标签上,以记录整个感觉器官浸入溶液中的神经反应,这在自然环境中发生。此处描述的体内钙成像方法可用于揭示新的味觉-受体相互作用 8,14,26,27,GRN 反应的时间细节 27,28,GRN 调节的分子机制29,30,以及下游回路中的味觉加工 8,18,19,20,28,31.
研究方案
本研究中使用的试剂和设备的详细信息列在 材料表中。
1. 成人血淋巴样 (AHL) 溶液的制备
- 制备含有 108 mM NaCl、5 mM KCl、4 mM NaHCO3、1 mM NaH2PO4、5 mM HEPES 和 15 mM 核糖的储备溶液。
注意:核糖用作非能量糖,以维持渗透压,而不会改变大脑中的营养水平。 - 在过滤并储存在 4 °C 之前,将该溶液的 pH 值调节至 7.5。 调整 pH 值后检查 AHL 的渗透压,以确保不同制备之间的一致性。
- 分别制备 1 M CaCl2 和 1 M MgCl2 储备液,过滤并在室温下储存。
- 为了制备主要 AHL 原液的等分试样,加入少量钙和镁,得到 2 mM 钙和 8.2 mM 镁的最终浓度。该 AHL 可在 4 °C 下储存并使用长达一个月,使用小等分试样至室温进行实验。
2. 在成像室上安装苍蝇
- 在安装苍蝇之前,使用磨刀石将牙科打蜡机的尖端磨成一个小而尖的杯子(图 1D)。将削尖的尖端连接到打蜡机上并打开它进行预热。加热设置将取决于尖端的类型和长度:需要允许蜡在接触时保持熔化的最低温度(在本例中为 50.5 °C)。
注意:可以在牙科打蜡机的末端缠绕一根金属丝,以固定锋利的金属尖端作为替代方案。 - 轻轻麻醉 1-5 只果蝇(遵循机构批准的方案)。尽量减少麻醉暴露时间,因为长时间暴露于 CO2 或寒冷会影响行为。对于 CO2,使用飞垫,在解剖显微镜下以 5 L/min 的速率提供 99.9% CO2 的连续、均匀流动。
- 使用解剖剪刀剪掉股骨/胫骨关节的中腿和后腿以及转子处的前腿,以去除部分腿部。使用钝镊子帮助纵苍蝇。修剪跗节可以防止睑板感觉和盖玻片或味觉刺激器的踢动。
- 使用钝镊子通过翅膀捡起苍蝇,以定位苍蝇,使头部位于成像室的目标子宫颈槽上方,但身体位于下方。完全向右或向左开始飞行是有帮助的。使用剪刀和钝镊子的钝面,轻轻地将头部和胸部同时推入槽中。
- 一旦牢固地进入插槽,将门襟推到插槽的背面,然后轻轻地重新定位,使门襟面向腔室的前部。避免将头部旋转得与胸部不对齐太远。
- 根据需要对任意数量的苍蝇重复此作(此成像室最多可安装 5 只苍蝇)。
- 在牙签的末端收集一小滴指甲油,然后涂上一层薄薄的涂层,将果蝇的头部固定到成像室。
注意:涂抹指甲油的确切区域取决于正在成像的大脑部分。如果对 SEZ(如图所示)或其他下内侧区域进行成像,可以将指甲油大量涂抹在苍蝇头的顶部,但要对上内侧区域进行成像,可以将指甲油最低限度地涂抹在头顶,并在眼睛附近横向添加,以使该区域清晰以便解剖。该协议仅针对味觉刺激进行了优化,无需嗅觉,但如果担心指甲油挥发物,请使用蜡或 UV 胶作为固定苍蝇头的替代方法。
3. 将长鼻打蜡,使其伸展
- 用一只手拿起打蜡机,在尖端沾上一小滴蜡。
- 另一方面,使用半锋利的镊子抓住一个上颌触诊,轻轻拉出并保持喙完全伸展。
注意:小心只抓住上颌触诊,因为捏住喙上的角质层会增加损伤的可能性。如果长鼻被挤压或长鼻角质层被刺破,请勿继续。可以使用小型苍蝇粪便作为镊子的替代品,在涂蜡时使用吸力拉出长鼻。 - 将打蜡机的尖端接触喙底部附近的腔室,直到蜡开始流动,然后移动以接触喙的底部。在轴的一半处打蜡,但避免用蜡或打蜡机接触贴标敏感器。这侧的蜡会将长鼻固定到位。如果感器在任何时候都被蜡或打蜡机接触,请不要继续。
- 使用上述方法对另一侧涂抹蜡,在喙上形成连续的蜡桥。
- 尽可能伸直喙。如果需要,可以通过重新加热耳蜡并轻轻地将长鼻推到所需位置来移动长鼻。
- 对要安装在同一腔室中的其他果蝇重复此作。
- 关闭 CO2 或从冰麻醉中清除苍蝇。将已安装的苍蝇放入湿度室中 60 分钟以恢复(干净、空的移液器吸头盒和湿的无绒湿巾)。
4. 解剖以揭示感兴趣的大脑区域
- 从湿度室中取出苍蝇。苍蝇必须明显是活着的,积极移动它们的腹部、腿和触角。解剖前设置共聚焦或双光子显微镜。
- 打开打蜡机以修复解剖过程中蜡中的潜在断裂,并准备室温 AHL。
- 使用非常锋利的镊子,捏掉两个触角,然后捏住角质层,提供一个孔,用于插入锋利镊子的一侧。在角质层下方运行镊子,将其从覆盖感兴趣大脑区域的区域中取出。 图 1F 表示角质层区域上有一个 X,以便用镊子去除。
- 将 AHL (~100 μL) 大量涂抹在头部,然后去除除薄层 AHL 以外的所有 AHL 以防止大脑干燥,从而在 AHL 中清洗暴露的大脑。
注意:如果耳垢在任何位置破裂并需要修复,请在重新加热耳垢之前短暂去除头部周围的所有 AHL 以将喙重新固定在伸展位置。 - 使用锋利的镊子去除气囊和覆盖大脑的任何大碎屑。通过保持镊子尖端可见来避免穿透大脑。
- 用 AHL 洗涤 ~3 次以去除所有小碎屑。
- 确保感兴趣的大脑区域清晰可见。为了像本例中那样对食管下区 (SEZ) 进行具体成像,用非常锋利的镊子捏住喙附近和穿过大脑的点附近的基部切开食道,然后取出这块以露出 SEZ。
注意:食管切除后,果蝇无法摄入溶液,并且不会发生咽部 GRN 激活。 - 在解剖显微镜下,将 10 mm x 20 mm 盖玻片放入成像室的斜槽中。确保它位于喙的底部而不会破坏耳垢。标签的尖端不得接触盖玻片。
5. 成像和味觉刺激
- 打开共聚焦或双光子显微镜,准备好进行图像捕获。设置一个带有毛细管的显微作器,该毛细管位于显微镜载物台上时将品尝剂输送到飞行中。
注意:双光子成像可以捕获来自脑组织更深处神经元的荧光。 - 将 ~2 μL 水(或其他阴性对照)上样到
显微镜载物台上的刺激器。 - 找到被解剖的苍蝇,并使用 10 倍空气浸入明场聚焦在标签上。在此视图下将毛细管与 labellum 对齐。可以包括指向果蝇标签的其他摄像头,以便从多个角度查看毛细管与果蝇的对齐情况。
注意:确保在对齐过程中用溶液刺激所有标记敏感器;如果刺激器或 Labellum 的位置不够垂直,请进行相应调整。可以用磨刀石拉动毛细管并向下锉削,以更紧密地贴合标签。 - 将毛细管直接放置在贴标机的正前方,靠近但不要接触。
- 移动载物台,使感兴趣的大脑区域居中,然后切换到更高放大倍率的水浸物镜(本例中使用 40 倍)。
- 在大脑顶部添加大约 200 μL 的 AHL,使其与物镜接触进行浸没。去除所有气泡。
- 使用明场定位焦点,在 z 平面中小心移动,找到被去除的角质层边缘,并将感兴趣的大脑区域居中。
- 切换到 488 nm 激光功率以查找感兴趣区域中的 GCaMP 表达。
注意:根据驱动程序线路和使用的 GCaMP 版本,可能需要进行一些初始优化,以放大单个制备的信噪比。共表达 RFP 对基线 GCaMP 荧光低的神经元有帮助。 - 准备延时摄影图像集。速度取决于特定的显微镜和 GCaMP 信号,但每 ~100 ms 至少捕获一张图像是最佳选择。
注:随时间捕获单个 Z 平面的荧光将优化捕获速度,以提供详细的钙动力学。在每个时间点在多个 Z 平面上拍摄的图像堆栈可能会减慢捕获速率,但会记录组织中不同深度的神经突之间的反应。 - 收集至少 5 秒的基线荧光后,手动移动刺激器,使毛细管覆盖标记物特定时间(在本例中为 5 秒),然后移除刺激物并根据需要捕获。
- 移除 AHL 并返回 10 倍明场,以确保盖玻片、刺激器和标签仍处于相同位置。
注意:如果刺激器没有与标签很好地对齐或旋转得太远,标签可能会移动,或者毛细管会撞击成像室,可能会破坏蜡并造成 AHL 泄漏。 - 拆下成像室。使用无绒湿巾去除第一种溶液,然后用水冲洗移液器。然后,将 ~2 μL 的下一个试饮液移液到毛细管中。
- 将成像室移回载物台,并针对此解决方案重复步骤 5.4-5.12。
注意:大多数品尝剂的高表面张力会导致残留的化学物质留在飞行标签上。然而,如果味觉剂是高度饱和或粘稠的,则可以在标签上移动水数次,以便在下一次刺激之前清洗感觉器官。 - 对这个苍蝇所需的多个解决方案重复此作。
- 返回步骤 3 以准备下一个苍蝇进行成像。
6. 图像分析
- 在图像处理软件中打开要分析的图像堆栈。如有必要,使用 GCaMP 信号之外的区域执行背景减法。
- 使用手绘或形状工具在要量化的投影周围选择一个紧密的感兴趣区域 (ROI),并确保将选区应用于堆栈中的所有图像。
- 为此 ROI 生成随时间变化的荧光读数列表,并将其导出到电子表格中以供进一步处理。在 ImageJ (FIJI) 中使用 z 轴轮廓 或所选图像处理软件中的类似功能。
- 在电子表格中,在步骤 5.10 的基线记录期间选择 10 个连续的时间点作为代表性基线。计算均值和标准差。
- 要获得 ΔF/F 的百分比,请计算每个时间点的 ((F - 平均基线 F)/基线平均值 F)*100)。要获得 ΔF/F 作为 z 分数,请计算每个时间点的 ((F - 平均基线 F)/标准差基线 F)。
- 要计算刺激过程中荧光的峰值变化,请选择 3 个具有最高荧光的连续点并计算平均值。
- 对刺激物和苍蝇的每个图像堆栈重复作。
注意:根据特定的显微镜、信号质量和首选的图像分析软件,根据需要调整这些步骤。
结果
图 1 提供了该制备中使用的成像室(图 1A、B)和打蜡器尖端(图 1D)的详细信息。 图 1 还说明了安装果蝇(图 1C)、将喙打蜡就位(图 1E)、解剖感兴趣的大脑区域(图 1F)和用味觉刺激标签,同时在大脑中记录荧光(图 1G)的程序的主要步骤。为了量化黑 腹果蝇 初级味觉受体神经元 (GRN) 的味觉诱导反应,用 Gr64f-Gal4 驱动 UAS-GCaMP6f 的表达,以获得钙指示剂在标签14、27、30、32、33、34、35 的所有糖感应“甜”GRN 中遗传表达.对于这些实验,使用了具有以下组件的共聚焦显微镜:带有 40 fps sCMOS 相机、10 倍和 40 倍物镜、转盘共聚焦、二向色 488 发射器和 488 nm 固态激光器的正置荧光显微镜。将 40 倍物镜浸入 AHL 中并以 SEZ 大脑区域为中心,以在这些标记 GRN 的轴突末端定位基线 GCaMP 信号(图 2A)。在基线期间(无刺激)、味觉刺激 5 秒期间(刺激器在标签上移动)以及刺激后直到荧光恢复到基线(图 2A、B),每 100 毫秒捕获一次荧光图像。水作为阴性对照,1 M 蔗糖作为阳性对照。荧光的相对变化计算为 13 只果蝇的 ΔF/F(z 分数),并随时间绘制以显示味觉刺激期间钙反应的动力学(图 2B)。绘制峰值 ΔF/F (z 分数) 并用于统计比较,以表明这些细胞中的蔗糖反应显着高于水中(图 2C)。该技术捕获到“甜”GRN 在蔗糖开始时具有很强的峰值,该峰值在刺激期间保持较高水平并有一些衰减。
为了进行比较,该方案在具有不同驱动程序 Gr66a-Gal4 的果蝇中重复,在标记14、17、28、34、36 上的所有“苦”GRN 中特异性表达 UAS-GCaMP6f。同样,这些 GRN 的轴突末端位于 SEZ 中:请注意,投影模式与糖感应 GRN 不同(图 2D)。像以前一样捕获和分析荧光,除了 100 mM 咖啡因用作阳性对照。从 11 只果蝇中平均得出的曲线显示,随着咖啡因刺激的开始,有一个很强的峰值,但已知某些苦刺激会发生刺激去除时出现的小的 “关闭 ”反应28(图 2E)。这种方法允许量化 “on” 和 “off” 反应,以表征味觉诱导反应的时间模式27,28。在这里,仅量化了“on”峰,以表明对咖啡因的反应明显强于水(图 2F)。图 2 中的实验具有高度可重复性,可用于确保方案正常工作。
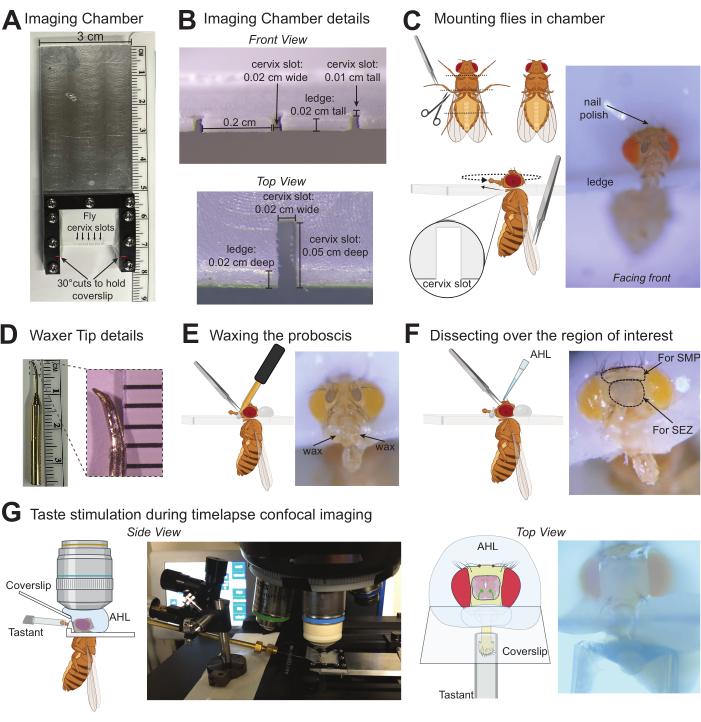
图 1:果 蝇 大脑中味觉诱导反应成像的协议图示。 (A) 用于一次安装多达五只苍蝇的定制成像室的俯视图。(B) 安装果蝇的成像室的详细信息,其测量值舒适地适合 黑腹果蝇的子宫颈。(C) 指示修剪跗节的位置(左上)以及如何使用镊子将跗节安装到成像室的子宫颈槽中的图形(左下)。安装在成像室中正确位置上的果蝇的照片(右)。(D) 打蜡机尖端的照片(左),打蜡机尖端的放大照片,以指示使用磨刀石修改标准尖端时要瞄准的大致形状和大小(右)。(E) 使用镊子将喙打蜡就位的图形说明(左),用适当打蜡的标签安装的果蝇的照片(右)。(F) 图形插图,代表感兴趣大脑区域的解剖和 AHL 的应用(左),当靶向 SEZ 或 SMP 大脑区域时,角质层区域周围有虚线圆圈的苍蝇照片。X 表示要捏住以进行解剖的角质层区域(右)。(G) 图形和照片表明了安装/解剖的苍蝇的位置、AHL 中的水浸物镜、在长鼻上带有品尝剂的刺激器以及在这些溶液之间形成屏障的盖玻片。侧视图缩小(左),顶视图位于 10 倍物镜下方(右)。 请单击此处查看此图的较大版本。
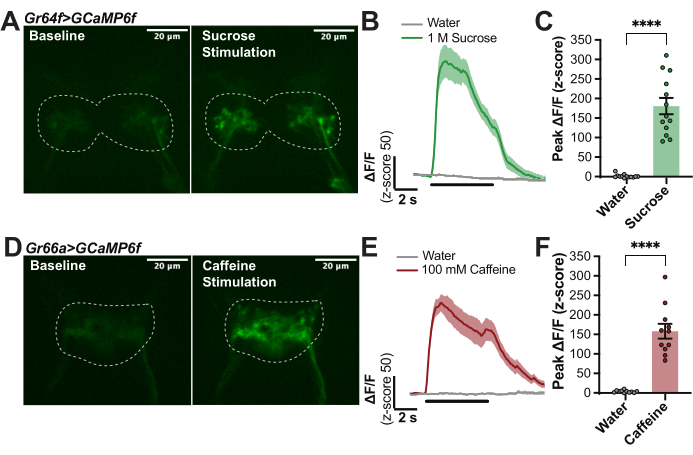
图 2:标记 GRN 对味觉刺激的钙反应示例。 (A) 从图像堆栈中捕获的静止图像,表明在基线和对 1 M 蔗糖的峰值响应期间,使用 Gr64f>GCaMP6f 的果蝇的 GCaMP 荧光水平,比例尺 = 20 μm。虚线表示用于分析的 ROI。(B) n = 14 只果蝇的钙反应曲线计算为 ΔF/F(z 分数),并结合水(阴性对照)和 1 M 蔗糖(阳性对照)以显示动力学;曲线下的黑线表示刺激何时超过 labellum。(C) 绘制的每只果蝇的峰值 ΔF/F(z 分数)用于统计比较。配对 t 检验,****p < 0.0001。(D) 从视频中捕获的静止图像,该视频显示了在基线和对 100 mM 咖啡因(比例尺 = 20 μm)的峰值响应期间, Gr66a>GCaMP6f 果蝇的 GCaMP 荧光水平。虚线表示用于分析的 ROI。(E) n = 11 只果蝇的钙响应曲线计算为 ΔF/F(z 分数),并结合水(阴性对照)和 100 mM 咖啡因(阳性对照)以显示动力学:注意小的“关闭”响应,曲线下的黑线表示刺激何时超过标签。(F) 绘制的每只果蝇的峰值 ΔF/F(z 分数)用于统计比较。配对 t 检验,****p < 0.0001。 请单击此处查看此图的较大版本。
讨论
该协议最具挑战性的方面之一是对标签进行打蜡和进行靶向解剖所需的显微作灵巧性。需要另一个步骤来确保标签,以均匀地刺激该感觉器官上的每个感觉器并可视化感兴趣的大脑区域。此处使用的定制成像室针对 黑腹果蝇进行了优化,但可能需要针对其他昆虫修改室的规格和打蜡方法。该方案可以应用于其他 果蝇 ,只需稍作修改,但 Brachycera 亚目的其他成员,例如蜜蜂和蚊子,可能需要更改安装和解剖步骤,以解释唇触和头部形态的差异。显微作器的对准以进行品尝输送也可能具有挑战性,并且需要使用特定的显微镜载物台进行初始测试以进行优化。如果蜡在刺激过程中破裂,可能会导致泄漏,从而使毛细管中的 AHL 和味觉接触。拉动毛细管并用磨刀石将它们锉平,使其更紧密地贴合标签,有助于防止 tastant 和 AHL 接触。必须排除任何泄漏或过度大脑运动的苍蝇。如果可能,请始终为每只动物包括阳性对照,以确保标签和标签神经不会因打蜡或解剖而受损。此处显示的“甜味”和“苦味”示例建议作为稳健的对照实验。
此处描述的体内钙成像方法已用于量化黑腹果蝇中初级味觉神经元、高阶神经元和整个 SEZ 的味觉诱导反应,以识别味觉受体和回路 8,14,17,18,19,20,27,28,30,31, 34,35,36,37,38,39,40,41,
42,43,44,45,46,47,48。这种模式生物体的广泛应用是由于现成的 Gal4 和分离 Gal4 驱动程序;因此,转基因昆虫需要获得在感兴趣的特定神经元中表达的 GCaMP 是这种方法的一个限制因素。幸运的是,随着基因编辑技术的进步,这正变得越来越容易用于模式生物以外的昆虫,最近报道了使用钙成像的害虫果蝇49 和携带媒介的蚊子50 的味觉诱导反应。与所有钙成像一样,对于感兴趣的目标神经元,可能需要对信噪比进行一些初始优化。通过使用更亮的 GCaMP 版本和表达两个 GCaMP 拷贝,可以增强信号。在目标神经元中共表达 RFP 有助于在基线时可视化目标神经元,并且可以作为对具有脉动倾向的区域大脑运动的控制。
该方案专门设计用于通过去除跗骨和触角、在上颌触诊上打蜡并限制摄入,从而不会刺激咽部 GRN 来从标签中分离化学感觉。然而,可以对该方案进行调整以包括来自睑板或咽部 GRN 的化学感觉。如果跗节完好无损,则可以单独刺激腿部,也可以通过在毛细管末端产生一个大的 tastant 溶液气泡来刺激腿。如果跗节完好无损,苍蝇有可能踢和移动盖玻片;因此,可以考虑在基部附近给跗节打蜡有助于防止不必要的移动。当前的例子包括切开食道的步骤,以避免咽部 GRN 刺激并更好地可视化 SEZ 中的标签投影,但同样的准备工作以前已被调整为通过保持食道完整和对咽侧投影进行成像来量化咽部 GRN 反应36。前面的应用使用了食欲糖刺激,苍蝇会自由消耗它来刺激咽部 GRN,但苍蝇不会轻易消耗厌恶的刺激来激活苦涩的咽部 GRN,这是这种方法的一个局限性。另一个限制是位于 果蝇11 翅膀中的 GRN 的反应不能用这种方法轻松研究。
虽然此处描述的体内钙成像已成为研究高阶味觉诱导反应的标准方法 8,18,19,20,28,但目前还有其他几种方法可以量化果蝇中初级标记 GRN 对味觉剂的反应。此处描述的体内钙成像方法记录了大脑轴突末端的 GCaMP 变化,但离体方法也用于量化标记 GRN 中的细胞体 GCaMP33。同样,已经描述了另一种安装方法,用于对完整果蝇中标记或跗骨 GRN 的细胞体进行成像51。电生理学仍然是研究昆虫初级味觉神经元反应的流行且有效的技术 13,16,32,52,53,54,55,56,57,58,59,60,64,62,63,64,65。这不需要基因编码的钙传感器,并且是神经元活动的更直接量化。然而,一次只能记录一个感器的反应,而钙成像可以同时记录来自整个 GRN 群体的反应。钙成像方法用于发现具有某些刺激的 GRN 中“开”和“关”反应的独特时间动态27,28,但黑腹果蝇味觉敏感器底部的电生理记录的最新进展现在允许在动作电位水平上量化“关”反应53.有趣的是,饥饿对原发性 GRN 敏感性的调节是通过钙成像检测到的,但不是在电生理学的动作电位水平上 29,但电生理尖端记录和钙成像都可以捕捉到饮食30,66 中 GRN 敏感性的变化。因此,电生理学仍然是钙成像的重要补充方法,用于识别味觉配体和受体,以及了解各种因素如何调节原代味觉受体神经元的敏感性。
披露声明
作者没有利益冲突,也没有什么可披露的。
致谢
我们要感谢布卢明顿 果蝇 种群中心的苍蝇种群和佛蒙特大学 IMF 实验室在制造定制成像室方面的帮助。我们还要感谢 BioRender 创作图形插图,感谢 Kayla Audette 为这些图形的设计做出贡献。这项工作得到了佛蒙特大学的新实验室启动资金和美国国家科学基金会 2332375 号奖项的支持。 图 1 中的图形是使用 www.BioRender.com 生成的。
材料
| Name | Company | Catalog Number | Comments |
| CaCl2 | Sigma-Aldrich | C7902 | For AHL |
| Caffeine | Sigma-Aldrich | C0750 | For a "bitter" taste stimulus |
| Clear nail polish- quick dry | Many vendors | Example: Sally Hansen Xtreme wear (clear) | |
| CO2 fly pad station | Genesee Scientific | 59-122BC | Includes tubing, a gun to initially anesthetize flies, and a pad to deliver continuous anesthesia |
| CO2 supply (cylinders) | Airgas | USP50 | For anesthesia |
| Confocal or two-photon microscope | Many vendors | Upright microscope, high signal to noise and rapid capture capabilities, 10X air immersion objective, 25-40X water immersion objective, accompanying hardware and software | |
| Coverslips | Globe Scientific | 1404-15 | 22 x 22 mm, No 1.5: for this specific imaging chamber, score and cut in half to get 11 x 22 mm coverslips |
| D. melanogaster: Gr64f-Gal4 | Bloomington Drosophila Stock Center | 57669 | For driving GCaMP expression in 'sweet' gustatory receptor neurons of the labellum |
| D. melanogaster: Gr66a-Gal4 | Bloomington Drosophila Stock Center | 57670 | For driving GCaMP expression in 'bitter' gustatory receptor neurons of the labellum |
| D. melanogaster: UAS-GCaMP6f | Bloomington Drosophila Stock Center | 42747 | For getting GCaMP expression when crossed to a Gal4 driver line |
| Dental Waxer | Pearson Dental | 49-00-54 | Digital wax carver, comes with tips that can be modified and sharpened small enough to deliver wax along the fly proboscis |
| Dissection microscope | Many vendors | .63 - 6.3X for optimal viewing but with sufficient working distance to perform dissections under the microscope | |
| Dissection scissors | Fine Science Tools | 15000-08 | This pair or any similar dissection scissors are appropriate |
| Empty pipette tip box | Free- many vendors | For humidity chamber: needs enough space so that the imaging chamber can sit and the lid can close without bumping the chamber | |
| Filter flask | Millipore-Sigma | CLS431097 | For filtering AHL stocks |
| Glass capillary | World Precision Instruments | TW100-4 | This size fits well over the D. melanogaster labellum without needing modification, but other capillaries can be pulled and filed down to an appropriate size |
| HEPES | Sigma-Aldrich | BP310 | For AHL |
| ImageJ (FIJI) | NIH | https://imagej.nih.gov/ij | Image analysis software |
| Imaging Chamber | IMF Labs | Custom item | The custom-made chamber in this example can be ordered at https://www.uvm.edu/research/imf/forms/contact-us. Base: 6061 aluminum, Holding Clamps: Black Delrin (Acetal), Insert: Moisture Resistant polyester (PET). Manual and CNC milling machines for fabrication. |
| KCl | Sigma-Aldrich | P9541 | For AHL |
| Kim wipes | Millipore-Sigma | Z188956 | For humidity chamber, wiping off forceps, removing solutions from capillaries, etc. |
| MgCl2 | Sigma-Aldrich | M9272 | For AHL |
| Micromanipulator | Tritech Research | U-31CF, USM-6, MINJ-4 | This example uses a magnet to attach the micromanipulator to the stage, other configurations are possible |
| NaCl | Sigma-Aldrich | S7653 | For AHL |
| NaH2PO4 | Sigma-Aldrich | 567545 | For AHL |
| NaHCO3 | Sigma-Aldrich | S6014 | For AHL |
| p10 pipette and tips | Many vendors | For filling the capillaries with tastants | |
| p200 pipette and tips | Many vendors | For AHL | |
| Parafin wax | Many vendors | White/clear block of wax often found in craft stores | |
| Ribose | Sigma-Aldrich | W379301 | For AHL |
| Semi-sharp forceps | Fine Science Tools | 11252-20 | Blunted to approximately tip size C |
| Sharp forceps | Fine Science Tools | 11252-20 | Sharpened to tip size A |
| Sharpening stone | Fine Science Tools | 29000-00 | For modifying dental waxer tips and forceps |
| Sucrose | Sigma-Aldrich | S0389 | For a "sweet'"taste stimulus |
| Toothpick | Many vendors | Small tip for nail polish application |
参考文献
- Wangler, M. F., Yamamoto, S., Bellen, H. J. Fruit flies in biomedical research. Genetics. 199 (3), 639-653 (2015).
- Ryu, L., Kim, S. Y., Kim, A. J. From photons to behaviors: Neural implementations of visual behaviors in Drosophila. Front Neurosci. 16, 883640 (2022).
- Joseph, R. M., Carlson, J. R. Drosophila chemoreceptors: A molecular interface between the chemical world and the brain. Trends Genet. 31 (12), 683-695 (2015).
- Montell, C. Drosophila sensory receptors-a set of molecular Swiss Army knives. Genetics. 217 (1), 1-34 (2021).
- Scott, K. Gustatory processing in Drosophila melanogaster. Annu Rev Entomol. 63, 15-30 (2018).
- Starostina, E., et al. A Drosophila DEG/ENaC subunit functions specifically in gustatory neurons required for male courtship behavior. J Neurosci. 32 (13), 4665-4674 (2012).
- Chen, Y., Amrein, H. Ionotropic receptors mediate Drosophila oviposition preference through sour gustatory receptor neurons. Curr Biol. 27 (18), 2741-2750.e4 (2017).
- Guillemin, J., et al. Taste cells expressing ionotropic receptor 94e reciprocally impact feeding and egg laying in Drosophila. Cell Rep. 43, 114625 (2024).
- Ostojic, I., et al. Positive and negative gustatory inputs affect Drosophila lifespan partly in parallel to dFOXO signaling. Proc Natl Acad Sci U S A. 111 (22), 8143-8148 (2014).
- Stocker, R. F. The organization of the chemosensory system in Drosophila melanogaster: A review. Cell Tissue Res. 275 (1), 3-26 (1994).
- Raad, H., Ferveur, J. -. F., Ledger, N., Capovilla, M., Robichon, A. Functional gustatory role of chemoreceptors in Drosophila wings. Cell Rep. 15 (7), 1442-1454 (2016).
- Montell, C. A taste of the Drosophila gustatory receptors. Curr Opin Neurobiol. 19 (4), 345-353 (2009).
- Weiss, L. A., Dahanukar, A., Kwon, J. Y., Banerjee, D., Carlson, J. R. The molecular and cellular basis of bitter taste in Drosophila. Neuron. 69 (2), 258-272 (2011).
- Jaeger, A. H., et al. A complex peripheral code for salt taste in Drosophila. Elife. 7, 37167 (2018).
- Freeman, E. G., Dahanukar, A. Molecular neurobiology of Drosophila taste. Curr Opin Neurobiol. 34, 140-148 (2015).
- Delventhal, R., Kiely, A., Carlson, J. R. Electrophysiological recording from Drosophila labellar taste sensilla. J Vis Exp. 84, e51355 (2014).
- Marella, S., et al. Imaging taste responses in the fly brain reveals a functional map of taste category and behavior. Neuron. 49 (2), 285-295 (2006).
- Shiu, P. K., Sterne, G. R., Engert, S., Dickson, B. J., Scott, K. Taste quality and hunger interactions in a feeding sensorimotor circuit. Elife. 11, e79887 (2022).
- Li, J., Dhaliwal, R., Stanley, M., Junca, P., Gordon, M. D. Functional imaging and connectome analyses reveal organizing principles of taste circuits in Drosophila. bioRxiv. , (2024).
- Junca, P., Stanley, M., Musso, P. -. Y., Gordon, M. D. Modulation of taste sensitivity by the olfactory system in Drosophila. bioRxiv. , (2021).
- Elliott, D. A., Brand, A. H. The GAL4 system: A versatile system for the expression of genes. Drosophila Methods Protoc. , 79-95 (2008).
- Riabinina, O., Potter, C. J., Dahmann, C. . Drosophila: Methods and Protocols. , 53-78 (2016).
- Diegelmann, S., Bate, M., Landgraf, M. Gateway cloning vectors for the LexA-based binary expression system in Drosophila. Fly. 2 (4), 236-239 (2008).
- Zhang, Y., et al. Fast and sensitive GCaMP calcium indicators for imaging neural populations. Nature. 615 (7954), 884-891 (2023).
- Ohkura, M., et al. Genetically encoded green fluorescent Ca2+ indicators with improved detectability for neuronal Ca2+ signals. PLoS One. 7 (12), e51286 (2012).
- Arntsen, C., Guillemin, J., Audette, K., Stanley, M. Tastant-receptor interactions: Insights from the fruit fly. Front Nutr. 11, 1394697 (2024).
- Stanley, M., Ghosh, B., Weiss, Z. F., Christiaanse, J., Gordon, M. D. Mechanisms of lactic acid gustatory attraction in Drosophila. Curr Biol. 31 (16), 3525-3537.e6 (2021).
- Devineni, A. V., Deere, J. U., Sun, B., Axel, R. Individual bitter-sensing neurons in drosophila exhibit both on and off responses that influence synaptic plasticity. Curr Biol. 31 (24), 5533-5546.e7 (2021).
- Inagaki, H. K., et al. Visualizing neuromodulation in vivo: Tango-mapping of dopamine signaling reveals appetite control of sugar sensing. Cell. 148 (3), 583-595 (2012).
- May, C. E., et al. High dietary sugar reshapes sweet taste to promote feeding behavior in drosophila melanogaster. Cell Rep. 27 (6), 1675-1685.e7 (2019).
- May, C. E., Rosander, J., Gottfried, J., Dennis, E., Dus, M. Dietary sugar inhibits satiation by decreasing the central processing of sweet taste. Elife. 9, e54530 (2020).
- Jiao, Y., Moon, S. J., Wang, X., Ren, Q., Montell, C. Gr64f is required in combination with other gustatory receptors for sugar detection in Drosophila. Curr Biol. 18 (22), 1797-1801 (2008).
- Chen, H. -. L., Stern, U., Yang, C. -. H. Molecular control limiting sensitivity of sweet taste neurons in Drosophila. Proc Natl Acad Sci USA. 116 (40), 20158-20168 (2019).
- Devineni, A. V., Sun, B., Zhukovskaya, A., Axel, R. Acetic acid activates distinct taste pathways in Drosophila to elicit opposing, state-dependent feeding responses. Elife. 8, e47677 (2019).
- Engert, S., Sterne, G. R., Bock, D. D., Scott, K. Drosophila gustatory projections are segregated by taste modality and connectivity. Elife. 11, e78110 (2022).
- Ledue, E. E., et al. Starvation-induced depotentiation of bitter taste in Drosophila. Curr Biol. 26 (21), 2854-2861 (2016).
- Mcdowell, S. A. T., Stanley, M., Gordon, M. D. A molecular mechanism for high salt taste in Drosophila. Curr Biol. 32 (14), 3070-3081.e7 (2022).
- Deere, J. U., Devineni, A. V. Taste cues elicit prolonged modulation of feeding behavior in Drosophila. iScience. 25 (10), 105159 (2022).
- Deere, J. U., et al. Selective integration of diverse taste inputs within a single taste modality. Elife. 12, (2023).
- Chu, B., Chui, V., Mann, K., Gordon, M. D. Presynaptic gain control drives sweet and bitter taste integration in Drosophila. Curr Biol. 24 (17), 1978-1984 (2014).
- Yao, Z., Scott, K. Serotonergic neurons translate taste detection into internal nutrient regulation. Neuron. 110 (6), 1036-1050.e7 (2022).
- Cameron, P., Hiroi, M., Ngai, J., Scott, K. The molecular basis for water taste in Drosophila. Nature. 465 (7294), 91-95 (2010).
- Jourjine, N., Mullaney, B. C., Mann, K., Scott, K. Coupled sensing of hunger and thirst signals balances sugar and water consumption. Cell. 166 (4), 855-866 (2016).
- Kim, H., Kirkhart, C., Scott, K. Long-range projection neurons in the taste circuit of Drosophila. Elife. 6, e23386 (2017).
- Kirkhart, C., Scott, K. Gustatory learning and processing in the Drosophila mushroom bodies. J Neurosci. 35 (15), 5950-5958 (2015).
- Steck, K., et al. Internal amino acid state modulates yeast taste neurons to support protein homeostasis in Drosophila. Elife. 7, e31625 (2018).
- Münch, D., Goldschmidt, D., Ribeiro, C. The neuronal logic of how internal states control food choice. Nature. 607 (7920), 747-755 (2022).
- Taisz, I., et al. Generating parallel representations of position and identity in the olfactory system. Cell. 186 (12), 2556-2573.e2 (2023).
- Cavey, M., et al. Increased sugar valuation contributes to the evolutionary shift in egg-laying behavior of the fruit pest Drosophilasuzukii. PLoS Biol. 21 (12), e3002432 (2023).
- Jové, V., et al. Sensory discrimination of blood and floral nectar by Aedes aegypti mosquitoes. Neuron. 108 (6), 1163-1180.e2 (2020).
- Shankar, S., Calvert, M. E., Yew, J. Y. Measuring physiological responses of Drosophila sensory neurons to lipid pheromones using live calcium imaging. J Vis Exp. (110), e53392 (2016).
- Dahanukar, A., Lei, Y. -. T., Kwon, J. Y., Carlson, J. R. Two gr genes underlie sugar reception in Drosophila. Neuron. 56 (3), 503-516 (2007).
- Dweck, H. K. M., Carlson, J. R. Base recording: A technique for analyzing responses of taste neurons in Drosophila. J Vis Exp. (205), e66665 (2024).
- Dweck, H. K. M., Talross, G. J. S., Luo, Y., Ebrahim, S. A. M., Carlson, J. R. Ir56b is an atypical ionotropic receptor that underlies appetitive salt response in Drosophila. Curr Biol. 32 (8), 1776-1787.e4 (2022).
- Park, J., Carlson, J. R. Physiological responses of the Drosophila labellum to amino acids. J Neurogenet. 32 (1), 27-36 (2018).
- Wang, W., et al. Sugar sensation and mechanosensation in the egg-laying preference shift of Drosophilasuzukii. Elife. 11, e81703 (2022).
- Xiao, S., Baik, L. S., Shang, X., Carlson, J. R. Meeting a threat of the Anthropocene: Taste avoidance of metal ions by Drosophila. Proc Natl Acad Sci USA. 119 (25), e2204238119 (2022).
- Ganguly, A., et al. Requirement for an otopetrin-like protein for acid taste in Drosophila. Proc Natl Acad Sci USA. 118 (51), e2110641118 (2021).
- Lee, Y., Moon, S. J., Montell, C., Snyder, S. H. Multiple gustatory receptors required for the caffeine response in Drosophila. Proc Natl Acad Sci USA. 106 (11), 4495-4500 (2009).
- Lee, Y., Poudel, S., Kim, Y., Thakur, D., Montell, C. Calcium taste avoidance in Drosophila. Neuron. 97 (1), 67-74.e4 (2018).
- Mi, T., et al. Alkaline taste sensation through the alkaliphile chloride channel in Drosophila. Nat Metab. 5 (3), 466-480 (2023).
- Rimal, S., et al. Mechanism of acetic acid gustatory repulsion in Drosophila. Cell Rep. 26 (6), 1432-1442.e4 (2019).
- Zhang, Y. V., Ni, J., Montell, C. The molecular basis for attractive salt-taste coding in Drosophila. Science. 340 (6138), 1334-1338 (2013).
- Aryal, B., Dhakal, S., Shrestha, B., Lee, Y. Molecular and neuronal mechanisms for amino acid taste perception in the Drosophila labellum. Curr Biol. 32 (6), 1376-1386.e4 (2022).
- Shrestha, B., Aryal, B., Lee, Y. The taste of vitamin C in Drosophila. EMBO Rep. 24 (6), e56319 (2023).
- Ganguly, A., Dey, M., Scott, C., Duong, V. -. K., Arun Dahanukar, A. Dietary macronutrient imbalances lead to compensatory changes in peripheral taste via independent signaling pathways. J Neurosci. 41 (50), 10222 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。