Method Article
In vivo Imágenes de calcio de las respuestas neuronales inducidas por el gusto en Drosophila adulta
En este artículo
Resumen
Un enfoque de imágenes de calcio permite el registro de las respuestas inducidas por el gusto en el cerebro de moscas despiertas mientras se aplica una solución al labelo. Las respuestas gustativas primarias en Drosophila melanogaster se utilizan como ejemplo, pero este protocolo se puede adaptar para estudiar neuronas aguas abajo u otras especies.
Resumen
Durante casi dos décadas, las imágenes de calcio in vivo han sido un método eficaz para medir las respuestas celulares a los estímulos gustativos en el organismo modelo de la mosca de la fruta, Drosophila melanogaster. Una fortaleza clave de esta metodología es su capacidad para registrar las respuestas neuronales inducidas por el gusto en animales despiertos sin necesidad de anestesia. Este enfoque emplea sistemas de expresión binarios (por ejemplo, Gal4-UAS) para expresar el indicador de calcio GCaMP en neuronas específicas de interés. Este protocolo describe un procedimiento en el que las moscas que expresan GCaMP se montan con el labelo firmemente posicionado, lo que permite registrar la fluorescencia en el cerebro con una resolución de milisegundos bajo un microscopio confocal mientras se aplica una solución al labelo, estimulando todas las sensibilidades gustativas de la etiqueta. Los ejemplos proporcionados se centran en las respuestas de calcio en las neuronas receptoras gustativas primarias de D. melanogaster. Sin embargo, este enfoque se puede adaptar para registrar otras neuronas de interés dentro del cerebro de drosófilos u otras especies de insectos. Este método de imagen permite a los investigadores registrar simultáneamente las respuestas colectivas de calcio de grupos de neuronas gustativas a través del labelo, complementando los registros electrofisiológicos de la punta que cuantifican los potenciales de acción de las neuronas individuales. La técnica de imagen de calcio in vivo descrita aquí ha sido fundamental para descubrir los mecanismos moleculares y celulares de la quimiosensación, identificar patrones de respuesta temporal únicos en las neuronas gustativas primarias, investigar los mecanismos de modulación gustativa y explorar el procesamiento del sabor en circuitos posteriores.
Introducción
La mosca de la fruta, Drosophila melanogaster, es célebre por las poderosas herramientas de investigación genética disponibles en este organismo modelo. Estas herramientas proporcionan la capacidad de manipular fácilmente genes específicos en células objetivo, lo que las hace ideales para explorar circuitos neuronales fundamentales como la visión y la quimiosensación 1,2,3. La guestación, a través de la quimiosensación de contacto, es una vía neuronal clave que regula los comportamientos involucrados en la alimentación, el apareamiento, la reproducción y, en última instancia, la supervivencia y el estado físico de los animales 4,5,6,7,8,9. Comprender cómo se codifica y transmite esta importante información quimiosensorial requiere describir la actividad de las neuronas en los circuitos que se activan por los estímulos gustativos.
En D. melanogaster, las neuronas receptoras gustativas externas (GRN) se encuentran en las patas delanteras, la probóscide y las alas10,11. El labelo, al final de la probóscide, contiene estructuras parecidas a pelos llamadas sensilla que pueden ser mapeadas por su morfología basada en el tamaño: largo (tipo L), intermedio (tipo I) y corto (tipo S)10. La mayoría de los GRN se concentran en este órgano sensorial, y cada sensilla contiene de 2 a 4 tipos diferentes de GRN, de modo que cada modalidad gustativa se extiende por el labelo 12,13,14,15. Mientras que los registros electrofisiológicos de la punta se pueden utilizar para cuantificar los potenciales de acción provenientes de los GRN en una sola sensilla16, in vivo, las imágenes de calcio se pueden usar para aislar la actividad de un tipo específico de GRN en todo el labelo14,17. Esta misma técnica de imagen de calcio también se puede utilizar para estudiar las respuestas neuronales en los circuitos gustativos posteriores 18,19,20. Las imágenes de calcio requieren sistemas de expresión binarios, como Gal4-UAS 21,22,23, y cruzar una línea conductora que contiene activadores transcripcionales específicos de células a una línea efectora para obtener la expresión de un GCaMP en las neuronas de interés. Cuando los niveles de calcio intracelular aumentan, estos indicadores de calcio codificados genéticamente aumentan en intensidad de fluorescencia, de modo que el nivel de fluorescencia se correlaciona con cambios en la actividad neuronal24,25.
Aquí, se describe un método para usar imágenes de calcio para observar las respuestas neuronales a los estímulos gustativos in vivo. El objetivo general de este método es estimular solo los GRN labelares para cuantificar las respuestas neuronales inducidas por el gusto en los cerebros de moscas despiertas. Se proporcionan ejemplos del uso de este método para registrar las respuestas en los GRN primarios del labelo en D. melanogaster, y se discuten los beneficios y desafíos del uso de este enfoque. Esta preparación se desarrolló para permitir a los experimentadores la capacidad de aplicar una solución sabrosa a un labelo de mosca inmovilizado mientras se está bajo un microscopio confocal para registrar las respuestas neuronales cuando todo el órgano sensorial se sumerge en una solución, lo que ocurre en entornos naturales. El enfoque de imágenes de calcio in vivo descrito aquí se puede utilizar para descubrir nuevas interacciones entre el sabor y el receptor 8,14,26,27, detalles temporales de las respuestas a GRN 27,28, mecanismos moleculares de la modulación de GRN29,30 y procesamiento del sabor en circuitos posteriores 8,18,19,20, 28,31.
Protocolo
Los detalles de los reactivos y el equipo utilizado en este estudio se enumeran en la Tabla de Materiales.
1. Preparación de una solución similar a la hemolinfa para adultos (AHL)
- Prepare una solución madre que contenga 108 mM de NaCl, 5 mM de KCl, 4 mM de NaHCO3, 1 mM de NaH,2PO4, 5 mM de HEPES y 15 mM de ribosa.
NOTA: La ribosa se utiliza como azúcar no energético para mantener la osmolaridad sin alterar los niveles de nutrientes en el cerebro. - Ajuste el pH de esta solución a 7,5 antes de filtrarla y almacenarla a 4 °C. Verifique la osmolaridad del AHL después de ajustar el pH para garantizar la consistencia en todas las preparaciones.
- Prepare existencias separadas de 1 M de CaCl2 y 1 M de MgCl2, filtre y almacene a temperatura ambiente.
- Para preparar una alícuota de la reserva principal de AHL, agregue un pequeño volumen de calcio y magnesio para obtener concentraciones finales de 2 mM de calcio y 8,2 mM de magnesio. Este AHL puede almacenarse a 4 °C y utilizarse hasta un mes, utilizando pequeñas alícuotas llevadas a temperatura ambiente para los experimentos.
2. Moscas de montaje en la cámara de imágenes
- Antes de montar moscas, afile la punta de una cera dental en una copa pequeña y puntiaguda con una piedra de afilar (Figura 1D). Coloque la punta afilada en la cera y enciéndala para precalentar. Los ajustes de calor dependerán del tipo y la longitud de la punta: se necesita una temperatura mínima que permita que la cera permanezca derretida al contacto (50,5 °C funciona en este ejemplo).
NOTA: Se puede enrollar un alambre alrededor del extremo de la cera dental para fijar una punta de metal afilada como alternativa. - Anestesiar suavemente de 1 a 5 moscas (siguiendo los protocolos aprobados institucionalmente). Minimice el tiempo de exposición a la anestesia, ya que los períodos prolongados de exposición al CO2 o al frío pueden afectar el comportamiento. Para el CO2, utilice una almohadilla para moscas que proporcione un flujo continuo y uniforme de 99,9% de CO2 a una tasa de 5 L/min bajo un microscopio de disección.
- Use tijeras de disección para extirpar partes de las patas cortando las patas medias y traseras en la articulación femoral/tibial y las patas delanteras en el trocánter. Usa pinzas romas para ayudar a manipular la mosca. El recorte de los tarsos evitará la sensación de tarso y las patadas del cubreobjetos o del estimulador del gusto.
- Levante la mosca por las alas con pinzas romas para colocar la mosca de modo que la cabeza esté por encima de la ranura del cuello uterino objetivo de la cámara de imágenes, pero el cuerpo esté debajo. Es útil arrancar la mosca completamente a la derecha o a la izquierda. Con el lado romo de las tijeras y las pinzas romas, empuje suavemente la cabeza y el tórax simultáneamente en la ranura.
- Una vez que esté seguro dentro de la ranura, empuje la mosca hacia la parte posterior de la ranura y vuelva a colocarla suavemente para que la mosca mire hacia el frente de la cámara. Evite rotar la cabeza demasiado lejos del tórax.
- Repita el procedimiento para tantas moscas como sea necesario (esta cámara de imágenes puede montar hasta 5 moscas).
- Reúna una pequeña gota de esmalte de uñas en el extremo de un palillo de dientes y aplique una capa delgada para asegurar la cabeza de la mosca a la cámara de imágenes.
NOTA: el área precisa para aplicar el esmalte de uñas depende de la parte del cerebro que se esté fotografiando. Si se obtienen imágenes de la ZEE (como se muestra aquí) u otras regiones mediales inferiores, el esmalte de uñas se puede aplicar generosamente en la parte superior de la cabeza de la mosca, pero para obtener imágenes de las regiones mediales superiores, el esmalte de uñas se puede aplicar mínimamente en la parte superior de la cabeza y agregarse lateralmente cerca de los ojos para dejar esta área libre para la disección. Este protocolo está optimizado para la estimulación del gusto solo sin olfato, pero si los volátiles del esmalte de uñas son una preocupación, use cera o pegamento UV como métodos alternativos para asegurar la cabeza de la mosca.
3. Encerar la probóscide en posición extendida
- Levanta la cerera con una mano y recoge una pequeña gota de cera en la punta.
- Por otro lado, use pinzas semiafiladas para agarrar un palpo maxilar y tire suavemente y sostenga la probóscide en extensión completa.
NOTA: Tenga cuidado de agarrar solo el palpo maxilar, ya que pellizcar la cutícula en la probóscide aumenta el potencial de daño. No proceda si la probóscide está pellizcada o la cutícula de la probóscide está perforada. Se puede usar un pequeño pobro de mosca como alternativa a las pinzas para extraer la probóscide mediante succión mientras se aplica la cera. - Toque la punta de la cerera con la cámara cerca de la base de la probóscide hasta que la cera comience a fluir, luego muévase para hacer contacto con la base de la probóscide. Cera hasta la mitad del tallo, pero evita tocar las sensillas labellares con la cera o el encerador. La cera de este lado mantendrá la probóscide en su lugar. No proceda si la cera o el encerador tocan las sensillae en cualquier momento.
- Aplique cera usando el método anterior para el otro lado, haciendo un puente continuo de cera sobre la probóscide.
- Extienda completamente la probóscide lo más recta posible. Si es necesario, se puede mover la probóscide recalentando la cera y empujando suavemente la probóscide a la posición deseada.
- Repita el procedimiento para otras moscas que se van a montar en la misma cámara.
- Apague el CO2 o elimine las moscas de la anestesia con hielo. Coloque las moscas montadas en una cámara de humedad durante 60 minutos para que se recuperen (caja de puntas de pipeta limpia y vacía con toallitas húmedas y sin pelusa).
4. Disección para revelar la región cerebral de interés
- Retire las moscas de la cámara de humedad. Las moscas deben estar claramente vivas, moviendo activamente su abdomen, patas y antenas. Configure el microscopio confocal o de dos fotones antes de la disección.
- Encienda la cerera para reparar las posibles roturas en la cera durante la disección y prepare AHL a temperatura ambiente.
- Con pinzas muy afiladas, pellizque ambas antenas, luego pellizque la cutícula para proporcionar un orificio para insertar un lado de las pinzas afiladas. Pasa las pinzas por debajo de la cutícula para extraerla de la región que cubre el área cerebral de interés. La Figura 1F indica una X sobre las áreas de la cutícula a las que apuntar con las pinzas para la extracción.
- Lave el cerebro expuesto en AHL aplicando generosamente AHL (~ 100 μL) en la cabeza y luego retire toda la capa de AHL excepto una capa delgada para evitar que el cerebro se seque.
NOTA: Si la cera se rompe en algún punto y necesita ser reparada, retire brevemente todo el AHL alrededor de la cabeza antes de recalentar la cera para volver a asegurar la probóscide en la posición extendida. - Con pinzas afiladas, retire los sacos de aire y cualquier residuo grande que cubra el cerebro. Evite penetrar en el cerebro manteniendo visibles las puntas de las pinzas.
- Lave con AHL ~ 3 veces para eliminar todos los desechos pequeños.
- Asegúrese de que la región del cerebro de interés sea claramente visible. Para obtener una imagen específica de la zona subesofágica (ZEE) como en este ejemplo, corte el esófago en la base cerca de la probóscide y cerca del punto donde pasa a través del cerebro pellizcando con pinzas muy afiladas y retirando esta pieza para exponer la ZEE.
NOTA: Las moscas no pueden ingerir soluciones después de que se extirpa el esófago y no puede ocurrir ninguna activación de GRN faríngea. - Bajo el microscopio de disección, coloque el cubreobjetos de 10 mm x 20 mm en la ranura angular de la cámara de imágenes. Asegúrese de que descanse en la base de la probóscide sin romper la cera. La punta del labelo no debe tocar el cubreobjetos.
5. Imagen y estimulación del gusto
- Encienda el microscopio confocal o de dos fotones y esté listo para la captura de imágenes. Configure un micromanipulador con un tubo capilar que esté posicionado para entregar los sabores a la mosca mientras están en la etapa del microscopio.
NOTA: Las imágenes de dos fotones pueden capturar la fluorescencia de las neuronas que se encuentran más profundas en el tejido cerebral. - Cargue ~ 2 μL de agua (u otro control negativo) en el tubo capilar del
estimulador en la platina del microscopio. - Encuentre la mosca diseccionada y concéntrese en el labelo utilizando un campo claro de inmersión en aire 10x. Alinee el capilar con el labelo bajo esta vista. Se pueden incluir cámaras adicionales apuntando al labelo de la mosca para ver la alineación del capilar con la mosca desde múltiples ángulos.
NOTA: Asegúrese de que todos los sensores labellares estén siendo estimulados con la solución durante la alineación; Si la posición del estimulador o labelo no es lo suficientemente perpendicular para esto, ajústelo en consecuencia. Los capilares se pueden tirar y limar con una piedra de afilar para proporcionar un ajuste más apretado alrededor del labelo. - Deje el capilar colocado directamente delante del labelo, cerca pero sin tocarse.
- Mueva la etapa para que la región del cerebro de interés esté centrada y cambie a un objetivo de inmersión en agua de mayor aumento (40x utilizado en este ejemplo).
- Agregue aproximadamente 200 μL de AHL en la parte superior del cerebro para hacer contacto con el objetivo para la inmersión. Retira las burbujas.
- Oriente el enfoque usando el campo claro para moverse con cuidado en el plano z para encontrar el borde de la cutícula que se eliminó y centrar la región del cerebro de interés.
- Cambie a una potencia láser de 488 nm para encontrar la expresión de GCaMP en el área de interés.
NOTA: Dependiendo de la línea de controlador y la versión de GCaMP utilizada, es posible que se necesite una optimización inicial para amplificar la relación señal-ruido para preparaciones individuales. La coexpresión de RFP puede ser útil para las neuronas con baja fluorescencia basal de GCaMP. - Prepare una colección de imágenes de lapso de tiempo. La velocidad dependerá del microscopio específico y de la señal GCaMP, pero lo óptimo es capturar al menos una imagen cada ~100 ms.
NOTA: La captura de un solo plano Z de fluorescencia a lo largo del tiempo optimizará la velocidad de captura para proporcionar una cinética detallada del calcio. Las pilas de imágenes tomadas en múltiples planos Z en cada punto de tiempo pueden ralentizar las tasas de captura, pero registrarán las respuestas a través de neuritas que se encuentran a diferentes profundidades en el tejido. - Después de recolectar al menos 5 s de fluorescencia basal, mueva manualmente el estimulador para que el capilar cubra el labelo durante un período de tiempo específico (5 s en este ejemplo), luego retire el estímulo y capture durante el tiempo que desee.
- Retire el AHL y vuelva a pasar a un campo claro de 10x para asegurarse de que el cubreobjetos, el estimulador y el labelo sigan en la misma posición.
NOTA: Si el estimulador no está bien alineado con el labelo o se gira demasiado, el labelo se puede mover o el capilar puede golpear la cámara de imágenes, lo que podría romper la cera y crear una fuga del AHL. - Retire la cámara de imagen. Utilice una toallita sin pelusa para retirar la primera solución y enjuague la pipeta con agua. A continuación, pipetee ~2 μL del siguiente saborizante en el tubo capilar.
- Vuelva a colocar la cámara de imágenes en la platina y repita los pasos 5.4 a 5.12 para esta solución.
NOTA: La alta tensión superficial de la mayoría de los catantes presenta productos químicos residuales por permanecer en el labelo al vuelo. Sin embargo, si los saborizantes son muy saturados o viscosos, el agua se puede mover sobre el labelo varias veces para lavar el órgano sensorial antes del siguiente estímulo. - Repita para tantas soluciones como desee para esta mosca.
- Vuelva al paso 3 para preparar la siguiente mosca para la obtención de imágenes.
6. Análisis de imágenes
- Abra la pila de imágenes que se analizará en el software de procesamiento de imágenes. Si es necesario, realice una sustracción en segundo plano utilizando una región fuera de la señal GCaMP.
- Seleccione una región de interés (ROI) ajustada alrededor de las proyecciones que se van a cuantificar con la herramienta de mano alzada o de forma y asegúrese de que la selección se aplique a todas las imágenes de la pila.
- Genere una lista de las lecturas de fluorescencia a lo largo del tiempo para este ROI y expórtela a una hoja de cálculo para su posterior procesamiento. Utilice el perfil del eje Z de trazado en ImageJ (FIJI) o una función similar en el software de procesamiento de imágenes de su elección.
- En la hoja de cálculo, seleccione 10 puntos de tiempo consecutivos durante el registro de la línea base en el paso 5.10 como línea base representativa. Calcula la media y la desviación estándar.
- Para obtener ΔF/F como porcentaje, calcule ((F - media de referencia F)/media de referencia F)*100) para cada punto de tiempo. Para obtener ΔF/F como puntuación z, calcule ((F - línea de base media F)/desviación estándar de la línea de base F) para cada punto de tiempo.
- Para calcular el cambio de pico en la fluorescencia durante la estimulación, seleccione 3 puntos consecutivos con la fluorescencia más alta y calcule la media.
- Repita para cada pila de imágenes a través de estímulos y moscas.
NOTA: Adapte estos pasos según sea necesario en función del microscopio específico, la calidad de la señal y el software de análisis de imágenes preferido.
Resultados
La Figura 1 proporciona detalles de la cámara de imágenes (Figura 1A, B) y la punta de la cera (Figura 1D) utilizadas en esta preparación. La Figura 1 también ilustra los pasos principales del procedimiento para montar moscas (Figura 1C), encerar la probóscide en su lugar (Figura 1E), diseccionar la región cerebral de interés (Figura 1F) y estimular el labelo con un saborante mientras se registra la fluorescencia en el cerebro (Figura 1G). Para cuantificar las respuestas inducidas por el sabor en las neuronas receptoras gustativas primarias (GRN) de moscas Drosophila melanogaster con expresión impulsiva de Gr64f-Gal4 de UAS-GCaMP6f se produjo para obtener el indicador de calcio expresado genéticamente en todos los GRN "dulces" sensibles al azúcar del labelo 14,27,30,32,33,34,35. Para estos experimentos, se utilizó un microscopio confocal con los siguientes componentes: un microscopio fluorescente vertical con cámara sCMOS de 40 fps, objetivos de 10x y 40x, disco giratorio confocal, emisores dicroicos de 488 y láseres de estado sólido de 488 nm. El objetivo 40x se sumergió en AHL y se centró en la región del cerebro SEZ para localizar la señal de GCaMP de referencia en los terminales axónicos de estos GRN etiquetadores (Figura 2A). Se capturó una imagen de fluorescencia cada 100 ms durante la estimulación basal (sin estimulación), durante 5 s de estimulación gustativa (el estimulador se movió sobre el labelo) y después de la estimulación hasta que la fluorescencia volvió a la línea de base (Figura 2A, B). Se utilizó agua como control negativo y sacarosa 1 M como control positivo. El cambio relativo en la fluorescencia se calculó como ΔF/F (puntuación z) para 13 moscas y se graficó a lo largo del tiempo para mostrar la cinética de las respuestas de calcio durante la estimulación del gusto (Figura 2B). Se trazó el pico ΔF/F (puntuación z) y se utilizó para comparaciones estadísticas para indicar que la respuesta de sacarosa en estas células es significativamente mayor que en el agua (Figura 2C). Esta técnica capta que los GRN "dulces" tienen un pico fuerte al inicio de la sacarosa que permanece alto con algo de descomposición durante el período de estimulación.
A modo de comparación, este protocolo se repitió en moscas con un controlador diferente, Gr66a-Gal4, que expresaba UAS-GCaMP6f específicamente en todos los GRN "amargos" en el labelo 14,17,28,34,36. De manera similar, los terminales axónicos de estos GRN estaban ubicados en la ZEE: observe que el patrón de proyección es distinto de los GRN sensibles al azúcar (Figura 2D). La fluorescencia se capturó y analizó como antes, excepto para 100 mM de cafeína, que se utilizó como control positivo. La curva promediada de 11 moscas muestra un pico fuerte con el inicio de la estimulación con cafeína, pero también hay una pequeña respuesta "apagada" con la eliminación de estímulos que se sabe que ocurre con ciertos estímulos amargos28 (Figura 2E). Este método permite cuantificar las respuestas de "encendido" y "apagado" para caracterizar los patrones temporales de las respuestas inducidas por el gusto27,28. Aquí, solo se cuantificaron los picos "encendidos" para indicar que la respuesta a la cafeína es significativamente más fuerte que la del agua (Figura 2F). Los experimentos de la Figura 2 son altamente reproducibles y se pueden utilizar para garantizar que el protocolo funcione correctamente.
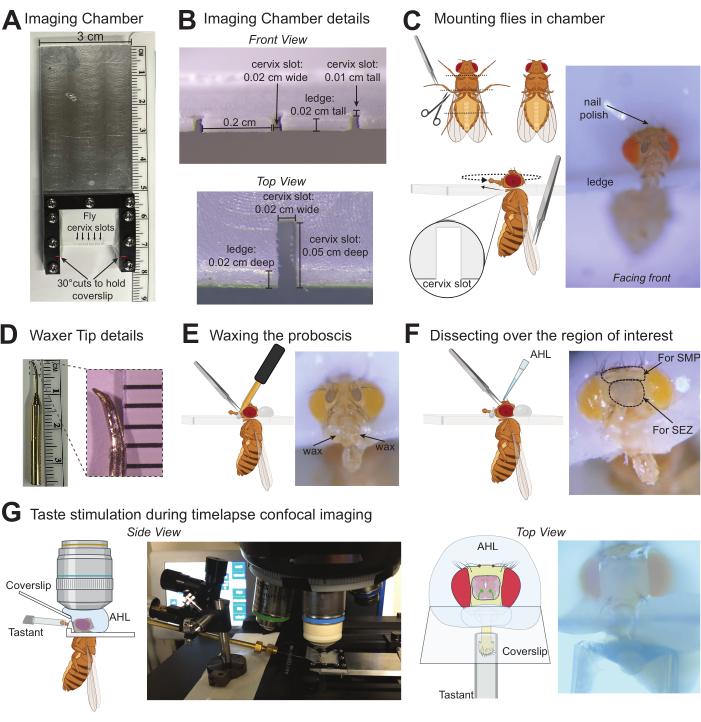
Figura 1: Ilustraciones de protocolos para obtener imágenes de las respuestas inducidas por el gusto en el cerebro de Drosophila . (A) Vista superior de la cámara de imágenes personalizada utilizada para montar hasta cinco moscas a la vez. (B) Detalles de la cámara de imágenes donde se montan las moscas con medidas que se ajustan cómodamente al cuello uterino de D. melanogaster. (C) Gráficos que indican dónde recortar los tarsos (arriba a la izquierda) y cómo montar la mosca en la ranura del cuello uterino de la cámara de imágenes con pinzas (abajo a la izquierda). Foto de una mosca montada en la posición correcta en la cámara de imágenes (derecha). (D) Foto de la punta de la cera (izquierda), foto ampliada de la punta para indicar la forma y el tamaño aproximados a los que se debe apuntar cuando se utiliza una piedra de afilar para modificar la punta estándar (derecha). (E) Ilustración gráfica de la cera de la probóscide en su lugar con pinzas (izquierda), foto de una mosca montada con un labelo debidamente encerado (derecha). (F) Ilustración gráfica que representa la disección sobre la región cerebral de interés y la aplicación de AHL (izquierda), foto de una mosca con círculos punteados alrededor del área de la cutícula para eliminar cuando se dirige a las regiones cerebrales SEZ o SMP. La X indica las regiones de la cutícula que se deben pellizcar para la disección (derecha). (G) Los gráficos y las fotos indican la posición de la mosca montada/disecada, el objetivo de inmersión en agua en AHL, el estimulador con un sabor sobre la probóscide y el cubreobjetos formando una barrera entre estas soluciones. La vista lateral se alejó (izquierda) y la vista superior estaba debajo del objetivo 10x (derecha). Haga clic aquí para ver una versión más grande de esta figura.
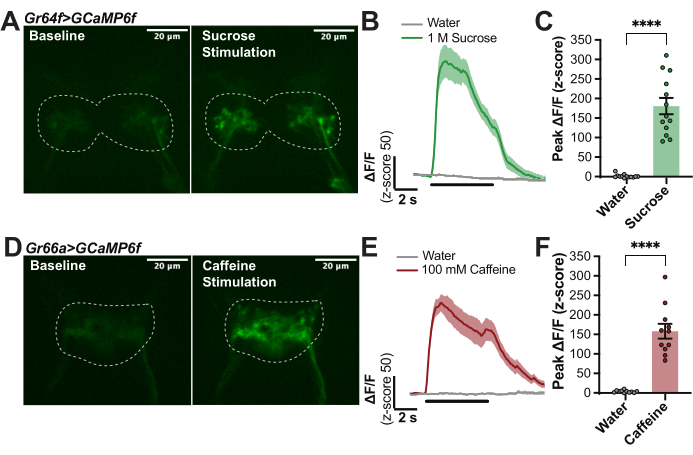
Figura 2: Ejemplo de las respuestas de calcio de los GRN labelares a los estímulos gustativos. (A) Captura fija de una pila de imágenes que indica el nivel de fluorescencia de GCaMP en una mosca con Gr64f>GCaMP6f al inicio y durante la respuesta máxima a la sacarosa 1 M, barra de escala = 20 μm. Las líneas punteadas indican el ROI para el análisis. (B) Curvas de respuesta de calcio para n = 14 moscas calculadas como ΔF/F (puntuación z) y combinadas para agua (control negativo) y sacarosa 1 M (control positivo) para mostrar cinética; La línea negra debajo de las curvas indica cuando el estímulo está sobre el labelo. (C) Pico ΔF/F (puntuación z) para cada mosca trazada para comparaciones estadísticas. Prueba t pareada, ****p < 0,0001. (D) Captura fija de un video que indica el nivel de fluorescencia de GCaMP en una mosca con Gr66a>GCaMP6f al inicio y durante la respuesta máxima a 100 mM de cafeína, barra de escala = 20 μm. Las líneas punteadas indican el ROI para el análisis. (E) Curvas de respuesta de calcio para n = 11 moscas calculadas como ΔF/F (z-score) y combinadas para agua (control negativo) y 100 mM de cafeína (control positivo) para mostrar cinética: observe la pequeña respuesta "off", la línea negra debajo de las curvas indica cuando el estímulo está sobre el labelo. (F) Pico ΔF/F (puntuación z) para cada mosca trazada para comparaciones estadísticas. Prueba t pareada, ****p < 0,0001. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Uno de los aspectos más desafiantes de este protocolo es la destreza de micromanipulación necesaria para encerar el labelo y realizar las disecciones específicas. Es necesario un paso adicional para asegurar el labelo para estimular cada sensillum de manera uniforme a través de este órgano sensorial y visualizar las regiones cerebrales de interés. La cámara de imagen personalizada utilizada aquí está optimizada para D. melanogaster, pero es posible que sea necesario modificar las especificaciones de la cámara y el enfoque de encerado para otros insectos. Este protocolo se puede aplicar a otros drosófilos con pocas modificaciones, pero otros miembros del suborden Brachycera, como las abejas y los mosquitos, pueden requerir cambios en los pasos de montaje y disección para tener en cuenta las diferencias en el palpo labial y la morfología de la cabeza. La alineación del micromanipulador para la entrega del degustador también puede ser un desafío y requiere pruebas iniciales con la etapa específica del microscopio para la optimización. Si la cera se rompe durante la estimulación, puede producirse fugas por las que el AHL y el saborante en el capilar entran en contacto. Tirar de los capilares y limarlos con una piedra de afilar para que se ajusten más al labelo puede ayudar a evitar que el catante y el AHL entren en contacto. Se deben excluir las moscas con fugas o movimientos cerebrales excesivos. Cuando sea posible, incluya siempre un control positivo para cada animal para asegurarse de que el labelo y los nervios labelares no se dañen por el encerado o la disección. Los ejemplos "dulces" y "amargos" que se muestran aquí se recomiendan como experimentos de control sólidos.
El enfoque de imágenes de calcio in vivo descrito aquí se ha utilizado para cuantificar las respuestas inducidas por el gusto en neuronas gustativas primarias, neuronas de orden superior y toda la ZEE en D. melanogaster para identificar receptores y circuitos gustativos 8,14,17,18,19,20,27,28,30,31, 34,35,36,37,38,39,40,41,
42,43,44,45,46,47,48. Las aplicaciones generalizadas en este organismo modelo se deben a los controladores Gal4 y Gal4 divididos fácilmente disponibles; por lo tanto, la necesidad de que los insectos modificados genéticamente obtengan GCaMP expresada en neuronas específicas de interés es un factor limitante para este enfoque. Afortunadamente, con los avances en la tecnología de edición de genes, esto se está volviendo más accesible para los insectos más allá de los organismos modelo, y recientemente se han reportado respuestas inducidas por el gusto utilizando imágenes de calcio para la plaga Drosophila suzukii49 y para los mosquitos portadores de vectores50. Al igual que con todas las imágenes de calcio, puede ser necesaria una optimización inicial de la relación señal-ruido para las neuronas objetivo de interés. Las señales se pueden mejorar mediante el uso de versiones más brillantes de GCaMP y mediante la expresión de dos copias de GCaMP. La coexpresión de RFP en las neuronas diana puede ayudar a visualizar las neuronas diana en la línea de base y puede servir como control del movimiento del cerebro en regiones que tienen propensión a pulsar.
Este protocolo está diseñado específicamente para aislar la quimiosensación del labelo mediante la extirpación de los tarsos y las antenas, la cera sobre los palpos maxilares y la limitación de la ingestión para que no se estimulen las GRN faríngeas. Sin embargo, se pueden hacer ajustes a este protocolo para incluir la quimiosensación de las GRN tarsales o faríngeas. Si los tarsos se dejan intactos, las patas pueden estimularse solas o además del labelo creando una gran burbuja de solución gustativa en el extremo del capilar. Existe la posibilidad de que una mosca patee y mueva el cubreobjetos si los tarsos se dejan intactos; Por lo tanto, se puede considerar encerar los tarsos cerca de la base para ayudar a prevenir movimientos no deseados. El ejemplo actual incluye el paso de cortar el esófago para evitar la estimulación faríngea de la GRN y para visualizar mejor las proyecciones labelares en la ZEE, pero esta misma preparación ha sido adaptada previamente para cuantificar las respuestas de la GRN faríngea dejando el esófago intacto e imagenizando las proyecciones faríngeas laterales36. Esta aplicación anterior utilizó un estímulo de azúcar apetitivo, que las moscas consumirán libremente para estimular los GRN faríngeos, pero las moscas no consumirán fácilmente un estímulo aversivo para activar los GRN faríngeos amargos, que es una limitación de este enfoque. Una limitación adicional es que las respuestas de los GRN localizados en las alas de Drosophila11 no se pueden estudiar fácilmente con este enfoque.
Si bien las imágenes de calcio in vivo descritas aquí se han convertido en el método estándar para estudiar las respuestas inducidas por el sabor de orden superior 8,18,19,20,28, actualmente existen varios otros enfoques para cuantificar las respuestas de GRN del marcador primario a los saborantes en moscas. El enfoque de imagen de calcio in vivo descrito aquí registra los cambios de GCaMP en las terminales de los axones en el cerebro, pero también se ha utilizado un enfoque ex vivo para cuantificar el cuerpo celular GCaMP en GRNs labelares33. De manera similar, se ha descrito otro enfoque de montaje para obtener imágenes de los cuerpos celulares de GRN labelares o tarsales en moscas intactas51. La electrofisiología sigue siendo una técnica popular y eficaz para estudiar las respuestas de las neuronas gustativas primarias en insectos 13,16,32,52,53,54,55,56,57,58,59,60,64,62,63,64,65. Esto no requiere la necesidad de sensores de calcio codificados genéticamente y es una cuantificación más directa de la actividad neuronal. Sin embargo, las respuestas de una sola sensilla se pueden registrar a la vez, mientras que las imágenes de calcio pueden registrar una población completa de GRN simultáneamente. El enfoque de imágenes de calcio se utilizó para descubrir la dinámica temporal única de las respuestas de "encendido" y "apagado" en GRN con ciertos estímulos27,28, pero un avance reciente en los registros electrofisiológicos a partir de la base de la sensibilidad gustativa en D. melanogaster ahora permite cuantificar las respuestas "apagado" al nivel de los potenciales de acción53. Curiosamente, la modulación de la sensibilidad primaria a la GRN por el hambre se detectó a través de imágenes de calcio, pero no a nivel de potenciales de acción con la electrofisiología29, sin embargo, tanto los registros electrofisiológicos de la punta como las imágenes de calcio pueden capturar un cambio en la sensibilidad de GRN con la dieta30,66. Por lo tanto, la electrofisiología sigue siendo un enfoque importante y complementario a las imágenes de calcio para identificar ligandos y receptores de sabor y para comprender cómo varios factores modulan la sensibilidad de las neuronas receptoras gustativas primarias.
Divulgaciones
Los autores no tienen conflictos de intereses ni nada que revelar.
Agradecimientos
Nos gustaría agradecer al Bloomington Drosophila Stock Center por las existencias de moscas y a los Laboratorios IMF de la Universidad de Vermont por su ayuda en la fabricación de las cámaras de imágenes personalizadas. También nos gustaría agradecer a BioRender por la creación de ilustraciones gráficas y a Kayla Audette por contribuir al diseño de estos gráficos. Este trabajo fue apoyado por nuevos fondos de inicio de laboratorio de la Universidad de Vermont y el premio número 2332375 de la Fundación Nacional de Ciencias. Los gráficos de la Figura 1 se generaron con www.BioRender.com.
Materiales
| Name | Company | Catalog Number | Comments |
| CaCl2 | Sigma-Aldrich | C7902 | For AHL |
| Caffeine | Sigma-Aldrich | C0750 | For a "bitter" taste stimulus |
| Clear nail polish- quick dry | Many vendors | Example: Sally Hansen Xtreme wear (clear) | |
| CO2 fly pad station | Genesee Scientific | 59-122BC | Includes tubing, a gun to initially anesthetize flies, and a pad to deliver continuous anesthesia |
| CO2 supply (cylinders) | Airgas | USP50 | For anesthesia |
| Confocal or two-photon microscope | Many vendors | Upright microscope, high signal to noise and rapid capture capabilities, 10X air immersion objective, 25-40X water immersion objective, accompanying hardware and software | |
| Coverslips | Globe Scientific | 1404-15 | 22 x 22 mm, No 1.5: for this specific imaging chamber, score and cut in half to get 11 x 22 mm coverslips |
| D. melanogaster: Gr64f-Gal4 | Bloomington Drosophila Stock Center | 57669 | For driving GCaMP expression in 'sweet' gustatory receptor neurons of the labellum |
| D. melanogaster: Gr66a-Gal4 | Bloomington Drosophila Stock Center | 57670 | For driving GCaMP expression in 'bitter' gustatory receptor neurons of the labellum |
| D. melanogaster: UAS-GCaMP6f | Bloomington Drosophila Stock Center | 42747 | For getting GCaMP expression when crossed to a Gal4 driver line |
| Dental Waxer | Pearson Dental | 49-00-54 | Digital wax carver, comes with tips that can be modified and sharpened small enough to deliver wax along the fly proboscis |
| Dissection microscope | Many vendors | .63 - 6.3X for optimal viewing but with sufficient working distance to perform dissections under the microscope | |
| Dissection scissors | Fine Science Tools | 15000-08 | This pair or any similar dissection scissors are appropriate |
| Empty pipette tip box | Free- many vendors | For humidity chamber: needs enough space so that the imaging chamber can sit and the lid can close without bumping the chamber | |
| Filter flask | Millipore-Sigma | CLS431097 | For filtering AHL stocks |
| Glass capillary | World Precision Instruments | TW100-4 | This size fits well over the D. melanogaster labellum without needing modification, but other capillaries can be pulled and filed down to an appropriate size |
| HEPES | Sigma-Aldrich | BP310 | For AHL |
| ImageJ (FIJI) | NIH | https://imagej.nih.gov/ij | Image analysis software |
| Imaging Chamber | IMF Labs | Custom item | The custom-made chamber in this example can be ordered at https://www.uvm.edu/research/imf/forms/contact-us. Base: 6061 aluminum, Holding Clamps: Black Delrin (Acetal), Insert: Moisture Resistant polyester (PET). Manual and CNC milling machines for fabrication. |
| KCl | Sigma-Aldrich | P9541 | For AHL |
| Kim wipes | Millipore-Sigma | Z188956 | For humidity chamber, wiping off forceps, removing solutions from capillaries, etc. |
| MgCl2 | Sigma-Aldrich | M9272 | For AHL |
| Micromanipulator | Tritech Research | U-31CF, USM-6, MINJ-4 | This example uses a magnet to attach the micromanipulator to the stage, other configurations are possible |
| NaCl | Sigma-Aldrich | S7653 | For AHL |
| NaH2PO4 | Sigma-Aldrich | 567545 | For AHL |
| NaHCO3 | Sigma-Aldrich | S6014 | For AHL |
| p10 pipette and tips | Many vendors | For filling the capillaries with tastants | |
| p200 pipette and tips | Many vendors | For AHL | |
| Parafin wax | Many vendors | White/clear block of wax often found in craft stores | |
| Ribose | Sigma-Aldrich | W379301 | For AHL |
| Semi-sharp forceps | Fine Science Tools | 11252-20 | Blunted to approximately tip size C |
| Sharp forceps | Fine Science Tools | 11252-20 | Sharpened to tip size A |
| Sharpening stone | Fine Science Tools | 29000-00 | For modifying dental waxer tips and forceps |
| Sucrose | Sigma-Aldrich | S0389 | For a "sweet'"taste stimulus |
| Toothpick | Many vendors | Small tip for nail polish application |
Referencias
- Wangler, M. F., Yamamoto, S., Bellen, H. J. Fruit flies in biomedical research. Genetics. 199 (3), 639-653 (2015).
- Ryu, L., Kim, S. Y., Kim, A. J. From photons to behaviors: Neural implementations of visual behaviors in Drosophila. Front Neurosci. 16, 883640 (2022).
- Joseph, R. M., Carlson, J. R. Drosophila chemoreceptors: A molecular interface between the chemical world and the brain. Trends Genet. 31 (12), 683-695 (2015).
- Montell, C. Drosophila sensory receptors-a set of molecular Swiss Army knives. Genetics. 217 (1), 1-34 (2021).
- Scott, K. Gustatory processing in Drosophila melanogaster. Annu Rev Entomol. 63, 15-30 (2018).
- Starostina, E., et al. A Drosophila DEG/ENaC subunit functions specifically in gustatory neurons required for male courtship behavior. J Neurosci. 32 (13), 4665-4674 (2012).
- Chen, Y., Amrein, H. Ionotropic receptors mediate Drosophila oviposition preference through sour gustatory receptor neurons. Curr Biol. 27 (18), 2741-2750.e4 (2017).
- Guillemin, J., et al. Taste cells expressing ionotropic receptor 94e reciprocally impact feeding and egg laying in Drosophila. Cell Rep. 43, 114625 (2024).
- Ostojic, I., et al. Positive and negative gustatory inputs affect Drosophila lifespan partly in parallel to dFOXO signaling. Proc Natl Acad Sci U S A. 111 (22), 8143-8148 (2014).
- Stocker, R. F. The organization of the chemosensory system in Drosophila melanogaster: A review. Cell Tissue Res. 275 (1), 3-26 (1994).
- Raad, H., Ferveur, J. -. F., Ledger, N., Capovilla, M., Robichon, A. Functional gustatory role of chemoreceptors in Drosophila wings. Cell Rep. 15 (7), 1442-1454 (2016).
- Montell, C. A taste of the Drosophila gustatory receptors. Curr Opin Neurobiol. 19 (4), 345-353 (2009).
- Weiss, L. A., Dahanukar, A., Kwon, J. Y., Banerjee, D., Carlson, J. R. The molecular and cellular basis of bitter taste in Drosophila. Neuron. 69 (2), 258-272 (2011).
- Jaeger, A. H., et al. A complex peripheral code for salt taste in Drosophila. Elife. 7, 37167 (2018).
- Freeman, E. G., Dahanukar, A. Molecular neurobiology of Drosophila taste. Curr Opin Neurobiol. 34, 140-148 (2015).
- Delventhal, R., Kiely, A., Carlson, J. R. Electrophysiological recording from Drosophila labellar taste sensilla. J Vis Exp. 84, e51355 (2014).
- Marella, S., et al. Imaging taste responses in the fly brain reveals a functional map of taste category and behavior. Neuron. 49 (2), 285-295 (2006).
- Shiu, P. K., Sterne, G. R., Engert, S., Dickson, B. J., Scott, K. Taste quality and hunger interactions in a feeding sensorimotor circuit. Elife. 11, e79887 (2022).
- Li, J., Dhaliwal, R., Stanley, M., Junca, P., Gordon, M. D. Functional imaging and connectome analyses reveal organizing principles of taste circuits in Drosophila. bioRxiv. , (2024).
- Junca, P., Stanley, M., Musso, P. -. Y., Gordon, M. D. Modulation of taste sensitivity by the olfactory system in Drosophila. bioRxiv. , (2021).
- Elliott, D. A., Brand, A. H. The GAL4 system: A versatile system for the expression of genes. Drosophila Methods Protoc. , 79-95 (2008).
- Riabinina, O., Potter, C. J., Dahmann, C. . Drosophila: Methods and Protocols. , 53-78 (2016).
- Diegelmann, S., Bate, M., Landgraf, M. Gateway cloning vectors for the LexA-based binary expression system in Drosophila. Fly. 2 (4), 236-239 (2008).
- Zhang, Y., et al. Fast and sensitive GCaMP calcium indicators for imaging neural populations. Nature. 615 (7954), 884-891 (2023).
- Ohkura, M., et al. Genetically encoded green fluorescent Ca2+ indicators with improved detectability for neuronal Ca2+ signals. PLoS One. 7 (12), e51286 (2012).
- Arntsen, C., Guillemin, J., Audette, K., Stanley, M. Tastant-receptor interactions: Insights from the fruit fly. Front Nutr. 11, 1394697 (2024).
- Stanley, M., Ghosh, B., Weiss, Z. F., Christiaanse, J., Gordon, M. D. Mechanisms of lactic acid gustatory attraction in Drosophila. Curr Biol. 31 (16), 3525-3537.e6 (2021).
- Devineni, A. V., Deere, J. U., Sun, B., Axel, R. Individual bitter-sensing neurons in drosophila exhibit both on and off responses that influence synaptic plasticity. Curr Biol. 31 (24), 5533-5546.e7 (2021).
- Inagaki, H. K., et al. Visualizing neuromodulation in vivo: Tango-mapping of dopamine signaling reveals appetite control of sugar sensing. Cell. 148 (3), 583-595 (2012).
- May, C. E., et al. High dietary sugar reshapes sweet taste to promote feeding behavior in drosophila melanogaster. Cell Rep. 27 (6), 1675-1685.e7 (2019).
- May, C. E., Rosander, J., Gottfried, J., Dennis, E., Dus, M. Dietary sugar inhibits satiation by decreasing the central processing of sweet taste. Elife. 9, e54530 (2020).
- Jiao, Y., Moon, S. J., Wang, X., Ren, Q., Montell, C. Gr64f is required in combination with other gustatory receptors for sugar detection in Drosophila. Curr Biol. 18 (22), 1797-1801 (2008).
- Chen, H. -. L., Stern, U., Yang, C. -. H. Molecular control limiting sensitivity of sweet taste neurons in Drosophila. Proc Natl Acad Sci USA. 116 (40), 20158-20168 (2019).
- Devineni, A. V., Sun, B., Zhukovskaya, A., Axel, R. Acetic acid activates distinct taste pathways in Drosophila to elicit opposing, state-dependent feeding responses. Elife. 8, e47677 (2019).
- Engert, S., Sterne, G. R., Bock, D. D., Scott, K. Drosophila gustatory projections are segregated by taste modality and connectivity. Elife. 11, e78110 (2022).
- Ledue, E. E., et al. Starvation-induced depotentiation of bitter taste in Drosophila. Curr Biol. 26 (21), 2854-2861 (2016).
- Mcdowell, S. A. T., Stanley, M., Gordon, M. D. A molecular mechanism for high salt taste in Drosophila. Curr Biol. 32 (14), 3070-3081.e7 (2022).
- Deere, J. U., Devineni, A. V. Taste cues elicit prolonged modulation of feeding behavior in Drosophila. iScience. 25 (10), 105159 (2022).
- Deere, J. U., et al. Selective integration of diverse taste inputs within a single taste modality. Elife. 12, (2023).
- Chu, B., Chui, V., Mann, K., Gordon, M. D. Presynaptic gain control drives sweet and bitter taste integration in Drosophila. Curr Biol. 24 (17), 1978-1984 (2014).
- Yao, Z., Scott, K. Serotonergic neurons translate taste detection into internal nutrient regulation. Neuron. 110 (6), 1036-1050.e7 (2022).
- Cameron, P., Hiroi, M., Ngai, J., Scott, K. The molecular basis for water taste in Drosophila. Nature. 465 (7294), 91-95 (2010).
- Jourjine, N., Mullaney, B. C., Mann, K., Scott, K. Coupled sensing of hunger and thirst signals balances sugar and water consumption. Cell. 166 (4), 855-866 (2016).
- Kim, H., Kirkhart, C., Scott, K. Long-range projection neurons in the taste circuit of Drosophila. Elife. 6, e23386 (2017).
- Kirkhart, C., Scott, K. Gustatory learning and processing in the Drosophila mushroom bodies. J Neurosci. 35 (15), 5950-5958 (2015).
- Steck, K., et al. Internal amino acid state modulates yeast taste neurons to support protein homeostasis in Drosophila. Elife. 7, e31625 (2018).
- Münch, D., Goldschmidt, D., Ribeiro, C. The neuronal logic of how internal states control food choice. Nature. 607 (7920), 747-755 (2022).
- Taisz, I., et al. Generating parallel representations of position and identity in the olfactory system. Cell. 186 (12), 2556-2573.e2 (2023).
- Cavey, M., et al. Increased sugar valuation contributes to the evolutionary shift in egg-laying behavior of the fruit pest Drosophilasuzukii. PLoS Biol. 21 (12), e3002432 (2023).
- Jové, V., et al. Sensory discrimination of blood and floral nectar by Aedes aegypti mosquitoes. Neuron. 108 (6), 1163-1180.e2 (2020).
- Shankar, S., Calvert, M. E., Yew, J. Y. Measuring physiological responses of Drosophila sensory neurons to lipid pheromones using live calcium imaging. J Vis Exp. (110), e53392 (2016).
- Dahanukar, A., Lei, Y. -. T., Kwon, J. Y., Carlson, J. R. Two gr genes underlie sugar reception in Drosophila. Neuron. 56 (3), 503-516 (2007).
- Dweck, H. K. M., Carlson, J. R. Base recording: A technique for analyzing responses of taste neurons in Drosophila. J Vis Exp. (205), e66665 (2024).
- Dweck, H. K. M., Talross, G. J. S., Luo, Y., Ebrahim, S. A. M., Carlson, J. R. Ir56b is an atypical ionotropic receptor that underlies appetitive salt response in Drosophila. Curr Biol. 32 (8), 1776-1787.e4 (2022).
- Park, J., Carlson, J. R. Physiological responses of the Drosophila labellum to amino acids. J Neurogenet. 32 (1), 27-36 (2018).
- Wang, W., et al. Sugar sensation and mechanosensation in the egg-laying preference shift of Drosophilasuzukii. Elife. 11, e81703 (2022).
- Xiao, S., Baik, L. S., Shang, X., Carlson, J. R. Meeting a threat of the Anthropocene: Taste avoidance of metal ions by Drosophila. Proc Natl Acad Sci USA. 119 (25), e2204238119 (2022).
- Ganguly, A., et al. Requirement for an otopetrin-like protein for acid taste in Drosophila. Proc Natl Acad Sci USA. 118 (51), e2110641118 (2021).
- Lee, Y., Moon, S. J., Montell, C., Snyder, S. H. Multiple gustatory receptors required for the caffeine response in Drosophila. Proc Natl Acad Sci USA. 106 (11), 4495-4500 (2009).
- Lee, Y., Poudel, S., Kim, Y., Thakur, D., Montell, C. Calcium taste avoidance in Drosophila. Neuron. 97 (1), 67-74.e4 (2018).
- Mi, T., et al. Alkaline taste sensation through the alkaliphile chloride channel in Drosophila. Nat Metab. 5 (3), 466-480 (2023).
- Rimal, S., et al. Mechanism of acetic acid gustatory repulsion in Drosophila. Cell Rep. 26 (6), 1432-1442.e4 (2019).
- Zhang, Y. V., Ni, J., Montell, C. The molecular basis for attractive salt-taste coding in Drosophila. Science. 340 (6138), 1334-1338 (2013).
- Aryal, B., Dhakal, S., Shrestha, B., Lee, Y. Molecular and neuronal mechanisms for amino acid taste perception in the Drosophila labellum. Curr Biol. 32 (6), 1376-1386.e4 (2022).
- Shrestha, B., Aryal, B., Lee, Y. The taste of vitamin C in Drosophila. EMBO Rep. 24 (6), e56319 (2023).
- Ganguly, A., Dey, M., Scott, C., Duong, V. -. K., Arun Dahanukar, A. Dietary macronutrient imbalances lead to compensatory changes in peripheral taste via independent signaling pathways. J Neurosci. 41 (50), 10222 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados