Method Article
ב Vivo הדמיית סידן של תגובות עצביות הנגרמות על ידי טעם בדרוזופילה בוגרת
In This Article
Summary
גישת הדמיית סידן מאפשרת להקליט תגובות הנגרמות על ידי טעם במוחם של זבובים ערים בזמן שתמיסה מוחלת על התווית. תגובות טעם ראשוניות ב-Drosophila melanogaster משמשות כדוגמה, אך ניתן להתאים פרוטוקול זה לחקר נוירונים במורד הזרם או מינים אחרים.
Abstract
במשך כמעט שני עשורים, הדמיית סידן in vivo הייתה שיטה יעילה למדידת תגובות תאיות לגירויי טעם באורגניזם מודל זבוב הפירות, Drosophila melanogaster. חוזק מרכזי של מתודולוגיה זו הוא יכולתה לתעד תגובות עצביות הנגרמות על ידי טעם בבעלי חיים ערים ללא צורך בהרדמה. גישה זו משתמשת במערכות ביטוי בינאריות (למשל, Gal4-UAS) כדי לבטא את אינדיקטור הסידן GCaMP בתאי עצב ספציפיים מעניינים. פרוטוקול זה מתאר הליך שבו זבובים המבטאים GCaMP מותקנים עם התווית ממוקמת בצורה מאובטחת, מה שמאפשר להקליט פלואורסצנטיות במוח ברזולוציה של אלפית שנייה תחת מיקרוסקופ קונפוקלי בזמן שתמיסה מוחלת על התווית, ומגרה את כל רגישות הטעם של התווית. הדוגמאות סיפקו התמקדות בתגובות סידן בתאי עצב ראשוניים של קולטני טעם של D. melanogaster. עם זאת, ניתן להתאים גישה זו כדי להקליט מנוירונים אחרים בעלי עניין במוח של דרוזופילידים או מיני חרקים אחרים. שיטת הדמיה זו מאפשרת לחוקרים להקליט בו זמנית תגובות סידן קולקטיביות מקבוצות של נוירונים טעמיים על פני התווית, ומשלימות הקלטות קצה אלקטרופיזיולוגיות המכמתות פוטנציאל פעולה מנוירונים בודדים. טכניקת הדמיית הסידן in vivo המתוארת כאן הייתה חיונית בחשיפת מנגנונים מולקולריים ותאיים של כימותרפיה, זיהוי דפוסי תגובה זמניים ייחודיים בנוירוני טעם ראשוניים, חקירת מנגנונים של אפנון טעם וחקר עיבוד טעם במעגלים במורד הזרם.
Introduction
זבוב הפירות, Drosophila melanogaster, ידוע בזכות כלי המחקר הגנטי רבי העוצמה הזמינים באורגניזם מודל זה. כלים אלה מספקים את היכולת לתפעל בקלות גנים ספציפיים בתאים ממוקדים, מה שהופך אותו לאידיאלי לחקר מעגלים עצביים בסיסיים כגון ראייה וכימותרפיה 1,2,3. הריון, באמצעות כימו-תחושת מגע, הוא מסלול עצבי מרכזי המווסת התנהגויות המעורבות בהאכלה, הזדווגות, רבייה, ובסופו של דבר, הישרדות וכושר של בעלי חיים 4,5,6,7,8,9. הבנת האופן שבו מידע כימו-סנסורי חשוב זה מקודד ומועבר דורשת תיאור פעילות הנוירונים במעגלים המופעלים על ידי גירוי טעם.
ב-D. melanogaster, נוירונים של קולטני טעם חיצוניים (GRNs) ממוקמים על הרגליים הקדמיות, החרטום והכנפיים10,11. התווית, בקצה החרטום, מכילה מבנים דמויי שיער הנקראים sensilla שניתן למפות לפי המורפולוגיה שלהם על סמך גודל: ארוך (סוג L), בינוני (סוג I) וקצר (סוג S)10. רוב ה-GRNs מרוכזים באיבר חישה זה, כאשר כל סנסילה מכילה 2-4 סוגים שונים של GRNs כך שכל אופן טעם מפוזר על פני התווית 12,13,14,15. בעוד שניתן להשתמש ברישומי קצה אלקטרופיזיולוגיים כדי לכמת פוטנציאל פעולה המגיע מ-GRNs ב-sensilla16 יחיד, in vivo, ניתן להשתמש בהדמיית סידן כדי לבודד את הפעילות של סוג מסוים של GRN על פני התווית המלאה14,17. ניתן להשתמש באותה טכניקת הדמיית סידן גם כדי לחקור תגובות עצביות במעגלי טעם במורד הזרם 18,19,20. הדמיית סידן דורשת מערכות ביטוי בינאריות, כגון Gal4-UAS 21,22,23, וחציית קו נהג המכיל מפעילי שעתוק ספציפיים לתא לקו אפקטור כדי לקבל ביטוי של GCaMP בתאי עצב מעניינים. כאשר רמות הסידן התוך-תאיות עולות, מדדי הסידן המקודדים גנטית הללו עולים בעוצמת הקרינה כך שרמת הקרינה מתואמת עם שינויים בפעילות העצבית24,25.
כאן מתוארת שיטה לשימוש בהדמיית סידן כדי לצפות בתגובות עצביות לגירויי טעם in vivo. המטרה הכוללת של שיטה זו היא לעורר רק את ה-GRNs המתויגים לכמת תגובות עצביות הנגרמות על ידי טעם במוחם של זבובים ערים. ניתנות דוגמאות לשימוש בשיטה זו כדי לתעד תגובות ב-GRNs העיקריים של התווית ב-D. melanogaster, ונדונים היתרונות והאתגרים של שימוש בגישה זו. תכשיר זה פותח כדי לאפשר לנסיינים את היכולת ליישם תמיסת טסטנט על תווית זבוב משותק תחת מיקרוסקופ קונפוקלי כדי לתעד תגובות עצביות כאשר כל איבר החישה שקוע בתמיסה, המתרחשת בסביבה טבעית. ניתן להשתמש בגישת הדמיית הסידן in vivo המתוארת כאן כדי לחשוף אינטראקציות חדשניות בין טעם-קולטן 8,14,26,27, פרטים זמניים של תגובות GRN 27,28, מנגנונים מולקולריים של אפנון GRN29,30 ועיבוד טעם במעגלים במורד הזרם 8,18,19,20, 28,31.
Protocol
פרטי הריאגנטים והציוד המשמש במחקר זה מפורטים בטבלת החומרים.
1. הכנת תמיסה דמוית המולימפה למבוגרים (AHL)
- הכן תמיסת מלאי המכילה 108 מ"מ של NaCl, 5 מ"מ של KCl, 4 מ"מ של NaHCO3, 1 מ"מ של NaH2PO4, 5 מ"מ של HEPES ו-15 מ"מ של ריבוז.
הערה: ריבוז משמש כסוכר לא אנרגטי לשמירה על אוסמולריות מבלי לשנות את רמות החומרים המזינים במוח. - התאם את ה-pH של תמיסה זו ל-7.5 לפני סינון ואחסון ב-4 מעלות צלזיוס. בדוק את האוסמולריות של ה-AHL לאחר התאמת ה-pH כדי להבטיח עקביות בין התכשירים.
- הכינו מלאי נפרד של 1 מ' של CaCl2 ו-1 מ' של MgCl2, סננו ואחסנו בטמפרטורת החדר.
- כדי להכין מנה של מלאי ה-AHL העיקרי, הוסף נפח קטן של הסידן והמגנזיום כדי לקבל ריכוזים סופיים של 2 מ"מ סידן ו-8.2 מ"מ מגנזיום. ניתן לאחסן את ה-AHL הזה בטמפרטורה של 4 מעלות צלזיוס ולהשתמש בו עד חודש, תוך שימוש בכמויות קטנות המובאות לטמפרטורת החדר לניסויים.
2. הרכבת זבובים על תא ההדמיה
- לפני הרכבת זבובים, השחיזו את הקצה של שעווה דנטלית לתוך קטנה ומחודדת באמצעות אבן השחזה (איור 1D). חבר את הקצה המושחז לשעווה והפעל אותו לחימום מראש. הגדרות החום יהיו תלויות בסוג ובאורך הקצה: יש צורך בטמפרטורה מינימלית המאפשרת לשעווה להישאר נמסה במגע (50.5 מעלות צלזיוס עובד בדוגמה זו).
הערה: ניתן לעטוף חוט סביב קצה השעווה הדנטלית כדי להדביק קצה מתכת מושחז כחלופה. - יש להרדים בעדינות 1-5 זבובים (בהתאם לפרוטוקולים המאושרים על ידי המוסד). צמצם את זמן החשיפה להרדמה, שכן תקופות ממושכות של חשיפה ל-CO2 או לקור עלולות להשפיע על ההתנהגות. עבור CO2, השתמש בכרית זבוב המספקת זרימה רציפה ואחידה של 99.9% CO2 בקצב של 5 ליטר לדקה תחת מיקרוסקופ דיסקציה.
- השתמש במספריים לדיסקציה כדי להסיר חלקים מהרגליים על ידי חיתוך הרגליים האמצעיות והאחוריות במפרק הירך/שוק והרגליים הקדמיות בטרוכנטר. השתמש במלקחיים קהים כדי לעזור לתפעל את הזבוב. חיתוך הטרסי ימנע תחושת טרסל ובעיטה בכיסוי או בממריץ הטעם.
- הרימו את הזבוב מהכנפיים באמצעות מלקחיים קהים כדי למקם את הזבוב כך שהראש יהיה מעל חריץ צוואר הרחם הממוקד של תא ההדמיה, אך הגוף נמצא מתחת. כדאי להתחיל את הזבוב במלואו ימינה או שמאלה. בעזרת הצד הקהה של המספריים והמלקחיים הקהים, דחף בעדינות את הראש ובית החזה בו זמנית לתוך החריץ.
- לאחר שנכנס היטב לחריץ, דחף את הזבוב לחלק האחורי של החריץ ומקם אותו בעדינות כך שהזבוב יפנה לקדמת החדר. הימנע מסיבוב הראש רחוק מדי מחוץ ליישור עם בית החזה.
- חזור על הפעולה עבור כמה זבובים שצריך (תא הדמיה זה יכול להכיל עד 5 זבובים).
- אספו טיפה קטנה של לק על קצה הקיסם ומרחו שכבה דקה כדי להדק את ראש הזבוב לתא ההדמיה.
הערה: האזור המדויק למריחת הלק תלוי באיזה חלק במוח מצולם. אם מדמים את ה-SEZ (כפי שמוצג כאן) או אזורים מדיאליים נחותים אחרים, ניתן למרוח לק בנדיבות על החלק העליון של ראש הזבוב, אך כדי לדמות אזורים מדיאליים מעולים, ניתן למרוח לק באופן מינימלי על החלק העליון של הראש ולהוסיף לרוחב ליד העיניים כדי להשאיר אזור זה פנוי לדיסקציה. פרוטוקול זה מותאם לגירוי טעם בלבד ללא חוש הריח, אך אם לק נדיף מהווה דאגה, השתמש בשעווה או בדבק UV כשיטות חלופיות לאבטחת ראש הזבוב.
3. שעווה של הפרובוסקיס במצב מורחב
- הרם את השעווה ביד אחת ואסוף טיפת שעווה קטנה בקצה.
- מצד שני, השתמש במלקחיים חדים למחצה כדי לתפוס מישוש מקסילרי אחד ולמשוך בעדינות החוצה ולהחזיק את הפרובוסקיס בהארכה מלאה.
הערה: היזהר לאחוז רק במישוש המקסילרי מכיוון שצביטה של הקוטיקולה על הפרובוסקיס מגדילה את פוטנציאל הנזק. אל תמשיך אם הפרובוסקיס צבט או שציפורן הפרובוסקיס מנוקבת. פוטר זבוב קטן עשוי לשמש כחלופה למלקחיים כדי לשלוף את הפרובוסקיס באמצעות יניקה בזמן מריחת השעווה. - גע בקצה השעווה בתא ליד בסיס הפרובוסקיס עד שהשעווה מתחילה לזרום, ואז זז כדי ליצור מגע עם בסיס החוטם. שעווה באמצע הפיר, אך הימנע מלגעת ב-Labellar sensillae עם השעווה או השעווה. השעווה בצד זה תחזיק את הפרובוסקיס במקומו. אל תמשיכו אם השעווה או השעווה נוגעים בשעווה בכל עת.
- מרחו שעווה בשיטה לעיל לצד השני, וצרו גשר רציף של שעווה מעל החוטם.
- הארך את הפרובוסקיס במלואו ישר ככל האפשר. במידת הצורך, ניתן לבצע הזזת הפרובוסקיס על ידי חימום מחדש של השעווה ודחיפה עדינה של הפרובוסקיס למצב הרצוי.
- חזור על הפעולה עבור זבובים אחרים שיורכבו באותו תא.
- כבה את CO2 או הסר זבובים מהרדמת קרח. הנח זבובים רכובים בתא לחות למשך 60 דקות להתאוששות (קופסת קצה פיפטה נקייה וריקה עם מגבונים רטובים ונטולי מוך).
4. דיסקציה כדי לחשוף את אזור העניין במוח
- הסר את הזבובים מתא הלחות. זבובים חייבים להיות חיים בבירור, להזיז באופן פעיל את הבטן, הרגליים והאנטנות שלהם. הגדר את המיקרוסקופ הקונפוקלי או הדו-פוטוני לפני הדיסקציה.
- הפעל את השעווה כדי לתקן שברים פוטנציאליים בשעווה במהלך החיתוך והכן AHL בטמפרטורת החדר.
- בעזרת מלקחיים חדים מאוד, צבטו את שתי האנטנות, ואז צבטו את הציפורן כדי ליצור חור להכנסת צד אחד של המלקחיים החדים. העבירו את המלקחיים מתחת לציפורן כדי להסיר אותה מהאזור המכסה את אזור העניין במוח. איור 1F מציין X מעל אזורים של הקוטיקולה שיש לכוון אליהם עם המלקחיים להסרה.
- שטפו את המוח החשוף ב-AHL על ידי מריחה נדיבה של AHL (~100 מיקרוליטר) על הראש, ולאחר מכן הסרת כל השכבה מלבד שכבה דקה של AHL כדי למנוע מהמוח להתייבש.
הערה: אם השעווה נשברת בשלב כלשהו ויש צורך לתקן אותה, הסר בקצרה את כל ה-AHL סביב הראש לפני חימום מחדש של השעווה כדי לאבטח מחדש את הפרובוסקיס במצב מורחב. - בעזרת מלקחיים חדים, הסר שקי אוויר וכל פסולת גדולה המכסה את המוח. הימנע מחדירה למוח על ידי שמירה על קצות המלקחיים גלויים.
- יש לשטוף עם AHL ~ 3 פעמים כדי להסיר את כל הפסולת הקטנה.
- ודא שאזור העניין במוח נראה בבירור. כדי לדמות באופן ספציפי את האזור התת-ושטי (SEZ) כמו בדוגמה זו, חתכו את הוושט בבסיס ליד הפרובוסקיס וליד הנקודה שבה הוא עובר דרך המוח על ידי צביטה עם מלקחיים חדים מאוד והסרת החלק הזה כדי לחשוף את ה-SEZ.
הערה: זבובים אינם יכולים לבלוע תמיסות לאחר הסרת הוושט, ולא יכולה להתרחש הפעלת GRN של הלוע. - מתחת למיקרוסקופ החיתוך, מקם את החלקת הכיסוי בגודל 10 מ"מ על 20 מ"מ לתוך החריץ הזוויתי של תא ההדמיה. ודא שהוא מונח בבסיס הפרובוסקיס מבלי לשבור את השעווה. אסור שקצה התווית ייגע בכיסוי.
5. הדמיה וגירוי טעם
- הפעל את המיקרוסקופ הקונפוקלי או הדו-פוטוני והיה מוכן לצילום תמונה. הגדר מיקרומניפולטור עם צינור נימי הממוקם כדי להעביר את הטעמים לזבוב בזמן שהם נמצאים בשלב המיקרוסקופ.
הערה: הדמיה דו-פוטונית יכולה ללכוד פלואורסצנטיות מתאי עצב שנמצאים עמוק יותר ברקמת המוח. - טען ~ 2 מיקרוליטר מים (או בקרה שלילית אחרת) לתוך הצינור הנימי של
ממריץ על במת המיקרוסקופ. - מצא את הזבוב המנותח והתמקד בתווית באמצעות שדה בהירות טבילה באוויר פי 10. יישר את הנימים עם התווית תחת תצוגה זו. ניתן לכלול מצלמות נוספות המכוונות אל תווית הזבוב כדי לראות את יישור הנימים עם הזבוב מזוויות מרובות.
הערה: ודא שכל רגישי התוויות מגורים עם התמיסה במהלך היישור; אם מיקום הממריץ או התווית אינו מאונך מספיק לכך, התאם בהתאם. ניתן למשוך נימים ולהגיש אותם עם אבן השחזה כדי לספק התאמה הדוקה יותר סביב התווית. - השאר את הנימים ממוקמים ישירות מול התווית, קרוב אך לא נוגע.
- הזיזו את השלב כך שאזור העניין במוח יהיה ממורכז ועברו ליעד טבילה במים בהגדלה גבוהה יותר (פי 40 בדוגמה זו).
- הוסף כ-200 מיקרוליטר של AHL על גבי המוח כדי ליצור קשר עם המטרה לטבילה. הסר בועות.
- כוונו את המיקוד באמצעות שדה בהיר כדי לנוע בזהירות במישור ה-z כדי למצוא את קצה הקוטיקולה שהוסר ולמרכז את אזור העניין במוח.
- עבור להספק לייזר של 488 ננומטר כדי למצוא ביטוי GCaMP באזור העניין.
הערה: בהתאם לקו הדרייבר ולגרסת ה-GCaMP המשמשת, ייתכן שיהיה צורך באופטימיזציה ראשונית כלשהי כדי להגביר את האות לרעש עבור הכנות בודדות. ביטוי משותף של RFP יכול להיות מועיל לנוירונים עם פלואורסצנטיות GCaMP נמוכה. - הכן אוסף תמונות בהילוך מהיר. המהירות תהיה תלויה במיקרוסקופ הספציפי ובאות GCaMP, אך לכידת תמונה אחת לפחות כל ~100 אלפיות השנייה היא אופטימלית.
הערה: לכידת מישור Z יחיד של פלואורסצנטיות לאורך זמן תייעל את מהירות הלכידה כדי לספק קינטיקה מפורטת של סידן. ערימות תמונות שצולמו במספר מישורי Z בכל נקודת זמן עשויות להאט את קצב הלכידה, אך יתעדו תגובות על פני נויריטים שנמצאים בעומקים שונים ברקמה. - לאחר איסוף לפחות 5 שניות של פלואורסצנטיות בסיסית, הזז ידנית את הממריץ כך שהנימים יכסו את התווית למשך פרק זמן מסוים (5 שניות בדוגמה זו), ואז הסר את הגירוי ולכוד למשך זמן רב ככל שתרצה.
- הסר את ה-AHL וחזור לשדה בהיר פי 10 כדי להבטיח שהכיסוי, הממריץ והתווית עדיין באותו מיקום.
הערה: אם הסטימולטור אינו מיושר היטב עם התווית או מסובב רחוק מדי, ניתן להזיז את התווית, או שהנימים יכולים לפגוע בתא ההדמיה, מה שעלול לשבור את השעווה וליצור דליפה מה-AHL. - הסר את תא ההדמיה. השתמש במגבון נטול מוך כדי להסיר את התמיסה הראשונה ולשטוף את הפיפטה במים. לאחר מכן, פיפטה ~2 מיקרוליטר של הטסטנט הבא לתוך הצינור הנימים.
- העבר את תא ההדמיה בחזרה ל-stagה וחזור על שלבים 5.4-5.12 עבור פתרון זה.
הערה: מתח הפנים הגבוה של רוב הטעמים מציג שאריות כימיקלים מהישארות על תווית הזבוב. עם זאת, אם הטסטנטים רוויים מאוד או צמיגים, ניתן להעביר מים מעל התווית מספר פעמים כדי לשטוף את איבר החישה לפני הגירוי הבא. - חזור על הפעולה עבור כמה פתרונות שתרצה עבור זבוב זה.
- חזור לשלב 3 כדי להכין את הזבוב הבא להדמיה.
6. ניתוח תמונה
- פתח את ערימת התמונות לניתוח בתוכנת עיבוד תמונה. במידת הצורך, בצע חיסור רקע באמצעות אזור מחוץ לאות GCaMP.
- בחר אזור עניין צר (ROI) סביב ההקרנות לכימות באמצעות הכלי ביד חופשית או צורה וודא שהבחירה מוחלת על כל התמונות בערימה.
- צור רשימה של קריאות הקרינה לאורך זמן עבור החזר ROI זה וייצא אותו לגיליון אלקטרוני להמשך עיבוד. השתמש בפרופיל ציר ה-Z של העלילה ב-ImageJ (FIJI) או בפונקציה דומה בתוכנת עיבוד התמונה לבחירה.
- בגיליון האלקטרוני, בחר 10 נקודות זמן רצופות במהלך ההקלטה הבסיסית בשלב 5.10 כתוכנית בסיסית מייצגת. חשב את הממוצע וסטיית התקן.
- כדי לקבל ΔF/F באחוזים, חשב ((F - ממוצע קו בסיס F)/ממוצע בסיסי F)*100) עבור כל נקודת זמן. כדי לקבל ΔF/F כציון z, חשב ((F - קו בסיס ממוצע F)/קו בסיס סטיית תקן F) עבור כל נקודת זמן.
- כדי לחשב את שיא השינוי בקרינה במהלך הגירוי, בחרו 3 נקודות רצופות עם הקרינה הגבוהה ביותר וחשבו את הממוצע.
- חזור על הפעולה עבור כל ערימת תמונות על פני גירויים וזבובים.
הערה: התאם שלבים אלה לפי הצורך בהתבסס על המיקרוסקופ הספציפי, איכות האות ותוכנת ניתוח התמונה המועדפת.
תוצאות
איור 1 מספק פרטים על תא ההדמיה (איור 1A,B) וקצה השעווה (איור 1D) המשמשים בתכשיר זה. איור 1 גם ממחיש את השלבים העיקריים של ההליך של הרכבת זבובים (איור 1C), שעווה של הפרובוסקיס למקומו (איור 1E), ניתוח של אזור המוח המעניין (איור 1F), וגירוי התווית עם טסטנט תוך כדי רישום פלואורסצנטיות במוח (איור 1G). כדי לכמת תגובות הנגרמות על ידי טעם בתאי עצב ראשוניים של קולטני טעם (GRNs) של Drosophila melanogaster, זבובים עם Gr64f-Gal4, ביטוי מניע של UAS-GCaMP6f הופקו כדי לקבל את אינדיקטור הסידן המתבטא גנטית בכל ה-GRNs ה"מתוקים" של התווית 14,27,30,32,33,34,35. לצורך ניסויים אלה נעשה שימוש במיקרוסקופ קונפוקלי עם הרכיבים הבאים: מיקרוסקופ פלואורסצנטי זקוף עם מצלמת sCMOS של 40 פריימים לשנייה, מטרות של פי 10 ו-40, קונפוקל דיסק מסתובב, פולטות 488 דיכרואיות ולייזרים במצב מוצק של 488 ננומטר. המטרה של פי 40 הייתה שקועה ב-AHL והתמקדה באזור המוח של ה-SEZ כדי לאתר את אות ה-GCaMP הבסיסי במסופי האקסון של ה-GRNs התוויות האלה (איור 2A). תמונת פלואורסצנטיות נלכדה כל 100 אלפיות השנייה במהלך קו הבסיס (ללא גירוי), במהלך 5 שניות של גירוי טעם (הממריץ נע מעל התווית), ואחרי הגירוי עד שהפלואורסצנטיות חזרה לקו הבסיס (איור 2A,B). מים שימשו כבקרה שלילית, וסוכרוז 1 M שימש כביקורת חיובית. השינוי היחסי בקרינה חושב כ-ΔF/F (ציון z) עבור 13 זבובים, ושורטט לאורך זמן כדי להראות את הקינטיקה של תגובות הסידן במהלך גירוי הטעם (איור 2B). שיא ה-ΔF/F (z-score) תוכנן ושימש להשוואות סטטיסטיות כדי להצביע על כך שתגובת הסוכרוז בתאים אלה גבוהה משמעותית מאשר במים (איור 2C). טכניקה זו לוכדת של-GRNs "מתוקים" יש שיא חזק עם הופעת סוכרוז שנשאר גבוה עם דעיכה מסוימת לאורך תקופת הגירוי.
לשם השוואה, פרוטוקול זה חזר על עצמו בזבובים עם דרייבר אחר, Gr66a-Gal4, המבטא UAS-GCaMP6f באופן ספציפי בכל ה-GRNs ה"מרים" בתווית 14,17,28,34,36. באופן דומה, מסופי האקסון של GRNs אלה היו ממוקמים ב-SEZ: שימו לב שדפוס ההקרנה שונה מ-GRNs חישת הסוכר (איור 2D). הקרינה נלכדה ונותחה כמו קודם, למעט 100 מ"מ קפאין, ששימש כבקרה חיובית. העקומה הממוצעת מ-11 זבובים מראה שיא חזק עם תחילת גירוי הקפאין, אולם יש גם תגובת "כבוי" קטנה עם הסרת גירוי שידוע שמתרחשת עם גירויים מרים מסוימים28 (איור 2E). שיטה זו מאפשרת לכמת תגובות "מופעל" ו"כבוי" כדי לאפיין את הדפוסים הזמניים של תגובות הנגרמות על ידי טעם27,28. כאן, רק הפסגות "מופעלות" כומתו כדי לציין שהתגובה לקפאין חזקה יותר באופן משמעותי ממים (איור 2F). הניסויים באיור 2 ניתנים לשחזור מאוד וניתן להשתמש בהם כדי להבטיח שהפרוטוקול פועל כראוי.
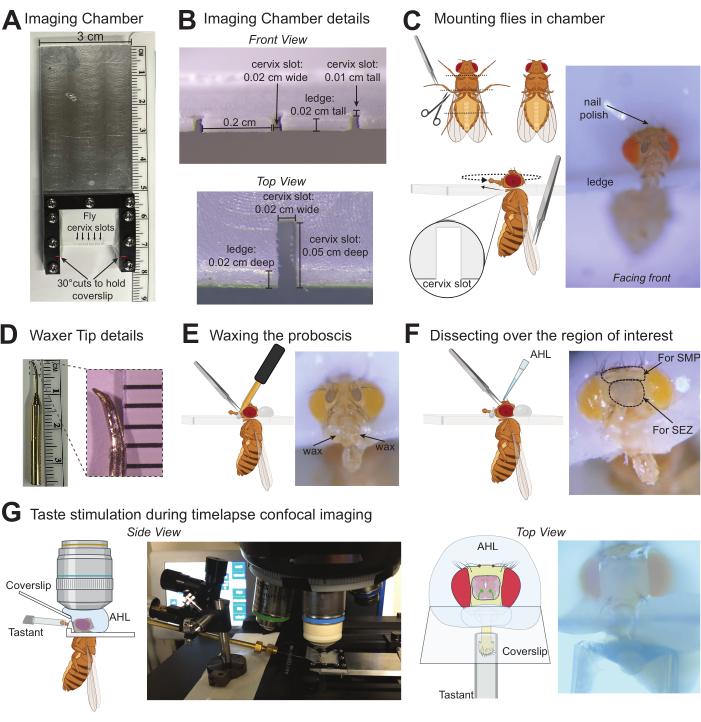
איור 1: איורי פרוטוקול להדמיית תגובות הנגרמות על ידי טעם במוח של דרוזופילה . (A) מבט מלמעלה על תא ההדמיה המותאם אישית המשמש להרכבה של עד חמישה זבובים בכל פעם. (B) פרטים של תא ההדמיה שבו מורכבים הזבובים עם מידות שמתאימות בנוחות לצוואר הרחם של D. melanogaster. (C) גרפיקה שמציינת היכן לקצץ את הטרסי (משמאל למעלה) וכיצד להרכיב את הזבוב לתוך חריץ צוואר הרחם של תא ההדמיה באמצעות מלקחיים (למטה משמאל). תמונה של זבוב רכוב במיקום הנכון בתא ההדמיה (מימין). (D) תמונה של קצה השעווה (משמאל), תמונה מוגדלת של הקצה כדי לציין את הצורה והגודל המשוערים שיש לכוון אליהם בעת שימוש באבן השחזה כדי לשנות את הקצה הסטנדרטי (מימין). (E) איור גרפי של שעווה של הפרובוסקיס למקומו באמצעות מלקחיים (משמאל), תמונה של זבוב רכוב עם תווית שעווה כהלכה (מימין). (F) איור גרפי שמייצג את הדיסקציה מעל אזור העניין במוח ויישום של AHL (משמאל), תמונה של זבוב עם עיגולים מנוקדים סביב אזור הקוטיקולה שצריך להסיר כשמתמקדים באזורי המוח של SEZ או SMP. X מציין אזורים בקוטיקולה שיש לצבוט לצורך חיתוך (מימין). (G) גרפיקה ותמונות מצביעות על המיקום של הזבוב המורכב/מנותח, מטרת הטבילה במים ב-AHL, הממריץ עם טסטנט מעל החרטום, והחלקת הכיסוי היוצרת מחסום בין התמיסות האלה. התצוגה הצדדית התרחקה (משמאל), והתצוגה העליונה הייתה מתחת למטרה פי 10 (מימין). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
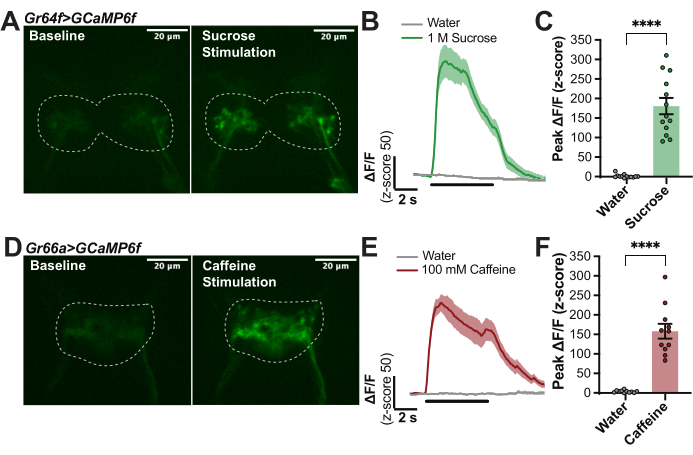
איור 2: דוגמה לתגובות סידן של GRNs תוויות לגירוי טעם. (A) לוכד סטילס מערימת תמונות המציינת את רמת הקרינה GCaMP בזבוב עם Gr64f>GCaMP6f בקו הבסיס ובמהלך תגובת השיא לסוכרוז של 1 M, סרגל קנה מידה = 20 מיקרומטר. הקווים המקווקוים מציינים את ההחזר על ההשקעה לניתוח. (B) עקומות תגובת סידן עבור n = 14 זבובים מחושבות כ-ΔF/F (ציון z) ומשולבות עבור מים (ביקורת שלילית) וסוכרוז של 1 M (בקרה חיובית) כדי להראות קינטיקה; הקו השחור מתחת לעקומות מציין מתי הגירוי נמצא מעל התווית. (C) שיא ΔF/F (z-score) עבור כל זבוב ששורטט לצורך השוואות סטטיסטיות. מבחן t מזווג, ****p < 0.0001. (D) צילום סטילס מסרטון שמציין את רמת הקרינה GCaMP בזבוב עם Gr66a>GCaMP6f בנקודת ההתחלה, ובמהלך תגובת השיא ל-100 מילימטר קפאין, סרגל קנה מידה = 20 מיקרומטר. הקווים המקווקוים מציינים את ההחזר על ההשקעה לניתוח. (E) עקומות תגובת סידן עבור n = 11 זבובים מחושבות כ-ΔF/F (ציון z) ומשולבות עבור מים (ביקורת שלילית) ו-100 מ"מ קפאין (בקרה חיובית) כדי להראות קינטיקה: שימו לב לתגובת ה"כבוי" הקטנה, קו שחור מתחת לעקומות מציין מתי הגירוי נמצא מעל התווית. (F) שיא ΔF/F (ציון z) עבור כל זבוב ששורטט לצורך השוואות סטטיסטיות. מבחן t מזווג, ****p < 0.0001. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
אחד ההיבטים המאתגרים ביותר של פרוטוקול זה הוא מיומנות המיקרומניפולציה הדרושה לשעווה של התווית וביצוע הנתיחות הממוקדות. צעד נוסף לאבטחת התווית נחוץ כדי לעורר כל סנסילום באופן שווה על פני איבר חישה זה ולדמיין אזורים מעניינים במוח. תא ההדמיה המותאם אישית המשמש כאן מותאם ל-D. melanogaster, אך ייתכן שיהיה צורך לשנות את מפרט החדר וגישת השעווה עבור חרקים אחרים. ניתן ליישם פרוטוקול זה על דרוזופילידים אחרים עם שינוי מועט, אך חברים אחרים בתת-סדרה של ברכיסרה, כגון דבורים ויתושים, עשויים לדרוש שינויים בשלבי ההרכבה והדיסקציה כדי להסביר את ההבדלים במישוש השפתיים ובמורפולוגיה של הראש. יישור המיקרומניפולטור למתן הטסטנט יכול גם הוא להיות מאתגר ודורש בדיקה ראשונית עם שלב המיקרוסקופ הספציפי לאופטימיזציה. אם השעווה נשברת במהלך הגירוי, זה יכול לגרום לדליפות שבהן ה-AHL והטסטנט בנימים יוצרים מגע. משיכת הנימים והגשמתם כלפי מטה עם אבן השחזה כדי להתאים יותר לתווית יכולה לעזור למנוע מגע בין הטסטנט ל-AHL. יש לשלול זבובים עם דליפות או תנועות מוח מוגזמות. במידת האפשר, כלול תמיד בקרה חיובית עבור כל בעל חיים כדי להבטיח שעצבי התווית והתווית אינם נפגעים מהשעווה או הדיסקציה. הדוגמאות ה"מתוקות" וה"מרות" המוצגות כאן מומלצות כניסויי בקרה חזקים.
גישת הדמיית הסידן in vivo המתוארת כאן שימשה לכימות תגובות הנגרמות על ידי טעם בנוירוני טעם ראשוניים, נוירונים מסדר גבוה יותר וכל ה-SEZ ב-D. melanogaster כדי לזהות קולטני טעם ומעגלים 8,14,17,18,19,20,27,28,30,31, 34,35,36,37,38,39,40,41,
42,43,44,45,46,47,48. היישומים הנפוצים באורגניזם מודל זה נובעים ממנהלי ההתקנים הזמינים של Gal4 ו-Gal4 המפוצלים; לפיכך, הצורך של חרקים מהונדסים גנטית להתבטא ב-GCaMP בתאי עצב ספציפיים מעניינים הוא גורם מגביל אחד לגישה זו. למרבה המזל, עם ההתקדמות בטכנולוגיית עריכת הגנים, זה הופך לנגיש יותר עבור חרקים מעבר לאורגניזמים מודלים, ולאחרונה דווח על תגובות המושרות על ידי טעם באמצעות הדמיית סידן עבור המזיק Drosophila suzukii49 ועבור יתושים נושאי וקטור50. כמו בכל הדמיית סידן, ייתכן שיהיה צורך באופטימיזציה ראשונית של אות לרעש עבור הנוירונים הממוקדים המעניינים. ניתן לשפר אותות על ידי שימוש בגרסאות בהירות יותר של GCaMP ועל ידי ביטוי שני עותקים של GCaMP. ביטוי משותף של RFP בנוירוני מטרה יכול לעזור לדמיין את נוירוני המטרה בנקודת ההתחלה ויכול לשמש כבקרה לתנועת המוח באזורים שיש להם נטייה לפעום.
פרוטוקול זה תוכנן במיוחד כדי לבודד את התחושה הכימותרפית מהתווית על ידי הסרת הטרסי והאנטנות, שעווה מעל המישוש המקסילרי והגבלת הבליעה כך שלא יעוררו GRNs של הלוע. עם זאת, ניתן לבצע התאמות לפרוטוקול זה כך שיכלול תחושה כימותרפית מ-GRNs טרסליים או לוע. אם הטרסי נותר שלם, ניתן לגרות את הרגליים לבד או בנוסף לתווית על ידי יצירת בועה גדולה של תמיסת טסטנט בקצה הנימים. יש פוטנציאל לזבוב לבעוט ולהזיז את הכיסוי אם הטרסי נשאר שלם; לכן, ניתן לשקול שעווה של הטרסי ליד הבסיס כדי לסייע במניעת תנועות לא רצויות. הדוגמה הנוכחית כוללת את השלב של חיתוך הוושט כדי למנוע גירוי GRN של הלוע וכדי לדמיין טוב יותר את הקרנות התווית ב-SEZ, אך אותה תכשיר הותאם בעבר לכימות תגובות GRN של הלוע על ידי השארת הוושט שלם והדמיית הקרנות הלועהרוחביות 36. יישום קודם זה השתמש בגירוי סוכר מעורר תיאבון, שזבובים יצרכו בחופשיות כדי לעורר GRNs של הלוע, אך זבובים לא יצרכו בקלות גירוי מרתיע להפעלת GRNs מרים של הלוע, וזו מגבלה אחת של גישה זו. מגבלה נוספת היא שלא ניתן לחקור בקלות את התגובות של GRNs הממוקמים בכנפיים של דרוזופילה11 בגישה זו.
בעוד שהדמיית הסידן in vivo המתוארת כאן הפכה לשיטה הסטנדרטית לחקר תגובות מסדר גבוה יותר הנגרמות על ידי טעם 8,18,19,20,28, ישנן כיום מספר גישות אחרות לכימות תגובות GRN ראשוניות לטעימות בזבובים. גישת הדמיית הסידן in vivo המתוארת כאן מתעדת שינויים ב-GCaMP במסופי האקסון במוח, אך נעשה שימוש בגישת ex vivo גם כדי לכמת את GCaMP של גוף התא ב-LABELLAR GRNs33. באופן דומה, תוארה גישת הרכבה נוספת להדמיית גופי התאים של GRNs תווית או טרסלית בזבובים שלמים51. אלקטרופיזיולוגיה ממשיכה להיות טכניקה פופולרית ויעילה לחקר התגובות של נוירוני טעם ראשוניים בחרקים 13,16,32,52,53,54,55,56,57,58,59,60,64,62,63,64,65. זה לא דורש צורך בחיישני סידן מקודדים גנטית ומהווה כימות ישיר יותר של הפעילות העצבית. עם זאת, ניתן לרשום תגובות מרגיש אחד בלבד בכל פעם, בעוד שהדמיית סידן יכולה להקליט מאוכלוסייה מלאה של GRNs בו זמנית. גישת הדמיית הסידן שימשה לגילוי הדינמיקה הזמנית הייחודית של תגובות "מופעלות" ו"כבויות" ב-GRNs עם גירויים מסוימים27,28, אך התקדמות אחרונה בהקלטות אלקטרופיזיולוגיות מבסיס רגישת הטעם ב-D. melanogaster מאפשרת כעת לכמת תגובות "כבויות" ברמת פוטנציאל הפעולה53. מעניין לציין כי אפנון הרגישות הראשונית ל-GRN על ידי רעב זוהה באמצעות הדמיית סידן אך לא ברמת פוטנציאל הפעולה עם אלקטרופיזיולוגיה29, אך גם רישומי קצה אלקטרופיזיולוגיים וגם הדמיית סידן יכולים ללכוד שינוי ברגישות ל-GRN עם דיאטה 30,66. לפיכך, אלקטרופיזיולוגיה נותרה גישה חשובה ומשלימה להדמיית סידן לזיהוי ליגנדים וקולטני טעם ולהבנת האופן שבו גורמים שונים מווסתים את הרגישות של נוירונים ראשוניים של קולטני טעם.
Disclosures
למחברים אין ניגודי אינטרסים ואין מה לחשוף.
Acknowledgements
ברצוננו להודות למרכז המניות של בלומינגטון דרוזופילה על מניות זבובים ולמעבדות קרן המטבע של אוניברסיטת ורמונט על עזרתם בייצור תאי ההדמיה המותאמים אישית. ברצוננו גם להודות ל-BioRender על יצירת האיורים הגרפיים ולקיילה אודט על תרומתה לעיצוב הגרפיקה הזאת. עבודה זו נתמכה על ידי קרנות סטארט-אפ מעבדות חדשות מאוניברסיטת ורמונט ופרס הקרן הלאומית למדע מספר 2332375. הגרפיקה באיור 1 נוצרה עם www.BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| CaCl2 | Sigma-Aldrich | C7902 | For AHL |
| Caffeine | Sigma-Aldrich | C0750 | For a "bitter" taste stimulus |
| Clear nail polish- quick dry | Many vendors | Example: Sally Hansen Xtreme wear (clear) | |
| CO2 fly pad station | Genesee Scientific | 59-122BC | Includes tubing, a gun to initially anesthetize flies, and a pad to deliver continuous anesthesia |
| CO2 supply (cylinders) | Airgas | USP50 | For anesthesia |
| Confocal or two-photon microscope | Many vendors | Upright microscope, high signal to noise and rapid capture capabilities, 10X air immersion objective, 25-40X water immersion objective, accompanying hardware and software | |
| Coverslips | Globe Scientific | 1404-15 | 22 x 22 mm, No 1.5: for this specific imaging chamber, score and cut in half to get 11 x 22 mm coverslips |
| D. melanogaster: Gr64f-Gal4 | Bloomington Drosophila Stock Center | 57669 | For driving GCaMP expression in 'sweet' gustatory receptor neurons of the labellum |
| D. melanogaster: Gr66a-Gal4 | Bloomington Drosophila Stock Center | 57670 | For driving GCaMP expression in 'bitter' gustatory receptor neurons of the labellum |
| D. melanogaster: UAS-GCaMP6f | Bloomington Drosophila Stock Center | 42747 | For getting GCaMP expression when crossed to a Gal4 driver line |
| Dental Waxer | Pearson Dental | 49-00-54 | Digital wax carver, comes with tips that can be modified and sharpened small enough to deliver wax along the fly proboscis |
| Dissection microscope | Many vendors | .63 - 6.3X for optimal viewing but with sufficient working distance to perform dissections under the microscope | |
| Dissection scissors | Fine Science Tools | 15000-08 | This pair or any similar dissection scissors are appropriate |
| Empty pipette tip box | Free- many vendors | For humidity chamber: needs enough space so that the imaging chamber can sit and the lid can close without bumping the chamber | |
| Filter flask | Millipore-Sigma | CLS431097 | For filtering AHL stocks |
| Glass capillary | World Precision Instruments | TW100-4 | This size fits well over the D. melanogaster labellum without needing modification, but other capillaries can be pulled and filed down to an appropriate size |
| HEPES | Sigma-Aldrich | BP310 | For AHL |
| ImageJ (FIJI) | NIH | https://imagej.nih.gov/ij | Image analysis software |
| Imaging Chamber | IMF Labs | Custom item | The custom-made chamber in this example can be ordered at https://www.uvm.edu/research/imf/forms/contact-us. Base: 6061 aluminum, Holding Clamps: Black Delrin (Acetal), Insert: Moisture Resistant polyester (PET). Manual and CNC milling machines for fabrication. |
| KCl | Sigma-Aldrich | P9541 | For AHL |
| Kim wipes | Millipore-Sigma | Z188956 | For humidity chamber, wiping off forceps, removing solutions from capillaries, etc. |
| MgCl2 | Sigma-Aldrich | M9272 | For AHL |
| Micromanipulator | Tritech Research | U-31CF, USM-6, MINJ-4 | This example uses a magnet to attach the micromanipulator to the stage, other configurations are possible |
| NaCl | Sigma-Aldrich | S7653 | For AHL |
| NaH2PO4 | Sigma-Aldrich | 567545 | For AHL |
| NaHCO3 | Sigma-Aldrich | S6014 | For AHL |
| p10 pipette and tips | Many vendors | For filling the capillaries with tastants | |
| p200 pipette and tips | Many vendors | For AHL | |
| Parafin wax | Many vendors | White/clear block of wax often found in craft stores | |
| Ribose | Sigma-Aldrich | W379301 | For AHL |
| Semi-sharp forceps | Fine Science Tools | 11252-20 | Blunted to approximately tip size C |
| Sharp forceps | Fine Science Tools | 11252-20 | Sharpened to tip size A |
| Sharpening stone | Fine Science Tools | 29000-00 | For modifying dental waxer tips and forceps |
| Sucrose | Sigma-Aldrich | S0389 | For a "sweet'"taste stimulus |
| Toothpick | Many vendors | Small tip for nail polish application |
References
- Wangler, M. F., Yamamoto, S., Bellen, H. J. Fruit flies in biomedical research. Genetics. 199 (3), 639-653 (2015).
- Ryu, L., Kim, S. Y., Kim, A. J. From photons to behaviors: Neural implementations of visual behaviors in Drosophila. Front Neurosci. 16, 883640 (2022).
- Joseph, R. M., Carlson, J. R. Drosophila chemoreceptors: A molecular interface between the chemical world and the brain. Trends Genet. 31 (12), 683-695 (2015).
- Montell, C. Drosophila sensory receptors-a set of molecular Swiss Army knives. Genetics. 217 (1), 1-34 (2021).
- Scott, K. Gustatory processing in Drosophila melanogaster. Annu Rev Entomol. 63, 15-30 (2018).
- Starostina, E., et al. A Drosophila DEG/ENaC subunit functions specifically in gustatory neurons required for male courtship behavior. J Neurosci. 32 (13), 4665-4674 (2012).
- Chen, Y., Amrein, H. Ionotropic receptors mediate Drosophila oviposition preference through sour gustatory receptor neurons. Curr Biol. 27 (18), 2741-2750.e4 (2017).
- Guillemin, J., et al. Taste cells expressing ionotropic receptor 94e reciprocally impact feeding and egg laying in Drosophila. Cell Rep. 43, 114625 (2024).
- Ostojic, I., et al. Positive and negative gustatory inputs affect Drosophila lifespan partly in parallel to dFOXO signaling. Proc Natl Acad Sci U S A. 111 (22), 8143-8148 (2014).
- Stocker, R. F. The organization of the chemosensory system in Drosophila melanogaster: A review. Cell Tissue Res. 275 (1), 3-26 (1994).
- Raad, H., Ferveur, J. -. F., Ledger, N., Capovilla, M., Robichon, A. Functional gustatory role of chemoreceptors in Drosophila wings. Cell Rep. 15 (7), 1442-1454 (2016).
- Montell, C. A taste of the Drosophila gustatory receptors. Curr Opin Neurobiol. 19 (4), 345-353 (2009).
- Weiss, L. A., Dahanukar, A., Kwon, J. Y., Banerjee, D., Carlson, J. R. The molecular and cellular basis of bitter taste in Drosophila. Neuron. 69 (2), 258-272 (2011).
- Jaeger, A. H., et al. A complex peripheral code for salt taste in Drosophila. Elife. 7, 37167 (2018).
- Freeman, E. G., Dahanukar, A. Molecular neurobiology of Drosophila taste. Curr Opin Neurobiol. 34, 140-148 (2015).
- Delventhal, R., Kiely, A., Carlson, J. R. Electrophysiological recording from Drosophila labellar taste sensilla. J Vis Exp. 84, e51355 (2014).
- Marella, S., et al. Imaging taste responses in the fly brain reveals a functional map of taste category and behavior. Neuron. 49 (2), 285-295 (2006).
- Shiu, P. K., Sterne, G. R., Engert, S., Dickson, B. J., Scott, K. Taste quality and hunger interactions in a feeding sensorimotor circuit. Elife. 11, e79887 (2022).
- Li, J., Dhaliwal, R., Stanley, M., Junca, P., Gordon, M. D. Functional imaging and connectome analyses reveal organizing principles of taste circuits in Drosophila. bioRxiv. , (2024).
- Junca, P., Stanley, M., Musso, P. -. Y., Gordon, M. D. Modulation of taste sensitivity by the olfactory system in Drosophila. bioRxiv. , (2021).
- Elliott, D. A., Brand, A. H. The GAL4 system: A versatile system for the expression of genes. Drosophila Methods Protoc. , 79-95 (2008).
- Riabinina, O., Potter, C. J., Dahmann, C. . Drosophila: Methods and Protocols. , 53-78 (2016).
- Diegelmann, S., Bate, M., Landgraf, M. Gateway cloning vectors for the LexA-based binary expression system in Drosophila. Fly. 2 (4), 236-239 (2008).
- Zhang, Y., et al. Fast and sensitive GCaMP calcium indicators for imaging neural populations. Nature. 615 (7954), 884-891 (2023).
- Ohkura, M., et al. Genetically encoded green fluorescent Ca2+ indicators with improved detectability for neuronal Ca2+ signals. PLoS One. 7 (12), e51286 (2012).
- Arntsen, C., Guillemin, J., Audette, K., Stanley, M. Tastant-receptor interactions: Insights from the fruit fly. Front Nutr. 11, 1394697 (2024).
- Stanley, M., Ghosh, B., Weiss, Z. F., Christiaanse, J., Gordon, M. D. Mechanisms of lactic acid gustatory attraction in Drosophila. Curr Biol. 31 (16), 3525-3537.e6 (2021).
- Devineni, A. V., Deere, J. U., Sun, B., Axel, R. Individual bitter-sensing neurons in drosophila exhibit both on and off responses that influence synaptic plasticity. Curr Biol. 31 (24), 5533-5546.e7 (2021).
- Inagaki, H. K., et al. Visualizing neuromodulation in vivo: Tango-mapping of dopamine signaling reveals appetite control of sugar sensing. Cell. 148 (3), 583-595 (2012).
- May, C. E., et al. High dietary sugar reshapes sweet taste to promote feeding behavior in drosophila melanogaster. Cell Rep. 27 (6), 1675-1685.e7 (2019).
- May, C. E., Rosander, J., Gottfried, J., Dennis, E., Dus, M. Dietary sugar inhibits satiation by decreasing the central processing of sweet taste. Elife. 9, e54530 (2020).
- Jiao, Y., Moon, S. J., Wang, X., Ren, Q., Montell, C. Gr64f is required in combination with other gustatory receptors for sugar detection in Drosophila. Curr Biol. 18 (22), 1797-1801 (2008).
- Chen, H. -. L., Stern, U., Yang, C. -. H. Molecular control limiting sensitivity of sweet taste neurons in Drosophila. Proc Natl Acad Sci USA. 116 (40), 20158-20168 (2019).
- Devineni, A. V., Sun, B., Zhukovskaya, A., Axel, R. Acetic acid activates distinct taste pathways in Drosophila to elicit opposing, state-dependent feeding responses. Elife. 8, e47677 (2019).
- Engert, S., Sterne, G. R., Bock, D. D., Scott, K. Drosophila gustatory projections are segregated by taste modality and connectivity. Elife. 11, e78110 (2022).
- Ledue, E. E., et al. Starvation-induced depotentiation of bitter taste in Drosophila. Curr Biol. 26 (21), 2854-2861 (2016).
- Mcdowell, S. A. T., Stanley, M., Gordon, M. D. A molecular mechanism for high salt taste in Drosophila. Curr Biol. 32 (14), 3070-3081.e7 (2022).
- Deere, J. U., Devineni, A. V. Taste cues elicit prolonged modulation of feeding behavior in Drosophila. iScience. 25 (10), 105159 (2022).
- Deere, J. U., et al. Selective integration of diverse taste inputs within a single taste modality. Elife. 12, (2023).
- Chu, B., Chui, V., Mann, K., Gordon, M. D. Presynaptic gain control drives sweet and bitter taste integration in Drosophila. Curr Biol. 24 (17), 1978-1984 (2014).
- Yao, Z., Scott, K. Serotonergic neurons translate taste detection into internal nutrient regulation. Neuron. 110 (6), 1036-1050.e7 (2022).
- Cameron, P., Hiroi, M., Ngai, J., Scott, K. The molecular basis for water taste in Drosophila. Nature. 465 (7294), 91-95 (2010).
- Jourjine, N., Mullaney, B. C., Mann, K., Scott, K. Coupled sensing of hunger and thirst signals balances sugar and water consumption. Cell. 166 (4), 855-866 (2016).
- Kim, H., Kirkhart, C., Scott, K. Long-range projection neurons in the taste circuit of Drosophila. Elife. 6, e23386 (2017).
- Kirkhart, C., Scott, K. Gustatory learning and processing in the Drosophila mushroom bodies. J Neurosci. 35 (15), 5950-5958 (2015).
- Steck, K., et al. Internal amino acid state modulates yeast taste neurons to support protein homeostasis in Drosophila. Elife. 7, e31625 (2018).
- Münch, D., Goldschmidt, D., Ribeiro, C. The neuronal logic of how internal states control food choice. Nature. 607 (7920), 747-755 (2022).
- Taisz, I., et al. Generating parallel representations of position and identity in the olfactory system. Cell. 186 (12), 2556-2573.e2 (2023).
- Cavey, M., et al. Increased sugar valuation contributes to the evolutionary shift in egg-laying behavior of the fruit pest Drosophilasuzukii. PLoS Biol. 21 (12), e3002432 (2023).
- Jové, V., et al. Sensory discrimination of blood and floral nectar by Aedes aegypti mosquitoes. Neuron. 108 (6), 1163-1180.e2 (2020).
- Shankar, S., Calvert, M. E., Yew, J. Y. Measuring physiological responses of Drosophila sensory neurons to lipid pheromones using live calcium imaging. J Vis Exp. (110), e53392 (2016).
- Dahanukar, A., Lei, Y. -. T., Kwon, J. Y., Carlson, J. R. Two gr genes underlie sugar reception in Drosophila. Neuron. 56 (3), 503-516 (2007).
- Dweck, H. K. M., Carlson, J. R. Base recording: A technique for analyzing responses of taste neurons in Drosophila. J Vis Exp. (205), e66665 (2024).
- Dweck, H. K. M., Talross, G. J. S., Luo, Y., Ebrahim, S. A. M., Carlson, J. R. Ir56b is an atypical ionotropic receptor that underlies appetitive salt response in Drosophila. Curr Biol. 32 (8), 1776-1787.e4 (2022).
- Park, J., Carlson, J. R. Physiological responses of the Drosophila labellum to amino acids. J Neurogenet. 32 (1), 27-36 (2018).
- Wang, W., et al. Sugar sensation and mechanosensation in the egg-laying preference shift of Drosophilasuzukii. Elife. 11, e81703 (2022).
- Xiao, S., Baik, L. S., Shang, X., Carlson, J. R. Meeting a threat of the Anthropocene: Taste avoidance of metal ions by Drosophila. Proc Natl Acad Sci USA. 119 (25), e2204238119 (2022).
- Ganguly, A., et al. Requirement for an otopetrin-like protein for acid taste in Drosophila. Proc Natl Acad Sci USA. 118 (51), e2110641118 (2021).
- Lee, Y., Moon, S. J., Montell, C., Snyder, S. H. Multiple gustatory receptors required for the caffeine response in Drosophila. Proc Natl Acad Sci USA. 106 (11), 4495-4500 (2009).
- Lee, Y., Poudel, S., Kim, Y., Thakur, D., Montell, C. Calcium taste avoidance in Drosophila. Neuron. 97 (1), 67-74.e4 (2018).
- Mi, T., et al. Alkaline taste sensation through the alkaliphile chloride channel in Drosophila. Nat Metab. 5 (3), 466-480 (2023).
- Rimal, S., et al. Mechanism of acetic acid gustatory repulsion in Drosophila. Cell Rep. 26 (6), 1432-1442.e4 (2019).
- Zhang, Y. V., Ni, J., Montell, C. The molecular basis for attractive salt-taste coding in Drosophila. Science. 340 (6138), 1334-1338 (2013).
- Aryal, B., Dhakal, S., Shrestha, B., Lee, Y. Molecular and neuronal mechanisms for amino acid taste perception in the Drosophila labellum. Curr Biol. 32 (6), 1376-1386.e4 (2022).
- Shrestha, B., Aryal, B., Lee, Y. The taste of vitamin C in Drosophila. EMBO Rep. 24 (6), e56319 (2023).
- Ganguly, A., Dey, M., Scott, C., Duong, V. -. K., Arun Dahanukar, A. Dietary macronutrient imbalances lead to compensatory changes in peripheral taste via independent signaling pathways. J Neurosci. 41 (50), 10222 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved