Method Article
In vivo Imagerie calcique des réponses neuronales induites par le goût chez la drosophile adulte
Dans cet article
Résumé
Une approche d’imagerie calcique permet d’enregistrer les réponses induites par le goût dans le cerveau des mouches éveillées pendant qu’une solution est appliquée sur le labelle. Les réponses gustatives primaires chez Drosophila melanogaster sont utilisées à titre d’exemple, mais ce protocole peut être adapté pour étudier les neurones en aval ou d’autres espèces.
Résumé
Depuis près de deux décennies, l’imagerie calcique in vivo est une méthode efficace pour mesurer les réponses cellulaires aux stimuli gustatifs chez l’organisme modèle de la mouche des fruits, Drosophila melanogaster. L’une des principales forces de cette méthodologie est sa capacité à enregistrer les réponses neuronales induites par le goût chez les animaux éveillés sans avoir besoin d’anesthésie. Cette approche utilise des systèmes d’expression binaires (par exemple, Gal4-UAS) pour exprimer l’indicateur calcique GCaMP dans des neurones d’intérêt spécifiques. Ce protocole décrit une procédure dans laquelle les mouches exprimant GCaMP sont montées avec le labelle solidement positionné, ce qui permet d’enregistrer la fluorescence dans le cerveau à une résolution milliseconde sous un microscope confocal pendant qu’une solution est appliquée sur le labelle, stimulant ainsi toute la sensille gustative du labelle. Les exemples fournis se concentrent sur les réponses calciques dans les neurones récepteurs gustatifs primaires de D. melanogaster. Cependant, cette approche peut être adaptée pour enregistrer à partir d’autres neurones d’intérêt dans le cerveau des drosophiles ou d’autres espèces d’insectes. Cette méthode d’imagerie permet aux chercheurs d’enregistrer simultanément les réponses calciques collectives de groupes de neurones gustatifs à travers le labelle, complétant ainsi les enregistrements électrophysiologiques des pointes qui quantifient les potentiels d’action des neurones individuels. La technique d’imagerie calcique in vivo décrite ici a permis de découvrir les mécanismes moléculaires et cellulaires de la chimiosensation, d’identifier des modèles de réponse temporelle uniques dans les neurones gustatifs primaires, d’étudier les mécanismes de modulation gustative et d’explorer le traitement du goût dans les circuits en aval.
Introduction
La mouche des fruits, Drosophila melanogaster, est célèbre pour les puissants outils de recherche génétique disponibles dans cet organisme modèle. Ces outils offrent la possibilité de manipuler facilement des gènes spécifiques dans des cellules ciblées, ce qui les rend idéaux pour explorer les circuits neuronaux fondamentaux tels que la vision et la chimiosensation 1,2,3. La gustation, par le biais de la chimiosensation de contact, est une voie neuronale clé qui régule les comportements impliqués dans l’alimentation, l’accouplement, la reproduction et, en fin de compte, la survie et la forme physique des animaux 4,5,6,7,8,9. Pour comprendre comment cette importante information chimiosensorielle est codée et transmise, il faut décrire l’activité des neurones dans les circuits activés par les stimuli gustatifs.
Chez D. melanogaster, les neurones récepteurs gustatifs externes (GRN) sont situés sur les pattes antérieures, le trompe et les ailes10,11. Le labelle, à l’extrémité de la trompe, contient des structures ressemblant à des cheveux appelées sensilles qui peuvent être cartographiées par leur morphologie en fonction de la taille : longue (type L), intermédiaire (type I) et courte (type S)10. La plupart des GRN sont concentrés sur cet organe sensoriel, chaque sensille contenant 2 à 4 types différents de GRN de sorte que chaque modalité de goût est répartie sur le labelle 12,13,14,15. Alors que les enregistrements électrophysiologiques des pointes peuvent être utilisés pour quantifier les potentiels d’action provenant des GRN dans une seule sensille16, in vivo, l’imagerie calcique peut être utilisée pour isoler l’activité d’un type spécifique de GRN à travers le labelle complet14,17. Cette même technique d’imagerie calcique peut également être utilisée pour étudier les réponses neuronales dans les circuits gustatifs en aval 18,19,20. L’imagerie calcique nécessite des systèmes d’expression binaires, tels que Gal4-UAS 21,22,23, et le croisement d’une ligne pilote contenant des activateurs transcriptionnels spécifiques à une cellule vers une ligne effectrice pour obtenir l’expression d’un GCaMP dans les neurones d’intérêt. Lorsque les niveaux de calcium intracellulaire augmentent, ces indicateurs de calcium génétiquement codés augmentent en intensité de fluorescence, de sorte que le niveau de fluorescence est corrélé avec les changements de l’activité neuronale24,25.
Ici, une méthode d’utilisation de l’imagerie calcique pour observer les réponses neuronales aux stimuli gustatifs in vivo est décrite. L’objectif global de cette méthode est de stimuler uniquement les GRN labellaires pour quantifier les réponses neuronales induites par le goût dans le cerveau des mouches éveillées. Des exemples sont fournis pour l’utilisation de cette méthode pour enregistrer les réponses dans les GRN primaires du labelle chez D. melanogaster, et les avantages et les défis de l’utilisation de cette approche sont discutés. Cette préparation a été développée pour permettre aux expérimentateurs d’appliquer une solution savoureuse à un labelle de mouche immobilisé sous un microscope confocal afin d’enregistrer les réponses neuronales lorsque l’organe sensoriel entier est immergé dans une solution, ce qui se produit dans des environnements naturels. L’approche d’imagerie calcique in vivo décrite ici peut être utilisée pour découvrir de nouvelles interactions entre le goût et le récepteur 8,14,26,27, les détails temporels des réponses GRN 27,28, les mécanismes moléculaires de la modulation GRN29,30 et le traitement du goût dans les circuits en aval 8,18,19,20, 28,31.
Protocole
Les détails des réactifs et de l’équipement utilisés dans cette étude sont énumérés dans la table des matériaux.
1. Préparation d’une solution de type hémolymphe adulte (AHL)
- Préparez une solution mère contenant 108 mM de NaCl, 5 mM de KCl, 4 mM de NaHCO3, 1 mM de NaH2PO4, 5 mM de HEPES et 15 mM de ribose.
REMARQUE : Le ribose est utilisé comme sucre non énergétique pour maintenir l’osmolarité sans altérer les niveaux de nutriments dans le cerveau. - Ajustez le pH de cette solution à 7,5 avant de filtrer et de stocker à 4 °C. Vérifiez l’osmolarité de l’AHL après avoir ajusté le pH pour assurer l’uniformité entre les préparations.
- Préparez des stocks séparés de 1 M de CaCl2 et de 1 M de MgCl2, filtrez et conservez à température ambiante.
- Pour préparer une aliquote du stock principal d’AHL, ajoutez un petit volume de calcium et de magnésium pour obtenir des concentrations finales de 2 mM de calcium et 8,2 mM de magnésium. Cette AHL peut être conservée à 4 °C et utilisée jusqu’à un mois, à l’aide de petites aliquotes portées à température ambiante pour des expériences.
2. Montage des mouches sur la chambre d’imagerie
- Avant de monter les mouches, aiguisez la pointe d’un cireur dentaire en une petite coupelle pointue à l’aide d’une pierre à aiguiser (figure 1D). Fixez la pointe aiguisée au cireur et allumez-la pour préchauffer. Les réglages de chaleur dépendront du type et de la longueur de la pointe : une température minimale qui permet à la cire de rester fondue au contact est nécessaire (50,5 °C fonctionne dans cet exemple).
REMARQUE : Un fil peut être enroulé autour de l’extrémité de l’épilateur dentaire pour fixer une pointe métallique aiguisée comme alternative. - Anesthésier doucement 1 à 5 mouches (en suivant les protocoles approuvés par l’établissement). Minimisez le temps d’exposition à l’anesthésie, car des périodes prolongées d’exposition au CO2 ou au froid peuvent avoir un impact sur le comportement. Pour le CO2, utilisez un tampon anti-mouches qui fournit un débit continu et uniforme de 99,9 % de CO2 à un débit de 5 L/min sous un microscope de dissection.
- Utilisez des ciseaux de dissection pour enlever des parties des pattes en coupant le milieu et l’arrière de l’articulation fémorale/tibiale et les pattes avant au niveau du trochanter. Utilisez des pinces émoussées pour aider à manipuler la mouche. La coupe des tarses évitera la sensation tarsienne et les coups de pied de la lamelle ou du stimulateur de goût.
- Ramassez la mouche par les ailes à l’aide d’une pince émoussée pour positionner la mouche de manière à ce que la tête soit au-dessus de la fente du col de l’utérus ciblée de la chambre d’imagerie, mais que le corps soit en dessous. Il est utile de commencer la mouche complètement à droite ou à gauche. À l’aide du côté émoussé des ciseaux et de la pince émoussée, poussez doucement la tête et le thorax simultanément dans la fente.
- Une fois bien à l’intérieur de la fente, poussez la mouche à l’arrière de la fente et repositionnez-la doucement de manière à ce qu’elle fasse face à l’avant de la chambre. Évitez de tourner la tête trop loin de l’alignement avec le thorax.
- Répétez l’opération pour autant de mouches que nécessaire (cette chambre d’imagerie peut monter jusqu’à 5 mouches).
- Rassemblez une petite gouttelette de vernis à ongles à l’extrémité d’un cure-dent et appliquez une fine couche pour fixer la tête de la mouche à la chambre d’imagerie.
REMARQUE : la zone précise d’application du vernis à ongles dépend de la partie du cerveau qui est imagée. Si vous imagez la ZES (comme illustré ici) ou d’autres régions médiales inférieures, le vernis à ongles peut être appliqué généreusement sur le haut de la tête de mouche, mais pour imager les régions médiales supérieures, le vernis à ongles peut être appliqué au minimum sur le haut de la tête et ajouté latéralement près des yeux pour laisser cette zone dégagée pour la dissection. Ce protocole est optimisé pour la stimulation du goût uniquement sans olfaction, mais si les substances volatiles du vernis à ongles sont un problème, utilisez de la cire ou de la colle UV comme méthodes alternatives pour fixer la tête de mouche.
3. Épilation à la cire de la trompe en position allongée
- Prenez le cireur d’une main et recueillez une petite gouttelette de cire sur la pointe.
- D’autre part, utilisez une pince semi-tranchante pour saisir un palpe maxillaire et tirez doucement et maintenez la trompe en pleine extension.
REMARQUE : Veillez à ne saisir que le palpe maxillaire, car le pincement de la cuticule sur la trompe augmente le risque de dommages. Ne poursuivez pas si la trompe est pincée ou si la cuticule du proboscis est perforée. Un petit pouce-mouches peut être utilisé comme alternative aux pinces pour retirer la trompe en utilisant la succion pendant l’application de la cire. - Touchez l’extrémité du cireur vers la chambre près de la base de la trompe jusqu’à ce que la cire commence à couler, puis déplacez-la pour entrer en contact avec la base de la trompe. Cirez à mi-chemin de la tige, mais évitez de toucher les sensilles labellaires avec la cire ou le cire. La cire de ce côté maintiendra la trompe en place. Ne procédez pas si les sensilles sont touchées par la cire ou le cire à tout moment.
- Appliquez de la cire en utilisant la méthode ci-dessus pour l’autre côté, en faisant un pont continu de cire sur la trompe.
- Étendez complètement la trompe aussi droite que possible. Si nécessaire, le déplacement de la trompe peut se faire en réchauffant la cire et en poussant doucement la trompe dans la position souhaitée.
- Répétez l’opération pour que d’autres mouches soient montées dans la même chambre.
- Éteignez le CO2 ou retirez les mouches de l’anesthésie glacée. Placez les mouches montées dans une chambre d’humidité pendant 60 minutes pour les récupérer (boîte d’embout de pipette propre et vide avec des lingettes humides et non pelucheuses).
4. Dissection pour révéler la région cérébrale d’intérêt
- Retirez les mouches de la chambre d’humidité. Les mouches doivent être clairement vivantes, bouger activement leur abdomen, leurs pattes et leurs antennes. Installez le microscope confocal ou à deux photons avant la dissection.
- Allumez l’épilateur pour réparer les ruptures potentielles de la cire pendant la dissection et préparez l’AHL à température ambiante.
- À l’aide d’une pince très tranchante, pincez les deux antennes, puis pincez la cuticule pour créer un trou permettant d’insérer un côté de la pince tranchante. Passez la pince sous la cuticule pour la retirer de la région couvrant la zone cérébrale d’intérêt. La figure 1F indique un X sur les zones de la cuticule à cibler avec la pince pour l’enlever.
- Lavez le cerveau exposé dans AHL en appliquant généreusement AHL (~100 μL) sur la tête, puis en enlevant toute la couche sauf une fine couche d’AHL pour empêcher le cerveau de se dessécher.
REMARQUE : Si la cire se brise à un moment donné et doit être réparée, retirez brièvement toute l’AHL autour de la tête avant de réchauffer la cire pour fixer à nouveau la trompe en position étendue. - À l’aide d’une pince tranchante, retirez les sacs d’air et tous les gros débris recouvrant le cerveau. Évitez de pénétrer dans le cerveau en gardant les pointes des pinces visibles.
- Laver avec AHL ~3 fois pour enlever tous les petits débris.
- Assurez-vous que la région cérébrale d’intérêt est clairement visible. Pour imager spécifiquement la zone sous-œsophagienne (ZES) comme dans cet exemple, coupez l’œsophage à la base près du proboscis et près du point où il traverse le cerveau en pinçant avec des pinces très tranchantes et en retirant ce morceau pour exposer la ZES.
REMARQUE : Les mouches ne peuvent pas ingérer de solutions après l’ablation de l’œsophage, et aucune activation du GRN pharyngé ne peut se produire. - Sous le microscope de dissection, placez la lamelle de 10 mm x 20 mm dans la fente inclinée de la chambre d’imagerie. Assurez-vous qu’il repose à la base de la trompe sans casser la cire. L’extrémité du labelle ne doit pas toucher la lamelle.
5. Imagerie et stimulation du goût
- Allumez le microscope confocal ou à deux photons et soyez prêt pour la capture d’images. Installez un micromanipulateur avec un tube capillaire qui est positionné pour délivrer les arômes à la mouche pendant qu’ils sont sur la platine du microscope.
REMARQUE : L’imagerie à deux photons peut capturer la fluorescence des neurones situés plus profondément dans le tissu cérébral. - Chargez ~2 μL d’eau (ou un autre contrôle négatif) dans le tube capillaire du
stimulateur sur la platine du microscope. - Trouvez la mouche disséquée et concentrez-vous sur le labelle en utilisant un fond clair d’immersion dans l’air 10x. Alignez le capillaire avec le labelle sous cette vue. Des caméras supplémentaires pointées sur le labelle de la mouche peuvent être incluses pour voir l’alignement du capillaire avec la mouche sous plusieurs angles.
REMARQUE : Assurez-vous que toutes les sensilles labellaires sont stimulées avec la solution pendant l’alignement ; Si la position du stimulateur ou du labelle n’est pas assez perpendiculaire pour cela, ajustez en conséquence. Les capillaires peuvent être tirés et limés à l’aide d’une pierre à aiguiser pour fournir un ajustement plus serré autour du labelle. - Laissez le capillaire positionné directement devant le labelle, près mais sans se toucher.
- Déplacez la platine de manière à ce que la région cérébrale d’intérêt soit centrée et passez à un objectif d’immersion dans l’eau à plus fort grossissement (40x utilisé dans cet exemple).
- Ajoutez environ 200 μL d’AHL sur le dessus du cerveau pour entrer en contact avec l’objectif d’immersion. Retirez toutes les bulles.
- Orientez la mise au point à l’aide du fond clair pour vous déplacer soigneusement dans le plan z afin de trouver le bord de la cuticule qui a été enlevé et de centrer la région cérébrale d’intérêt.
- Passez à une puissance laser de 488 nm pour trouver l’expression de GCaMP dans la zone d’intérêt.
REMARQUE : En fonction de la ligne de pilote et de la version de GCaMP utilisée, une optimisation initiale peut être nécessaire pour amplifier le rapport signal/bruit pour des préparations individuelles. La co-expression de RFP peut être utile pour les neurones à faible fluorescence GCaMP de base. - Préparez une collection d’images timelapse. La vitesse dépendra du microscope spécifique et du signal GCaMP, mais la capture d’au moins une image toutes les ~100 ms est optimale.
REMARQUE : La capture d’un seul plan Z de fluorescence au fil du temps optimisera la vitesse de capture pour fournir une cinétique calcique détaillée. Les piles d’images prises sur plusieurs plans Z à chaque point temporel peuvent ralentir les taux de capture, mais enregistreront les réponses à travers les neurites qui se trouvent à différentes profondeurs dans le tissu. - Après avoir recueilli au moins 5 s de fluorescence de base, déplacez manuellement le stimulateur de manière à ce que le capillaire recouvre le labelle pendant une durée spécifique (5 s dans cet exemple), puis retirez le stimulus et capturez aussi longtemps que vous le souhaitez.
- Retirez l’AHL et revenez à un fond clair 10x pour vous assurer que la lamelle, le stimulateur et le labelle sont toujours dans la même position.
REMARQUE : Si le stimulateur n’est pas bien aligné avec le labelle ou s’il est tourné trop loin, le labelle peut être déplacé ou le capillaire peut heurter la chambre d’imagerie, brisant potentiellement la cire et créant une fuite de l’AHL. - Retirez la chambre d’imagerie. Utilisez une lingette non pelucheuse pour retirer la première solution et rincez la pipette avec de l’eau. Ensuite, pipetez ~2 μL du goût suivant dans le tube capillaire.
- Remettez la chambre d’imagerie sur la platine et répétez les étapes 5.4 à 5.12 pour cette solution.
REMARQUE : La tension superficielle élevée de la plupart des savourants présente des produits chimiques résiduels provenant de la présence sur l’étiquette de mouche. Cependant, si les arômes sont très saturés ou visqueux, l’eau peut être déplacée plusieurs fois sur le labelle pour laver l’organe sensoriel avant le stimulus suivant. - Répétez l’opération pour autant de solutions que vous le souhaitez pour cette mouche.
- Revenez à l’étape 3 pour préparer la prochaine mouche pour l’imagerie.
6. Analyse d’images
- Ouvrez la pile d’images à analyser dans un logiciel de traitement d’images. Si nécessaire, effectuez une soustraction d’arrière-plan à l’aide d’une région située en dehors du signal GCaMP.
- Sélectionnez une zone d’intérêt (ROI) étroite autour des projections à quantifier à l’aide de l’outil à main levée ou de forme et assurez-vous que la sélection est appliquée à toutes les images de la pile.
- Générez une liste des lectures de fluorescence au fil du temps pour ce retour sur investissement et exportez-la vers une feuille de calcul pour un traitement ultérieur. Utilisez le profil de l’axe Z du tracé dans ImageJ (FIJI) ou une fonction similaire dans le logiciel de traitement d’image de votre choix.
- Dans la feuille de calcul, sélectionnez 10 points temporels consécutifs lors de l’enregistrement de la ligne de base à l’étape 5.10 comme référence représentative. Calculez la moyenne et l’écart-type.
- Pour obtenir ΔF/F en pourcentage, calculez ((F - valeur de référence F)/moyenne de base F)*100) pour chaque point temporel. Pour obtenir ΔF/F en tant que score z, calculez ((F - ligne de base moyenne F)/écart type ligne de base F) pour chaque point temporel.
- Pour calculer la variation maximale de la fluorescence pendant la stimulation, sélectionnez 3 points consécutifs avec la fluorescence la plus élevée et calculez la moyenne.
- Répétez l’opération pour chaque pile d’images sur les stimuli et les mouches.
REMARQUE : Adaptez ces étapes si nécessaire en fonction du microscope spécifique, de la qualité du signal et du logiciel d’analyse d’image préféré.
Résultats
La figure 1 fournit des détails sur la chambre d’imagerie (figures 1A, B) et l’embout du cire (figure 1D) utilisés dans cette préparation. La figure 1 illustre également les principales étapes de la procédure de montage des mouches (figure 1C), de mise en place de la trompe (figure 1E), de dissection de la région cérébrale d’intérêt (figure 1F) et de stimulation du labelle avec un savourateur tout en enregistrant la fluorescence dans le cerveau (figure 1G). Pour quantifier les réponses induites par le goût dans les neurones récepteurs gustatifs primaires (GRN) de Drosophila melanogaster, des mouches avec l’expression Gr64f-Gal4 conduisant l’UAS-GCaMP6f ont été produites pour obtenir l’indicateur de calcium génétiquement exprimé dans tous les GRN « sucrés » sensibles au sucre du labelle 14,27,30,32,33,34,35. Pour ces expériences, un microscope confocal avec les composants suivants a été utilisé : un microscope fluorescent vertical avec une caméra sCMOS de 40 ips, des objectifs 10x et 40x, un disque rotatif confocal, des émetteurs dichroïques 488 et des lasers à semi-conducteurs de 488 nm. L’objectif 40x a été immergé dans AHL et centré sur la région cérébrale de la ZES pour localiser le signal de base GCaMP dans les terminaisons axonales de ces GRN labellaires (Figure 2A). Une image de fluorescence a été capturée toutes les 100 ms pendant la ligne de base (pas de stimulation), pendant 5 s de stimulation gustative (stimulateur déplacé sur le labelle) et après la stimulation jusqu’à ce que la fluorescence revienne à la ligne de base (Figure 2A,B). L’eau a été utilisée comme témoin négatif, et 1 M de saccharose a été utilisé comme témoin positif. La variation relative de la fluorescence a été calculée en ΔF/F (score z) pour 13 mouches et tracée au fil du temps pour montrer la cinétique des réponses calciques pendant la stimulation du goût (figure 2B). Le pic ΔF/F (score z) a été tracé et utilisé pour des comparaisons statistiques afin d’indiquer que la réponse du saccharose dans ces cellules est significativement plus élevée que dans l’eau (figure 2C). Cette technique montre que les GRN « doux » ont un fort pic au début du saccharose qui reste élevé avec une certaine décomposition au cours de la période de stimulation.
À titre de comparaison, ce protocole a été répété chez des mouches avec un pilote différent, Gr66a-Gal4, exprimant spécifiquement UAS-GCaMP6f dans tous les GRN « amers » sur le labelle 14,17,28,34,36. De même, les terminaisons axonales de ces GRN étaient situées dans la ZES : remarquez que le motif de projection est distinct des GRN sensibles au sucre (Figure 2D). La fluorescence a été capturée et analysée comme auparavant, à l’exception de 100 mM de caféine, qui a été utilisée comme témoin positif. La courbe calculée en moyenne à partir de 11 mouches montre un fort pic avec le début de la stimulation par la caféine, mais il y a aussi une petite réponse « off » avec la suppression du stimulus qui est connue pour se produire avec certains stimuli amers28 (Figure 2E). Cette méthode permet de quantifier à la fois les réponses « on » et « off » afin de caractériser les modèles temporels des réponses induites par le goût27,28. Ici, seuls les pics « on » ont été quantifiés pour indiquer que la réponse à la caféine est significativement plus forte que celle de l’eau (Figure 2F). Les expériences de la figure 2 sont hautement reproductibles et peuvent être utilisées pour s’assurer que le protocole fonctionne correctement.
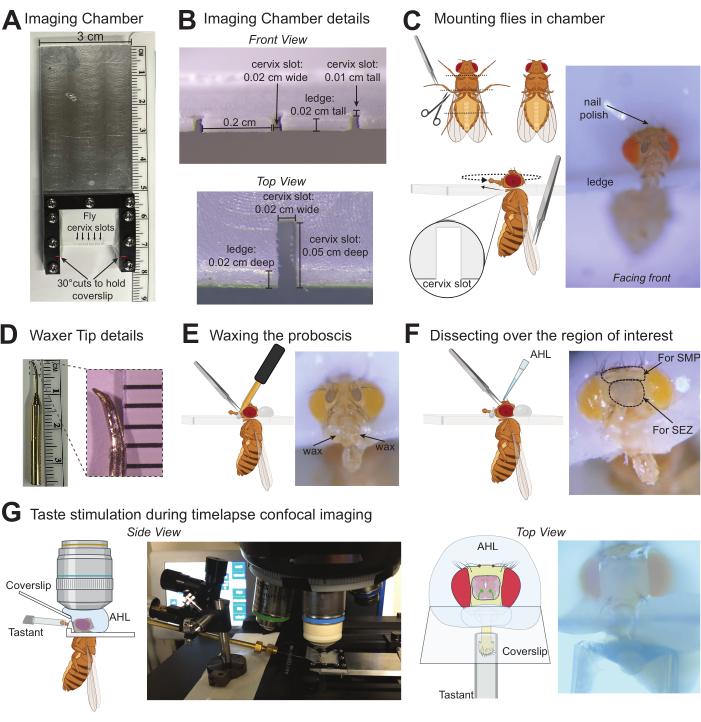
Figure 1 : Illustrations de protocole pour l’imagerie des réponses induites par le goût dans le cerveau de la drosophile. (A) Vue de dessus de la chambre d’imagerie personnalisée utilisée pour monter jusqu’à cinq mouches à la fois. (B) Détails de la chambre d’imagerie où les mouches sont montées avec des mesures qui s’adaptent confortablement au col de l’utérus de D. melanogaster. (C) Graphiques indiquant où couper les tarses (en haut à gauche) et comment monter la mouche dans la fente du col de l’utérus de la chambre d’imagerie à l’aide d’une pince (en bas à gauche). Photo d’une mouche montée dans la bonne position dans la chambre d’imagerie (à droite). (D) Photo de la pointe du cireur (à gauche), photo zoomée de la pointe pour indiquer la forme et la taille approximatives à cibler lors de l’utilisation d’une pierre à aiguiser pour modifier la pointe standard (à droite). (E) Illustration graphique de l’épilation à la cire de la trompe à l’aide d’une pince (à gauche), photo d’une mouche montée avec un labelle correctement ciré (à droite). (F) Illustration graphique représentant la dissection sur la région cérébrale d’intérêt et l’application de l’AHL (à gauche), photo d’une mouche avec des cercles pointillés autour de la zone de la cuticule à enlever lors du ciblage des régions cérébrales de la ZES ou de la SMP. X indique les régions de la cuticule à pincer pour la dissection (à droite). (G) Les graphiques et les photos indiquent la position de la mouche montée/disséquée, l’objectif d’immersion dans l’eau dans l’AHL, le stimulateur avec un goût sur la trompe et la lamelle formant une barrière entre ces solutions. La vue latérale a fait un zoom arrière (à gauche) et la vue de dessus était sous l’objectif 10x (à droite). Veuillez cliquer ici pour voir une version agrandie de cette figure.
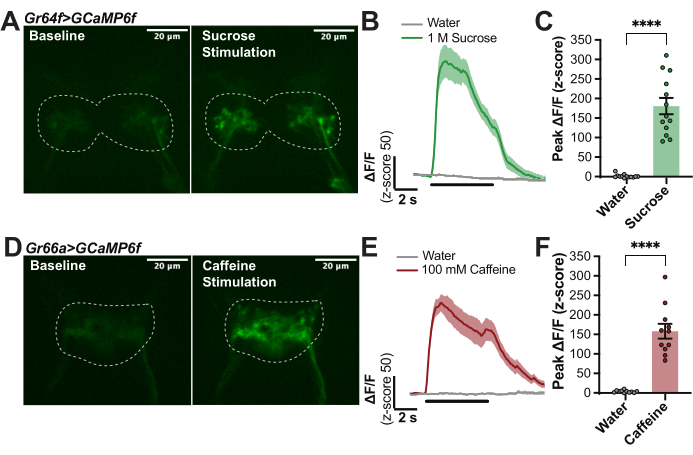
Figure 2 : Exemple de réponses calciques des GRN labellaires aux stimuli gustatifs. (A) Capture d’une image fixe à partir d’une pile d’images indiquant le niveau de fluorescence GCaMP chez une mouche avec Gr64f>GCaMP6f au départ et pendant la réponse maximale à 1 M de saccharose, barre d’échelle = 20 μm. Les pointillés indiquent le retour sur investissement de l’analyse. (B) Courbes de réponse calcique pour n = 14 mouches calculées comme ΔF/F (score z) et combinées pour l’eau (témoin négatif) et 1 M de saccharose (témoin positif) pour montrer la cinétique ; La ligne noire sous les courbes indique quand le stimulus est au-dessus du labelle. (C) Pic ΔF/F (score z) pour chaque mouche tracé à des fins de comparaisons statistiques. Test t apparié, ****p < 0,0001. (D) Capture fixe d’une vidéo indiquant le niveau de fluorescence de GCaMP chez une mouche avec Gr66a>GCaMP6f au départ et pendant la réponse maximale à 100 mM de caféine, barre d’échelle = 20 μm. Les pointillés indiquent le retour sur investissement de l’analyse. (E) Courbes de réponse calcique pour n = 11 mouches calculées comme ΔF/F (score z) et combinées pour l’eau (contrôle négatif) et 100 mM de caféine (contrôle positif) pour montrer la cinétique : remarquez la petite réponse « off », la ligne noire sous les courbes indique quand le stimulus est au-dessus du labelle. (F) Pic ΔF/F (score z) pour chaque mouche tracé à des fins de comparaisons statistiques. Test t apparié, ****p < 0,0001. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
L’un des aspects les plus difficiles de ce protocole est la dextérité de micromanipulation nécessaire pour cirer le labelle et effectuer les dissections ciblées. Une étape supplémentaire pour sécuriser le labelle est nécessaire pour stimuler uniformément chaque sensillum à travers cet organe sensoriel et visualiser les régions cérébrales d’intérêt. La chambre d’imagerie personnalisée utilisée ici est optimisée pour D. melanogaster, mais les spécifications de la chambre et l’approche de l’épilation à la cire peuvent devoir être modifiées pour d’autres insectes. Ce protocole peut être appliqué à d’autres drosophiles avec peu de modifications, mais d’autres membres du sous-ordre des Brachycères, tels que les abeilles et les moustiques, peuvent nécessiter des modifications aux étapes de montage et de dissection pour tenir compte des différences de morphologie des palpes labiaux et de la tête. L’alignement du micromanipulateur pour l’administration du goût peut également être difficile et nécessite des tests initiaux avec la platine de microscope spécifique pour l’optimisation. Si la cire est cassée pendant la stimulation, cela peut entraîner des fuites au cours desquelles l’AHL et le goût dans le capillaire entrent en contact. Tirer les capillaires et les limer avec une pierre à aiguiser pour qu’ils s’adaptent plus étroitement au labelle peut aider à empêcher le savourateur et l’AHL d’entrer en contact. Les mouches présentant des fuites ou des mouvements excessifs du cerveau doivent être exclues. Dans la mesure du possible, incluez toujours un témoin positif pour chaque animal afin de vous assurer que le labelle et les nerfs labellaires ne sont pas endommagés par l’épilation à la cire ou la dissection. Les exemples « sucré » et « amer » présentés ici sont recommandés comme expériences de contrôle robustes.
L’approche d’imagerie calcique in vivo décrite ici a été utilisée pour quantifier les réponses induites par le goût dans les neurones gustatifs primaires, les neurones d’ordre supérieur et l’ensemble de la ZES chez D. melanogaster afin d’identifier les récepteurs et les circuits gustatifs 8,14,17,18,19,20,27,28,30,31, 34,35,36,37,38,39,40,41,
42,43,44,45,46,47,48. Les applications répandues dans cet organisme modèle sont dues aux pilotes Gal4 et Split-Gal4 facilement disponibles ; ainsi, la nécessité pour les insectes génétiquement modifiés d’exprimer GCaMP dans des neurones d’intérêt spécifiques est un facteur limitant pour cette approche. Heureusement, avec les progrès de la technologie d’édition génomique, cela devient plus accessible pour les insectes au-delà des organismes modèles, et des réponses induites par le goût à l’aide de l’imagerie calcique ont récemment été signalées pour le ravageur Drosophila suzukii49 et pour les moustiques porteurs de vecteurs50. Comme pour toute imagerie calcique, une certaine optimisation initiale du rapport signal/bruit peut être nécessaire pour les neurones ciblés d’intérêt. Les signaux peuvent être améliorés en utilisant des versions plus lumineuses de GCaMP et en exprimant deux copies de GCaMP. La co-expression de la RFP dans les neurones cibles peut aider à visualiser les neurones cibles au départ et peut servir de contrôle pour le mouvement du cerveau dans les régions qui ont une propension à pulser.
Ce protocole est spécifiquement conçu pour isoler la chimiosensation du labelle en enlevant les tarses et les antennes, en épilant les palpes maxillaires et en limitant l’ingestion afin qu’aucun GRN pharyngé ne soit stimulé. Cependant, des ajustements à ce protocole peuvent être apportés pour inclure la chimiosensation des GRN tarsiens ou pharyngés. Si les tarses sont laissés intacts, les jambes peuvent être stimulées seules ou en complément du labelle en créant une grosse bulle de solution savoureuse à l’extrémité du capillaire. Il est possible qu’une mouche donne des coups de pied et déplace la lamelle si les tarses sont laissés intacts ; Par conséquent, il peut être envisagé d’épiler les tarses près de la base pour aider à prévenir les mouvements indésirables. L’exemple actuel comprend l’étape de coupe de l’œsophage pour éviter la stimulation du GRN pharyngé et pour mieux visualiser les projections labellaires dans la ZES, mais cette même préparation a déjà été adaptée pour quantifier les réponses du GRN pharyngé en laissant l’œsophage intact et en imageant les projections pharyngées latérales36. Cette application précédente utilisait un stimulus de sucre appétitif, que les mouches consommeront librement pour stimuler les GRN pharyngés, mais les mouches ne consommeront pas facilement un stimulus aversif pour activer les GRN pharyngés amers, ce qui est une limitation de cette approche. Une limitation supplémentaire est que les réponses des GRN situées dans les ailes de la drosophile11 ne peuvent pas être facilement étudiées avec cette approche.
Bien que l’imagerie calcique in vivo décrite ici soit devenue la méthode standard pour étudier les réponses induites par le goût d’ordre supérieur 8,18,19,20,28, il existe actuellement plusieurs autres approches pour quantifier les réponses du GRN labellaire primaire aux arômes chez les mouches. L’approche d’imagerie calcique in vivo décrite ici enregistre les changements de GCaMP dans les terminaisons axonales du cerveau, mais une approche ex vivo a également été utilisée pour quantifier le GCaMP du corps cellulaire dans les GRN33 labellaires. De même, une autre approche de montage a été décrite pour l’imagerie des corps cellulaires des GRN labellaires ou tarsiens chez des mouches intactes51. L’électrophysiologie continue d’être une technique populaire et efficace pour étudier les réponses des neurones gustatifs primaires chez les insectes 13,16,32,52,53,54,55,56,57,58,59,60,64,62,63,64,65. Cela ne nécessite pas la nécessité d’avoir des capteurs de calcium codés génétiquement et constitue une quantification plus directe de l’activité neuronale. Cependant, les réponses d’une seule sensille peuvent être enregistrées à la fois, tandis que l’imagerie calcique peut enregistrer simultanément une population complète de GRN. L’approche de l’imagerie calcique a été utilisée pour découvrir la dynamique temporelle unique des réponses « activées » et « désactivées » dans les GRN avec certains stimuli27,28, mais une avancée récente dans les enregistrements électrophysiologiques à partir de la base de la sensille gustative chez D. melanogaster permet maintenant de quantifier les réponses « désactivées » au niveau des potentiels d’action53. Il est intéressant de noter que la modulation de la sensibilité primaire au GRN par la faim a été détectée par l’imagerie calcique, mais pas au niveau des potentiels d’action avec l’électrophysiologie29, mais les enregistrements électrophysiologiques des pointes et l’imagerie calcique peuvent capturer un changement de sensibilité au GRN avec le régimealimentaire 30,66. Ainsi, l’électrophysiologie reste une approche importante et complémentaire à l’imagerie calcique pour identifier les ligands et les récepteurs du goût et pour comprendre comment divers facteurs modulent la sensibilité des neurones récepteurs gustatifs primaires.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts et rien à divulguer.
Remerciements
Nous tenons à remercier le Bloomington Drosophila Stock Center pour les stocks de mouches et l’IMF Labs de l’Université du Vermont pour leur aide dans la fabrication des chambres d’imagerie personnalisées. Nous tenons également à remercier BioRender pour la création des illustrations graphiques et Kayla Audette pour sa contribution à la conception de ces graphiques. Ce travail a été soutenu par de nouveaux fonds de démarrage de laboratoire de l’Université du Vermont et le prix numéro 2332375 de la National Science Foundation. Les graphiques de la figure 1 ont été générés avec www.BioRender.com.
matériels
| Name | Company | Catalog Number | Comments |
| CaCl2 | Sigma-Aldrich | C7902 | For AHL |
| Caffeine | Sigma-Aldrich | C0750 | For a "bitter" taste stimulus |
| Clear nail polish- quick dry | Many vendors | Example: Sally Hansen Xtreme wear (clear) | |
| CO2 fly pad station | Genesee Scientific | 59-122BC | Includes tubing, a gun to initially anesthetize flies, and a pad to deliver continuous anesthesia |
| CO2 supply (cylinders) | Airgas | USP50 | For anesthesia |
| Confocal or two-photon microscope | Many vendors | Upright microscope, high signal to noise and rapid capture capabilities, 10X air immersion objective, 25-40X water immersion objective, accompanying hardware and software | |
| Coverslips | Globe Scientific | 1404-15 | 22 x 22 mm, No 1.5: for this specific imaging chamber, score and cut in half to get 11 x 22 mm coverslips |
| D. melanogaster: Gr64f-Gal4 | Bloomington Drosophila Stock Center | 57669 | For driving GCaMP expression in 'sweet' gustatory receptor neurons of the labellum |
| D. melanogaster: Gr66a-Gal4 | Bloomington Drosophila Stock Center | 57670 | For driving GCaMP expression in 'bitter' gustatory receptor neurons of the labellum |
| D. melanogaster: UAS-GCaMP6f | Bloomington Drosophila Stock Center | 42747 | For getting GCaMP expression when crossed to a Gal4 driver line |
| Dental Waxer | Pearson Dental | 49-00-54 | Digital wax carver, comes with tips that can be modified and sharpened small enough to deliver wax along the fly proboscis |
| Dissection microscope | Many vendors | .63 - 6.3X for optimal viewing but with sufficient working distance to perform dissections under the microscope | |
| Dissection scissors | Fine Science Tools | 15000-08 | This pair or any similar dissection scissors are appropriate |
| Empty pipette tip box | Free- many vendors | For humidity chamber: needs enough space so that the imaging chamber can sit and the lid can close without bumping the chamber | |
| Filter flask | Millipore-Sigma | CLS431097 | For filtering AHL stocks |
| Glass capillary | World Precision Instruments | TW100-4 | This size fits well over the D. melanogaster labellum without needing modification, but other capillaries can be pulled and filed down to an appropriate size |
| HEPES | Sigma-Aldrich | BP310 | For AHL |
| ImageJ (FIJI) | NIH | https://imagej.nih.gov/ij | Image analysis software |
| Imaging Chamber | IMF Labs | Custom item | The custom-made chamber in this example can be ordered at https://www.uvm.edu/research/imf/forms/contact-us. Base: 6061 aluminum, Holding Clamps: Black Delrin (Acetal), Insert: Moisture Resistant polyester (PET). Manual and CNC milling machines for fabrication. |
| KCl | Sigma-Aldrich | P9541 | For AHL |
| Kim wipes | Millipore-Sigma | Z188956 | For humidity chamber, wiping off forceps, removing solutions from capillaries, etc. |
| MgCl2 | Sigma-Aldrich | M9272 | For AHL |
| Micromanipulator | Tritech Research | U-31CF, USM-6, MINJ-4 | This example uses a magnet to attach the micromanipulator to the stage, other configurations are possible |
| NaCl | Sigma-Aldrich | S7653 | For AHL |
| NaH2PO4 | Sigma-Aldrich | 567545 | For AHL |
| NaHCO3 | Sigma-Aldrich | S6014 | For AHL |
| p10 pipette and tips | Many vendors | For filling the capillaries with tastants | |
| p200 pipette and tips | Many vendors | For AHL | |
| Parafin wax | Many vendors | White/clear block of wax often found in craft stores | |
| Ribose | Sigma-Aldrich | W379301 | For AHL |
| Semi-sharp forceps | Fine Science Tools | 11252-20 | Blunted to approximately tip size C |
| Sharp forceps | Fine Science Tools | 11252-20 | Sharpened to tip size A |
| Sharpening stone | Fine Science Tools | 29000-00 | For modifying dental waxer tips and forceps |
| Sucrose | Sigma-Aldrich | S0389 | For a "sweet'"taste stimulus |
| Toothpick | Many vendors | Small tip for nail polish application |
Références
- Wangler, M. F., Yamamoto, S., Bellen, H. J. Fruit flies in biomedical research. Genetics. 199 (3), 639-653 (2015).
- Ryu, L., Kim, S. Y., Kim, A. J. From photons to behaviors: Neural implementations of visual behaviors in Drosophila. Front Neurosci. 16, 883640 (2022).
- Joseph, R. M., Carlson, J. R. Drosophila chemoreceptors: A molecular interface between the chemical world and the brain. Trends Genet. 31 (12), 683-695 (2015).
- Montell, C. Drosophila sensory receptors-a set of molecular Swiss Army knives. Genetics. 217 (1), 1-34 (2021).
- Scott, K. Gustatory processing in Drosophila melanogaster. Annu Rev Entomol. 63, 15-30 (2018).
- Starostina, E., et al. A Drosophila DEG/ENaC subunit functions specifically in gustatory neurons required for male courtship behavior. J Neurosci. 32 (13), 4665-4674 (2012).
- Chen, Y., Amrein, H. Ionotropic receptors mediate Drosophila oviposition preference through sour gustatory receptor neurons. Curr Biol. 27 (18), 2741-2750.e4 (2017).
- Guillemin, J., et al. Taste cells expressing ionotropic receptor 94e reciprocally impact feeding and egg laying in Drosophila. Cell Rep. 43, 114625 (2024).
- Ostojic, I., et al. Positive and negative gustatory inputs affect Drosophila lifespan partly in parallel to dFOXO signaling. Proc Natl Acad Sci U S A. 111 (22), 8143-8148 (2014).
- Stocker, R. F. The organization of the chemosensory system in Drosophila melanogaster: A review. Cell Tissue Res. 275 (1), 3-26 (1994).
- Raad, H., Ferveur, J. -. F., Ledger, N., Capovilla, M., Robichon, A. Functional gustatory role of chemoreceptors in Drosophila wings. Cell Rep. 15 (7), 1442-1454 (2016).
- Montell, C. A taste of the Drosophila gustatory receptors. Curr Opin Neurobiol. 19 (4), 345-353 (2009).
- Weiss, L. A., Dahanukar, A., Kwon, J. Y., Banerjee, D., Carlson, J. R. The molecular and cellular basis of bitter taste in Drosophila. Neuron. 69 (2), 258-272 (2011).
- Jaeger, A. H., et al. A complex peripheral code for salt taste in Drosophila. Elife. 7, 37167 (2018).
- Freeman, E. G., Dahanukar, A. Molecular neurobiology of Drosophila taste. Curr Opin Neurobiol. 34, 140-148 (2015).
- Delventhal, R., Kiely, A., Carlson, J. R. Electrophysiological recording from Drosophila labellar taste sensilla. J Vis Exp. 84, e51355 (2014).
- Marella, S., et al. Imaging taste responses in the fly brain reveals a functional map of taste category and behavior. Neuron. 49 (2), 285-295 (2006).
- Shiu, P. K., Sterne, G. R., Engert, S., Dickson, B. J., Scott, K. Taste quality and hunger interactions in a feeding sensorimotor circuit. Elife. 11, e79887 (2022).
- Li, J., Dhaliwal, R., Stanley, M., Junca, P., Gordon, M. D. Functional imaging and connectome analyses reveal organizing principles of taste circuits in Drosophila. bioRxiv. , (2024).
- Junca, P., Stanley, M., Musso, P. -. Y., Gordon, M. D. Modulation of taste sensitivity by the olfactory system in Drosophila. bioRxiv. , (2021).
- Elliott, D. A., Brand, A. H. The GAL4 system: A versatile system for the expression of genes. Drosophila Methods Protoc. , 79-95 (2008).
- Riabinina, O., Potter, C. J., Dahmann, C. . Drosophila: Methods and Protocols. , 53-78 (2016).
- Diegelmann, S., Bate, M., Landgraf, M. Gateway cloning vectors for the LexA-based binary expression system in Drosophila. Fly. 2 (4), 236-239 (2008).
- Zhang, Y., et al. Fast and sensitive GCaMP calcium indicators for imaging neural populations. Nature. 615 (7954), 884-891 (2023).
- Ohkura, M., et al. Genetically encoded green fluorescent Ca2+ indicators with improved detectability for neuronal Ca2+ signals. PLoS One. 7 (12), e51286 (2012).
- Arntsen, C., Guillemin, J., Audette, K., Stanley, M. Tastant-receptor interactions: Insights from the fruit fly. Front Nutr. 11, 1394697 (2024).
- Stanley, M., Ghosh, B., Weiss, Z. F., Christiaanse, J., Gordon, M. D. Mechanisms of lactic acid gustatory attraction in Drosophila. Curr Biol. 31 (16), 3525-3537.e6 (2021).
- Devineni, A. V., Deere, J. U., Sun, B., Axel, R. Individual bitter-sensing neurons in drosophila exhibit both on and off responses that influence synaptic plasticity. Curr Biol. 31 (24), 5533-5546.e7 (2021).
- Inagaki, H. K., et al. Visualizing neuromodulation in vivo: Tango-mapping of dopamine signaling reveals appetite control of sugar sensing. Cell. 148 (3), 583-595 (2012).
- May, C. E., et al. High dietary sugar reshapes sweet taste to promote feeding behavior in drosophila melanogaster. Cell Rep. 27 (6), 1675-1685.e7 (2019).
- May, C. E., Rosander, J., Gottfried, J., Dennis, E., Dus, M. Dietary sugar inhibits satiation by decreasing the central processing of sweet taste. Elife. 9, e54530 (2020).
- Jiao, Y., Moon, S. J., Wang, X., Ren, Q., Montell, C. Gr64f is required in combination with other gustatory receptors for sugar detection in Drosophila. Curr Biol. 18 (22), 1797-1801 (2008).
- Chen, H. -. L., Stern, U., Yang, C. -. H. Molecular control limiting sensitivity of sweet taste neurons in Drosophila. Proc Natl Acad Sci USA. 116 (40), 20158-20168 (2019).
- Devineni, A. V., Sun, B., Zhukovskaya, A., Axel, R. Acetic acid activates distinct taste pathways in Drosophila to elicit opposing, state-dependent feeding responses. Elife. 8, e47677 (2019).
- Engert, S., Sterne, G. R., Bock, D. D., Scott, K. Drosophila gustatory projections are segregated by taste modality and connectivity. Elife. 11, e78110 (2022).
- Ledue, E. E., et al. Starvation-induced depotentiation of bitter taste in Drosophila. Curr Biol. 26 (21), 2854-2861 (2016).
- Mcdowell, S. A. T., Stanley, M., Gordon, M. D. A molecular mechanism for high salt taste in Drosophila. Curr Biol. 32 (14), 3070-3081.e7 (2022).
- Deere, J. U., Devineni, A. V. Taste cues elicit prolonged modulation of feeding behavior in Drosophila. iScience. 25 (10), 105159 (2022).
- Deere, J. U., et al. Selective integration of diverse taste inputs within a single taste modality. Elife. 12, (2023).
- Chu, B., Chui, V., Mann, K., Gordon, M. D. Presynaptic gain control drives sweet and bitter taste integration in Drosophila. Curr Biol. 24 (17), 1978-1984 (2014).
- Yao, Z., Scott, K. Serotonergic neurons translate taste detection into internal nutrient regulation. Neuron. 110 (6), 1036-1050.e7 (2022).
- Cameron, P., Hiroi, M., Ngai, J., Scott, K. The molecular basis for water taste in Drosophila. Nature. 465 (7294), 91-95 (2010).
- Jourjine, N., Mullaney, B. C., Mann, K., Scott, K. Coupled sensing of hunger and thirst signals balances sugar and water consumption. Cell. 166 (4), 855-866 (2016).
- Kim, H., Kirkhart, C., Scott, K. Long-range projection neurons in the taste circuit of Drosophila. Elife. 6, e23386 (2017).
- Kirkhart, C., Scott, K. Gustatory learning and processing in the Drosophila mushroom bodies. J Neurosci. 35 (15), 5950-5958 (2015).
- Steck, K., et al. Internal amino acid state modulates yeast taste neurons to support protein homeostasis in Drosophila. Elife. 7, e31625 (2018).
- Münch, D., Goldschmidt, D., Ribeiro, C. The neuronal logic of how internal states control food choice. Nature. 607 (7920), 747-755 (2022).
- Taisz, I., et al. Generating parallel representations of position and identity in the olfactory system. Cell. 186 (12), 2556-2573.e2 (2023).
- Cavey, M., et al. Increased sugar valuation contributes to the evolutionary shift in egg-laying behavior of the fruit pest Drosophilasuzukii. PLoS Biol. 21 (12), e3002432 (2023).
- Jové, V., et al. Sensory discrimination of blood and floral nectar by Aedes aegypti mosquitoes. Neuron. 108 (6), 1163-1180.e2 (2020).
- Shankar, S., Calvert, M. E., Yew, J. Y. Measuring physiological responses of Drosophila sensory neurons to lipid pheromones using live calcium imaging. J Vis Exp. (110), e53392 (2016).
- Dahanukar, A., Lei, Y. -. T., Kwon, J. Y., Carlson, J. R. Two gr genes underlie sugar reception in Drosophila. Neuron. 56 (3), 503-516 (2007).
- Dweck, H. K. M., Carlson, J. R. Base recording: A technique for analyzing responses of taste neurons in Drosophila. J Vis Exp. (205), e66665 (2024).
- Dweck, H. K. M., Talross, G. J. S., Luo, Y., Ebrahim, S. A. M., Carlson, J. R. Ir56b is an atypical ionotropic receptor that underlies appetitive salt response in Drosophila. Curr Biol. 32 (8), 1776-1787.e4 (2022).
- Park, J., Carlson, J. R. Physiological responses of the Drosophila labellum to amino acids. J Neurogenet. 32 (1), 27-36 (2018).
- Wang, W., et al. Sugar sensation and mechanosensation in the egg-laying preference shift of Drosophilasuzukii. Elife. 11, e81703 (2022).
- Xiao, S., Baik, L. S., Shang, X., Carlson, J. R. Meeting a threat of the Anthropocene: Taste avoidance of metal ions by Drosophila. Proc Natl Acad Sci USA. 119 (25), e2204238119 (2022).
- Ganguly, A., et al. Requirement for an otopetrin-like protein for acid taste in Drosophila. Proc Natl Acad Sci USA. 118 (51), e2110641118 (2021).
- Lee, Y., Moon, S. J., Montell, C., Snyder, S. H. Multiple gustatory receptors required for the caffeine response in Drosophila. Proc Natl Acad Sci USA. 106 (11), 4495-4500 (2009).
- Lee, Y., Poudel, S., Kim, Y., Thakur, D., Montell, C. Calcium taste avoidance in Drosophila. Neuron. 97 (1), 67-74.e4 (2018).
- Mi, T., et al. Alkaline taste sensation through the alkaliphile chloride channel in Drosophila. Nat Metab. 5 (3), 466-480 (2023).
- Rimal, S., et al. Mechanism of acetic acid gustatory repulsion in Drosophila. Cell Rep. 26 (6), 1432-1442.e4 (2019).
- Zhang, Y. V., Ni, J., Montell, C. The molecular basis for attractive salt-taste coding in Drosophila. Science. 340 (6138), 1334-1338 (2013).
- Aryal, B., Dhakal, S., Shrestha, B., Lee, Y. Molecular and neuronal mechanisms for amino acid taste perception in the Drosophila labellum. Curr Biol. 32 (6), 1376-1386.e4 (2022).
- Shrestha, B., Aryal, B., Lee, Y. The taste of vitamin C in Drosophila. EMBO Rep. 24 (6), e56319 (2023).
- Ganguly, A., Dey, M., Scott, C., Duong, V. -. K., Arun Dahanukar, A. Dietary macronutrient imbalances lead to compensatory changes in peripheral taste via independent signaling pathways. J Neurosci. 41 (50), 10222 (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon