Method Article
В естественных условиях Кальциевая визуализация нервных реакций, вызванных вкусом, у взрослых дрозофил
В этой статье
Резюме
Подход к визуализации кальция позволяет регистрировать вкусовые реакции в мозге бодрствующих мух, в то время как раствор наносится на лабеллум. В качестве примера используются первичные вкусовые реакции у Drosophila melanogaster , но этот протокол может быть адаптирован для изучения нижестоящих нейронов или других видов.
Аннотация
В течение почти двух десятилетий визуализация кальция in vivo была эффективным методом измерения клеточных реакций на вкусовые стимулы в модельном организме плодовой мушки, Drosophila melanogaster. Ключевым преимуществом этой методологии является ее способность записывать вызванные вкусом нейронные реакции у бодрствующих животных без необходимости анестезии. В этом подходе используются бинарные системы экспрессии (например, Gal4-UAS) для экспрессии индикатора кальция GCaMP в конкретных нейронах, представляющих интерес. Этот протокол описывает процедуру, при которой мухи, экспрессирующие GCaMP, устанавливаются с надежно расположенным лабеллумом, что позволяет регистрировать флуоресценцию в мозге с миллисекундным разрешением под конфокальным микроскопом, в то время как раствор наносится на лабеллум, стимулируя все лабеллярные вкусовые ощущения. Представленные примеры сосредоточены на реакциях кальция в первичных вкусовых рецепторных нейронах D. melanogaster. Тем не менее, этот подход может быть адаптирован для записи от других нейронов, представляющих интерес в мозге дрозофилид или других видов насекомых. Этот метод визуализации позволяет исследователям одновременно регистрировать коллективные реакции кальция от групп вкусовых нейронов по всему лабеллуму, дополняя электрофизиологические записи зонда, которые количественно оценивают потенциалы действия отдельных нейронов. Описанный здесь метод визуализации кальция in vivo сыграл важную роль в раскрытии молекулярных и клеточных механизмов хемоощущения, выявлении уникальных временных паттернов реакции в первичных вкусовых нейронах, исследовании механизмов вкусовой модуляции и изучении обработки вкуса в последующих контурах.
Введение
Плодовая муха, Drosophila melanogaster, известна своими мощными инструментами генетических исследований, доступными в этом модельном организме. Эти инструменты обеспечивают возможность легко манипулировать определенными генами в клетках-мишенях, что делает их идеальными для исследования фундаментальных нейронных цепей, таких как зрение и хемочувствительность 1,2,3. Зондирование посредством контактной хемоощущения является ключевым нейронным путем, который регулирует поведение, связанное с кормлением, спариванием, размножением и, в конечном счете, выживанием и приспособленностью животных 4,5,6,7,8,9. Понимание того, как эта важная хемосенсорная информация кодируется и передается, требует описания активности нейронов в цепях, которые активируются вкусовыми стимулами.
У D. melanogaster наружные вкусовые рецепторные нейроны (GRN) расположены на передних конечностях, хоботке и крыльях 10,11. Лабеллум на конце хоботка содержит волосовидные структуры, называемые сенсиллами, которые могут быть отображены по их морфологии в зависимости от размера: длинные (L-тип), промежуточные (I-тип) и короткие (S-тип)10. Большая часть GRN сосредоточена на этом органе чувств, причем каждая сенсилла содержит 2-4 различных типа GRN, так что каждая вкусовая модальность распределена по лабеллуму 12,13,14,15. В то время как электрофизиологические записи зонда могут быть использованы для количественной оценки потенциалов действия, поступающих от GRN в одной сенсилле16, in vivo визуализация кальция может быть использована для выделения активности конкретного типа GRN по всему лабеллуму14,17. Этот же метод визуализации кальция может быть также использован для изучения нейронных реакций в последующих вкусовых контурах 18,19,20. Для визуализации кальция требуются бинарные системы экспрессии, такие как Gal4-UAS 21,22,23, и скрещивание драйверной линии, содержащей клеточно-специфические активаторы транскрипции, с эффекторной линией, чтобы получить экспрессию GCaMP в интересующих нейронах. Когда внутриклеточный уровень кальция повышается, эти генетически кодируемые показатели кальция увеличиваются в интенсивности флуоресценции, так что уровень флуоресценции коррелирует с изменениями нейрональной активности24,25.
Здесь описан метод использования визуализации кальция для наблюдения за нейронными реакциями на вкусовые стимулы in vivo. Общая цель этого метода состоит в том, чтобы стимулировать только лабеллярные GRN для количественной оценки индуцированных вкусом нейронных реакций в мозге бодрствующих мух. Приведены примеры использования этого метода для регистрации ответов в первичных GRN лабеллума у D. melanogaster, а также обсуждаются преимущества и проблемы использования этого подхода. Этот препарат был разработан для того, чтобы позволить экспериментаторам наносить раствор на обездвиженную муху лабеллум, находясь под конфокальным микроскопом, чтобы регистрировать нейронные реакции при погружении всего органа чувств в раствор, что происходит в естественных условиях. Описанный здесь подход к визуализации кальция in vivo может быть использован для выявления новых взаимодействий между тастантом и рецептором 8,14,26,27, временных деталей ответов GRN 27,28, молекулярных механизмов модуляции GRN29,30 и обработки вкуса в последующих контурах 8,18,19,20. 28,31.
протокол
Подробная информация о реагентах и оборудовании, использованных в этом исследовании, приведена в Таблице материалов.
1. Приготовление раствора гемолимфоподобного (АГЛ) раствора для взрослых
- Приготовьте стоковый раствор, содержащий 108 мМ NaCl, 5 мМ KCl, 4 мМ NaHCO3, 1 мМ2PO4, 5 мМ HEPES и 15 мМ рибозы.
ПРИМЕЧАНИЕ: Рибоза используется в качестве неэнергетического сахара для поддержания осмолярности без изменения уровня питательных веществ в мозге. - Отрегулируйте pH этого раствора до 7,5 перед фильтрацией и хранением при температуре 4 °C. Проверьте осмолярность АГЛ после регулировки pH, чтобы обеспечить постоянство между препаратами.
- Подготовьте отдельные запасы по 1 М CaCl2 и 1 М MgCl2, процедите и храните при комнатной температуре.
- Чтобы приготовить аликвоту основного запаса АГЛ, добавьте небольшой объем кальция и магния, чтобы получить конечные концентрации 2 мМ кальция и 8,2 мМ магния. Этот АГЛ можно хранить при температуре 4 °C и использовать до одного месяца, используя для экспериментов небольшие аликвоты, доведенные до комнатной температуры.
2. Крепление мушек на камеру визуализации
- Перед установкой мушек заточите кончик стоматологического воскового аппарата в маленькую заостренную чашку с помощью точильного камня (Рисунок 1D). Приложите заточенный кончик к восковому аппарату и включите его для предварительного нагрева. Настройки нагрева будут зависеть от типа и длины наконечника: необходима минимальная температура, при которой воск остается расплавленным при контакте (в данном примере работает 50,5 °C).
ПРИМЕЧАНИЕ: Проволоку можно обернуть вокруг конца стоматологического воскового аппарата, чтобы прикрепить заточенный металлический наконечник в качестве альтернативы. - Аккуратно обезболить 1-5 мух (следуя утвержденным в учреждении протоколам). Сведите к минимуму время воздействия анестезии, так как длительное воздействие CO2 или холода может повлиять на поведение. Для лечения CO2 используйте подушечку от мухи, которая обеспечивает непрерывный, равномерный поток 99,9% CO2 со скоростью 5 л/мин под диссекционным микроскопом.
- С помощью ножниц для вскрытия удалите части ног, разрезав средние и задние ноги в бедренном/большеберцовом суставе и передние ноги в вертеле. Используйте тупые щипцы, чтобы помочь манипулировать мухой. Обрезка лапок предотвратит ощущение предплюсны и брыкание покровного стекла или стимулятора вкуса.
- Возьмите муху за крылья с помощью тупых щипцов, чтобы расположить муху так, чтобы голова находилась над целевым слотом шейки матки камеры визуализации, а тело — ниже. Полезно начинать полет полностью вправо или влево. Используя тупую сторону ножниц и тупые щипцы, аккуратно протолкните головку и грудную клетку одновременно в прорезь.
- Надежно обрабатывая прорезь, вставьте ее в заднюю часть прорези и осторожно переместите ее так, чтобы мушка была обращена к передней части патронника. Избегайте слишком сильного поворота головки не на одной линии с грудной клеткой.
- Повторите для такого количества мух, которое необходимо (эта камера визуализации может вместить до 5 мух).
- Соберите небольшую капельку лака для ногтей на конце зубочистки и нанесите тонкий слой, чтобы закрепить голову мухи на камере визуализации.
ПРИМЕЧАНИЕ: точная область нанесения лака для ногтей зависит от того, какая часть мозга визуализируется. При визуализации СЭЗ (как показано здесь) или других нижних медиальных областей, лак для ногтей можно обильно нанести на верхнюю часть головы мухи, но для визуализации верхних медиальных областей лак для ногтей можно нанести минимально на макушку головы и добавить сбоку возле глаз, чтобы оставить эту область свободной для вскрытия. Этот протокол оптимизирован только для стимуляции вкуса без обоняния, но если летучие вещества лака для ногтей вызывают беспокойство, используйте воск или УФ-клей в качестве альтернативных методов закрепления головки мухи.
3. Восковая эпиляция хоботка в вытянутом положении
- Возьмите восковой аппарат одной рукой и соберите небольшую капельку воска на кончике.
- С другой стороны, с помощью полуострых щипцов захватите один верхнечелюстной щупик и аккуратно вытяните и удерживайте хоботок в полном разгибании.
ПРИМЕЧАНИЕ: Будьте осторожны и держите только верхнечелюстной щупик, так как защемление кутикулы на хоботке увеличивает вероятность повреждения. Не приступайте к работе, если хоботок защемлен или кутикула хоботка проколота. В качестве альтернативы щипцам можно использовать небольшой кусачок для вытягивания хоботка с помощью отсасывания во время нанесения воска. - Прикоснитесь кончиком воскового аппарата к камере у основания хоботка, пока воск не начнет течь, затем переместитесь, чтобы соприкоснуться с основанием хоботка. Нанесите воск на полпути вниз по стержню, но не касайтесь сенсиллы этикетки воском или воском. Воск с этой стороны будет удерживать хоботок на месте. Не продолжайте, если воск или восковой аппарат в любое время коснулись сенсилл.
- Нанесите воск описанным выше методом на другую сторону, сделав непрерывный мостик из воска над хоботком.
- Полностью вытяните хоботок как можно прямее. При необходимости перемещение хоботка может быть выполнено путем повторного нагрева воска и осторожного нажатия хоботка в нужное положение.
- Повторите то же самое для других мушек, установленных в той же камере.
- Выключите CO2 или удалите мух от ледяной анестезии. Поместите установленные мушки в камеру для влажности на 60 минут для восстановления (чистая, пустая коробка для наконечника пипетки с влажными салфетками без ворса).
4. Диссекция для выявления интересующей области мозга
- Удалите мух из камеры влажности. Мухи должны быть явно живыми, активно двигать брюшком, ногами, усиками. Перед вскрытием установите конфокальный или двухфотонный микроскоп.
- Включите воскоприемник, чтобы устранить возможные разрывы в воске во время вскрытия и подготовить AHL комнатной температуры.
- С помощью очень острых щипцов отщипните оба усика, затем зажмите кутикулу, чтобы обеспечить отверстие для введения одной стороны острых щипцов. Проведите щипцами под кутикулой, чтобы удалить ее из области, охватывающей интересующую область мозга. На рисунке 1F обозначен крестик над участками кутикулы, на которые нацелены щипцы для удаления.
- Промойте открытый мозг в AHL, обильно нанеся AHL (~100 μL) на голову, а затем удалите все, кроме тонкого слоя HHL, чтобы предотвратить высыхание мозга.
ПРИМЕЧАНИЕ: Если воск сломался в какой-либо момент и его необходимо отремонтировать, кратковременно удалите весь AHL вокруг головки перед повторным нагревом воска, чтобы закрепить хоботок в выдвинутом положении. - С помощью острых щипцов удалите воздушные мешочки и любой крупный мусор, покрывающий мозг. Избегайте проникновения в мозг, держа кончики щипцов на виду.
- Промойте с AHL ~3 раза, чтобы удалить весь мелкий мусор.
- Убедитесь, что интересующая область мозга хорошо видна. Чтобы конкретно визуализировать подпищеводную зону (СЭЗ), как в этом примере, разрежьте пищевод у основания рядом с хоботком и рядом с точкой, где он проходит через мозг, зажав очень острыми щипцами и удалив этот кусок, чтобы обнажить СЭЗ.
ПРИМЕЧАНИЕ: Мухи не могут глотать растворы после удаления пищевода, и не может произойти активация глоточного GRN. - Поместите покровное стекло размером 10 x 20 мм под угол камеры для препарирования под микроскопом размером 10 x 20 мм. Убедитесь, что он находится у основания хоботка, не разрушая воск. Кончик лабеллума не должен касаться покровного стекла.
5. Визуализация и стимуляция вкуса
- Включите конфокальный или двухфотонный микроскоп и будьте готовы к захвату изображения. Установите микроманипулятор с капиллярной трубкой, которая расположена таким образом, чтобы доставлять вкусовые вещества к мухе, когда они находятся на предметном столике микроскопа.
Двухфотонная визуализация может захватывать флуоресценцию нейронов, которые находятся глубже в ткани мозга. - Загрузите ~2 мкл воды (или другой отрицательный контроль) в капиллярную трубку
стимулятор на предметном столике микроскопа. - Найдите рассеченную муху и сфокусируйтесь на лабеллуме с помощью 10-кратного погружного светового поля. Совместите капилляр с лабеллумом под этим видом. Дополнительные камеры, направленные на лабеллум мухи, могут быть включены для наблюдения за выравниванием капилляра с мухой под разными углами.
ПРИМЕЧАНИЕ: Убедитесь, что все этикеточные сенсиллы стимулируются раствором во время выравнивания; Если положение стимулятора или лабеллума недостаточно перпендикулярно для этого, отрегулируйте соответствующим образом. Капилляры можно потянуть и подпилить с помощью точильного камня, чтобы обеспечить более плотное прилегание к лабеллуму. - Оставьте капилляр расположенным прямо перед лабеллумом, близко, но не касаясь.
- Переместите предметную область так, чтобы интересующая область мозга была центрирована, и переключитесь на объектив с большим увеличением, погружением в воду (в этом примере используется 40-кратный раз).
- Добавьте примерно 200 μL AHL в верхнюю часть мозга, чтобы установить контакт с объективом для погружения. Удалите все пузыри.
- Сориентируйте фокус с помощью светлого поля, чтобы осторожно перемещаться в z-плоскости, чтобы найти край кутикулы, который был удален, и центрировать интересующую область мозга.
- Переключитесь на мощность лазера 488 нм, чтобы найти экспрессию GCaMP в интересующей области.
ПРИМЕЧАНИЕ: В зависимости от линии драйвера и используемой версии GCaMP может потребоваться некоторая первоначальная оптимизация для усиления соотношения сигнал/шум для отдельных приготовлений. Коэкспрессирующий RFP может быть полезен для нейронов с низкой базовой флуоресценцией GCaMP. - Подготовьте коллекцию таймлапс-изображений. Скорость будет зависеть от конкретного микроскопа и сигнала GCaMP, но оптимальным является захват хотя бы одного изображения каждые ~100 мс.
ПРИМЕЧАНИЕ: Захват одной Z-плоскости флуоресценции с течением времени оптимизирует скорость захвата для получения подробной кинетики кальция. Стеки изображений, сделанные в нескольких плоскостях Z в каждой временной точке, могут замедлить скорость захвата, но будут регистрировать отклики на нейриты, которые находятся на разной глубине в ткани. - Собрав не менее 5 с исходной флуоресценции, вручную переместите стимулятор так, чтобы капилляр покрывал лабеллум в течение определенного периода времени (5 с в этом примере), затем удалите стимул и захватывайте столько, сколько нужно.
- Снимите AHL и вернитесь к 10-кратному светлому полю, чтобы убедиться, что покровное стекло, стимулятор и лабеллум остаются в том же положении.
ПРИМЕЧАНИЕ: Если стимулятор плохо выровнен с лабеллумом или повернут слишком далеко, лабеллум может быть перемещен, или капилляр может попасть на камеру визуализации, потенциально разрушая воск и создавая утечку из AHL. - Снимите камеру визуализации. Удалите первый раствор безворсовой салфеткой и промойте пипетку водой. Затем нанесите пипетку ~2 мкл следующего тастанта в капиллярную трубку.
- Переместите камеру визуализации обратно в рабочую область и повторите шаги 5.4-5.12 для этого решения.
ПРИМЕЧАНИЕ: Высокое поверхностное натяжение большинства вкусовых добавок представляет собой остаточные химические вещества, остающиеся на лету. Однако, если вкусовые вещества сильно насыщены или вязки, воду можно несколько раз перемещать по лабеллуму, чтобы промыть орган чувств перед следующим раздражителем. - Повторите для любого количества решений для этой мухи.
- Вернитесь к шагу 3, чтобы подготовить следующую муху к визуализации.
6. Анализ изображений
- Откройте стек изображений для анализа в программном обеспечении для обработки изображений. При необходимости выполните фоновое вычитание с использованием области за пределами сигнала GCaMP.
- Выберите узкую область интереса (ROI) вокруг проекций, которые необходимо количественно оценить, с помощью инструмента «Произвольная форма» или «Фигура» и убедитесь, что выборка применена ко всем изображениям в стеке.
- Сгенерируйте список показаний флуоресценции за определенный период времени для этой рентабельности инвестиций и экспортируйте его в электронную таблицу для дальнейшей обработки. Используйте профиль оси Z графика в ImageJ (FIJI) или аналогичную функцию в выбранном программном обеспечении для обработки изображений.
- В электронной таблице выберите 10 последовательных временных точек во время базовой записи на шаге 5.10 в качестве репрезентативной базовой линии. Рассчитайте среднее значение и стандартное отклонение.
- Чтобы получить ΔF/F в процентах, рассчитайте ((F - среднее базовое F)/базовое среднее F) * 100) для каждой временной точки. Чтобы получить ΔF/F в виде z-оценки, рассчитайте ((F - средняя базовая линия F)/базовая линия стандартного отклонения F) для каждой временной точки.
- Чтобы рассчитать пиковое изменение флуоресценции во время стимуляции, выберите 3 последовательные точки с наибольшей флуоресценцией и рассчитайте среднее значение.
- Повторите для каждой стопки изображений раздражители и мухи.
ПРИМЕЧАНИЕ: При необходимости адаптируйте эти шаги в зависимости от конкретного микроскопа, качества сигнала и предпочитаемого программного обеспечения для анализа изображений.
Результаты
На рисунке 1 представлена подробная информация о камере для визуализации (рис. 1A, B) и наконечнике воскового аппарата (рис. 1D), используемых в данном препарате. На рисунке 1 также показаны основные этапы процедуры посадки мух (рисунок 1C), установки хоботка воском на место (рисунок 1E), рассечения интересующей области мозга (рисунок 1F) и стимуляции лабеллума с помощью тастанта при регистрации флуоресценции в мозге (рисунок 1G). Для количественной оценки индуцированных вкусом реакций в первичных вкусовых рецепторных нейронах (GRN) мух Drosophila melanogaster с GR64f-Gal4 была получена управляющая экспрессия UAS-GCaMP6f с целью получения показателя кальция, генетически экспрессирующегося во всех чувствительных к сахару «сладких» GRN лабеллума 14,27,30,32,33,34,35. Для этих экспериментов был использован конфокальный микроскоп со следующими компонентами: вертикальный флуоресцентный микроскоп с камерой sCMOS со скоростью 40 кадров в секунду, объективами 10x и 40x, конфокальным вращающимся диском, дихроичными излучателями 488 и твердотельными лазерами с длиной волны 488 нм. Объектив 40x был погружен в AHL и сосредоточен в области мозга SEZ для определения местоположения исходного сигнала GCaMP в терминалах аксонов этих маркировочных GRN (рис. 2A). Флуоресцентное изображение регистрировалось каждые 100 мс во время исходного уровня (без стимуляции), в течение 5 с стимуляции вкуса (стимулятор перемещался по лабеллуму) и после стимуляции до тех пор, пока флуоресценция не возвращалась к исходному уровню (рис. 2A, B). В качестве отрицательного контроля использовали воду, а в качестве положительного контроля – 1 М сахарозу. Относительное изменение флуоресценции было рассчитано как ΔF/F (z-оценка) для 13 мух и построено на графике с течением времени, чтобы показать кинетику реакций кальция во время стимуляции вкуса (рис. 2B). Был построен график пикового значения ΔF/F (z-оценка), который был использован для статистических сравнений, чтобы показать, что реакция сахарозы в этих клетках значительно выше, чем в воде (рис. 2C). Этот метод фиксирует, что «сладкие» GRN имеют сильный пик при вступлении сахарозы, который остается высоким с некоторым спадом в течение периода стимуляции.
Для сравнения, этот протокол был повторен у мух с другим драйвером, Gr66a-Gal4, экспрессирующим UAS-GCaMP6f специфически во всех «горьких» GRN на лабеллуме 14,17,28,34,36. Аналогичным образом, терминалы аксонов этих GRN были расположены в СЭЗ: обратите внимание, что рисунок проекции отличается от GRN, чувствительных к сахару (рис. 2D). Флуоресценцию фиксировали и анализировали, как и раньше, за исключением 100 мМ кофеина, который использовался в качестве положительного контроля. Кривая, усредненная по 11 мухам, показывает сильный пик с началом стимуляции кофеином, но также существует небольшая реакция «выключения» при удалении стимула, которая, как известно, происходит при возникновении определенных горьких стимулов28 (рисунок 2E). Этот метод позволяет количественно оценить как «включенные», так и «выключенные» реакции для характеристики временных паттернов реакций, вызванных вкусом27,28. Здесь были количественно определены только пики «включения», указывающие на то, что реакция на кофеин значительно сильнее, чем на воду (рисунок 2F). Эксперименты, показанные на рисунке 2, обладают высокой воспроизводимостью и могут быть использованы для обеспечения правильной работы протокола.
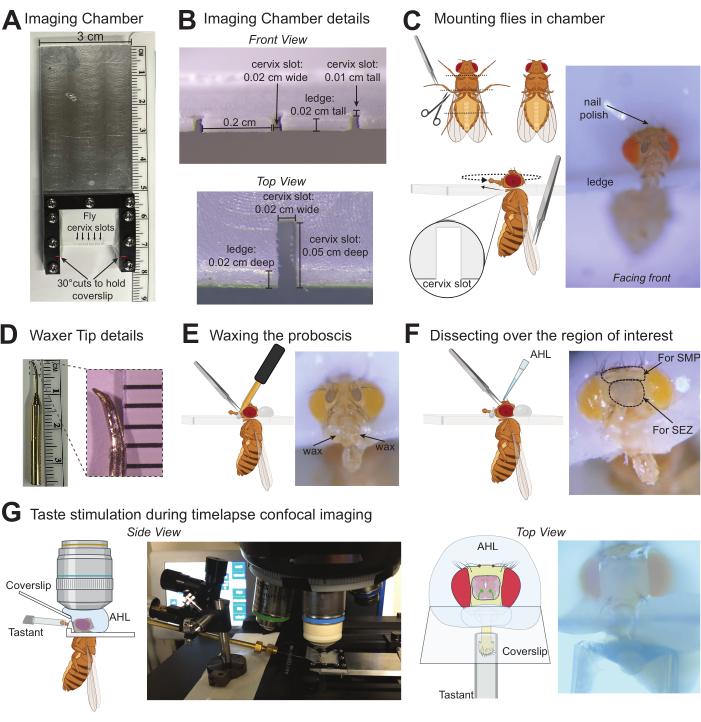
Рисунок 1: Иллюстрации протокола для визуализации вкусовых реакций в мозге дрозофилы . (A) Вид сверху на специальную камеру визуализации, используемую для установки до пяти мух одновременно. (B) Подробная информация о камере визуализации, в которую установлены мухи, с измерениями, которые удобно помещаются на шейке матки D. melanogaster. (C) Графика, показывающая, где обрезать лапки (вверху слева) и как установить ширинку в паз шейки матки камеры визуализации с помощью щипцов (внизу слева). Фотография установленной мухи в правильном положении в камере визуализации (справа). (D) Фотография наконечника восковика (слева), увеличенная фотография наконечника для указания приблизительной формы и размера для цели при использовании точильного камня для модификации стандартного наконечника (справа). (E) Графическая иллюстрация восковой эпиляции хоботка на место с помощью щипцов (слева), фотография мухи, прикрепленной с помощью правильно навощенного лабеллума (справа). (F) Графическая иллюстрация, представляющая собой рассечение над интересующей областью мозга и нанесение AHL (слева), фотография мухи с пунктирными кругами вокруг области кутикулы, которую необходимо удалить при нацеливании на области мозга SEZ или SMP. X обозначает участки кутикулы, которые необходимо зажать для рассечения (справа). (G) Графики и фотографии показывают положение установленной/расчлененной мухи, объектив погружения в воду в АГЛ, стимулятор с тастантом над хоботком и покровное стекло, образующее барьер между этими растворами. Вид сбоку был уменьшен (слева), а вид сверху находился под 10-кратным объективом (справа). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
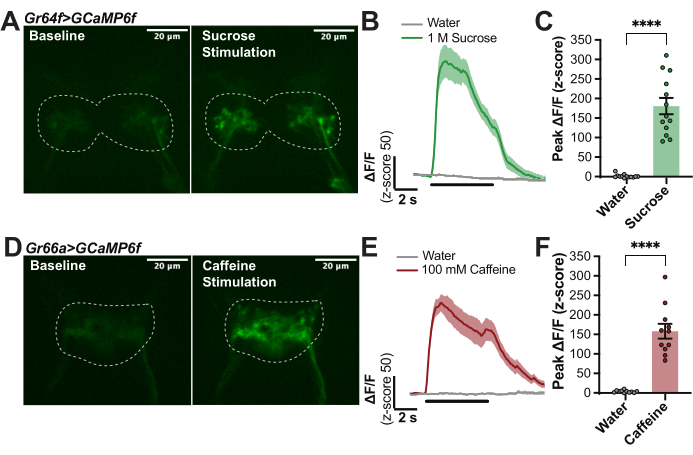
Рисунок 2: Пример кальциевой реакции ламеченных GRN на вкусовые стимулы. (A) Кадр из стека изображений, показывающий уровень флуоресценции GCaMP у мухи с Gr64f>GCaMP6f на исходном уровне и во время пиковой реакции на 1 М сахарозы, масштабная линейка = 20 мкм. Пунктирными линиями обозначен ROI для анализа. (B) Кривые реакции кальция для n = 14 мух, рассчитанные как ΔF/F (z-оценка) и объединенные для воды (отрицательный контроль) и 1 М сахарозы (положительный контроль) для демонстрации кинетики; Черная линия под кривыми указывает, когда стимул находится над лабеллумом. (C) Пиковое значение ΔF/F (z-оценка) для каждой мухи, построенное для статистических сравнений. Парный t-критерий, ****p < 0,0001. (D) Кадры из видео, показывающие уровень флуоресценции GCaMP у мухи с Gr66a>GCaMP6f на исходном уровне и во время пиковой реакции на 100 мМ кофеина, масштабная линейка = 20 мкм. Пунктирными линиями обозначен ROI для анализа. (E) Кривые реакции кальция для n = 11 мух, рассчитанные как ΔF/F (z-оценка) и объединенные для воды (отрицательный контроль) и 100 мМ кофеина (положительный контроль) для демонстрации кинетики: обратите внимание на маленькую реакцию «выключено», черная линия под кривыми указывает, когда стимул находится над лабеллумом. (F) Пиковое значение ΔF/F (z-оценка) для каждой мухи, построенное на графике для статистических сравнений. Парный t-критерий, ****p < 0,0001. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Одним из самых сложных аспектов этого протокола является ловкость микроманипуляций, необходимая для нанесения воска на лабеллум и выполнения целенаправленных вскрытий. Дополнительный шаг для закрепления лабеллума необходим для равномерной стимуляции каждого сенсиллума по всему этому органу чувств и визуализации интересующих областей мозга. Используемая здесь специальная камера визуализации оптимизирована для D. melanogaster, но технические характеристики камеры и подход к восковой эпиляции могут потребоваться для других насекомых. Этот протокол может быть применен к другим дрозофилам с небольшими модификациями, но другие члены подотряда Brachycera, такие как пчелы и комары, могут потребовать изменений в этапах монтажа и рассечения, чтобы учесть различия в морфологии губных щупиков и головы. Юстировка микроманипулятора для подачи теста также может быть сложной задачей и требует предварительного тестирования с помощью специального предметного столика микроскопа для оптимизации. Если воск разрушается во время стимуляции, это может привести к утечкам, в результате чего АГЛ и тастант в капилляре вступают в контакт. Вытягивание капилляров и подпиливание их точильным камнем, чтобы они плотнее прилегали к лабеллуму, может помочь предотвратить контакт тастанта и AHL. Мухи с любыми протеканиями или чрезмерной подвижностью мозга должны быть исключены. По возможности всегда проводите положительный контроль для каждого животного, чтобы убедиться, что лабеллум и лабеллярные нервы не повреждены в результате восковой эпиляции или вскрытия. Показанные здесь примеры «сладкого» и «горького» рекомендуются в качестве надежных контрольных экспериментов.
Описанный здесь подход к визуализации кальция in vivo был использован для количественной оценки вкусовых реакций в первичных вкусовых нейронах, нейронах более высокого порядка и во всей СЭЗ у D. melanogaster для идентификации вкусовых рецепторов и цепей 8,14,17,18,19,20,27,28,30,31. 34,35,36,37,38,39,40,41,
42,43,44,45,46,47,48. Широкое применение в этом модельном организме обусловлено легкодоступными драйверами Gal4 и split-Gal4; таким образом, потребность генетически модифицированных насекомых в экспрессии GCaMP в конкретных нейронах, представляющих интерес, является одним из ограничивающих факторов для этого подхода. К счастью, с развитием технологий редактирования генов, это становится более доступным для насекомых, выходящих за рамки модельных организмов, и недавно были зарегистрированы вызванные вкусом реакции с использованием визуализации кальция для вредителя Drosophila suzukii49 и для комаров-переносчиков50. Как и при любой визуализации кальция, для интересующих их нейронов может потребоваться некоторая первоначальная оптимизация соотношения сигнал/шум. Сигналы могут быть усилены за счет использования более ярких версий GCaMP и экспрессии двух копий GCaMP. Коэкспрессия RFP в нейронах-мишенях может помочь визуализировать нейроны-мишени на исходном уровне и может служить в качестве контроля движения мозга в областях, которые имеют склонность к пульсации.
Этот протокол специально разработан для изоляции хемоощущения от лабеллума путем удаления лапок и усиков, восковой эпиляции верхней челюсти и ограничения приема внутрь таким образом, чтобы не стимулировались глоточные GRN. Тем не менее, в этот протокол могут быть внесены коррективы, чтобы включить хемочувствительность из тарзальных или глоточных GRN. Если лапки оставить нетронутыми, ноги можно стимулировать отдельно или в дополнение к лабеллуму, создав большой пузырь раствора тастанта на конце капилляра. Существует вероятность того, что муха ударится и сдвинет покровное стекло, если лапки останутся нетронутыми; Поэтому можно рассмотреть возможность нанесения восковой эпиляции лапок у основания для предотвращения нежелательных движений. Данный пример включает этап разрезания пищевода для предотвращения стимуляции глоточного GRN и для лучшей визуализации проекций на глотку в СЭЗ, но этот же препарат был ранее адаптирован для количественной оценки реакции глотки на GRN путем оставления пищевода нетронутым и визуализации боковых проекций глотки36. В этом предыдущем применении использовался аппетитный сахарный стимул, который мухи свободно потребляют для стимуляции глоточного GRN, но мухи не будут охотно поглощать аверсивный стимул для активации горьких глоточных GRN, что является одним из ограничений этого подхода. Дополнительным ограничением является то, что реакции GRN, расположенных в крыльях дрозофилы11 , не могут быть легко изучены с помощью этого подхода.
В то время как описанная здесь визуализация кальция in vivo стала стандартным методом изучения вкусовых реакций более высокого порядка 8,18,19,20,28, в настоящее время существует несколько других подходов для количественной оценки первичных реакций GRN на вкусовые вещества у мух. Описанный здесь подход к визуализации кальция in vivo регистрирует изменения GCaMP в окончаниях аксонов в головном мозге, но подход ex vivo также использовался для количественной оценки GCaMP клеточного тела в метельных GRN33. Аналогичным образом, был описан другой подход к монтированию для визуализации клеточных тел либо лабеллярных, либо тарзальных GRN у интактных мух51. Электрофизиология продолжает оставаться популярным и эффективным методом изучения реакций первичных вкусовых нейронов у насекомых 13,16,32,52,53,54,55,56,57,58,59,60,64,62,63,64,65. Это не требует необходимости в генетически кодируемых кальциевых сенсорах и является более прямой количественной оценкой нейронной активности. Тем не менее, ответы только от одной сенсиллы могут быть зарегистрированы за один раз, в то время как кальциевая визуализация может регистрировать от полной популяции GRN одновременно. Для обнаружения уникальной временной динамики реакций «включено» и «выключено» у GRN с определенными стимулами было использовано с помощью визуализации кальция 27,28, но недавний прогресс в электрофизиологических записях на основе вкусовой сенсиллы у D. melanogaster теперь позволяет количественно определять реакции «выключения» на уровне потенциалов действия53. Интересно, что модуляция первичной чувствительности GRN голодом была обнаружена с помощью визуализации кальция, но не на уровне потенциалов действия с помощью электрофизиологии29, однако как электрофизиологические записи зонда, так и визуализация кальция могут зафиксировать изменение чувствительности GRN при диете30,66. Таким образом, электрофизиология остается важным, дополняющим подход к визуализации кальция для идентификации вкусовых лигандов и рецепторов, а также для понимания того, как различные факторы модулируют чувствительность нейронов первичных вкусовых рецепторов.
Раскрытие информации
У авторов нет конфликта интересов и нечего раскрывать.
Благодарности
Мы хотели бы поблагодарить Bloomington Drosophila Stock Center для поголовья мух и Университет Вермонта IMF Labs за их помощь в изготовлении камер для визуализации на заказ. Мы также хотели бы выразить признательность компании BioRender за создание графических иллюстраций и Кайле Одетт за вклад в разработку этих графических изображений. Эта работа была поддержана новыми фондами стартапов лаборатории от Университета Вермонта и премией Национального научного фонда No 2332375. Графики на рисунке 1 были сгенерированы с помощью www.BioRender.com.
Материалы
| Name | Company | Catalog Number | Comments |
| CaCl2 | Sigma-Aldrich | C7902 | For AHL |
| Caffeine | Sigma-Aldrich | C0750 | For a "bitter" taste stimulus |
| Clear nail polish- quick dry | Many vendors | Example: Sally Hansen Xtreme wear (clear) | |
| CO2 fly pad station | Genesee Scientific | 59-122BC | Includes tubing, a gun to initially anesthetize flies, and a pad to deliver continuous anesthesia |
| CO2 supply (cylinders) | Airgas | USP50 | For anesthesia |
| Confocal or two-photon microscope | Many vendors | Upright microscope, high signal to noise and rapid capture capabilities, 10X air immersion objective, 25-40X water immersion objective, accompanying hardware and software | |
| Coverslips | Globe Scientific | 1404-15 | 22 x 22 mm, No 1.5: for this specific imaging chamber, score and cut in half to get 11 x 22 mm coverslips |
| D. melanogaster: Gr64f-Gal4 | Bloomington Drosophila Stock Center | 57669 | For driving GCaMP expression in 'sweet' gustatory receptor neurons of the labellum |
| D. melanogaster: Gr66a-Gal4 | Bloomington Drosophila Stock Center | 57670 | For driving GCaMP expression in 'bitter' gustatory receptor neurons of the labellum |
| D. melanogaster: UAS-GCaMP6f | Bloomington Drosophila Stock Center | 42747 | For getting GCaMP expression when crossed to a Gal4 driver line |
| Dental Waxer | Pearson Dental | 49-00-54 | Digital wax carver, comes with tips that can be modified and sharpened small enough to deliver wax along the fly proboscis |
| Dissection microscope | Many vendors | .63 - 6.3X for optimal viewing but with sufficient working distance to perform dissections under the microscope | |
| Dissection scissors | Fine Science Tools | 15000-08 | This pair or any similar dissection scissors are appropriate |
| Empty pipette tip box | Free- many vendors | For humidity chamber: needs enough space so that the imaging chamber can sit and the lid can close without bumping the chamber | |
| Filter flask | Millipore-Sigma | CLS431097 | For filtering AHL stocks |
| Glass capillary | World Precision Instruments | TW100-4 | This size fits well over the D. melanogaster labellum without needing modification, but other capillaries can be pulled and filed down to an appropriate size |
| HEPES | Sigma-Aldrich | BP310 | For AHL |
| ImageJ (FIJI) | NIH | https://imagej.nih.gov/ij | Image analysis software |
| Imaging Chamber | IMF Labs | Custom item | The custom-made chamber in this example can be ordered at https://www.uvm.edu/research/imf/forms/contact-us. Base: 6061 aluminum, Holding Clamps: Black Delrin (Acetal), Insert: Moisture Resistant polyester (PET). Manual and CNC milling machines for fabrication. |
| KCl | Sigma-Aldrich | P9541 | For AHL |
| Kim wipes | Millipore-Sigma | Z188956 | For humidity chamber, wiping off forceps, removing solutions from capillaries, etc. |
| MgCl2 | Sigma-Aldrich | M9272 | For AHL |
| Micromanipulator | Tritech Research | U-31CF, USM-6, MINJ-4 | This example uses a magnet to attach the micromanipulator to the stage, other configurations are possible |
| NaCl | Sigma-Aldrich | S7653 | For AHL |
| NaH2PO4 | Sigma-Aldrich | 567545 | For AHL |
| NaHCO3 | Sigma-Aldrich | S6014 | For AHL |
| p10 pipette and tips | Many vendors | For filling the capillaries with tastants | |
| p200 pipette and tips | Many vendors | For AHL | |
| Parafin wax | Many vendors | White/clear block of wax often found in craft stores | |
| Ribose | Sigma-Aldrich | W379301 | For AHL |
| Semi-sharp forceps | Fine Science Tools | 11252-20 | Blunted to approximately tip size C |
| Sharp forceps | Fine Science Tools | 11252-20 | Sharpened to tip size A |
| Sharpening stone | Fine Science Tools | 29000-00 | For modifying dental waxer tips and forceps |
| Sucrose | Sigma-Aldrich | S0389 | For a "sweet'"taste stimulus |
| Toothpick | Many vendors | Small tip for nail polish application |
Ссылки
- Wangler, M. F., Yamamoto, S., Bellen, H. J. Fruit flies in biomedical research. Genetics. 199 (3), 639-653 (2015).
- Ryu, L., Kim, S. Y., Kim, A. J. From photons to behaviors: Neural implementations of visual behaviors in Drosophila. Front Neurosci. 16, 883640 (2022).
- Joseph, R. M., Carlson, J. R. Drosophila chemoreceptors: A molecular interface between the chemical world and the brain. Trends Genet. 31 (12), 683-695 (2015).
- Montell, C. Drosophila sensory receptors-a set of molecular Swiss Army knives. Genetics. 217 (1), 1-34 (2021).
- Scott, K. Gustatory processing in Drosophila melanogaster. Annu Rev Entomol. 63, 15-30 (2018).
- Starostina, E., et al. A Drosophila DEG/ENaC subunit functions specifically in gustatory neurons required for male courtship behavior. J Neurosci. 32 (13), 4665-4674 (2012).
- Chen, Y., Amrein, H. Ionotropic receptors mediate Drosophila oviposition preference through sour gustatory receptor neurons. Curr Biol. 27 (18), 2741-2750.e4 (2017).
- Guillemin, J., et al. Taste cells expressing ionotropic receptor 94e reciprocally impact feeding and egg laying in Drosophila. Cell Rep. 43, 114625 (2024).
- Ostojic, I., et al. Positive and negative gustatory inputs affect Drosophila lifespan partly in parallel to dFOXO signaling. Proc Natl Acad Sci U S A. 111 (22), 8143-8148 (2014).
- Stocker, R. F. The organization of the chemosensory system in Drosophila melanogaster: A review. Cell Tissue Res. 275 (1), 3-26 (1994).
- Raad, H., Ferveur, J. -. F., Ledger, N., Capovilla, M., Robichon, A. Functional gustatory role of chemoreceptors in Drosophila wings. Cell Rep. 15 (7), 1442-1454 (2016).
- Montell, C. A taste of the Drosophila gustatory receptors. Curr Opin Neurobiol. 19 (4), 345-353 (2009).
- Weiss, L. A., Dahanukar, A., Kwon, J. Y., Banerjee, D., Carlson, J. R. The molecular and cellular basis of bitter taste in Drosophila. Neuron. 69 (2), 258-272 (2011).
- Jaeger, A. H., et al. A complex peripheral code for salt taste in Drosophila. Elife. 7, 37167 (2018).
- Freeman, E. G., Dahanukar, A. Molecular neurobiology of Drosophila taste. Curr Opin Neurobiol. 34, 140-148 (2015).
- Delventhal, R., Kiely, A., Carlson, J. R. Electrophysiological recording from Drosophila labellar taste sensilla. J Vis Exp. 84, e51355 (2014).
- Marella, S., et al. Imaging taste responses in the fly brain reveals a functional map of taste category and behavior. Neuron. 49 (2), 285-295 (2006).
- Shiu, P. K., Sterne, G. R., Engert, S., Dickson, B. J., Scott, K. Taste quality and hunger interactions in a feeding sensorimotor circuit. Elife. 11, e79887 (2022).
- Li, J., Dhaliwal, R., Stanley, M., Junca, P., Gordon, M. D. Functional imaging and connectome analyses reveal organizing principles of taste circuits in Drosophila. bioRxiv. , (2024).
- Junca, P., Stanley, M., Musso, P. -. Y., Gordon, M. D. Modulation of taste sensitivity by the olfactory system in Drosophila. bioRxiv. , (2021).
- Elliott, D. A., Brand, A. H. The GAL4 system: A versatile system for the expression of genes. Drosophila Methods Protoc. , 79-95 (2008).
- Riabinina, O., Potter, C. J., Dahmann, C. . Drosophila: Methods and Protocols. , 53-78 (2016).
- Diegelmann, S., Bate, M., Landgraf, M. Gateway cloning vectors for the LexA-based binary expression system in Drosophila. Fly. 2 (4), 236-239 (2008).
- Zhang, Y., et al. Fast and sensitive GCaMP calcium indicators for imaging neural populations. Nature. 615 (7954), 884-891 (2023).
- Ohkura, M., et al. Genetically encoded green fluorescent Ca2+ indicators with improved detectability for neuronal Ca2+ signals. PLoS One. 7 (12), e51286 (2012).
- Arntsen, C., Guillemin, J., Audette, K., Stanley, M. Tastant-receptor interactions: Insights from the fruit fly. Front Nutr. 11, 1394697 (2024).
- Stanley, M., Ghosh, B., Weiss, Z. F., Christiaanse, J., Gordon, M. D. Mechanisms of lactic acid gustatory attraction in Drosophila. Curr Biol. 31 (16), 3525-3537.e6 (2021).
- Devineni, A. V., Deere, J. U., Sun, B., Axel, R. Individual bitter-sensing neurons in drosophila exhibit both on and off responses that influence synaptic plasticity. Curr Biol. 31 (24), 5533-5546.e7 (2021).
- Inagaki, H. K., et al. Visualizing neuromodulation in vivo: Tango-mapping of dopamine signaling reveals appetite control of sugar sensing. Cell. 148 (3), 583-595 (2012).
- May, C. E., et al. High dietary sugar reshapes sweet taste to promote feeding behavior in drosophila melanogaster. Cell Rep. 27 (6), 1675-1685.e7 (2019).
- May, C. E., Rosander, J., Gottfried, J., Dennis, E., Dus, M. Dietary sugar inhibits satiation by decreasing the central processing of sweet taste. Elife. 9, e54530 (2020).
- Jiao, Y., Moon, S. J., Wang, X., Ren, Q., Montell, C. Gr64f is required in combination with other gustatory receptors for sugar detection in Drosophila. Curr Biol. 18 (22), 1797-1801 (2008).
- Chen, H. -. L., Stern, U., Yang, C. -. H. Molecular control limiting sensitivity of sweet taste neurons in Drosophila. Proc Natl Acad Sci USA. 116 (40), 20158-20168 (2019).
- Devineni, A. V., Sun, B., Zhukovskaya, A., Axel, R. Acetic acid activates distinct taste pathways in Drosophila to elicit opposing, state-dependent feeding responses. Elife. 8, e47677 (2019).
- Engert, S., Sterne, G. R., Bock, D. D., Scott, K. Drosophila gustatory projections are segregated by taste modality and connectivity. Elife. 11, e78110 (2022).
- Ledue, E. E., et al. Starvation-induced depotentiation of bitter taste in Drosophila. Curr Biol. 26 (21), 2854-2861 (2016).
- Mcdowell, S. A. T., Stanley, M., Gordon, M. D. A molecular mechanism for high salt taste in Drosophila. Curr Biol. 32 (14), 3070-3081.e7 (2022).
- Deere, J. U., Devineni, A. V. Taste cues elicit prolonged modulation of feeding behavior in Drosophila. iScience. 25 (10), 105159 (2022).
- Deere, J. U., et al. Selective integration of diverse taste inputs within a single taste modality. Elife. 12, (2023).
- Chu, B., Chui, V., Mann, K., Gordon, M. D. Presynaptic gain control drives sweet and bitter taste integration in Drosophila. Curr Biol. 24 (17), 1978-1984 (2014).
- Yao, Z., Scott, K. Serotonergic neurons translate taste detection into internal nutrient regulation. Neuron. 110 (6), 1036-1050.e7 (2022).
- Cameron, P., Hiroi, M., Ngai, J., Scott, K. The molecular basis for water taste in Drosophila. Nature. 465 (7294), 91-95 (2010).
- Jourjine, N., Mullaney, B. C., Mann, K., Scott, K. Coupled sensing of hunger and thirst signals balances sugar and water consumption. Cell. 166 (4), 855-866 (2016).
- Kim, H., Kirkhart, C., Scott, K. Long-range projection neurons in the taste circuit of Drosophila. Elife. 6, e23386 (2017).
- Kirkhart, C., Scott, K. Gustatory learning and processing in the Drosophila mushroom bodies. J Neurosci. 35 (15), 5950-5958 (2015).
- Steck, K., et al. Internal amino acid state modulates yeast taste neurons to support protein homeostasis in Drosophila. Elife. 7, e31625 (2018).
- Münch, D., Goldschmidt, D., Ribeiro, C. The neuronal logic of how internal states control food choice. Nature. 607 (7920), 747-755 (2022).
- Taisz, I., et al. Generating parallel representations of position and identity in the olfactory system. Cell. 186 (12), 2556-2573.e2 (2023).
- Cavey, M., et al. Increased sugar valuation contributes to the evolutionary shift in egg-laying behavior of the fruit pest Drosophilasuzukii. PLoS Biol. 21 (12), e3002432 (2023).
- Jové, V., et al. Sensory discrimination of blood and floral nectar by Aedes aegypti mosquitoes. Neuron. 108 (6), 1163-1180.e2 (2020).
- Shankar, S., Calvert, M. E., Yew, J. Y. Measuring physiological responses of Drosophila sensory neurons to lipid pheromones using live calcium imaging. J Vis Exp. (110), e53392 (2016).
- Dahanukar, A., Lei, Y. -. T., Kwon, J. Y., Carlson, J. R. Two gr genes underlie sugar reception in Drosophila. Neuron. 56 (3), 503-516 (2007).
- Dweck, H. K. M., Carlson, J. R. Base recording: A technique for analyzing responses of taste neurons in Drosophila. J Vis Exp. (205), e66665 (2024).
- Dweck, H. K. M., Talross, G. J. S., Luo, Y., Ebrahim, S. A. M., Carlson, J. R. Ir56b is an atypical ionotropic receptor that underlies appetitive salt response in Drosophila. Curr Biol. 32 (8), 1776-1787.e4 (2022).
- Park, J., Carlson, J. R. Physiological responses of the Drosophila labellum to amino acids. J Neurogenet. 32 (1), 27-36 (2018).
- Wang, W., et al. Sugar sensation and mechanosensation in the egg-laying preference shift of Drosophilasuzukii. Elife. 11, e81703 (2022).
- Xiao, S., Baik, L. S., Shang, X., Carlson, J. R. Meeting a threat of the Anthropocene: Taste avoidance of metal ions by Drosophila. Proc Natl Acad Sci USA. 119 (25), e2204238119 (2022).
- Ganguly, A., et al. Requirement for an otopetrin-like protein for acid taste in Drosophila. Proc Natl Acad Sci USA. 118 (51), e2110641118 (2021).
- Lee, Y., Moon, S. J., Montell, C., Snyder, S. H. Multiple gustatory receptors required for the caffeine response in Drosophila. Proc Natl Acad Sci USA. 106 (11), 4495-4500 (2009).
- Lee, Y., Poudel, S., Kim, Y., Thakur, D., Montell, C. Calcium taste avoidance in Drosophila. Neuron. 97 (1), 67-74.e4 (2018).
- Mi, T., et al. Alkaline taste sensation through the alkaliphile chloride channel in Drosophila. Nat Metab. 5 (3), 466-480 (2023).
- Rimal, S., et al. Mechanism of acetic acid gustatory repulsion in Drosophila. Cell Rep. 26 (6), 1432-1442.e4 (2019).
- Zhang, Y. V., Ni, J., Montell, C. The molecular basis for attractive salt-taste coding in Drosophila. Science. 340 (6138), 1334-1338 (2013).
- Aryal, B., Dhakal, S., Shrestha, B., Lee, Y. Molecular and neuronal mechanisms for amino acid taste perception in the Drosophila labellum. Curr Biol. 32 (6), 1376-1386.e4 (2022).
- Shrestha, B., Aryal, B., Lee, Y. The taste of vitamin C in Drosophila. EMBO Rep. 24 (6), e56319 (2023).
- Ganguly, A., Dey, M., Scott, C., Duong, V. -. K., Arun Dahanukar, A. Dietary macronutrient imbalances lead to compensatory changes in peripheral taste via independent signaling pathways. J Neurosci. 41 (50), 10222 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены