Method Article
In vivo (İn canlı) Erişkin Drosophila'da Tat Kaynaklı Nöral Yanıtların Kalsiyum Görüntülemesi
Bu Makalede
Özet
Kalsiyum görüntüleme yaklaşımı, labelluma bir çözelti uygulanırken uyanık sineklerin beyinlerinde tat kaynaklı tepkilerin kaydedilmesini sağlar. Drosophila melanogaster'deki birincil tat tepkileri örnek olarak kullanılır, ancak bu protokol aşağı akış nöronlarını veya diğer türleri incelemek için uyarlanabilir.
Özet
Yaklaşık yirmi yıldır, in vivo kalsiyum görüntüleme, meyve sineği model organizması Drosophila melanogaster'deki tat uyaranlarına hücresel tepkileri ölçmek için etkili bir yöntem olmuştur. Bu metodolojinin önemli bir gücü, uyanık hayvanlarda anesteziye ihtiyaç duymadan tat kaynaklı sinirsel tepkileri kaydetme yeteneğidir. Bu yaklaşım, ilgilenilen belirli nöronlarda kalsiyum indikatörü GCaMP'yi ifade etmek için ikili ekspresyon sistemlerini (örneğin, Gal4-UAS) kullanır. Bu protokol, GCaMP'yi ifade eden sineklerin, labellum güvenli bir şekilde konumlandırılmış olarak monte edildiği, beyindeki floresansın konfokal bir mikroskop altında milisaniye çözünürlükte kaydedilmesini sağlarken, labelluma bir çözelti uygulandığı ve tüm labellar tat duyularını uyardığı bir prosedürü tanımlar. Verilen örnekler, D. melanogaster'in primer tat reseptör nöronlarındaki kalsiyum yanıtlarına odaklanmaktadır. Bununla birlikte, bu yaklaşım, Drosophilids veya diğer böcek türlerinin beynindeki diğer ilgili nöronlardan kayıt yapmak için uyarlanabilir. Bu görüntüleme yöntemi, araştırmacıların, bireysel nöronlardan gelen aksiyon potansiyellerini ölçen elektrofizyolojik uç kayıtlarını tamamlayarak, labellum boyunca tat nöron gruplarından gelen toplu kalsiyum yanıtlarını aynı anda kaydetmelerini sağlar. Burada özetlenen in vivo kalsiyum görüntüleme tekniği, kemosensasyonun moleküler ve hücresel mekanizmalarını ortaya çıkarmada, birincil tat nöronlarındaki benzersiz zamansal yanıt modellerini tanımlamada, tat modülasyonu mekanizmalarını araştırmada ve aşağı akış devrelerinde tat işlemeyi keşfetmede etkili olmuştur.
Giriş
Meyve sineği, Drosophila melanogaster, bu model organizmada bulunan güçlü genetik araştırma araçları için ünlüdür. Bu araçlar, hedeflenen hücrelerdeki belirli genleri kolayca manipüle etme yeteneği sağlayarak, görme ve kemosensation 1,2,3 gibi temel nöral devreleri keşfetmek için idealdir. Tuzluk, kontakt kemosensasyon yoluyla, beslenme, çiftleşme, üreme ve nihayetinde hayvanların hayatta kalması ve zindeliği ile ilgili davranışları düzenleyen önemli bir nöral yoldur 4,5,6,7,8,9. Bu önemli kemosensoriyel bilginin nasıl kodlandığını ve iletildiğini anlamak, tat uyaranları tarafından aktive edilen devrelerdeki nöronların aktivitesini tanımlamayı gerektirir.
D. melanogaster'de, dış tat reseptör nöronları (GRN'ler) ön ayaklarda, hortumda ve kanatlardabulunur 10,11. Hortumun sonundaki labellum, boyutlarına göre morfolojilerine göre haritalanabilen sensilla adı verilen saç benzeri yapılar içerir: uzun (L tipi), orta (I tipi) ve kısa (S tipi)10. GRN'lerin çoğu bu duyu organı üzerinde yoğunlaşır, her bir sensilla 2-4 farklı tipte GRN içerir, böylece her tat modalitesi 12,13,14,15 etiketine yayılır. Elektrofizyolojik uç kayıtları, tek bir sensilla'da GRN'lerden gelen aksiyon potansiyellerini ölçmek için kullanılabilir16, in vivo olarak, kalsiyum görüntüleme, tam etiket14,17 boyunca belirli bir GRN tipinin aktivitesini izole etmek için kullanılabilir. Aynı kalsiyum görüntüleme tekniği, aşağı akış tat devrelerindeki(18,19,20) nöral tepkileri incelemek için de kullanılabilir. Kalsiyum görüntüleme, Gal4-UAS 21,22,23 gibi ikili ekspresyon sistemlerini ve ilgilenilen nöronlarda bir GCaMP'nin ekspresyonunu elde etmek için hücreye özgü transkripsiyonel aktivatörler içeren bir sürücü hattını bir efektör hattına geçmeyi gerektirir. Hücre içi kalsiyum seviyeleri yükseldiğinde, bu genetik olarak kodlanmış kalsiyum göstergeleri floresan yoğunluğunda artar, böylece floresan seviyesi nöronal aktivitedekideğişikliklerle ilişkilendirilir 24,25.
Burada, in vivo tat uyaranlarına nöral tepkileri gözlemlemek için kalsiyum görüntülemeyi kullanmak için bir yöntem açıklanmaktadır. Bu yöntemin genel amacı, uyanık sineklerin beyinlerindeki tat kaynaklı nöral tepkileri ölçmek için yalnızca etiketleyici GRN'leri uyarmaktır. D. melanogaster'deki labellumun birincil GRN'lerindeki yanıtları kaydetmek için bu yöntemin kullanılması için örnekler verilmiş ve bu yaklaşımı kullanmanın yararları ve zorlukları tartışılmıştır. Bu hazırlık, deneycilerin, tüm duyu organı doğal ortamlarda meydana gelen bir çözeltiye daldırıldığında nöral tepkileri kaydetmek için konfokal bir mikroskop altındayken hareketsiz hale getirilmiş bir sinek labellumuna bir tastant çözeltisi uygulama yeteneğine izin vermek için geliştirilmiştir. Burada açıklanan in vivo kalsiyum görüntüleme yaklaşımı, yeni tastant-reseptör etkileşimlerini 8,14,26,27, GRN yanıtlarının zamansal ayrıntılarını 27,28, GRN modülasyonunun moleküler mekanizmalarını29,30 ve aşağı akış devrelerinde tat işlemeyi ortaya çıkarmak içinkullanılabilir 8,18,19,20, 28,31.
Protokol
Bu çalışmada kullanılan reaktiflerin ve ekipmanların detayları Malzeme Tablosunda listelenmiştir.
1. Erişkin hemolenf benzeri (AHL) çözeltinin hazırlanması
- 108 mM NaCl, 5 mM KCl, 4 mM NaHCO3, 1 mM NaH2PO4, 5 mM HEPES ve 15 mM riboz içeren bir stok çözeltisi hazırlayın.
NOT: Riboz, beyindeki besin seviyelerini değiştirmeden ozmolariteyi korumak için enerjik olmayan bir şeker olarak kullanılır. - Filtrelemeden ve 4 °C'de saklamadan önce bu çözeltinin pH'ını 7,5'e ayarlayın. Preparatlar arasında tutarlılığı sağlamak için pH'ı ayarladıktan sonra AHL'nin ozmolaritesini kontrol edin.
- 1 M CaCl2 ve 1 M MgCl2 için ayrı stoklar hazırlayın, süzün ve oda sıcaklığında saklayın.
- Ana AHL stoğunun bir alikotunu hazırlamak için, 2 mM kalsiyum ve 8.2 mM magnezyumun nihai konsantrasyonlarını elde etmek için küçük bir hacimde kalsiyum ve magnezyum ekleyin. Bu AHL, 4 ° C'de saklanabilir ve deneyler için oda sıcaklığına getirilen küçük alikotlar kullanılarak bir aya kadar kullanılabilir.
2. Görüntüleme odasına sineklerin montajı
- Sinekleri monte etmeden önce, bir diş ağdasının ucunu bir bileme taşı kullanarak küçük, sivri bir kaba keskinleştirin (Şekil 1D). Bilenmiş ucu ağda makinesine takın ve ön ısıtmak için açın. Isı ayarları, ucun tipine ve uzunluğuna bağlı olacaktır: temas halinde balmumunun erimiş kalmasına izin veren minimum bir sıcaklık gereklidir (bu örnekte 50,5 °C işe yarar).
NOT: Alternatif olarak keskinleştirilmiş bir metal ucu sabitlemek için diş mumunun ucuna bir tel sarılabilir. - 1-5 sineği nazikçe uyuşturun (kurumsal olarak onaylanmış protokolleri izleyerek). Anesteziye maruz kalma süresini en aza indirin, çünkü CO2 veya soğuğa uzun süre maruz kalmak davranışı etkileyebilir. CO2 için, diseksiyon mikroskobu altında 5 L / dk hızında% 99.9 CO2'lik sürekli, eşit bir akış sağlayan bir sineklik kullanın.
- Orta ve arka bacakları femoral/tibial eklemde ve ön ayakları trokanterde keserek bacakların bazı kısımlarını çıkarmak için diseksiyon makası kullanın. Sineği manipüle etmeye yardımcı olmak için künt forseps kullanın. Tarsi'nin kırpılması, tarsal hissi ve lamel veya tat uyarıcısının tekmelenmesini önleyecektir.
- Sineği konumlandırmak için künt forseps kullanarak sineği kanatlarından alın, böylece baş görüntüleme odasının hedeflenen serviks yuvasının üzerinde olacak, ancak vücut aşağıda olacaktır. Sineği tamamen sağa veya sola başlatmak faydalıdır. Makasın kör tarafını ve künt forsepsleri kullanarak, başı ve göğüs kafesi aynı anda yavaşça yuvaya itin.
- Yuvaya güvenli bir şekilde girdikten sonra, sineği yuvanın arkasına itin ve sinek odanın önüne bakacak şekilde yavaşça yeniden konumlandırın. Kafayı göğüs kafesi ile aynı hizadan çok fazla döndürmekten kaçının.
- Gerektiği kadar sinek için tekrarlayın (bu görüntüleme odası 5 sineğe kadar monte edebilir).
- Bir kürdanın ucuna küçük bir damla oje koyun ve sineğin başını görüntüleme odasına sabitlemek için ince bir kat uygulayın.
NOT: Oje uygulanacak kesin alan, beynin hangi bölümünün görüntülendiğine bağlıdır. SEZ (burada gösterildiği gibi) veya diğer alt medial bölgeler görüntüleniyorsa, oje sinek başının üst kısmına cömertçe uygulanabilir, ancak üst medial bölgeleri görüntülemek için, oje başın üst kısmına minimal olarak uygulanabilir ve bu alanı diseksiyon için açık bırakmak için gözlerin yakınında yanal olarak eklenebilir. Bu protokol, yalnızca koku alma olmadan tat stimülasyonu için optimize edilmiştir, ancak oje uçucuları söz konusuysa, sinek kafasını sabitlemek için alternatif yöntemler olarak balmumu veya UV yapıştırıcısı kullanın.
3. Hortumun uzatılmış bir pozisyonda mumlanması
- Ağda makinesini bir elinizle alın ve ucunda küçük bir balmumu damlası toplayın.
- Öte yandan, bir maksiller palp tutmak için yarı keskin forseps kullanın ve hortumu yavaşça dışarı çekin ve tam uzantıda tutun.
NOT: Kütikülü hortum üzerinde sıkıştırmak hasar potansiyelini artırdığından, yalnızca üst çene palpını kavramaya dikkat edin. Hortum sıkışırsa veya hortum kütikülü delinirse devam etmeyin. Balmumu uygularken emme kullanarak hortumu çıkarmak için forsepslere alternatif olarak küçük bir sinek pooter kullanılabilir. - Ağda akmaya başlayana kadar ağda makinesinin ucunu hortumun tabanına yakın hazneye dokundurun, ardından hortumun tabanı ile temas etmek için hareket ettirin. Milin yarısına kadar cilalayın, ancak etiketleme duyusuna balmumu veya ağda makinesi ile dokunmaktan kaçının. Bu taraftaki balmumu hortumu yerinde tutacaktır. Duyulara herhangi bir zamanda balmumu veya ağda makinesi tarafından dokunulursa devam etmeyin.
- Diğer taraf için yukarıdaki yöntemi kullanarak balmumu uygulayın ve hortum üzerinde sürekli bir balmumu köprüsü yapın.
- Hortumu mümkün olduğunca düz bir şekilde tamamen uzatın. Gerekirse, hortumun hareket ettirilmesi, balmumunun yeniden ısıtılması ve hortumun istenen konuma hafifçe itilmesiyle yapılabilir.
- Aynı hazneye monte edilecek diğer sinekler için tekrarlayın.
- CO2'yi kapatın veya buz anestezisinden sinekleri çıkarın. Monte edilmiş sinekleri toparlanması için 60 dakika boyunca bir nem odasına yerleştirin (ıslak, tüy bırakmayan mendillerle temiz, boş pipet ucu kutusu).
4. İlgilenilen beyin bölgesini ortaya çıkarmak için diseksiyon
- Sinekleri nem odasından çıkarın. Sinekler açıkça canlı olmalı, karınlarını, bacaklarını ve antenlerini aktif olarak hareket ettirmelidir. Diseksiyondan önce konfokal veya iki fotonlu mikroskobu kurun.
- Diseksiyon sırasında balmumundaki olası kırılmaları onarmak için ağda makinesini açın ve oda sıcaklığında AHL'yi hazırlayın.
- Çok keskin forseps kullanarak, her iki anteni de sıkıştırın, ardından keskin forsepslerin bir tarafını yerleştirmek için bir delik sağlamak için kütikülü sıkıştırın. Forsepsleri kütikülün altından geçirerek beynin ilgi alanını kaplayan bölgeden çıkarın. Şekil 1F , çıkarılması için forseps ile hedeflenecek kütikül alanları üzerinde bir X'i göstermektedir.
- Kafaya cömertçe AHL (~ 100 μL) uygulayarak ve ardından beynin kurumasını önlemek için ince bir AHL tabakası dışında hepsini çıkararak maruz kalan beyni AHL'de yıkayın.
NOT: Balmumu herhangi bir noktada kırılırsa ve onarılması gerekiyorsa, hortumu uzatılmış konumda yeniden sabitlemek için balmumu yeniden ısıtmadan önce başın etrafındaki tüm AHL'yi kısa bir süre çıkarın. - Keskin forsepsler kullanarak hava keseciklerini ve beyni kaplayan büyük kalıntıları temizleyin. Forsepsin uçlarını görünür tutarak beyne nüfuz etmekten kaçının.
- Tüm küçük kalıntıları temizlemek için AHL ~ 3 kez yıkayın.
- İlgilenilen beyin bölgesinin açıkça görülebildiğinden emin olun. Bu örnekte olduğu gibi özofagus bölgesini (SEZ) spesifik olarak görüntülemek için, yemek borusunu çok keskin forsepslerle sıkıştırarak ve SEZ'i ortaya çıkarmak için bu parçayı çıkararak hortumun yakınındaki tabandan ve beyinden geçtiği noktanın yakınında kesin.
NOT: Yemek borusu çıkarıldıktan sonra sinekler çözeltileri yutamaz ve faringeal GRN aktivasyonu meydana gelemez. - Diseksiyon mikroskobu altında, 10 mm x 20 mm lamel görüntüleme odasının açılı yuvasına yerleştirin. Balmumu kırmadan hortumun tabanında durduğundan emin olun. Labellum'un ucu lamel ile temas etmemelidir.
5. Görüntüleme ve tat stimülasyonu
- Konfokal veya iki fotonlu mikroskobu açın ve görüntü yakalamaya hazır olun. Mikroskop aşamasındayken tastantları sineklere iletmek için konumlandırılmış bir kılcal tüpe sahip bir mikromanipülatör kurun.
NOT: İki fotonlu görüntüleme, beyin dokusunun daha derinlerinde bulunan nöronlardan floresan yakalayabilir. - Cihazın kılcal borusuna ~ 2 μL su (veya başka bir negatif kontrol) yükleyin.
mikroskop aşamasında stimülatörü. - Parçalanmış sineği bulun ve 10x havaya daldırma parlak alan kullanarak etikete odaklanın. Bu görünümün altındaki kılcal damarı labellum ile hizalayın. Kılcal damarın sinek ile hizalanmasını birden fazla açıdan görüntülemek için sineğin etiketine işaret eden ek kameralar dahil edilebilir.
NOT: Hizalama sırasında tüm labellar sensilla'nın çözelti ile uyarıldığından emin olun; Stimülatörün veya etiketin konumu bunun için yeterince dik değilse, buna göre ayarlayın. Kılcal damarlar, etiketin etrafına daha sıkı bir uyum sağlamak için bir bileme taşı ile çekilebilir ve törpülenebilir. - Kılcal damarı doğrudan labellumun önüne yerleştirin, yakın ama dokunmayın.
- Sahneyi, ilgilenilen beyin bölgesi ortalanacak şekilde hareket ettirin ve daha yüksek büyütmeli, suya daldırma hedefine geçin (bu örnekte 40x kullanılmıştır).
- Daldırma hedefi ile temas kurmak için beynin üstüne yaklaşık 200 μL AHL ekleyin. Baloncukları çıkarın.
- Çıkarılan kütikülün kenarını bulmak ve ilgilenilen beyin bölgesini ortalamak için z düzleminde dikkatlice hareket etmek için parlak alanı kullanarak odağı yönlendirin.
- İlgilendiğiniz alanda GCaMP ifadesini bulmak için 488 nm lazer gücüne geçin.
NOT: Sürücü hattına ve kullanılan GCaMP sürümüne bağlı olarak, bireysel hazırlıklar için sinyal-gürültüyü yükseltmek için bazı başlangıç optimizasyonları gerekebilir. Birlikte eksprese edilen RFP, düşük temel GCaMP floresansına sahip nöronlar için yardımcı olabilir. - Timelapse görüntü koleksiyonu hazırlayın. Hız, belirli mikroskoba ve GCaMP sinyaline bağlı olacaktır, ancak her ~ 100 ms'de en az bir görüntü yakalamak en uygunudur.
NOT: Zaman içinde tek bir Z floresan düzlemini yakalamak, ayrıntılı kalsiyum kinetiği sağlamak için yakalama hızını optimize edecektir. Her zaman noktasında birden fazla Z düzleminde çekilen görüntü yığınları, yakalama hızlarını yavaşlatabilir, ancak dokuda farklı derinliklerde bulunan nöritler arasındaki yanıtları kaydeder. - En az 5 sn başlangıç floresan topladıktan sonra, stimülatörü, kılcal damar belirli bir süre boyunca labellumu kaplayacak şekilde manuel olarak hareket ettirin (bu örnekte 5 s), ardından uyaranı çıkarın ve istediğiniz kadar uzun süre yakalayın.
- Lamel, stimülatör ve labellum'un hala aynı konumda olduğundan emin olmak için AHL'yi çıkarın ve 10x parlak alana dönün.
NOT: Stimülatör labellum ile iyi hizalanmamışsa veya çok fazla döndürülmüşse, labellum hareket ettirilebilir veya kılcal damar görüntüleme odasına çarpabilir, bu da potansiyel olarak balmumu kırabilir ve AHL'den bir sızıntı oluşturabilir. - Görüntüleme odasını çıkarın. İlk solüsyonu çıkarmak için tüy bırakmayan bir mendil kullanın ve pipeti suyla yıkayın. Ardından, bir sonraki tastantın ~ 2 μL'sini kılcal boruya pipetleyin.
- Görüntüleme odasını sahne alanına geri taşıyın ve bu çözüm için 5.4-5.12 arasındaki adımları tekrarlayın.
NOT: Çoğu kumaşın yüksek yüzey gerilimi, artık kimyasalların sinek etiketinde kalmasına neden olur. Bununla birlikte, tatlar yüksek derecede doymuş veya viskoz ise, bir sonraki uyarandan önce duyu organını yıkamak için su labellum üzerinde birkaç kez hareket ettirilebilir. - Bu sinek için istediğiniz kadar çözüm için tekrarlayın.
- Bir sonraki sineği görüntülemeye hazırlamak için 3. adıma dönün.
6. Görüntü analizi
- Analiz edilecek görüntü yığınını görüntü işleme yazılımında açın. Gerekirse, GCaMP sinyalinin dışındaki bir bölgeyi kullanarak arka planda çıkarma işlemi gerçekleştirin.
- Serbest el veya şekil aracını kullanarak nicelleştirilecek projeksiyonların etrafında sıkı bir ilgi alanı (ROI) seçin ve seçimin yığındaki tüm görüntülere uygulandığından emin olun.
- Bu yatırım getirisi için zaman içindeki floresan okumalarının bir listesini oluşturun ve daha sonraki işlemler için bir elektronik tabloya aktarın. ImageJ'de (FIJI) çizim Z ekseni profilini veya tercih edilen görüntü işleme yazılımında benzer bir işlevi kullanın.
- Elektronik tabloda, adım 5.10'daki temel kayıt sırasında temsili bir taban çizgisi olarak ardışık 10 zaman noktası seçin. Ortalama ve standart sapmayı hesaplayın.
- ΔF/F'yi yüzde olarak elde etmek için, her zaman noktası için ((F - ortalama taban çizgisi F)/temel ortalama F)*100) hesaplayın. ΔF/F'yi bir z puanı olarak almak için, her zaman noktası için ((F - ortalama taban çizgisi F)/standart sapma taban çizgisi F) hesaplayın.
- Stimülasyon sırasında floresandaki en yüksek değişimi hesaplamak için, en yüksek floresansa sahip 3 ardışık nokta seçin ve ortalamayı hesaplayın.
- Uyaranlar ve sinekler arasındaki her görüntü yığını için tekrarlayın.
NOT: Bu adımları, belirli mikroskoba, sinyal kalitesine ve tercih edilen görüntü analiz yazılımına göre gerektiği gibi uyarlayın.
Sonuçlar
Şekil 1, bu hazırlıkta kullanılan görüntüleme odasının (Şekil 1A,B) ve mum ucunun (Şekil 1D) ayrıntılarını sağlar. Şekil 1 ayrıca sinekleri monte etme (Şekil 1C), hortumu yerine mumlama (Şekil 1E), ilgilenilen beyin bölgesi üzerinde diseksiyon (Şekil 1F) ve beyinde floresan kaydederken labellumu bir tastantla uyarma prosedürünün ana adımlarını göstermektedir (Şekil 1G). Drosophila melanogaster'in primer tat reseptör nöronlarında (GRN'ler) tat kaynaklı tepkileri ölçmek için, UAS-GCaMP6f'nin Gr64f-Gal4 sürüş ekspresyonu ile sinekler, 14,27,30,32,33,34,35 etiketinin tüm şeker algılayıcı "tatlı" GRN'lerinde genetik olarak ifade edilen kalsiyum göstergesini elde etmek için üretildi. Bu deneyler için, aşağıdaki bileşenlere sahip bir konfokal mikroskop kullanıldı: 40 fps sCMOS kameralı dik bir floresan mikroskop, 10x ve 40x objektifler, dönen disk konfokal, dikroik 488 yayıcılar ve 488 nm katı hal lazerleri. 40x objektif AHL'ye daldırıldı ve bu etiketleyici GRN'lerin akson terminallerinde temel GCaMP sinyalini bulmak için SEZ beyin bölgesine odaklandı (Şekil 2A). Taban çizgisi sırasında (stimülasyon yok), 5 saniye tat stimülasyonu sırasında (stimülatör labellum üzerinde hareket ettirildi) ve stimülasyondan sonra floresan taban çizgisine dönene kadar her 100 ms'de bir floresan görüntüsü yakalandı (Şekil 2A, B). Negatif kontrol olarak su, pozitif kontrol olarak 1 M sükroz kullanıldı. Floresanstaki nispi değişim, 13 sinek için ΔF/F (z-skoru) olarak hesaplandı ve tat stimülasyonu sırasında kalsiyum tepkilerinin kinetiğini göstermek için zaman içinde çizildi (Şekil 2B). Tepe ΔF/F (z-skoru) çizildi ve bu hücrelerdeki sükroz yanıtının sudan önemli ölçüde daha yüksek olduğunu göstermek için istatistiksel karşılaştırmalar için kullanıldı (Şekil 2C). Bu teknik, "tatlı" GRN'lerin, stimülasyon süresi boyunca bir miktar çürüme ile yüksek kalan sakaroz başlangıcında güçlü bir zirveye sahip olduğunu yakalar.
Karşılaştırma için, bu protokol farklı bir sürücü olan Gr66a-Gal4 ile sineklerde tekrarlandı ve UAS-GCaMP6f'yi özellikle 14,17,28,34,36 etiketindeki tüm "acı" GRN'lerde eksprese etti. Benzer şekilde, bu GRN'lerin akson terminalleri SEZ'de bulunuyordu: projeksiyon modelinin şeker algılayıcı GRN'lerden farklı olduğuna dikkat edin (Şekil 2D). Floresan, pozitif kontrol olarak kullanılan 100 mM kafein dışında, daha önce olduğu gibi yakalandı ve analiz edildi. 11 sinekten elde edilen eğrinin ortalaması, kafein stimülasyonunun başlamasıyla güçlü bir zirve gösterir, ancak aynı zamanda belirli acı uyaranlarla meydana geldiği bilinen uyaranın çıkarılmasıyla küçük bir "kapalı" yanıt da vardır28 (Şekil 2E). Bu yöntem, tat kaynaklı tepkilerin zamansal kalıplarını karakterize etmek için hem "açık" hem de "kapalı" yanıtların nicelleştirilmesine izin verir 27,28. Burada, kafeine verilen yanıtın sudan önemli ölçüde daha güçlü olduğunu göstermek için yalnızca "açık" zirveler ölçülmüştür (Şekil 2F). Şekil 2'deki deneyler yüksek oranda tekrarlanabilir ve protokolün düzgün çalıştığından emin olmak için kullanılabilir.
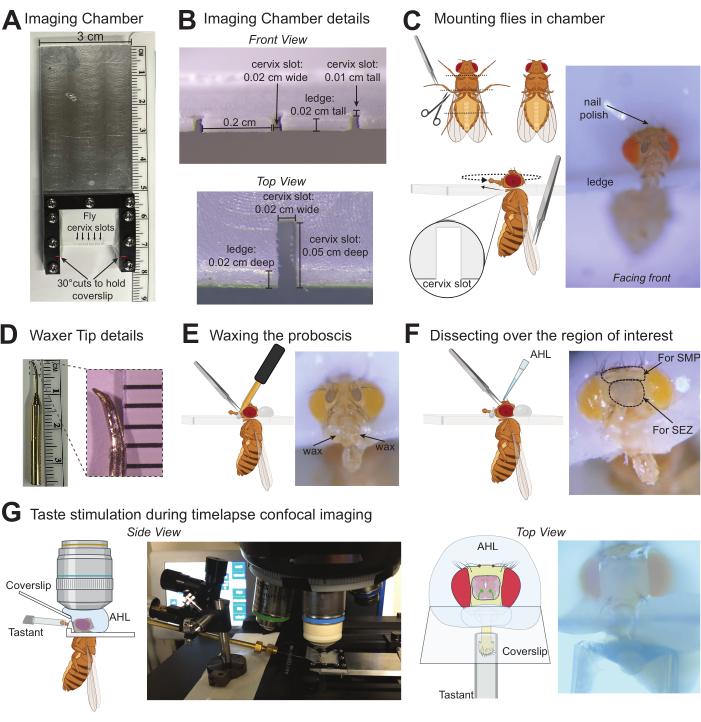
Şekil 1: Drosophila beyninde tat kaynaklı tepkileri görüntülemek için protokol çizimleri. (A) Bir seferde en fazla beş sineği monte etmek için kullanılan özel görüntüleme odasının üstten görünümü. (B) Sineklerin monte edildiği görüntüleme odasının ayrıntıları, D. melanogaster'in rahim ağzına rahatça uyan ölçümlerle yapılır. (C) Tarsinin nerede kesileceğini (sol üstte) ve forseps (sol altta) kullanılarak sineğin görüntüleme odasının serviks yuvasına nasıl monte edileceğini gösteren grafikler. Görüntüleme odasında doğru konumda monte edilmiş bir sineğin fotoğrafı (sağda). (D) Mum ucunun fotoğrafı (solda), standart ucu değiştirmek için bir bileme taşı kullanırken hedeflenecek yaklaşık şekli ve boyutu belirtmek için ucun yakınlaştırılmış fotoğrafı (sağda). (E) Forseps kullanılarak hortumun yerine mumlanmasının grafik gösterimi (solda), uygun şekilde mumlanmış bir labellum ile monte edilmiş bir sineğin fotoğrafı (sağda). (F) İlgilenilen beyin bölgesi üzerindeki diseksiyonu ve AHL'nin uygulanmasını temsil eden grafik illüstrasyon (solda), SEZ veya SMP beyin bölgelerini hedeflerken çıkarmak için kütikül alanı etrafında noktalı daireler bulunan bir sineğin fotoğrafı. X, diseksiyon için sıkıştırılacak kütikül bölgelerini gösterir (sağda). (G) Grafikler ve fotoğraflar, monte edilmiş/disseke edilmiş sineğin konumunu, AHL'deki suya daldırma hedefini, hortum üzerinde bir tastantlı stimülatörü ve bu çözeltiler arasında bir bariyer oluşturan lamel gösterir. Yan görünüm uzaklaştırıldı (solda) ve üst görünüm 10x objektifin altındaydı (sağda). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
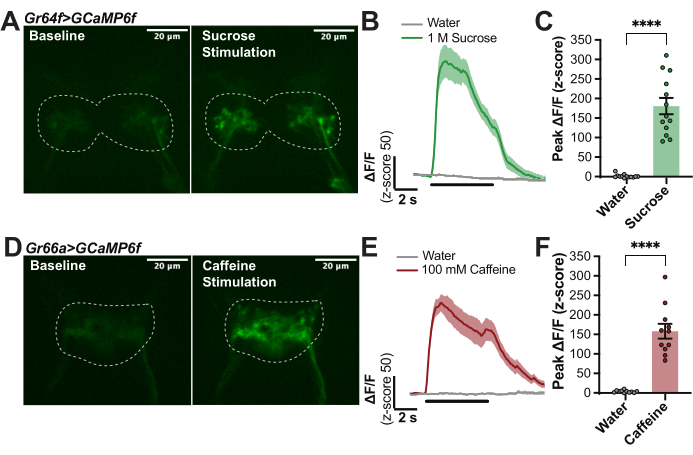
Şekil 2: Etiketleyici GRN'lerin tat uyaranlarına kalsiyum tepkilerine örnek. (A) Başlangıçta ve 64 M sükroza en yüksek yanıt sırasında Gr6f>GCaMP6f ile bir sinekte GCaMP floresan seviyesini gösteren bir görüntü yığınından hala yakalar, ölçek çubuğu = 20 μm. Noktalı çizgiler, analiz için yatırım getirisini gösterir. (B) N = 14 sinek için kalsiyum yanıt eğrileri ΔF/F (z-skoru) olarak hesaplanır ve kinetiği göstermek için su (negatif kontrol) ve 1 M sükroz (pozitif kontrol) için birleştirilir; Eğrilerin altındaki siyah çizgi, uyaranın etiketin üzerinde olduğunu gösterir. (C) İstatistiksel karşılaştırmalar için çizilen her sinek için tepe ΔF/F (z-skoru). Eşleştirilmiş t-testi, ****p < 0.0001. (D) Başlangıçta ve 100 mM kafeine en yüksek yanıt sırasında Gr66a>GCaMP6f ile bir sinekte GCaMP floresan seviyesini gösteren bir videodan hala yakalar, ölçek çubuğu = 20 μm. Noktalı çizgiler, analiz için yatırım getirisini gösterir. (E) ΔF/F (z-skoru) olarak hesaplanan ve kinetiği göstermek için su (negatif kontrol) ve 100 mM kafein (pozitif kontrol) için birleştirilen n = 11 sinek için kalsiyum yanıt eğrileri: küçük "kapalı" tepkiye dikkat edin, eğrilerin altındaki siyah çizgi, uyaranın etiketin üzerinde olduğunu gösterir. (F) İstatistiksel karşılaştırmalar için çizilen her sinek için tepe ΔF/F (z-skoru). Eşleştirilmiş t-testi, ****p < 0.0001. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu protokolün en zorlu yönlerinden biri, labellumu cilalamak ve hedeflenen diseksiyonları gerçekleştirmek için gereken mikromanipülasyon becerisidir. Labellum'u sabitlemek için ek bir adım, her bir sensillumu bu duyu organı boyunca eşit şekilde uyarmak ve ilgilenilen beyin bölgelerini görselleştirmek için gereklidir. Burada kullanılan özel görüntüleme odası, D. melanogaster için optimize edilmiştir, ancak odanın özelliklerinin ve ağda yaklaşımının diğer böcekler için değiştirilmesi gerekebilir. Bu protokol, çok az değişiklikle diğer Drosophilidlere uygulanabilir, ancak arılar ve sivrisinekler gibi Brachycera alt takımının diğer üyeleri, labial palp ve kafa morfolojisindeki farklılıkları hesaba katmak için montaj ve diseksiyon adımlarında değişiklikler gerektirebilir. Doku iletimi için mikromanipülatörün hizalanması da zor olabilir ve optimizasyon için özel mikroskop aşaması ile ilk testi gerektirir. Stimülasyon sırasında balmumu kırılırsa, kılcal damardaki AHL ve tastantın temas ettiği sızıntılara neden olabilir. Kılcal damarları çekmek ve etiketlemeye daha yakın oturması için bir bileme taşı ile törpülemek, tastant ve AHL'nin temas etmesini önlemeye yardımcı olabilir. Herhangi bir sızıntı veya aşırı beyin hareketi olan sinekler dışlanmalıdır. Mümkün olduğunda, labellum ve labellar sinirlerin ağda veya diseksiyondan zarar görmemesini sağlamak için her hayvan için her zaman pozitif bir kontrol ekleyin. Burada gösterilen "tatlı" ve "acı" örnekler, sağlam kontrol deneyleri olarak önerilir.
Burada tarif edilen in vivo kalsiyum görüntüleme yaklaşımı, birincil tat nöronlarında, yüksek dereceli nöronlarda ve D. melanogaster'deki tüm SEZ'de tat kaynaklı tepkileri ölçmek için kullanılmıştır tat reseptörlerini ve devrelerini tanımlamak için D. melanogaster 8,14,17,18,19,20,27,28,30,31, 34,35,36,37,38,39,40,41,
42,43,44,45,46,47,48. Bu model organizmadaki yaygın uygulamalar, kolayca bulunabilen Gal4 ve bölünmüş Gal4 sürücülerinden kaynaklanmaktadır; bu nedenle, genetiği değiştirilmiş böceklerin GCaMP'yi ilgilenilen belirli nöronlarda ifade etme ihtiyacı, bu yaklaşım için sınırlayıcı bir faktördür. Neyse ki, gen düzenleme teknolojisindeki ilerlemelerle, bu, model organizmaların ötesindeki böcekler için daha erişilebilir hale geliyor ve son zamanlarda Drosophila suzukii49 ve vektör taşıyan sivrisinekler50 için kalsiyum görüntüleme kullanılarak tat kaynaklı tepkiler bildirilmiştir. Tüm kalsiyum görüntülemede olduğu gibi, hedeflenen nöronlar için sinyal-gürültünün bir miktar ilk optimizasyonu gerekli olabilir. Sinyaller, GCaMP'nin daha parlak sürümleri kullanılarak ve GCaMP'nin iki kopyası ifade edilerek geliştirilebilir. Hedef nöronlarda RFP'nin birlikte eksprese edilmesi, hedef nöronların başlangıçta görselleştirilmesine yardımcı olabilir ve nabız atma eğilimi olan bölgelerde beyin hareketi için bir kontrol görevi görebilir.
Bu protokol, tarsi ve anteni çıkararak, maksiller palpların üzerine ağda yaparak ve faringeal GRN'lerin uyarılmaması için yutmayı sınırlayarak kemosensasyonu labellumdan izole etmek için özel olarak tasarlanmıştır. Bununla birlikte, bu protokolde tarsal veya faringeal GRN'lerden kemosensasyonu içerecek şekilde ayarlamalar yapılabilir. Tarsi sağlam bırakılırsa, bacaklar tek başına veya kılcal damarın ucunda büyük bir tastant solüsyonu baloncuğu oluşturarak labellum'a ek olarak uyarılabilir. Tarsi bozulmadan bırakılırsa, bir sineğin lamel tekmeleme ve hareket ettirme potansiyeli vardır; Bu nedenle, istenmeyen hareketlerin önlenmesine yardımcı olmak için tarsinin tabana yakın bir yerde mumlanması düşünülebilir. Mevcut örnek, faringeal GRN stimülasyonunu önlemek ve SEZ'deki labellar projeksiyonları daha iyi görselleştirmek için yemek borusunun kesilmesi adımını içerir, ancak aynı preparat daha önce yemek borusunu sağlam bırakarak ve lateral faringeal projeksiyonları görüntüleyerek faringeal GRN yanıtlarını ölçmek için uyarlanmıştır36. Bu önceki uygulama, sineklerin faringeal GRN'leri uyarmak için serbestçe tüketeceği iştah açıcı bir şeker uyarıcısı kullanıyordu, ancak sinekler, bu yaklaşımın bir sınırlaması olan acı faringeal GRN'leri aktive etmek için caydırıcı bir uyaranı kolayca tüketmeyecekti. Ek bir sınırlama, Drosophila11'in kanatlarında bulunan GRN'lerin tepkilerinin bu yaklaşımla kolayca incelenememesidir.
Burada tarif edilen in vivo kalsiyum görüntüleme, daha yüksek dereceli tat kaynaklı yanıtları incelemek için standart yöntem haline gelmiş olsa da 8,18,19,20,28, şu anda sineklerde tatlara birincil etiketleyici GRN yanıtlarını ölçmek için birkaç başka yaklaşım vardır. Burada tarif edilen in vivo kalsiyum görüntüleme yaklaşımı, beyindeki akson terminallerindeki GCaMP değişikliklerini kaydeder, ancak etiketleyiciGRNs 33'teki hücre gövdesi GCaMP'yi ölçmek için ex vivo bir yaklaşım da kullanılmıştır. Benzer şekilde, sağlam sineklerde labellar veya tarsal GRN'lerin hücre gövdelerini görüntülemek için başka bir montaj yaklaşımı tanımlanmıştır51. Elektrofizyoloji, böceklerde birincil tat nöronlarının tepkilerini incelemek için popüler ve etkili bir teknik olmaya devam ediyor 13,16,32,52,53,54,55,56,57,58,59,60,64,62,63,64,65. Bu, genetik olarak kodlanmış kalsiyum sensörlerine ihtiyaç duymayı gerektirmez ve nöronal aktivitenin daha doğrudan bir nicelleştirilmesidir. Bununla birlikte, bir seferde yalnızca bir sensilladan gelen yanıtlar kaydedilebilirken, kalsiyum görüntüleme aynı anda tam bir GRN popülasyonundan kayıt yapabilir. Kalsiyum görüntüleme yaklaşımı, belirli uyaranlara sahip GRN'lerde "açık" ve "kapalı" tepkilerin benzersiz zamansal dinamiklerini keşfetmek için kullanıldı27,28, ancak D. melanogaster'deki tat sensilla tabanından elektrofizyolojik kayıtlarda son zamanlarda yapılan bir ilerleme, artık "kapalı" yanıtların aksiyon potansiyelleri düzeyinde ölçülmesine izin vermektedir53. İlginç bir şekilde, açlık ile primer GRN duyarlılığının modülasyonu kalsiyum görüntüleme ile tespit edildi, ancak elektrofizyoloji29 ile aksiyon potansiyelleri düzeyinde değildi, ancak hem elektrofizyolojik uç kayıtları hem de kalsiyum görüntüleme, diyet30,66 ile GRN duyarlılığında bir değişiklik yakalayabilir. Bu nedenle, elektrofizyoloji, tat ligandlarını ve reseptörlerini tanımlamak ve çeşitli faktörlerin primer tat reseptörü nöronlarının duyarlılığını nasıl modüle ettiğini anlamak için kalsiyum görüntülemeye önemli, tamamlayıcı bir yaklaşım olmaya devam etmektedir.
Açıklamalar
Yazarların herhangi bir çıkar çatışması ve ifşa edecek hiçbir şeyi yoktur.
Teşekkürler
Sinek stokları için Bloomington Drosophila Stok Merkezi'ne ve özel görüntüleme odalarının imalatındaki yardımları için Vermont Üniversitesi IMF Laboratuvarlarına teşekkür ederiz. Ayrıca grafik illüstrasyonların oluşturulması için BioRender'a ve bu grafiklerin tasarımına katkıda bulunduğu için Kayla Audette'e teşekkür ederiz. Bu çalışma, Vermont Üniversitesi'nden yeni laboratuvar başlangıç fonları ve Ulusal Bilim Vakfı'nın 2332375 numaralı ödülü ile desteklendi. Şekil 1'deki grafikler www.BioRender.com ile oluşturulmuştur.
Malzemeler
| Name | Company | Catalog Number | Comments |
| CaCl2 | Sigma-Aldrich | C7902 | For AHL |
| Caffeine | Sigma-Aldrich | C0750 | For a "bitter" taste stimulus |
| Clear nail polish- quick dry | Many vendors | Example: Sally Hansen Xtreme wear (clear) | |
| CO2 fly pad station | Genesee Scientific | 59-122BC | Includes tubing, a gun to initially anesthetize flies, and a pad to deliver continuous anesthesia |
| CO2 supply (cylinders) | Airgas | USP50 | For anesthesia |
| Confocal or two-photon microscope | Many vendors | Upright microscope, high signal to noise and rapid capture capabilities, 10X air immersion objective, 25-40X water immersion objective, accompanying hardware and software | |
| Coverslips | Globe Scientific | 1404-15 | 22 x 22 mm, No 1.5: for this specific imaging chamber, score and cut in half to get 11 x 22 mm coverslips |
| D. melanogaster: Gr64f-Gal4 | Bloomington Drosophila Stock Center | 57669 | For driving GCaMP expression in 'sweet' gustatory receptor neurons of the labellum |
| D. melanogaster: Gr66a-Gal4 | Bloomington Drosophila Stock Center | 57670 | For driving GCaMP expression in 'bitter' gustatory receptor neurons of the labellum |
| D. melanogaster: UAS-GCaMP6f | Bloomington Drosophila Stock Center | 42747 | For getting GCaMP expression when crossed to a Gal4 driver line |
| Dental Waxer | Pearson Dental | 49-00-54 | Digital wax carver, comes with tips that can be modified and sharpened small enough to deliver wax along the fly proboscis |
| Dissection microscope | Many vendors | .63 - 6.3X for optimal viewing but with sufficient working distance to perform dissections under the microscope | |
| Dissection scissors | Fine Science Tools | 15000-08 | This pair or any similar dissection scissors are appropriate |
| Empty pipette tip box | Free- many vendors | For humidity chamber: needs enough space so that the imaging chamber can sit and the lid can close without bumping the chamber | |
| Filter flask | Millipore-Sigma | CLS431097 | For filtering AHL stocks |
| Glass capillary | World Precision Instruments | TW100-4 | This size fits well over the D. melanogaster labellum without needing modification, but other capillaries can be pulled and filed down to an appropriate size |
| HEPES | Sigma-Aldrich | BP310 | For AHL |
| ImageJ (FIJI) | NIH | https://imagej.nih.gov/ij | Image analysis software |
| Imaging Chamber | IMF Labs | Custom item | The custom-made chamber in this example can be ordered at https://www.uvm.edu/research/imf/forms/contact-us. Base: 6061 aluminum, Holding Clamps: Black Delrin (Acetal), Insert: Moisture Resistant polyester (PET). Manual and CNC milling machines for fabrication. |
| KCl | Sigma-Aldrich | P9541 | For AHL |
| Kim wipes | Millipore-Sigma | Z188956 | For humidity chamber, wiping off forceps, removing solutions from capillaries, etc. |
| MgCl2 | Sigma-Aldrich | M9272 | For AHL |
| Micromanipulator | Tritech Research | U-31CF, USM-6, MINJ-4 | This example uses a magnet to attach the micromanipulator to the stage, other configurations are possible |
| NaCl | Sigma-Aldrich | S7653 | For AHL |
| NaH2PO4 | Sigma-Aldrich | 567545 | For AHL |
| NaHCO3 | Sigma-Aldrich | S6014 | For AHL |
| p10 pipette and tips | Many vendors | For filling the capillaries with tastants | |
| p200 pipette and tips | Many vendors | For AHL | |
| Parafin wax | Many vendors | White/clear block of wax often found in craft stores | |
| Ribose | Sigma-Aldrich | W379301 | For AHL |
| Semi-sharp forceps | Fine Science Tools | 11252-20 | Blunted to approximately tip size C |
| Sharp forceps | Fine Science Tools | 11252-20 | Sharpened to tip size A |
| Sharpening stone | Fine Science Tools | 29000-00 | For modifying dental waxer tips and forceps |
| Sucrose | Sigma-Aldrich | S0389 | For a "sweet'"taste stimulus |
| Toothpick | Many vendors | Small tip for nail polish application |
Referanslar
- Wangler, M. F., Yamamoto, S., Bellen, H. J. Fruit flies in biomedical research. Genetics. 199 (3), 639-653 (2015).
- Ryu, L., Kim, S. Y., Kim, A. J. From photons to behaviors: Neural implementations of visual behaviors in Drosophila. Front Neurosci. 16, 883640 (2022).
- Joseph, R. M., Carlson, J. R. Drosophila chemoreceptors: A molecular interface between the chemical world and the brain. Trends Genet. 31 (12), 683-695 (2015).
- Montell, C. Drosophila sensory receptors-a set of molecular Swiss Army knives. Genetics. 217 (1), 1-34 (2021).
- Scott, K. Gustatory processing in Drosophila melanogaster. Annu Rev Entomol. 63, 15-30 (2018).
- Starostina, E., et al. A Drosophila DEG/ENaC subunit functions specifically in gustatory neurons required for male courtship behavior. J Neurosci. 32 (13), 4665-4674 (2012).
- Chen, Y., Amrein, H. Ionotropic receptors mediate Drosophila oviposition preference through sour gustatory receptor neurons. Curr Biol. 27 (18), 2741-2750.e4 (2017).
- Guillemin, J., et al. Taste cells expressing ionotropic receptor 94e reciprocally impact feeding and egg laying in Drosophila. Cell Rep. 43, 114625 (2024).
- Ostojic, I., et al. Positive and negative gustatory inputs affect Drosophila lifespan partly in parallel to dFOXO signaling. Proc Natl Acad Sci U S A. 111 (22), 8143-8148 (2014).
- Stocker, R. F. The organization of the chemosensory system in Drosophila melanogaster: A review. Cell Tissue Res. 275 (1), 3-26 (1994).
- Raad, H., Ferveur, J. -. F., Ledger, N., Capovilla, M., Robichon, A. Functional gustatory role of chemoreceptors in Drosophila wings. Cell Rep. 15 (7), 1442-1454 (2016).
- Montell, C. A taste of the Drosophila gustatory receptors. Curr Opin Neurobiol. 19 (4), 345-353 (2009).
- Weiss, L. A., Dahanukar, A., Kwon, J. Y., Banerjee, D., Carlson, J. R. The molecular and cellular basis of bitter taste in Drosophila. Neuron. 69 (2), 258-272 (2011).
- Jaeger, A. H., et al. A complex peripheral code for salt taste in Drosophila. Elife. 7, 37167 (2018).
- Freeman, E. G., Dahanukar, A. Molecular neurobiology of Drosophila taste. Curr Opin Neurobiol. 34, 140-148 (2015).
- Delventhal, R., Kiely, A., Carlson, J. R. Electrophysiological recording from Drosophila labellar taste sensilla. J Vis Exp. 84, e51355 (2014).
- Marella, S., et al. Imaging taste responses in the fly brain reveals a functional map of taste category and behavior. Neuron. 49 (2), 285-295 (2006).
- Shiu, P. K., Sterne, G. R., Engert, S., Dickson, B. J., Scott, K. Taste quality and hunger interactions in a feeding sensorimotor circuit. Elife. 11, e79887 (2022).
- Li, J., Dhaliwal, R., Stanley, M., Junca, P., Gordon, M. D. Functional imaging and connectome analyses reveal organizing principles of taste circuits in Drosophila. bioRxiv. , (2024).
- Junca, P., Stanley, M., Musso, P. -. Y., Gordon, M. D. Modulation of taste sensitivity by the olfactory system in Drosophila. bioRxiv. , (2021).
- Elliott, D. A., Brand, A. H. The GAL4 system: A versatile system for the expression of genes. Drosophila Methods Protoc. , 79-95 (2008).
- Riabinina, O., Potter, C. J., Dahmann, C. . Drosophila: Methods and Protocols. , 53-78 (2016).
- Diegelmann, S., Bate, M., Landgraf, M. Gateway cloning vectors for the LexA-based binary expression system in Drosophila. Fly. 2 (4), 236-239 (2008).
- Zhang, Y., et al. Fast and sensitive GCaMP calcium indicators for imaging neural populations. Nature. 615 (7954), 884-891 (2023).
- Ohkura, M., et al. Genetically encoded green fluorescent Ca2+ indicators with improved detectability for neuronal Ca2+ signals. PLoS One. 7 (12), e51286 (2012).
- Arntsen, C., Guillemin, J., Audette, K., Stanley, M. Tastant-receptor interactions: Insights from the fruit fly. Front Nutr. 11, 1394697 (2024).
- Stanley, M., Ghosh, B., Weiss, Z. F., Christiaanse, J., Gordon, M. D. Mechanisms of lactic acid gustatory attraction in Drosophila. Curr Biol. 31 (16), 3525-3537.e6 (2021).
- Devineni, A. V., Deere, J. U., Sun, B., Axel, R. Individual bitter-sensing neurons in drosophila exhibit both on and off responses that influence synaptic plasticity. Curr Biol. 31 (24), 5533-5546.e7 (2021).
- Inagaki, H. K., et al. Visualizing neuromodulation in vivo: Tango-mapping of dopamine signaling reveals appetite control of sugar sensing. Cell. 148 (3), 583-595 (2012).
- May, C. E., et al. High dietary sugar reshapes sweet taste to promote feeding behavior in drosophila melanogaster. Cell Rep. 27 (6), 1675-1685.e7 (2019).
- May, C. E., Rosander, J., Gottfried, J., Dennis, E., Dus, M. Dietary sugar inhibits satiation by decreasing the central processing of sweet taste. Elife. 9, e54530 (2020).
- Jiao, Y., Moon, S. J., Wang, X., Ren, Q., Montell, C. Gr64f is required in combination with other gustatory receptors for sugar detection in Drosophila. Curr Biol. 18 (22), 1797-1801 (2008).
- Chen, H. -. L., Stern, U., Yang, C. -. H. Molecular control limiting sensitivity of sweet taste neurons in Drosophila. Proc Natl Acad Sci USA. 116 (40), 20158-20168 (2019).
- Devineni, A. V., Sun, B., Zhukovskaya, A., Axel, R. Acetic acid activates distinct taste pathways in Drosophila to elicit opposing, state-dependent feeding responses. Elife. 8, e47677 (2019).
- Engert, S., Sterne, G. R., Bock, D. D., Scott, K. Drosophila gustatory projections are segregated by taste modality and connectivity. Elife. 11, e78110 (2022).
- Ledue, E. E., et al. Starvation-induced depotentiation of bitter taste in Drosophila. Curr Biol. 26 (21), 2854-2861 (2016).
- Mcdowell, S. A. T., Stanley, M., Gordon, M. D. A molecular mechanism for high salt taste in Drosophila. Curr Biol. 32 (14), 3070-3081.e7 (2022).
- Deere, J. U., Devineni, A. V. Taste cues elicit prolonged modulation of feeding behavior in Drosophila. iScience. 25 (10), 105159 (2022).
- Deere, J. U., et al. Selective integration of diverse taste inputs within a single taste modality. Elife. 12, (2023).
- Chu, B., Chui, V., Mann, K., Gordon, M. D. Presynaptic gain control drives sweet and bitter taste integration in Drosophila. Curr Biol. 24 (17), 1978-1984 (2014).
- Yao, Z., Scott, K. Serotonergic neurons translate taste detection into internal nutrient regulation. Neuron. 110 (6), 1036-1050.e7 (2022).
- Cameron, P., Hiroi, M., Ngai, J., Scott, K. The molecular basis for water taste in Drosophila. Nature. 465 (7294), 91-95 (2010).
- Jourjine, N., Mullaney, B. C., Mann, K., Scott, K. Coupled sensing of hunger and thirst signals balances sugar and water consumption. Cell. 166 (4), 855-866 (2016).
- Kim, H., Kirkhart, C., Scott, K. Long-range projection neurons in the taste circuit of Drosophila. Elife. 6, e23386 (2017).
- Kirkhart, C., Scott, K. Gustatory learning and processing in the Drosophila mushroom bodies. J Neurosci. 35 (15), 5950-5958 (2015).
- Steck, K., et al. Internal amino acid state modulates yeast taste neurons to support protein homeostasis in Drosophila. Elife. 7, e31625 (2018).
- Münch, D., Goldschmidt, D., Ribeiro, C. The neuronal logic of how internal states control food choice. Nature. 607 (7920), 747-755 (2022).
- Taisz, I., et al. Generating parallel representations of position and identity in the olfactory system. Cell. 186 (12), 2556-2573.e2 (2023).
- Cavey, M., et al. Increased sugar valuation contributes to the evolutionary shift in egg-laying behavior of the fruit pest Drosophilasuzukii. PLoS Biol. 21 (12), e3002432 (2023).
- Jové, V., et al. Sensory discrimination of blood and floral nectar by Aedes aegypti mosquitoes. Neuron. 108 (6), 1163-1180.e2 (2020).
- Shankar, S., Calvert, M. E., Yew, J. Y. Measuring physiological responses of Drosophila sensory neurons to lipid pheromones using live calcium imaging. J Vis Exp. (110), e53392 (2016).
- Dahanukar, A., Lei, Y. -. T., Kwon, J. Y., Carlson, J. R. Two gr genes underlie sugar reception in Drosophila. Neuron. 56 (3), 503-516 (2007).
- Dweck, H. K. M., Carlson, J. R. Base recording: A technique for analyzing responses of taste neurons in Drosophila. J Vis Exp. (205), e66665 (2024).
- Dweck, H. K. M., Talross, G. J. S., Luo, Y., Ebrahim, S. A. M., Carlson, J. R. Ir56b is an atypical ionotropic receptor that underlies appetitive salt response in Drosophila. Curr Biol. 32 (8), 1776-1787.e4 (2022).
- Park, J., Carlson, J. R. Physiological responses of the Drosophila labellum to amino acids. J Neurogenet. 32 (1), 27-36 (2018).
- Wang, W., et al. Sugar sensation and mechanosensation in the egg-laying preference shift of Drosophilasuzukii. Elife. 11, e81703 (2022).
- Xiao, S., Baik, L. S., Shang, X., Carlson, J. R. Meeting a threat of the Anthropocene: Taste avoidance of metal ions by Drosophila. Proc Natl Acad Sci USA. 119 (25), e2204238119 (2022).
- Ganguly, A., et al. Requirement for an otopetrin-like protein for acid taste in Drosophila. Proc Natl Acad Sci USA. 118 (51), e2110641118 (2021).
- Lee, Y., Moon, S. J., Montell, C., Snyder, S. H. Multiple gustatory receptors required for the caffeine response in Drosophila. Proc Natl Acad Sci USA. 106 (11), 4495-4500 (2009).
- Lee, Y., Poudel, S., Kim, Y., Thakur, D., Montell, C. Calcium taste avoidance in Drosophila. Neuron. 97 (1), 67-74.e4 (2018).
- Mi, T., et al. Alkaline taste sensation through the alkaliphile chloride channel in Drosophila. Nat Metab. 5 (3), 466-480 (2023).
- Rimal, S., et al. Mechanism of acetic acid gustatory repulsion in Drosophila. Cell Rep. 26 (6), 1432-1442.e4 (2019).
- Zhang, Y. V., Ni, J., Montell, C. The molecular basis for attractive salt-taste coding in Drosophila. Science. 340 (6138), 1334-1338 (2013).
- Aryal, B., Dhakal, S., Shrestha, B., Lee, Y. Molecular and neuronal mechanisms for amino acid taste perception in the Drosophila labellum. Curr Biol. 32 (6), 1376-1386.e4 (2022).
- Shrestha, B., Aryal, B., Lee, Y. The taste of vitamin C in Drosophila. EMBO Rep. 24 (6), e56319 (2023).
- Ganguly, A., Dey, M., Scott, C., Duong, V. -. K., Arun Dahanukar, A. Dietary macronutrient imbalances lead to compensatory changes in peripheral taste via independent signaling pathways. J Neurosci. 41 (50), 10222 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır