Method Article
In vivo Imaging del calcio delle risposte neurali indotte dal gusto nella Drosophila adulta
In questo articolo
Riepilogo
Un approccio di imaging del calcio consente la registrazione delle risposte indotte dal gusto nel cervello dei moscerini svegli mentre una soluzione viene applicata al labello. Le risposte gustative primarie in Drosophila melanogaster sono utilizzate come esempio, ma questo protocollo può essere adattato per studiare i neuroni a valle o altre specie.
Abstract
Per quasi due decenni, l'imaging del calcio in vivo è stato un metodo efficace per misurare le risposte cellulari agli stimoli gustativi nell'organismo modello del moscerino della frutta, Drosophila melanogaster. Un punto di forza di questa metodologia è la sua capacità di registrare le risposte neurali indotte dal gusto negli animali svegli senza la necessità di anestesia. Questo approccio impiega sistemi di espressione binari (ad esempio, Gal4-UAS) per esprimere l'indicatore di calcio GCaMP in specifici neuroni di interesse. Questo protocollo descrive una procedura in cui i moscerini che esprimono GCaMP sono montati con il labello posizionato in modo sicuro, consentendo di registrare la fluorescenza nel cervello con una risoluzione di millisecondi sotto un microscopio confocale mentre una soluzione viene applicata al labello, stimolando tutti i sensi del gusto labellare. Gli esempi forniti si concentrano sulle risposte al calcio nei neuroni primari del recettore gustativo di D. melanogaster. Tuttavia, questo approccio può essere adattato per registrare da altri neuroni di interesse all'interno del cervello di Drosofilidi o di altre specie di insetti. Questo metodo di imaging consente ai ricercatori di registrare simultaneamente le risposte collettive del calcio da gruppi di neuroni gustativi in tutto il labello, integrando le registrazioni elettrofisiologiche delle punte che quantificano i potenziali d'azione dei singoli neuroni. La tecnica di imaging del calcio in vivo qui descritta è stata determinante per scoprire i meccanismi molecolari e cellulari della chemiosensazione, identificare modelli di risposta temporale unici nei neuroni primari del gusto, studiare i meccanismi di modulazione gustativa ed esplorare l'elaborazione del gusto nei circuiti a valle.
Introduzione
Il moscerino della frutta, Drosophila melanogaster, è celebrato per i potenti strumenti di ricerca genetica disponibili in questo organismo modello. Questi strumenti forniscono la capacità di manipolare prontamente geni specifici in cellule bersaglio, rendendolo ideale per esplorare circuiti neurali fondamentali come la vista e la chemiosensazione 1,2,3. La gustazione, attraverso la chemiosensazione di contatto, è un percorso neurale chiave che regola i comportamenti coinvolti nell'alimentazione, nell'accoppiamento, nella riproduzione e, in ultima analisi, nella sopravvivenza e nell'idoneità degli animali 4,5,6,7,8,9. Comprendere come queste importanti informazioni chemiosensoriali vengono codificate e trasmesse richiede la descrizione dell'attività dei neuroni nei circuiti che vengono attivati dagli stimoli gustativi.
In D. melanogaster, i neuroni del recettore gustativo esterno (GRN) si trovano sulle zampe anteriori, sulla proboscide e sulle ali10,11. Il labello, alla fine della proboscide, contiene strutture simili a peli chiamate sensilla che possono essere mappate dalla loro morfologia in base alle dimensioni: lungo (tipo L), intermedio (tipo I) e corto (tipo S)10. La maggior parte dei GRN è concentrata su questo organo sensoriale, con ogni sensilla contenente 2-4 diversi tipi di GRN in modo che ogni modalità di gusto sia distribuita attraverso il labello 12,13,14,15. Mentre le registrazioni elettrofisiologiche delle punte possono essere utilizzate per quantificare i potenziali d'azione provenienti dai GRN in un singolo sensillo16, in vivo, l'imaging del calcio può essere utilizzato per isolare l'attività di un tipo specifico di GRN attraverso l'intero labello14,17. Questa stessa tecnica di imaging del calcio può essere utilizzata anche per studiare le risposte neurali nei circuiti gustativi a valle 18,19,20. L'imaging del calcio richiede sistemi di espressione binaria, come Gal4-UAS 21,22,23, e l'attraversamento di una linea driver contenente attivatori trascrizionali specifici della cellula con una linea effettrice per ottenere l'espressione di una GCaMP nei neuroni di interesse. Quando i livelli di calcio intracellulare aumentano, questi indicatori di calcio geneticamente codificati aumentano l'intensità della fluorescenza in modo che il livello di fluorescenza sia correlato con i cambiamenti nell'attività neuronale24,25.
Qui viene descritto un metodo per utilizzare l'imaging del calcio per osservare le risposte neurali agli stimoli gustativi in vivo. L'obiettivo generale di questo metodo è quello di stimolare solo i GRN labellari per quantificare le risposte neurali indotte dal gusto nel cervello dei moscerini svegli. Vengono forniti esempi per l'utilizzo di questo metodo per registrare le risposte nei GRN primari del labello in D. melanogaster e vengono discussi i vantaggi e le sfide dell'utilizzo di questo approccio. Questa preparazione è stata sviluppata per consentire agli sperimentatori la capacità di applicare una soluzione tastant a un labello di mosca immobilizzato mentre sono sotto un microscopio confocale per registrare le risposte neurali quando l'intero organo sensoriale è immerso in una soluzione, che si verifica in ambienti naturali. L'approccio di imaging del calcio in vivo qui descritto può essere utilizzato per scoprire nuove interazioni tastanto-recettore 8,14,26,27, dettagli temporali delle risposte GRN27,28, meccanismi molecolari della modulazione GRN29,30 e elaborazione del gusto nei circuiti a valle 8,18,19,20, 28,31.
Protocollo
I dettagli dei reagenti e delle attrezzature utilizzate in questo studio sono elencati nella tabella dei materiali.
1. Preparazione di una soluzione emolinfatica adulta (AHL)
- Preparare una soluzione madre contenente 108 mM di NaCl, 5 mM di KCl, 4 mM di NaHCO3, 1 mM di NaH2PO4, 5 mM di HEPES e 15 mM di ribosio.
NOTA: Il ribosio è usato come zucchero non energetico per mantenere l'osmolarità senza alterare i livelli di nutrienti nel cervello. - Regolare il pH di questa soluzione a 7,5 prima di filtrare e conservare a 4 °C. Controllare l'osmolarità dell'AHL dopo aver regolato il pH per garantire la coerenza tra le preparazioni.
- Preparare brodi separati di 1 M di CaCl2 e 1 M di MgCl2, filtrare e conservare a temperatura ambiente.
- Per preparare un'aliquota del brodo principale di AHL, aggiungere un piccolo volume di calcio e magnesio per ottenere concentrazioni finali di 2 mM di calcio e 8,2 mM di magnesio. Questo AHL può essere conservato a 4 °C e utilizzato per un massimo di un mese, utilizzando piccole aliquote portate a temperatura ambiente per gli esperimenti.
2. Montaggio delle mosche sulla camera di imaging
- Prima di montare le mosche, affilare la punta di una ceretta dentale in una piccola coppa appuntita utilizzando una pietra per affilare (Figura 1D). Attacca la punta affilata alla ceretta e accendila per preriscaldarla. Le impostazioni di calore dipenderanno dal tipo e dalla lunghezza della punta: è necessaria una temperatura minima che permetta alla cera di rimanere sciolta al contatto (50,5 °C funziona in questo esempio).
NOTA: In alternativa, è possibile avvolgere un filo attorno all'estremità della ceretta dentale per fissare una punta metallica affilata. - Anestetizzare delicatamente 1-5 mosche (seguendo i protocolli istituzionalmente approvati). Ridurre al minimo il tempo di esposizione all'anestesia, poiché periodi prolungati di esposizione alla CO2 o al freddo possono influire sul comportamento. Per la CO2, utilizzare un cuscinetto antimosche che fornisca un flusso continuo e uniforme del 99,9% di CO2 a una velocità di 5 L/min al microscopio da dissezione.
- Usa le forbici da dissezione per rimuovere parti delle zampe tagliando le zampe medie e posteriori all'articolazione femorale/tibiale e le zampe anteriori al trocantere. Usa una pinza smussata per aiutare a manipolare la mosca. Tagliare i tarsi eviterà la sensazione tarsale e il calcio del vetrino coprioggetti o dello stimolatore del gusto.
- Raccogli la mosca per le ali usando una pinza smussata per posizionare la mosca in modo che la testa sia sopra la fessura della cervice mirata della camera di imaging, ma il corpo sia sotto. È utile avviare la mosca completamente a destra o a sinistra. Usando il lato smussato delle forbici e la pinza smussata, spingi delicatamente la testa e il torace contemporaneamente nella fessura.
- Una volta saldamente all'interno della fessura, spingere la mosca verso la parte posteriore della fessura e riposizionarla delicatamente in modo che la mosca sia rivolta verso la parte anteriore della camera. Evitare di ruotare la testa troppo disallineata con il torace.
- Ripetere l'operazione per il numero di mosche necessario (questa camera di imaging può montare fino a 5 mosche).
- Raccogli una piccola goccia di smalto per unghie sull'estremità di uno stuzzicadenti e applica uno strato sottile per fissare la testa della mosca alla camera di imaging.
NOTA: l'area precisa in cui applicare lo smalto dipende da quale parte del cervello viene visualizzata. Se si esegue l'imaging della ZES (come mostrato qui) o di altre regioni mediali inferiori, lo smalto per unghie può essere applicato generosamente sulla parte superiore della testa della mosca, ma per visualizzare le regioni mediali superiori, lo smalto per unghie può essere applicato minimamente sulla parte superiore della testa e aggiunto lateralmente vicino agli occhi per lasciare quest'area libera per la dissezione. Questo protocollo è ottimizzato solo per la stimolazione del gusto senza olfatto, ma se i volatili dello smalto per unghie sono un problema, usa la cera o la colla UV come metodi alternativi per fissare la testa della mosca.
3. Ceratura della proboscide in posizione estesa
- Prendi la ceretta con una mano e raccogli una piccola goccia di cera sulla punta.
- D'altra parte, usa una pinza semi-affilata per afferrare un palpo mascellare ed estrarre delicatamente e tenere la proboscide in piena estensione.
NOTA: Fare attenzione ad afferrare solo la palpo mascellare poiché pizzicare la cuticola sulla proboscide aumenta il potenziale di danno. Non procedere se la proboscide è pizzicata o la cuticola della proboscide è perforata. Un piccolo pooter per mosche può essere utilizzato in alternativa alla pinza per estrarre la proboscide utilizzando l'aspirazione durante l'applicazione della cera. - Toccare la punta della ceretta con la camera vicino alla base della proboscide fino a quando la cera inizia a scorrere, quindi spostarsi per entrare in contatto con la base della proboscide. Cerare a metà dello stelo, ma evitare di toccare i sensilli labellari con la cera o la ceretta. La cera su questo lato manterrà la proboscide in posizione. Non procedere mai se i sensilli vengono toccati dalla cera o dalla ceretta.
- Applicare la cera con il metodo sopra descritto per l'altro lato, creando un ponte continuo di cera sulla proboscide.
- Estendere completamente la proboscide il più dritta possibile. Se necessario, lo spostamento della proboscide può essere effettuato riscaldando la cera e spingendo delicatamente la proboscide nella posizione desiderata.
- Ripetere per altre mosche da montare nella stessa camera.
- Spegnere la CO2 o rimuovere le mosche dall'anestesia del ghiaccio. Posizionare le mosche montate in una camera di umidità per 60 minuti per il recupero (pulire e svuotare la scatola dei puntali della pipetta con salviette bagnate e prive di lanugine).
4. Dissezione per rivelare la regione cerebrale di interesse
- Rimuovi le mosche dalla camera di umidità. Le mosche devono essere chiaramente vive, muovendo attivamente l'addome, le zampe e le antenne. Impostare il microscopio confocale o a due fotoni prima della dissezione.
- Accendere la ceretta per riparare eventuali rotture della cera durante la dissezione e preparare l'AHL a temperatura ambiente.
- Usando una pinza molto affilata, pizzica entrambe le antenne, quindi pizzica la cuticola per fornire un foro per l'inserimento di un lato della pinza affilata. Fai scorrere la pinza sotto la cuticola per rimuoverla dalla regione che copre l'area cerebrale di interesse. La Figura 1F indica una X sulle aree della cuticola da colpire con la pinza per la rimozione.
- Lavare il cervello esposto in AHL applicando generosamente AHL (~100 μL) sulla testa e poi rimuovendo tutto lo strato di AHL tranne un sottile per evitare che il cervello si secchi.
NOTA: Se la cera si rompe in qualsiasi momento e deve essere riparata, rimuovere brevemente tutto l'AHL intorno alla testa prima di riscaldare nuovamente la cera per fissare nuovamente la proboscide in posizione estesa. - Usando una pinza affilata, rimuovi le sacche d'aria e tutti i detriti di grandi dimensioni che coprono il cervello. Evita di penetrare nel cervello mantenendo visibili le punte del forcipe.
- Lavare con AHL ~3 volte per rimuovere tutti i piccoli detriti.
- Assicurati che la regione del cervello di interesse sia chiaramente visibile. Per visualizzare in modo specifico la zona subesofagea (SEZ) come in questo esempio, tagliare l'esofago alla base vicino alla proboscide e vicino al punto in cui passa attraverso il cervello pizzicando con una pinza molto affilata e rimuovendo questo pezzo per esporre la SEZ.
NOTA: I moscerini non possono ingerire soluzioni dopo che l'esofago è stato rimosso e non può verificarsi alcuna attivazione GRN faringea. - Sotto il microscopio di dissezione, posizionare il vetrino coprioggetti da 10 mm x 20 mm nella fessura angolata della camera di imaging. Assicurati che poggi alla base della proboscide senza rompere la cera. La punta del labello non deve toccare il vetrino coprioggetti.
5. Imaging e stimolazione del gusto
- Accendi il microscopio confocale o a due fotoni e preparati per l'acquisizione delle immagini. Impostare un micromanipolatore con un tubo capillare posizionato per erogare i sapori al volo mentre si trova sul tavolino del microscopio.
NOTA: L'imaging a due fotoni può catturare la fluorescenza dai neuroni che si trovano più in profondità nel tessuto cerebrale. - Caricare ~2 μL di acqua (o un altro controllo negativo) nel tubo capillare del
stimolatore sul tavolino del microscopio. - Trova la mosca sezionata e concentrati sul labello utilizzando un campo chiaro a immersione in aria 10x. Allineare il capillare con il labello sotto questa vista. È possibile includere telecamere aggiuntive puntate sul labello della mosca per visualizzare l'allineamento del capillare con la mosca da più angolazioni.
NOTA: Assicurarsi che tutti i sensilli labellari vengano stimolati con la soluzione durante l'allineamento; Se la posizione dello stimolatore o del labello non è sufficientemente perpendicolare a tale scopo, regolare di conseguenza. I capillari possono essere tirati e limati verso il basso con una pietra per affilare per fornire una vestibilità più aderente attorno al labello. - Lasciare il capillare posizionato direttamente davanti al labello, vicino ma senza toccarlo.
- Sposta il tavolino in modo che la regione del cervello di interesse sia centrata e passa a un obiettivo a immersione in acqua con ingrandimento più elevato (40x utilizzato in questo esempio).
- Aggiungere circa 200 μl di AHL sulla parte superiore del cervello per entrare in contatto con l'obiettivo per l'immersione. Rimuovi eventuali bolle.
- Orientare la messa a fuoco utilizzando il campo chiaro per spostarsi con attenzione nel piano z per trovare il bordo della cuticola che è stato rimosso e centrare la regione cerebrale di interesse.
- Passa alla potenza del laser a 488 nm per trovare l'espressione di GCaMP nell'area di interesse.
NOTA: A seconda della linea di driver e della versione di GCaMP utilizzata, potrebbe essere necessaria un'ottimizzazione iniziale per amplificare il rapporto segnale/rumore per le singole preparazioni. La co-espressione di RFP può essere utile per i neuroni con bassa fluorescenza GCaMP al basale. - Prepara una raccolta di immagini timelapse. La velocità dipenderà dal microscopio specifico e dal segnale GCaMP, ma catturare almeno un'immagine ogni ~100 ms è ottimale.
NOTA: La cattura di un singolo piano Z di fluorescenza nel tempo ottimizzerà la velocità di cattura per fornire una cinetica dettagliata del calcio. Le pile di immagini scattate su più piani Z in ogni punto temporale possono rallentare i tassi di acquisizione, ma registreranno le risposte tra neuriti che si trovano a diverse profondità nel tessuto. - Dopo aver raccolto almeno 5 s di fluorescenza basale, spostare manualmente lo stimolatore in modo che il capillare copra il labello per un determinato periodo di tempo (5 s in questo esempio), quindi rimuovere lo stimolo e catturare per tutto il tempo desiderato.
- Rimuovere l'AHL e tornare al campo chiaro 10x per assicurarsi che il vetrino coprioggetti, lo stimolatore e il labello siano ancora nella stessa posizione.
NOTA: Se lo stimolatore non è allineato bene con il labello o viene ruotato troppo, il labello può essere spostato o il capillare può colpire la camera di imaging, rompendo potenzialmente il cerume e creando una perdita dall'AHL. - Rimuovere la camera di imaging. Utilizzare un panno privo di lanugine per rimuovere la prima soluzione e sciacquare la pipetta con acqua. Quindi, pipettare ~2 μl del tastant successivo nel tubo capillare.
- Riportare la camera di imaging sul tavolino e ripetere i passaggi 5.4-5.12 per questa soluzione.
NOTA: L'elevata tensione superficiale della maggior parte dei degustanti presenta sostanze chimiche residue dovute alla permanenza sul labello della mosca. Tuttavia, se i sapori sono altamente saturi o viscosi, l'acqua può essere spostata più volte sul labello per lavare l'organo sensoriale prima dello stimolo successivo. - Ripeti per tutte le soluzioni che desideri per questa mosca.
- Tornare al passaggio 3 per preparare la mosca successiva per l'imaging.
6. Analisi delle immagini
- Aprire la pila di immagini da analizzare nel software di elaborazione delle immagini. Se necessario, eseguire una sottrazione di fondo utilizzando una regione esterna al segnale GCaMP.
- Seleziona una regione di interesse (ROI) stretta attorno alle proiezioni da quantificare utilizzando lo strumento a mano libera o forma e assicurati che la selezione venga applicata a tutte le immagini nella pila.
- Genera un elenco delle letture della fluorescenza nel tempo per questo ROI ed esportalo in un foglio di calcolo per un'ulteriore elaborazione. Utilizzare il profilo dell'asse Z di stampa in ImageJ (FIJI) o una funzione simile nel software di elaborazione delle immagini preferito.
- Nel foglio di calcolo, selezionare 10 punti temporali consecutivi durante la registrazione della linea di base nel passaggio 5.10 come linea di base rappresentativa. Calcola la media e la deviazione standard.
- Per ottenere ΔF/F in percentuale, calcolare ((F - media F di base)/media di base F)*100) per ogni punto temporale. Per ottenere ΔF/F come z-score, calcolare ((F - media del basale F)/deviazione standard del basale F) per ogni punto temporale.
- Per calcolare la variazione di picco della fluorescenza durante la stimolazione, selezionare 3 punti consecutivi con la fluorescenza più alta e calcolare la media.
- Ripeti per ogni pila di immagini attraverso stimoli e mosche.
NOTA: Adattare questi passaggi in base alle esigenze del microscopio specifico, alla qualità del segnale e al software di analisi delle immagini preferito.
Risultati
La Figura 1 fornisce i dettagli della camera di imaging (Figura 1A, B) e della punta della cera (Figura 1D) utilizzati in questa preparazione. La Figura 1 illustra anche le fasi principali della procedura per il montaggio delle mosche (Figura 1C), la ceratura della proboscide in posizione (Figura 1E), la sezionazione sulla regione cerebrale di interesse (Figura 1F) e la stimolazione del labello con un tastant durante la registrazione della fluorescenza nel cervello (Figura 1G). Per quantificare le risposte indotte dal gusto nei neuroni primari del recettore gustativo (GRN) delle mosche Drosophila melanogaster con Gr64f-Gal4 che guidano l'espressione di UAS-GCaMP6f sono stati prodotti per ottenere l'indicatore del calcio geneticamente espresso in tutti i GRN "dolci" sensibili allo zucchero del labello 14,27,30,32,33,34,35. Per questi esperimenti, è stato utilizzato un microscopio confocale con i seguenti componenti: un microscopio fluorescente verticale con fotocamera sCMOS da 40 fps, obiettivi 10x e 40x, confocale a disco rotante, emettitori dicroici 488 e laser a stato solido da 488 nm. L'obiettivo 40x è stato immerso in AHL e centrato sulla regione cerebrale della SEZ per localizzare il segnale GCaMP basale nei terminali assonici di questi GRN labellari (Figura 2A). Un'immagine a fluorescenza è stata catturata ogni 100 ms durante il basale (nessuna stimolazione), durante 5 secondi di stimolazione del gusto (lo stimolatore si è spostato sul labello) e dopo la stimolazione fino a quando la fluorescenza non è tornata al basale (Figura 2A, B). L'acqua è stata utilizzata come controllo negativo e il saccarosio 1 M è stato utilizzato come controllo positivo. La variazione relativa della fluorescenza è stata calcolata come ΔF/F (z-score) per 13 mosche e tracciata nel tempo per mostrare la cinetica delle risposte del calcio durante la stimolazione del gusto (Figura 2B). Il picco ΔF/F (z-score) è stato tracciato e utilizzato per confronti statistici per indicare che la risposta al saccarosio in queste cellule è significativamente più alta che nell'acqua (Figura 2C). Questa tecnica cattura il fatto che i GRN "dolci" hanno un forte picco all'insorgenza del saccarosio che rimane alto con un certo decadimento durante il periodo di stimolazione.
Per confronto, questo protocollo è stato ripetuto in mosche con un driver diverso, Gr66a-Gal4, che esprime UAS-GCaMP6f specificamente in tutti i GRN "amari" sul labello 14,17,28,34,36. Allo stesso modo, i terminali assonali di questi GRN si trovavano nella ZES: si noti che il modello di proiezione è distinto dai GRN sensibili allo zucchero (Figura 2D). La fluorescenza è stata catturata e analizzata come in precedenza, ad eccezione di 100 mM di caffeina, che è stata utilizzata come controllo positivo. La curva media di 11 mosche mostra un forte picco con l'inizio della stimolazione della caffeina, ma c'è anche una piccola risposta "off" con la rimozione dello stimolo che è nota per verificarsi con alcuni stimoli amari28 (Figura 2E). Questo metodo consente di quantificare sia le risposte "on" che "off" per caratterizzare i modelli temporali delle risposte indotte dal gusto27,28. Qui, sono stati quantificati solo i picchi "on" per indicare che la risposta alla caffeina è significativamente più forte di quella dell'acqua (Figura 2F). Gli esperimenti nella Figura 2 sono altamente riproducibili e possono essere utilizzati per garantire che il protocollo funzioni correttamente.
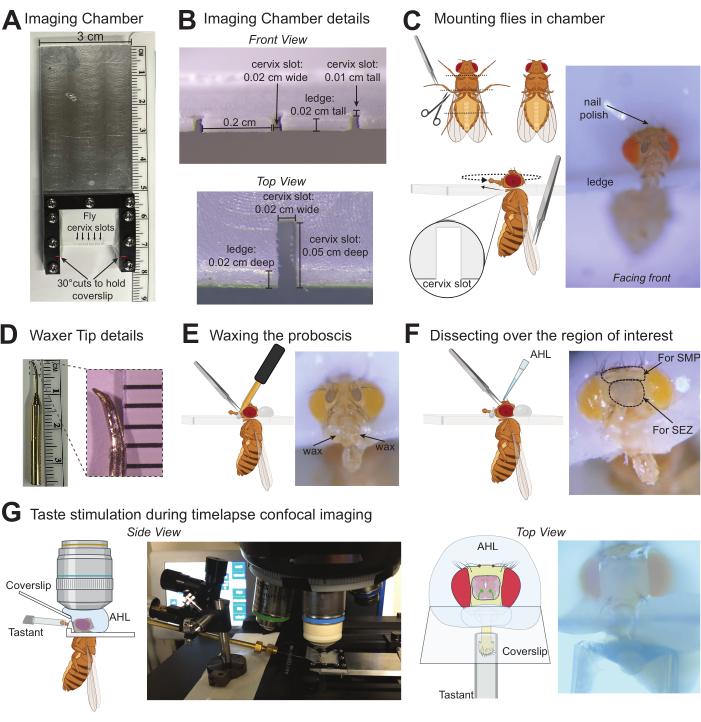
Figura 1: Illustrazioni del protocollo per l'imaging delle risposte indotte dal gusto nel cervello di Drosophila . (A) Vista dall'alto della camera di imaging personalizzata utilizzata per montare fino a cinque mosche alla volta. (B) Dettagli della camera di imaging in cui sono montate le mosche con misurazioni che si adattano comodamente alla cervice di D. melanogaster. (C) Grafici che indicano dove tagliare i tarsi (in alto a sinistra) e come montare la mosca nella fessura della cervice della camera di imaging usando una pinza (in basso a sinistra). Foto di una mosca montata nella posizione corretta nella camera di imaging (a destra). (D) Foto della punta della ceretta (a sinistra), foto ingrandita della punta per indicare la forma e le dimensioni approssimative del bersaglio quando si utilizza una pietra per affilare per modificare la punta standard (a destra). (E) Illustrazione grafica della ceratura della proboscide in posizione con una pinza (a sinistra), foto di una mosca montata con un labello adeguatamente cerato (a destra). (F) Illustrazione grafica che rappresenta la dissezione sulla regione cerebrale di interesse e l'applicazione di AHL (a sinistra), foto di una mosca con cerchi punteggiati attorno all'area della cuticola da rimuovere quando si prendono di mira le regioni cerebrali SEZ o SMP. X indica le regioni della cuticola da pizzicare per la dissezione (a destra). (G) Grafici e foto indicano la posizione della mosca montata/sezionata, l'obiettivo di immersione in acqua in AHL, lo stimolatore con un tastant sopra la proboscide e il vetrino coprioggetti che forma una barriera tra queste soluzioni. La vista laterale è stata rimpicciolita (a sinistra) e la vista dall'alto era sotto l'obiettivo 10x (a destra). Clicca qui per visualizzare una versione più grande di questa figura.
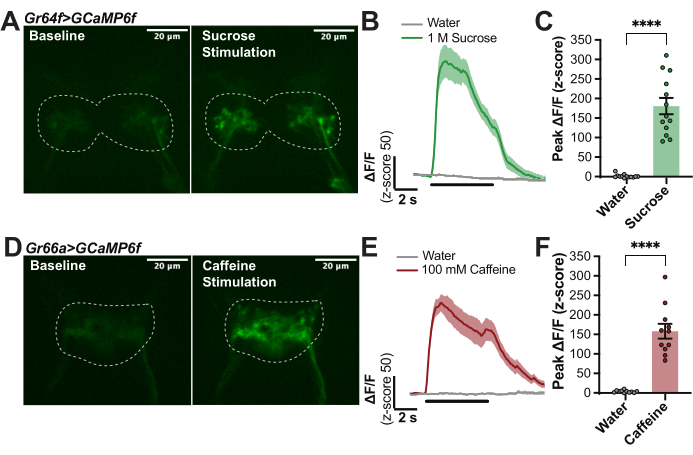
Figura 2: Esempio di risposte del calcio dei GRN labellari agli stimoli gustativi. (A) Cattura da una pila di immagini che indica il livello di fluorescenza GCaMP in un moscerino con Gr64f>GCaMP6f al basale e durante la risposta di picco a 1 M di saccarosio, barra della scala = 20 μm. Le linee tratteggiate indicano il ROI per l'analisi. (B) curve di risposta del calcio per n = 14 mosche calcolate come ΔF/F (z-score) e combinate per acqua (controllo negativo) e 1 M di saccarosio (controllo positivo) per mostrare la cinetica; La linea nera sotto le curve indica quando lo stimolo è sopra il labello. (C) Picco ΔF/F (z-score) per ogni mosca tracciata per confronti statistici. Test t accoppiato, ****p < 0,0001. (D) Immagini fisse da un video che indica il livello di fluorescenza GCaMP in un moscerino con Gr66a>GCaMP6f al basale e durante la risposta di picco a 100 mM di caffeina, barra della scala = 20 μm. Le linee tratteggiate indicano il ROI per l'analisi. (E) Curve di risposta del calcio per n = 11 mosche calcolate come ΔF/F (z-score) e combinate per acqua (controllo negativo) e 100 mM di caffeina (controllo positivo) per mostrare la cinetica: notare la piccola risposta "off", la linea nera sotto le curve indica quando lo stimolo è sopra il labello. (F) Picco ΔF/F (z-score) per ogni mosca tracciata per confronti statistici. Test t accoppiato, ****p < 0,0001. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Uno degli aspetti più impegnativi di questo protocollo è la destrezza di micromanipolazione necessaria per cerare il labello ed eseguire le dissezioni mirate. Un ulteriore passaggio per fissare il labello è necessario per stimolare ogni sensillum in modo uniforme in questo organo sensoriale e visualizzare le regioni cerebrali di interesse. La camera di imaging personalizzata utilizzata qui è ottimizzata per D. melanogaster, ma potrebbe essere necessario modificare le specifiche della camera e l'approccio alla cera per altri insetti. Questo protocollo può essere applicato ad altri Drosofilidi con poche modifiche, ma altri membri del sottordine Brachycera, come api e zanzare, possono richiedere modifiche alle fasi di montaggio e dissezione per tenere conto delle differenze nella morfologia del palpo labiale e della testa. Anche l'allineamento del micromanipolatore per l'erogazione di tastant può essere impegnativo e richiede un test iniziale con lo stadio specifico del microscopio per l'ottimizzazione. Se il cerume si rompe durante la stimolazione, possono verificarsi perdite per cui l'AHL e il tastant nel capillare entrano in contatto. Tirare i capillari e limarli con una pietra per affilare per adattarli più strettamente al labello può aiutare a prevenire il contatto tra tastant e AHL. Devono essere escluse mosche con perdite o movimenti cerebrali eccessivi. Quando possibile, includere sempre un controllo positivo per ogni animale per garantire che il labello e i nervi labellari non vengano danneggiati dalla ceretta o dalla dissezione. Gli esempi "dolce" e "amaro" mostrati qui sono raccomandati come robusti esperimenti di controllo.
L'approccio di imaging del calcio in vivo qui descritto è stato utilizzato per quantificare le risposte indotte dal gusto nei neuroni primari del gusto, nei neuroni di ordine superiore e nell'intera SEZ in D. melanogaster per identificare i recettori gustativi e i circuiti 8,14,17,18,19,20,27,28,30,31, 34,35,36,37,38,39,40,41,
42,43,44,45,46,47,48. Le applicazioni diffuse in questo organismo modello sono dovute ai driver Gal4 e split-Gal4 prontamente disponibili; quindi, la necessità per gli insetti geneticamente modificati di ottenere GCaMP espressa in specifici neuroni di interesse è un fattore limitante per questo approccio. Fortunatamente, con i progressi nella tecnologia di editing genetico, questo sta diventando più accessibile per gli insetti al di là degli organismi modello, e le risposte indotte dal gusto utilizzando l'imaging del calcio sono state recentemente riportate per il parassita Drosophila suzukii49 e per le zanzare portatrici di vettori50. Come per tutte le immagini del calcio, può essere necessaria un'ottimizzazione iniziale del rapporto segnale-rumore per i neuroni bersaglio di interesse. I segnali possono essere migliorati utilizzando versioni più luminose di GCaMP ed esprimendo due copie di GCaMP. La co-espressione di RFP nei neuroni bersaglio può aiutare a visualizzare i neuroni bersaglio al basale e può fungere da controllo per il movimento del cervello nelle regioni che hanno una propensione a pulsare.
Questo protocollo è specificamente progettato per isolare la chemiosensazione dal labello rimuovendo i tarsi e le antenne, depilando i palpi mascellari e limitando l'ingestione in modo che non vengano stimolati i GRN faringei. Tuttavia, è possibile apportare modifiche a questo protocollo per includere la chemiosensazione da GRN tarsale o faringea. Se i tarsi vengono lasciati intatti, le zampe possono essere stimolate da sole o in aggiunta al labello creando una grande bolla di soluzione tastant all'estremità del capillare. C'è la possibilità che una mosca scalci e sposti il vetrino coprioggetti se i tarsi vengono lasciati intatti; Pertanto, si può prendere in considerazione la ceratura dei tarsi vicino alla base per aiutare a prevenire movimenti indesiderati. L'esempio attuale include la fase di taglio dell'esofago per evitare la stimolazione GRN faringea e per visualizzare meglio le proiezioni labellari nella ZES, ma questa stessa preparazione è stata precedentemente adattata per quantificare le risposte GRN faringee lasciando intatto l'esofago e l'imaging delle proiezioni faringee laterali36. Questa applicazione precedente utilizzava uno stimolo zuccherino appetitivo, che le mosche consumano liberamente per stimolare le GRN faringee, ma le mosche non consumano prontamente uno stimolo avversivo per attivare le GRN faringee amare, che è una limitazione di questo approccio. Un'ulteriore limitazione è che le risposte dei GRN localizzati nelle ali di Drosophila11 non possono essere facilmente studiate con questo approccio.
Mentre l'imaging in vivo del calcio qui descritto è diventato il metodo standard per studiare le risposte indotte dal gusto di ordine superiore 8,18,19,20,28, attualmente esistono diversi altri approcci per quantificare le risposte GRN primarie labellari ai sapori nei moscerini. L'approccio di imaging del calcio in vivo qui descritto registra le variazioni di GCaMP nei terminali assonici nel cervello, ma è stato utilizzato anche un approccio ex vivo per quantificare la GCaMP del corpo cellulare nei GRN labellari33. Allo stesso modo, è stato descritto un altro approccio di montaggio per l'imaging dei corpi cellulari di GRN labellari o tarsali in mosche intatte51. L'elettrofisiologia continua ad essere una tecnica popolare ed efficace per studiare le risposte dei neuroni primari del gusto negli insetti 13,16,32,52,53,54,55,56,57,58,59,60,64,62,63,64,65. Ciò non richiede la necessità di sensori di calcio geneticamente codificati ed è una quantificazione più diretta dell'attività neuronale. Tuttavia, le risposte da un solo sensilla alla volta possono essere registrate, mentre l'imaging del calcio può essere registrato da un'intera popolazione di GRN contemporaneamente. L'approccio dell'imaging del calcio è stato utilizzato per scoprire le dinamiche temporali uniche delle risposte "on" e "off" nei GRN con determinati stimoli27,28, ma un recente progresso nelle registrazioni elettrofisiologiche dalla base dei sensilli del gusto in D. melanogaster consente ora di quantificare le risposte "off" a livello dei potenziali d'azione53. È interessante notare che la modulazione della sensibilità primaria al GRN da parte della fame è stata rilevata tramite imaging del calcio, ma non a livello di potenziali d'azione con l'elettrofisiologia29, ma sia le registrazioni elettrofisiologiche della punta che l'imaging del calcio possono catturare un cambiamento nella sensibilità al GRN con la dieta30,66. Pertanto, l'elettrofisiologia rimane un approccio importante e complementare all'imaging del calcio per identificare ligandi e recettori del gusto e per comprendere come vari fattori modulano la sensibilità dei neuroni primari dei recettori gustativi.
Divulgazioni
Gli autori non hanno conflitti di interesse e nulla da rivelare.
Riconoscimenti
Vorremmo ringraziare il Bloomington Drosophila Stock Center per gli stock di mosche e l'Università del Vermont IMF Labs per il loro aiuto nella fabbricazione delle camere di imaging personalizzate. Ringraziamo anche BioRender per la creazione delle illustrazioni grafiche e Kayla Audette per aver contribuito alla progettazione di queste grafiche. Questo lavoro è stato supportato da nuovi fondi per l'avvio di laboratori dall'Università del Vermont e dal premio numero 2332375 della National Science Foundation. I grafici nella Figura 1 sono stati generati con www.BioRender.com.
Materiali
| Name | Company | Catalog Number | Comments |
| CaCl2 | Sigma-Aldrich | C7902 | For AHL |
| Caffeine | Sigma-Aldrich | C0750 | For a "bitter" taste stimulus |
| Clear nail polish- quick dry | Many vendors | Example: Sally Hansen Xtreme wear (clear) | |
| CO2 fly pad station | Genesee Scientific | 59-122BC | Includes tubing, a gun to initially anesthetize flies, and a pad to deliver continuous anesthesia |
| CO2 supply (cylinders) | Airgas | USP50 | For anesthesia |
| Confocal or two-photon microscope | Many vendors | Upright microscope, high signal to noise and rapid capture capabilities, 10X air immersion objective, 25-40X water immersion objective, accompanying hardware and software | |
| Coverslips | Globe Scientific | 1404-15 | 22 x 22 mm, No 1.5: for this specific imaging chamber, score and cut in half to get 11 x 22 mm coverslips |
| D. melanogaster: Gr64f-Gal4 | Bloomington Drosophila Stock Center | 57669 | For driving GCaMP expression in 'sweet' gustatory receptor neurons of the labellum |
| D. melanogaster: Gr66a-Gal4 | Bloomington Drosophila Stock Center | 57670 | For driving GCaMP expression in 'bitter' gustatory receptor neurons of the labellum |
| D. melanogaster: UAS-GCaMP6f | Bloomington Drosophila Stock Center | 42747 | For getting GCaMP expression when crossed to a Gal4 driver line |
| Dental Waxer | Pearson Dental | 49-00-54 | Digital wax carver, comes with tips that can be modified and sharpened small enough to deliver wax along the fly proboscis |
| Dissection microscope | Many vendors | .63 - 6.3X for optimal viewing but with sufficient working distance to perform dissections under the microscope | |
| Dissection scissors | Fine Science Tools | 15000-08 | This pair or any similar dissection scissors are appropriate |
| Empty pipette tip box | Free- many vendors | For humidity chamber: needs enough space so that the imaging chamber can sit and the lid can close without bumping the chamber | |
| Filter flask | Millipore-Sigma | CLS431097 | For filtering AHL stocks |
| Glass capillary | World Precision Instruments | TW100-4 | This size fits well over the D. melanogaster labellum without needing modification, but other capillaries can be pulled and filed down to an appropriate size |
| HEPES | Sigma-Aldrich | BP310 | For AHL |
| ImageJ (FIJI) | NIH | https://imagej.nih.gov/ij | Image analysis software |
| Imaging Chamber | IMF Labs | Custom item | The custom-made chamber in this example can be ordered at https://www.uvm.edu/research/imf/forms/contact-us. Base: 6061 aluminum, Holding Clamps: Black Delrin (Acetal), Insert: Moisture Resistant polyester (PET). Manual and CNC milling machines for fabrication. |
| KCl | Sigma-Aldrich | P9541 | For AHL |
| Kim wipes | Millipore-Sigma | Z188956 | For humidity chamber, wiping off forceps, removing solutions from capillaries, etc. |
| MgCl2 | Sigma-Aldrich | M9272 | For AHL |
| Micromanipulator | Tritech Research | U-31CF, USM-6, MINJ-4 | This example uses a magnet to attach the micromanipulator to the stage, other configurations are possible |
| NaCl | Sigma-Aldrich | S7653 | For AHL |
| NaH2PO4 | Sigma-Aldrich | 567545 | For AHL |
| NaHCO3 | Sigma-Aldrich | S6014 | For AHL |
| p10 pipette and tips | Many vendors | For filling the capillaries with tastants | |
| p200 pipette and tips | Many vendors | For AHL | |
| Parafin wax | Many vendors | White/clear block of wax often found in craft stores | |
| Ribose | Sigma-Aldrich | W379301 | For AHL |
| Semi-sharp forceps | Fine Science Tools | 11252-20 | Blunted to approximately tip size C |
| Sharp forceps | Fine Science Tools | 11252-20 | Sharpened to tip size A |
| Sharpening stone | Fine Science Tools | 29000-00 | For modifying dental waxer tips and forceps |
| Sucrose | Sigma-Aldrich | S0389 | For a "sweet'"taste stimulus |
| Toothpick | Many vendors | Small tip for nail polish application |
Riferimenti
- Wangler, M. F., Yamamoto, S., Bellen, H. J. Fruit flies in biomedical research. Genetics. 199 (3), 639-653 (2015).
- Ryu, L., Kim, S. Y., Kim, A. J. From photons to behaviors: Neural implementations of visual behaviors in Drosophila. Front Neurosci. 16, 883640 (2022).
- Joseph, R. M., Carlson, J. R. Drosophila chemoreceptors: A molecular interface between the chemical world and the brain. Trends Genet. 31 (12), 683-695 (2015).
- Montell, C. Drosophila sensory receptors-a set of molecular Swiss Army knives. Genetics. 217 (1), 1-34 (2021).
- Scott, K. Gustatory processing in Drosophila melanogaster. Annu Rev Entomol. 63, 15-30 (2018).
- Starostina, E., et al. A Drosophila DEG/ENaC subunit functions specifically in gustatory neurons required for male courtship behavior. J Neurosci. 32 (13), 4665-4674 (2012).
- Chen, Y., Amrein, H. Ionotropic receptors mediate Drosophila oviposition preference through sour gustatory receptor neurons. Curr Biol. 27 (18), 2741-2750.e4 (2017).
- Guillemin, J., et al. Taste cells expressing ionotropic receptor 94e reciprocally impact feeding and egg laying in Drosophila. Cell Rep. 43, 114625 (2024).
- Ostojic, I., et al. Positive and negative gustatory inputs affect Drosophila lifespan partly in parallel to dFOXO signaling. Proc Natl Acad Sci U S A. 111 (22), 8143-8148 (2014).
- Stocker, R. F. The organization of the chemosensory system in Drosophila melanogaster: A review. Cell Tissue Res. 275 (1), 3-26 (1994).
- Raad, H., Ferveur, J. -. F., Ledger, N., Capovilla, M., Robichon, A. Functional gustatory role of chemoreceptors in Drosophila wings. Cell Rep. 15 (7), 1442-1454 (2016).
- Montell, C. A taste of the Drosophila gustatory receptors. Curr Opin Neurobiol. 19 (4), 345-353 (2009).
- Weiss, L. A., Dahanukar, A., Kwon, J. Y., Banerjee, D., Carlson, J. R. The molecular and cellular basis of bitter taste in Drosophila. Neuron. 69 (2), 258-272 (2011).
- Jaeger, A. H., et al. A complex peripheral code for salt taste in Drosophila. Elife. 7, 37167 (2018).
- Freeman, E. G., Dahanukar, A. Molecular neurobiology of Drosophila taste. Curr Opin Neurobiol. 34, 140-148 (2015).
- Delventhal, R., Kiely, A., Carlson, J. R. Electrophysiological recording from Drosophila labellar taste sensilla. J Vis Exp. 84, e51355 (2014).
- Marella, S., et al. Imaging taste responses in the fly brain reveals a functional map of taste category and behavior. Neuron. 49 (2), 285-295 (2006).
- Shiu, P. K., Sterne, G. R., Engert, S., Dickson, B. J., Scott, K. Taste quality and hunger interactions in a feeding sensorimotor circuit. Elife. 11, e79887 (2022).
- Li, J., Dhaliwal, R., Stanley, M., Junca, P., Gordon, M. D. Functional imaging and connectome analyses reveal organizing principles of taste circuits in Drosophila. bioRxiv. , (2024).
- Junca, P., Stanley, M., Musso, P. -. Y., Gordon, M. D. Modulation of taste sensitivity by the olfactory system in Drosophila. bioRxiv. , (2021).
- Elliott, D. A., Brand, A. H. The GAL4 system: A versatile system for the expression of genes. Drosophila Methods Protoc. , 79-95 (2008).
- Riabinina, O., Potter, C. J., Dahmann, C. . Drosophila: Methods and Protocols. , 53-78 (2016).
- Diegelmann, S., Bate, M., Landgraf, M. Gateway cloning vectors for the LexA-based binary expression system in Drosophila. Fly. 2 (4), 236-239 (2008).
- Zhang, Y., et al. Fast and sensitive GCaMP calcium indicators for imaging neural populations. Nature. 615 (7954), 884-891 (2023).
- Ohkura, M., et al. Genetically encoded green fluorescent Ca2+ indicators with improved detectability for neuronal Ca2+ signals. PLoS One. 7 (12), e51286 (2012).
- Arntsen, C., Guillemin, J., Audette, K., Stanley, M. Tastant-receptor interactions: Insights from the fruit fly. Front Nutr. 11, 1394697 (2024).
- Stanley, M., Ghosh, B., Weiss, Z. F., Christiaanse, J., Gordon, M. D. Mechanisms of lactic acid gustatory attraction in Drosophila. Curr Biol. 31 (16), 3525-3537.e6 (2021).
- Devineni, A. V., Deere, J. U., Sun, B., Axel, R. Individual bitter-sensing neurons in drosophila exhibit both on and off responses that influence synaptic plasticity. Curr Biol. 31 (24), 5533-5546.e7 (2021).
- Inagaki, H. K., et al. Visualizing neuromodulation in vivo: Tango-mapping of dopamine signaling reveals appetite control of sugar sensing. Cell. 148 (3), 583-595 (2012).
- May, C. E., et al. High dietary sugar reshapes sweet taste to promote feeding behavior in drosophila melanogaster. Cell Rep. 27 (6), 1675-1685.e7 (2019).
- May, C. E., Rosander, J., Gottfried, J., Dennis, E., Dus, M. Dietary sugar inhibits satiation by decreasing the central processing of sweet taste. Elife. 9, e54530 (2020).
- Jiao, Y., Moon, S. J., Wang, X., Ren, Q., Montell, C. Gr64f is required in combination with other gustatory receptors for sugar detection in Drosophila. Curr Biol. 18 (22), 1797-1801 (2008).
- Chen, H. -. L., Stern, U., Yang, C. -. H. Molecular control limiting sensitivity of sweet taste neurons in Drosophila. Proc Natl Acad Sci USA. 116 (40), 20158-20168 (2019).
- Devineni, A. V., Sun, B., Zhukovskaya, A., Axel, R. Acetic acid activates distinct taste pathways in Drosophila to elicit opposing, state-dependent feeding responses. Elife. 8, e47677 (2019).
- Engert, S., Sterne, G. R., Bock, D. D., Scott, K. Drosophila gustatory projections are segregated by taste modality and connectivity. Elife. 11, e78110 (2022).
- Ledue, E. E., et al. Starvation-induced depotentiation of bitter taste in Drosophila. Curr Biol. 26 (21), 2854-2861 (2016).
- Mcdowell, S. A. T., Stanley, M., Gordon, M. D. A molecular mechanism for high salt taste in Drosophila. Curr Biol. 32 (14), 3070-3081.e7 (2022).
- Deere, J. U., Devineni, A. V. Taste cues elicit prolonged modulation of feeding behavior in Drosophila. iScience. 25 (10), 105159 (2022).
- Deere, J. U., et al. Selective integration of diverse taste inputs within a single taste modality. Elife. 12, (2023).
- Chu, B., Chui, V., Mann, K., Gordon, M. D. Presynaptic gain control drives sweet and bitter taste integration in Drosophila. Curr Biol. 24 (17), 1978-1984 (2014).
- Yao, Z., Scott, K. Serotonergic neurons translate taste detection into internal nutrient regulation. Neuron. 110 (6), 1036-1050.e7 (2022).
- Cameron, P., Hiroi, M., Ngai, J., Scott, K. The molecular basis for water taste in Drosophila. Nature. 465 (7294), 91-95 (2010).
- Jourjine, N., Mullaney, B. C., Mann, K., Scott, K. Coupled sensing of hunger and thirst signals balances sugar and water consumption. Cell. 166 (4), 855-866 (2016).
- Kim, H., Kirkhart, C., Scott, K. Long-range projection neurons in the taste circuit of Drosophila. Elife. 6, e23386 (2017).
- Kirkhart, C., Scott, K. Gustatory learning and processing in the Drosophila mushroom bodies. J Neurosci. 35 (15), 5950-5958 (2015).
- Steck, K., et al. Internal amino acid state modulates yeast taste neurons to support protein homeostasis in Drosophila. Elife. 7, e31625 (2018).
- Münch, D., Goldschmidt, D., Ribeiro, C. The neuronal logic of how internal states control food choice. Nature. 607 (7920), 747-755 (2022).
- Taisz, I., et al. Generating parallel representations of position and identity in the olfactory system. Cell. 186 (12), 2556-2573.e2 (2023).
- Cavey, M., et al. Increased sugar valuation contributes to the evolutionary shift in egg-laying behavior of the fruit pest Drosophilasuzukii. PLoS Biol. 21 (12), e3002432 (2023).
- Jové, V., et al. Sensory discrimination of blood and floral nectar by Aedes aegypti mosquitoes. Neuron. 108 (6), 1163-1180.e2 (2020).
- Shankar, S., Calvert, M. E., Yew, J. Y. Measuring physiological responses of Drosophila sensory neurons to lipid pheromones using live calcium imaging. J Vis Exp. (110), e53392 (2016).
- Dahanukar, A., Lei, Y. -. T., Kwon, J. Y., Carlson, J. R. Two gr genes underlie sugar reception in Drosophila. Neuron. 56 (3), 503-516 (2007).
- Dweck, H. K. M., Carlson, J. R. Base recording: A technique for analyzing responses of taste neurons in Drosophila. J Vis Exp. (205), e66665 (2024).
- Dweck, H. K. M., Talross, G. J. S., Luo, Y., Ebrahim, S. A. M., Carlson, J. R. Ir56b is an atypical ionotropic receptor that underlies appetitive salt response in Drosophila. Curr Biol. 32 (8), 1776-1787.e4 (2022).
- Park, J., Carlson, J. R. Physiological responses of the Drosophila labellum to amino acids. J Neurogenet. 32 (1), 27-36 (2018).
- Wang, W., et al. Sugar sensation and mechanosensation in the egg-laying preference shift of Drosophilasuzukii. Elife. 11, e81703 (2022).
- Xiao, S., Baik, L. S., Shang, X., Carlson, J. R. Meeting a threat of the Anthropocene: Taste avoidance of metal ions by Drosophila. Proc Natl Acad Sci USA. 119 (25), e2204238119 (2022).
- Ganguly, A., et al. Requirement for an otopetrin-like protein for acid taste in Drosophila. Proc Natl Acad Sci USA. 118 (51), e2110641118 (2021).
- Lee, Y., Moon, S. J., Montell, C., Snyder, S. H. Multiple gustatory receptors required for the caffeine response in Drosophila. Proc Natl Acad Sci USA. 106 (11), 4495-4500 (2009).
- Lee, Y., Poudel, S., Kim, Y., Thakur, D., Montell, C. Calcium taste avoidance in Drosophila. Neuron. 97 (1), 67-74.e4 (2018).
- Mi, T., et al. Alkaline taste sensation through the alkaliphile chloride channel in Drosophila. Nat Metab. 5 (3), 466-480 (2023).
- Rimal, S., et al. Mechanism of acetic acid gustatory repulsion in Drosophila. Cell Rep. 26 (6), 1432-1442.e4 (2019).
- Zhang, Y. V., Ni, J., Montell, C. The molecular basis for attractive salt-taste coding in Drosophila. Science. 340 (6138), 1334-1338 (2013).
- Aryal, B., Dhakal, S., Shrestha, B., Lee, Y. Molecular and neuronal mechanisms for amino acid taste perception in the Drosophila labellum. Curr Biol. 32 (6), 1376-1386.e4 (2022).
- Shrestha, B., Aryal, B., Lee, Y. The taste of vitamin C in Drosophila. EMBO Rep. 24 (6), e56319 (2023).
- Ganguly, A., Dey, M., Scott, C., Duong, V. -. K., Arun Dahanukar, A. Dietary macronutrient imbalances lead to compensatory changes in peripheral taste via independent signaling pathways. J Neurosci. 41 (50), 10222 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon