Method Article
使用无创无图像心电图成像系统进行实时心脏标测
摘要
本研究介绍了一种使用无创、无图像心电图成像系统进行实时心脏标测的新方法。该系统无需术前计算机断层扫描或磁共振成像扫描即可获取电生理心脏图,从而能够有效指导心脏手术,例如消融和心脏再同步化治疗植入物。
摘要
快速、安全和有效的心脏标测对于复杂心律失常的管理至关重要,但目前的方法面临重大局限性。12 导联心电图 (ECG) 虽然对初步诊断至关重要,但缺乏指导导管消融术或心脏再同步治疗设备植入等高级手术所需的空间分辨率和深度。另一方面,侵入性标测技术提供详细的电活动,但需要多次放置导管,从而增加了手术风险和复杂性。这些方法耗时、昂贵且实时评估有限,尤其是在心房颤动 (AF)、不稳定心律失常和心脏再同步治疗 (CRT) 等动态心律失常中。
本研究介绍了一种无创、无图像心电图成像 (Imageless-ECGI) 系统,旨在通过提供实时、逐搏心脏图来补充传统方法。无需术前成像,该系统可捕获整个心脏的高分辨率电活动,为侵入性标测提供了一种更安全、更高效的替代方案。通过将表面记录的即时性与现代计算模型的空间精度相结合,无 Imageless-ECGI 系统弥合了传统 ECG 和侵入性标测之间的差距,有可能改变电生理学实验室的工作流程。
引言
对于准确评估心脏活动,尤其是对于接受复杂心律失常手术的患者,例如心房颤动 (AF) 和室性心动过速 (VT) 消融术,或在植入起搏器和心脏再同步治疗 (CRT) 设备期间,无创电生理标测的需求变得越来越重要。目前,三维 (3D) 电解剖标测 (EAM) 仍然是导管消融术期间指导作者的金标准1,通过提供全面的功能图来表征心律失常 2,3。然而,EAM 对于捕捉 AF、非持续性心律失常的动态时空模式并不理想,并且标测所需的长时间和侵入性程序使其在 CRT 程序中使用不切实际。
传统的无创方法,如 12 导联心电图 (ECG),虽然对识别特定的心律失常病灶(例如流出道或尖 VT)非常准确,但对心脏的整体电行为的了解有限。当需要实时标测来指导动态和复杂心律失常的干预时,这种局限性尤其明显,其中致心律失常区域的精确定位对于成功结果至关重要。无创标测可以在增强术前计划和在电生理干预期间提供实时反馈方面发挥重要作用。
为了在术前支持电生理学家,心脏成像方式的进步,如计算机断层扫描 (CT) 和磁共振成像 (MRI),已被证明可以有效地提供详细的结构信息,包括壁厚4 和心肌纤维化 5,6,7,8 .然而,这些模式侧重于解剖学和结构特征,在功能电标测方面留下了空白。此外,获得高质量的心脏图像需要专门的扫描方案、训练有素的人员和复杂的后处理方法,例如高级分割和精确的组织表征,特别是用于检测心脏纤维化。
经典心电图成像 (ECGI) 系统已成为一种无创选择,通过基于体表电位 (BSP) 重建心脏电活动而提供有希望的结果9,10,11,12。尽管具有潜力,但 ECGI 系统仍面临明显的局限性13,14。首先,他们需要术前 CT 扫描以将电极位置映射到心脏几何形状上,这使得他们的临床常规使用不太可行。其次,用于解决心脏标测逆问题的传统正则化方法通常会引入非生理传播模式,从而限制了它们在临床环境中的准确性。
本研究的目的是描述一种新型无创 ECGI 系统的特点和程序,该系统能够在不需要 CT 或 MRI15 的情况下进行实时映射,称为无图像 ECGI。我们探索了无图像 ECGI 的进展,并提出了电生理标测的潜在临床应用,克服了当前技术(如 EAM、12 导联心电图和经典 ECGI)在管理复杂心律失常手术方面的局限性。这种方法可以在患者到达后的几分钟内创建心脏地图,从而简化工作流程并缩短准备时间。此外,该系统使用先进的信号处理算法来生成准确的生理传播模式,从而改善心律失常定位和程序结果。
研究方案
该方法已在一项多中心观察性临床研究中得到前瞻性验证。该研究是根据《赫尔辛基宣言》和相关机构的道德标准进行的。研究方案 SAVE-COR (NCT05772182) 已获得格雷戈里奥·马拉尼翁大学医院、巴塞罗那临床医院和拉菲理工大学医院伦理委员会的批准,并获得了所有患者的知情同意。
注意:纳入和排除标准的详细描述是:
纳入标准: (i) 侵入性电解剖研究和/或植入腔内起搏装置的适应症。(ii) 已获得并签署纳入研究的知情同意书。
排除标准: (i) < 18 岁。(ii) 无法进行心内膜导管插入术(例如,孕妇或哺乳期妇女)。(iii) 身体或精神上无法理解和接受知情同意。(iv) 无法直立以进行 ECGI 系统所需的 3D 躯干重建。(v) 患有先天性疾病的患者。
1. 术前实时无图像心电图系统准备
- 验证生物电位放大器(图 1A)是否已充满电,并将其放置在电生理学 (EP) 房间桌子的末端,靠近患者脚的位置。
注意:生物电放大器(参见 材料表)是一个隔离的 128 通道设备,负责放大和数字化电极收集的电信号。 - 通过检查一端的放大器连接器和另一端连接传感器背心的黑色插座,验证左右电缆是否未损坏(图 1B)。
注意:左右电缆(参见 材料表)长 1.5 m,用于将电信号从传感器背心传输到生物电放大器。 - 将左右连接器电缆插入生物电放大器(图 1C)。每根电缆都与一个插头相关联,该插头由一个数字区分,该数字对于电缆和放大器都是相同的。
- 验证 3D 扫描仪平台是否已充满电,然后打开 3D 扫描应用程序。
注意:3D 扫描应用程序是在 3D 扫描仪平台上运行的软件(参见 材料表),它利用红外结构光相机生成患者躯干的 3D 模型重建。该应用程序还可以自动检测电极快速响应 (QR) 码的位置。 - 确认 PC 工作站(参见 材料表)已安装无图像 ECGI 软件用户界面 (UI) 并已充满电。
注:无图像 ECGI 软件(参见材料表)结合了信号处理算法来估计心脏几何形状,并为诊断和治疗心律失常或指导心脏装置植入手术提供有价值的信息 16,17,18,19.该系统的 UI 允许用户可视化、选择和分析心电图信号,创建心外膜活动的交互式地图,从而实现对心脏功能的无创评估。 - 使用隔离的以太网电缆将生物电放大器连接到工作站(参见 材料表)。将一端插入放大器的以太网端口,另一端插入工作站。
注意:隔离的以太网电缆将电信号从生物电放大器传输到工作站。 - 选择传感器背心(参见 材料表),检查包装,并验证密封是否完好。如果包装打开或损坏,请勿使用传感器背心。
- 打开传感器背心包装,验证四个背心组件是否在里面。如果缺少其中一个组件,请选择其他传感器背心包装。
注意:传感器背心是一个高密度电极阵列,带有 128 个银电极,可以同时绘制患者整个躯干的表面电活动。背心是射线可透的,包含四个补丁,覆盖躯干的前后左右表面。每个电极的正面都有一个二维码,可以自动识别电极位置。
2. 术前患者准备
- 在电生理学检查或设备植入的同一天将患者收治入院。
- 将患者站着或坐在椅子或 EP 台上,确保整个躯干区域没有衣服。
- 对患者的皮肤进行目视检查,以检查患者是否有海岸、伤口或任何其他皮肤状况,以避免将电极连接到这些区域。
- 或者,为有大量毛发的人梳理躯干,以最大限度地减少噪音伪影并减少传感器背心脱下时的不适。
- 将传感器背心的四个部分(右前、左前、右后和左后)正确放置在患者的躯干上(图 2A),并在必要时折叠电极之间的连接,将背心调整到患者的尺寸。
- 或者,对于 CRT 手术,避免将电极放置在将要插入心脏植入物的区域,通常位于左上胸部。
注意:如果需要,可以安全地断开与打印破折号的连接,因为这些区域中不存在活动轨迹。 - 将传感器背心的右腿驱动 (RLD) 和参比 (REF) 电极分别放在右腿和左腿上,尽可能远离其他背心电极。
- 确保房间照明充足,并确保患者躯干周围直径 1.5 m 范围内没有物体,因为它们可能会干扰或扭曲 3D 躯干重建。
- 将患者的手臂放在头上,以防止干扰 3D 躯干重建,如图 2C 所示。
- 获得患者的 3D 躯干重建。
- 获取 3D 扫描仪平台并打开 3D 扫描应用程序。
- 扫描右前背心组件侧面的二维码以验证传感器背心(图 2B),确保它是一次性使用的且未过期。
注意:一旦检测到 QR 码,3D 扫描应用程序就可以采集 3D 躯干重建。 - 将 3D 扫描仪平台放置在患者面前的躯干水平,用双手牢牢握住,并围绕患者完成 360° 旋转以获得 3D 躯干重建(图 2C)。
注意:随着扫描的进行,来自 3D 扫描仪平台的红外结构光相机会为躯干创建一个灰色的 3D 闭合网格,在完全旋转后完成该过程。通常,3D 躯干重建过程需要 1-2 分钟才能完成。 - 对 3D 躯干重建进行目视检查,以确保整个躯干被灰色阴影覆盖,并且重建的网格中不存在孔洞。
- 扫描完成后,将 3D 躯干重建保存在应用程序中。
- 让患者躺在 EP 病房的桌子上。
- 将传感器背心的四个部分连接到相应的左右连接器电缆(图 1D)。将右前和右背心连接器连接到右侧电缆插座,将左前和左后背心连接器连接到左侧电缆插座。
- 打开生物电放大器的电源,使无图像 ECGI 软件能够接收实时电生理信号。
3. 估计患者的心脏几何形状
- 以用户身份登录工作站中安装的实时无图像 ECGI 软件(图 3)。提供用户名和密码。
- 单击 Add Patient 按钮,并在 UI 的 Home Window 中引入识别详细信息以注册新患者(图 4)。然后,创建一个与患者关联的新会话,提供手术类型和以下基础数据:性别、年龄、身高和体重。
注意:单个患者可以进行多次治疗。例如,在随访的临床研究中,如果患者接受了第二次 ECGI 注册,则可以创建一个新会话,而无需再次添加患者。 - 使用 USB-C 电缆将 3D 扫描仪平台连接到工作站。
- 单击 加载躯干扫描 按钮,然后在 躯干几何窗口中 上传 3D 躯干重建(图 5)。
注意:该软件将自动检测传感器背心中 128 个电极的定位。每个背心组件都有不同的电极颜色:右前 = 红色,左前 = 蓝色,右后 = 粉红色,左后 = 橙色。 - 或者,通过单击每个电极并将其重新定位在躯干表面上来手动调整电极位置。
- 选择 Compute Geometry 按钮和 Estimate Heart Geometry 选项,以在 Torso Geometry 窗口中估计患者的心脏几何形状(图 5)。
注意:该软件使用基于统计形状模型 (SSM) 的方法估计心脏几何形状(图 6A),如以前的文献20 中所述。该算法首先处理患者的 3D 躯干重建和基础数据(性别、年龄、身高和体重)作为输入。随后,SSM 结合基于 MRI 的躯干和心脏几何形状,迭代调整以适应患者的 3D 躯干网格。这决定了患者体内的最佳心脏几何形状、位置和方向(图 6B)。此过程消除了对术前 CT 或 MRI 的需要,从而能够在 10-15 分钟内生成第一个无创心脏图。需要注意的是,弹出消息会通知用户 3D 躯干重建是否缺乏足够的分辨率或包含任何可能影响估计结果准确性的伪影。
4. 用于实时引导心脏再同步化治疗 (CSP-CRT) 的传导系统起搏植入物的无创无创 ECGI 标测(案例 4)
- 转到 Amplifier 窗口 并单击 Connect Amplifier 按钮开始采集实时电生理信号(图 7)。单击不同的导联以可视化放大器屏幕中的信号。
- 转到 实时窗口 (图 8)以获得实时无创心脏标测。
注意:实时窗口可实现实时信号的可视化,排除噪声信号,创建时间制造器,自动描绘分析片段(例如,P 波和 QRS 复合波),并计算和显示无创 ECGI 图。 - 通过单击 128 导联视图 按钮,选择 User Only 选项作为 noisy 导联选择模式,并在生成 ECGI 图之前双击 noisy 信号以排除它们,以排除噪声信号。这提高了映射计算质量,因为 ECGI 是一个病态问题21。
注意:以绿色显示的传感器背心引线表示信号质量好,用于逆向问题计算,而以红色显示的引线有噪声,被排除在分析之外(图 8A)。 - 单击 12 导联视图 按钮以实时可视化估计的 12 导联心电图(图 8B)。
- 确保 RT ON 按钮处于活动状态,以自动更新信号分析部分中的信号(图 8C)。此选项会自动触发并定义要分析的 QRS 波群的起始和偏移。
注意: RT 按钮可以切换到 RT OFF 模式以冻结信号,允许用户在系统的自动描绘不理想时手动描绘 QRS 波群。 - 通过单击 选项 按钮配置 ECGI 激活映射分析,以自动生成 CSP-CRT 程序的最佳基础心律图:
- 选择 Analyze Ventricle (分析心室 ) 选项以仅映射心室。
- 为 Activation Times Algorithm 选择基于小波的17 分析选项。
- 为 Mapping Type 功能选择 Average Beat 选项,以计算最近 10 个 QRS 复合波的平均波。
- 保留 Offset Correction、Beat Number 和 Sync Option 功能的默认设置。
- 在地图可视化部分选择两个面板选项,并确保将左侧地图设置为 更新 模式,以便它随着分析的每个新平均 QRS 波群而不断更新。
- 在左侧可视化双心室基础激活图(图 8D 左面板)。系统自动计算躯干和心脏网格之间的传递矩阵,以基于边界元法 22,23,24 重建心脏的心外膜电活动。
注意: 激活 图描绘了心脏外膜去极化的时间进程,有助于确定激活起源并识别折返或局灶性模式。激活的计算方法是 (1) 将每个重建的电图转换为所有负斜率时间样本的正弦小波和以及与当时斜率成正比的振幅,以及 (2) 选择转换信号的最大振幅的时刻作为激活时间17 的时刻。 - 通过单击“ 保存映射 ”按钮编写名称并保存基础图,并在可重现后将图切换到 “冻结 ”模式。可重复的 ECGI 图在至少三个连续图中具有一致的激活持续时间和传播模式。
注意:在 CSP-CRT 程序中,基础图(图 12A)将作为评估间隔区域电极拧紧过程中双心室同步的参考,直到到达左束支区域(图 12C)。 - 通过单击 选项 按钮配置 ECGI 激活映射分析,以在隔膜区域的拧紧和起搏过程中获得最佳映射:
- 选择 Analyze Venttricle (分析心室 ) 以仅标测心室。
- 为 Activation Times Algorithm (激活时间算法) 选择基于小波的分析选项。
- 为 Mapping Type 选择单心跳选项,以分析单心跳的波,以捕获在不同隔膜位置同时拧紧和起搏过程中心电图信号的变化。
- 保留 Offset Correction、Beat Number 和 Sync Option 功能的默认设置。
- 将右侧面板映射设置为更新模式,以确保它在拧紧过程中不断更新每个新分析的单拍 QRS 复合物。
- 使用 链接值 菜单将右侧面板映射的颜色图范围与基础图同步,并通过 链接相机 菜单链接它们的相机位置(图 8D 右面板)。
注意:当导联导线拧入隔膜区域时,会在各个位置(即右室间隔、间隔中段、深间隔和左束支)自动生成心跳间 ECGI 图。通过标准化所有评估的 ECGI 图的色图范围,将这些图与基础图进行比较(图 12B、C)。这种设置允许在拧上引线时清晰地可视化激活模式的变化。 - 在隔膜区域的拧紧过程中,每当观察到激活模式的变化时,通过单击 Save Map(保存映射 )按钮写下名称并保存每个映射,一直持续到到达左束分支区域。
5. 额外的无创无成像 ECGI 标测分析
注意:可以从计算的 ECGI 信号中得出不同的心脏图,以评估心脏基质、表征心律失常、评估 CRT 或在手术过程中提取临床相关指标。可以生成的地图类型取决于所分析的特定心律,对于规则心律和不规则心律都有不同的方法。
- 使用 Real-Time 窗口的信号分析部分来分析患者在电生理过程中可能表现出的不同节律:
- 当患者处于稳定/规则心律(如窦性心律、心房或心室起搏、心房扑动或室性心动过速)时,分析规则心律,将 单搏 或 平均心跳 分析设置为 标测类型 功能。从常规节律分析中计算 激活 图和 传导速度 (CV) 图。
- 分析心律不齐,当患者处于心房颤动状态时,使用 不规则心律搏动 分析作为 标测类型 功能。该系统可以选择扩展的 AF 片段(例如,1 分钟)以抑制 QRST 复合物并捕获 AF 的动态时空模式。从不规则心律分析中计算 相位 图、 转子直方图 和 主导频率 图。
- (可选)按地图选择的下拉菜单,如果已分析了规则节奏,请选择 Activation map。有关详细的 激活 映射描述,请参阅步骤 4.8。
- (可选)按地图选择的下拉菜单,如果已分析了规则节律,请选择 Conduction Velocity 地图。
注意:传导速度是从激活图得出的指标。该指标表示波前穿过心外膜每个区域所需的时间。CV 计算依赖于心脏表面激活时间图的空间梯度,并应用速度矢量场来识别有效传播的区域。具有均匀方向矢量的区域表示稳定的电传播,而具有角度差异的区域表示无效传播,使用径向基函数25 进行插值。CV 允许识别底物映射过程中与心律失常复发率相关的传导减速区域17。 - (可选)按图选择的下拉菜单,然后在分析不规则节律时选择 Phase 图。
注意:相位图跟踪心肌定义区域随时间推移通过动作电位的进展。这种类型的地图是动态的,因为它代表了心脏电位的进展。在相位图中,应用希尔伯特变换来计算 ECGI 信号的相位。每个阶段对应于信号每个周期内动作电位的给定状态(π 表示静息,π/2 表示去极化,0 表示平台期,-π 表示复极化)26。 - (可选)在分析不规则节律时,按地图选择的下拉菜单并选择 Rotor Histogram 地图。
注意:转子直方图源自相位图,表示相位奇点的最频繁位置,这些位置是具有集中重入活动的区域,以红色显示。简而言之,相位奇异性被定义为相位从 -π 变为 π 的关键点。在其周围环境中没有显示相位逐渐空间进展的 PS 将被丢弃。最后,量化每个转子的匝数以获得 转子直方图 图18。该算法在识别 AF 期间传播模式和表现出折返的特定区域方面的精度已根据心内膜标测进行了系统评估,证明相关性为 71%16。 - (可选)在分析不规则节律时,按地图选择的下拉菜单并选择 Dominant Frequency (DF) 地图。
注意:DF 图显示每个心脏区域随时间推移的主要电频率,有助于识别可能成为 AF 驱动因素的快速电活动区域。DF 计算为 Welch 周期图27,28 中具有最高功率谱密度的频率。其分析可以检测心房内纤颤活动高度稳定性或可变性的区域。直方图用于评估主频率的时间分布,提供最相关电活动的清晰和定量表示,并有助于识别具有异常行为的区域。
结果
案例 1 - 规划和指导非典型心房扑动的导管消融术
该病例是一名 59 岁男性(体重指数 -BMI-30)患者,有高血压、吸烟、心脏瓣膜病、EHRA IIb 分类病史,CHA2DS 2-VASc 评分为 1,根据 12 导联心电图,有非典型心房扑动 (AFL) 导致导管消融的迹象(图 9A)。患者既往无导管消融史。术前晚期钆增强 MRI (LGE-MRI) 显示左心房 (LA) 后壁广泛纤维化,正常 LA 平视率为 24 cm²,左心室射血分数 (LVEF) 保留 54%。
在通过股骨鞘引入导管前几分钟进行无创无图像心电图检查。选择无 QRST 复合物的 AFL 的完整周期 (209 ms) 进行分析。该映射揭示了二尖瓣 (MV) 周围的宏重入回路,将二尖瓣周围线确定为终止心律失常的最佳消融目标(图9B)。在此之后,进行了基于接触的 EAM(图 9C),证实了在无创无影 ECGI 中观察到的传播模式。沿二尖瓣周围线的消融成功终止了心律失常。
在这个临床病例中,在侵入性 EAM 之前准确表征了心律失常,从而能够精确定位心律失常传播模式并简化消融手术。然而,对于复杂的房性心动过速,例如 AFL 或局灶性心动过速,无图像 ECGI 提供实时的单搏标测,使其在非持续性心律失常的情况下特别有价值。它对手术过程中心律失常模式变化的适应性确保了精确和动态的标测。此外,虽然逆时针 AFL 的诊断通常从 12 导联心电图简单明了,但精确定位和识别复杂快速性心律失常的机制可能具有挑战性。因此,在医疗会诊时或几分钟前进行无图像 ECGI 可以通过为导管消融计划提供上游指导和消除不必要的房间隔入路来提高手术安全性和效率。
案例 2 - 持续性心房颤动导管消融过程中相位奇异性的演变
该病例为一名 63 岁男性患者 (BMI 31),左心室射血分数 (LVEF,55%)保留,无扩张的 LA,纽约心脏协会 (NYHA) 为 I 因持续性 AF 而被指征进行导管消融术。未进行术前 CT 或 MRI 成像。患者既往有 2019 年 12 月肺静脉隔离 (PVI) 导管消融术史。
到达时,患者处于 AF 状态。在整个消融过程中使用无图像 ECGI 进行基质映射(图 10A)。在基线时,ECGI 确定了右心房 (RA) 侧壁、右心耳 (RAA) 基底、左心耳后壁 (PW) 和左心耳 (LAA) 基底的相位奇异性。这些发现与使用腔内导管观察到的高频和碎片化 EGM 相关,并且通过 LA EAM 重建确认了足够的 PVI。脉冲场消融术 (PFA) 从 LAA 基底开始,导致从 AF 到非典型 AFL 的节律改变。无影像 ECGI 显示二尖瓣周围 AFL,通过冠状窦导管远端极夹带证实。创建了一条二尖瓣线;然而,AF 被重新诱发。随后,实现了 PW 的完全隔离。尽管如此,无图像 ECGI 继续在 RAA 基上识别出重要的相位奇点。在针对该区域的多个 PFA 应用之后,实现了窦性心律(图 10B)。
这个临床案例代表了 AF 如何由于心房电活动的高度可变性而带来独特的挑战。无图像 ECGI 有效地捕捉了消融过程中 AF 进展的时空模式,最多可获取三个无创图以指导基质修饰,直到实现 SR。标准治疗,如肺静脉隔离,复发率相对较高29。AF 治疗的主要难点在于两个方面:(1) 确定哪些患者将单独从 PVI 中受益,以及 (2) 对于那些需要更广泛方法的患者,确定 PVI 区域之外消融将最有效减少心律失常复发的区域。在窦性心律期间,无图像 ECGI 已证明能够生成 CV 图,这已被证明可用于预测 PVI 消融成功17。然而,在这种情况下,无图像 ECGI 同时捕获了 AF 动力学模式,为临床医生提供了 AF 如何传播的全面视图,并有助于识别驱动心律失常的关键区域。结果分析应侧重于消融无成像 ECGI 检测到的 AF 驱动因素与临床终点(例如长期无心律失常生存期)之间的相关性,以进一步验证其在优化 AF 消融策略中的效用。
案例 3 - 指导心脏再同步化治疗的双心室起搏优化
该病例为一名 67 岁女性患者,患有非缺血性扩张型心肌病,LVEF 为 25%,术前 MRI 无晚期钆增强证据,基线心电图为左束支传导阻滞 (LBBB),QRS 持续时间为 156 ms。作为 CRT 的一部分,患者需要进行双心室起搏 (BiVP)。
在心脏 CRT 手术过程中,使用实时无成像 ECGI 评估起搏器植入前后的心室同步。在基线节律时,患者的最新激活区域是在左心室 (LV) 的基底外侧壁确定的,如图 11A 所示。在 116 ms 测量心室总活化时间 (TAT),表明显着的心室不同步。使用 ECGI 评估不同的设备配置,最佳设置确定为 BiVP,同时使用激活 LV 导联的远端和近端磁极,房室延迟为 140 ms。如图 11B 所示,三个心室起搏点没有晚期激活区域,表明同步成功,TAT 提高了 70 毫秒。
心脏再同步化治疗旨在恢复心力衰竭和延长 QRS 波患者的心室电协调并改善心脏功能。在这种情况下,无图像 ECGI 提供了实时映射,这是在 CRT 过程中指导 BiVP 优化的关键。它能够精确评估心室激动模式,并帮助确定最佳装置配置,确保完全心室同步。ECGI 的无创性和即时反馈使临床医生能够改进导联编程。相比之下,虽然研究强调了 ECGI 在指导左心室导联放置在最新激活区30 附近的价值,但解剖学限制可能会限制其适用性。通过 ECGI 确定的基础和最终再同步参数(例如 TAT)应通过监测患者随时间对 CRT 的临床反应(包括症状改善和长期心室功能)与临床结果相关联。
案例 4 - 用于心脏再同步化治疗的实时引导传导系统起搏植入物
该临床病例为一名 45 岁女性患者,患有严重心室功能不全 (LVEF 15%) 和 LBBB,QRS 持续时间为 172 ms。该患者需要使用传导系统 (CSP) 起搏方法的植入式心律转复除颤器 CRT。
在装置植入过程中使用实时无图像 ECGI 来监测隔膜区域电极拧紧过程中的心室同步。如图 12 所示,基线 ECGI 图将 LV 的外侧壁确定为最新激活区域,TAT 为 133 ms。电极拧紧期间的心跳间 ECGI 标测显示心室同步性逐渐改善,到达左束支时实现最佳同步,导致 TAT 为 95 ms。
该病例证明了实时无图像 ECGI 在 CRT 手术期间指导 LBBP 植入的潜力。其单拍实时标测功能允许在间隔区域导联植入的每个步骤中分析心室 TAT 和再同步性。该系统提供了一个快速、直观且易于解释的指标,解决了心电图 CSP 标准缺乏标准化的问题。除了在 BiVP-CRT 程序中,还需要进一步的研究来确定无图像 ECGI 参数是否与临床 CRT 反应显着相关,以及它们与 12 导联心电图预测因子的比较。
案例 5 - 计划和指导室性心动过速的导管消融术
该病例是一名 53 岁男性患者 (BMI 25.4),患有缺血性心肌病、严重心室功能障碍 (LVEF 15%),NYHA II 级因复发性 VT 而被转诊进行导管消融手术。术前 MRI 显示广泛的心内膜纤维化和致心律失常通道位于左心室的下基底和下内侧段。患者在 2018 年有 VT 导管消融术的既往史。
在整个手术过程中同时进行无图像 ECGI 标测(图 13A)和侵入性 EAM(图 13B)。导管消融过程涉及右心室 (RV) 心尖起搏期间基于基质的标测和使用程序刺激的 VT 诱导。无图像 ECGI 在导管引入前的窦性心律标测期间确定了 LV 下基段的传导减慢区域。这一发现与 MRI 上观察到的纤维化一致。随后从右心室 (RV) 心尖起搏证实 LV 基底段和内侧段的传导减慢,确定该区域可能是致心律失常的基质。短暂诱导周期长度为 380 ms 的 VT,由于血流动力学不稳定,需要心脏复律。因此,仅获得了有限数量的 EAM 积分。然而,使用单个 VT 周期,无图像 ECGI 成功识别了在起搏图中观察到等时拥挤的同一区域的 VT 峡部。
在该 VT 病例中使用实时无图像 ECGI 成功解决了 VT 管理中的两个主要临床挑战:(1) 窦性心律期间潜在消融目标的精确定位和 (2) 血流动力学不稳定的 VT 的特征。从单个心跳中,VT 峡部在底物和心律失常激活图中都被准确识别。该系统使作员能够在消融之前或期间识别致心律失常的底物,并从单个周期中实时表征多个可诱导的 VT。

图 1:无映像 ECGI 硬件组件。 (A) 具有特定电缆连接端口的双电位放大器。(B) 左右电缆,一端配备放大器连接器,另一端配备传感器背心插座连接器。(C) 显示连接到双电位放大器的左右电缆的配置。(D) 将传感器背心连接到电缆插座的程序示意图。 请单击此处查看此图的较大版本。

图 2:3D 躯干重建扫描仪程序。 (A) 128 导联体表电位传感器背心由四个组件(前-右、前-左、后-右、后-左)组成,在 3D 重建之前放置在患者的躯干上。每个电极都有一个唯一的二维码,用于自动识别。电极之间的连接可以折叠,以使背心适应患者的体型。(B) Front-Right 组件上的 QR 码验证背心,使 3D 扫描仪应用程序能够启动躯干重建。(C) 3D 扫描仪平台通过 3D 扫描仪应用程序,使用红外结构光相机生成重建的躯干。缩写: FR: front-right;FL: 左前;BR:右后;和 BL:左后。 请单击此处查看此图的较大版本。
图 3:无图像 ECGI 用户界面登录屏幕,需要指定的用户名和密码才能访问软件。 请单击此处查看此图的较大版本。
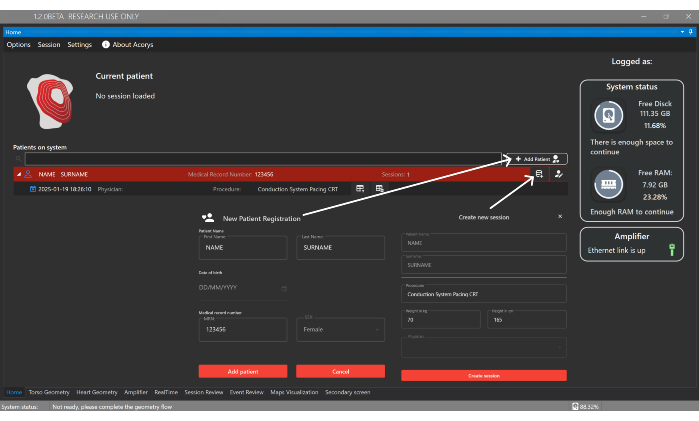
图 4:主窗口。“主页”窗口支持管理患者、医生和用户,以及配置患者会话。它还显示有关导入的会话以及系统和放大器状态的信息。请单击此处查看此图的较大版本。
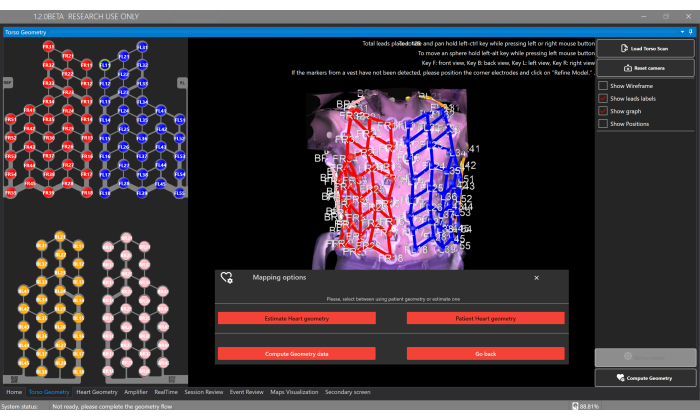
图 5:躯干几何窗口。 “ 躯干几何” 窗口允许用户上传和查看 3D 躯干模型、分割电极,并通过 “计算几何 ”按钮选择心脏几何类型,从而启用估计或从个性化 CT/MRI 中提供分割。 请单击此处查看此图的较大版本。
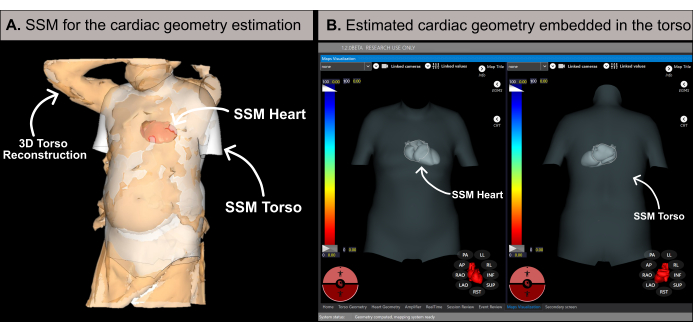
图 6:心脏几何估计。 (A) SSM 算法利用基础特征和患者的 3D 躯干重建来估计心脏几何形状。(B) 躯干 SSM 内估计的心脏几何形状,显示前后(左侧)和后-前(右侧)视图。缩写: 3D: 三维;SSM:统计形状模型。 请单击此处查看此图的较大版本。
图 7:放大器窗口。 Amplifier 窗口允许实时可视化从传感器背心的每个电极获得的信号。请单击此处查看此图的较大版本。

图 8:实时窗口。 (A) 来自高密度电极阵列背心的有源导联的示意图。绿色电极包含高质量的信号,而红色电极包含噪声信号,不参与逆问题计算。(B) 实时估计心电图的 12 条导联。(C) 自动触发和描绘 QRS 波群的开始和偏移(绿色窗口)。参与映射计算的所有潜在客户的平均信号以蓝色显示。(D) 地图可视化部分支持单视图、双视图或四视图。此示例显示了 CRT 手术期间带有基底和左束支起搏(最终映射)状态激活图的双映射视图。基础图处于冻结模式,保持静止,而最终图处于更新模式,使用每个新分析的 QRS 波群重新计算。 请单击此处查看此图的较大版本。
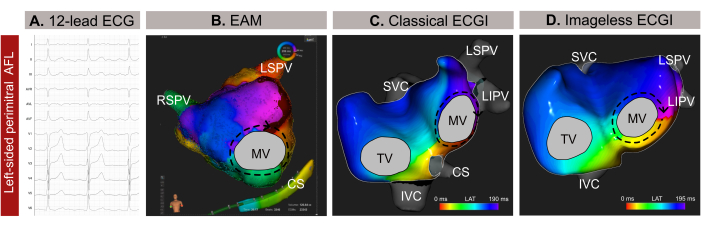
图 9:左侧非典型 AFL 的图形示例以及 12 导联心电图、无图像心电图和侵入性 EAM 的不同诊断能力。 (A) 非典型 AFL 的 12 导联心电图信号在 V1 中呈现正脑室上波。(B) 使用 SSM 估计的心脏几何形状并显示前后视图的无图像 ECGI。传播电路显示 MV 周围的所有颜色,这是二尖瓣周围 AFL 的典型模式。(C) 源自 EAM 的局部激活映射并显示前后视图,显示 MV 周围的宏观折返,确认无图像 ECGI 的诊断。缩写: ECG: electrocardiogram;EAM: 电解剖标测;ECGI:心电图成像。SVC: 上腔静脉;IVC: 下腔静脉;CS: 冠状窦;LSPV:左上肺静脉;RIPV:右下肺静脉;RSPV:右上肺静脉。 请单击此处查看此图的较大版本。
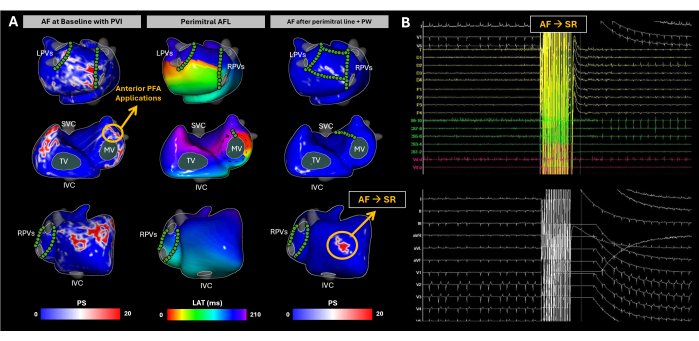
图 10:使用无创无成像 ECGI 标测跟踪 AF 导管消融期间心房基质的演变。 (A) 无成像 ECGI 的后-前视图、前后视图和右侧视图,PFA 部位用绿色圆圈标记。基线 PS 图突出显示了 RA 侧壁、RAA 基底、LA 后壁和 LAA 基底的折返。LAA 基底的 PFA 将节律过渡到二尖瓣周围 AFL。尽管完成了二尖瓣线和后壁隔离,但 AF 再次自发地诱发。ECGI 显示 RAA 碱基中的 PS,这成为消融靶点。在该区域进行了多次 PFA 应用,并恢复了窦性心律。(B) AF 变为 SR 时的 12 导联心电图和心内信号。缩写: SVC:上腔静脉;IVC: 下腔静脉;LPVs:左肺静脉;RPVs:右肺静脉;AF:心房颤动,SR:窦性心律,PS:相位奇异性,LAT:局部激活时间,TV:三尖瓣,MV:二尖瓣,PVI:肺静脉隔离,AFL:心房扑动,PW:后壁,PFA:脉冲场消融术。 请单击此处查看此图的较大版本。
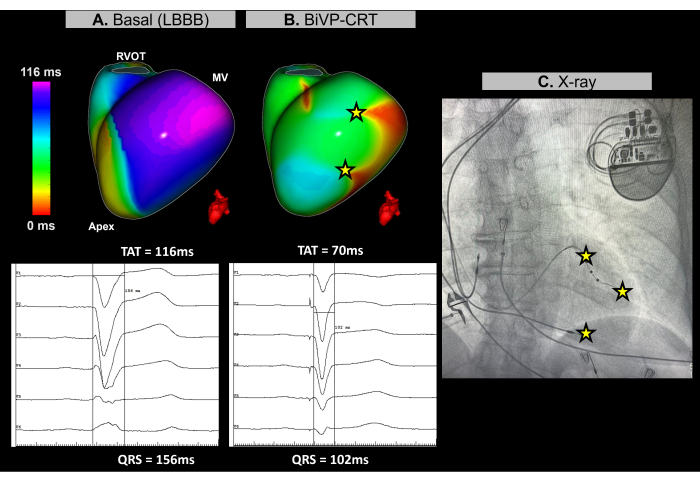
图 11:使用无图像 ECGI 优化双心室起搏。 (A) 患者的基线心律。无图像 ECGI 图(左侧视图)显示左心室外侧壁有一个迟发区域(紫色),TAT 为 116 ms,表明心室不同步。这与基线心电图一致,基线心电图显示宽 QRS 波群 (156 ms) 伴有 LBBB 模式。(B) 起搏器植入后配置。在 BiVP 同时激活 LV 导联的远端和近端极并且房室延迟 140 ms 之后,无图像 ECGI 图显示没有延迟激活区域(无紫色区域),表明同步心室激活和 TAT 降低 70 ms。这与最终心电图中观察到的缩短的 QRS 波群一致,其中 QRS 持续时间减少到 102 毫秒。(C) 植入起搏器的前后 X 线片视图,显示起搏器电极的位置。LV 导联远端和近端磁极的起搏活动也反映在 ECGI 图中。缩写:LBBB:左束支传导阻滞,BiVP:双心室起搏,CRT:心脏再同步化治疗,RVOT:右心室流出道,MV:二尖瓣,TAT:总激活时间。 请单击此处查看此图的较大版本。
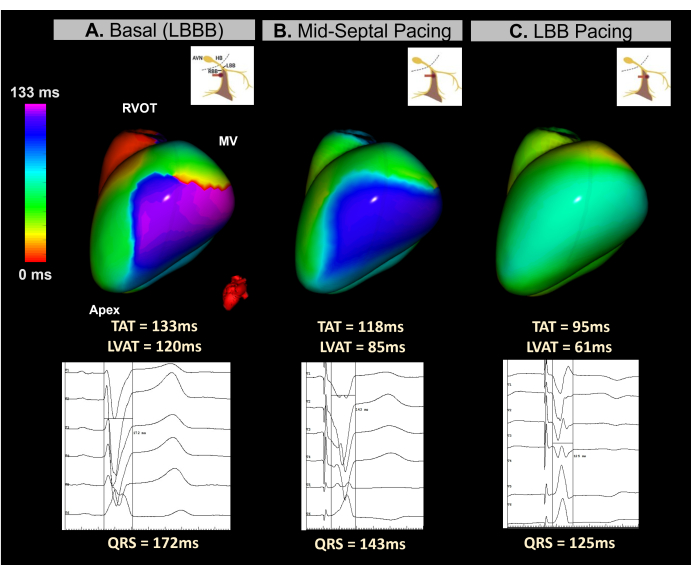
图 12:使用无图像 ECGI 通过传导系统起搏对 CRT 进行无创评估。 (A) 患者基线心律。ECGI 图(左侧视图)显示 LV 外侧壁上的延迟激活区域(紫色),TAT 为 133 ms,提示心室不同步。这与基线心电图相对应,基线心电图显示 LBBB 典型的宽 QRS 波群 (172 ms)。(B) LBBP 导联植入期间的中间期(中间隔起搏)。无创图显示 LV 中延迟区域的部分校正,颜色从紫色变为蓝色。这伴随着 QRS 波群持续时间的缩短。(C) 拧紧过程中 LBBP 引线的最终位置。该图显示了延迟区的完全矫正,颜色从紫色过渡到绿色,表明两个心室同步激活。缩写: LBBB:左束支传导阻滞,LBB:左束支,RVOT:右心室流出道,MV:二尖瓣,TAT:总激活时间。 请单击此处查看此图的较大版本。
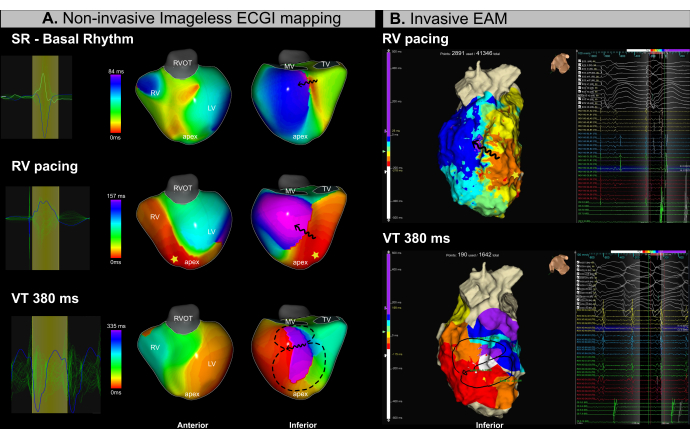
图13:使用无像 ECGI 对 VT 峡部进行无创评估。 (A) VT 消融手术过程中的无图像 ECGI 标测可识别 LV 下基底和下内侧区域的致心律失常基质和 VT 峡部。第一行对应于窦性心律,中间行对应于 RV 心尖起搏,底行对应于 VT。(B) 在 VT 消融手术期间获得的侵入性 EAM 显示 ECGI 识别的相同区域的等时激活映射。顶行对应于 RV 心尖起搏,而底行代表 VT。缩写: RV: 右心室, LV: 左心室, SR: 窦性心律, RVOT: 右心室流出道, MV: 二尖瓣, TV: 三尖瓣。 请单击此处查看此图的较大版本。
讨论
该方法描述强调了无创、单搏和实时 ECGI 方法的临床应用,它可以支持各种电生理程序,例如导管消融和 CRT,而无需 CT 或 MRI 等术前心脏成像 15,17,31,32在本报告中,Imageless ECGI 展示了可能促进其临床采用的关键技术特征。虽然 ECGI 已被证明是跨各种心律失常进行心脏标测的强大工具 19,33,34,35,36,但它仍然面临一些临床和技术挑战 13,14。
经典的 ECGI 系统需要在心脏标测的同一天进行 CT 扫描,ECGI 电极就位9、10、12、37、38。由于需要 CT 扫描分割(心脏和电极),这种方法增加了额外的时间,将初始 ECGI 图的生成延迟了大约 1-3 小时。相比之下,本报告中介绍的无图像 ECGI 系统利用高密度阵列电极对胸部进行红外 3D 扫描,可以在手术前几分钟或医疗咨询期间进行15,17。该系统自动分割胸椎电极并估计患者的心脏几何形状,简化了无创心脏标测过程,并显著缩短了患者到达和第一个 ECGI 标测可用之间的时间。先前对无图像 ECGI 方法的验证表明,使用估计的心脏几何形状会引入最小的误差,从而保持无创地图的准确性。在 AF 患者中,观察到来自估计心脏几何形状的 ECGI 信号与实际心脏几何形状之间具有很强的相关性,即使有几何平移15。对于规则性心律失常,例如复杂房性心动过速,与 EAM 的比较表明在识别受累心腔、确定机制(局灶性或折返性)和推断消融目标方面具有很高的准确性31。在 VT 的情况下,已经评估了该方法以指导作者在窦性心律 (SR) 期间前往 VT 峡部区域 (SR)39,这表明在一级预防中识别有 VT 风险的患者的潜力。此外,在冠状窦起搏期间观察到无图像 ECGI 和 EAM 激活图之间的强烈区域一致性,尤其是在早期和晚期激活部位40。
在 CRT 中,12 导联心电图的实时形态学变化通常用于确认导联植入过程中的再同步性,特别是在 CSP 手术中,在间隔导联放置的各个阶段评估心电图,直到到达 LBB 区域。然而,已发布的心电图算法通常很复杂,它们之间存在显着差异,并且在某些情况下难以在临床实践中实施 41,42,43。可能是由于这种复杂性,尚未一致确定左束支起搏 (LBBP) 的特定心电图参数可以可靠地预测患者是否会对心脏再同步化做出反应。实时无成像 ECGI 方法在整个导联植入过程中提供简单而详细的逐次心跳映射,通过评估左心室激活时间等参数来评估不同步校正,如 CRT 适应症32 或 AV 传导阻滞44 患者所示。因此,通过进一步研究,实时 ECGI 参数可能会指导作员优化导线植入位置或预测患者对 CRT 的反应。
尽管该方法学报告已经介绍了实时无图像 ECGI 的潜力,但其他使用心律失常模拟的新型无创标测方法也旨在消除对术前成像的需求。心律失常概率矢量心动图映射 (VMAP) 研究表明,在精确定位室性心律失常部位方面具有显着的区域准确性45 ,并有望在识别非 PVI 消融之外 AF 驱动因素的位置46。VMAP 将 12 导联心电图与多个计算模型结合使用来识别心律失常目标,而无需依赖患者特定的几何数据。然而,这种方法对于像 AF 这样的房性心律失常来说可能不是最佳选择,因为表面心电图上的高频分量对于无创识别心律失常驱动因素至关重要。这些成分通常由后外侧和前外侧表面的电极捕获27,这在临床实践中使用的标准 12 导联心电图中没有表示。
尽管需要进一步的临床研究,但实时无图像 ECGI 有可能成为跨各种心律失常进行无创心脏标测的宝贵工具。其方法论的简单性和医院环境中简化的患者工作流程使临床医生能够收集更多的临床数据,从而可以改善患者预后和未来的技术进步。总之,无创心脏标测的未来在于向完全无图像的方法发展,允许更快、更顺利地整合到日常临床实践中,从常规咨询到电生理手术期间的实时标测。
披露声明
JRP、BPS、JSC、IHR、RM、CF、EZ、JM、DL、FA、MSG 和 AMC 获得了 Corify Care SL 的荣誉。AMC、MSG 和 FA 是 Corify Care SL 和 JRP、BPS、JSC、IHR、JM、DL、JBG、FA、LM、MSG 和 AMC 的股东。TFA 已获得 Biosense-Webster 的研究资助。IRL 已获得 Abbott 和 Biosense-Webster 的讲师和顾问酬金。APS 已获得 Bisosense-Webster、Abbott 和 Boston-Scientific 的演讲者和顾问酬金。JMT 曾获得 Abbott、Boston-Scientific 和 Medtronic 的讲师和顾问酬金。EA 已获得 Biosense-Webster 和 Bayer 的演讲者和顾问酬金。LM 作为 Boston-Scientific、Abbott、Johnson&Johnson 和 Medtronic 的顾问、讲师和顾问委员会报告酬金,并且是 Galgo Medical SL 的股东。JBG 报告了作为 Microport CRM 和 Abbott 的顾问和演讲者的酬金,此外还获得了 Abbott 对奖学金的无限制赠款支持。MPL 已获得美敦力的演讲者酬金。
致谢
这项研究由欧洲创新与技术研究所 (EIT) 根据赠款协议 SAVE-COR No 220385 和瓦伦西亚政府 (EFICACIA) 资助的 CIAICO/2022/020 赠款资助。额外的支持来自巴伦西亚政府(拨款 CIAPOS/2021/238、ACIF/2021/205、CIBEFP/2022/9)、MCIN/AEI/10.13039/501100011033 和 ESF 投资于您的未来(拨款 RYC2018-024346-I)、卡洛斯三世健康研究所(拨款 CIBERCV16 CB16/11/00354)和西班牙加泰罗尼亚(拨款 2021_SGR_01350,SGR21/GENCAT)。我们还感谢 CERCA 计划/加泰罗尼亚政府的支持。MPL 通过 Río Hortega 合同 CM22/2025 资助(00107 年 [卡洛斯三世健康研究所 (ISCIII);Fondo Social Europeo (FSE)]。作者感谢 Neus Portella 和 Sheila Marco 提供的秘书支持,并感谢巴塞罗那临床医院、格雷戈里奥·马拉尼翁总医院、拉菲理工大学医院的医疗和护理团队的临床支持。他们还感谢西班牙马德里 Corify Care SL 的 Almudena Albertos 和瓦伦西亚理工大学的 Arantxa Carrasco。
材料
| Name | Company | Catalog Number | Comments |
| ACORYS Mapping System | Corify Care SL | ACORYS | Imageless ECGI system |
| ACORYS 3D Scan Software | Corify Care SL | ACSCAN | 3D scanner app |
| ACORYS Amplifier | Corify Care SL | ACAMP | Biopotential amplifier |
| ACORYS Sensor Vest | Corify Care SL | ACSEN | Sensor vest, 4 components (Front Right, Front Left, Back Right and Back Left) |
| ACORYS Software | Corify Care SL | ACSOF, version 1.2 | Imageless ECGI software |
| Affera mapping system | Medtronic | AFR-00003 | |
| CADENCE Adult mulifuntion defibrillation electrodes | Cardinal Health | 22660R | |
| Catheter extension cable | Medtronic | AFR-00006 | |
| Desktop or portable PC workstation | Any | Windows 11 as the operating system | Imageless ECGI workstation. The processor must be at least an Intel i7 from the 2020 generation or newer. It requires a minimum of 32 GB of RAM and 500 GB of SSD storage. Additionally, a compatible version of .NET Framework must be installed. An internet connection is not required. |
| Dynamic XT 10E 2 5 2 MM Diagnostic Catheter | Boston Scientific | M0042011010 | |
| EP-TRACER 2 ProCart | Cardiotek | The system includes several components provided by the company | |
| External Defibrillator Monitor | PHILLIPS | Efficia DFM100 | |
| Fentanyl | Kern pharma | 1004000143-03 | |
| Heparine | Reig Jofre | 608737.4 O | |
| HexaFlow irrigation pump | Medtronic | AFR-00005 | |
| HexaGen RF generator | Medtronic | AFR-00004 | |
| HexaPulse PF generator | Medtronic | AFR-00008 | |
| INTELLAMAP ORIO Mapping Catheter | Boston Scientific | M004RC64S0 | |
| IntellaNav StablePoint Ablation Catheter | Boston Scientific | M004ERFSDS96200 | |
| iPad mini | Apple | 6th generation A2567 | 3D scanner platform |
| iPadOS | Apple | 15.3 or superior | 3D scanner platform |
| Isolated Ethernet Cable | Corify Care SL | ACNET | Ethernet cable |
| Isoprenaline | Reig Jofre | 7227007 | |
| Left Connector Cable | Corify Care SL | ACCAB_L | Left cables |
| Location Reference Patch Kit | Boston Scientific | M004RAPATCH20 | |
| Location reference patch kit | Medtronic | AFR-00007 | |
| MetriQ Tubing Set | Boston Scientific | M0041170 | |
| Midazolam | Normon | X5XF1 | |
| Physiological Saline Solution for Irrigation | Fabrenius Kabi | br14801 | |
| Propofol | B Braun | 855437.9 OH | |
| Remifentanil | Kern pharma | 672786.7 | |
| RHYTHMIA HD | Boston Scientific | M004 RBINSTALL2ROW0 | |
| Right Connector Cable | Corify Care SL | ACCAB_R | Right cables |
| Single Patient Use ECG Electrodes | Ambu | M-00-S | |
| Sphere-9 mapping and ablation catheter | Medtronic | AFR-00001 | |
| Structure SDK | Structure | 2.2.1 for iOS or superior | 3D scanner platform, infrared structured light camera |
| Structure Sensor Pro | Structure | ST02B. Firmware version 1.2 or superior | 3D scanner platform, infrared structured light camera |
| Sugamadex Teva | Normon | 7340157-OH | |
| Tubing set | Medtronic | AFR-00002 | |
| WorkMate Claris System | Abbott | H700123 | |
| X-Ray C-Arm | Phillips | The system includes several components provided by the company |
参考文献
- Narayan, S. M., John, R. M. Advanced electroanatomic mapping: current and emerging approaches. Curr Treat Options Cardiovasc Med. 26 (4), 69-91 (2024).
- Raiman, M., Tung, R. Automated isochronal late activation mapping to identify deceleration zones: rationale and methodology of a practical electroanatomic mapping approach for ventricular tachycardia ablation. Comput Biol Med. 102, 336-340 (2018).
- Guichard, J. -. B., et al. Substrate mapping for ventricular tachycardia ablation through high-density whole-chamber double extra stimuli. JACC Clin Electrophysiol. 10 (7), 1534-1547 (2024).
- Takigawa, M., et al. Are wall thickness channels defined by computed tomography predictive of isthmuses of postinfarction ventricular tachycardia. Heart Rhythm. 16 (11), 1661-1668 (2019).
- Vázquez-Calvo, S., et al. Noninvasive detection of slow conduction with cardiac magnetic resonance imaging for ventricular tachycardia ablation. Europace. 26 (2), euae025 (2024).
- Sánchez-Somonte, P., et al. Scar channels in cardiac magnetic resonance to predict appropriate therapies in primary prevention. Heart Rhythm. 18 (8), 1336-1343 (2021).
- Roca-Luque, I., et al. Post-ablation cardiac magnetic resonance to assess ventricular tachycardia recurrence (PAM-VT study). Eur Heart J Cardiovasc Imaging. 25 (2), 188-198 (2023).
- Roca-Luque, I., et al. Ventricular scar channel entrances identified by new wideband cardiac magnetic resonance sequence to guide ventricular tachycardia ablation in patients with cardiac defibrillators. Europace. 22 (4), 598-606 (2020).
- Rudy, Y., Burnes, J. E. Noninvasive electrocardiographic imaging. Ann Noninvasive Electrocardiol. 4 (3), 340-359 (1999).
- Haissaguerre, M., et al. Noninvasive panoramic mapping of human atrial fibrillation mechanisms: a feasibility report. J Cardiovasc Electrophysiol. 24 (6), 711-717 (2013).
- Tsyganov, A., et al. Mapping of ventricular arrhythmias using a novel noninvasive epicardial and endocardial electrophysiology system. J Electrocardiol. 51 (1), 92-98 (2018).
- Pereira, H., Niederer, S., Rinaldi, C. A. Electrocardiographic imaging for cardiac arrhythmias and resynchronization therapy. Europace. 22 (10), 1447-1462 (2020).
- Duchateau, J., et al. Performance and limitations of noninvasive cardiac activation mapping. Heart Rhythm. 16 (3), 435-442 (2019).
- Cluitmans, M., et al. Validation and opportunities of electrocardiographic imaging: from technical achievements to clinical applications. Front Physiol. 9, 1305 (2018).
- Molero, R., González-Ascaso, A., Climent, A. M., Guillem, M. S. Robustness of imageless electrocardiographic imaging against uncertainty in atrial morphology and location. J Electrocardiol. 77, 58-61 (2023).
- Rodrigo, M., et al. Noninvasive assessment of complexity of atrial fibrillation: correlation with contact mapping and impact of ablation. Circ Arrhythm Electrophysiol. 13 (3), e007700 (2020).
- Invers-Rubio, E., et al. Regional conduction velocities determined by noninvasive mapping are associated with arrhythmia-free survival after atrial fibrillation ablation. Heart Rhythm. 21 (9), 1570-1580 (2024).
- Fambuena-Santos, C., et al. AF driver detection in pulmonary vein area by electrocardiographic imaging: relation with a favorable outcome of pulmonary vein isolation. Front Physiol. 14, 1057700 (2023).
- San Antonio, R., et al. Optimized single-point left ventricular pacing leads to improved resynchronization compared with multipoint pacing. Pacing Clin Electrophysiol. 44 (3), 519-527 (2021).
- Zacur, E., et al. MRI-Based Heart and Torso Personalization for Computer Modeling and Simulation of Cardiac Electrophysiology. Imaging for Patient-Customized Simulations and Systems for Point-of-Care Ultrasound. 10549, (2017).
- Bell, J. B., Tikhonov, A. N., Arsenin, V. Y. Solutions of ill-posed problems. Math Comput. 32 (144), 1320 (1978).
- Oster, H. S., Taccardi, B., Lux, R. L., Ershler, P. R., Rudy, Y. Electrocardiographic imaging: noninvasive characterization of intramural myocardial activation from inverse-reconstructed epicardial potentials and electrograms. Circulation. 97 (15), 1496-1507 (1998).
- Figuera, C., et al. Regularization techniques for ECG imaging during atrial fibrillation: a computational study. Front Physiol. 7, 466 (2016).
- Molero, R., et al. Improving electrocardiographic imaging solutions: a comprehensive study on regularization parameter selection in L-curve optimization in the atria. Comput Biol Med. 182, 109141 (2024).
- Hernández-Romero, I., et al. Local conduction velocity estimation during wavefront collisions and reentrant scenarios. 2022 Computing in Cardiology (CinC). , (2022).
- Rodrigo, M., et al. Technical considerations on phase mapping for identification of atrial reentrant activity in direct- and inverse-computed electrograms. Circ Arrhythm Electrophysiol. 10 (9), e005008 (2017).
- Guillem, M. S., et al. Noninvasive localization of maximal frequency sites of atrial fibrillation by body surface potential mapping. Circ Arrhythm Electrophysiol. 6 (2), 294-301 (2013).
- Pedrón-Torrecilla, J., et al. Noninvasive estimation of epicardial dominant high-frequency regions during atrial fibrillation. J Cardiovasc Electrophysiol. 27 (4), 435-442 (2016).
- Tzeis, S. 2024 European Heart Rhythm Association/Heart Rhythm Society/Asia Pacific Heart Rhythm Society/Latin American Heart Rhythm Society expert consensus statement on catheter and surgical ablation of atrial fibrillation. Europace. 26 (4), euae043 (2024).
- Parreira, L., et al. Noninvasive three-dimensional electrical activation mapping to predict cardiac resynchronization therapy response: site of latest left ventricular activation relative to pacing site. Europace. 25 (4), 1458-1466 (2023).
- Reventos-Presmanes, J., et al. Noninvasive electrocardiographic imaging for the characterization of complex atrial tachyarrhythmias. Europace. 25 (Supplement_1), (2023).
- Regany, M., et al. ECG imaging as a real time tool to guide left bundle branch pacing implant in patients with left bundle branch block and resynchronization therapy indication. Europace. 26 (Supplement_1), (2024).
- Rudy, Y. Noninvasive electrocardiographic imaging of arrhythmogenic substrates in humans. Circ Res. 112 (5), 863-874 (2013).
- Shah, A. J., et al. Validation of novel 3-dimensional electrocardiographic mapping of atrial tachycardias by invasive mapping and ablation. J Am Coll Cardiol. 62 (10), 889-897 (2013).
- Graham, A. J., et al. Evaluation of ECG imaging to map hemodynamically stable and unstable ventricular arrhythmias. Circ Arrhythm Electrophysiol. 13 (2), e007377 (2020).
- Pujol-Lopez, M., et al. Conduction system pacing vs biventricular pacing in heart failure and wide QRS patients. JACC Clin Electrophysiol. 8 (11), 1431-1445 (2022).
- Rudy, Y., Lindsay, B. D. Electrocardiographic imaging of heart rhythm disorders. Cardiac Electrophysiol Clin. 7 (1), 17-35 (2015).
- Haissaguerre, M., et al. Driver domains in persistent atrial fibrillation. Circulation. 130 (7), 530-538 (2014).
- Reventos-Presmanes, J., et al. Noninvasive assessment of the ventricular tachycardia isthmus during sinus rhythm. Europace. 26 (Supplement_1), (2024).
- Ros, S., et al. Imageless electrocardiographic imaging for atrial electrophysiological characterization: a validation study. Europace. 26, (2024).
- Wu, S., et al. Left bundle branch pacing for cardiac resynchronization therapy: nonrandomized on-treatment comparison with his bundle pacing and biventricular pacing. Can J Cardiol. 37 (2), 319-328 (2021).
- Pujol-López, M., et al. Stepwise application of ECG and electrogram-based criteria to ensure electrical resynchronization with left bundle branch pacing. Europace. 25 (6), euad128 (2023).
- Zhu, K., Chang, D., Li, Q. Which is more likely to achieve cardiac synchronization: left bundle branch pacing or left ventricular septal pacing. Front Cardiovasc Med. 9, 845312 (2022).
- Martinez-Perez, M., et al. Real-time assessment of LV synchrony in AV block population undergoing LBB pacing using ECG imaging. Europace. 26 (Supplement_1), (2024).
- Krummen, D. E., et al. Forward-solution noninvasive computational arrhythmia mapping: the VMAP study. Circ Arrhythm Electrophysiol. 15 (9), (2022).
- Gu, K., et al. Ablation of non-pulmonary vein atrial fibrillation drivers identified by vMap in addition to pulmonary vein isolation improves procedural outcomes. 29th annual AF Symposium 2024. , (2024).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。