Method Article
Noninvaziv Görüntüsüz Elektrokardiyografik Görüntüleme Sistemi ile Gerçek Zamanlı Kardiyak Haritalama
Bu Makalede
Özet
Bu çalışma, noninvaziv, görüntüsüz bir elektrokardiyografik görüntüleme sistemi kullanarak gerçek zamanlı kardiyak haritalama için yeni bir yaklaşım sunmaktadır. Bu sistem, işlem öncesi bilgisayarlı tomografi veya manyetik rezonans görüntüleme taramaları gerektirmeden elektrofizyolojik kardiyak haritaların elde edilmesini sağlayarak, ablasyon ve kardiyak resenkronizasyon tedavisi implantları gibi kardiyak prosedürler için verimli rehberlik sağlar.
Özet
Hızlı, güvenli ve etkili kardiyak haritalama, kompleks aritmilerin yönetimi için kritik öneme sahiptir, ancak mevcut yöntemler önemli sınırlamalarla karşı karşıyadır. 12 derivasyonlu elektrokardiyogram (EKG), ilk tanı için gerekli olmakla birlikte, kateter ablasyonu veya kardiyak resenkronizasyon tedavi cihazı implantasyonu gibi ileri prosedürlere rehberlik etmek için gereken uzamsal çözünürlük ve derinlikten yoksundur. Öte yandan, invaziv haritalama teknikleri ayrıntılı elektriksel aktivite sağlar, ancak birden fazla kateter yerleştirilmesini gerektirir, bu da prosedürel riskleri ve karmaşıklığı artırır. Bu yöntemler zaman alıcı, pahalıdır ve özellikle atriyal fibrilasyon (AF), kararsız aritmi ve kardiyak resenkronizasyon tedavisi (CRT) gibi dinamik aritmilerde sınırlı gerçek zamanlı değerlendirme sunar.
Bu çalışma, gerçek zamanlı, atımdan atıma kardiyak haritalar sağlayarak geleneksel yöntemleri tamamlamak için tasarlanmış noninvaziv, görüntüsüz bir elektrokardiyografik görüntüleme (Görüntüsüz-EKGI) sistemini tanıtmaktadır. İşlem öncesi görüntülemeye ihtiyaç duymadan, bu sistem tüm kalp boyunca yüksek çözünürlüklü elektriksel aktiviteyi yakalayarak invaziv haritalamaya daha güvenli ve daha verimli bir alternatif sunar. Görüntüsüz EKGI sistemi, yüzey kayıtlarının dolaysızlığını modern hesaplama modellerinin uzamsal doğruluğuyla birleştirerek, geleneksel EKG ile invaziv haritalama arasındaki boşluğu doldurur ve elektrofizyoloji laboratuvarlarındaki iş akışını potansiyel olarak dönüştürür.
Giriş
Özellikle atriyal fibrilasyon (AF) ve ventriküler taşikardi (VT) ablasyonu gibi karmaşık aritmi prosedürleri geçiren hastalarda veya kalp pillerinin ve kardiyak resenkronizasyon tedavisi (CRT) cihazlarının implantasyonu sırasında kardiyak aktivitenin doğru bir şekilde değerlendirilmesi için noninvaziv elektrofizyolojik haritalama ihtiyacı giderek daha önemli hale gelmiştir. Şu anda, üç boyutlu (3D) elektroanatomik haritalama (EAM), aritmileri 2,3 karakterize etmek için kapsamlı fonksiyonel haritalar sağlayarak kateter ablasyonu 1 sırasında operatörlere rehberlik etmek için altın standart olmaya devam etmektedir. Bununla birlikte, EAM, AF'nin dinamik uzay-zamansal paternlerini, sürekli olmayan aritmileri yakalamak için yetersizdir ve haritalama için gereken uzun süre ve invaziv prosedür, CRT prosedürlerinde kullanım için pratik değildir.
12 derivasyonlu elektrokardiyogram (EKG) gibi geleneksel noninvaziv yöntemler, spesifik aritmi odaklarını (örneğin, çıkış yolu veya doruk VT) tanımlamak için son derece doğru olsa da, kalbin küresel elektriksel davranışı hakkında sınırlı bilgi sunar. Bu sınırlama, özellikle başarılı sonuçlar için aritmojenik alanların hassas lokalizasyonunun çok önemli olduğu dinamik ve karmaşık aritmilere müdahalelere rehberlik etmek için gerçek zamanlı haritalama gerektiğinde belirgindir. Noninvaziv haritalama, işlem öncesi planlamayı geliştirmede ve elektrofizyolojik müdahaleler sırasında gerçek zamanlı geri bildirim sağlamada önemli bir rol oynayabilir.
Elektrofizyologları prosedür öncesi desteklemek için, bilgisayarlı tomografi (BT) ve manyetik rezonans görüntüleme (MRG) gibi kardiyak görüntüleme modalitelerindeki ilerlemelerin, duvar kalınlığı4 ve miyokardiyal fibroz 5,6,7,8 dahil olmak üzere ayrıntılı yapısal bilgi sağlamada etkili olduğu kanıtlanmıştır . Bununla birlikte, bu modaliteler anatomik ve yapısal özelliklere odaklanarak fonksiyonel elektriksel haritalamada bir boşluk bırakmaktadır. Ek olarak, yüksek kaliteli kardiyak görüntüler elde etmek, özellikle kardiyak fibrozu tespit etmek için özel tarama protokolleri, eğitimli personel ve gelişmiş segmentasyon ve hassas doku karakterizasyonu gibi karmaşık işlem sonrası yöntemler gerektirir.
Klasik elektrokardiyografik görüntüleme (EKGI) sistemleri, vücut yüzey potansiyellerine (BSP) dayalı olarak kardiyak elektriksel aktiviteyi yeniden yapılandırarak umut verici sonuçlar sunan, invaziv olmayan bir seçenek olarak ortaya çıkmıştır9,10,11,12. Potansiyellerine rağmen, EKGI sistemleri dikkate değer sınırlamalarla karşı karşıyadır13,14. İlk olarak, elektrot pozisyonlarını kardiyak geometriler üzerine haritalamak için işlem öncesi BT taramalarına ihtiyaç duyarlar ve bu da klinik rutin kullanımlarını daha az uygulanabilir hale getirir. İkincisi, kardiyak haritalamanın ters problemini çözmede kullanılan geleneksel düzenleme yöntemleri, genellikle fizyolojik olmayan yayılma paternlerini ortaya çıkararak klinik ortamlarda doğruluklarını sınırlar.
Bu çalışmanın amacı, Görüntüsüz EKGI olarak bilinen, BT veya MRI15'e ihtiyaç duymadan gerçek zamanlı haritalama yapabilen yeni bir noninvaziv EKGI sisteminin özelliklerini ve prosedürlerini tanımlamaktı. Imageless EKGI'nin ilerlemelerini araştırdık ve karmaşık aritmi prosedürlerinin yönetiminde EAM, 12 derivasyonlu EKG ve klasik EKGI gibi mevcut tekniklerin sınırlamalarının üstesinden gelerek elektrofizyolojik haritalama için potansiyel klinik uygulamalar sunduk. Bu yaklaşım, hastanın varışından birkaç dakika sonra kardiyak haritaların oluşturulmasını sağlayarak iş akışını kolaylaştırır ve hazırlık süresini azaltır. Ek olarak, sistem, doğru fizyolojik yayılma modelleri oluşturmak için gelişmiş sinyal işleme algoritmaları kullanır, aritmi lokalizasyonunu ve prosedürel sonuçları iyileştirir.
Protokol
Metodoloji, çok merkezli bir gözlemsel klinik çalışmada prospektif olarak doğrulanmıştır. Çalışma, Helsinki Bildirgesi'ne ve ilgili kurumların etik standartlarına uygun olarak yürütülmüştür. Çalışma protokolü, SAVE-COR (NCT05772182), Hospital Universitario Gregorio Marañón, Hospital Clínic de Barcelona ve Hospital Universitari i Politècnic La Fe Etik Kurulları tarafından onaylandı ve tüm hastalardan bilgilendirilmiş onam alındı.
NOT: Dahil etme ve hariç tutma kriterlerinin ayrıntılı açıklamaları şunlardır:
Dahil edilme kriterleri: (i) İnvaziv bir elektroanatomik çalışma ve / veya intrakaviter pacing cihazlarının implantasyonu için endikasyon. (ii) Çalışmaya dahil edilmek için bilgilendirilmiş onam almış ve imzalamış olmak.
Dışlama kriterleri: (i) <18 yaş. (ii) Endokardiyal kateterizasyon uygulanamama (ör., hamile veya emziren kadınlar). (iii) Bilgilendirilmiş onamı anlama ve kabul etme konusunda fiziksel veya zihinsel yetersizlik. (iv) EKGI sistemi için gerekli olan 3D gövde rekonstrüksiyonunu sağlamak için dik duramama. (v) Konjenital patolojileri olan hastalar.
1. İşlem öncesi gerçek zamanlı görüntüsüz EKGI sistemi hazırlığı
- Biyopotansiyel amplifikatörün (Şekil 1A) tam olarak şarj olduğunu doğrulayın ve elektrofizyoloji (EP) odası masasının sonuna, hastanın ayaklarının yerleştirileceği yere yakın bir yere yerleştirin.
NOT: Biyopotansiyel amplifikatör (Malzeme Tablosuna bakınız), elektrotlar tarafından toplanan elektrik sinyallerini yükseltmekten ve sayısallaştırmaktan sorumlu izole edilmiş 128 kanallı bir cihazdır. - Bir uçta amplifikatör konektörlerini ve diğer uçta sensör yeleğinin bağlı olduğu siyah soketleri kontrol ederek sağ ve sol kabloların hasar görmediğini doğrulayın (Şekil 1B).
NOT: Sağ ve sol kablolar (Malzeme Tablosuna bakın) 1.5 m uzunluğundadır ve elektrik sinyallerini sensör yeleğinden biyopotansiyel amplifikatöre iletir. - Sağ ve sol konektör kablolarını biyopotansiyel amplifikatöre takın (Şekil 1C). Her kablo, hem kablo hem de amplifikatör için aynı olan bir sayı ile ayırt edilen bir fiş ile ilişkilendirilir.
- 3D tarayıcı platformunun tamamen şarj olduğunu doğrulayın ve 3D tarama uygulamasını açın.
NOT: 3D tarama uygulaması, hastanın gövdesinin 3D model rekonstrüksiyonunu oluşturmak için kızılötesi yapısal ışık kamerası kullanan bir 3D tarayıcı platformunda ( Malzeme Tablosuna bakın) çalışan bir yazılımdır. Uygulama ayrıca elektrot hızlı yanıt (QR) kodlarının konumunu otomatik olarak algılar. - PC iş istasyonunda (Malzeme Tablosuna bakın) görüntüsüz EKGI yazılımı kullanıcı arayüzünün (UI) kurulu olduğunu ve şarjının tam dolu olduğunu doğrulayın.
NOT: Imageless EKGI yazılımı (Malzeme Tablosuna bakınız), kardiyak geometriyi tahmin etmek ve kardiyak aritmileri teşhis ve tedavi etmek veya kardiyak cihaz implantasyon prosedürlerine rehberlik etmek için değerli bilgiler sağlamak için sinyal işleme algoritmalarını içerir 16,17,18,19. Sistemin kullanıcı arayüzü, kullanıcıların elektrokardiyografik sinyalleri görselleştirmesine, seçmesine ve analiz etmesine olanak tanıyarak, kardiyak fonksiyonun invaziv olmayan değerlendirmesini sağlayan etkileşimli epikardiyal aktivite haritaları oluşturur. - Biyopotansiyel amplifikatörü yalıtılmış bir Ethernet kablosu kullanarak iş istasyonuna bağlayın (Malzeme Tablosuna bakın). Bir ucunu amplifikatörün Ethernet bağlantı noktasına ve diğer ucunu iş istasyonuna takın.
NOT: İzole edilmiş Ethernet kablosu, elektrik sinyallerini biyopotansiyel amplifikatörden iş istasyonuna iletir. - Bir sensör yeleği seçin ( Malzeme Tablosuna bakın), ambalajı inceleyin ve sızdırmazlığın hasarsız olduğunu doğrulayın. Ambalaj açılmış veya hasar görmüşse sensör yeleğini kullanmayın.
- Sensör yelek ambalajını açın ve dört yelek bileşeninin içeride olduğunu doğrulayın. Bileşenlerden biri eksikse başka bir sensör yeleği ambalajı seçin.
NOT: Sensör yeleği, hastanın tüm gövdesi boyunca yüzey elektriksel aktivitesinin aynı anda haritalanmasını sağlayan 128 gümüş elektrotlu yüksek yoğunluklu bir elektrot dizisidir. Yelek radyolüsenttir ve gövdenin ön ve arka sol ve sağ yüzeylerini kaplayan dört yama içerir. Her elektrotun ön tarafında, otomatik elektrot konumu tanımlamasına olanak tanıyan bir QR kodu bulunur.
2. İşlem öncesi hasta hazırlığı
- Hastayı elektrofizyolojik çalışma veya cihaz implantasyonu ile aynı gün hastaneye yatırın.
- Hastayı ayakta durarak veya bir sandalyeye veya EP masasına oturarak yerleştirin ve tüm gövde bölgesinde giysi bulunmadığından emin olun.
- Bu bölgelere elektrot takmaktan kaçınmak için hastanın kıyıları, yaraları veya başka herhangi bir cilt rahatsızlığı olup olmadığını kontrol etmek için hastanın cildinde görsel bir inceleme yapın.
- İsteğe bağlı olarak, gürültü artefaktlarını en aza indirmek ve sensör yeleğinin çıkarılması sırasında rahatsızlığı azaltmak için önemli tüylere sahip kişiler için gövdeyi tımar edin.
- Sensör yeleğinin dört parçasını (Ön Sağ, Ön Sol, Arka Sağ ve Arka Sol) hastanın gövdesine doğru bir şekilde yerleştirin (Şekil 2A) ve gerektiğinde elektrotlar arasındaki bağlantıları katlayarak yeleği hastanın boyutuna göre ayarlayın.
- İsteğe bağlı olarak, CRT prosedürleri için, genellikle sol üst göğüste bulunan kalp implantının yerleştirileceği alana elektrot yerleştirmekten kaçının.
NOT: Basılı tirelerle bağlantılar, bu alanlarda aktif iz bulunmadığından, gerekirse güvenli bir şekilde kesilebilir. - Sensör yeleğinin Sağ Bacak Tahrikli (RLD) ve referans (REF) elektrotlarını, diğer yelek elektrotlarından mümkün olduğunca uzağa sırasıyla sağ ve sol bacaklara yerleştirin.
- Yeterli oda aydınlatması sağlayın ve hastanın gövdesinin çevresinde 1,5 m çapında hiçbir nesnenin bulunmadığından emin olun, çünkü bunlar 3D gövde rekonstrüksiyonunu engelleyebilir veya bozabilir.
- Şekil 2C'de görüldüğü gibi 3D gövde rekonstrüksiyonuna müdahale etmeyi önlemek için hastayı kolları başının üzerine gelecek şekilde konumlandırın.
- Hastanın 3D gövde rekonstrüksiyonunu elde edin.
- 3D tarayıcı platformunu alın ve 3D tarama uygulamasını açın.
- Sensör yeleğini doğrulamak için Ön Sağ yelek bileşeninin yan tarafındaki QR kodunu tarayın (Şekil 2B), tek kullanımlık olduğundan ve son kullanma tarihi geçmediğinden emin olun.
NOT: QR kodu algılandıktan sonra, 3D tarama uygulaması, 3D gövde rekonstrüksiyonunun elde edilmesini sağlar. - 3D tarayıcı platformunu hastanın önünde gövde hizasına yerleştirin, iki elinizle sıkıca tutun ve 3D gövde rekonstrüksiyonunu elde etmek için hastanın etrafında 360°'lik bir dönüş yapın (Şekil 2C).
NOT: Tarama ilerledikçe, 3D tarayıcı platformundan gelen kızılötesi yapılandırılmış ışıklı kamera, gövdenin gri renkli kapalı bir 3D ağını oluşturur ve işlemi tam bir dönüşle tamamlar. Tipik olarak, 3D gövde rekonstrüksiyon işleminin tamamlanması 1-2 dakika sürer. - Tüm gövdenin gri bir gölgeyle kaplandığından ve yeniden yapılandırılmış ağda delik bulunmadığından emin olmak için 3D gövde rekonstrüksiyonunun görsel bir incelemesini yapın.
- Tarama bittiğinde 3D gövde rekonstrüksiyonunu uygulamaya kaydedin.
- Hastanın AP odası masasına uzanmasını sağlayın.
- Sensör yeleğinin dört parçasını ilgili sağ ve sol konektör kablolarına bağlayın (Şekil 1D). Ön-sağ ve arka-sağ yelek konektörlerini sağ kablo soketine ve ön-sol ve arka-sol yelek konektörlerini sol kablo soketine takın.
- Görüntüsüz EKGI yazılımının gerçek zamanlı elektrofizyolojik sinyalleri almasını sağlamak için biyopotansiyel amplifikatörü açın.
3. Hastanın kardiyak geometrisinin tahmini
- İş istasyonunda yüklü olan gerçek zamanlı Imageless ECGI yazılımında kullanıcı olarak oturum açın (Şekil 3). Bir kullanıcı adı ve parola girin.
- Hasta Ekle düğmesine tıklayın ve kullanıcı arayüzünün Ana Penceresinde yeni bir hastayı kaydetmek için kimlik bilgilerini girin (Şekil 4). Ardından, prosedür türünü ve aşağıdaki temel verileri sağlayarak hastayla ilişkili yeni bir oturum oluşturun: cinsiyet, yaş, boy ve kilo.
NOT: Tek bir hastada birden fazla seans olabilir. Örneğin takipli klinik çalışmalarda bir hastaya ikinci bir EKGI kaydı yapılırsa tekrar hasta eklenmeden yeni bir seans oluşturulabilir. - 3D tarayıcı platformunu bir USB-C kablosu kullanarak iş istasyonuna bağlayın.
- Gövde Taramayı Yükle düğmesine tıklayın ve 3B gövde rekonstrüksiyonunu Gövde Geometrisi Penceresine yükleyin (Şekil 5).
NOT: Yazılım, sensör yeleğinden 128 elektrotun lokalizasyonunu otomatik olarak algılayacaktır. Her yelek bileşeninin farklı elektrot renkleri vardır: Ön Sağ = kırmızı, Ön Sol = mavi, Arka Sağ = pembe ve Arka Sol = turuncu. - İsteğe bağlı olarak, her bir elektroda tıklayarak ve gövde yüzeyinde yeniden konumlandırarak elektrot konumlarını manuel olarak ayarlayın.
- Gövde Geometrisi Penceresinde hastanın kardiyak geometrisini tahmin etmek için Geometriyi Hesapla düğmesini ve Kalp Geometrisini Tahmin Et seçeneğini seçin (Şekil 5).
NOT: Yazılım, önceki literatür20'de ayrıntılı olarak açıklandığı gibi, istatistiksel şekil modeline (SSM) (Şekil 6A) dayalı bir metodoloji kullanarak kardiyak geometriyi tahmin eder. Algoritma önce hastanın 3D gövde rekonstrüksiyonunu ve bazal verilerini (cinsiyet, yaş, boy ve kilo) girdi olarak işler. Daha sonra, MRG tabanlı gövde ve kardiyak geometrileri içeren SSM, hastanın 3D gövde ağına uyacak şekilde yinelemeli olarak ayarlanır. Bu, hastanın vücudundaki optimal kalp geometrisini, pozisyonunu ve oryantasyonunu belirler (Şekil 6B). Bu işlem, işlem öncesi BT veya MRG ihtiyacını ortadan kaldırarak 10-15 dakika içinde ilk noninvaziv kardiyak haritanın oluşturulmasını sağlar. Bir açılır mesajın, 3B gövde rekonstrüksiyonunun yeterli çözünürlüğe sahip olup olmadığını veya tahmin sonuçlarının doğruluğunu etkileyebilecek herhangi bir artefakt içerip içermediğini kullanıcıya bildirdiğine dikkat etmek önemlidir.
4. Gerçek zamanlı olarak kardiyak resenkronizasyon tedavisi (CSP-CRT) için iletim sistemi pacing implantına rehberlik etmek için noninvaziv görüntüsüz EKGI haritalaması (vaka 4)
- Şuraya gidin: Amplifier Penceresine gidin ve gerçek zamanlı elektrofizyolojik sinyalleri almaya başlamak için Amplifikatörü Bağla düğmesine tıklayın (Şekil 7). Amplifikatör ekranındaki sinyalleri görselleştirmek için farklı uçlara tıklayın.
- Gerçek zamanlı noninvaziv kardiyak haritalama elde etmek için Gerçek Zamanlı Pencereye (Şekil 8) gidin.
NOT: Gerçek Zamanlı Pencere, gerçek zamanlı sinyallerin görselleştirilmesini sağlar, gürültülü sinyalleri hariç tutar, geçici oluşturucular oluşturur, analiz segmentlerini otomatik olarak tanımlar (örneğin, P dalgası ve QRS kompleksi) ve noninvaziv EKGI haritalarını hesaplar ve görüntüler. - 128 uçlu görünüm düğmesine tıklayarak, gürültülü müşteri adayları seçim modu olarak Yalnızca Kullanıcı seçeneğini seçerek ve ECGI haritasını oluşturmadan önce hariç tutmak için gürültülü sinyallere çift tıklayarak gürültülü sinyalleri hariç tutun. Bu, EKGI kötü niyetli bir problem olduğu için haritalama hesaplama kalitesini artırır21.
NOT: Yeşil renkle gösterilen sensör yelek uçları iyi kaliteli sinyalleri gösterir ve ters problem hesaplaması için kullanılırken, kırmızı ile gösterilen uçlar gürültülüdür ve analizden çıkarılır (Şekil 8A). - Tahmini 12 derivasyonlu EKG'yi gerçek zamanlı olarak görselleştirmek için 12 derivasyonlu görünüm düğmesine tıklayın (Şekil 8B).
- Sinyal analizi bölümündeki sinyalleri otomatik olarak güncellemek için RT ON düğmesinin etkin olduğundan emin olun (Şekil 8C). Bu seçenek, analiz edilecek QRS kompleksinin başlangıcını ve ofsetini otomatik olarak tetikler ve tanımlar.
NOT: RT düğmesi, sinyalleri dondurmak için RT KAPALI moduna geçirilebilir, bu da sistemin otomatik tanımlaması yetersiz olduğunda kullanıcının QRS kompleksini manuel olarak tanımlamasına olanak tanır. - CSP-CRT prosedürü için otomatik olarak en uygun bazal ritim haritasını oluşturmak için Seçenekler düğmesine tıklayarak EKGI aktivasyon eşleme analizini yapılandırın:
- Yalnızca ventrikülleri eşlemek için Ventrikülü Analiz Et seçeneğini seçin.
- Aktivasyon Süreleri Algoritması için dalgacık tabanlı17 analiz seçeneğini seçin.
- Son 10 QRS kompleksinin ortalama dalgasını hesaplamak için Eşleme Türü özelliği için Ortalama Vuruş seçeneğini seçin.
- Ofset Düzeltme, Vuruş Numarası ve Senkronizasyon Seçeneği özellikleri için varsayılan ayarları değiştirmeyin.
- Harita görselleştirme bölümünde iki panel seçeneğini belirleyin ve sol haritanın Güncelleme moduna ayarlandığından emin olun, böylece analiz edilen her yeni ortalama QRS kompleksi ile sürekli olarak güncellenir.
- Sol tarafta bi-ventriküler bazal Aktivasyon haritasını görselleştirin (Şekil 8D sol panel). Sistem, sınır elemanı yöntemi 22,23,24'e dayalı olarak kalbin epikardiyal elektriksel aktivitesini yeniden yapılandırmak için gövde ve kalp ağları arasındaki transfer matrisini otomatik olarak hesaplar.
NOT: Aktivasyon haritası, kardiyak epikardiyum boyunca depolarizasyonun zamansal ilerlemesini gösterir, aktivasyon kökenlerini belirlemeye ve yeniden giriş veya odak modellerini belirlemeye yardımcı olur. Aktivasyonlar, (1) yeniden yapılandırılmış her bir elektrogramın, tüm negatif eğim süresi örnekleri ve o andaki eğimle orantılı genlik için bir sinüzoidal dalgacıklar toplamına dönüştürülmesi ve (2) dönüştürülen sinyalin maksimum genliğinin anının aktivasyon süresi17 anı olarak seçilmesiyle hesaplanır. - Adı yazın ve Haritayı Kaydet düğmesine tıklayarak bazal haritayı kaydedin ve tekrarlanabilir olduğunda haritayı Dondurma moduna geçirin. Tekrarlanabilir bir EKGI haritası, en az üç ardışık haritada tutarlı aktivasyon süresine ve yayılma modellerine sahiptir.
NOT: CSP-CRT prosedürlerinde, bazal harita (Şekil 12A), septal bölgedeki elektrot vidalama işlemi sırasında sol demet dal alanına ulaşana kadar bi-ventriküler senkronizasyonu değerlendirmek için bir referans görevi görecektir (Şekil 12C). - Septal bölgedeki vidalama ve pacing işlemi sırasında en uygun haritaları elde etmek için Seçenekler düğmesine tıklayarak EKGI aktivasyon haritalama analizini yapılandırın:
- Yalnızca ventrikülleri eşlemek için Ventrikülü Analiz Et'i seçin.
- Aktivasyon Süreleri Algoritması için dalgacık tabanlı analiz seçeneğini seçin.
- Farklı septal pozisyonlarda eşzamanlı vidalama ve pacing işlemi sırasında elektrokardiyografik sinyallerdeki değişiklikleri yakalamak üzere tek bir vuruşun dalgasını analiz etmek için Eşleme Türü için tek vuruş seçeneğini seçin.
- Ofset Düzeltme, Vuruş Numarası ve Senkronizasyon Seçeneği özellikleri için varsayılan ayarları değiştirmeyin.
- Vidalama işlemi sırasında yeni analiz edilen her tek vuruşlu QRS kompleksi ile sürekli olarak güncellendiğinden emin olmak için sağ panel haritasını Güncelleme moduna ayarlayın.
- Bağlantılı Değerler menüsünü kullanarak sağ panel haritasının renk haritası aralığını bazal harita ile senkronize edin ve Bağlantılı Kamera menüsü aracılığıyla kamera konumlarını bağlayın (Şekil 8D sağ panel).
NOT: Kurşun septal bölgede vidalandığından, atımdan atıma EKGI haritaları çeşitli pozisyonlarda otomatik olarak oluşturulur (yani, sağ ventrikül septumu, orta septum, derin septum ve sol demet dalı). Bu haritalar, değerlendirilen tüm ECGI haritalarında renk haritası aralığı standartlaştırılarak bazal harita ile karşılaştırılır (Şekil 12B, C). Bu kurulum, uç vidalanırken aktivasyon modellerindeki değişikliklerin net bir şekilde görselleştirilmesini sağlar. - Adı yazın ve septal bölgedeki vidalama işlemi sırasında aktivasyon modelinde bir değişiklik gözlemlendiğinde Haritayı Kaydet düğmesine tıklayarak her haritayı kaydedin ve sol demet dal alanına ulaşılana kadar devam edin.
5. Ek noninvaziv görüntüsüz EKGI haritalama analizi
NOT: Kardiyak substratı değerlendirmek, aritmileri karakterize etmek, CRT'yi değerlendirmek veya prosedürler sırasında klinik olarak ilgili ölçümleri çıkarmak için bilgisayarlı EKGI sinyallerinden farklı kardiyak haritalar türetilebilir. Oluşturulabilecek haritaların türü, hem düzenli hem de düzensiz ritimler için farklı yaklaşımlarla analiz edilen spesifik kardiyak ritme bağlıdır.
- Elektrofizyolojik prosedür sırasında hastaların sergileyebileceği farklı ritimleri analiz etmek için Gerçek Zamanlı penceresinin sinyal analizi bölümünü kullanın:
- Hasta sinüs ritmi, atriyal veya ventriküler pacing, atriyal çarpıntı veya ventriküler taşikardi gibi stabilize/düzenli bir ritimde olduğunda, tek vuruş veya ortalama vuruş analizini Eşleme Türü özelliği olarak ayarlayarak düzenli ritimleri analiz edin. Düzenli ritim analizinden Aktivasyon haritasını ve İletim Hızı (CV) haritasını hesaplayın.
- Hasta atriyal fibrilasyondayken Haritalama Türü özelliği olarak düzensiz ritim atım analizini kullanarak düzensiz ritmi analiz edin. Sistem, QRST komplekslerini bastırmak ve AF'nin dinamik uzay-zamansal modellerini yakalamak için genişletilmiş AF segmentlerinin (örn. 1 dakika) seçilmesini sağlar. Düzensiz ritim analizinden Faz haritası, Rotor Histogram haritası ve Baskın Frekans haritasını hesaplayın.
- İsteğe bağlı olarak, harita seçiminin açılır menüsüne basın ve düzenli bir ritim analiz edilmişse Aktivasyon haritasını seçin. Ayrıntılı bir Etkinleştirme haritası açıklaması için adım 4.8'e bakın.
- İsteğe bağlı olarak, harita seçiminin açılır menüsüne basın ve düzenli bir ritim analiz edilmişse İletim Hızı haritasını seçin.
NOT: İletim hızı, aktivasyon haritasından türetilen bir metriktir. Bu metrik, bir dalga cephesinin epikardın her bir bölgesinden geçmesi için geçen süreyi temsil eder. CV hesaplaması, etkili yayılma bölgelerini belirlemek için uygulanan hız vektör alanları ile kardiyak yüzeyler boyunca aktivasyon zaman haritalarının uzamsal gradyanlarına dayanır. Düzgün yönlü vektörlere sahip alanlar, kararlı elektrik yayılımını gösterirken, etkisiz yayılımı gösteren açısal eşitsizliklere sahip bölgeler, bir Radyal Temel Fonksiyon25 kullanılarak enterpolasyona tabi tutulur. CV, aritmi nüks oranları17 ile ilgili substrat haritalaması sırasında iletim yavaşlama alanlarının belirlenmesine izin verir. - İsteğe bağlı olarak, harita seçiminin açılır menüsüne basın ve düzensiz bir ritmi analiz ederken Faz haritasını seçin.
NOT: Faz haritası, miyokardın tanımlanmış bir bölgesinin zaman içindeki aksiyon potansiyeli boyunca ilerlemesini izler. Bu tür bir harita, kardiyak potansiyelin ilerlemesini temsil ettiği için dinamiktir. Faz haritasında, EKGI sinyalinin fazını hesaplamak için Hilbert Dönüşümü uygulanır. Her faz, sinyalin her döngüsü boyunca aksiyon potansiyelinin belirli bir durumuna karşılık gelir (dinlenme için π, depolarizasyon için π/2, plato için 0 ve repolarizasyon için -π)26. - İsteğe bağlı olarak, harita seçiminin açılır menüsüne basın ve düzensiz bir ritmi analiz ederken Rotor Histogram haritasını seçin.
NOT: Bir Faz haritasından türetilen bir Rotor Histogram haritası, yoğun yeniden giriş aktivitesine sahip alanlar olan ve kırmızı ile gösterilen faz tekilliklerinin en sık görülen konumlarının bir temsilidir. Kısaca, faz tekillikleri, fazın -π'dan π'ye kaydığı kilit noktalar olarak tanımlanır. Çevrelerindeki fazların kademeli bir uzamsal ilerlemesini göstermeyen PS'ler atılır. Son olarak, Rotor Histogram haritası18'i elde etmek için her rotor için dönüş sayısı ölçülür. Algoritmanın AF sırasında yayılma paternlerini ve yeniden girişleri sergileyen spesifik bölgeleri belirlemedeki hassasiyeti, endokardiyal haritalamaya karşı sistematik olarak değerlendirilmiş ve %71'lik bir korelasyon göstermiştir16. - İsteğe bağlı olarak, harita seçiminin açılır menüsüne basın ve düzensiz bir ritmi analiz ederken Baskın Frekans (DF) haritasını seçin.
NOT: DF haritaları, zaman içinde her bir kardiyak bölgedeki baskın elektrik frekansını göstererek, AF'nin itici gücü olarak hizmet edebilecek hızlı elektriksel aktivite alanlarını belirlemeye yardımcı olur. DF, Welch periodogramı27,28'de en yüksek güç spektral yoğunluğuna sahip frekans olarak hesaplanmıştır. Analizi, atriyum içindeki fibrilatuar aktivitede yüksek stabilite veya değişkenliğe sahip alanların tespit edilmesini sağlar. Baskın frekansların zamansal dağılımını değerlendirmek, en ilgili elektriksel aktivitenin net ve nicel bir temsilini sağlamak ve anormal davranışa sahip bölgelerin tanımlanmasını kolaylaştırmak için bir histogram kullanılır.
Sonuçlar
Durum 1 - Atipik bir atriyal flutterın kateter ablasyonunun planlanması ve yönlendirilmesi
Bu olgu, hipertansiyon, sigara, kalp kapak hastalığı, EHRA IIb sınıflaması öyküsü olan ve 12 derivasyonlu EKG'ye göre atipik atriyal flutter'a (AFL) bağlı kateter ablasyonu endikasyonu olan CHA2DS 2-VASc skoru 1 olan 59 yaşında erkek (vücut kitle indeksi -VKİ-30) bir hastadır (Şekil 9A). Hastanın daha önce kateter ablasyonu öyküsü yoktu. İşlem öncesi geç gadolinyum tutulumu MG (LGE-MRG) sonucunda sol atriyum (LA) arka duvarında yaygın fibrozis saptandı, normal LA planimetrisi 24 cm² ve korunmuş sol ventrikül ejeksiyon fraksiyonu (LVEF) %54 idi.
Noninvaziv görüntüsüz EKGİ, kateter girişinden sadece birkaç dakika önce femoral kılıf yoluyla yapıldı. Analiz için QRST komplekslerinden arınmış tam bir AFL döngüsü (209 ms) seçildi. Haritalama, mitral kapak (MV) etrafında bir makro reentrant devre ortaya çıkardı ve perimitral çizgiyi aritmi sonlandırma için optimal ablasyon hedefi olarak belirledi (Şekil 9B). Bunu takiben, noninvaziv Imageless EKGI'de gözlenen yayılma paternini doğrulayan temas tabanlı EAM (Şekil 9C) gerçekleştirildi. Perimitral hat boyunca ablasyon aritmiyi başarıyla sonlandırdı.
Bu klinik durumda, aritmi invaziv EAM'den önce doğru bir şekilde karakterize edildi, bu da aritmi yayılma paterninin hassas bir şekilde lokalizasyonunu sağladı ve ablasyon prosedürünü kolaylaştırdı. Bununla birlikte, AFL veya fokal taşikardi gibi karmaşık atriyal taşikardi için Imageless ECGI, gerçek zamanlı, tek atımlı haritalama sunarak, sürekli olmayan aritmi vakalarında özellikle değerli kılar. Bir prosedür sırasında aritmi modellerindeki değişikliklere uyarlanabilirliği, hassas ve dinamik haritalama sağlar. Ayrıca, saat yönünün tersine AFL'nin teşhisi genellikle 12 derivasyonlu bir EKG'den basit olsa da, karmaşık taşiaritmilerin mekanizmasını tam olarak bulmak ve tanımlamak zor olabilir. Sonuç olarak, Görüntüsüz EKGI'nin tıbbi konsültasyonda veya dakikalar önce gerçekleştirilmesi, kateter ablasyon planlaması için yukarı akış rehberliği sağlayarak ve gereksiz transseptal yaklaşımları ortadan kaldırarak prosedürel güvenliği ve verimliliği artırabilir.
Vaka 2 - Kalıcı atriyal fibrilasyonun kateter ablasyonu sırasında faz tekilliklerinin evrimi
Bu olgu 63 yaşında bir erkek hastadır (VKİ 31) ve korunmuş sol ventrikül ejeksiyon fraksiyonu (LVEF, %55), dilate LA yoktu ve New York Kalp Derneği (NYHA) tarafından persistan AF nedeniyle kateter ablasyonu için endike edildi. İşlem öncesi BT veya MRG görüntülemesi yapılmadı. Hastanın daha önce Aralık 2019'da pulmoner ven izolasyonu (PVI) için kateter ablasyonu öyküsü vardı.
Varışta, hasta AF'deydi. Ablasyon prosedürü boyunca görüntüsüz EKGI kullanılarak substrat haritalaması yapıldı (Şekil 10A). Başlangıçta, EKGI sağ atriyal (RA) lateral duvar, sağ atriyal apendiks (RAA) tabanı, sol atriyal arka duvar (PW) ve sol atriyal apendiks (LAA) tabanında faz tekillikleri tanımladı. Bu bulgular endokaviter kateterler kullanılarak gözlenen yüksek frekanslı ve parçalı EGM'ler ile korelasyon gösterdi ve yeterli PVI, LA EAM rekonstrüksiyonu ile doğrulandı. LAA tabanında darbeli alan ablasyonu (PFA) başlatıldı ve AF'den atipik AFL'ye bir ritim değişikliği ile sonuçlandı. Görüntüsüz EKG'de perimitral AFL saptandı ve bu durum koroner sinüs kateterinin distal polünden sürüklenme ile doğrulandı. Mitral hat oluşturuldu; bununla birlikte, AF yeniden indüklendi. Daha sonra, tam PW izolasyonu sağlandı. Buna rağmen, görüntüsüz EKGI, RAA tabanında önemli faz tekilliklerini tanımlamaya devam etti. Bu bölgeyi hedef alan çok sayıda PFA uygulamasını takiben sinüs ritmi elde edildi (Şekil 10B).
Bu klinik vaka, atriyumdaki elektriksel aktivitenin yüksek değişkenliği nedeniyle AF'nin nasıl benzersiz zorluklar sunduğunun bir temsilidir. Görüntüsüz EKGI, ablasyon sırasında AF ilerlemesinin mekansal-zamansal modellerini etkili bir şekilde yakaladı ve SR elde edilene kadar substrat modifikasyonuna rehberlik etmek için üç adede kadar noninvaziv harita elde edildi. Pulmoner ven izolasyonu gibi standart tedaviler nispeten yüksek nüks oranlarına sahiptir29. AF tedavisindeki temel zorluklar iki alanda yatmaktadır: (1) hangi hastaların tek başına PVI'den fayda göreceğini belirlemek ve (2) daha geniş bir yaklaşıma ihtiyaç duyanlar için, ablasyonu aritmi nüksünü en etkili şekilde azaltacak PVI alanı dışındaki bölgeleri belirlemek. Sinüs ritmi sırasında, Imageless ECGI, PVI ablasyon başarısını tahmin etmede yararlı olduğu kanıtlanmış CV haritaları oluşturma yeteneğini göstermiştir17. Bununla birlikte, bu durumda, görüntüsüz EKGI, AF dinamik modellerini aynı anda yakalayarak klinisyenlere AF'nin nasıl yayıldığına dair kapsamlı bir görünüm sağlar ve aritmiye neden olan kilit bölgeleri belirlemeye yardımcı olur. Sonuç analizi, AF ablasyon stratejilerini optimize etmedeki faydasını daha da doğrulamak için, ablasyonlu Görüntüsüz EKGI ile tespit edilen AF sürücüleri ile uzun süreli aritmisiz sağkalım gibi klinik uç noktalar arasındaki korelasyona odaklanmalıdır.
Durum 3 - Kardiyak resenkronizasyon tedavisi için biventriküler pacing optimizasyonuna rehberlik etme
Bu olgu, non-iskemik dilate kardiyomiyopatisi olan, LVEF'si %25 olan, işlem öncesi MRG'de geç gadolinyum tutulumu bulgusu olmayan, başlangıç EKG'sinde sol dal bloğu (LBBB) ve QRS süresi 156 ms olan 67 yaşında bir kadın hastadır. Hasta KRT'nin bir parçası olarak biventriküler pacing (BiVP) için endike edildi.
Kardiyak CRT prosedürü sırasında, kalp pili implantasyonu öncesi ve sonrası ventriküler senkronizasyonu değerlendirmek için gerçek zamanlı görüntüsüz EKGI kullanıldı. Başlangıç ritminde, hastanın en son aktivasyon bölgesi, Şekil 11A'da gösterildiği gibi sol ventrikülün (LV) bazal-lateral duvarında tanımlandı. Ventriküler toplam aktivasyon süresi (TAT) 116 ms'de ölçüldü ve bu da önemli ventriküler asenkroniyi gösterdi. Farklı cihaz konfigürasyonları EKGI kullanılarak değerlendirildi, optimal kurulum, LV derivasyonunun distal ve proksimal kutuplarının eşzamanlı aktivasyonu ve 140 ms'lik bir atriyoventriküler gecikme kullanılarak BiVP olarak belirlendi. Şekil 11B'de gösterildiği gibi, üç ventriküler pacing noktası, 70 ms'lik gelişmiş bir TAT ile başarılı bir senkronizasyonu gösteren geç aktive edilmiş bölgelerle sonuçlanmadı.
Kardiyak resenkronizasyon tedavisi, kalp yetmezliği ve uzamış QRS'li hastalarda ventriküllerdeki elektriksel koordinasyonu yeniden sağlamayı ve kalp fonksiyonunu iyileştirmeyi amaçlar. Bu durumda, Imageless ECGI, CRT prosedürü sırasında BiVP optimizasyonuna rehberlik etmede anahtar olan gerçek zamanlı haritalama sağladı. Ventriküler aktivasyon modellerinin hassas bir şekilde değerlendirilmesini sağladı ve tam ventriküler senkronizasyon sağlayarak optimal cihaz konfigürasyonunun belirlenmesine yardımcı oldu. ECGI'nin noninvaziv doğası ve anında geri bildirimi, klinisyenlerin kurşun programlamayı iyileştirmesine izin verdi. Buna karşılık, çalışmalar EKGI'nin en son aktive edilen bölge30'un yakınında sol ventrikül kurşun yerleşimine rehberlik etmedeki değerini vurgularken, anatomik kısıtlamalar uygulanabilirliğini sınırlayabilir. TAT gibi EKGI ile belirlenen bazal ve son resenkronizasyon parametreleri, semptom iyileşmesi ve uzun süreli ventriküler fonksiyon dahil olmak üzere hastanın zaman içinde CRT'ye klinik yanıtını izleyerek klinik sonuçlarla ilişkili olmalıdır.
Durum 4 - Gerçek zamanlı olarak kardiyak resenkronizasyon tedavisi için kılavuz iletim sistemi pacing implantı
Bu klinik olgu, ciddi ventrikül disfonksiyonu (LVEF %15) ve QRS süresi 172 ms olan LBBB olan 45 yaşında bir kadın hastadır. Hasta, bir iletim sistemi (CSP) pacing yaklaşımı kullanılarak implante edilebilir bir kardiyoverted defibrilatör CRT için endike edildi.
Cihaz implantasyonu sırasında septal bölgede elektrot vidalama işlemi boyunca ventriküler senkronizasyonu izlemek için gerçek zamanlı görüntüsüz EKGI kullanıldı. Şekil 12'de gösterildiği gibi, temel EKGI haritası, LV'nin yan duvarını 133 ms'lik bir TAT ile en son aktive edilen alan olarak tanımladı. Elektrot vidalama sırasında atımdan atıma EKGI haritalaması, ventriküler senkronizasyonda ilerleyici iyileşmeler gösterdi ve sol demet dalına ulaşıldığında optimal senkronizasyon elde edildi ve bu da 95 ms'lik bir TAT ile sonuçlandı.
Bu vaka, gerçek zamanlı Imageless ECGI'nin bir CRT prosedürü sırasında LBBP implantasyonuna rehberlik etme potansiyelini göstermiştir. Tek atımlı, gerçek zamanlı haritalama yetenekleri, septal bölgedeki kurşun implantasyonunun her adımında ventriküler TAT analizine ve yeniden senkronizasyona izin verdi. Sistem, elektrokardiyografik CSP kriterlerindeki standardizasyon eksikliğini gideren hızlı, görsel ve yorumlanması kolay bir ölçüm sağladı. BiVP-CRT prosedürlerinde olduğu gibi, Imageless EKGI parametrelerinin klinik CRT yanıtı ile anlamlı korelasyon gösterip göstermediğini ve 12 derivasyonlu EKG prediktörleriyle nasıl karşılaştırıldığını belirlemek için daha ileri çalışmalara ihtiyaç vardır.
Vaka 5 - Ventriküler taşikardi kateter ablasyonunun planlanması ve yönlendirilmesi
Bu olgu iskemik kardiyomiyopatili, ciddi ventrikül disfonksiyonu (LVEF %15) olan 53 yaşında erkek (VKİ 25.4) olup, nüks VT nedeniyle NYHA sınıf II kateter ablasyon işlemine yönlendirilmiştir. İşlem öncesi yapılan MRG'de sol ventrikülün infero-bazal ve infero-medial segmentlerine lokalize yaygın endokardiyal fibrozis ve aritmojenik kanallar izlendi. Hastanın daha önce 2018 yılında VT kateter ablasyonu öyküsü vardı.
İşlem boyunca eş zamanlı görüntüsüz EKGI haritalaması (Şekil 13A) ve invaziv EAM (Şekil 13B) uygulandı. Kateter ablasyon işlemi, programlanmış stimülasyon kullanılarak sağ ventrikül (RV) apikal pacing ve VT indüksiyonu sırasında substrat bazlı haritalamayı içeriyordu. Görüntüsüz EKGİ, kateter yerleştirilmeden önce sinüs ritmi haritalaması sırasında LV'nin infero-bazal segmentinde iletimin yavaşladığı bir bölge tespit etti. Bu bulgu MRG'de gözlenen fibrozis ile uyumluydu. Sağ ventrikül (RV) apeksinden müteakip pacing, LV'nin bazal ve medial segmentlerinde iletim yavaşlamasını doğruladı ve bu alanı olası aritmojenik substrat olarak tanımladı. Hemodinamik instabilite nedeniyle kardiyoversiyon gerektiren 380 ms döngü uzunluğuna sahip bir VT kısa bir süre indüklendi. Sonuç olarak, yalnızca sınırlı sayıda EAM puanı elde edildi. Bununla birlikte, tek bir VT döngüsü kullanarak, görüntüsüz EKGI, tempolu haritalarda izokronal kalabalıklaşmanın gözlendiği aynı bölgede VT kıstağını başarıyla tanımladı.
Bu VT olgusunda gerçek zamanlı görüntüsüz EKGI kullanımı, VT yönetiminde iki ana klinik zorluğu başarıyla ele almıştır: (1) sinüs ritmi sırasında potansiyel ablasyon hedeflerinin kesin lokalizasyonu ve (2) hemodinamik instabilite ile VT'nin karakterizasyonu. Tek bir atımdan, VT isthmus hem substrat hem de aritmi aktivasyon haritalarında doğru bir şekilde tanımlandı. Sistem, operatörlerin ablasyondan önce veya ablasyon sırasında aritmojenik substratları tanımlamasını ve tek bir döngüden gerçek zamanlı olarak birden fazla indüklenebilir VT'yi karakterize etmesini sağladı.

Şekil 1: Görüntüsüz EKGI donanım bileşenleri. (A) Belirli kablo bağlantı portlarına sahip bipotansiyel amplifikatör. (B) Sağ ve sol kablolar, bir ucunda amplifikatör konektörleri ve diğer ucunda sensör yeleği soket konektörleri ile donatılmıştır. (C) Bipotansiyel amplifikatöre bağlı sağ ve sol kabloları gösteren konfigürasyon. (D) Sensör yeleğini kablo soketlerine bağlama prosedürünün şematik iş akışı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: 3D gövde rekonstrüksiyonu tarayıcı prosedürü. (A) Dört bileşenden (Ön-Sağ, Ön-Sol, Arka-Sağ, Arka-Sol) oluşan 128 uçlu gövde yüzey potansiyeli sensör yeleği, 3D rekonstrüksiyon öncesinde hastanın gövdesine yerleştirilir. Her elektrotun otomatik tanımlama için benzersiz bir QR kodu vardır. Elektrotlar arasındaki bağlantılar, yeleği hastanın vücut şekline uyacak şekilde katlanabilir. (B) Sağ Ön bileşendeki QR kodu, yeleği doğrulayarak 3D tarayıcı uygulamasının gövde rekonstrüksiyonunu başlatmasını sağlar. (C) 3D tarayıcı uygulaması aracılığıyla 3D tarayıcı platformu, kızılötesi yapılandırılmış bir ışık kamerası kullanarak yeniden yapılandırılmış gövdeyi oluşturur. Kısaltmalar: FR: ön sağ; FL: ön sol; BR: sağ arka; ve BL: sol arka. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 3: Yazılım erişimi için belirlenmiş bir kullanıcı adı ve parola gerektiren görüntüsüz EKGI kullanıcı arayüzü oturum açma ekranı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
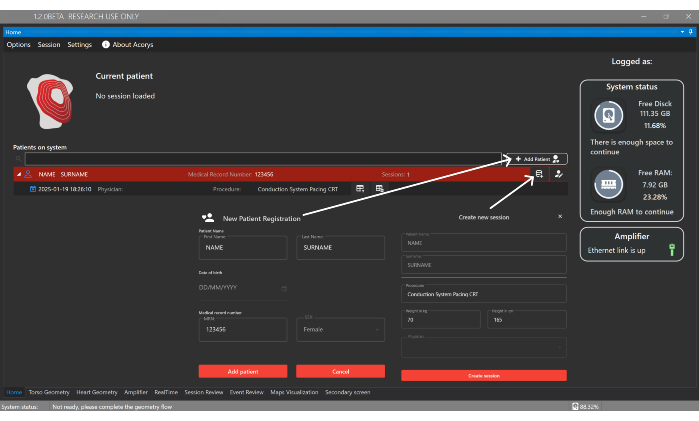
Şekil 4: Ana pencere. Ana pencere , hastaların, doktorların ve kullanıcıların yönetiminin yanı sıra hasta oturumlarının yapılandırılmasını da sağlar. Ayrıca, içe aktarılan oturumlar ve sistemin ve amplifikatörün durumu hakkındaki bilgileri de görüntüler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
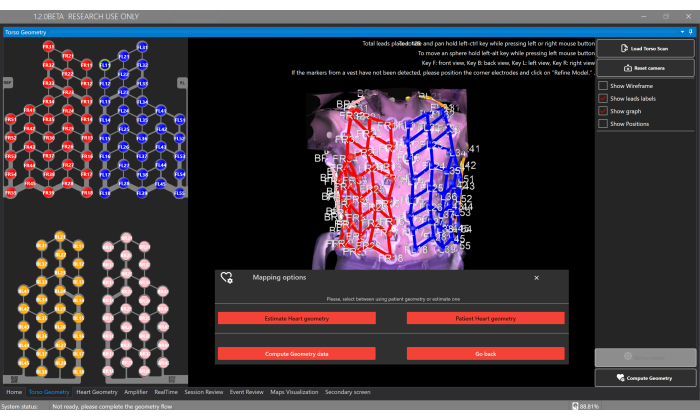
Resim 5: Gövde geometrisi penceresi. Gövde Geometrisi penceresi, kullanıcıların 3B gövde modelini, segment elektrotlarını yüklemesine ve görüntülemesine ve kişiselleştirilmiş CT/MRI'dan tahmin yapılmasını veya segmentasyon sağlamasını sağlayan Geometriyi Hesapla düğmesi aracılığıyla kalp geometrisi türünü seçmesine olanak tanır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
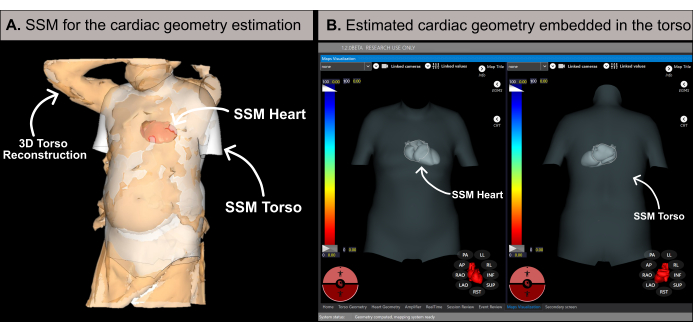
Şekil 6: Kardiyak geometri tahmini. (A) Kardiyak geometriyi tahmin etmek için bazal özellikleri ve hastanın 3D gövde rekonstrüksiyonunu kullanan SSM algoritması. (B) Antero-posterior (sol taraf) ve postero-anterior (sağ taraf) görünümleri gösteren gövdenin SSM'si içindeki tahmini kardiyak geometri. Kısaltmalar: 3D: üç boyutlu; SSM: istatistiksel şekil modeli. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
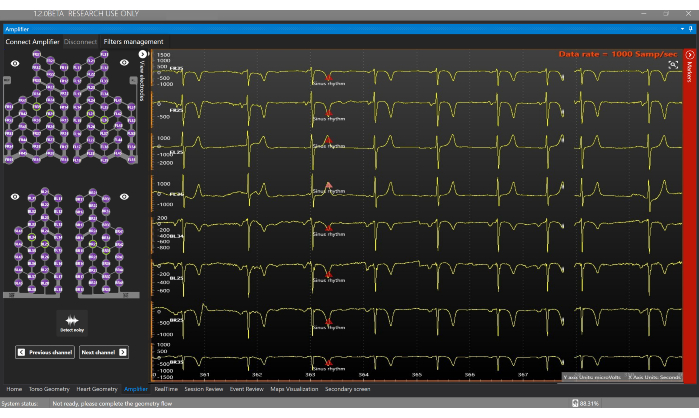
Şekil 7: Amplifikatör penceresi. Amplifikatör penceresi, Sensör Yeleğinin her bir elektrotundan elde edilen sinyallerin gerçek zamanlı olarak görselleştirilmesini sağlar. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 8: Gerçek zamanlı pencere. (A) Yüksek yoğunluklu elektrot dizisi yeleğinden aktif uçların şematik gösterimi. Yeşil elektrotlar kaliteli sinyaller içerirken, kırmızı elektrotlar gürültülü sinyaller içerir ve ters problem hesaplamasına katılmazlar. (B) Elektrokardiyogramın 12 ucunun gerçek zamanlı olarak tahmini. (C) QRS kompleksinin başlangıcının ve ofsetinin otomatik olarak tetiklenmesi ve tanımlanması (yeşil renkli pencere). Haritalama hesaplamasına katılan tüm müşteri adaylarının ortalama sinyali mavi renkle gösterilir. (D) Haritalar Görselleştirme bölümü tek, çift veya dört harita görünümlerini destekler. Bu örnek, bir CRT yordamı sırasında bazal ve sol dal ilerleme hızı (son harita) durumları için etkinleştirme haritaları içeren bir çift eşleme görünümünü gösterir. Bazal harita dondurma modundadır, statik kalırken, son harita güncelleme modundadır ve her yeni analiz edilen QRS kompleksi ile yeniden hesaplanır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
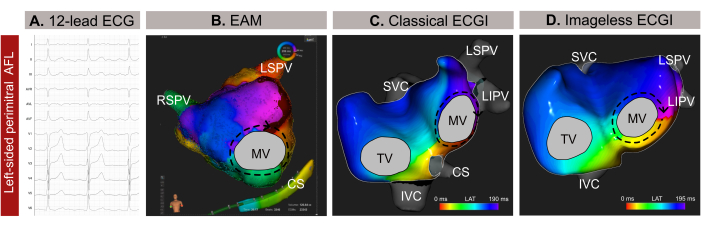
Şekil 9: Sol taraflı atipik bir AFL'nin grafiksel örneği ve 12 derivasyonlu EKG, görüntüsüz EKGI ve invaziv EAM'nin farklı tanı kapasiteleri. (A) Atipik AFL'nin 12 derivasyonlu EKG sinyalleri, V1'de pozitif supraventriküler dalgalar sunar. (B) Bir SSM'den tahmini bir kardiyak geometri kullanan ve antero-posterior bir görünüm gösteren görüntüsüz EKGI. Yayılma devresi, perimitral AFL için tipik bir model olan MV'nin etrafındaki tüm renkleri gösterir. (C) EAM'den türetilen ve bir antero-posterior görünüm gösteren lokal aktivasyon haritalaması, MV etrafında bir makro yeniden girişi gösterir ve Görüntüsüz EKGI'den tanıyı doğrular. Kısaltmalar: EKG: elektrokardiyogram; EAM: elektroanatomik haritalama; EKGI: elektrokardiyografik görüntüleme. SVC: superior vena kava; IVC: inferior vena kava; CS: koroner sinüs; LSPV: sol superior pulmoner ven; RIPV: sağ inferior pulmoner ven; RSPV: sağ superior pulmoner ven. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
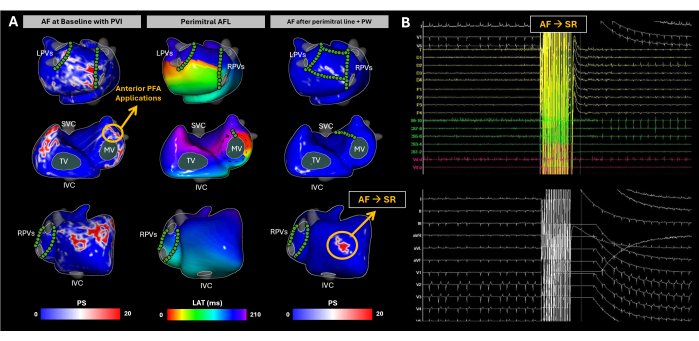
Şekil 10: Noninvaziv görüntüsüz EKGI haritalaması kullanılarak AF kateter ablasyonu sırasında atriyal substrat gelişiminin izlenmesi. (A) Görüntüsüz EKGI'nin Postero-Anterior, Antero-Postero ve Sağ Lateral görünümleri, PFA bölgeleri yeşil dairelerle işaretlenmiştir. Temel PS haritası, RA yan duvarı, RAA tabanı, LA arka duvarı ve LAA tabanındaki yeniden girişleri vurgular. LAA tabanındaki PFA, ritmi perimitral AFL'ye geçirdi. Mitral hat ve arka duvar izolasyonu tamamlanmasına rağmen AF spontan olarak tekrar indüklendi. EKGI, ablasyon hedefi haline gelen RAA tabanında PS'yi ortaya çıkardı. Bu bölgeye birden fazla PFA uygulaması yapıldı ve sinüs ritmi yeniden sağlandı. (B) AF anındaki 12 derivasyonlu EKG ve intrakardiyak sinyaller SR olarak değiştirildi. Kısaltmalar: SVC: superior vena kava; IVC: inferior vena kava; LPV'ler: sol pulmoner venler; RPV'ler: sağ pulmoner venler; AF: atriyal fibrilasyon, SR: sinüs ritmi, PS: faz tekillikleri, LAT: lokal aktivasyon süreleri, TV: triküspit kapak, MV: mitral kapak, PVI: pulmoner ven izolasyonu, AFL: atriyal çarpıntı, PW: arka duvar ve PFA: darbeli alan ablasyonu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
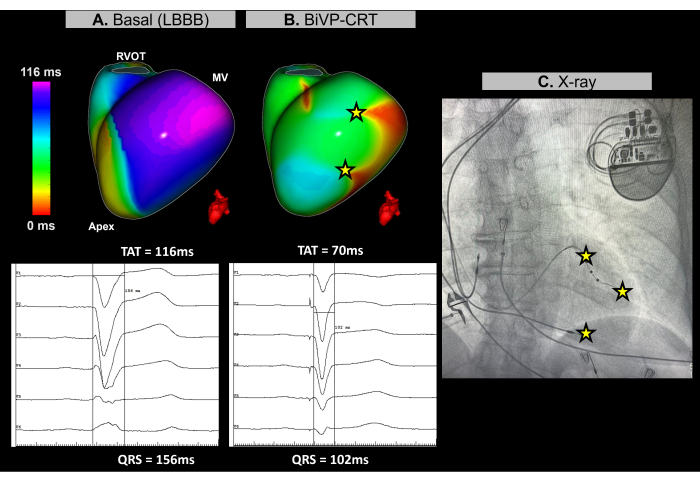
Şekil 11: Görüntüsüz EKGI kullanarak biventriküler pacing'in optimizasyonu. (A) Hastanın başlangıç ritmi. Görüntüsüz EKGI haritası (sol lateral görünüm), LV'nin lateral duvarında ventriküler dissenkroniyi gösteren 116 ms'lik bir TAT ile geç aktive olan bir bölgeyi (mor) ortaya çıkarır. Bu, LBBB paterni ile geniş bir QRS kompleksi (156 ms) gösteren temel EKG ile uyumludur. (B) Kalp pili implantasyonu sonrası konfigürasyon. LV derivasyonunun distal ve proksimal kutuplarının eşzamanlı aktivasyonu ve 140 ms'lik bir atriyoventriküler gecikme ile BiVP'yi takiben, Görüntüsüz EKGI haritası, senkron ventriküler aktivasyonu ve 70 ms'lik bir azalmış TAT'yi gösteren gecikmeli aktif bölge (mor alan yok) göstermez. Bu, QRS süresinin 102 ms'ye düştüğü son EKG'de gözlenen kısaltılmış QRS kompleksi ile tutarlıdır. (C) İmplante edilen kalp pilinin, kalp pili elektrotlarının yerini gösteren antero-posterior röntgen görünümü. LV derivasyonunun hem distal hem de proksimal kutuplarının pacing aktivitesi de EKGI haritasına yansır. Kısaltmalar: LBBB: sol dal bloğu, BiVP: biventriküler pacing, CRT: kardiyak resenkronizasyon tedavisi, RVOT: sağ ventrikül çıkış yolu, MV: mitral kapak, TAT: toplam aktivasyon süresi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
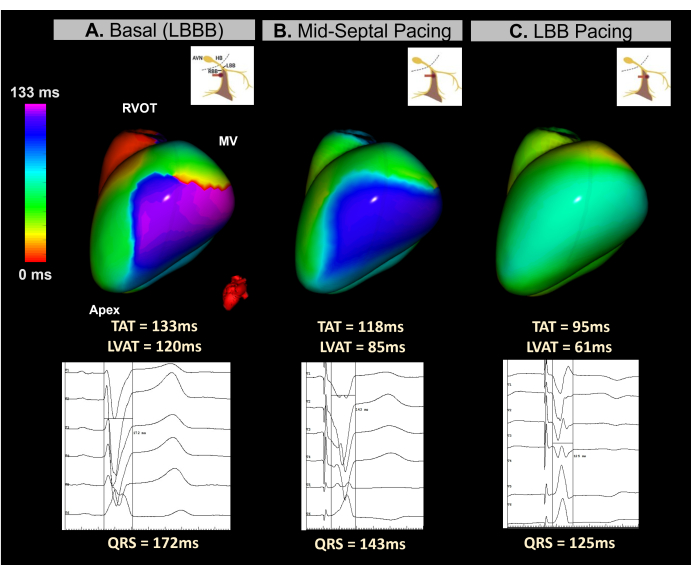
Şekil 12: Görüntüsüz EKGI kullanılarak iletim sistemi pacing yoluyla CRT'nin Noninvaziv Değerlendirmesi. (A) Hasta başlangıç ritmi. EKGI haritası (sol lateral görünüm), LV'nin yan duvarında 133 ms'lik bir TAT ile gecikmiş aktivasyon bölgesini (mor) gösterir ve ventriküler dissenkroniyi düşündürür. Bu, LBBB'ye özgü geniş bir QRS kompleksi (172 ms) gösteren başlangıç EKG'sine karşılık gelir. (B) LBBP kurşununun implantasyonu sırasında ara faz (orta septal pacing). Noninvaziv harita, rengin mordan maviye kaymasıyla LV'deki gecikmeli bölgenin kısmi bir düzeltmesini gösterir. Buna, QRS kompleks süresinde bir azalma eşlik eder. (C) Vidalama işlemi sırasında LBBP kablosunun son konumu. Harita, her iki ventrikülün senkronize aktivasyonunu gösteren mordan yeşile geçiş yapan renk ile gecikmeli alanın tam olarak düzeltilmesini gösterir. Kısaltmalar: LBBB: sol demet dal bloğu, LBB: sol demet dal, RVOT: sağ ventrikül çıkış yolu, MV: mitral kapak, TAT: toplam aktivasyon süresi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
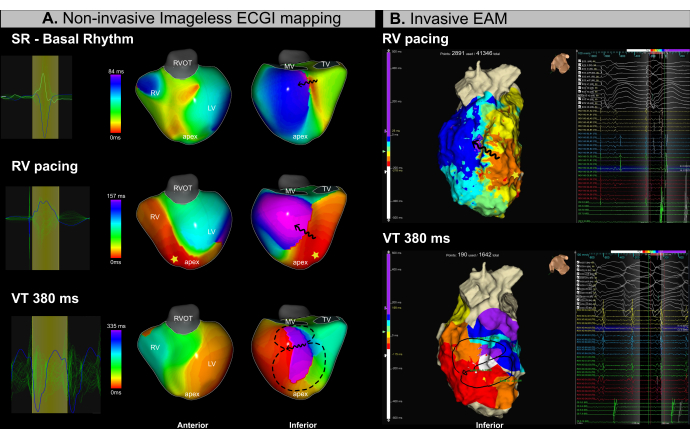
Şekil 13: Görüntüsüz EKGI kullanılarak VT isthmus'un noninvaziv değerlendirmesi. (A) VT ablasyon prosedürü sırasında görüntüsüz EKGI haritalaması, LV'nin infero-bazal ve infero-medial bölgelerindeki aritmojenik substratı ve VT isthmus'u tanımlar. İlk sıra sinüs ritmine, orta sıra RV apikal pacing'e ve alt sıra VT'ye karşılık gelir. (B) VT ablasyon prosedürü sırasında elde edilen invaziv EAM, ECGI ile tanımlanan aynı bölgelerde izokronal aktivasyon haritalamasını gösterir. Üst sıra RV apikal pacing'e karşılık gelirken, alt sıra VT'yi temsil eder. Kısaltmalar: RV: sağ ventrikül, LV: sol ventrikül, SR: sinüs ritmi, RVOT: sağ ventrikül çıkış yolu, MV: mitral kapak, TV: triküspit kapak. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu metodolojik açıklama, BT veya MRG gibi işlem öncesi kardiyak görüntülemeye ihtiyaç duymadan kateter ablasyonu ve CRT gibi çeşitli elektrofizyolojik prosedürleri destekleyebilen noninvaziv, tek atımlı ve gerçek zamanlı bir EKGI yaklaşımının klinik faydasını vurgulamaktadır 15,17,31,32 Bu raporda, Imageless ECGI, klinik olarak benimsenmesini teşvik edebilecek temel teknik özellikleri göstermektedir. ECGI'nin çok çeşitli aritmilerde kardiyak haritalama için güçlü bir araç olduğu kanıtlanmış olsada 19,33,34,35,36, çeşitli klinik ve teknik zorluklarla karşılaşmaya devam etmektedir13,14.
Klasik EKGI sistemleri, EKGI elektrotları 9,10,12,37,38 yerindeyken özellikle kardiyak haritalama ile aynı gün bir BT taramasına ihtiyaç duyar. Bu yaklaşım, BT tarama segmentasyonuna (kalp ve elektrotlar) ihtiyaç duyulması nedeniyle ekstra zaman ekler ve ilk EKGI haritasının oluşturulmasını yaklaşık 1-3 saat geciktirir. Buna karşılık, bu raporda sunulan görüntüsüz EKGI sistemi, işlemden sadece birkaç dakika önce veya tıbbi konsültasyonlar sırasında gerçekleştirilebilen yüksek yoğunluklu dizi elektrotlarla göğüs kafesinin kızılötesi 3D taramasını kullanır15,17. Sistem, torasik elektrotları otomatik olarak segmentlere ayırır ve hastanın kardiyak geometrisini tahmin ederek noninvaziv kardiyak haritalama sürecini kolaylaştırır ve hastanın gelişi ile ilk EKGI haritasının bulunması arasındaki süreyi önemli ölçüde azaltır. Görüntüsüz EKGI yaklaşımının önceki doğrulaması, tahmini kardiyak geometrinin kullanılmasının minimum hatalara yol açtığını ve noninvaziv haritaların doğruluğunu koruduğunu göstermiştir. AF'li hastalarda, geometrik ötelemelerde bile, tahmini ve gerçek kardiyak geometrilerden elde edilen EKGI sinyalleri arasında güçlü bir korelasyon gözlenmiştir15. Kompleks atriyal taşikardi gibi düzenli aritmiler için, EAM ile yapılan karşılaştırmalar, ilgili kalp odasını tanımlamada, mekanizmayı belirlemede (fokal veya reentrant) ve ablasyon hedefini çıkarmada yüksek doğruluk göstermiştir31. VT söz konusu olduğunda, yaklaşım, operatörleri sinüs ritmi (SR)39 sırasında VT isthmuses alanlarına yönlendirmek için değerlendirilmiştir, bu da birincil önlemede VT riski taşıyan hastaları belirleme potansiyelini göstermektedir. Ek olarak, koroner sinüs pacing sırasında, özellikle erken ve geç aktivasyon bölgelerinde görüntüsüz EKGI ve EAM aktivasyon haritaları arasında güçlü bölgesel uyum gözlenmiştir40.
CRT'de, 12 derivasyonlu EKG'deki gerçek zamanlı morfolojik değişiklikler, özellikle EKG'nin LBB alanına ulaşılana kadar septal kurşun yerleşiminin çeşitli aşamalarında değerlendirildiği CSP prosedürlerinde, kurşun implantasyonu sırasında yeniden senkronizasyonu doğrulamak için tipik olarak kullanılır. Bununla birlikte, yayınlanan EKG algoritmaları genellikle karmaşıktır, aralarında önemli farklılıklar gösterir ve bazı durumlarda klinik uygulamada uygulanması zordur 41,42,43. Muhtemelen bu karmaşıklık nedeniyle, bir hastanın kardiyak resenkronizasyona yanıt verip vermeyeceğini güvenilir bir şekilde tahmin edebilen sol dal pacing (LBBP) için spesifik bir elektrokardiyografik parametre tutarlı bir şekilde tanımlanmamıştır. Gerçek zamanlı görüntüsüz EKGI yaklaşımı, CRT endikasyonu32 olan veya AV blok44 olan hastalarda gösterildiği gibi, sol ventrikül aktivasyon süresi gibi parametreleri değerlendirerek eşzamansızlık düzeltmesini değerlendirerek, kurşun implantasyonu boyunca basit ve ayrıntılı, atım atım haritalama sunar. Bu nedenle, daha fazla araştırma ile, gerçek zamanlı EKGI parametreleri, operatörlere kurşun implantasyon konumunu optimize etmede veya hastanın CRT'ye yanıtını tahmin etmede potansiyel olarak rehberlik edebilir.
Bu metodolojik raporda gerçek zamanlı Görüntüsüz EKGI'nin potansiyeli sunulmuş olsa da, aritmi simülasyonlarını kullanan diğer yeni noninvaziv haritalama yaklaşımları da işlem öncesi görüntüleme ihtiyacını ortadan kaldırmayı amaçlamıştır. Aritmojenik Olasılığın Vektörkardiyografik Haritalanması (VMAP) çalışması, ventriküler aritmi bölgelerinin45 belirlenmesinde önemli bölgesel doğruluk göstermiştir ve PVI olmayan ablasyonun46 ötesinde AF sürücülerinin konumunu belirlemede umut vaat etmektedir. VMAP, hastaya özgü geometrik verilere güvenmeden aritmi hedeflerini belirlemek için 12 derivasyonlu EKG'yi çoklu hesaplama modelleriyle birlikte kullanır. Bununla birlikte, bu yaklaşım, yüzey EKG'sindeki yüksek frekanslı bileşenlerin aritmi sürücülerini non-invaziv olarak tanımlamak için çok önemli olduğu AF gibi atriyal aritmiler için yetersiz olabilir. Bu bileşenler tipik olarak, klinik uygulamada kullanılan standart 12 derivasyonlu EKG'de temsil edilmeyen arka ve antero-lateral yüzeylerdeki27 elektrotlar tarafından yakalanır.
Daha fazla klinik araştırmaya ihtiyaç duyulmasına rağmen, gerçek zamanlı görüntüsüz EKGI, geniş bir aritmi aralığında noninvaziv kardiyak haritalama için değerli bir araç olma potansiyeline sahiptir. Metodolojik basitliği ve hastane ortamlarındaki kolaylaştırılmış hasta iş akışı, klinisyenlerin daha fazla klinik veri toplamasını sağlar ve bu da hem hasta sonuçlarını hem de gelecekteki teknolojik gelişmeleri iyileştirebilir. Sonuç olarak, noninvaziv kardiyak haritalamanın geleceği, rutin konsültasyonlardan elektrofizyolojik prosedürler sırasında gerçek zamanlı haritalamaya kadar günlük klinik uygulamaya daha hızlı ve sorunsuz entegrasyona izin veren tamamen görüntüsüz bir yaklaşıma doğru ilerlemede yatmaktadır.
Açıklamalar
JRP, BPS, JSC, IHR, RM, CF, EZ, JM, DL, FA, MSG ve AMC, Corify Care SL'den fahri olarak onur ödülü aldı. AMC, MSG ve FA, Corify Care SL'nin kurucu ortaklarıdır ve JRP, BPS, JSC, IHR, JM, DL, JBG, FA, LM, MSG ve AMC hissedarlardır. TFA, Biosense-Webster'dan araştırma hibeleri aldı. IRL, Abbott ve Biosense-Webster'dan öğretim görevlisi ve danışman olarak onur ödülü aldı. APS, Bisosense-Webster, Abbott ve Boston-Scientific'ten konuşmacı ve danışman onur ödülü aldı. JMT, Abbott, Boston-Scientific ve Medtronic'ten öğretim görevlisi ve danışman olarak onur ödülü aldı. EA, Biosense-Webster ve Bayer'den konuşmacı ve danışman onur ödülü aldı. LM, Boston-Scientific, Abbott, Johnson & Johnson ve Medtronic'ten danışman, öğretim görevlisi ve Danışma Kurulu olarak fahri rapor vermektedir ve Galgo Medical SL'nin hissedarıdır. JBG, Abbott'tan bir burs için sınırsız hibe desteğine ek olarak, Microport CRM ve Abbott'tan danışman ve konuşmacı olarak fahri rapor vermektedir. MPL, Medtronic'ten konuşmacı onur ödülü aldı.
Teşekkürler
Bu araştırma, Avrupa İnovasyon ve Teknoloji Enstitüsü (EIT) tarafından SAVE-COR No 220385 hibe sözleşmesi kapsamında ve Generalitat Valenciana (EFICACIA) tarafından finanse edilen CIAICO/2022/020 hibesi ile finanse edilmiştir. Ek destek Generalitat Valenciana (hibe CIAPOS/2021/238, ACIF/2021/205, CIBEFP/2022/9), MCIN/AEI/10.13039/501100011033 ve ESF Geleceğinize Yatırım Yapmak (hibe RYC2018-024346-I), Instituto de Salud Carlos III (hibe CIBERCV16 CB16/11/00354) ve Katalonya, İspanya (hibe 2021_SGR_01350, SGR21/GENCAT). Ayrıca CERCA Programı/Generalitat de Catalunya'nın desteğini de kabul ediyoruz. MPL (2023-2025) Río Hortega sözleşmesi CM22/00107 [Instituto de Salud Carlos III (ISCIII); Fondo Social Europeo (FSE)]. Yazarlar, sekreterlik desteği sağladıkları için Neus Portella ve Sheila Marco'ya ve Hospital Clínic de Barcelona, Hospital General Universitario Gregorio Marañón, Hospital Universitari i Politècnic La Fe'deki klinik destekleri için tıbbi ve hemşirelik ekiplerine teşekkür eder. Ayrıca Corify Care SL, Madrid, İspanya'dan Almudena Albertos ve Universitat Politecnica de Valencia'dan Arantxa Carrasco'ya da teşekkürlerini sunuyorlar.
Malzemeler
| Name | Company | Catalog Number | Comments |
| ACORYS Mapping System | Corify Care SL | ACORYS | Imageless ECGI system |
| ACORYS 3D Scan Software | Corify Care SL | ACSCAN | 3D scanner app |
| ACORYS Amplifier | Corify Care SL | ACAMP | Biopotential amplifier |
| ACORYS Sensor Vest | Corify Care SL | ACSEN | Sensor vest, 4 components (Front Right, Front Left, Back Right and Back Left) |
| ACORYS Software | Corify Care SL | ACSOF, version 1.2 | Imageless ECGI software |
| Affera mapping system | Medtronic | AFR-00003 | |
| CADENCE Adult mulifuntion defibrillation electrodes | Cardinal Health | 22660R | |
| Catheter extension cable | Medtronic | AFR-00006 | |
| Desktop or portable PC workstation | Any | Windows 11 as the operating system | Imageless ECGI workstation. The processor must be at least an Intel i7 from the 2020 generation or newer. It requires a minimum of 32 GB of RAM and 500 GB of SSD storage. Additionally, a compatible version of .NET Framework must be installed. An internet connection is not required. |
| Dynamic XT 10E 2 5 2 MM Diagnostic Catheter | Boston Scientific | M0042011010 | |
| EP-TRACER 2 ProCart | Cardiotek | The system includes several components provided by the company | |
| External Defibrillator Monitor | PHILLIPS | Efficia DFM100 | |
| Fentanyl | Kern pharma | 1004000143-03 | |
| Heparine | Reig Jofre | 608737.4 O | |
| HexaFlow irrigation pump | Medtronic | AFR-00005 | |
| HexaGen RF generator | Medtronic | AFR-00004 | |
| HexaPulse PF generator | Medtronic | AFR-00008 | |
| INTELLAMAP ORIO Mapping Catheter | Boston Scientific | M004RC64S0 | |
| IntellaNav StablePoint Ablation Catheter | Boston Scientific | M004ERFSDS96200 | |
| iPad mini | Apple | 6th generation A2567 | 3D scanner platform |
| iPadOS | Apple | 15.3 or superior | 3D scanner platform |
| Isolated Ethernet Cable | Corify Care SL | ACNET | Ethernet cable |
| Isoprenaline | Reig Jofre | 7227007 | |
| Left Connector Cable | Corify Care SL | ACCAB_L | Left cables |
| Location Reference Patch Kit | Boston Scientific | M004RAPATCH20 | |
| Location reference patch kit | Medtronic | AFR-00007 | |
| MetriQ Tubing Set | Boston Scientific | M0041170 | |
| Midazolam | Normon | X5XF1 | |
| Physiological Saline Solution for Irrigation | Fabrenius Kabi | br14801 | |
| Propofol | B Braun | 855437.9 OH | |
| Remifentanil | Kern pharma | 672786.7 | |
| RHYTHMIA HD | Boston Scientific | M004 RBINSTALL2ROW0 | |
| Right Connector Cable | Corify Care SL | ACCAB_R | Right cables |
| Single Patient Use ECG Electrodes | Ambu | M-00-S | |
| Sphere-9 mapping and ablation catheter | Medtronic | AFR-00001 | |
| Structure SDK | Structure | 2.2.1 for iOS or superior | 3D scanner platform, infrared structured light camera |
| Structure Sensor Pro | Structure | ST02B. Firmware version 1.2 or superior | 3D scanner platform, infrared structured light camera |
| Sugamadex Teva | Normon | 7340157-OH | |
| Tubing set | Medtronic | AFR-00002 | |
| WorkMate Claris System | Abbott | H700123 | |
| X-Ray C-Arm | Phillips | The system includes several components provided by the company |
Referanslar
- Narayan, S. M., John, R. M. Advanced electroanatomic mapping: current and emerging approaches. Curr Treat Options Cardiovasc Med. 26 (4), 69-91 (2024).
- Raiman, M., Tung, R. Automated isochronal late activation mapping to identify deceleration zones: rationale and methodology of a practical electroanatomic mapping approach for ventricular tachycardia ablation. Comput Biol Med. 102, 336-340 (2018).
- Guichard, J. -. B., et al. Substrate mapping for ventricular tachycardia ablation through high-density whole-chamber double extra stimuli. JACC Clin Electrophysiol. 10 (7), 1534-1547 (2024).
- Takigawa, M., et al. Are wall thickness channels defined by computed tomography predictive of isthmuses of postinfarction ventricular tachycardia. Heart Rhythm. 16 (11), 1661-1668 (2019).
- Vázquez-Calvo, S., et al. Noninvasive detection of slow conduction with cardiac magnetic resonance imaging for ventricular tachycardia ablation. Europace. 26 (2), euae025 (2024).
- Sánchez-Somonte, P., et al. Scar channels in cardiac magnetic resonance to predict appropriate therapies in primary prevention. Heart Rhythm. 18 (8), 1336-1343 (2021).
- Roca-Luque, I., et al. Post-ablation cardiac magnetic resonance to assess ventricular tachycardia recurrence (PAM-VT study). Eur Heart J Cardiovasc Imaging. 25 (2), 188-198 (2023).
- Roca-Luque, I., et al. Ventricular scar channel entrances identified by new wideband cardiac magnetic resonance sequence to guide ventricular tachycardia ablation in patients with cardiac defibrillators. Europace. 22 (4), 598-606 (2020).
- Rudy, Y., Burnes, J. E. Noninvasive electrocardiographic imaging. Ann Noninvasive Electrocardiol. 4 (3), 340-359 (1999).
- Haissaguerre, M., et al. Noninvasive panoramic mapping of human atrial fibrillation mechanisms: a feasibility report. J Cardiovasc Electrophysiol. 24 (6), 711-717 (2013).
- Tsyganov, A., et al. Mapping of ventricular arrhythmias using a novel noninvasive epicardial and endocardial electrophysiology system. J Electrocardiol. 51 (1), 92-98 (2018).
- Pereira, H., Niederer, S., Rinaldi, C. A. Electrocardiographic imaging for cardiac arrhythmias and resynchronization therapy. Europace. 22 (10), 1447-1462 (2020).
- Duchateau, J., et al. Performance and limitations of noninvasive cardiac activation mapping. Heart Rhythm. 16 (3), 435-442 (2019).
- Cluitmans, M., et al. Validation and opportunities of electrocardiographic imaging: from technical achievements to clinical applications. Front Physiol. 9, 1305 (2018).
- Molero, R., González-Ascaso, A., Climent, A. M., Guillem, M. S. Robustness of imageless electrocardiographic imaging against uncertainty in atrial morphology and location. J Electrocardiol. 77, 58-61 (2023).
- Rodrigo, M., et al. Noninvasive assessment of complexity of atrial fibrillation: correlation with contact mapping and impact of ablation. Circ Arrhythm Electrophysiol. 13 (3), e007700 (2020).
- Invers-Rubio, E., et al. Regional conduction velocities determined by noninvasive mapping are associated with arrhythmia-free survival after atrial fibrillation ablation. Heart Rhythm. 21 (9), 1570-1580 (2024).
- Fambuena-Santos, C., et al. AF driver detection in pulmonary vein area by electrocardiographic imaging: relation with a favorable outcome of pulmonary vein isolation. Front Physiol. 14, 1057700 (2023).
- San Antonio, R., et al. Optimized single-point left ventricular pacing leads to improved resynchronization compared with multipoint pacing. Pacing Clin Electrophysiol. 44 (3), 519-527 (2021).
- Zacur, E., et al. MRI-Based Heart and Torso Personalization for Computer Modeling and Simulation of Cardiac Electrophysiology. Imaging for Patient-Customized Simulations and Systems for Point-of-Care Ultrasound. 10549, (2017).
- Bell, J. B., Tikhonov, A. N., Arsenin, V. Y. Solutions of ill-posed problems. Math Comput. 32 (144), 1320 (1978).
- Oster, H. S., Taccardi, B., Lux, R. L., Ershler, P. R., Rudy, Y. Electrocardiographic imaging: noninvasive characterization of intramural myocardial activation from inverse-reconstructed epicardial potentials and electrograms. Circulation. 97 (15), 1496-1507 (1998).
- Figuera, C., et al. Regularization techniques for ECG imaging during atrial fibrillation: a computational study. Front Physiol. 7, 466 (2016).
- Molero, R., et al. Improving electrocardiographic imaging solutions: a comprehensive study on regularization parameter selection in L-curve optimization in the atria. Comput Biol Med. 182, 109141 (2024).
- Hernández-Romero, I., et al. Local conduction velocity estimation during wavefront collisions and reentrant scenarios. 2022 Computing in Cardiology (CinC). , (2022).
- Rodrigo, M., et al. Technical considerations on phase mapping for identification of atrial reentrant activity in direct- and inverse-computed electrograms. Circ Arrhythm Electrophysiol. 10 (9), e005008 (2017).
- Guillem, M. S., et al. Noninvasive localization of maximal frequency sites of atrial fibrillation by body surface potential mapping. Circ Arrhythm Electrophysiol. 6 (2), 294-301 (2013).
- Pedrón-Torrecilla, J., et al. Noninvasive estimation of epicardial dominant high-frequency regions during atrial fibrillation. J Cardiovasc Electrophysiol. 27 (4), 435-442 (2016).
- Tzeis, S. 2024 European Heart Rhythm Association/Heart Rhythm Society/Asia Pacific Heart Rhythm Society/Latin American Heart Rhythm Society expert consensus statement on catheter and surgical ablation of atrial fibrillation. Europace. 26 (4), euae043 (2024).
- Parreira, L., et al. Noninvasive three-dimensional electrical activation mapping to predict cardiac resynchronization therapy response: site of latest left ventricular activation relative to pacing site. Europace. 25 (4), 1458-1466 (2023).
- Reventos-Presmanes, J., et al. Noninvasive electrocardiographic imaging for the characterization of complex atrial tachyarrhythmias. Europace. 25 (Supplement_1), (2023).
- Regany, M., et al. ECG imaging as a real time tool to guide left bundle branch pacing implant in patients with left bundle branch block and resynchronization therapy indication. Europace. 26 (Supplement_1), (2024).
- Rudy, Y. Noninvasive electrocardiographic imaging of arrhythmogenic substrates in humans. Circ Res. 112 (5), 863-874 (2013).
- Shah, A. J., et al. Validation of novel 3-dimensional electrocardiographic mapping of atrial tachycardias by invasive mapping and ablation. J Am Coll Cardiol. 62 (10), 889-897 (2013).
- Graham, A. J., et al. Evaluation of ECG imaging to map hemodynamically stable and unstable ventricular arrhythmias. Circ Arrhythm Electrophysiol. 13 (2), e007377 (2020).
- Pujol-Lopez, M., et al. Conduction system pacing vs biventricular pacing in heart failure and wide QRS patients. JACC Clin Electrophysiol. 8 (11), 1431-1445 (2022).
- Rudy, Y., Lindsay, B. D. Electrocardiographic imaging of heart rhythm disorders. Cardiac Electrophysiol Clin. 7 (1), 17-35 (2015).
- Haissaguerre, M., et al. Driver domains in persistent atrial fibrillation. Circulation. 130 (7), 530-538 (2014).
- Reventos-Presmanes, J., et al. Noninvasive assessment of the ventricular tachycardia isthmus during sinus rhythm. Europace. 26 (Supplement_1), (2024).
- Ros, S., et al. Imageless electrocardiographic imaging for atrial electrophysiological characterization: a validation study. Europace. 26, (2024).
- Wu, S., et al. Left bundle branch pacing for cardiac resynchronization therapy: nonrandomized on-treatment comparison with his bundle pacing and biventricular pacing. Can J Cardiol. 37 (2), 319-328 (2021).
- Pujol-López, M., et al. Stepwise application of ECG and electrogram-based criteria to ensure electrical resynchronization with left bundle branch pacing. Europace. 25 (6), euad128 (2023).
- Zhu, K., Chang, D., Li, Q. Which is more likely to achieve cardiac synchronization: left bundle branch pacing or left ventricular septal pacing. Front Cardiovasc Med. 9, 845312 (2022).
- Martinez-Perez, M., et al. Real-time assessment of LV synchrony in AV block population undergoing LBB pacing using ECG imaging. Europace. 26 (Supplement_1), (2024).
- Krummen, D. E., et al. Forward-solution noninvasive computational arrhythmia mapping: the VMAP study. Circ Arrhythm Electrophysiol. 15 (9), (2022).
- Gu, K., et al. Ablation of non-pulmonary vein atrial fibrillation drivers identified by vMap in addition to pulmonary vein isolation improves procedural outcomes. 29th annual AF Symposium 2024. , (2024).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır