Method Article
Mappatura cardiaca in tempo reale con un sistema di imaging elettrocardiografico non invasivo senza immagini
In questo articolo
Riepilogo
Questo studio introduce un nuovo approccio per la mappatura cardiaca in tempo reale utilizzando un sistema di imaging elettrocardiografico non invasivo e senza immagini. Questo sistema consente l'acquisizione di mappe cardiache elettrofisiologiche senza richiedere la tomografia computerizzata pre-procedurale o le scansioni di risonanza magnetica, consentendo una guida efficiente per le procedure cardiache come l'ablazione e gli impianti di terapia di resincronizzazione cardiaca.
Abstract
Una mappatura cardiaca rapida, sicura ed efficace è fondamentale per la gestione di aritmie complesse, ma i metodi attuali devono affrontare limitazioni significative. L'elettrocardiogramma a 12 derivazioni (ECG), sebbene essenziale per la diagnosi iniziale, non ha la risoluzione spaziale e la profondità necessarie per guidare procedure avanzate come l'ablazione transcatetere o l'impianto di un dispositivo per la terapia di risincronizzazione cardiaca. D'altra parte, le tecniche di mappatura invasive forniscono un'attività elettrica dettagliata, ma richiedono il posizionamento di più cateteri, aumentando i rischi e la complessità procedurale. Questi metodi richiedono molto tempo, sono costosi e offrono una valutazione limitata in tempo reale, soprattutto nelle aritmie dinamiche come la fibrillazione atriale (FA), l'aritmia instabile e la terapia di risincronizzazione cardiaca (CRT).
Questo studio introduce un sistema di imaging elettrocardiografico (Imageless-ECGI) non invasivo e senza immagini progettato per integrare i metodi tradizionali fornendo mappe cardiache battito per battito in tempo reale. Senza la necessità di imaging pre-procedurale, questo sistema acquisisce l'attività elettrica ad alta risoluzione in tutto il cuore, offrendo un'alternativa più sicura ed efficiente alla mappatura invasiva. Combinando l'immediatezza delle registrazioni di superficie con l'accuratezza spaziale dei moderni modelli computazionali, il sistema Imageless-ECGI colma il divario tra l'ECG tradizionale e la mappatura invasiva, trasformando potenzialmente il flusso di lavoro nei laboratori di elettrofisiologia.
Introduzione
La necessità di una mappatura elettrofisiologica non invasiva è diventata sempre più importante per valutare accuratamente l'attività cardiaca, in particolare nei pazienti sottoposti a procedure di aritmia complesse, come l'ablazione della fibrillazione atriale (FA) e della tachicardia ventricolare (TV), o durante l'impianto di pacemaker e dispositivi per la terapia di risincronizzazione cardiaca (CRT). Attualmente, la mappatura elettroanatomica tridimensionale (3D) rimane il gold standard per guidare gli operatori durante l'ablazione transcatetere1, fornendo mappe funzionali complete per caratterizzare le aritmie 2,3. Tuttavia, l'EAM non è ottimale per catturare i modelli spazio-temporali dinamici della FA, delle aritmie non sostenute e il lungo tempo e la procedura invasiva richiesta per la mappatura lo rendono poco pratico per l'uso nelle procedure CRT.
I metodi tradizionali non invasivi, come l'elettrocardiogramma a 12 derivazioni (ECG), sebbene altamente accurati per identificare specifici focolai di aritmia (ad esempio, tratto di efflusso o TV a cuspide), offrono una visione limitata del comportamento elettrico globale del cuore. Questa limitazione è particolarmente evidente quando è richiesta la mappatura in tempo reale per guidare gli interventi in aritmie dinamiche e complesse, dove la localizzazione precisa delle aree aritmogene è fondamentale per risultati di successo. La mappatura non invasiva potrebbe svolgere un ruolo importante nel migliorare la pianificazione pre-procedurale e fornire feedback in tempo reale durante gli interventi elettrofisiologici.
Per supportare gli elettrofisiologi pre-procedurali, i progressi nelle modalità di imaging cardiaco, come la tomografia computerizzata (TC) e la risonanza magnetica (MRI), si sono dimostrati efficaci nel fornire informazioni strutturali dettagliate, tra cui lo spessore della parete4 e la fibrosi miocardica 5,6,7,8. Tuttavia, queste modalità si concentrano sulle caratteristiche anatomiche e strutturali, lasciando un vuoto nella mappatura elettrica funzionale. Inoltre, l'ottenimento di immagini cardiache di alta qualità richiede protocolli di scansione specializzati, personale qualificato e metodi di post-elaborazione complessi come la segmentazione avanzata e la caratterizzazione precisa dei tessuti, in particolare per il rilevamento della fibrosi cardiaca.
I classici sistemi di imaging elettrocardiografico (ECGI) sono emersi come opzione non invasiva, offrendo risultati promettenti ricostruendo l'attività elettrica cardiaca in base ai potenziali di superficie corporea (BSP)9,10,11,12. Nonostante il loro potenziale, i sistemi ECGI devono affrontare notevoli limitazioni13,14. In primo luogo, richiedono scansioni TC pre-procedurali per mappare le posizioni degli elettrodi sulle geometrie cardiache, rendendo meno fattibile il loro uso di routine clinica. In secondo luogo, i metodi di regolarizzazione tradizionali utilizzati per risolvere il problema inverso della mappatura cardiaca spesso introducono modelli di propagazione non fisiologici, limitandone l'accuratezza in ambito clinico.
L'obiettivo di questo studio era quello di descrivere le caratteristiche e le procedure di un nuovo sistema ECGI non invasivo in grado di mappare in tempo reale senza la necessità di TC o MRI15, noto come ECGI senza immagini. Abbiamo esplorato i progressi dell'ECGI senza immagini e presentato potenziali applicazioni cliniche per la mappatura elettrofisiologica, superando i limiti delle tecniche attuali come l'EAM, l'ECG a 12 derivazioni e l'ECGI classico nella gestione di complesse procedure di aritmia. Questo approccio consente la creazione di mappe cardiache entro pochi minuti dall'arrivo del paziente, semplificando il flusso di lavoro e riducendo i tempi di preparazione. Inoltre, il sistema utilizza algoritmi avanzati di elaborazione del segnale per generare modelli di propagazione fisiologica accurati, migliorando la localizzazione dell'aritmia e i risultati procedurali.
Protocollo
La metodologia è stata convalidata in modo prospettico in uno studio clinico osservazionale multicentrico. Lo studio è stato condotto in conformità con la Dichiarazione di Helsinki e gli standard etici delle istituzioni coinvolte. Il protocollo di studio, SAVE-COR (NCT05772182), è stato approvato dai Comitati Etici dell'Hospital Universitario Gregorio Marañón, dell'Hospital Clínic de Barcelona e dell'Hospital Universitari i Politècnic La Fe, ed è stato ottenuto il consenso informato di tutti i pazienti.
NOTA: Le descrizioni dettagliate dei criteri di inclusione ed esclusione sono:
Criteri di inclusione: (i) Indicazione per uno studio elettroanatomico invasivo e/o l'impianto di dispositivi di stimolazione intracavitaria. (ii) Aver ottenuto e firmato il consenso informato per l'inclusione nello studio.
Criteri di esclusione: (i) <18 anni. (ii) Incapacità di sottoporsi a cateterismo endocardico (ad esempio, donne in gravidanza o in allattamento). (iii) Incapacità fisica o mentale di comprendere e accettare il consenso informato. (iv) Incapacità di stare in piedi per consentire la ricostruzione 3D del busto richiesta per il sistema ECGI. (v) Pazienti con patologie congenite.
1. Preparazione pre-procedurale del sistema ECGI senza immagini in tempo reale
- Verificare che l'amplificatore del biopotenziale (Figura 1A) sia completamente carico e posizionarlo all'estremità del tavolo della stanza di elettrofisiologia (EP), vicino a dove sarebbero posizionati i piedi del paziente.
NOTA: L'amplificatore di biopotenziale (vedi Tabella dei materiali) è un dispositivo isolato a 128 canali responsabile dell'amplificazione e della digitalizzazione dei segnali elettrici raccolti dagli elettrodi. - Verificare che i cavi destro e sinistro non siano danneggiati ispezionando i connettori dell'amplificatore a un'estremità e le prese nere, dove è collegato il giubbotto del sensore, all'altra estremità (Figura 1B).
NOTA: I cavi destro e sinistro (vedi Tabella dei materiali) sono lunghi 1,5 m e trasmettono segnali elettrici dal giubbotto del sensore all'amplificatore di biopotenziale. - Collegare i cavi del connettore destro e sinistro all'amplificatore di biopotenziale (Figura 1C). Ad ogni cavo è associata una spina che si distingue per un numero, che è lo stesso sia per il cavo che per l'amplificatore.
- Verificare che la piattaforma dello scanner 3D sia completamente carica e aprire l'applicazione di scansione 3D.
NOTA: L'applicazione di scansione 3D è un software in esecuzione su una piattaforma di scansione 3D (vedere la Tabella dei materiali) che utilizza una telecamera a luce strutturale a infrarossi per generare una ricostruzione del modello 3D del busto del paziente. L'applicazione rileva anche automaticamente la posizione dei codici di risposta rapida (QR) dell'elettrodo. - Verificare che sulla workstation PC (vedere Tabella dei materiali) sia installata l'interfaccia utente del software ECGI senza immagini e che sia completamente carica.
NOTA: Il software Imageless ECGI (vedi Tabella dei materiali) incorpora algoritmi di elaborazione del segnale per stimare la geometria cardiaca e fornire informazioni preziose per la diagnosi e il trattamento delle aritmie cardiache o per guidare le procedure di impianto di dispositivi cardiaci 16,17,18,19. L'interfaccia utente del sistema consente agli utenti di visualizzare, selezionare e analizzare i segnali elettrocardiografici, creando mappe interattive dell'attività epicardica che consentono una valutazione non invasiva della funzione cardiaca. - Collegare l'amplificatore di biopotenziale alla workstation utilizzando un cavo Ethernet isolato (vedere la tabella dei materiali). Inserire un'estremità nella porta Ethernet dell'amplificatore e l'altra nella workstation.
NOTA: Il cavo Ethernet isolato trasmette i segnali elettrici dall'amplificatore di biopotenziale alla workstation. - Selezionare un giubbotto sensore (vedere la Tabella dei materiali), ispezionare l'imballaggio e verificare che la guarnizione non sia danneggiata. Non utilizzare il giubbotto sensore se la confezione è aperta o danneggiata.
- Aprire la confezione del giubbotto sensore e verificare che i quattro componenti del giubbotto siano all'interno. Scegliere un'altra confezione del giubbotto sensore se manca uno dei componenti.
NOTA: Il giubbotto sensore è un array di elettrodi ad alta densità con 128 elettrodi d'argento che consentono la mappatura simultanea dell'attività elettrica superficiale su tutto il busto del paziente. Il giubbotto è radiotrasparente e contiene quattro cerotti che coprono le superfici anteriore e posteriore sinistra e destra del busto. Ogni elettrodo è dotato di un codice QR sulla parte anteriore, che consente l'identificazione automatica della posizione dell'elettrodo.
2. Preparazione pre-procedurale del paziente
- Ricoverare il paziente in ospedale lo stesso giorno dello studio elettrofisiologico o dell'impianto del dispositivo.
- Posizionare il paziente in piedi o seduto su una sedia o sul tavolo EP e assicurarsi che l'intera area del busto sia libera da indumenti.
- Eseguire un'ispezione visiva della pelle del paziente per verificare se il paziente presenta rive, ferite o qualsiasi altra condizione della pelle per evitare di attaccare elettrodi a queste aree.
- Facoltativamente, pulire il busto per le persone con peli significativi per ridurre al minimo gli artefatti di rumore e ridurre il disagio durante la rimozione del giubbotto sensore.
- Posizionare correttamente le quattro parti del giubbotto sensore (anteriore destro, anteriore sinistro, posteriore destro e posteriore sinistro) sul busto del paziente (Figura 2A) e regolare il giubbotto in base alle dimensioni del paziente piegando i collegamenti tra gli elettrodi quando necessario.
- Opzionalmente, per le procedure CRT, evitare di posizionare gli elettrodi nell'area in cui verrà inserito l'impianto cardiaco, spesso situato nella parte superiore sinistra del torace.
NOTA: I collegamenti con trattini stampati possono essere interrotti in modo sicuro, se necessario, poiché in quelle aree non sono presenti tracce attive. - Posizionare gli elettrodi Right-Leg-Driven (RLD) e di riferimento (REF) del giubbotto sensore rispettivamente sulla gamba destra e sinistra, il più lontano possibile dagli altri elettrodi del giubbotto.
- Garantire un'adeguata illuminazione della stanza e assicurarsi che nessun oggetto si trovi entro un diametro di 1,5 m attorno al busto del paziente, in quanto potrebbe interferire o distorcere la ricostruzione 3D del busto.
- Posizionare il paziente con le braccia sopra la testa per evitare interferenze con la ricostruzione 3D del busto, come mostrato nella Figura 2C.
- Ottenere la ricostruzione 3D del busto del paziente.
- Prendi la piattaforma dello scanner 3D e apri l'applicazione di scansione 3D.
- Scansiona il codice QR sul lato laterale del componente del giubbotto anteriore destro per convalidare il giubbotto sensore (Figura 2B), assicurandoti che sia monouso e non scaduto.
NOTA: Una volta rilevato il codice QR, l'applicazione di scansione 3D consente l'acquisizione della ricostruzione 3D del busto. - Posizionare la piattaforma dello scanner 3D all'altezza del busto di fronte al paziente, tenerla saldamente con entrambe le mani e completare una rotazione di 360° attorno al paziente per acquisire la ricostruzione 3D del busto (Figura 2C).
NOTA: Man mano che la scansione procede, la telecamera a luce strutturata a infrarossi della piattaforma dello scanner 3D crea una rete chiusa 3D di colore grigio del busto, completando il processo con una rotazione completa. In genere, il processo di ricostruzione 3D del busto richiede 1-2 minuti per essere completato. - Condurre un'ispezione visiva della ricostruzione 3D del busto per assicurarsi che l'intero busto sia coperto da un'ombra grigia e che non siano presenti fori nella rete ricostruita.
- Salvare la ricostruzione 3D del busto nell'applicazione una volta terminata la scansione.
- Far sdraiare il paziente sul tavolo della stanza EP.
- Collegare le quattro parti del giubbotto sensore ai cavi del connettore destro e sinistro corrispondenti (Figura 1D). Collegare i connettori del giubbotto anteriore destro e posteriore destro alla presa del cavo destro e i connettori del giubbotto anteriore sinistro e posteriore sinistro alla presa del cavo sinistro.
- Accendere l'amplificatore del biopotenziale per consentire al software ECGI senza immagini di ricevere segnali elettrofisiologici in tempo reale.
3. Stima della geometria cardiaca del paziente
- Accedere come utente al software ECGI senza immagini in tempo reale installato nella workstation (Figura 3). Fornisci un nome utente e una password.
- Fare clic sul pulsante Aggiungi paziente e inserire i dettagli di identificazione per registrare un nuovo paziente nella finestra iniziale dell'interfaccia utente (Figura 4). Quindi, creare una nuova sessione associata al paziente, fornendo il tipo di procedura e i seguenti dati basali: sesso, età, altezza e peso.
NOTA: Un singolo paziente può avere più sessioni. Ad esempio, negli studi clinici con follow-up, se un paziente viene sottoposto a una seconda registrazione ECGI, è possibile creare una nuova sessione senza aggiungere nuovamente il paziente. - Collegare la piattaforma dello scanner 3D alla workstation utilizzando un cavo USB-C.
- Fare clic sul pulsante Carica scansione busto e caricare la ricostruzione 3D del busto nella finestra Geometria busto (Figura 5).
NOTA: Il software rileverà automaticamente la localizzazione dei 128 elettrodi dal giubbotto sensore. Ogni componente del giubbotto ha diversi colori degli elettrodi: Anteriore destro = rosso, Anteriore sinistro = blu, Posteriore destro = rosa e Posteriore sinistro = arancione. - Facoltativamente, è possibile regolare manualmente le posizioni degli elettrodi facendo clic su ciascun elettrodo e riposizionandolo sulla superficie del busto.
- Selezionare il pulsante Calcola geometria e l'opzione Stima geometria cardiaca per stimare la geometria cardiaca del paziente nella finestra Geometria del busto (Figura 5).
NOTA: Il software stima la geometria cardiaca utilizzando una metodologia basata su un modello di forma statistica (SSM) (Figura 6A), come dettagliato nella letteratura precedente20. L'algoritmo elabora prima la ricostruzione 3D del busto del paziente e i dati basali (sesso, età, altezza e peso) come input. Successivamente, l'SSM, che incorpora geometrie del tronco e del cuore basate sulla risonanza magnetica, si regola iterativamente per adattarsi alla rete del busto 3D del paziente. Questo determina la geometria, la posizione e l'orientamento ottimali del cuore all'interno del corpo del paziente (Figura 6B). Questo processo elimina la necessità di TC o risonanza magnetica pre-procedurale, consentendo la generazione della prima mappa cardiaca non invasiva entro 10-15 minuti. È importante notare che un messaggio pop-up informa l'utente se la ricostruzione 3D del busto non ha una risoluzione sufficiente o contiene artefatti che potrebbero influire sull'accuratezza dei risultati della stima.
4. Mappatura ECGI non invasiva senza immagini per guidare l'impianto di stimolazione del sistema di conduzione per la terapia di risincronizzazione cardiaca (CSP-CRT) in tempo reale (caso 4)
- Vai alla finestra dell'amplificatore e fai clic sul pulsante Connetti amplificatore per iniziare ad acquisire segnali elettrofisiologici in tempo reale (Figura 7). Fare clic sui diversi cavi per visualizzare i segnali nella schermata dell'amplificatore.
- Vai alla finestra in tempo reale (Figura 8) per ottenere una mappatura cardiaca non invasiva in tempo reale.
NOTA: La finestra in tempo reale consente la visualizzazione di segnali in tempo reale, esclude i segnali rumorosi, crea creatori temporali, delinea automaticamente i segmenti di analisi (ad esempio, onda P e complesso QRS) e calcola e visualizza mappe ECGI non invasive. - Per escludere i segnali disturbati, fare clic sul pulsante di visualizzazione a 128 derivazioni , selezionare l'opzione Solo utente come modalità di selezione delle derivazioni rumorose e fare doppio clic sui segnali rumorosi per escluderli prima di generare la mappa ECGI. Ciò migliora la qualità del calcolo della mappatura, poiché l'ECGI è un problema mal posto21.
NOTA: I cavi del giubbotto del sensore visualizzati in verde indicano segnali di buona qualità e vengono utilizzati per il calcolo inverso del problema, mentre i cavi mostrati in rosso sono rumorosi e sono esclusi dall'analisi (Figura 8A). - Fare clic sul pulsante di visualizzazione a 12 derivazioni per visualizzare una stima dell'ECG a 12 derivazioni in tempo reale (Figura 8B).
- Assicurarsi che il pulsante RT ON sia attivo per aggiornare automaticamente i segnali nella sezione di analisi del segnale (Figura 8C). Questa opzione attiva e definisce automaticamente l'inizio e l'offset del complesso QRS da analizzare.
NOTA: Il pulsante RT può essere commutato in modalità RT OFF per congelare i segnali, consentendo all'utente di delineare manualmente il complesso QRS quando la delineazione automatica del sistema non è ottimale. - Configurare l'analisi della mappatura di attivazione ECGI facendo clic sul pulsante Opzioni per generare automaticamente una mappa del ritmo basale ottimale per la procedura CSP-CRT:
- Selezionare l'opzione Analizza ventricolo per mappare solo i ventricoli.
- Selezionare l'opzione di analisi basata su wavelet17 per l'algoritmo dei tempi di attivazione.
- Selezionare l'opzione Battito medio per la funzione Tipo di mappatura per calcolare l'onda media degli ultimi 10 complessi QRS.
- Lasciate le impostazioni predefinite per le funzioni Correzione scostamento, Numero battuta e Opzione di sincronizzazione .
- Seleziona l'opzione due pannelli nella sezione di visualizzazione delle mappe e assicurati che la mappa di sinistra sia impostata sulla modalità di aggiornamento , in modo che si aggiorni continuamente con ogni nuovo complesso QRS medio analizzato.
- Visualizzare la mappa di attivazione basale bi-ventricolare sul lato sinistro (Figura 8D pannello sinistro). Il sistema calcola automaticamente la matrice di trasferimento tra le maglie del busto e del cuore per ricostruire l'attività elettrica epicardica del cuore in base al metodo degli elementi limite 22,23,24.
NOTA: La mappa di attivazione rappresenta la progressione temporale della depolarizzazione nell'epicardio cardiaco, aiutando a individuare le origini di attivazione e a identificare i modelli rientranti o focali. Le attivazioni sono calcolate (1) trasformando ogni elettrogramma ricostruito in una somma di wavelet sinusoidali per tutti i campioni di tempo di pendenza negativa e ampiezza proporzionale alla pendenza in quel momento e (2) selezionando l'istante dell'ampiezza massima del segnale trasformato come istante del tempo di attivazione17. - Scrivi il nome e salva la mappa basale facendo clic sul pulsante Salva mappa e passa la mappa alla modalità Freeze una volta che è riproducibile. Una mappa ECGI riproducibile ha una durata di attivazione e modelli di propagazione coerenti su almeno tre mappe consecutive.
NOTA: Nelle procedure CSP-CRT, la mappa basale (Figura 12A) servirà come riferimento per valutare la sincronia bi-ventricolare durante il processo di avvitamento dell'elettrodo nella regione del setto fino a raggiungere l'area di branca sinistra (Figura 12C). - Configura l'analisi della mappatura dell'attivazione ECGI facendo clic sul pulsante Opzioni per ottenere mappe ottimali durante il processo di avvitamento e stimolazione nella regione del setto:
- Seleziona Analizza ventricolo per mappare solo i ventricoli.
- Selezionare l'opzione di analisi basata su wavelet per l'algoritmo dei tempi di attivazione.
- Selezionare l'opzione battito singolo per Tipo di mappatura per analizzare l'onda di un singolo battito e acquisire le variazioni dei segnali elettrocardiografici durante il processo di avvitamento e stimolazione simultaneo in diverse posizioni del setto.
- Lasciate le impostazioni predefinite per le funzioni Correzione scostamento, Numero battuta e Opzione di sincronizzazione .
- Imposta la mappa del pannello di destra sulla modalità di aggiornamento per assicurarti che si aggiorni continuamente con ogni nuovo complesso QRS a battito singolo analizzato durante il processo di avvitamento.
- Sincronizzare l'intervallo della mappa dei colori della mappa del pannello di destra con la mappa basale utilizzando il menu Valori collegati e collegare le posizioni della telecamera tramite il menu Telecamera collegata (Figura 8D pannello di destra).
NOTA: Quando l'elettrocatetere viene avvitato nella regione del setto, le mappe ECGI battito a battito vengono generate automaticamente in varie posizioni (ad esempio, setto ventricolare destro, setto medio, setto profondo e ramo del fascio sinistro). Queste mappe vengono confrontate con la mappa basale standardizzando l'intervallo della mappa dei colori in tutte le mappe ECGI valutate (Figura 12B, C). Questa configurazione consente una chiara visualizzazione delle modifiche nei modelli di attivazione mentre il cavo è avvitato. - Scrivere il nome e salvare ogni mappa facendo clic sul pulsante Salva mappa ogni volta che si osserva un cambiamento nel modello di attivazione durante il processo di avvitamento nella regione del setto, continuando fino a raggiungere l'area di branca sinistra.
5. Analisi aggiuntiva della mappatura ECGI senza immagini non invasiva
NOTA: Diverse mappe cardiache possono essere derivate dai segnali ECGI computerizzati per valutare il substrato cardiaco, caratterizzare le aritmie, valutare la CRT o estrarre metriche clinicamente rilevanti durante le procedure. Il tipo di mappe che possono essere generate dipende dallo specifico ritmo cardiaco analizzato, con approcci distinti sia per i ritmi regolari che per quelli irregolari.
- Utilizza la sezione di analisi del segnale della finestra in tempo reale per analizzare i diversi ritmi che i pazienti possono mostrare durante la procedura elettrofisiologica:
- Analizza i ritmi regolari, impostando l'analisi del battito singolo o del battito medio come funzione del tipo di mappatura , quando il paziente si trova in un ritmo stabilizzato/regolare, come il ritmo sinusale, la stimolazione atriale o ventricolare, il flutter atriale o la tachicardia ventricolare. Calcola la mappa di attivazione e la mappa della velocità di conduzione (CV) dall'analisi del ritmo regolare.
- Analizza il ritmo irregolare, utilizzando l'analisi del ritmo irregolare come funzione di mappatura quando il paziente è in fibrillazione atriale. Il sistema consente la selezione di segmenti AF estesi (ad esempio, 1 min) per sopprimere i complessi QRST e catturare i pattern spaziotemporali dinamici della AF. Calcola la mappa di fase , la mappa dell'istogramma del rotore e la mappa della frequenza dominante dall'analisi del ritmo irregolare.
- Facoltativamente, premere il menu a tendina della selezione della mappa e scegliere la mappa di attivazione se è stato analizzato un ritmo regolare. Vedere il passaggio 4.8 per una descrizione dettagliata della mappa di attivazione .
- Facoltativamente, premere il menu a discesa della selezione della mappa e scegliere la mappa della velocità di conduzione se è stato analizzato un ritmo regolare.
NOTA: La velocità di conduzione è una metrica derivata dalla mappa di attivazione. Questa metrica rappresenta il tempo impiegato da un fronte d'onda per attraversare ciascuna area dell'epicardio. Il calcolo del CV si basa sui gradienti spaziali delle mappe del tempo di attivazione sulle superfici cardiache, con campi vettoriali di velocità applicati per identificare le regioni di propagazione efficace. Le aree con vettori direzionali uniformi indicavano una propagazione elettrica stabile, mentre le regioni con disparità angolari, che indicavano una propagazione inefficace, venivano interpolate utilizzando una funzione di base radiale25. La CV consente di identificare le aree di decelerazione della conduzione durante la mappatura del substrato che sono correlate ai tassi di recidiva dell'aritmia17. - Facoltativamente, premere il menu a discesa della selezione della mappa e scegliere la mappa di fase durante l'analisi di un ritmo irregolare.
NOTA: La mappa delle fasi tiene traccia della progressione di una regione definita del miocardio attraverso il potenziale d'azione nel tempo. Questo tipo di mappa è dinamica poiché rappresenta la progressione del potenziale cardiaco. Nella mappa di fase, la trasformata di Hilbert viene applicata per calcolare la fase del segnale ECGI. Ogni fase corrisponde a un dato stato del potenziale d'azione su ogni ciclo del segnale (π per la quiete, π/2 per la depolarizzazione, 0 per il plateau e -π per la ripolarizzazione)26. - Facoltativamente, premere il menu a discesa della selezione della mappa e scegliere la mappa dell'istogramma del rotore durante l'analisi di un ritmo irregolare.
NOTA: Una mappa dell'istogramma del rotore, derivata da una mappa di fase, è una rappresentazione delle posizioni più frequenti delle singolarità di fase, che sono aree con attività rientrante concentrata e sono visualizzate in rosso. In breve, le singolarità di fase sono definite come punti chiave in cui la fase passa da -π a π. Le PS che non mostrano una progressione spaziale graduale delle fasi nel loro ambiente vengono scartate. Infine, il numero di giri per ogni rotore viene quantificato per ottenere la mappa dell'istogramma del rotore 18. La precisione dell'algoritmo nell'identificare i pattern di propagazione durante la FA e le regioni specifiche che mostrano rientri è stata sistematicamente valutata rispetto alla mappatura endocardica, dimostrando una correlazione del 71%16. - Facoltativamente, premere il menu a discesa della selezione della mappa e selezionare la mappa della frequenza dominante (DF) durante l'analisi di un ritmo irregolare.
NOTA: Le mappe DF mostrano la frequenza elettrica predominante in ciascuna regione cardiaca nel tempo, aiutando a identificare le aree di rapida attività elettrica che possono fungere da driver della FA. I DF sono calcolati come la frequenza con la più alta densità spettrale di potenza nel periodogramma di Welch27,28. La sua analisi consente di rilevare aree con elevata stabilità o variabilità nell'attività fibrillatoria all'interno degli atri. Un istogramma viene utilizzato per valutare la distribuzione temporale delle frequenze dominanti, fornendo una rappresentazione chiara e quantitativa dell'attività elettrica più rilevante e facilitando l'identificazione delle regioni con comportamento anomalo.
Risultati
Caso 1 - Pianificazione e guida dell'ablazione transcatetere di un flutter atriale atipico
Si tratta di un paziente di sesso maschile di 59 anni (indice di massa corporea -BMI-30) con anamnesi di ipertensione, fumo, malattie delle valvole cardiache, classificazione EHRA IIb e un punteggio CHA2DS 2-VASc di 1 con indicazione di ablazione transcatetere dovuta a flutter atriale atipico (AFL) basato su un ECG a 12 derivazioni (Figura 9A). Il paziente non aveva precedenti di ablazione transcatetere. La risonanza magnetica pre-procedurale per l'enhancement tardivo del gadolinio (LGE-MRI) ha rivelato un'estesa fibrosi nella parete posteriore dell'atrio sinistro (LA), con una planimetria LA normale di 24 cm² e una frazione di eiezione ventricolare sinistra (LVEF) conservata del 54%.
L'ECGI non invasivo senza immagini è stato eseguito pochi minuti prima dell'introduzione del catetere tramite una guaina femorale. Per l'analisi è stato selezionato un ciclo completo di AFL (209 ms), privo di complessi QRST. La mappatura ha rivelato un circuito macro-rientrante attorno alla valvola mitrale (MV), individuando la linea perimitrale come bersaglio ottimale per l'ablazione per la terminazione dell'aritmia (Figura 9B). Successivamente, è stata condotta l'EAM basata sul contatto (Figura 9C), che ha confermato il modello di propagazione osservato nell'ECGI senza immagini non invasivo. L'ablazione lungo la linea peritrale ha posto fine con successo all'aritmia.
In questo caso clinico, l'aritmia è stata accuratamente caratterizzata prima dell'EAM invasiva, consentendo una localizzazione precisa del pattern di propagazione dell'aritmia e semplificando la procedura di ablazione. Tuttavia, per le tachicardie atriali complesse, come l'AFL o la tachicardia focale, l'ECGI senza immagini offre una mappatura in tempo reale a battito singolo, il che lo rende particolarmente utile nei casi di aritmia non sostenuta. La sua adattabilità ai cambiamenti dei modelli di aritmia durante una procedura garantisce una mappatura precisa e dinamica. Inoltre, mentre la diagnosi di AFL in senso antiorario è solitamente semplice da un ECG a 12 derivazioni, localizzare e identificare con precisione il meccanismo delle tachiaritmie complesse può essere difficile. Di conseguenza, l'esecuzione dell'ECGI senza immagini durante la consultazione medica o pochi minuti prima può migliorare la sicurezza e l'efficienza della procedura, fornendo una guida a monte per la pianificazione dell'ablazione transcatetere ed eliminando gli approcci transettali non necessari.
Caso 2 - Evoluzione delle singolarità di fase durante l'ablazione transcatetere della fibrillazione atriale persistente
Questo caso è un paziente di sesso maschile di 63 anni (BMI 31) con frazione di eiezione ventricolare sinistra conservata (LVEF, 55%), senza LA dilatata e la New York Heart Association (NYHA) di I era indicata per l'ablazione transcatetere a causa di FA persistente. Non è stata eseguita alcuna TC o risonanza magnetica pre-procedurale. Il paziente aveva una precedente storia di ablazione transcatetere per isolamento della vena polmonare (PVI) nel dicembre 2019.
All'arrivo, il paziente era in fibrillazione atriale. La mappatura del substrato è stata condotta utilizzando ECGI senza immagini durante tutta la procedura di ablazione (Figura 10A). Al basale, l'ECGI ha identificato singolarità di fase nella parete laterale dell'atrio destro (RA), nella base dell'appendice atriale destra (RAA), nella parete posteriore dell'atrio sinistro (PW) e nella base dell'appendice atriale sinistra (LAA). Questi risultati sono correlati con EGM frammentati e ad alta frequenza osservati utilizzando cateteri endocavitari e un'adeguata PVI è stata confermata tramite la ricostruzione LA EAM. L'ablazione in campo pulsato (PFA) è stata avviata presso la base LAA, con conseguente cambiamento del ritmo da AF a AFL atipica. L'ECGI senza immagini ha rivelato una AFL perimitralica, che è stata confermata tramite trascinamento dal polo distale del catetere del seno coronarico. È stata creata una linea mitralica; tuttavia, la FA è stata reindotta. Successivamente, è stato raggiunto il completo isolamento PW. Nonostante ciò, l'ECGI senza immagini ha continuato a identificare singolarità di fase significative alla base RAA. A seguito di molteplici applicazioni di PFA mirate a quest'area, è stato raggiunto il ritmo sinusale (Figura 10B).
Questo caso clinico è una rappresentazione di come la FA presenti sfide uniche a causa dell'elevata variabilità dell'attività elettrica negli atri. L'ECGI senza immagine ha catturato efficacemente i modelli spazio-temporali della progressione della FA durante l'ablazione, con l'acquisizione di un massimo di tre mappe non invasive per guidare la modifica del substrato fino al raggiungimento della SR. I trattamenti standard, come l'isolamento della vena polmonare, hanno tassi di recidiva relativamente elevati29. Le principali difficoltà nel trattamento della FA risiedono in due aree: (1) determinare quali pazienti trarranno beneficio dalla sola PVI e (2) per coloro che richiedono un approccio più ampio, identificare le regioni al di fuori dell'area PVI la cui ablazione ridurrà più efficacemente la recidiva dell'aritmia. Durante il ritmo sinusale, l'ECGI senza immagini ha dimostrato la capacità di generare mappe CV, che si sono dimostrate utili nel prevedere il successo dell'ablazione PVI17. Tuttavia, in questo caso, l'ECGI senza immagini ha catturato contemporaneamente i modelli di dinamica della fibrillazione atriale, fornendo ai medici una visione completa di come si propaga la fibrillazione atriale e aiutando a identificare le regioni chiave che guidano l'aritmia. L'analisi dei risultati dovrebbe concentrarsi sulla correlazione tra i driver di FA ablati rilevati da ECGI senza immagini e gli endpoint clinici, come la sopravvivenza libera da aritmia a lungo termine, per convalidare ulteriormente la sua utilità nell'ottimizzazione delle strategie di ablazione della FA.
Caso 3 - Ottimizzazione della stimolazione biventricolare per la terapia di risincronizzazione cardiaca
Si tratta di una paziente di 67 anni con cardiomiopatia dilatativa non ischemica, LVEF del 25%, nessuna evidenza di enhancement tardivo del gadolinio alla risonanza magnetica pre-procedurale, con un blocco di branca sinistra (LBBB) all'ECG basale e una durata del QRS di 156 ms. Il paziente è stato indicato per la stimolazione biventricolare (BiVP) come parte della CRT.
Durante la procedura di CRT cardiaca, è stato utilizzato l'ECGI senza immagini in tempo reale per valutare la sincronizzazione ventricolare prima e dopo l'impianto del pacemaker. Al ritmo basale, l'ultima regione di attivazione del paziente è stata identificata nella parete basale-laterale del ventricolo sinistro (LV), come illustrato nella Figura 11A. Il tempo di attivazione totale ventricolare (TAT) è stato misurato a 116 ms, indicando una significativa asincronia ventricolare. Diverse configurazioni del dispositivo sono state valutate utilizzando l'ECGI, con la configurazione ottimale determinata come BiVP utilizzando l'attivazione simultanea dei poli distale e prossimale dell'elettrocatetere LV e un ritardo atrioventricolare di 140 ms. Come mostrato nella Figura 11B, i tre punti di stimolazione ventricolare non hanno portato a regioni attivate tardivamente, indicando una sincronizzazione riuscita, con un TAT migliorato di 70 ms.
La terapia di risincronizzazione cardiaca mira a ripristinare la coordinazione elettrica nei ventricoli e migliorare la funzione cardiaca nei pazienti con insufficienza cardiaca e QRS prolungato. In questo caso, l'ECGI senza immagini ha fornito una mappatura in tempo reale che è stata fondamentale per guidare l'ottimizzazione del BiVP durante la procedura CRT. Ha consentito una valutazione precisa dei modelli di attivazione ventricolare e ha contribuito a identificare la configurazione ottimale del dispositivo, garantendo la completa sincronizzazione ventricolare. La natura non invasiva e il feedback immediato dell'ECGI hanno permesso ai medici di perfezionare la programmazione degli elettrocateteri. Al contrario, mentre gli studi evidenziano il valore dell'ECGI nel guidare il posizionamento dell'elettrocatetere ventricolare sinistro vicino all'ultima regione attivata30, i vincoli anatomici possono limitarne l'applicabilità. I parametri basali e finali di risincronizzazione determinati dall'ECGI, come la TAT, devono essere correlati agli esiti clinici monitorando la risposta clinica del paziente alla CRT nel tempo, compreso il miglioramento dei sintomi e la funzione ventricolare a lungo termine.
Caso 4 - Impianto di stimolazione del sistema di conduzione guida per la terapia di risincronizzazione cardiaca in tempo reale
Questo caso clinico è una paziente di 45 anni con grave disfunzione ventricolare (LVEF 15%) e BBS con una durata QRS di 172 ms. Il paziente è stato indicato per un defibrillatore cardioverso impiantabile CRT utilizzando un approccio di stimolazione del sistema di conduzione (CSP).
L'ECGI senza immagini in tempo reale è stato utilizzato durante l'impianto del dispositivo per monitorare la sincronia ventricolare durante il processo di avvitamento dell'elettrodo nella regione del setto. Come mostrato nella Figura 12, la mappa ECGI di base ha identificato la parete laterale del ventricolo sinistro come l'ultima area attivata, con un TAT di 133 ms. La mappatura ECGI battito a battito durante l'avvitamento dell'elettrodo ha dimostrato miglioramenti progressivi nella sincronia ventricolare, con una sincronizzazione ottimale raggiunta al raggiungimento del ramo sinistro del fascio, con un TAT di 95 ms.
Questo caso ha dimostrato il potenziale dell'ECGI senza immagini in tempo reale per guidare l'impianto di LBBP durante una procedura CRT. Le sue capacità di mappatura in tempo reale a battito singolo hanno consentito l'analisi della TAT ventricolare e la risincronizzazione in ogni fase dell'impianto dell'elettrocatetere nella regione del setto. Il sistema ha fornito una metrica veloce, visiva e di facile interpretazione, risolvendo la mancanza di standardizzazione nei criteri CSP elettrocardiografici. Oltre che nelle procedure BiVP-CRT, sono necessari ulteriori studi per determinare se i parametri ECGI senza immagini sono correlati in modo significativo con la risposta clinica CRT e come si confrontano con i predittori ECG a 12 derivazioni.
Caso 5 - Pianificazione e guida dell'ablazione transcatetere della tachicardia ventricolare
Si tratta di un paziente di sesso maschile di 53 anni (BMI 25,4) con cardiomiopatia ischemica, grave disfunzione ventricolare (LVEF 15%) e classe II NYHA che è stato sottoposto a una procedura di ablazione transcatetere a causa di TV ricorrente. La risonanza magnetica pre-procedurale ha rivelato un'estesa fibrosi endocardica e canali aritmogeni localizzati nei segmenti infero-basale e infero-mediale del ventricolo sinistro. Il paziente aveva una precedente storia di ablazione transcatetere VT nel 2018.
Durante la procedura sono stati eseguiti simultaneamente la mappatura ECGI senza immagini (Figura 13A) e l'EAM invasivo (Figura 13B). Il processo di ablazione transcatetere ha comportato la mappatura basata sul substrato durante la stimolazione apicale del ventricolo destro (RV) e l'induzione del televisore mediante stimolazione programmata. L'ECGI senza immagini ha identificato una regione di rallentamento della conduzione nel segmento infero-basale del ventricolo sinistro durante la mappatura del ritmo sinusale prima dell'introduzione del catetere. Questo risultato era coerente con la fibrosi osservata alla risonanza magnetica. La successiva stimolazione dall'apice del ventricolo destro (RV) ha confermato il rallentamento della conduzione nei segmenti basale e mediale del ventricolo sinistro, identificando quest'area come il probabile substrato aritmogeno. È stata brevemente indotta una VT con una lunghezza del ciclo di 380 ms, che ha richiesto una cardioversione a causa dell'instabilità emodinamica. Di conseguenza, è stato acquisito solo un numero limitato di punti EAM. Tuttavia, utilizzando un singolo ciclo di TV, l'ECGI senza immagini ha identificato con successo l'istmo VT nella stessa regione in cui è stato osservato l'affollamento isocronico nelle mappe stimolate.
L'uso dell'ECGI senza immagini in tempo reale in questo caso di TV ha affrontato con successo due importanti sfide cliniche nella gestione della TV: (1) la localizzazione precisa di potenziali bersagli di ablazione durante il ritmo sinusale e (2) la caratterizzazione della TV con instabilità emodinamica. Da un singolo battito, l'istmo VT è stato identificato con precisione sia nel substrato che nelle mappe di attivazione dell'aritmia. Il sistema ha permesso agli operatori di identificare i substrati aritmogeni prima o durante l'ablazione e di caratterizzare più VT inducibili in tempo reale da un singolo ciclo.

Figura 1: Componenti hardware ECGI senza immagini. (A) Amplificatore bipotenziale con porte di collegamento via cavo specifiche. (B) Cavi destro e sinistro, dotati di connettori per lifier su un'estremità e connettori per prese per giubbotti sensore sull'altra. (C) Configurazione che mostra i cavi destro e sinistro collegati all'amplificatore bipotenziale. (D) Flusso di lavoro schematico della procedura per il collegamento del giubbotto del sensore alle prese dei cavi. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Procedura di scansione 3D per la ricostruzione del busto. (A) Il giubbotto sensore di potenziale della superficie corporea a 128 derivazioni, composto da quattro componenti (Anteriore-Destra, Anteriore-Sinistra, Posteriore-Destra, Posteriore-Sinistra), viene posizionato sul busto del paziente prima della ricostruzione 3D. Ogni elettrodo ha un codice QR univoco per l'identificazione automatica. Le connessioni tra gli elettrodi possono essere piegate per adattarsi al giubbotto alla forma del corpo del paziente. (B) Il codice QR sul componente anteriore-destro convalida il giubbotto, consentendo all'applicazione dello scanner 3D di avviare la ricostruzione del busto. (C) La piattaforma di scansione 3D, tramite l'applicazione di scansione 3D, genera il busto ricostruito utilizzando una telecamera a luce strutturata a infrarossi. Abbreviazioni: FR: anteriore destro; FL: anteriore-sinistro; BR: dietro a destra; e BL: dietro a sinistra. Clicca qui per visualizzare una versione più grande di questa figura.
Figura 3: Schermata di accesso all'interfaccia utente ECGI senza immagini che richiede un nome utente e una password designati per l'accesso al software. Clicca qui per visualizzare una versione più grande di questa figura.
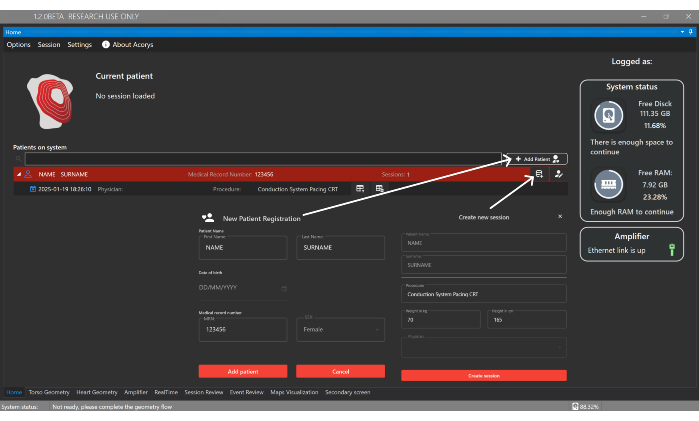
Figura 4: Finestra iniziale. La finestra Home consente la gestione di pazienti, medici e utenti, nonché la configurazione delle sessioni dei pazienti. Visualizza anche le informazioni sulle sessioni importate e lo stato del sistema e dell'amplificatore. Clicca qui per visualizzare una versione più grande di questa figura.
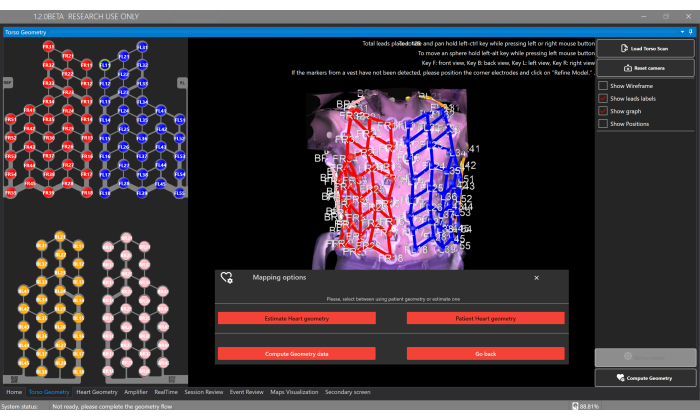
Figura 5: Finestra della geometria del busto. La finestra Geometria del busto consente agli utenti di caricare e visualizzare il modello 3D del busto, segmentare gli elettrodi e selezionare il tipo di geometria del cuore tramite il pulsante Calcola geometria , che consente la stima o di fornire una segmentazione da TC/MRI personalizzata. Clicca qui per visualizzare una versione più grande di questa figura.
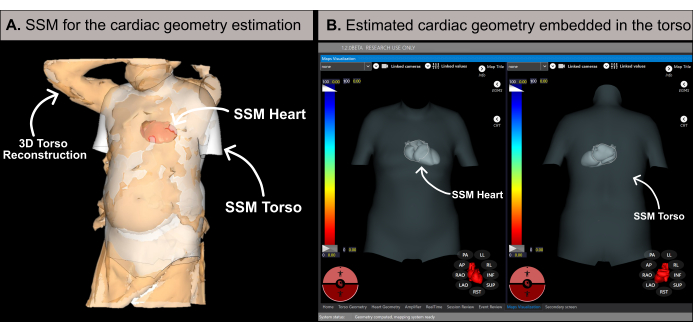
Figura 6: Stima della geometria cardiaca. (A) Algoritmo SSM che utilizza le caratteristiche basali e la ricostruzione 3D del busto del paziente per stimare la geometria cardiaca. (B) Geometria cardiaca stimata all'interno dell'SSM del busto che mostra le viste antero-posteriore (lato sinistro) e postero-anteriore (lato destro). Abbreviazioni: 3D: tridimensionale; SSM: modello statistico di forma. Clicca qui per visualizzare una versione più grande di questa figura.
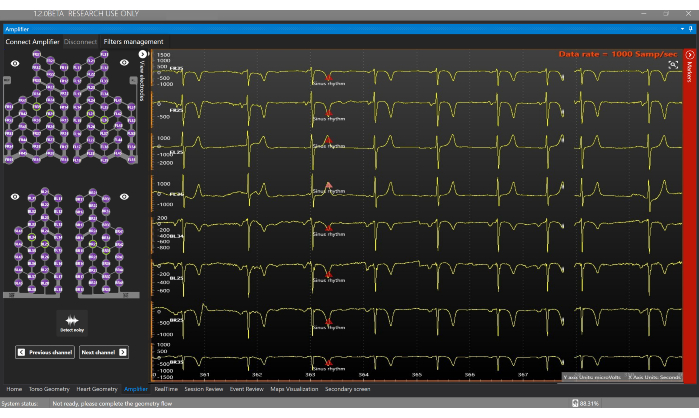
Figura 7: Finestra dell'amplificatore. La finestra Amplifier consente la visualizzazione in tempo reale dei segnali che vengono ottenuti da ciascun elettrodo del Sensor Vest. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 8: Finestra in tempo reale. (A) Rappresentazione schematica dei conduttori attivi dal giubbotto dell'array di elettrodi ad alta densità. Gli elettrodi verdi contengono segnali di buona qualità, mentre gli elettrodi rossi contengono segnali rumorosi e non partecipano al calcolo inverso del problema. (B) Stima delle 12 derivazioni dell'elettrocardiogramma in tempo reale. (C) Attivazione e delineazione automatica dell'insorgenza e dell'offset del complesso QRS (finestra di colore verde). Il segnale medio di tutti i lead che partecipano al calcolo della mappatura è mostrato in blu. (D) La sezione Visualizzazione mappe supporta visualizzazioni singole, doppie o a quattro mappe. Questo esempio mostra una vista a doppia mappatura con mappe di attivazione per gli stati di stimolazione del ramo del fascio basale e sinistro (mappa finale) durante una procedura CRT. La mappa basale è in modalità freeze, rimanendo statica, mentre la mappa finale è in modalità di aggiornamento, ricalcolandola ad ogni nuovo complesso QRS analizzato. Clicca qui per visualizzare una versione più grande di questa figura.
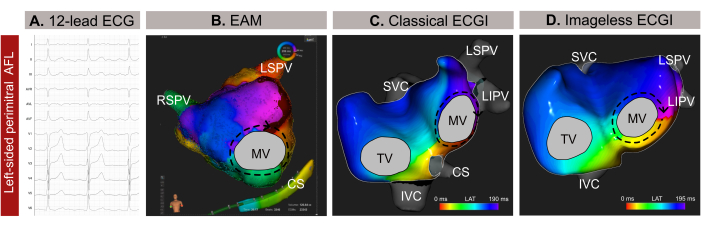
Figura 9: Esempio grafico di una AFL atipica sul lato sinistro e le diverse capacità diagnostiche dell'ECG a 12 derivazioni, dell'ECGI senza immagini e dell'EAM invasiva. (A) I segnali ECG a 12 derivazioni dell'AFL atipica presentano onde sopraventricolari positive in V1. (B) ECGI senza immagini che utilizza una geometria cardiaca stimata da un SSM e visualizza una vista antero-posteriore. Il circuito di propagazione mostra tutti i colori intorno alla MV, un modello tipico per una AFL perimitrale. (C) La mappatura dell'attivazione locale derivata dall'EAM e che mostra una vista antero-posteriore mostra un macro-rientro attorno alla MV, confermando la diagnosi dell'ECGI senza immagini. Abbreviazioni: ECG: elettrocardiogramma; EAM: mappatura elettroanatomica; ECGI: imaging elettrocardiografico. SVC: vena cava superiore; IVC: vena cava inferiore; CS: seno coronarico; LSPV: vena polmonare superiore sinistra; RIPV: vena polmonare inferiore destra; RSPV: vena polmonare superiore destra. Clicca qui per visualizzare una versione più grande di questa figura.
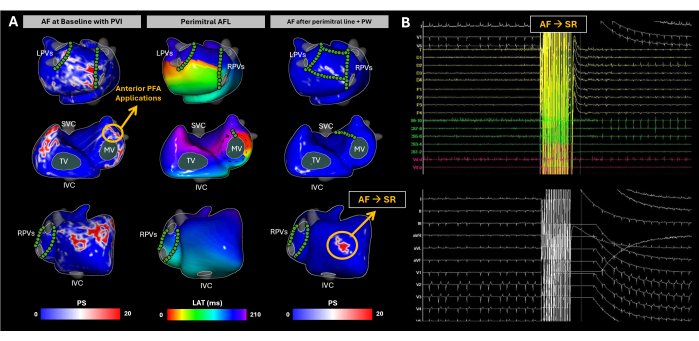
Figura 10: Monitoraggio dell'evoluzione del substrato atriale durante l'ablazione transcatetere con FA utilizzando la mappatura ECGI non invasiva senza immagini. (A) Viste posteriore-anteriore, antero-posteriore e laterale destra di ECGI senza immagini, con siti PFA contrassegnati da cerchi verdi. La mappa PS di base evidenzia i rientri nella parete laterale dell'AR, nella base dell'RAA, nella parete posteriore dell'LA e nella base dell'LAA. La PFA alla base LAA ha cambiato il ritmo verso l'AFL perimite. Nonostante il completamento della linea mitrale e l'isolamento della parete posteriore, la FA è stata nuovamente indotta spontaneamente. L'ECGI ha rivelato la PS nella base RAA, che è diventata l'obiettivo dell'ablazione. In quell'area sono state eseguite più applicazioni di PFA e il ritmo sinusale è stato ripristinato. (B) L'ECG a 12 derivazioni e i segnali intracardiaci al momento della FA sono cambiati in SR. Abbreviazioni: SVC: vena cava superiore; IVC: vena cava inferiore; LPV: vene polmonari sinistre; RPV: vene polmonari destre; FA: fibrillazione atriale, SR: ritmo sinusale, PS: singolarità di fase, LAT: tempi di attivazione locale, TV: valvola tricuspide, MV: valvola mitrale, PVI: isolamento della vena polmonare, AFL: flutter atriale, PW: parete posteriore e PFA: ablazione in campo pulsato. Clicca qui per visualizzare una versione più grande di questa figura.
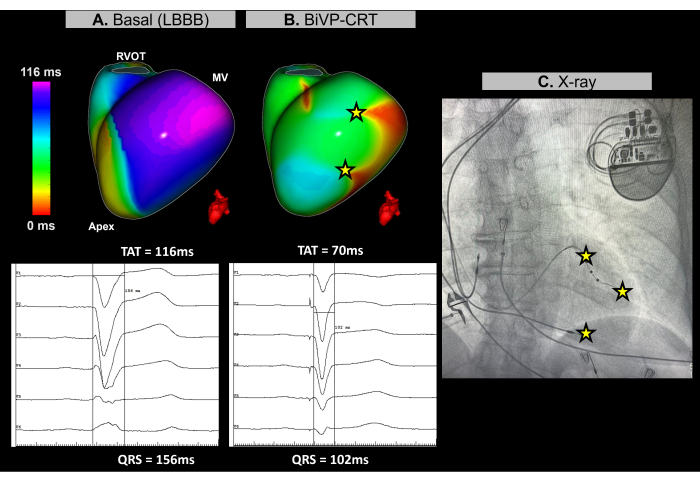
Figura 11: Ottimizzazione della stimolazione biventricolare mediante ECGI senza immagini. (A) Ritmo basale del paziente. La mappa ECGI senza immagini (vista laterale sinistra) rivela una regione ad attivazione tardiva (viola) nella parete laterale del ventricolo sinistro, con un TAT di 116 ms, che indica una dissincronia ventricolare. Questo si allinea con l'ECG basale, che mostra un ampio complesso QRS (156 ms) con un pattern LBBB. (B) Configurazione post-impianto del pacemaker. Dopo BiVP con attivazione simultanea dei poli distale e prossimale dell'elettrocatetere ventricolare sinistro e un ritardo atrioventricolare di 140 ms, la mappa ECGI senza immagine non mostra regioni attivate ritardate (nessuna area viola), indicando un'attivazione ventricolare sincrona e un TAT ridotto di 70 ms. Ciò è coerente con il complesso QRS accorciato osservato nell'ECG finale, dove la durata del QRS diminuisce a 102 ms. (C) Vista a raggi X antero-posteriore del pacemaker impiantato, che mostra la posizione degli elettrodi del pacemaker. L'attività di stimolazione dei poli distale e prossimale dell'elettrocatetere LV si riflette anche nella mappa ECGI. Abbreviazioni: LBBB: blocco di branca sinistra, BiVP: stimolazione biventricolare, CRT: terapia di risincronizzazione cardiaca, RVOT: tratto di efflusso ventricolare destro, MV: valvola mitrale, TAT: tempo totale di attivazione. Clicca qui per visualizzare una versione più grande di questa figura.
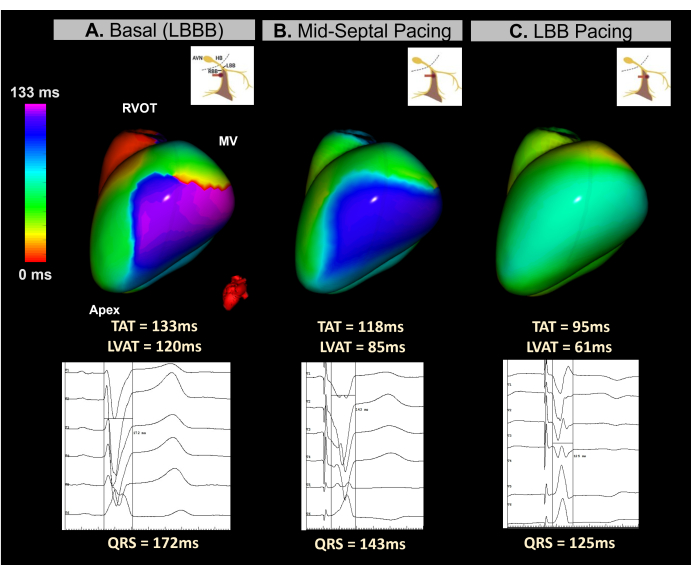
Figura 12: Valutazione non invasiva della CRT tramite stimolazione del sistema di conduzione utilizzando ECGI senza immagini. (A) Ritmo basale del paziente. La mappa ECGI (vista laterale sinistra) indica una regione di attivazione ritardata (viola) sulla parete laterale del ventricolo sinistro, con un TAT di 133 ms, suggerendo una dissincronia ventricolare. Ciò corrisponde all'ECG basale, che mostra un ampio complesso QRS (172 ms) tipico del BBS. (B) Fase intermedia (stimolazione medio-settale) durante l'impianto dell'elettrocatetere LBBP. La mappa non invasiva mostra una correzione parziale della regione ritardata nel LV, con il colore che cambia dal viola al blu. Ciò è accompagnato da una riduzione della durata del complesso QRS. (C) La posizione finale del cavo LBBP durante il processo di avvitamento. La mappa dimostra la correzione completa dell'area ritardata, con il colore che passa dal viola al verde, indicando l'attivazione sincrona di entrambi i ventricoli. Abbreviazioni: LBBB: blocco di branca sinistro, LBB: branca sinistra, RVOT: tratto di efflusso ventricolare destro, MV: valvola mitrale, TAT: tempo totale di attivazione. Clicca qui per visualizzare una versione più grande di questa figura.
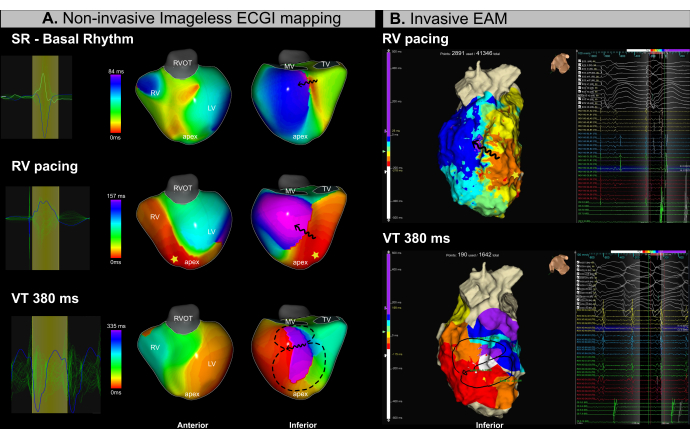
Figura 13: Valutazione non invasiva dell'istmo VT mediante ECGI senza immagini. (A) La mappatura ECGI senza immagine durante la procedura di ablazione VT identifica il substrato aritmogeno e l'istmo VT nelle regioni infero-basale e infero-mediale del LV. La prima fila corrisponde al ritmo sinusale, la fila centrale alla stimolazione apicale del ventricolo destro e la fila inferiore alla TV. (B) L'EAM invasiva ottenuta durante la procedura di ablazione VT mostra una mappatura dell'attivazione isocrona nelle stesse regioni identificate dall'ECGI. La riga superiore corrisponde alla pacing apicale del RV, mentre la riga inferiore rappresenta la VT. Abbreviazioni: RV: ventricolo destro, LV: ventricolo sinistro, SR: ritmo sinusale, RVOT: tratto di efflusso ventricolare destro, MV: valvola mitrale, TV: valvola tricuspide. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Questa descrizione metodologica evidenzia l'utilità clinica di un approccio ECGI non invasivo, a battito singolo e in tempo reale, in grado di supportare una varietà di procedure elettrofisiologiche, come l'ablazione transcatetere e la CRT, senza la necessità di imaging cardiaco pre-procedurale come TC o RM 15,17,31,32 In questo rapporto, l'ECGI senza immagini dimostra le caratteristiche tecniche chiave che possono promuoverne l'adozione clinica. Sebbene l'ECGI abbia già dimostrato di essere un potente strumento per la mappatura cardiaca in un'ampia gamma di aritmie 19,33,34,35,36, continua ad affrontare diverse sfide cliniche e tecniche 13,14.
I sistemi ECGI classici necessitano di una TAC specificamente lo stesso giorno della mappatura cardiaca, con gli elettrodi ECGI in posizione 9,10,12,37,38. Questo approccio aggiunge tempo extra a causa della necessità di segmentazione della scansione TC (cuore ed elettrodi), ritardando la generazione della mappa ECGI iniziale di circa 1-3 ore. Al contrario, il sistema ECGI senza immagini presentato in questo rapporto utilizza una scansione 3D a infrarossi del torace con elettrodi array ad alta densità, che può essere eseguita pochi minuti prima della procedura o durante le consultazioni mediche15,17. Il sistema segmenta automaticamente gli elettrodi toracici e stima la geometria cardiaca del paziente, semplificando il processo di mappatura cardiaca non invasiva e riducendo significativamente il tempo che intercorre tra l'arrivo del paziente e la disponibilità della prima mappa ECGI. La precedente convalida dell'approccio ECGI senza immagini ha dimostrato che l'utilizzo della geometria cardiaca stimata introduce errori minimi, mantenendo l'accuratezza delle mappe non invasive. Nei pazienti con FA, è stata osservata una forte correlazione tra i segnali ECGI derivati dalle geometrie cardiache stimate rispetto a quelle effettive, anche con traslazioni geometriche15. Per le aritmie regolari, come la tachicardia atriale complessa, i confronti con l'EAM hanno dimostrato un'elevata accuratezza nell'identificare la camera cardiaca coinvolta, nel determinare il meccanismo (focale o rientrante) e nell'inferire l'obiettivo di ablazione31. Nel caso della TV, l'approccio è stato valutato per guidare gli operatori verso le aree di istmo VT durante il ritmo sinusale (SR)39, il che mostra il potenziale per identificare i pazienti a rischio di TV nella prevenzione primaria. Inoltre, durante la stimolazione del seno coronarico è stata osservata una forte congruenza regionale tra le mappe di attivazione ECGI senza immagini e EAM, in particolare nei siti di attivazione precoce e tardiva40.
Nella CRT, i cambiamenti morfologici in tempo reale nell'ECG a 12 derivazioni sono tipicamente utilizzati per confermare la risincronizzazione durante l'impianto dell'elettrocatetere, in particolare nelle procedure CSP in cui l'ECG viene valutato in varie fasi del posizionamento dell'elettrocatetere settale fino a raggiungere l'area LBB. Tuttavia, gli algoritmi ECG pubblicati sono spesso complessi, mostrano differenze significative tra loro e in alcuni casi sono difficili da implementare nella pratica clinica 41,42,43. Probabilmente a causa di questa complessità, non è stato identificato in modo coerente alcun parametro elettrocardiografico specifico per la stimolazione del ramo sinistro (LBBP) in grado di prevedere in modo affidabile se un paziente risponderà alla risincronizzazione cardiaca. L'approccio ECGI senza immagini in tempo reale offre una mappatura semplice e dettagliata, battito per battito durante l'impianto dell'elettrocatetere, valutando la correzione della dissincronia valutando parametri come il tempo di attivazione del ventricolo sinistro, come dimostrato nei pazienti con indicazione CRT32 o in quelli con blocco AV44. Pertanto, con ulteriori indagini, i parametri ECGI in tempo reale potrebbero potenzialmente guidare gli operatori nell'ottimizzazione della posizione di impianto dell'elettrocatetere o nella previsione della risposta del paziente alla CRT.
Sebbene il potenziale dell'ECGI senza immagini in tempo reale sia stato presentato in questo rapporto metodologico, altri nuovi approcci di mappatura non invasiva che utilizzano simulazioni di aritmia hanno anche mirato a eliminare la necessità di imaging pre-procedurale. Lo studio VMAP (Vectorcardiographic Mapping of Arrhythmogenic Probability (VMAP) ha dimostrato una significativa accuratezza regionale nell'individuare i siti di aritmia ventricolare45 e si mostra promettente nell'identificare la posizione dei driver di FA oltre l'ablazione non-PVI46. VMAP utilizza l'ECG a 12 derivazioni in combinazione con più modelli computazionali per identificare i target di aritmia senza fare affidamento su dati geometrici specifici del paziente. Tuttavia, questo approccio può non essere ottimale per le aritmie atriali come la FA, in cui le componenti ad alta frequenza sull'ECG di superficie sono cruciali per identificare i driver dell'aritmia in modo non invasivo. Questi componenti sono tipicamente catturati da elettrodi sulle superfici posteriore e antero-laterale27, che non sono rappresentati nell'ECG standard a 12 derivazioni utilizzato nella pratica clinica.
Nonostante la necessità di ulteriori indagini cliniche, l'ECGI senza immagini in tempo reale ha il potenziale per diventare uno strumento prezioso per la mappatura cardiaca non invasiva in un'ampia gamma di aritmie. La sua semplicità metodologica e il flusso di lavoro semplificato del paziente in ambito ospedaliero consentono ai medici di raccogliere più dati clinici, che potrebbero migliorare sia gli esiti dei pazienti che i futuri progressi tecnologici. In conclusione, il futuro della mappatura cardiaca non invasiva risiede nell'avanzare verso un approccio completamente privo di immagini, che consenta un'integrazione più rapida e fluida nella pratica clinica quotidiana, dalle consultazioni di routine alla mappatura in tempo reale durante le procedure elettrofisiologiche.
Divulgazioni
JRP, BPS, JSC, IHR, RM, CF, EZ, JM, DL, FA, MSG e AMC hanno ricevuto la laurea onoraria da Corify Care SL. AMC, MSG e FA sono co-fondatori di Corify Care SL e JRP, BPS, JSC, IHR, JM, DL, JBG, FA, LM, MSG e AMC sono azionisti. TFA ha ricevuto sovvenzioni per la ricerca da Biosense-Webster. IRL ha ricevuto onorari come docente e consulente da Abbott e Biosense-Webster. APS ha ricevuto onorari di relatore e consulente da Bisosense-Webster, Abbott e Boston-Scientific. JMT ha ricevuto onorari come docente e consulente da Abbott, Boston-Scientific e Medtronic. EA ha ricevuto onorari di relatore e consulente da Biosense-Webster e Bayer. LM riporta onorari come consulente, docente e comitato consultivo da Boston-Scientific, Abbott, Johnson & Johnson e Medtronic ed è azionista di Galgo Medical SL. JBG riporta onorari come consulente e relatore da Microport CRM e Abbott, oltre al sostegno illimitato di sovvenzioni per una borsa di studio da Abbott. MPL ha ricevuto onorari di relatore da Medtronic.
Riconoscimenti
Questa ricerca è stata finanziata dall'Istituto Europeo di Innovazione e Tecnologia (EIT) nell'ambito della convenzione di sovvenzione SAVE-COR n. 220385 e dalla sovvenzione CIAICO/2022/020 finanziata dalla Generalitat Valenciana (EFICACIA). Un ulteriore sostegno è arrivato dalla Generalitat Valenciana (sovvenzione CIAPOS/2021/238, ACIF/2021/205, CIBEFP/2022/9), MCIN/AEI/10.13039/501100011033 e dall'FSE Investing in Your Future (sovvenzione RYC2018-024346-I), dall'Instituto de Salud Carlos III (sovvenzione CIBERCV16 CB16/11/00354) e dalla Catalogna, Spagna (sovvenzione 2021_SGR_01350, SGR21/GENCAT). Ringraziamo anche il sostegno del Programma CERCA/Generalitat de Catalunya. MPL finanziato (2023-2025) attraverso un contratto Río Hortega CM22/00107 [Instituto de Salud Carlos III (ISCIII); Fondo Social Europeo (FSE)]. Gli autori ringraziano Neus Portella e Sheila Marco per il supporto alla segreteria e alle équipe mediche e infermieristiche per il loro supporto clinico presso l'Hospital Clínic de Barcelona, l'Hospital General Universitario Gregorio Marañón, l'Hospital Universitari i Politècnic La Fe. Si estendono anche grazie ad Almudena Albertos di Corify Care SL, Madrid, Spagna e Arantxa Carrasco dell'Universitat Politecnica de Valencia.
Materiali
| Name | Company | Catalog Number | Comments |
| ACORYS Mapping System | Corify Care SL | ACORYS | Imageless ECGI system |
| ACORYS 3D Scan Software | Corify Care SL | ACSCAN | 3D scanner app |
| ACORYS Amplifier | Corify Care SL | ACAMP | Biopotential amplifier |
| ACORYS Sensor Vest | Corify Care SL | ACSEN | Sensor vest, 4 components (Front Right, Front Left, Back Right and Back Left) |
| ACORYS Software | Corify Care SL | ACSOF, version 1.2 | Imageless ECGI software |
| Affera mapping system | Medtronic | AFR-00003 | |
| CADENCE Adult mulifuntion defibrillation electrodes | Cardinal Health | 22660R | |
| Catheter extension cable | Medtronic | AFR-00006 | |
| Desktop or portable PC workstation | Any | Windows 11 as the operating system | Imageless ECGI workstation. The processor must be at least an Intel i7 from the 2020 generation or newer. It requires a minimum of 32 GB of RAM and 500 GB of SSD storage. Additionally, a compatible version of .NET Framework must be installed. An internet connection is not required. |
| Dynamic XT 10E 2 5 2 MM Diagnostic Catheter | Boston Scientific | M0042011010 | |
| EP-TRACER 2 ProCart | Cardiotek | The system includes several components provided by the company | |
| External Defibrillator Monitor | PHILLIPS | Efficia DFM100 | |
| Fentanyl | Kern pharma | 1004000143-03 | |
| Heparine | Reig Jofre | 608737.4 O | |
| HexaFlow irrigation pump | Medtronic | AFR-00005 | |
| HexaGen RF generator | Medtronic | AFR-00004 | |
| HexaPulse PF generator | Medtronic | AFR-00008 | |
| INTELLAMAP ORIO Mapping Catheter | Boston Scientific | M004RC64S0 | |
| IntellaNav StablePoint Ablation Catheter | Boston Scientific | M004ERFSDS96200 | |
| iPad mini | Apple | 6th generation A2567 | 3D scanner platform |
| iPadOS | Apple | 15.3 or superior | 3D scanner platform |
| Isolated Ethernet Cable | Corify Care SL | ACNET | Ethernet cable |
| Isoprenaline | Reig Jofre | 7227007 | |
| Left Connector Cable | Corify Care SL | ACCAB_L | Left cables |
| Location Reference Patch Kit | Boston Scientific | M004RAPATCH20 | |
| Location reference patch kit | Medtronic | AFR-00007 | |
| MetriQ Tubing Set | Boston Scientific | M0041170 | |
| Midazolam | Normon | X5XF1 | |
| Physiological Saline Solution for Irrigation | Fabrenius Kabi | br14801 | |
| Propofol | B Braun | 855437.9 OH | |
| Remifentanil | Kern pharma | 672786.7 | |
| RHYTHMIA HD | Boston Scientific | M004 RBINSTALL2ROW0 | |
| Right Connector Cable | Corify Care SL | ACCAB_R | Right cables |
| Single Patient Use ECG Electrodes | Ambu | M-00-S | |
| Sphere-9 mapping and ablation catheter | Medtronic | AFR-00001 | |
| Structure SDK | Structure | 2.2.1 for iOS or superior | 3D scanner platform, infrared structured light camera |
| Structure Sensor Pro | Structure | ST02B. Firmware version 1.2 or superior | 3D scanner platform, infrared structured light camera |
| Sugamadex Teva | Normon | 7340157-OH | |
| Tubing set | Medtronic | AFR-00002 | |
| WorkMate Claris System | Abbott | H700123 | |
| X-Ray C-Arm | Phillips | The system includes several components provided by the company |
Riferimenti
- Narayan, S. M., John, R. M. Advanced electroanatomic mapping: current and emerging approaches. Curr Treat Options Cardiovasc Med. 26 (4), 69-91 (2024).
- Raiman, M., Tung, R. Automated isochronal late activation mapping to identify deceleration zones: rationale and methodology of a practical electroanatomic mapping approach for ventricular tachycardia ablation. Comput Biol Med. 102, 336-340 (2018).
- Guichard, J. -. B., et al. Substrate mapping for ventricular tachycardia ablation through high-density whole-chamber double extra stimuli. JACC Clin Electrophysiol. 10 (7), 1534-1547 (2024).
- Takigawa, M., et al. Are wall thickness channels defined by computed tomography predictive of isthmuses of postinfarction ventricular tachycardia. Heart Rhythm. 16 (11), 1661-1668 (2019).
- Vázquez-Calvo, S., et al. Noninvasive detection of slow conduction with cardiac magnetic resonance imaging for ventricular tachycardia ablation. Europace. 26 (2), euae025 (2024).
- Sánchez-Somonte, P., et al. Scar channels in cardiac magnetic resonance to predict appropriate therapies in primary prevention. Heart Rhythm. 18 (8), 1336-1343 (2021).
- Roca-Luque, I., et al. Post-ablation cardiac magnetic resonance to assess ventricular tachycardia recurrence (PAM-VT study). Eur Heart J Cardiovasc Imaging. 25 (2), 188-198 (2023).
- Roca-Luque, I., et al. Ventricular scar channel entrances identified by new wideband cardiac magnetic resonance sequence to guide ventricular tachycardia ablation in patients with cardiac defibrillators. Europace. 22 (4), 598-606 (2020).
- Rudy, Y., Burnes, J. E. Noninvasive electrocardiographic imaging. Ann Noninvasive Electrocardiol. 4 (3), 340-359 (1999).
- Haissaguerre, M., et al. Noninvasive panoramic mapping of human atrial fibrillation mechanisms: a feasibility report. J Cardiovasc Electrophysiol. 24 (6), 711-717 (2013).
- Tsyganov, A., et al. Mapping of ventricular arrhythmias using a novel noninvasive epicardial and endocardial electrophysiology system. J Electrocardiol. 51 (1), 92-98 (2018).
- Pereira, H., Niederer, S., Rinaldi, C. A. Electrocardiographic imaging for cardiac arrhythmias and resynchronization therapy. Europace. 22 (10), 1447-1462 (2020).
- Duchateau, J., et al. Performance and limitations of noninvasive cardiac activation mapping. Heart Rhythm. 16 (3), 435-442 (2019).
- Cluitmans, M., et al. Validation and opportunities of electrocardiographic imaging: from technical achievements to clinical applications. Front Physiol. 9, 1305 (2018).
- Molero, R., González-Ascaso, A., Climent, A. M., Guillem, M. S. Robustness of imageless electrocardiographic imaging against uncertainty in atrial morphology and location. J Electrocardiol. 77, 58-61 (2023).
- Rodrigo, M., et al. Noninvasive assessment of complexity of atrial fibrillation: correlation with contact mapping and impact of ablation. Circ Arrhythm Electrophysiol. 13 (3), e007700 (2020).
- Invers-Rubio, E., et al. Regional conduction velocities determined by noninvasive mapping are associated with arrhythmia-free survival after atrial fibrillation ablation. Heart Rhythm. 21 (9), 1570-1580 (2024).
- Fambuena-Santos, C., et al. AF driver detection in pulmonary vein area by electrocardiographic imaging: relation with a favorable outcome of pulmonary vein isolation. Front Physiol. 14, 1057700 (2023).
- San Antonio, R., et al. Optimized single-point left ventricular pacing leads to improved resynchronization compared with multipoint pacing. Pacing Clin Electrophysiol. 44 (3), 519-527 (2021).
- Zacur, E., et al. MRI-Based Heart and Torso Personalization for Computer Modeling and Simulation of Cardiac Electrophysiology. Imaging for Patient-Customized Simulations and Systems for Point-of-Care Ultrasound. 10549, (2017).
- Bell, J. B., Tikhonov, A. N., Arsenin, V. Y. Solutions of ill-posed problems. Math Comput. 32 (144), 1320 (1978).
- Oster, H. S., Taccardi, B., Lux, R. L., Ershler, P. R., Rudy, Y. Electrocardiographic imaging: noninvasive characterization of intramural myocardial activation from inverse-reconstructed epicardial potentials and electrograms. Circulation. 97 (15), 1496-1507 (1998).
- Figuera, C., et al. Regularization techniques for ECG imaging during atrial fibrillation: a computational study. Front Physiol. 7, 466 (2016).
- Molero, R., et al. Improving electrocardiographic imaging solutions: a comprehensive study on regularization parameter selection in L-curve optimization in the atria. Comput Biol Med. 182, 109141 (2024).
- Hernández-Romero, I., et al. Local conduction velocity estimation during wavefront collisions and reentrant scenarios. 2022 Computing in Cardiology (CinC). , (2022).
- Rodrigo, M., et al. Technical considerations on phase mapping for identification of atrial reentrant activity in direct- and inverse-computed electrograms. Circ Arrhythm Electrophysiol. 10 (9), e005008 (2017).
- Guillem, M. S., et al. Noninvasive localization of maximal frequency sites of atrial fibrillation by body surface potential mapping. Circ Arrhythm Electrophysiol. 6 (2), 294-301 (2013).
- Pedrón-Torrecilla, J., et al. Noninvasive estimation of epicardial dominant high-frequency regions during atrial fibrillation. J Cardiovasc Electrophysiol. 27 (4), 435-442 (2016).
- Tzeis, S. 2024 European Heart Rhythm Association/Heart Rhythm Society/Asia Pacific Heart Rhythm Society/Latin American Heart Rhythm Society expert consensus statement on catheter and surgical ablation of atrial fibrillation. Europace. 26 (4), euae043 (2024).
- Parreira, L., et al. Noninvasive three-dimensional electrical activation mapping to predict cardiac resynchronization therapy response: site of latest left ventricular activation relative to pacing site. Europace. 25 (4), 1458-1466 (2023).
- Reventos-Presmanes, J., et al. Noninvasive electrocardiographic imaging for the characterization of complex atrial tachyarrhythmias. Europace. 25 (Supplement_1), (2023).
- Regany, M., et al. ECG imaging as a real time tool to guide left bundle branch pacing implant in patients with left bundle branch block and resynchronization therapy indication. Europace. 26 (Supplement_1), (2024).
- Rudy, Y. Noninvasive electrocardiographic imaging of arrhythmogenic substrates in humans. Circ Res. 112 (5), 863-874 (2013).
- Shah, A. J., et al. Validation of novel 3-dimensional electrocardiographic mapping of atrial tachycardias by invasive mapping and ablation. J Am Coll Cardiol. 62 (10), 889-897 (2013).
- Graham, A. J., et al. Evaluation of ECG imaging to map hemodynamically stable and unstable ventricular arrhythmias. Circ Arrhythm Electrophysiol. 13 (2), e007377 (2020).
- Pujol-Lopez, M., et al. Conduction system pacing vs biventricular pacing in heart failure and wide QRS patients. JACC Clin Electrophysiol. 8 (11), 1431-1445 (2022).
- Rudy, Y., Lindsay, B. D. Electrocardiographic imaging of heart rhythm disorders. Cardiac Electrophysiol Clin. 7 (1), 17-35 (2015).
- Haissaguerre, M., et al. Driver domains in persistent atrial fibrillation. Circulation. 130 (7), 530-538 (2014).
- Reventos-Presmanes, J., et al. Noninvasive assessment of the ventricular tachycardia isthmus during sinus rhythm. Europace. 26 (Supplement_1), (2024).
- Ros, S., et al. Imageless electrocardiographic imaging for atrial electrophysiological characterization: a validation study. Europace. 26, (2024).
- Wu, S., et al. Left bundle branch pacing for cardiac resynchronization therapy: nonrandomized on-treatment comparison with his bundle pacing and biventricular pacing. Can J Cardiol. 37 (2), 319-328 (2021).
- Pujol-López, M., et al. Stepwise application of ECG and electrogram-based criteria to ensure electrical resynchronization with left bundle branch pacing. Europace. 25 (6), euad128 (2023).
- Zhu, K., Chang, D., Li, Q. Which is more likely to achieve cardiac synchronization: left bundle branch pacing or left ventricular septal pacing. Front Cardiovasc Med. 9, 845312 (2022).
- Martinez-Perez, M., et al. Real-time assessment of LV synchrony in AV block population undergoing LBB pacing using ECG imaging. Europace. 26 (Supplement_1), (2024).
- Krummen, D. E., et al. Forward-solution noninvasive computational arrhythmia mapping: the VMAP study. Circ Arrhythm Electrophysiol. 15 (9), (2022).
- Gu, K., et al. Ablation of non-pulmonary vein atrial fibrillation drivers identified by vMap in addition to pulmonary vein isolation improves procedural outcomes. 29th annual AF Symposium 2024. , (2024).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon