Method Article
מיפוי לב בזמן אמת עם מערכת הדמיה אלקטרוקרדיוגרפית לא פולשנית ללא תמונה
In This Article
Summary
מחקר זה מציג גישה חדשה למיפוי לב בזמן אמת באמצעות מערכת הדמיה אלקטרוקרדיוגרפית לא פולשנית וחסרת תמונה. מערכת זו מאפשרת קבלת מפות לב אלקטרופיזיולוגיות ללא צורך בטומוגרפיה ממוחשבת טרום פרוצדורלית או סריקות הדמיית תהודה מגנטית, מה שמאפשר הנחיה יעילה להליכים לבביים כגון אבלציה ושתלים לטיפול בסינכרון לב.
Abstract
מיפוי לב מהיר, בטוח ויעיל הוא קריטי לניהול הפרעות קצב מורכבות, אך השיטות הנוכחיות מתמודדות עם מגבלות משמעותיות. האלקטרוקרדיוגרמה בעלת 12 העופרת (ECG), למרות שהיא חיונית לאבחון ראשוני, חסרה את הרזולוציה המרחבית והעומק הדרושים להנחיית הליכים מתקדמים כגון אבלציה בצנתר או השתלת מכשיר לטיפול בסינכרון לב. מצד שני, טכניקות מיפוי פולשניות מספקות פעילות חשמלית מפורטת אך דורשות מיקומי צנתרים מרובים, מה שמגדיל את הסיכונים והמורכבות הפרוצדורלית. שיטות אלו גוזלות זמן, יקרות ומציעות הערכה מוגבלת בזמן אמת, במיוחד בהפרעות קצב דינמיות כמו פרפור פרוזדורים (AF), הפרעות קצב לא יציבות וטיפול בסנכרון מחדש של הלב (CRT).
מחקר זה מציג מערכת הדמיה אלקטרוקרדיוגרפית לא פולשנית וחסרת תמונה (Imageless-ECGI) שנועדה להשלים שיטות מסורתיות על ידי מתן מפות לב בזמן אמת, פעימה לפעום. ללא צורך בהדמיה טרום פרוצדורלית, מערכת זו לוכדת פעילות חשמלית ברזולוציה גבוהה על פני כל הלב, ומציעה אלטרנטיבה בטוחה ויעילה יותר למיפוי פולשני. על ידי שילוב המיידיות של הקלטות פני השטח עם הדיוק המרחבי של מודלים חישוביים מודרניים, מערכת Imageless-ECGI מגשרת על הפער בין א.ק.ג מסורתי למיפוי פולשני, ועשויה לשנות את זרימת העבודה במעבדות אלקטרופיזיולוגיה.
Introduction
הצורך במיפוי אלקטרופיזיולוגי לא פולשני הפך חשוב יותר ויותר להערכה מדויקת של פעילות הלב, במיוחד בחולים העוברים פרוצדורות הפרעות קצב מורכבות, כגון פרפור פרוזדורים (AF) ואבלציה של טכיקרדיה חדרית (VT), או במהלך השתלת קוצבי לב ומכשירי טיפול בסנכרון לב (CRT). נכון לעכשיו, מיפוי אלקטרואנטומי תלת מימדי (3D) (EAM) נותר תקן הזהב להנחיית מפעילים במהלך אבלציה בצנתר1 על ידי מתן מפות פונקציונליות מקיפות לאפיון הפרעות קצב 2,3. עם זאת, EAM אינו אופטימלי ללכידת הדפוסים המרחביים-זמניים הדינמיים של AF, הפרעות קצב לא מתמשכות, וההליך הארוך והפולשני הנדרש למיפוי הופך אותו לבלתי מעשי לשימוש בהליכי CRT.
שיטות לא פולשניות מסורתיות, כגון אלקטרוקרדיוגרמה עם 12 מוליכים (ECG), למרות שהן מדויקות ביותר לזיהוי מוקדי הפרעות קצב ספציפיות (למשל, דרכי יציאה או VT תלוליות), מציעות תובנה מוגבלת לגבי ההתנהגות החשמלית הגלובלית של הלב. מגבלה זו בולטת במיוחד כאשר נדרש מיפוי בזמן אמת כדי להנחות התערבויות בהפרעות קצב דינמיות ומורכבות, כאשר לוקליזציה מדויקת של אזורים הפרעות קצב היא חיונית לתוצאות מוצלחות. מיפוי לא פולשני יכול למלא תפקיד חשוב בשיפור התכנון הקדם-פרוצדורלי ומתן משוב בזמן אמת במהלך התערבויות אלקטרופיזיולוגיות.
כדי לתמוך באלקטרופיזיולוגים לפני הפרוצדורה, התקדמות בשיטות הדמיית לב, כגון טומוגרפיה ממוחשבת (CT) והדמיית תהודה מגנטית (MRI), הוכחה כיעילה במתן מידע מבני מפורט, כולל עובי דופן4 ופיברוזיס שריר הלב 5,6,7,8 . עם זאת, שיטות אלה מתמקדות בתכונות אנטומיות ומבניות, ומשאירות פער במיפוי חשמלי פונקציונלי. בנוסף, השגת תמונות לב באיכות גבוהה דורשת פרוטוקולי סריקה מיוחדים, כוח אדם מיומן ושיטות עיבוד מורכבות כמו פילוח מתקדם ואפיון רקמות מדויק, במיוחד לאיתור פיברוזיס לבבי.
מערכות הדמיה אלקטרוקרדיוגרפיות קלאסיות (ECGI) התגלו כאופציה לא פולשנית, המציעות תוצאות מבטיחות על ידי שחזור פעילות חשמלית לבבית על סמך פוטנציאל פני הגוף (BSP)9,10,11,12. למרות הפוטנציאל שלהן, מערכות ECGI מתמודדות עם מגבלות בולטות13,14. ראשית, הם דורשים סריקות CT טרום פרוצדורליות כדי למפות את מיקומי האלקטרודות על גיאומטריות לבביות, מה שהופך את השימוש השגרתי הקליני שלהם לפחות אפשרי. שנית, שיטות רגולציה מסורתיות המשמשות לפתרון הבעיה ההפוכה של מיפוי הלב מציגות לעתים קרובות דפוסי התפשטות לא פיזיולוגיים, המגבילים את הדיוק שלהם במסגרות קליניות.
מטרת מחקר זה הייתה לתאר את התכונות והנהלים של מערכת ECGI לא פולשנית חדשה המסוגלת למפות בזמן אמת ללא צורך ב-CT או MRI15, הידועה בשם Imageless ECGI. חקרנו את ההתקדמות של Imageless ECGI והצגנו יישומים קליניים פוטנציאליים למיפוי אלקטרופיזיולוגי, תוך התגברות על המגבלות של טכניקות קיימות כמו EAM, א.ק.ג 12 מוליכים ו-ECGI קלאסי בניהול הליכי הפרעות קצב מורכבות. גישה זו מאפשרת יצירת מפות לב תוך דקות מהגעת המטופל, ייעול זרימת העבודה וקיצור זמן ההכנה. בנוסף, המערכת משתמשת באלגוריתמים מתקדמים לעיבוד אותות כדי ליצור דפוסי התפשטות פיזיולוגיים מדויקים, לשפר את לוקליזציה של הפרעות קצב ותוצאות פרוצדורליות.
Protocol
המתודולוגיה אומתה באופן פרוספקטיבי במחקר קליני תצפיתי רב-מרכזי. המחקר נערך בהתאם להצהרת הלסינקי ולסטנדרטים האתיים של המוסדות המעורבים. פרוטוקול המחקר, SAVE-COR (NCT05772182), אושר על ידי הוועדות האתיות של בית החולים האוניברסיטאי גרגוריו מרניון, בית החולים קליניק דה ברצלונה ובית החולים האוניברסיטאי הפוליטי לה פה, והתקבלה הסכמה מדעת מכל המטופלים.
הערה: תיאורים מפורטים של קריטריוני ההכללה וההחרגה הם:
קריטריונים להכללה: (i) אינדיקציה למחקר אלקטרואנטומי פולשני ו/או השתלה של מכשירי קוצב תוך-חללי. (2) השגת הסכמה מדעת וחתימה על הכללה במחקר.
קריטריונים לאי הכללה: (i) גיל <18. (ii) חוסר יכולת לעבור צנתור אנדוקרדיאלי (למשל, נשים בהריון או מניקות). (3) חוסר יכולת פיזית או נפשית להבין ולקבל את ההסכמה מדעת. (iv) חוסר יכולת לעמוד זקוף כדי לאפשר שחזור פלג גוף עליון תלת מימדי הנדרש למערכת ECGI. (v) חולים עם פתולוגיות מולדות.
1. הכנת מערכת ECGI ללא תמונה בזמן אמת
- ודא שהמגבר הביו-פוטנציאלי (איור 1A) טעון במלואו והנח אותו בקצה שולחן החדר האלקטרופיזיולוגיה (EP), ליד המקום שבו כפות הרגליים של המטופל ימוקמו.
הערה: הביו-פוטנציאל ampחיים יותר (ראה טבלת חומרים) הוא מכשיר מבודד בעל 128 ערוצים האחראי על ampampדיגיטציה של האותות החשמליים שנאספו על ידי האלקטרודות. - ודא שהכבלים הימניים והשמאליים אינם פגומים על ידי בדיקת מחברי המגבר בקצה אחד והשקעים השחורים, שבהם מחובר אפוד החיישן, בקצה השני (איור 1B).
הערה: הכבלים הימניים והשמאליים (ראה טבלת חומרים) הם באורך 1.5 מ' ומעבירים אותות חשמליים מאפוד החיישן לביו-פוטנציאל ampחיים יותר. - חבר את כבלי המחבר הימני והשמאלי לביו-פוטנציאל ampחיים יותר (איור 1C). כל כבל משויך לתקע המובחן על ידי מספר, שהוא זהה הן לכבל והן למגבר.
- ודא שפלטפורמת סורק התלת-ממד טעונה במלואה ופתח את יישום הסריקה התלת-ממדית.
הערה: יישום הסריקה התלת מימדית הוא תוכנה הפועלת על פלטפורמת סורק תלת מימד (ראה טבלת חומרים) המשתמשת במצלמת אור מבנית אינפרא אדום כדי ליצור שחזור מודל תלת מימד של פלג גוף עליון של המטופל. האפליקציה גם מזהה אוטומטית את המיקום של קודי התגובה המהירה (QR) של האלקטרודה. - ודא שבתחנת העבודה של המחשב (ראה טבלת חומרים) מותקן ממשק המשתמש (UI) של תוכנת ECGI ללא תמונה והוא טעון במלואו.
הערה: תוכנת Imageless ECGI (ראה טבלת חומרים) משלבת אלגוריתמים לעיבוד אותות כדי להעריך את הגיאומטריה הלבבית ולספק מידע רב ערך לאבחון וטיפול בהפרעות קצב לב או הנחיית הליכי השתלת מכשיר לב 16,17,18,19. ממשק המשתמש של המערכת מאפשר למשתמשים לדמיין, לבחור ולנתח אותות אלקטרוקרדיוגרפיים, וליצור מפות אינטראקטיביות של פעילות אפיקרדיאלית המאפשרות הערכה לא פולשנית של תפקוד הלב. - חבר את הביו-פוטנציאל ampחיים יותר לתחנת העבודה באמצעות כבל Ethernet מבודד (ראה טבלת חומרים). הכנס קצה אחד ליציאת ה-Ethernet של המגבר ואת הקצה השני לתחנת העבודה.
הערה: כבל ה-Ethernet המבודד מעביר אותות חשמליים מהביו-פוטנציאל ampחיים יותר לתחנת העבודה. - בחר אפוד חיישן (ראה טבלת חומרים), בדוק את האריזה וודא שהאיטום אינו פגום. אל תשתמש באפוד החיישן אם האריזה נפתחה או פגומה.
- פתח את אריזת אפוד החיישן וודא שארבעת רכיבי האפוד נמצאים בפנים. בחר אריזת אפוד חיישן אחרת אם אחד הרכיבים חסר.
הערה: אפוד החיישן הוא מערך אלקטרודות בצפיפות גבוהה עם 128 אלקטרודות כסף המאפשרות מיפוי בו זמנית של הפעילות החשמלית של פני השטח על פני כל פלג הגוף העליון של המטופל. האפוד הוא רדיו-לוסנט ומכיל ארבעה טלאים המכסים את המשטחים השמאליים והימניים הקדמיים והאחוריים של פלג הגוף העליון. כל אלקטרודה כוללת קוד QR בחזית, המאפשר זיהוי אוטומטי של מיקום האלקטרודה.
2. הכנת מטופל לפני ההליך
- אשפוז המטופל בבית החולים באותו יום של המחקר האלקטרופיזיולוגי או השתלת המכשיר.
- מקם את המטופל עומד או יושב על כיסא או שולחן EP וודא שכל אזור פלג הגוף העליון נקי מבגדים.
- בצע בדיקה ויזואלית של עור המטופל כדי לבדוק אם למטופל יש חופים, פצעים או כל מצב עור אחר כדי להימנע מהצמדת אלקטרודות לאזורים אלה.
- לחלופין, טפח את פלג הגוף העליון לאנשים עם שיער משמעותי כדי למזער את חפצי הרעש ולהפחית את אי הנוחות במהלך הסרת אפוד החיישן.
- מקמו נכון את ארבעת החלקים של אפוד החיישן (קדמי ימין, קדמי שמאל, אחורי ימני ואחורי שמאל) על פלג הגוף העליון של המטופל (איור 2A) והתאימו את האפוד לגודל המטופל על ידי קיפול החיבורים בין האלקטרודות בעת הצורך.
- לחלופין, עבור הליכי CRT, הימנע מהצבת אלקטרודות באזור שבו יוחדר שתל הלב, הממוקם לרוב בחזה העליון השמאלי.
הערה: ניתן לנתק בבטחה חיבורים עם מקפים מודפסים במידת הצורך, מכיוון שאין מסלולים פעילים באזורים אלה. - הנח את האלקטרודות המונעות ברגל ימין (RLD) והייחוס (REF) של אפוד החיישן על רגל ימין ושמאל, בהתאמה, רחוק ככל האפשר מאלקטרודות האפוד האחרות.
- הקפידו על תאורת חדר נאותה וודא שאין חפצים בקוטר של 1.5 מ' סביב פלג הגוף העליון של המטופל, מכיוון שהם עלולים להפריע או לעוות את שחזור פלג הגוף העליון התלת מימדי.
- מקמו את המטופל עם זרועותיו מעל הראש כדי למנוע הפרעה לשחזור פלג גוף עליון תלת-ממדי, כפי שניתן לראות באיור 2C.
- השג את שחזור פלג גוף עליון תלת מימדי של המטופל.
- תפוס את פלטפורמת הסורק התלת-ממדי ופתח את יישום הסריקה התלת-ממדית.
- סרוק את קוד ה-QR בצד הצדדי של רכיב האפוד הקדמי הימני כדי לאמת את אפוד החיישן (איור 2B), וודא שהוא חד-פעמי ולא פג תוקפו.
הערה: לאחר זיהוי קוד ה-QR, יישום הסריקה התלת-ממדית מאפשר רכישת שחזור פלג גוף עליון תלת-ממדי. - מקמו את פלטפורמת הסורק התלת-ממדית בגובה פלג הגוף העליון מול המטופל, החזיקו אותה בחוזקה בשתי הידיים, והשלימו סיבוב של 360 מעלות סביב המטופל כדי לרכוש את שחזור פלג הגוף העליון התלת-ממדי (איור 2C).
הערה: ככל שהסריקה מתקדמת, מצלמת האור המובנית האינפרא אדום מפלטפורמת סורק התלת מימד יוצרת רשת סגורה תלת מימדית בצבע אפור של פלג הגוף העליון, ומשלימה את התהליך בסיבוב מלא. בדרך כלל, תהליך שחזור פלג גוף עליון תלת מימדי דורש 1-2 דקות להשלמתו. - ערכו בדיקה ויזואלית של שחזור פלג גוף עליון תלת-ממדי כדי לוודא שכל פלג הגוף העליון מכוסה בצל אפור ושאין חורים ברשת המשוחזרת.
- שמור את שחזור פלג הגוף העליון התלת-ממדי באפליקציה לאחר סיום הסריקה.
- בקש מהמטופל לשכב על שולחן חדר ה-EP.
- חבר את ארבעת החלקים של אפוד החיישן לכבלי המחבר הימני והשמאלי המתאימים (איור 1D). חבר את מחברי האפוד הקדמי-ימני והאחורי-ימני לשקע הכבל הימני ואת מחברי האפוד הקדמי-שמאלי והאחורי-שמאלי לשקע הכבל השמאלי.
- הפעל את מגבר הביו-פוטנציאל כדי לאפשר לתוכנת ECGI ללא תמונה לקבל אותות אלקטרופיזיולוגיים בזמן אמת.
3. הערכת גיאומטריית הלב של המטופל
- היכנס כמשתמש לתוכנת Imageless ECGI בזמן אמת המותקנת בתחנת העבודה (איור 3). ספק שם משתמש וסיסמה.
- לחץ על כפתור הוסף מטופל והצג פרטי זיהוי כדי לרשום מטופל חדש בחלון הבית של ממשק המשתמש (איור 4). לאחר מכן, צור מפגש חדש המשויך למטופל, המספק את סוג ההליך ואת הנתונים הבסיסיים הבאים: מין, גיל, גובה ומשקל.
הערה: מטופל יחיד יכול לעבור מספר מפגשים. לדוגמה, במחקרים קליניים עם מעקבים, אם מטופל עובר רישום ECGI שני, ניתן ליצור מפגש חדש מבלי להוסיף את המטופל שוב. - חבר את פלטפורמת סורק התלת מימד לתחנת העבודה באמצעות כבל USB-C.
- לחץ על הלחצן טען סריקת טורסו והעלה את שחזור פלג גוף עליון תלת-ממדי בחלון גיאומטריית טורסו (איור 5).
הערה: התוכנה תזהה אוטומטית את הלוקליזציה של 128 האלקטרודות מאפוד החיישן. לכל רכיב אפוד יש צבעי אלקטרודות שונים: קדמי ימני = אדום, קדמי שמאל = כחול, אחורי ימני = ורוד ואחורי שמאל = כתום. - לחלופין, התאם ידנית את מיקומי האלקטרודות על ידי לחיצה על כל אלקטרודה ומיקומה מחדש על משטח פלג הגוף העליון.
- בחר בלחצן גיאומטריית מחשוב ובאפשרות הערכת גיאומטריית לב כדי להעריך את גיאומטריית הלב של המטופל בחלון גיאומטריית פלג גוף עליון (איור 5).
הערה: התוכנה מעריכה את גיאומטריית הלב באמצעות מתודולוגיה המבוססת על מודל צורה סטטיסטי (SSM) (איור 6A), כמפורט בספרות קודמת20. האלגוריתם מעבד תחילה את שחזור פלג הגוף העליון התלת-ממדי של המטופל ואת הנתונים הבסיסיים (מין, גיל, גובה ומשקל) כקלט. לאחר מכן, ה-SSM, המשלב פלג גוף עליון מבוסס MRI וגיאומטריות לבביות, מתאים את עצמו באופן איטרטיבי כדי להתאים לרשת פלג גוף עליון תלת-ממדי של המטופל. זה קובע את גיאומטריית הלב, המיקום והכיוון האופטימליים בתוך גוף המטופל (איור 6B). תהליך זה מבטל את הצורך ב-CT או MRI טרום פרוצדורלי, ומאפשר יצירת מפת לב לא פולשנית ראשונה תוך 10-15 דקות. חשוב לציין כי הודעה קופצת מודיעה למשתמש אם שחזור פלג גוף עליון תלת מימדי חסר רזולוציה מספקת או מכיל חפצים כלשהם שעלולים להשפיע על דיוק תוצאות ההערכה.
4. מיפוי ECGI לא פולשני ללא תמונה להנחיית שתל קוצב מערכת הולכה לטיפול בסנכרון לב (CSP-CRT) בזמן אמת (מקרה 4)
- עבור אל חלון המגבר ולחץ על כפתור Connect Amplifier כדי להתחיל לקבל אותות אלקטרופיזיולוגיים בזמן-אמת (איור 7). לחץ על הלידים השונים כדי לדמיין את האותות במסך המגבר.
- עבור לחלון זמן אמת (איור 8) כדי לקבל מיפוי לב לא פולשני בזמן אמת.
הערה: חלון זמן אמת מאפשר הדמיה של אותות בזמן אמת, אינו כולל אותות רועשים, יוצר יוצרים זמניים, מתאר באופן אוטומטי מקטעי ניתוח (למשל, גל P ומתחם QRS), ומחשב ומציג מפות ECGI לא פולשניות. - אל תכלול אותות רועשים על ידי לחיצה על כפתור התצוגה של 128 לידים , בחירה באפשרות משתמש בלבד כמצב בחירת לידים רועשים, ולחיצה כפולה על אותות רועשים כדי לא לכלול אותם לפני יצירת מפת ה-ECGI. זה משפר את איכות חישוב המיפוי, מכיוון ש-ECGI היא בעיה לא מוצגת21.
הערה: מוליכי אפוד חיישן המוצגים בירוק מציינים אותות באיכות טובה ומשמשים לחישוב בעיה הפוכה, בעוד שהמוליכים המוצגים באדום רועשים ואינם נכללים בניתוח (איור 8A). - לחץ על כפתור התצוגה של 12 מוליכים כדי להמחיש א.ק.ג משוער של 12 מוליכים בזמן אמת (איור 8B).
- ודא שכפתור RT ON פעיל כדי לעדכן אוטומטית אותות בסעיף ניתוח האותות (איור 8C). אפשרות זו מפעילה ומגדירה באופן אוטומטי את ההתחלה וההיסט של מתחם ה-QRS שיש לנתח.
הערה: ניתן להעביר את כפתור RT למצב RT OFF כדי להקפיא את האותות, מה שמאפשר למשתמש לתחום ידנית את מתחם ה-QRS כאשר התיחום האוטומטי של המערכת אינו אופטימלי. - הגדר את ניתוח מיפוי ההפעלה של ECGI על ידי לחיצה על כפתור האפשרויות כדי ליצור באופן אוטומטי מפת קצב בזאלי אופטימלית עבור הליך CSP-CRT:
- בחר באפשרות נתח חדר כדי למפות רק את החדרים.
- בחר אפשרות ניתוח מבוססת גלים17 עבור אלגוריתם זמני ההפעלה.
- בחר באפשרות פעימה ממוצעת עבור התכונה סוג מיפוי כדי לחשב את הגל הממוצע של 10 מתחמי ה- QRS האחרונים.
- השאר את הגדרות ברירת המחדל עבור התכונות תיקון היסט, מספר פעימות ואפשרות סנכרון .
- בחר אפשרות של שתי חלוניות בקטע הדמיית המפות וודא שהמפה השמאלית מוגדרת למצב עדכון , כך שהיא מתעדכנת באופן רציף עם כל מתחם QRS ממוצע חדש שנותח.
- דמיין את מפת ההפעלה הבסיסית הדו-חדרית בצד שמאל (איור 8D פאנל שמאל). המערכת מחשבת אוטומטית את מטריצת ההעברה בין פלג גוף עליון לרשתות לב כדי לשחזר את הפעילות החשמלית האפיקרדיאלית של הלב בהתבסס על שיטת אלמנט הגבול 22,23,24.
הערה: מפת ההפעלה מתארת את ההתקדמות הזמנית של דפולריזציה על פני האפיקרדיום הלבבי, ומסייעת באיתור מקורות הפעלה וזיהוי דפוסי כניסה חוזרים או מוקד. ההפעלות מחושבות על ידי (1) הפיכת כל אלקטרוגרמה משוחזרת לסכום של גלים סינוסואידיים עבור כל דגימות זמן השיפוע השלילי והמשרעת פרופורציונלית לשיפוע באותו זמן ו-(2) בחירת הרגע של המשרעת המקסימלית של האות המותמר כרגעי זמן ההפעלה17. - כתוב את השם ושמור את המפה הבזאלית על ידי לחיצה על כפתור שמור מפה והעברת המפה למצב הקפאה ברגע שניתן לשחזר אותה. למפת ECGI הניתנת לשחזור יש משך הפעלה ודפוסי התפשטות עקביים על פני לפחות שלוש מפות רצופות.
הערה: בהליכי CSP-CRT, המפה הבסיסית (איור 12A) תשמש כאסמכתא להערכת סנכרון דו-חדרי במהלך תהליך הברגת האלקטרודה באזור המחיצה עד להגעה לאזור ענף הצרור השמאלי (איור 12C). - הגדר את ניתוח מיפוי הפעלת ECGI על ידי לחיצה על כפתור האפשרויות להשגת מפות אופטימליות במהלך תהליך ההברגה והקצב באזור המחיצה:
- בחר נתח חדר כדי למפות רק את החדרים.
- בחר באפשרות הניתוח המבוסס על גלים עבור אלגוריתם זמני ההפעלה.
- בחר באפשרות הפעימה הבודדת עבור סוג המיפוי כדי לנתח את הגל של פעימה בודדת כדי ללכוד שינויים באותות אלקטרוקרדיוגרפיים במהלך תהליך הברגה וקוצב בו-זמנית במצבי מחיצה שונים.
- השאר את הגדרות ברירת המחדל עבור התכונות תיקון היסט, מספר פעימות ואפשרות סנכרון .
- הגדר את מפת הלוח הימני למצב עדכון כדי להבטיח שהיא מתעדכנת באופן רציף עם כל קומפלקס QRS פעימה אחת שנותח לאחרונה במהלך תהליך ההברגה.
- סנכרן את טווח מפת הצבעים של מפת הלוח הימני עם המפה הבזאלית באמצעות תפריט Linked Values וקשר את מיקומי המצלמה שלהם דרך תפריט המצלמה המקושרת (איור 8D החלונית הימנית).
הערה: כאשר העופרת מוברגת באזור המחיצה, מפות ECGI פעימה לפעימות נוצרות אוטומטית במיקומים שונים (כלומר, מחיצת החדר הימני, אמצע המחיצה, מחיצה עמוקה וענף צרור שמאלי). מפות אלה מושווים למפה הבסיסית על ידי סטנדרטיזציה של טווח מפת הצבעים על פני כל מפות ה-ECGI המוערכות (איור 12B, C). הגדרה זו מאפשרת הדמיה ברורה של שינויים בדפוסי ההפעלה בזמן שהכבל מוברג. - כתוב את השם ושמור כל מפה על ידי לחיצה על כפתור שמור מפה בכל פעם שנצפה שינוי בדפוס ההפעלה במהלך תהליך ההברגה באזור המחיצה, והמשך עד להגעה לאזור ענף הצרור השמאלי.
5. ניתוח מיפוי ECGI לא פולשני נוסף ללא תמונה
הערה: ניתן לגזור מפות לב שונות מאותות ECGI ממוחשבים כדי להעריך את מצע הלב, לאפיין הפרעות קצב, להעריך CRT או לחלץ מדדים רלוונטיים מבחינה קלינית במהלך פרוצדורות. סוג המפות שניתן ליצור תלוי בקצב הלב הספציפי המנותח, עם גישות שונות למקצבים סדירים ולא סדירים כאחד.
- השתמש בסעיף ניתוח האותות של חלון זמן אמת כדי לנתח את המקצבים השונים שהמטופלים עשויים להפגין במהלך ההליך האלקטרופיזיולוגי:
- נתח מקצבים רגילים, הגדר ניתוח פעימה בודדת או פעימה ממוצעת כתכונת סוג מיפוי , כאשר המטופל נמצא בקצב מיוצב/סדיר, כגון קצב סינוס, קצב פרוזדורים או חדר, רפרוף פרוזדורים או טכיקרדיה חדרית. חשב את מפת ההפעלה ומפת מהירות ההולכה (CV) מניתוח קצב רגיל.
- נתח קצב לא סדיר, תוך שימוש בניתוח פעימות קצב לא סדיר כתכונת סוג מיפוי כאשר המטופל נמצא בפרפור פרוזדורים. המערכת מאפשרת בחירה של מקטעי מיקוד אוטומטי מורחבים (למשל, דקה אחת) כדי לדכא מתחמי QRST וללכוד את הדפוסים המרחביים-זמניים הדינמיים של המיקוד האוטומטי. חישוב מפת פאזה , מפת היסטוגרמה של הרוטור ומפת תדרים דומיננטית מניתוח קצב לא סדיר.
- לחלופין, לחץ על התפריט הנפתח של בחירת המפה ובחר את מפת ההפעלה אם נותח קצב קבוע. ראה שלב 4.8 לתיאור מפורט של מפת ההפעלה .
- לחלופין, לחץ על התפריט הנפתח של בחירת המפה ובחר את מפת מהירות ההולכה אם נותח קצב קבוע.
הערה: מהירות ההולכה היא מדד הנגזר ממפת ההפעלה. מדד זה מייצג את הזמן שלוקח לחזית גל לעבור דרך כל אזור של האפיקרדיום. חישוב ה-CV מסתמך על שיפועים מרחביים של מפות זמן הפעלה על פני משטחי לב, עם שדות וקטורי מהירות המיושמים לזיהוי אזורים של התפשטות יעילה. אזורים עם וקטורים כיווניים אחידים הצביעו על התפשטות חשמלית יציבה, בעוד שאזורים עם פערים זוויתיים, המעידים על התפשטות לא יעילה, עוברים אינטרפולציה באמצעות פונקציית בסיס רדיאלי25. CV מאפשר לזהות אזורים של האטת הולכה במהלך מיפוי מצע הקשורים לשיעורי הישנות הפרעות קצב17. - לחלופין, לחץ על התפריט הנפתח של בחירת המפה ובחר את מפת השלבים בעת ניתוח קצב לא סדיר.
הערה: מפת השלבים עוקבת אחר ההתקדמות של אזור מוגדר בשריר הלב דרך פוטנציאל הפעולה לאורך זמן. מפה מסוג זה היא דינמית מכיוון שהיא מייצגת את התקדמות הפוטנציאל הלבבי. במפת הפאזה, טרנספורמציה של הילברט מוחלת כדי לחשב את הפאזה של אות ה-ECGI. כל שלב מתאים למצב נתון של פוטנציאל הפעולה על פני כל מחזור של האות (π למנוחה, π/2 לדפולריזציה, 0 למישור ו-π לרפולריזציה)26. - לחלופין, לחץ על התפריט הנפתח של בחירת המפה ובחר את מפת היסטוגרמה של הרוטור בעת ניתוח קצב לא סדיר.
הערה: מפת היסטוגרמה של רוטור, הנגזרת ממפת פאזה, היא ייצוג של המיקומים השכיחים ביותר של סינגולריות פאזה, שהם אזורים עם פעילות חוזרת מרוכזת ומוצגים באדום. בקצרה, סינגולריות פאזה מוגדרת כנקודות מפתח שבהן הפאזה עוברת מ-π ל-π. PSS שאינם מראים התקדמות מרחבית הדרגתית של שלבים בסביבתם מושלכים. לבסוף, מספר הסיבובים עבור כל רוטור מכומת כדי לקבל את מפת היסטוגרמה של הרוטור 18. הדיוק של האלגוריתם בזיהוי דפוסי התפשטות במהלך AF והאזורים הספציפיים המציגים כניסות חוזרות הוערך באופן שיטתי מול מיפוי אנדוקרדיאלי, מה שמדגים מתאם של 71%16. - לחלופין, לחץ על התפריט הנפתח של בחירת המפה ובחר את מפת התדר הדומיננטי (DF) בעת ניתוח קצב לא סדיר.
הערה: מפות DF מציגות את התדר החשמלי השולט בכל אזור לב לאורך זמן, ועוזרות לזהות אזורים של פעילות חשמלית מהירה שעשויים לשמש כמניעים של AF. DF מחושבים כתדר עם הצפיפות הספקטרלית הגבוהה ביותר בפריודוגרמה של וולש27,28. הניתוח שלו מאפשר זיהוי של אזורים בעלי יציבות גבוהה או שונות בפעילות הפרפור בתוך הפרוזדורים. היסטוגרמה משמשת להערכת ההתפלגות הזמנית של תדרים דומיננטיים, מספקת ייצוג ברור וכמותי של הפעילות החשמלית הרלוונטית ביותר ומקלה על זיהוי אזורים עם התנהגות חריגה.
תוצאות
מקרה 1 - תכנון והנחיית אבלציה בצנתר של רפרוף פרוזדורים לא טיפוסי
מקרה זה הוא מטופל גבר בן 59 (מדד מסת גוף -BMI-30) עם היסטוריה של יתר לחץ דם, עישון, מחלת מסתמי לב, סיווג EHRA IIb, וציון CHA2DS 2-VASc של 1 עם אינדיקציה לאבלציה בצנתר עקב רפרוף פרוזדורים לא טיפוסי (AFL) המבוסס על א.ק.ג עם 12 מוליכים (איור 9A). למטופל לא הייתה היסטוריה קודמת של אבלציה בצנתר. MRI לשיפור גדוליניום מאוחר טרום פרוצדורלי (LGE-MRI) חשף פיברוזיס נרחב בדופן האחורית של הפרוזדור השמאלי (LA), עם פלנימטריית LA תקינה של 24 סמ"ר ושבר פליטה של החדר השמאלי (LVEF) של 54%.
ECGI לא פולשני ללא תמונה בוצע דקות ספורות לפני החדרת הצנתר דרך מעטפת הירך. מחזור שלם של ה-AFL (209 אלפיות השנייה), ללא מתחמי QRST, נבחר לניתוח. המיפוי חשף מעגל מאקרו-חוזר סביב המסתם המיטרלי (MV), שהצביע על הקו הפרימיטרלי כיעד האבלציה האופטימלי לסיום הפרעות קצב (איור 9B). לאחר מכן, נערך EAM מבוסס מגע (איור 9C), שאישר את דפוס ההתפשטות שנצפה ב-ECGI הלא פולשני ללא תמונה. אבלציה לאורך הקו הפרימיטרלי סיימה בהצלחה את הפרעת הקצב.
במקרה קליני זה, הפרעת הקצב אופיינה במדויק לפני EAM פולשני, מה שאפשר לוקליזציה מדויקת של דפוס התפשטות הפרעת הקצב וייעל את הליך האבלציה. עם זאת, עבור טכיקרדיה פרוזדורית מורכבת, כגון AFL או טכיקרדיה מוקדית, Imageless ECGI מציע מיפוי בזמן אמת, פעימה אחת, מה שהופך אותו לבעל ערך במיוחד במקרים של הפרעות קצב לא מתמשכות. יכולת ההסתגלות שלו לשינויים בדפוסי הפרעות קצב במהלך הליך מבטיחה מיפוי מדויק ודינמי. יתר על כן, בעוד שהאבחנה של AFL נגד כיוון השעון היא בדרך כלל פשוטה מא.ק.ג עם 12 מוליכים, איתור וזיהוי מדויק של המנגנון של טכיאריתמיות מורכבות יכול להיות מאתגר. כתוצאה מכך, ביצוע ECGI ללא תמונה בייעוץ רפואי או דקות לפני יכול לשפר את הבטיחות והיעילות הפרוצדורלית על ידי מתן הדרכה במעלה הזרם לתכנון אבלציה בצנתר וביטול גישות טרנספטליות מיותרות.
מקרה 2 - התפתחות סינגולריות פאזה במהלך אבלציה בצנתר של פרפור פרוזדורים מתמשך
מקרה זה הוא מטופל גבר בן 63 (BMI 31) עם מקטע פליטה של החדר השמאלי (LVEF, 55%), ללא LA מורחב, ואיגוד הלב של ניו יורק (NYHA) של I סומן לאבלציה בצנתר עקב AF מתמשך. לא בוצעה הדמיית CT או MRI טרום פרוצדורלית. לחולה הייתה היסטוריה קודמת של אבלציה בצנתר לבידוד ורידים ריאתיים (PVI) בדצמבר 2019.
עם הגעתו, המטופל היה ב-AF. מיפוי המצע נערך באמצעות ECGI ללא תמונה לאורך כל הליך האבלציה (איור 10A). בנקודת ההתחלה, ECGI זיהה סינגולריות פאזה בדופן הצדדית של הפרוזדור הימני (RA), בסיס התוספתן הימני (RAA), הדופן האחורית הפרוזדורית השמאלית (PW) ובסיס התוספתן הפרוזדורי השמאלי (LAA). ממצאים אלה היו בקורלציה עם EGMs בתדירות גבוהה ומקוטעים שנצפו באמצעות צנתרים אנדוקוויטריים, ו-PVI הולם אושר באמצעות שחזור LA EAM. אבלציה של שדה דופק (PFA) החלה בבסיס LAA, וכתוצאה מכך שינוי קצב מ-AF ל-AFL לא טיפוסי. ECGI ללא תמונה חשף AFL פרימיטרלי, שאושר באמצעות הרכבה מהקוטב הדיסטלי של קטטר הסינוס הכלילי. נוצר קו מיטרלי; עם זאת, AF הושרתה מחדש. לאחר מכן, הושג בידוד מוחלט של PW. למרות זאת, ECGI ללא תמונה המשיך לזהות סינגולריות פאזה משמעותית בבסיס RAA. בעקבות יישומי PFA מרובים המכוונים לאזור זה, הושג קצב סינוסים (איור 10B).
מקרה קליני זה מייצג כיצד AF מציב אתגרים ייחודיים בשל השונות הגבוהה של הפעילות החשמלית בפרוזדורים. ECGI ללא תמונה לכד ביעילות דפוסים מרחביים-זמניים של התקדמות AF במהלך אבלציה, עם עד שלוש מפות לא פולשניות שנרכשו כדי להנחות את שינוי המצע עד להשגת SR. לטיפולים סטנדרטיים, כמו בידוד ורידים ריאתיים, יש שיעורי הישנות גבוהים יחסית29. הקשיים העיקריים בטיפול ב-AF נעוצים בשני תחומים: (1) קביעה אילו מטופלים יפיקו תועלת מ-PVI בלבד, ו-(2) עבור אלה הזקוקים לגישה רחבה יותר, זיהוי האזורים מחוץ לאזור ה-PVI שהאבלציה שלהם תפחית בצורה היעילה ביותר את הישנות הפרעות הקצב. במהלך קצב הסינוסים, Imageless ECGI הוכיח את היכולת ליצור מפות CV, שהוכחו כשימושיות בחיזוי הצלחה באבלציה של PVI17. עם זאת, במקרה זה, ECGI ללא תמונה לכד דפוסי דינמיקה של מיקוד אוטומטי במקביל, וסיפק לרופאים מבט מקיף על אופן התפשטות הפרעת הקצב ועזר לזהות אזורי מפתח המניעים את הפרעת הקצב. ניתוח התוצאות צריך להתמקד במתאם בין מניעי ה-AF שזוהו ב-ECGI ללא תמונה לבין נקודות קצה קליניות, כגון הישרדות ללא הפרעות קצב לטווח ארוך, כדי לאמת עוד יותר את התועלת שלו באופטימיזציה של אסטרטגיות אבלציה של AF.
מקרה 3 - הנחיית אופטימיזציה של קוצב דו-חדרי לטיפול בסנכרון מחדש של הלב
מקרה זה הוא מטופלת בת 67 עם קרדיומיופתיה מורחבת לא איסכמית, LVEF של 25%, ללא עדות לשיפור גדוליניום מאוחר ב-MRI טרום פרוצדורלי, עם חסימת ענף צרור שמאלי (LBBB) ב-ECG הבסיסי ומשך QRS של 156 אלפיות השנייה. המטופל סומן לקוצב דו-חדרי (BiVP) כחלק מ-CRT.
במהלך הליך ה-CRT הלבבי, נעשה שימוש ב-ECGI ללא תמונה בזמן אמת כדי להעריך סנכרון חדרים לפני ואחרי השתלת קוצב לב. בקצב הבסיסי, אזור ההפעלה האחרון של המטופל זוהה בדופן הבסיסית-צדדית של החדר השמאלי (LV), כפי שמתואר באיור 11A. זמן ההפעלה הכולל של החדר (TAT) נמדד ב-116 אלפיות השנייה, מה שמצביע על אסינכרוני חדרי משמעותי. תצורות התקן שונות הוערכו באמצעות ECGI, כאשר ההגדרה האופטימלית נקבעה כ-BiVP באמצעות הפעלה בו-זמנית של הקוטב הדיסטלי והפרוקסימלי של מוליך ה-LV, ועיכוב אטריו-חדרי של 140 אלפיות השנייה. כפי שמוצג באיור 11B, שלוש נקודות הקצב של החדרים לא הביאו לאזורים שהופעלו מאוחר, מה שמעיד על סנכרון מוצלח, עם TAT משופר של 70 אלפיות השנייה.
טיפול בסנכרון מחדש של הלב נועד להחזיר את הקואורדינציה החשמלית בחדרים ולשפר את תפקוד הלב בחולים עם אי ספיקת לב ו-QRS ממושך. במקרה זה, Imageless ECGI סיפק מיפוי בזמן אמת שהיה המפתח בהנחיית אופטימיזציה של BiVP במהלך הליך ה-CRT. זה איפשר הערכה מדויקת של דפוסי ההפעלה החדרית ועזר לזהות את תצורת המכשיר האופטימלית, מה שהבטיח סנכרון מלא של החדרים. האופי הלא פולשני והמשוב המיידי של ECGI אפשרו לרופאים לחדד את תכנות העופרת. לעומת זאת, בעוד שמחקרים מדגישים את הערך של ECGI בהנחיית מיקום עופרת בחדר שמאל ליד האזור המופעלהאחרון 30, אילוצים אנטומיים עשויים להגביל את תחולתו. פרמטרים בסיסיים וסופיים של סנכרון מחדש שנקבעו על ידי ECGI, כגון TAT, צריכים להיות קשורים לתוצאות הקליניות על ידי ניטור התגובה הקלינית של המטופל ל-CRT לאורך זמן, כולל שיפור בתסמינים ותפקוד חדרים לטווח ארוך.
מקרה 4 - שתל קוצב של מערכת הולכה מנחה לטיפול בסינכרון לב בזמן אמת
מקרה קליני זה הוא מטופלת בת 45 עם הפרעה חמורה בתפקוד החדרים (LVEF 15%) ו-LBBB עם משך QRS של 172 אלפיות השנייה. המטופל סומן לדפיברילטור קרדיו-וורטי מושתל CRT באמצעות גישת קצב של מערכת הולכה (CSP).
במהלך השתלת המכשיר נעשה שימוש ב-ECGI ללא תמונה בזמן אמת כדי לנטר סנכרון חדרים לאורך תהליך הברגת האלקטרודות באזור המחיצה. כפי שמוצג באיור 12, מפת ה-ECGI הבסיסית זיהתה את הקיר הצדדי של ה-LV כאזור המופעל האחרון, עם TAT של 133 אלפיות השנייה. מיפוי ECGI פעימה לפעימות במהלך הברגת האלקטרודות הראה שיפורים מתקדמים בסנכרון החדר, עם סנכרון אופטימלי שהושג עם הגעה לענף הצרור השמאלי, וכתוצאה מכך TAT של 95 אלפיות השנייה.
מקרה זה הדגים את הפוטנציאל של ECGI ללא תמונה בזמן אמת להנחות השתלת LBBP במהלך הליך CRT. יכולות המיפוי שלו בזמן אמת אפשרו ניתוח של TAT חדרי וסנכרון מחדש בכל שלב של השתלת עופרת באזור המחיצה. המערכת סיפקה מדד מהיר, ויזואלי וקל לפרשנות, המתייחס להיעדר סטנדרטיזציה בקריטריונים של CSP אלקטרוקרדיוגרפי. כמו גם בהליכי BiVP-CRT, יש צורך במחקרים נוספים כדי לקבוע אם פרמטרי ECGI ללא תמונה נמצאים בקורלציה משמעותית עם תגובת CRT קלינית וכיצד הם משווים למנבאי א.ק.ג עם 12 עופרת.
מקרה 5 - תכנון והנחיית אבלציה בצנתר של טכיקרדיה חדרית
מקרה זה הוא מטופל גבר בן 53 (BMI 25.4) עם קרדיומיופתיה איסכמית, הפרעה חמורה בתפקוד החדרים (LVEF 15%), ו-NYHA Class II הופנה להליך אבלציה בצנתר עקב VT חוזר. MRI טרום פרוצדורלי חשף פיברוזיס אנדוקרדיאלי נרחב ותעלות הפרעות קצב הממוקמות במקטעים התחתונים-בסיסיים והתחתונים-מדיאליים של החדר השמאלי. למטופל הייתה היסטוריה קודמת של אבלציה בצנתר VT בשנת 2018.
מיפוי ECGI ללא תמונה בו זמנית (איור 13A) ו-EAM פולשני (איור 13B) בוצעו לאורך כל ההליך. תהליך האבלציה של הצנתר כלל מיפוי מבוסס סובסטרט במהלך קוצב אפיקלי של החדר הימני (RV) ואינדוקציה של VT באמצעות גירוי מתוכנת. ECGI ללא תמונה זיהה אזור של האטה בהולכה במקטע התחתון-בסיסי של ה-LV במהלך מיפוי קצב הסינוסים לפני הכנסת הצנתר. ממצא זה עלה בקנה אחד עם פיברוזיס שנצפה ב-MRI. צעד עוקב מקודקוד החדר הימני (RV) אישר האטה בהולכה במקטעים הבסיסיים והמדיאליים של ה-LV, וזיהה אזור זה כמצע הפרעת קצב סביר. VT עם אורך מחזור של 380 אלפיות השנייה הושרה לזמן קצר, ודרש קרדיוגרציה עקב חוסר יציבות המודינמית. כתוצאה מכך, נרכש רק מספר מוגבל של נקודות EAM. עם זאת, באמצעות מחזור VT יחיד, ECGI ללא תמונה זיהה בהצלחה את מצר ה-VT באותו אזור שבו נצפתה צפיפות איזוכרונלית במפות הקצביות.
השימוש ב-ECGI ללא תמונה בזמן אמת במקרה VT זה התמודד בהצלחה עם שני אתגרים קליניים עיקריים בניהול VT: (1) לוקליזציה מדויקת של מטרות אבלציה פוטנציאליות במהלך קצב הסינוס ו-(2) אפיון VT עם חוסר יציבות המודינמית. מפעימה בודדת, מצר ה-VT זוהה במדויק הן במפות הפעלת הסובסטרט והן במפות הפעלת הפרעות הקצב. המערכת אפשרה למפעילים לזהות מצעים הפרעות קצב לפני או במהלך אבלציה ולאפיין מספר VTs הניתנים להשראה בזמן אמת ממחזור יחיד.

איור 1: רכיבי חומרת ECGI ללא-תמונה. (A) מגבר דו-פוטנציאלי עם יציאות חיבור כבלים ספציפיות. (ב) כבלים ימניים ושמאליים, מצוידים במחברי מגבר בקצה אחד ומחברי שקע אפוד חיישן בקצה השני. (ג) תצורה המציגה את הכבלים הימניים והשמאליים המחוברים למגבר הדו-פוטנציאלי. (ד) זרימת עבודה סכמטית של הליך חיבור אפוד החיישן לשקעי הכבלים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: נוהל סורק שחזור פלג גוף עליון תלת-ממדי. (A) אפוד חיישן פוטנציאל פני הגוף בעל 128 עופרת, המורכב מארבעה רכיבים (קדמי-ימין, קדמי-שמאל, אחורה-ימין, אחורה-שמאל), מונח על פלג הגוף העליון של המטופל לפני שחזור תלת-ממדי. לכל אלקטרודה קוד QR ייחודי לזיהוי אוטומטי. ניתן לקפל את החיבורים בין האלקטרודות כדי להתאים את האפוד לצורת הגוף של המטופל. (B) קוד ה-QR ברכיב הקדמי-ימני מאמת את האפוד, ומאפשר ליישום הסורק התלת-ממדי ליזום שחזור פלג גוף עליון. (C) פלטפורמת הסורק התלת-ממדי באמצעות יישום הסורק התלת-ממדי, מייצרת את פלג הגוף העליון המשוחזר באמצעות מצלמת אור מובנית אינפרא-אדום. קיצורים: FR: קדמי-ימין; FL: קדמי-שמאל; ביל: אחורי מימין; ו-BL: שמאל אחורי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
איור 3: מסך כניסה לממשק משתמש ECGI ללא-תמונה הדורש שם משתמש וסיסמה ייעודיים עבור גישה לתוכנה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
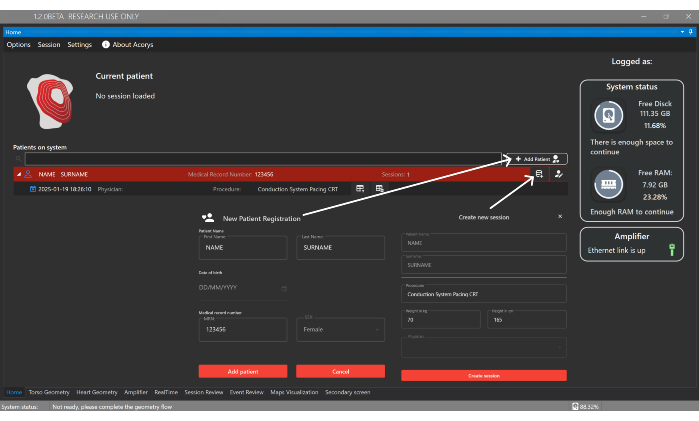
איור 4: חלון הבית. חלון הבית מאפשר ניהול של מטופלים, רופאים ומשתמשים, כמו גם קביעת תצורה של הפעלות מטופלים. הוא גם מציג מידע על ההפעלות המיובאות ועל מצב המערכת והמגבר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
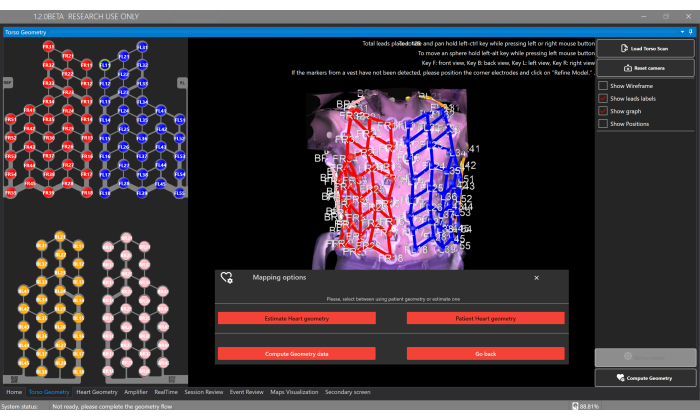
איור 5: חלון גיאומטריה של פלג גוף עליון. חלון גיאומטריית טורסו מאפשר למשתמשים להעלות ולהציג את מודל פלג גוף עליון תלת מימדי, אלקטרודות פלח ולבחור את סוג גיאומטריית הלב באמצעות כפתור גיאומטריית החישוב , המאפשר להעריך או לספק פילוח מ-CT/MRI מותאם אישית. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
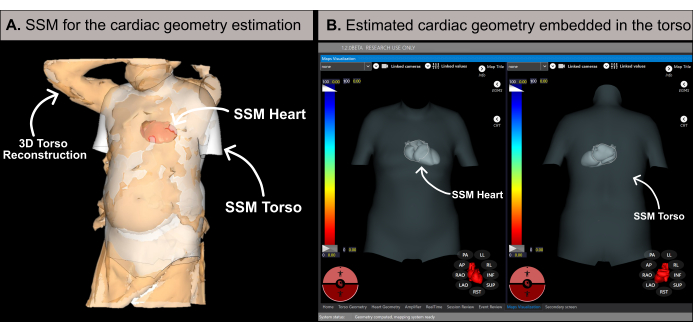
איור 6: הערכת גיאומטריה לבבית. (A) אלגוריתם SSM המשתמש במאפיינים בזאליים ובשחזור פלג גוף עליון תלת-ממדי של המטופל כדי להעריך את גיאומטריית הלב. (B) גיאומטריית לב משוערת בתוך ה-SSM של פלג הגוף העליון שמציגה תצוגות קדמיות-אחוריות (צד שמאל) ואחוריות-קדמיות (צד ימין). קיצורים: תלת מימד: תלת מימד; SSM: מודל צורה סטטיסטי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
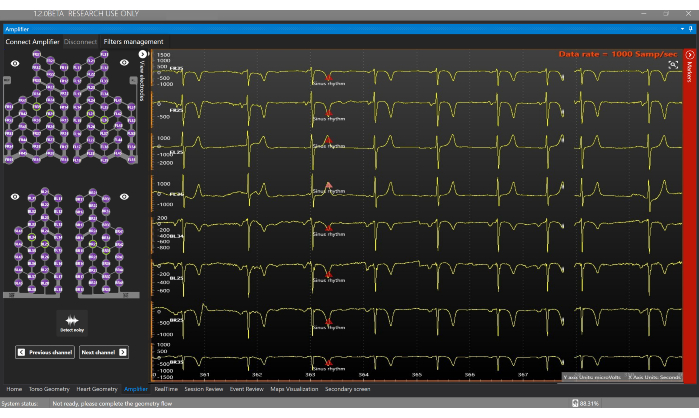
איור 7: חלון מגבר. חלון המגבר מאפשר הדמיה בזמן אמת של האותות המתקבלים מכל אלקטרודה של אפוד החיישן. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 8: חלון זמן-אמת. (A) ייצוג סכמטי של המוליכים הפעילים מאפוד מערך האלקטרודות בצפיפות גבוהה. אלקטרודות ירוקות מכילות אותות באיכות טובה ואילו אלקטרודות אדומות מכילות אותות רועשים ואינן משתתפות בחישוב הבעיה ההפוכה. (B) הערכה של 12 המוליכים של האלקטרוקרדיוגרמה בזמן אמת. (ג) הפעלה ותיחום אוטומטיים של ההתחלה וההיסט של מתחם ה-QRS (חלון בצבע ירוק). האות הממוצע של כל הלידים המשתתפים בחישוב המיפוי מוצג בכחול. (D) המקטע Maps Visualization תומך בתצוגות של מפות בודדות, כפולות או ארבע מפות. דוגמה זו מציגה תצוגת מיפוי כפולה עם מפות הפעלה עבור מצבי ריווח ענפי צרור בסיסי ושמאלי (מפה סופית) במהלך הליך CRT. המפה הבסיסית נמצאת במצב הקפאה, נשארת סטטית, בעוד שהמפה הסופית נמצאת במצב עדכון, ומחשבת מחדש עם כל קומפלקס QRS שנותח לאחרונה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
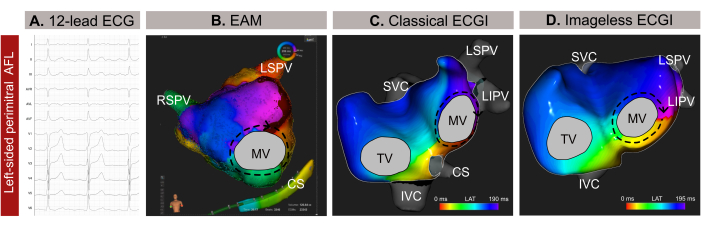
איור 9: דוגמה גרפית של AFL לא טיפוסי בצד שמאל ויכולות האבחון השונות של א.ק.ג עם 12 מוליכים, ECGI ללא-תמונה ו-EAM פולשני. (A) אותות ה-ECG עם 12 מוליכים של ה-AFL הלא טיפוסי מציגים גלים על-חדריים חיוביים ב-V1. (B) ECGI ללא תמונה באמצעות גיאומטריה לבבית משוערת מ-SSM והצגת מבט אנטרו-אחורי. מעגל ההתפשטות מציג את כל הצבעים סביב ה-MV, דפוס אופייני ל-AFL פרימיטרלי. (C) מיפוי הפעלה מקומי שנגזר מ-EAM ומציג מבט אנטרו-אחורי מראה כניסה חוזרת של מאקרו סביב ה-MV, המאשרת את האבחנה מה-ECGI ללא תמונה. קיצורים: א.ק.ג: אלקטרוקרדיוגרמה; EAM: מיפוי אלקטרואנטומי; ECGI: הדמיה אלקטרוקרדיוגרפית. SVC: וריד נבוב מעולה; IVC: וריד נבוב נחות; CS: סינוס כלילי; LSPV: וריד ריאתי עליון שמאלי; RIPV: וריד ריאתי תחתון ימני; RSPV: וריד ריאתי עליון ימני. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
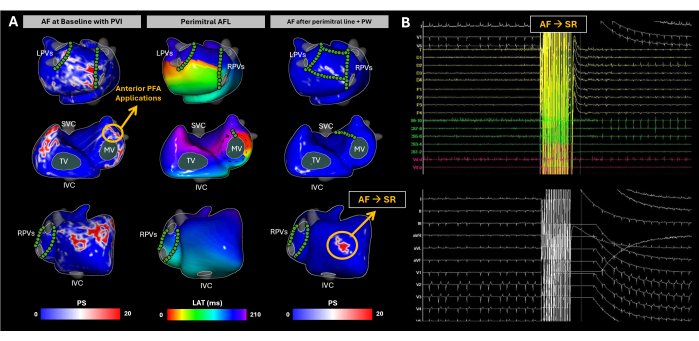
איור 10: מעקב אחר התפתחות מצע פרוזדורים במהלך אבלציה של קטטר AF באמצעות מיפוי ECGI לא פולשני ללא תמונה. (A) תצוגות אחוריות-קדמיות, קדמיות-אחוריות ורוחביות ימניות של ECGI ללא תמונה, עם אתרי PFA המסומנים בעיגולים ירוקים. מפת ה-PS הבסיסית מדגישה כניסות חוזרות בקיר הצדדי של RA, בבסיס RAA, בקיר האחורי של LA ובבסיס LAA. PFA בבסיס LAA העביר את הקצב ל-AFL פרימיטרלי. למרות השלמת הקו המיטרלי ובידוד הדופן האחורית, AF הושרה שוב באופן ספונטני. ECGI חשף PS בבסיס RAA, שהפך ליעד האבלציה. יישומי PFA מרובים בוצעו באזור זה, וקצב הסינוסים שוחזר. (B) האותות האק"ג והאותות התוך-לבביים עם 12 מוליכים ברגע שה-AF השתנה ל-SR. קיצורים: SVC: הווריד הנבוב העליון; IVC: וריד נבוב נחות; LPVs: ורידי ריאה שמאליים; RPVs: ורידי ריאה ימניים; AF: פרפור פרוזדורים, SR: קצב סינוס, PS: סינגולריות פאזה, LAT: זמני הפעלה מקומיים, טלוויזיה: מסתם טריקוספידי, MV: מסתם מיטרלי, PVI: בידוד ורידים ריאתיים, AFL: רפרוף פרוזדורים, PW: דופן אחורית, ו-PFA: אבלציה בשדה דופק. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
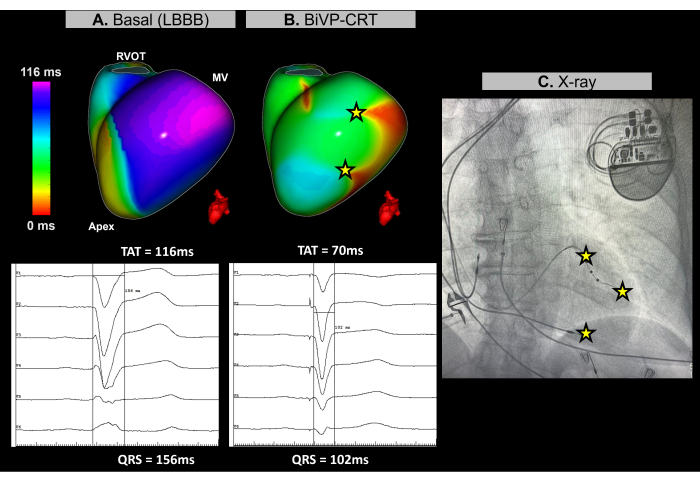
איור 11: אופטימיזציה של קוצב דו-חדרי באמצעות Imageless ECGI. (A) קצב בסיסי של המטופל. מפת ה-ECGI ללא תמונה (מבט שמאל-לרוחב) חושפת אזור שהופעל מאוחר (סגול) בדופן הצדדית של ה-LV, עם TAT של 116 אלפיות השנייה, המעיד על דיסנכרון חדר. זה מתיישב עם האק"ג הבסיסי, המציג קומפלקס QRS רחב (156 אלפיות השנייה) עם דפוס LBBB. (B) תצורת השתלת קוצב לב. לאחר BiVP עם הפעלה בו-זמנית של הקוטב הדיסטלי והפרוקסימלי של מוביל ה-LV ועיכוב פרוזדורי של 140 אלפיות השנייה, מפת ה-ECGI ללא תמונה אינה מציגה אזורים מושהים (ללא אזור סגול), מה שמעיד על הפעלה חדרית סינכרונית ו-TAT מופחת של 70 אלפיות השנייה. זה עולה בקנה אחד עם קומפלקס ה-QRS המקוצר שנצפה ב-ECG הסופי, שבו משך ה-QRS יורד ל-102 אלפיות השנייה. פעילות הקצב של הקוטב הדיסטלי והפרוקסימלי של עופרת ה-LV משתקפת גם במפת ה-ECGI. קיצורים: LBBB: בלוק ענף צרור שמאלי, BiVP: קוצב דו-חדרי, CRT: טיפול בסנכרון מחדש של הלב, RVOT: דרכי יציאת החדר הימני, MV: המסתם המיטרלי, TAT: זמן הפעלה כולל. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
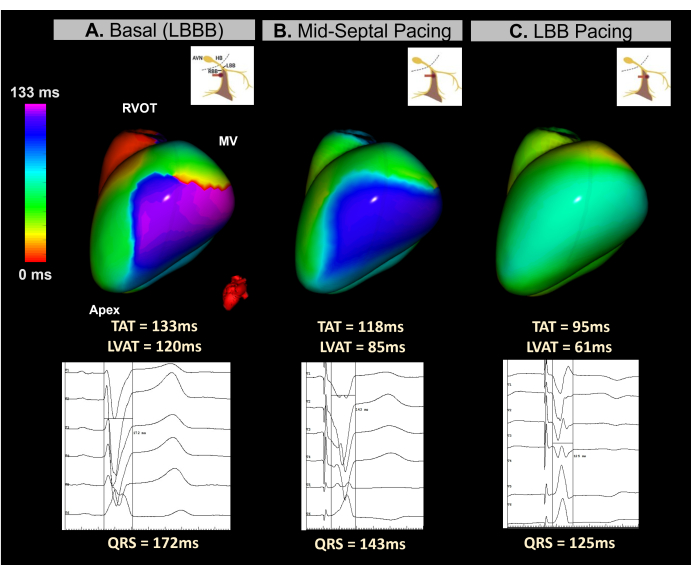
איור 12: הערכה לא פולשנית של CRT באמצעות קוצב מערכת הולכה באמצעות ECGI ללא תמונה. (A) קצב בסיס של המטופל. מפת ה-ECGI (מבט שמאל-לרוחב) מציינת אזור של הפעלה מושהית (סגול) על הדופן הצדדית של ה-LV, עם TAT של 133 אלפיות השנייה, מה שמרמז על דיסנכרון חדר. זה תואם את ה-ECG הבסיסי, המציג קומפלקס QRS רחב (172 אלפיות השנייה) האופייני ל-LBBB. (B) שלב ביניים (קוצב אמצע המחיצה) במהלך השתלת עופרת LBBP. המפה הלא פולשנית מציגה תיקון חלקי של האזור המושהה ב-LV, כאשר הצבע משתנה מסגול לכחול. זה מלווה בהפחתה במשך מורכב QRS. (ג) המיקום הסופי של כבל ה-LBBP במהלך תהליך ההברגה. המפה מדגימה תיקון מלא של האזור המושהה, כאשר הצבע עובר מסגול לירוק, מה שמעיד על הפעלה סינכרונית של שני החדרים. קיצורים: LBBB: בלוק ענף צרור שמאלי, LBB: ענף צרור שמאלי, RVOT: דרכי יציאה של החדר הימני, MV: מסתם מיטרלי, TAT: זמן הפעלה כולל. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
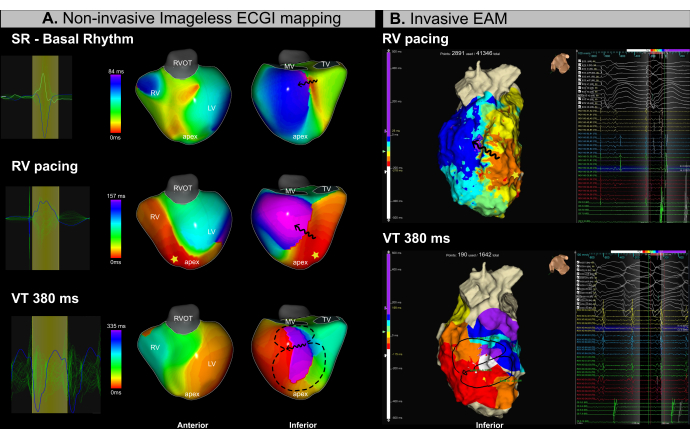
איור 13: הערכה לא פולשנית של מצר ה-VT באמצעות ECGI ללא תמונה. (A) מיפוי ECGI ללא תמונה במהלך הליך אבלציה של VT מזהה את המצע הפרעות קצב ואת מצר ה-VT באזורים התחתונים-בסיסיים והתחתונים-מדיאליים של ה-LV. השורה הראשונה מתאימה לקצב הסינוס, השורה האמצעית לקצב אפיקלי RV, והשורה התחתונה ל-VT. (B) EAM פולשני שהתקבל במהלך הליך אבלציה של VT מראה מיפוי הפעלה איזוכרונלית באותם אזורים שזוהו על ידי ECGI. השורה העליונה תואמת את הקצב האפיקלי של RV, ואילו השורה התחתונה מייצגת VT. קיצורים: RV: חדר ימין, LV: חדר שמאלי, SR: קצב סינוס, RVOT: דרכי יציאה של החדר הימני, MV: מסתם מיטרלי, טלוויזיה: שסתום תלת-שפתי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
תיאור מתודולוגי זה מדגיש את התועלת הקלינית של גישת ECGI לא פולשנית, פעימה אחת ובזמן אמת, שיכולה לתמוך במגוון פרוצדורות אלקטרופיזיולוגיות, כגון אבלציה בצנתר ו-CRT, ללא צורך בהדמיית לב טרום פרוצדורלית כמו CT או MRI 15,17,31,32 בדוח זה, Imageless ECGI מדגים מאפיינים טכניים מרכזיים שעשויים לקדם את האימוץ הקליני שלו. בעוד ש-ECGI כבר הוכיח את עצמו ככלי רב עוצמה למיפוי לב במגוון רחב של הפרעות קצב 19,33,34,35,36, הוא ממשיך להתמודד עם מספר אתגרים קליניים וטכניים13,14.
מערכות ECGI קלאסיות זקוקות לסריקת CT במיוחד באותו יום כמו מיפוי הלב, כאשר אלקטרודות ה-ECGI נמצאות במקום 9,10,12,37,38. גישה זו מוסיפה זמן נוסף עקב הצורך בסגמנטציה של סריקת CT (לב ואלקטרודות), ומעכבת את יצירת מפת ה-ECGI הראשונית בכ-1-3 שעות. לעומת זאת, מערכת ה-ECGI ללא תמונה המוצגת בדוח זה משתמשת בסריקת תלת מימד אינפרא אדום של בית החזה עם אלקטרודות מערך בצפיפות גבוהה, שניתן לבצע דקות ספורות לפני ההליך או במהלך ייעוץ רפואי15,17. המערכת מפלחת אוטומטית את האלקטרודות של בית החזה ומעריכה את גיאומטריית הלב של המטופל, מייעלת את תהליך מיפוי הלב הלא פולשני ומצמצמת משמעותית את הזמן בין הגעת המטופל לזמינות מפת ה-ECGI הראשונה. אימות קודם של גישת ה-ECGI ללא תמונה הראה כי שימוש בגיאומטריית לב משוערת מציג שגיאות מינימליות, תוך שמירה על הדיוק של מפות לא פולשניות. בחולים עם AF, נצפה מתאם חזק בין אותות ECGI שמקורם בגיאומטריות לב משוערות לעומת גיאומטריות לב בפועל, אפילו עם תרגומים גיאומטריים15. עבור הפרעות קצב רגילות, כגון טכיקרדיה פרוזדורית מורכבת, השוואות עם EAM הראו דיוק גבוה בזיהוי חדר הלב המעורב, קביעת המנגנון (מוקד או נכנס מחדש) והסקת יעד האבלציה31. במקרה של VT, הגישה הוערכה כדי להנחות את המפעילים לעבר אזורים של איסתמוסים של VT במהלך קצב הסינוס (SR)39, מה שמראה את הפוטנציאל לזהות חולים בסיכון ל-VT במניעה ראשונית. בנוסף, התאמה אזורית חזקה בין מפות הפעלה של ECGI ו-EAM ללא תמונה נצפתה במהלך קוצב הסינוסים הכליליים, במיוחד באתרי הפעלה מוקדמים ומאוחרים40.
ב-CRT, שינויים מורפולוגיים בזמן אמת ב-ECG עם 12 מוליכים משמשים בדרך כלל כדי לאשר סנכרון מחדש במהלך השתלת עופרת, במיוחד בהליכי CSP שבהם ה-ECG מוערך בשלבים שונים של מיקום עופרת המחיצה עד להגעה לאזור ה-LBB. עם זאת, אלגוריתמי האק"ג שפורסמו הם לרוב מורכבים, מראים הבדלים משמעותיים ביניהם, ובמקרים מסוימים קשה ליישם אותם בפרקטיקה הקלינית 41,42,43. אולי בשל מורכבות זו, לא זוהה באופן עקבי פרמטר אלקטרוקרדיוגרפי ספציפי לקוצב ענף צרור שמאלי (LBBP) שיכול לחזות באופן מהימן אם מטופל יגיב לסנכרון מחדש של הלב. גישת ה-ECGI ללא תמונה בזמן אמת מציעה מיפוי פשוט ומפורט, פעימה אחר פעימה לאורך השתלת העופרת, הערכת תיקון דיסנכרוני על ידי הערכת פרמטרים כגון זמן ההפעלה של החדר השמאלי, כפי שהודגם בחולים עם אינדיקציה ל-CRT32 או אלה עם בלוק AV44. לכן, עם חקירה נוספת, פרמטרים של ECGI בזמן אמת יכולים להנחות את המפעילים באופטימיזציה של מיקום השתלת העופרת או חיזוי תגובת המטופל ל-CRT.
למרות שהפוטנציאל של ה-ECGI ללא תמונה בזמן אמת הוצג בדוח מתודולוגי זה, גישות מיפוי לא פולשניות חדשות אחרות המשתמשות בסימולציות הפרעות קצב נועדו גם לבטל את הצורך בהדמיה טרום פרוצדורלית. מחקר המיפוי הווקטורקרדיוגרפי של הסתברות הפרעות קצב (VMAP) הראה דיוק אזורי משמעותי באיתור אתרי הפרעות קצב חדריות45 ומראה הבטחה בזיהוי מיקומם של מניעי AF מעבר לאבלציה שאינה PVI46. VMAP משתמש ב-ECG בעל 12 מוליכים בשילוב עם מודלים חישוביים מרובים כדי לזהות מטרות הפרעות קצב מבלי להסתמך על נתונים גיאומטריים ספציפיים למטופל. עם זאת, גישה זו עשויה להיות לא אופטימלית עבור הפרעות קצב פרוזדוריות כמו AF, כאשר רכיבים בתדר גבוה על פני השטח ECG חיוניים לזיהוי מניעי הפרעות קצב באופן לא פולשני. רכיבים אלה נלכדים בדרך כלל על ידי אלקטרודות על המשטחים האחוריים והאנטרו-צדדיים27, שאינם מיוצגים באק"ג הסטנדרטי בעל 12 עופרת המשמש בפרקטיקה הקלינית.
למרות הצורך במחקר קליני נוסף, ל-ECGI ללא תמונה בזמן אמת יש פוטנציאל להפוך לכלי רב ערך למיפוי לב לא פולשני במגוון רחב של הפרעות קצב. הפשטות המתודולוגית וזרימת העבודה היעילה של המטופלים בבתי חולים מאפשרים לרופאים לאסוף נתונים קליניים נוספים, מה שיכול לשפר הן את תוצאות המטופלים והן את ההתקדמות הטכנולוגית העתידית. לסיכום, העתיד של מיפוי לב לא פולשני טמון בהתקדמות לעבר גישה נטולת תמונה מלאה, המאפשרת שילוב מהיר וחלק יותר בפרקטיקה הקלינית היומיומית, מייעוץ שגרתי ועד מיפוי בזמן אמת במהלך פרוצדורות אלקטרופיזיולוגיות.
Disclosures
JRP, BPS, JSC, IHR, RM, CF, EZ, JM, DL, FA, MSG ו-AMC קיבלו תואר כבוד מ-Corify Care SL. AMC, MSG ו-FA הם מייסדים שותפים של Corify Care SL ו-JRP, BPS, JSC, IHR, JM, DL, JBG, FA, LM, MSG ו-AMC הם בעלי מניות. TFA קיבלה מענקי מחקר מ-Biosense-Webster. IRL קיבלה תואר כבוד כמרצה ויועץ מאבוט וביוסנס-וובסטר. APS קיבלה תואר כבוד של דוברים ויועצים מ-Bisosense-Webster, Abbott ו-Boston-Scientific. JMT קיבל תואר כבוד כמרצה ויועץ מאבוט, בוסטון-סיינטיפיק ומדטרוניק. EA קיבלה כבוד של דוברים ויועצים מ-Biosense-Webster ו-Bayer. LM מדווח על כבוד כיועץ, מרצה ומועצה מייעצת מבוסטון-סיינטיפיק, אבוט, ג'ונסון אנד ג'ונסון ומדטרוניק, והוא בעל מניות ב-Galgo Medical SL. JBG מדווח על כבוד כיועץ ודובר מ-Microport CRM ו-Abbott, בנוסף לתמיכה בלתי מוגבלת במענקים למלגה מ-Abbott. MPL קיבלה כבוד ממדטרוניק.
Acknowledgements
מחקר זה מומן על ידי המכון האירופי לחדשנות וטכנולוגיה (EIT) במסגרת הסכם מענק SAVE-COR No 220385 וממענק CIAICO/2022/020 במימון Generalitat Valenciana (EFICACIA). תמיכה נוספת הגיעה מ-Generalitat Valenciana (מענק CIAPOS/2021/238, ACIF/2021/205, CIBEFP/2022/9), MCIN/AEI/10.13039/501100011033 ו-ESF Investing in Your Future (מענק RYC2018-024346-I), Instituto de Salud Carlos III (מענק CIBERCV16 CB16/11/00354), וקטלוניה, ספרד (מענק 2021_SGR_01350, SGR21/GENCAT). אנו גם מודים לתמיכה מתוכנית CERCA / Generalitat de Catalunya. MPL מומן (2023-2025) באמצעות חוזה Río Hortega CM22/00107 [Instituto de Salud Carlos III (ISCIII); Fondo Social Europeo (FSE)]. המחברים מודים לנאוס פורטלה ושילה מרקו על תמיכת המזכירות, ולצוותים הרפואיים והסיעודיים על תמיכתם הקלינית בבית החולים קליניק דה ברצלונה, בית החולים האוניברסיטאי הכללי גרגוריו מרניון, בית החולים האוניברסיטאי והפוליטי לה פה. הם גם ממשיכים את דרכם הודות לאלמודה אלברטוס מ-Corify Care SL, מדריד, ספרד וארנטקסה קראסקו מאוניברסיטת פוליטכניקה דה ולנסיה.
Materials
| Name | Company | Catalog Number | Comments |
| ACORYS Mapping System | Corify Care SL | ACORYS | Imageless ECGI system |
| ACORYS 3D Scan Software | Corify Care SL | ACSCAN | 3D scanner app |
| ACORYS Amplifier | Corify Care SL | ACAMP | Biopotential amplifier |
| ACORYS Sensor Vest | Corify Care SL | ACSEN | Sensor vest, 4 components (Front Right, Front Left, Back Right and Back Left) |
| ACORYS Software | Corify Care SL | ACSOF, version 1.2 | Imageless ECGI software |
| Affera mapping system | Medtronic | AFR-00003 | |
| CADENCE Adult mulifuntion defibrillation electrodes | Cardinal Health | 22660R | |
| Catheter extension cable | Medtronic | AFR-00006 | |
| Desktop or portable PC workstation | Any | Windows 11 as the operating system | Imageless ECGI workstation. The processor must be at least an Intel i7 from the 2020 generation or newer. It requires a minimum of 32 GB of RAM and 500 GB of SSD storage. Additionally, a compatible version of .NET Framework must be installed. An internet connection is not required. |
| Dynamic XT 10E 2 5 2 MM Diagnostic Catheter | Boston Scientific | M0042011010 | |
| EP-TRACER 2 ProCart | Cardiotek | The system includes several components provided by the company | |
| External Defibrillator Monitor | PHILLIPS | Efficia DFM100 | |
| Fentanyl | Kern pharma | 1004000143-03 | |
| Heparine | Reig Jofre | 608737.4 O | |
| HexaFlow irrigation pump | Medtronic | AFR-00005 | |
| HexaGen RF generator | Medtronic | AFR-00004 | |
| HexaPulse PF generator | Medtronic | AFR-00008 | |
| INTELLAMAP ORIO Mapping Catheter | Boston Scientific | M004RC64S0 | |
| IntellaNav StablePoint Ablation Catheter | Boston Scientific | M004ERFSDS96200 | |
| iPad mini | Apple | 6th generation A2567 | 3D scanner platform |
| iPadOS | Apple | 15.3 or superior | 3D scanner platform |
| Isolated Ethernet Cable | Corify Care SL | ACNET | Ethernet cable |
| Isoprenaline | Reig Jofre | 7227007 | |
| Left Connector Cable | Corify Care SL | ACCAB_L | Left cables |
| Location Reference Patch Kit | Boston Scientific | M004RAPATCH20 | |
| Location reference patch kit | Medtronic | AFR-00007 | |
| MetriQ Tubing Set | Boston Scientific | M0041170 | |
| Midazolam | Normon | X5XF1 | |
| Physiological Saline Solution for Irrigation | Fabrenius Kabi | br14801 | |
| Propofol | B Braun | 855437.9 OH | |
| Remifentanil | Kern pharma | 672786.7 | |
| RHYTHMIA HD | Boston Scientific | M004 RBINSTALL2ROW0 | |
| Right Connector Cable | Corify Care SL | ACCAB_R | Right cables |
| Single Patient Use ECG Electrodes | Ambu | M-00-S | |
| Sphere-9 mapping and ablation catheter | Medtronic | AFR-00001 | |
| Structure SDK | Structure | 2.2.1 for iOS or superior | 3D scanner platform, infrared structured light camera |
| Structure Sensor Pro | Structure | ST02B. Firmware version 1.2 or superior | 3D scanner platform, infrared structured light camera |
| Sugamadex Teva | Normon | 7340157-OH | |
| Tubing set | Medtronic | AFR-00002 | |
| WorkMate Claris System | Abbott | H700123 | |
| X-Ray C-Arm | Phillips | The system includes several components provided by the company |
References
- Narayan, S. M., John, R. M. Advanced electroanatomic mapping: current and emerging approaches. Curr Treat Options Cardiovasc Med. 26 (4), 69-91 (2024).
- Raiman, M., Tung, R. Automated isochronal late activation mapping to identify deceleration zones: rationale and methodology of a practical electroanatomic mapping approach for ventricular tachycardia ablation. Comput Biol Med. 102, 336-340 (2018).
- Guichard, J. -. B., et al. Substrate mapping for ventricular tachycardia ablation through high-density whole-chamber double extra stimuli. JACC Clin Electrophysiol. 10 (7), 1534-1547 (2024).
- Takigawa, M., et al. Are wall thickness channels defined by computed tomography predictive of isthmuses of postinfarction ventricular tachycardia. Heart Rhythm. 16 (11), 1661-1668 (2019).
- Vázquez-Calvo, S., et al. Noninvasive detection of slow conduction with cardiac magnetic resonance imaging for ventricular tachycardia ablation. Europace. 26 (2), euae025 (2024).
- Sánchez-Somonte, P., et al. Scar channels in cardiac magnetic resonance to predict appropriate therapies in primary prevention. Heart Rhythm. 18 (8), 1336-1343 (2021).
- Roca-Luque, I., et al. Post-ablation cardiac magnetic resonance to assess ventricular tachycardia recurrence (PAM-VT study). Eur Heart J Cardiovasc Imaging. 25 (2), 188-198 (2023).
- Roca-Luque, I., et al. Ventricular scar channel entrances identified by new wideband cardiac magnetic resonance sequence to guide ventricular tachycardia ablation in patients with cardiac defibrillators. Europace. 22 (4), 598-606 (2020).
- Rudy, Y., Burnes, J. E. Noninvasive electrocardiographic imaging. Ann Noninvasive Electrocardiol. 4 (3), 340-359 (1999).
- Haissaguerre, M., et al. Noninvasive panoramic mapping of human atrial fibrillation mechanisms: a feasibility report. J Cardiovasc Electrophysiol. 24 (6), 711-717 (2013).
- Tsyganov, A., et al. Mapping of ventricular arrhythmias using a novel noninvasive epicardial and endocardial electrophysiology system. J Electrocardiol. 51 (1), 92-98 (2018).
- Pereira, H., Niederer, S., Rinaldi, C. A. Electrocardiographic imaging for cardiac arrhythmias and resynchronization therapy. Europace. 22 (10), 1447-1462 (2020).
- Duchateau, J., et al. Performance and limitations of noninvasive cardiac activation mapping. Heart Rhythm. 16 (3), 435-442 (2019).
- Cluitmans, M., et al. Validation and opportunities of electrocardiographic imaging: from technical achievements to clinical applications. Front Physiol. 9, 1305 (2018).
- Molero, R., González-Ascaso, A., Climent, A. M., Guillem, M. S. Robustness of imageless electrocardiographic imaging against uncertainty in atrial morphology and location. J Electrocardiol. 77, 58-61 (2023).
- Rodrigo, M., et al. Noninvasive assessment of complexity of atrial fibrillation: correlation with contact mapping and impact of ablation. Circ Arrhythm Electrophysiol. 13 (3), e007700 (2020).
- Invers-Rubio, E., et al. Regional conduction velocities determined by noninvasive mapping are associated with arrhythmia-free survival after atrial fibrillation ablation. Heart Rhythm. 21 (9), 1570-1580 (2024).
- Fambuena-Santos, C., et al. AF driver detection in pulmonary vein area by electrocardiographic imaging: relation with a favorable outcome of pulmonary vein isolation. Front Physiol. 14, 1057700 (2023).
- San Antonio, R., et al. Optimized single-point left ventricular pacing leads to improved resynchronization compared with multipoint pacing. Pacing Clin Electrophysiol. 44 (3), 519-527 (2021).
- Zacur, E., et al. MRI-Based Heart and Torso Personalization for Computer Modeling and Simulation of Cardiac Electrophysiology. Imaging for Patient-Customized Simulations and Systems for Point-of-Care Ultrasound. 10549, (2017).
- Bell, J. B., Tikhonov, A. N., Arsenin, V. Y. Solutions of ill-posed problems. Math Comput. 32 (144), 1320 (1978).
- Oster, H. S., Taccardi, B., Lux, R. L., Ershler, P. R., Rudy, Y. Electrocardiographic imaging: noninvasive characterization of intramural myocardial activation from inverse-reconstructed epicardial potentials and electrograms. Circulation. 97 (15), 1496-1507 (1998).
- Figuera, C., et al. Regularization techniques for ECG imaging during atrial fibrillation: a computational study. Front Physiol. 7, 466 (2016).
- Molero, R., et al. Improving electrocardiographic imaging solutions: a comprehensive study on regularization parameter selection in L-curve optimization in the atria. Comput Biol Med. 182, 109141 (2024).
- Hernández-Romero, I., et al. Local conduction velocity estimation during wavefront collisions and reentrant scenarios. 2022 Computing in Cardiology (CinC). , (2022).
- Rodrigo, M., et al. Technical considerations on phase mapping for identification of atrial reentrant activity in direct- and inverse-computed electrograms. Circ Arrhythm Electrophysiol. 10 (9), e005008 (2017).
- Guillem, M. S., et al. Noninvasive localization of maximal frequency sites of atrial fibrillation by body surface potential mapping. Circ Arrhythm Electrophysiol. 6 (2), 294-301 (2013).
- Pedrón-Torrecilla, J., et al. Noninvasive estimation of epicardial dominant high-frequency regions during atrial fibrillation. J Cardiovasc Electrophysiol. 27 (4), 435-442 (2016).
- Tzeis, S. 2024 European Heart Rhythm Association/Heart Rhythm Society/Asia Pacific Heart Rhythm Society/Latin American Heart Rhythm Society expert consensus statement on catheter and surgical ablation of atrial fibrillation. Europace. 26 (4), euae043 (2024).
- Parreira, L., et al. Noninvasive three-dimensional electrical activation mapping to predict cardiac resynchronization therapy response: site of latest left ventricular activation relative to pacing site. Europace. 25 (4), 1458-1466 (2023).
- Reventos-Presmanes, J., et al. Noninvasive electrocardiographic imaging for the characterization of complex atrial tachyarrhythmias. Europace. 25 (Supplement_1), (2023).
- Regany, M., et al. ECG imaging as a real time tool to guide left bundle branch pacing implant in patients with left bundle branch block and resynchronization therapy indication. Europace. 26 (Supplement_1), (2024).
- Rudy, Y. Noninvasive electrocardiographic imaging of arrhythmogenic substrates in humans. Circ Res. 112 (5), 863-874 (2013).
- Shah, A. J., et al. Validation of novel 3-dimensional electrocardiographic mapping of atrial tachycardias by invasive mapping and ablation. J Am Coll Cardiol. 62 (10), 889-897 (2013).
- Graham, A. J., et al. Evaluation of ECG imaging to map hemodynamically stable and unstable ventricular arrhythmias. Circ Arrhythm Electrophysiol. 13 (2), e007377 (2020).
- Pujol-Lopez, M., et al. Conduction system pacing vs biventricular pacing in heart failure and wide QRS patients. JACC Clin Electrophysiol. 8 (11), 1431-1445 (2022).
- Rudy, Y., Lindsay, B. D. Electrocardiographic imaging of heart rhythm disorders. Cardiac Electrophysiol Clin. 7 (1), 17-35 (2015).
- Haissaguerre, M., et al. Driver domains in persistent atrial fibrillation. Circulation. 130 (7), 530-538 (2014).
- Reventos-Presmanes, J., et al. Noninvasive assessment of the ventricular tachycardia isthmus during sinus rhythm. Europace. 26 (Supplement_1), (2024).
- Ros, S., et al. Imageless electrocardiographic imaging for atrial electrophysiological characterization: a validation study. Europace. 26, (2024).
- Wu, S., et al. Left bundle branch pacing for cardiac resynchronization therapy: nonrandomized on-treatment comparison with his bundle pacing and biventricular pacing. Can J Cardiol. 37 (2), 319-328 (2021).
- Pujol-López, M., et al. Stepwise application of ECG and electrogram-based criteria to ensure electrical resynchronization with left bundle branch pacing. Europace. 25 (6), euad128 (2023).
- Zhu, K., Chang, D., Li, Q. Which is more likely to achieve cardiac synchronization: left bundle branch pacing or left ventricular septal pacing. Front Cardiovasc Med. 9, 845312 (2022).
- Martinez-Perez, M., et al. Real-time assessment of LV synchrony in AV block population undergoing LBB pacing using ECG imaging. Europace. 26 (Supplement_1), (2024).
- Krummen, D. E., et al. Forward-solution noninvasive computational arrhythmia mapping: the VMAP study. Circ Arrhythm Electrophysiol. 15 (9), (2022).
- Gu, K., et al. Ablation of non-pulmonary vein atrial fibrillation drivers identified by vMap in addition to pulmonary vein isolation improves procedural outcomes. 29th annual AF Symposium 2024. , (2024).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved