Method Article
Картирование сердца в режиме реального времени с помощью неинвазивной системы электрокардиографической визуализации без изображения
В этой статье
Резюме
В этом исследовании представлен новый подход к картированию сердца в реальном времени с использованием неинвазивной системы электрокардиографической визуализации без изображения. Эта система позволяет получать электрофизиологические карты сердца без необходимости предварительной компьютерной томографии или магнитно-резонансной томографии, что обеспечивает эффективное руководство кардиологическими процедурами, такими как абляция и имплантаты сердечной ресинхронизирующей терапии.
Аннотация
Быстрое, безопасное и эффективное картирование сердца имеет решающее значение для лечения сложных аритмий, однако современные методы сталкиваются со значительными ограничениями. Электрокардиограмма (ЭКГ) в 12 отведениях, хотя и необходима для первоначальной диагностики, не обладает пространственным разрешением и глубиной, необходимыми для проведения сложных процедур, таких как катетерная абляция или имплантация устройства для сердечной ресинхронизирующей терапии. С другой стороны, инвазивные методы картирования обеспечивают детальную электрическую активность, но требуют многократной установки катетера, что увеличивает риски и сложность процедуры. Эти методы требуют много времени, дорого и предлагают ограниченную оценку в режиме реального времени, особенно при динамических аритмиях, таких как фибрилляция предсердий (ФП), нестабильная аритмия и сердечная ресинхронизирующая терапия (СРТ).
В этом исследовании представлена неинвазивная система электрокардиографической визуализации без изображения (Imageless-ECGI), разработанная для дополнения традиционных методов путем предоставления карт сердца в режиме реального времени. Не нуждаясь в предварительной процедурной визуализации, эта система регистрирует электрическую активность с высоким разрешением по всему сердцу, предлагая более безопасную и эффективную альтернативу инвазивному картированию. Сочетая непосредственность поверхностных записей с пространственной точностью современных вычислительных моделей, система Imageless-ECGI устраняет разрыв между традиционной ЭКГ и инвазивным картированием, потенциально трансформируя рабочий процесс в электрофизиологических лабораториях.
Введение
Потребность в неинвазивном электрофизиологическом картировании становится все более важной для точной оценки сердечной деятельности, особенно у пациентов, перенесших сложные процедуры аритмии, такие как фибрилляция предсердий (ФП) и абляция желудочковой тахикардии (ЖТ), или во время имплантации кардиостимуляторов и устройств сердечной ресинхронизирующей терапии (СРТ). В настоящее время трехмерное (3D) электроанатомическое картирование (EAM) остается золотым стандартом для руководства операторами во время катетерной абляции1, предоставляя исчерпывающие функциональные карты для характеристики аритмий 2,3. Тем не менее, EAM не является оптимальным для захвата динамических пространственно-временных паттернов ФП, неустойчивых аритмий, а длительная и инвазивная процедура, необходимая для картирования, делает ее непрактичной для использования в процедурах CRT.
Традиционные неинвазивные методы, такие как электрокардиограмма (ЭКГ) в 12 отведениях, хотя и обладают высокой точностью для выявления конкретных очагов аритмии (например, выходного тракта или ЖТ), предлагают ограниченное понимание глобального электрического поведения сердца. Это ограничение особенно очевидно, когда требуется картирование в реальном времени для управления вмешательствами при динамических и сложных аритмиях, где точная локализация аритмогенных областей имеет решающее значение для успешных результатов. Неинвазивное картирование может сыграть важную роль в улучшении предпроцедурного планирования и обеспечении обратной связи в режиме реального времени во время электрофизиологических вмешательств.
Для поддержки электрофизиологов в процедурном периоде достижения в области визуализации сердца, такие как компьютерная томография (КТ) и магнитно-резонансная томография (МРТ), доказали свою эффективность в предоставлении подробной структурной информации, включая толщину стенки4 и фиброз миокарда 5,6,7,8 . Тем не менее, эти методы сосредоточены на анатомических и структурных особенностях, оставляя пробел в функциональном электрическом картировании. Кроме того, для получения высококачественных изображений сердца требуются специализированные протоколы сканирования, обученный персонал и сложные методы постобработки, такие как расширенная сегментация и точная характеристика тканей, особенно для выявления сердечного фиброза.
Классические системы электрокардиографической визуализации (ЭКГ) стали неинвазивным вариантом, предлагающим многообещающие результаты за счет реконструкции электрической активности сердца на основе потенциалов поверхности тела (BSP)9,10,11,12. Несмотря на свой потенциал, системы ЭКГ сталкиваются с заметными ограничениями13,14. Во-первых, они требуют предварительного компьютерного томографирования для отображения положения электродов на геометрии сердца, что делает их повседневное клиническое использование менее целесообразным. Во-вторых, традиционные методы регуляризации, используемые для решения обратной задачи кардиологического картирования, часто вводят нефизиологические паттерны распространения, ограничивая их точность в клинических условиях.
Целью данного исследования было описание особенностей и процедур новой неинвазивной системы ЭКГ, способной проводить картирование в режиме реального времени без необходимости проведения КТ или МРТ15, известной как ЭКГ без изображения. Мы изучили достижения безобразной ЭКГ и представили потенциальные клинические приложения для электрофизиологического картирования, преодолевая ограничения современных методов, таких как ЭАМ, ЭКГ в 12 отведениях и классическая ЭКГИ в лечении сложных процедур аритмии. Такой подход позволяет создавать карты сердца в течение нескольких минут после прибытия пациента, оптимизируя рабочий процесс и сокращая время подготовки. Кроме того, система использует передовые алгоритмы обработки сигналов для создания точных физиологических моделей распространения, улучшая локализацию аритмии и результаты процедур.
протокол
Методология была проспективно валидирована в многоцентровом обсервационном клиническом исследовании. Исследование проводилось в соответствии с Хельсинкской декларацией и этическими стандартами участвующих учреждений. Протокол исследования SAVE-COR (NCT05772182) был одобрен этическими комитетами Университетской больницы Грегорио Мараньона, Клинической больницы Барселоны и Университетской политехнической больницы Ла Фе, и было получено информированное согласие всех пациентов.
ПРИМЕЧАНИЕ: Подробное описание критериев включения и исключения:
Критерии включения: (i) Показания к инвазивному электроанатомическому исследованию и/или имплантации внутриполостных кардиостимуляторов. (ii) получение и подписание информированного согласия на включение в исследование.
Критерии исключения: (i) возраст <18 лет. (ii) Невозможность проведения эндокардиальной катетеризации (например, беременным или кормящим женщинам). (iii) Физическая или психическая неспособность понять и принять информированное согласие. (iv) Неспособность встать в вертикальное положение для проведения 3D-реконструкции туловища, необходимой для системы ECGI. (v) Пациенты с врожденными патологиями.
1. Предпроцедурная подготовка системы ЭКГ без изображения в режиме реального времени
- Убедитесь, что усилитель биопотенциала (рисунок 1A) полностью заряжен, и поместите его в конец стола в кабинете электрофизиологии (EP), рядом с тем местом, где будут расположены ноги пациента.
ПРИМЕЧАНИЕ: Усилитель биопотенциала (см. Таблицу материалов) представляет собой изолированное 128-канальное устройство, отвечающее за усиление и оцифровку электрических сигналов, собираемых электродами. - Убедитесь, что правый и левый кабели не повреждены, осмотрев разъемы усилителя на одном конце и черные гнезда, к которым подключен жилет датчика, на другом конце (рис. 1B).
ПРИМЕЧАНИЕ: Правый и левый кабели (см. Таблицу материалов) имеют длину 1,5 м и передают электрические сигналы от сенсорного жилета к усилителю биопотенциала. - Подключите правый и левый соединительные кабели к усилителю биопотенциала (рисунок 1C). Каждый кабель связан со штекером, который отличается номером, одинаковым как для кабеля, так и для усилителя.
- Убедитесь, что платформа 3D-сканера полностью заряжена, и откройте приложение для 3D-сканирования.
ПРИМЕЧАНИЕ: Приложение для 3D-сканирования — это программное обеспечение, работающее на платформе 3D-сканера (см. Таблицу материалов), которое использует инфракрасную камеру структурного света для создания 3D-модели реконструкции туловища пациента. Приложение также автоматически определяет местоположение быстродействующих (QR) кодов электрода. - Убедитесь, что на рабочей станции ПК (см. Таблицу материалов) установлен пользовательский интерфейс программного обеспечения ECGI без изображения и она полностью заряжена.
ПРИМЕЧАНИЕ: Программное обеспечение ЭКГ без изображения (см. Таблицу материалов) включает в себя алгоритмы обработки сигналов для оценки геометрии сердца и предоставления ценной информации для диагностики и лечения сердечных аритмий или управления процедурами имплантации кардиологических устройств 16,17,18,19. Пользовательский интерфейс системы позволяет пользователям визуализировать, выбирать и анализировать электрокардиографические сигналы, создавая интерактивные карты эпикардиальной активности, которые позволяют неинвазивно оценивать сердечную функцию. - Подключите усилитель биопотенциала к рабочей станции с помощью изолированного кабеля Ethernet (см. Таблицу материалов). Вставьте один конец в порт Ethernet усилителя, а другой — в рабочую станцию.
ПРИМЕЧАНИЕ: Изолированный кабель Ethernet передает электрические сигналы от усилителя биопотенциала к рабочей станции. - Выберите жилет с датчиками (см. Таблицу материалов), осмотрите упаковку и убедитесь, что герметизация не повреждена. Не используйте сенсорный жилет, если упаковка открыта или повреждена.
- Откройте упаковку жилета с датчиком и убедитесь, что четыре компонента жилета находятся внутри. Выберите другую упаковку сенсорного жилета, если отсутствует один из компонентов.
ПРИМЕЧАНИЕ: Сенсорный жилет представляет собой электродную решетку высокой плотности со 128 серебряными электродами, которые позволяют одновременно отображать поверхностную электрическую активность по всему туловищу пациента. Жилет рентгенопрозрачный и содержит четыре пластыря, которые покрывают переднюю и заднюю левую и правую поверхности туловища. На лицевой стороне каждого электрода есть QR-код, позволяющий автоматически определять положение электрода.
2. Предпроцедурная подготовка пациента
- Госпитализируйте пациента в больницу в тот же день, что и электрофизиологическое исследование или имплантация устройства.
- Расположите пациента стоя или сидя на стуле или столе EP и убедитесь, что вся область туловища свободна от одежды.
- Проведите визуальный осмотр кожи пациента, чтобы проверить, есть ли у пациента берега, раны или любое другое состояние кожи, чтобы избежать прикрепления электродов к этим областям.
- По желанию можно ухаживать за туловищем для лиц со значительным количеством волос, чтобы свести к минимуму шумовые артефакты и уменьшить дискомфорт при снятии сенсорного жилета.
- Правильно расположите четыре части сенсорного жилета (переднюю правую, переднюю левую, заднюю правую и заднюю левую) на туловище пациента (рис. 2A) и отрегулируйте жилет в соответствии с размерами пациента, при необходимости сложив соединения между электродами.
- По желанию, при процедурах CRT избегайте размещения электродов в области, где будет вставлен сердечный имплантат, часто расположенной в левой верхней части грудной клетки.
ПРИМЕЧАНИЕ: Соединения с напечатанными черточками могут быть безопасно разорваны, если это необходимо, так как в этих областях нет активных дорожек. - Разместите электроды с приводом правой ноги (RLD) и опорного (REF) жилета с датчиком на правой и левой ногах соответственно, как можно дальше от других электродов жилета.
- Обеспечьте достаточное освещение в помещении и убедитесь, что в радиусе 1,5 м вокруг туловища пациента не должно быть никаких предметов, так как они могут помешать или исказить 3D-реконструкцию туловища.
- Расположите пациента так, чтобы его руки были подняты над головой, чтобы предотвратить вмешательство в 3D-реконструкцию туловища, как показано на рисунке 2C.
- Получите 3D реконструкцию туловища пациента.
- Возьмите платформу 3D-сканера и откройте приложение для 3D-сканирования.
- Отсканируйте QR-код на боковой стороне переднего правого жилета, чтобы проверить сенсорный жилет (рис. 2B), убедившись, что он одноразовый и не просрочен.
ПРИМЕЧАНИЕ: После обнаружения QR-кода приложение для 3D-сканирования позволяет получить 3D-реконструкцию туловища. - Расположите платформу 3D-сканера на уровне туловища перед пациентом, крепко держите ее обеими руками и выполните поворот на 360° вокруг пациента, чтобы получить 3D-реконструкцию туловища (рис. 2C).
ПРИМЕЧАНИЕ: По мере сканирования инфракрасная камера структурированного света с платформы 3D-сканера создает серую 3D-замкнутую сетку туловища, завершая процесс при полном вращении. Как правило, процесс 3D-реконструкции туловища занимает 1-2 минуты. - Проведите визуальный осмотр 3D-реконструкции туловища, чтобы убедиться, что все туловище покрыто серой тенью и что в реконструированной сетке нет отверстий.
- Сохраните 3D-реконструкцию туловища в приложении после завершения сканирования.
- Предложите пациенту лечь на стол для проведения ВП.
- Подсоедините четыре части жилета с датчиками к соответствующим правому и левому соединительным кабелям (рис. 1D). Подсоедините передний правый и задний-правый разъемы жилета к правому гнезду кабеля, а разъемы переднего левого и заднего левого жилета — к левому гнезду кабеля.
- Включите усилитель биопотенциала, чтобы программное обеспечение ЭКГ без изображения могло получать электрофизиологические сигналы в режиме реального времени.
3. Оценка геометрии сердца пациента
- Войдите в систему в качестве пользователя в программном обеспечении реального времени Imageless ECGI, установленном на рабочей станции (рисунок 3). Укажите имя пользователя и пароль.
- Нажмите кнопку «Добавить пациента » и введите идентификационные данные для регистрации нового пациента в главном окне пользовательского интерфейса (рисунок 4). Затем создайте новую сессию, связанную с пациентом, указав тип процедуры и следующие базальные данные: пол, возраст, рост и вес.
ПРИМЕЧАНИЕ: Один пациент может проходить несколько сеансов. Например, в клинических исследованиях с последующим наблюдением, если пациент проходит повторную регистрацию ЭКГ, новый сеанс может быть создан без добавления пациента снова. - Подключите платформу 3D-сканера к рабочей станции с помощью кабеля USB-C.
- Нажмите кнопку «Загрузить сканирование туловища » и загрузите 3D-реконструкцию туловища в окно «Геометрия туловища » (рисунок 5).
ПРИМЕЧАНИЕ: Программное обеспечение автоматически определит локализацию 128 электродов от сенсорного жилета. Каждый компонент жилета имеет разные цвета электродов: передний правый = красный, передний левый = синий, задний правый = розовый, а задний левый = оранжевый. - При необходимости можно вручную отрегулировать положение электродов, щелкнув по каждому электроду и переместив его на поверхность туловища.
- Нажмите кнопку «Вычислить геометрию » и опцию «Оценить геометрию сердца », чтобы оценить геометрию сердца пациента в окне «Геометрия туловища» (рисунок 5).
Программное обеспечение оценивает геометрию сердца с использованием методологии, основанной на статистической модели формы (SSM) (рисунок 6A), как подробно описано в предыдущей литературе20. Алгоритм сначала обрабатывает 3D-реконструкцию туловища пациента и базальные данные (пол, возраст, рост и вес) в качестве входных данных. Впоследствии SSM, включающий в себя геометрию туловища и сердца на основе МРТ, итеративно корректируется в соответствии с 3D-сеткой туловища пациента. Это определяет оптимальную геометрию сердца, положение и ориентацию в теле пациента (рис. 6B). Этот процесс устраняет необходимость в предварительной процедуре КТ или МРТ, что позволяет создать первую неинвазивную карту сердца в течение 10-15 минут. Важно отметить, что всплывающее сообщение информирует пользователя о том, если 3D-реконструкция туловища не имеет достаточного разрешения или содержит какие-либо артефакты, которые могут повлиять на точность результатов оценки.
4. Неинвазивное безобразное ЭКГ-картирование для проведения кардиостимуляционного имплантата для сердечной ресинхронизирующей терапии (CSP-CRT) в режиме реального времени (случай 4)
- Перейдите в окно «Усилитель» и нажмите кнопку «Подключить усилитель», чтобы начать прием электрофизиологических сигналов в режиме реального времени (рисунок 7). Нажимайте на различные провода, чтобы визуализировать сигналы на экране усилителя.
- Перейдите в окно реального времени (Рисунок 8), чтобы получить неинвазивное картирование сердца в режиме реального времени.
ПРИМЕЧАНИЕ: Окно в реальном времени позволяет визуализировать сигналы в реальном времени, исключает зашумленные сигналы, создает временные индикаторы, автоматически очерчивает сегменты анализа (например, комплекс зубца P и QRS), а также вычисляет и отображает неинвазивные карты ЭКГ. - Исключите зашумленные сигналы, нажав кнопку просмотра со 128 отведениями , выбрав опцию «Только для пользователя » в качестве режима выбора зашумленных отведений и дважды щелкнув по зашумленным сигналам, чтобы исключить их перед созданием карты ECGI. Это повышает качество вычислений при картировании, так как ЭКГИ является некорректно поставленной задачей21.
ПРИМЕЧАНИЕ: Провода жилета датчика, отображаемые зеленым цветом, указывают на хорошее качество сигналов и используются для вычисления обратной задачи, в то время как провода, показанные красным, являются зашумленными и исключаются из анализа (Рисунок 8A). - Нажмите кнопку просмотра в 12 отведениях , чтобы визуализировать оценку ЭКГ в 12 отведениях в режиме реального времени (Рисунок 8B).
- Убедитесь, что кнопка RT ON активна для автоматического обновления сигналов в разделе анализа сигналов (Рисунок 8C). Эта опция автоматически запускает и определяет начало и смещение анализируемого комплекса QRS.
ПРИМЕЧАНИЕ: Кнопка RT может быть переведена в режим RT OFF для замораживания сигналов, что позволяет пользователю вручную разграничивать комплекс QRS, когда автоматическое разграничение системы является неоптимальным. - Настройте анализ карты активации ЭКГИ, нажав кнопку «Параметры », чтобы автоматически создать оптимальную карту базального ритма для процедуры CSP-CRT:
- Выберите опцию «Анализ желудочка », чтобы отобразить только желудочки.
- Выберите опцию анализа на основе вейвлета17 для алгоритма времени активации.
- Выберите опцию Average Beat для функции Mapping Type , чтобы рассчитать среднюю волну последних 10 комплексов QRS.
- Оставьте настройки по умолчанию для функций «Коррекция смещения», «Номер такта» и «Опция синхронизации ».
- Выберите опцию «Две панели» в разделе визуализации карт и убедитесь, что левая карта установлена в режим обновления , чтобы она постоянно обновлялась с каждым новым анализируемым средним комплексом QRS.
- Визуализируйте карту бивентрикулярной базальной активации с левой стороны (Рисунок 8D левая панель). Система автоматически рассчитывает матрицу переноса между туловищем и сердечными сетками для реконструкции эпикардиальной электрической активности сердца на основе метода граничных элементов 22,23,24.
ПРИМЕЧАНИЕ: Карта активации отображает временное прогрессирование деполяризации в эпикарде сердца, что помогает точно определить происхождение активации и идентифицировать реентерабельные или фокальные паттерны. Активации рассчитываются следующим образом: (1) преобразование каждой восстановленной электрограммы в сумму синусоидальных вейвлетов для всех выборок времени отрицательного наклона и амплитуды, пропорциональной наклону в этот момент времени, и (2) выбор момента максимальной амплитуды преобразованного сигнала в качестве момента времени активации17. - Напишите имя и сохраните базальную карту, нажав кнопку «Сохранить карту », и переключите карту в режим «Стоп», как только она станет воспроизводимой. Воспроизводимая карта ECGI имеет постоянную продолжительность активации и шаблоны распространения, по крайней мере, на трех последовательных картах.
ПРИМЕЧАНИЕ: При процедурах CSP-CRT базальная карта (Рисунок 12A) будет служить эталоном для оценки бивентрикулярной синхронности во время процесса завинчивания электродов в области перегородки до достижения области левой ветви Гиса (Рисунок 12C). - Настройте анализ картирования активации ЭКГИ, нажав кнопку «Параметры » для получения оптимальных карт в процессе завинчивания и стимуляции в области перегородки:
- Выберите «Анализ желудочка», чтобы отобразить только желудочки.
- Выберите опцию анализа на основе вейвлетов для алгоритма Время активации.
- Выберите опцию одиночного удара для параметра Тип отображения , чтобы проанализировать волну одного удара и зафиксировать изменения электрокардиографических сигналов во время одновременного завинчивания и процесса стимуляции в разных положениях перегородки.
- Оставьте настройки по умолчанию для функций «Коррекция смещения», «Номер такта» и «Опция синхронизации ».
- Установите карту правой панели в режим обновления, чтобы она постоянно обновлялась с каждым новым анализируемым однобитным комплексом QRS в процессе завинчивания.
- Синхронизируйте диапазон цветовой карты карты правой панели с базальной картой с помощью меню «Связанные значения» и свяжите их положения камер с помощью меню «Связанная камера» (правая панель рис. 8D).
ПРИМЕЧАНИЕ: Поскольку проводник ввинчивается в область перегородки, карты ЭКГ автоматически генерируются в различных положениях (т.е. в правой межжелудочковой перегородке, средней перегородке, глубокой перегородке и левой ветви пучка пучка Гиса). Эти карты сравниваются с базальной картой путем стандартизации диапазона цветовой карты для всех оцениваемых карт ECGI (рис. 12B, C). Такая конфигурация позволяет четко визуализировать изменения в шаблонах активации при завинчивании провода. - Запишите имя и сохраните каждую карту, нажимая кнопку «Сохранить карту » всякий раз, когда в процессе завинчивания в области перегородки наблюдается изменение схемы активации, продолжая до тех пор, пока не будет достигнута область левой ветви пучка пучка.
5. Дополнительный неинвазивный анализ безобразного картирования ЭКГ
ПРИМЕЧАНИЕ: Различные сердечные карты могут быть получены из вычисленных сигналов ЭКГ для оценки сердечного субстрата, характеристики аритмий, оценки CRT или извлечения клинически значимых показателей во время процедур. Тип карт, которые могут быть сгенерированы, зависит от конкретного анализируемого сердечного ритма, при этом существуют различные подходы как для регулярных, так и для нерегулярных ритмов.
- Используйте раздел «Анализ сигналов» окна в режиме реального времени для анализа различных ритмов, которые пациенты могут демонстрировать во время электрофизиологической процедуры:
- Анализируйте регулярные ритмы, устанавливая анализ одиночных или средних ударов в качестве функции типа картирования, когда пациент находится в стабилизированном/регулярном ритме, таком как синусовый ритм, предсердная или желудочковая стимуляция, трепетание предсердий или желудочковая тахикардия. Вычисление карты активации и карты скорости проводимости (CV) на основе регулярного анализа ритма.
- Анализируйте нерегулярный ритм, используя анализ нерегулярного ритма в качестве функции типа картирования , когда пациент находится в состоянии фибрилляции предсердий. Система позволяет выбирать расширенные сегменты АФ (например, 1 минута) для подавления комплексов QRST и захвата динамических пространственно-временных паттернов АФ. Вычисление фазовой карты, карты гистограммы ротора и карты доминирующей частоты на основе анализа нерегулярных ритмов.
- При необходимости нажмите на выпадающее меню выбора карты и выберите карту активации, если был проанализирован регулярный ритм. Смотрите шаг 4.8 для подробного описания карты активации .
- При необходимости нажмите на выпадающее меню выбора карты и выберите карту скорости проводимости , если был проанализирован регулярный ритм.
ПРИМЕЧАНИЕ: Скорость проводимости — это метрика, полученная из карты активации. Эта метрика представляет собой время, которое требуется волновому фронту, чтобы пройти через каждую область эпикарда. Расчет сердечно-сосудистой системы основан на пространственных градиентах временных карт активации на сердечных поверхностях с применением векторных полей скорости для определения областей эффективного распространения. Области с однородными векторами направления указывают на стабильное электрическое распространение, в то время как области с угловыми диспропорциями, указывающими на неэффективное распространение, интерполируются с помощью функции радиального базиса25. CV позволяет идентифицировать области замедления проводимости при картировании субстрата, которые связаны с частотой рецидивов аритмии17. - При необходимости нажмите на выпадающее меню выбора карты и выберите Фазовую карту при анализе нерегулярного ритма.
ПРИМЕЧАНИЕ: Фазовая карта отслеживает прогрессирование определенной области миокарда через потенциал действия с течением времени. Этот тип карты является динамическим, поскольку он представляет собой прогрессию сердечного потенциала. В фазовой карте преобразование Гильберта применяется для вычисления фазы сигнала ЭКГИ. Каждая фаза соответствует заданному состоянию потенциала действия в течение каждого цикла сигнала (π для покоя, π/2 для деполяризации, 0 для плато и -π для реполяризации)26. - При необходимости нажмите на выпадающее меню выбора карты и выберите карту гистограммы ротора при анализе нерегулярного ритма.
ПРИМЕЧАНИЕ: Карта гистограммы ротора, полученная из карты фаз, представляет собой изображение наиболее частых местоположений фазовых сингулярностей, которые представляют собой области с концентрированной входящей активностью и отображаются красным цветом. Вкратце, фазовые сингулярности определяются как ключевые точки, в которых происходят фазовые сдвиги от -π до π. ФС, не показывающие постепенной пространственной прогрессии фаз в своем окружении, отбрасываются от них. Наконец, количество оборотов для каждого ротора количественно определяется для получения карты гистограммы ротора 18. Точность алгоритма в выявлении паттернов распространения во время ФП и конкретных областей, демонстрирующих повторные входы, систематически оценивалась в сравнении с эндокардиальным картированием, демонстрируя корреляцию 71%16. - При необходимости нажмите на выпадающее меню выбора карты и выберите карту доминирующей частоты (DF) при анализе нерегулярного ритма.
ПРИМЕЧАНИЕ: Карты DF отображают преобладающую электрическую частоту в каждой области сердца с течением времени, помогая определить области быстрой электрической активности, которые могут служить драйверами ФП. DF вычисляются как частота с наибольшей спектральной плотностью мощности на периодограмме Уэлча27,28. Его анализ позволяет обнаружить участки с высокой стабильностью или вариабельностью фибрилляторной активности в предсердиях. Гистограмма используется для оценки временного распределения доминирующих частот, обеспечивая четкое и количественное представление наиболее релевантной электрической активности и облегчая идентификацию областей с аномальным поведением.
Результаты
Случай 1 - Планирование и проведение катетерной абляции атипичного трепетания предсердий
Это пациент в возрасте 59 лет (индекс массы тела -ИМТ-30) с артериальной гипертензией, курением, заболеваниями сердечных клапанов в анамнезе, классификацией EHRA IIb и оценкой CHA2DS 2-VASc 1 с указанием катетерной абляции из-за атипичного трепетания предсердий (AFL) на основе ЭКГ в 12 отведениях (Рисунок 9A). В анамнезе пациентка не проводилась катетерная абляция. Предпроцедурная МРТ с поздним усилением гадолиния (ЛГЭ-МРТ) выявила обширный фиброз в задней стенке левого предсердия (ЛП) с нормальной планиметрией ЛП 24 см² и сохраненной фракцией выброса левого желудочка (ФВЛЖ) 54%.
Неинвазивная безобразная ЭКГ была выполнена всего за несколько минут до введения катетера через бедренную оболочку. Для анализа был выбран полный цикл АФЛ (209 мс), свободный от комплексов QRST. Картирование выявило макро-реентерабельную цепь вокруг митрального клапана (МВ), точно определив перимитральную линию как оптимальную мишень абляции для прекращения аритмии (рис. 9B). После этого была проведена контактная ЭАМ (рис. 9C), которая подтвердила характер распространения, наблюдаемый на неинвазивной ЭКГ без изображения. Абляция по перимитральной линии успешно завершила аритмию.
В данном клиническом случае аритмия была точно охарактеризована перед инвазивной ЭАМ, что позволило точно локализовать характер распространения аритмии и упростить процедуру абляции. Тем не менее, для сложных предсердных тахикардий, таких как AFL или фокальная тахикардия, Imageless ECGI предлагает картирование в режиме реального времени, что делает его особенно ценным в случаях неустойчивой аритмии. Его адаптивность к изменениям аритмии во время процедуры обеспечивает точное и динамичное картирование. Кроме того, в то время как диагностика АФЛ против часовой стрелки обычно проста с помощью ЭКГ в 12 отведениях, точное определение местоположения и идентификации механизма сложных тахиаритмий может быть сложной задачей. Следовательно, выполнение ЭКГ без изображения во время медицинской консультации или за несколько минут до нее может повысить безопасность и эффективность процедуры, обеспечивая предварительное руководство по планированию катетерной абляции и устраняя ненужные транссептальные доступы.
Случай 2 - Эволюция фазовых сингулярностей при катетерной абляции персистирующей фибрилляции предсердий
Этот случай - 63-летний мужчина (ИМТ 31) с сохраненной фракцией выброса левого желудочка (ФВЛЖ, 55%), без дилатационной ЛП, и Нью-Йоркской кардиологической ассоциации (NYHA) I была показана катетерная абляция из-за стойкой ФП. Предпроцедурная КТ или МРТ не проводилась. В декабре 2019 года пациентка ранее проходила катетерную абляцию для изоляции легочной вены (ПВИ).
По прибытии пациент находился в состоянии ФП. Картирование субстрата проводилось с использованием ЭКГ без изображения на протяжении всей процедуры абляции (рис. 10А). На исходном уровне с помощью ЭКГИ были выявлены фазовые сингулярности в боковой стенке правого предсердия (РА), основании придатка правого предсердия (РАА), задней стенке левого предсердия (PW) и основании ушка левого предсердия (LAA). Эти результаты коррелировали с высокочастотными и фрагментированными EGM, наблюдаемыми с использованием внутриполостных катетеров, и адекватная PVI была подтверждена с помощью реконструкции LA EAM. Абляция импульсным полем (PFA) была инициирована на базе LAA, что привело к изменению ритма от AF к атипичной AFL. С помощью ЭКГ без изображения был выявлен перимитральный AFL, который был подтвержден путем захвата с дистального полюса катетера коронарного синуса. Была создана митральная линия; однако ФП была вызвана повторно. Впоследствии была достигнута полная изоляция PW. Несмотря на это, ЭКГ без изображений продолжала выявлять значимые фазовые сингулярности в основании РАА. После многократного применения ПФА, нацеленного на эту область, был достигнут синусовый ритм (Рисунок 10B).
Этот клинический случай является примером того, как ФП представляет собой уникальные проблемы из-за высокой вариабельности электрической активности в предсердиях. Бесграфическая ЭКГ эффективно фиксировала пространственно-временные закономерности прогрессирования ФП во время абляции, при этом было получено до трех неинвазивных карт для управления модификацией субстрата до тех пор, пока не будет достигнута СР. Стандартные методы лечения, такие как изоляция легочных вен, имеют относительно высокую частоту рецидивов29. Основные трудности в лечении ФП заключаются в двух областях: (1) определение того, какие пациенты получат пользу только от ПВИ, и (2) для тех, кому требуется более широкий подход, выявление областей за пределами области ПВИ, абляция которых наиболее эффективно уменьшит рецидив аритмии. Во время синусового ритма система Imageless ECGI продемонстрировала способность генерировать сердечно-сосудистые карты, которые оказались полезными для прогнозирования успешности абляции PVI17. Однако в этом случае ЭКГ без изображения фиксировала динамические паттерны ФП одновременно, предоставляя врачам всестороннее представление о том, как распространяется ФП, и помогая определить ключевые области, вызывающие аритмию. Анализ исходов должен быть сосредоточен на корреляции между абляционными драйверами ФП, обнаруженными с помощью ЭКГ без изображения, и клиническими конечными точками, такими как долгосрочная выживаемость без аритмии, чтобы еще больше подтвердить его полезность в оптимизации стратегий абляции ФП.
Случай 3 - Оптимизация бивентрикулярной кардиостимуляции для сердечной ресинхронизирующей терапии
Это пациентка 67 лет с неишемической дилатационной кардиомиопатией, ФВЛЖ 25%, без признаков позднего усиления гадолиния на МРТ до процедуры, с блокадой левой ножки пучка Гиса (БЛНПГ) на исходной ЭКГ и продолжительностью QRS 156 мс. Пациентке была показана бивентрикулярная кардиостимуляция (БиВП) в составе СРТ.
Во время процедуры кардиологической СРТ для оценки синхронизации желудочков до и после имплантации кардиостимулятора использовалась ЭКГ без изображения в реальном времени. В исходном ритме последняя область активации пациента была идентифицирована в базально-боковой стенке левого желудочка (ЛЖ), как показано на рисунке 11А. Общее время активации желудочков (ТАТ) было измерено на уровне 116 мс, что указывает на значительную асинхронность желудочков. Различные конфигурации устройств оценивали с помощью ЭКГ, при этом оптимальной установкой был определен BiVP с одновременной активацией дистального и проксимального полюсов отведения ЛЖ и атриовентрикулярной задержкой 140 мс. Как показано на рисунке 11B, три точки стимуляции желудочков не привели к поздней активации областей, что указывает на успешную синхронизацию, с улучшенной TAT на 70 мс.
Сердечная ресинхронизирующая терапия направлена на восстановление электрической координации в желудочках и улучшение функции сердца у пациентов с сердечной недостаточностью и длительным QRS. В этом случае Imageless ECGI обеспечил отображение в режиме реального времени, что сыграло ключевую роль в оптимизации BiVP во время процедуры CRT. Это позволило точно оценить паттерны активации желудочков и помогло определить оптимальную конфигурацию устройства, обеспечив полную синхронизацию желудочков. Неинвазивный характер и немедленная обратная связь ЭКГ позволили клиницистам усовершенствовать программирование отведений. Напротив, в то время как исследования подчеркивают ценность ЭКГ в размещении отведения левого желудочка вблизи последней активированной области30, анатомические ограничения могут ограничивать ее применимость. Базальные и конечные параметры ресинхронизации, определенные с помощью ЭКГ, такие как ТАТ, должны быть связаны с клиническими исходами путем мониторинга клинического ответа пациента на СРТ с течением времени, включая улучшение симптомов и долгосрочную функцию желудочков.
Случай 4 - Ведущий кардиостимулятор для сердечной ресинхронизирующей терапии в режиме реального времени
Клиническим случаем является пациентка 45 лет с тяжелой желудочковой дисфункцией (ФВЛЖ 15%) и БЛНПГ с длительностью QRS 172 мс. Пациентке была показана имплантируемая кардиовертированная дефибриллятор CRT с использованием подхода к стимуляции с помощью системы проводимости (CSP).
Во время имплантации устройства была использована ЭКГ без изображения в реальном времени для мониторинга синхронии желудочков на протяжении всего процесса ввинчивания электродов в области перегородки. Как показано на рисунке 12, базовая карта ЭКГИ определила латеральную стенку ЛЖ как последнюю активированную область с TAT 133 мс. Картирование ЭКГ во время завинчивания электродов показало прогрессирующее улучшение синхронии желудочков, при этом оптимальная синхронизация достигалась при достижении левой ветви пучка, что приводило к ТАТ 95 мс.
Этот случай продемонстрировал потенциал безобразной ЭКГ в реальном времени для управления имплантацией LBBP во время процедуры CRT. Его возможности однотактного картирования в режиме реального времени позволили проанализировать TAT желудочков и ресинхронизацию на каждом этапе имплантации свинца в области перегородки. Система предоставила быструю, наглядную и простую для интерпретации метрику, устраняющую отсутствие стандартизации в электрокардиографических критериях CSP. Как и в процедурах BiVP-CRT, необходимы дальнейшие исследования, чтобы определить, коррелируют ли параметры ЭКГ без изображения с клиническим ответом CRT и как они соотносятся с предикторами ЭКГ в 12 отведениях.
Случай 5 - Планирование и руководство катетерной абляцией желудочковой тахикардии
Этот случай – 53-летний мужчина (ИМТ 25,4) с ишемической кардиомиопатией, тяжелой желудочковой дисфункцией (ФВЛЖ 15%), и по классификации NYHA II класса был направлен на процедуру катетерной абляции в связи с рецидивирующей ЖТ. При предпроцедурной МРТ выявлен обширный эндокардиальный фиброз и аритмогенные каналы, локализованные в нижнебазальном и нифферомедиальном сегментах левого желудочка. В 2018 году пациентка ранее проходила катетерную абляцию VT.
Одновременное безобразное картирование ЭКГ (Рисунок 13A) и инвазивная ЭМ (Рисунок 13B) выполнялись на протяжении всей процедуры. Процесс катетерной абляции включал в себя субстратное картирование во время апикальной стимуляции правого желудочка (ПЖ) и индукцию ЖТ с использованием запрограммированной стимуляции. С помощью ЭКГ без изображения было выявлено замедление области проводимости в нижнебазальном сегменте ЛЖ во время картирования синусового ритма перед введением катетера. Этот результат согласуется с фиброзом, наблюдаемым на МРТ. Последующая стимуляция от верхушки правого желудочка (ПЖ) подтвердила замедление проводимости в базальном и медиальном сегментах ЛЖ, определив эту область как вероятный аритмогенный субстрат. Была кратковременно индуцирована ЖТ с продолжительностью цикла 380 мс, что потребовало кардиоверсии из-за гемодинамической нестабильности. Следовательно, было получено лишь ограниченное количество баллов EAM. Тем не менее, используя один цикл ЖТ, ЭКГ без изображений успешно идентифицировала перешеек ЖТ в той же области, где наблюдалась изохронная скученность на картах темпа.
Использование ЭКГ без изображения в реальном времени в этом случае ЖТ успешно решило две основные клинические проблемы в лечении ЖТ: (1) точная локализация потенциальных мишеней абляции во время синусового ритма и (2) характеристика ЖТ с гемодинамической нестабильностью. По одному удару перешеек VT был точно идентифицирован как на картах субстрата, так и на картах активации аритмии. Система позволила операторам идентифицировать аритмогенные субстраты до или во время абляции и характеризовать несколько индуцируемых VT в режиме реального времени из одного цикла.

Рисунок 1: Аппаратные компоненты ЭКГ без изображения. (A) Бипотенциальный усилитель со специальными портами для подключения кабеля. (B) Правый и левый кабели, снабженные разъемами усилителя на одном конце и разъемами гнезда датчика жилета на другом. (C) Конфигурация, показывающая правый и левый кабели, подключенные к бипотенциальному усилителю. (D) Схематическая схема схемы подключения сенсорного жилета к кабельным гнездам. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Процедура сканирования 3D-реконструкции туловища. (A) Жилет с датчиком потенциала поверхности тела в 128 выводах, состоящий из четырех компонентов (передний-правый, передний-левый, задний-правый, задний-левый), размещается на туловище пациента перед 3D-реконструкцией. Каждый электрод имеет уникальный QR-код для автоматической идентификации. Соединения между электродами могут быть сложены, чтобы приспособить жилет к форме тела пациента. (B) QR-код на переднем и правом компонентах проверяет жилет на подлинность, что позволяет приложению 3D-сканера инициировать реконструкцию туловища. (C) Платформа 3D-сканера с помощью приложения 3D-сканера генерирует реконструированное туловище с помощью инфракрасной камеры со структурированным светом. Сокращения: FR: передний-правый; FL: передний-левый; BR: задний правый; и BL: назад-влево. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Рисунок 3: Экран входа в пользовательский интерфейс ECGI без изображения, требующий назначенного имени пользователя и пароля для доступа к программному обеспечению. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
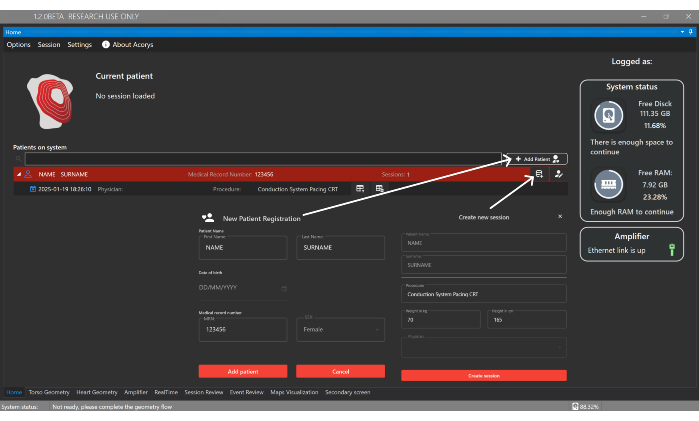
Рисунок 4: Домашнее окно. Домашнее окно позволяет управлять пациентами, врачами и пользователями, а также настраивать сеансы пациентов. Он также отображает информацию об импортированных сессиях и состоянии системы и усилителя. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
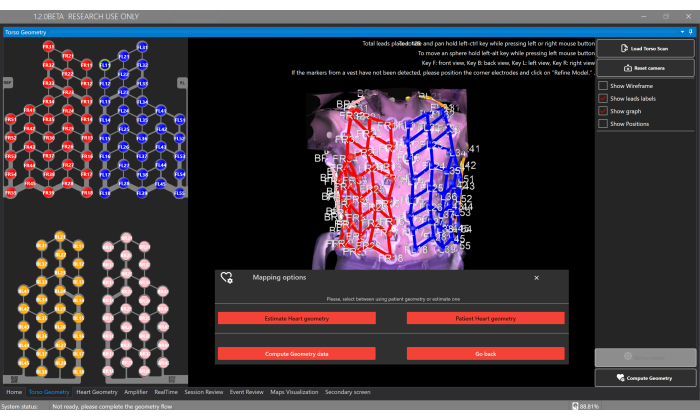
Рисунок 5: Окно геометрии туловища. Окно «Геометрия туловища » позволяет пользователям загружать и просматривать 3D-модель туловища, сегментировать электроды и выбирать тип геометрии сердца с помощью кнопки «Вычислить геометрию », которая позволяет оценить или предоставить сегментацию на основе персонализированных КТ/МРТ. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
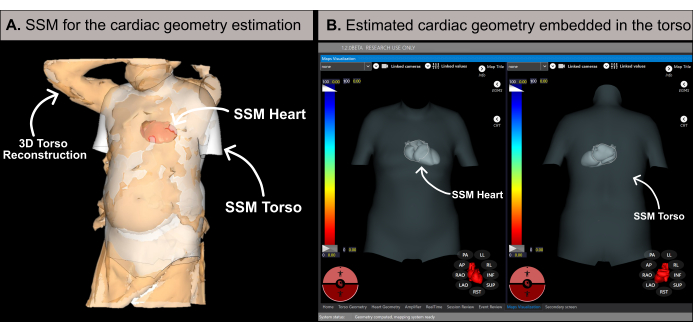
Рисунок 6: Оценка геометрии сердца. (A) Алгоритм SSM с использованием базальных особенностей и 3D-реконструкции туловища пациента для оценки геометрии сердца. (B) Оценка геометрии сердца в пределах ССМ туловища с отображением передне-заднего (левостороннего) и задне-переднего (правостороннего) видов. Сокращения: 3D: трехмерный; SSM: статистическая модель формы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Рисунок 7: Окно усилителя. Окно «Усилитель» позволяет в режиме реального времени визуализировать сигналы, получаемые от каждого электрода сенсорного жилета. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 8: Окно в реальном времени. (A) Схематическое изображение активных проводов от жилета электродной решетки высокой плотности. Зеленые электроды содержат сигналы хорошего качества, в то время как красные содержат зашумленные сигналы и не участвуют в вычислении обратной задачи. (B) Оценка 12 отведений электрокардиограммы в режиме реального времени. (В) Автоматическое срабатывание и разграничение начала и смещения комплекса QRS (окошко зеленого цвета). Средний сигнал всех отведений, участвующих в вычислении отображения, отображается синим цветом. (D) Раздел «Визуализация карт» поддерживает одно-, двух- или четырехкартографический вид. В этом примере показано представление с двойным отображением с картами активации для базального и левого состояний ветви пучка Гиса (окончательное отображение) во время процедуры CRT. Базальная карта находится в режиме заморозки, оставаясь статичной, в то время как итоговая карта находится в режиме обновления, пересчитывая с каждым новым анализируемым комплексом QRS. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
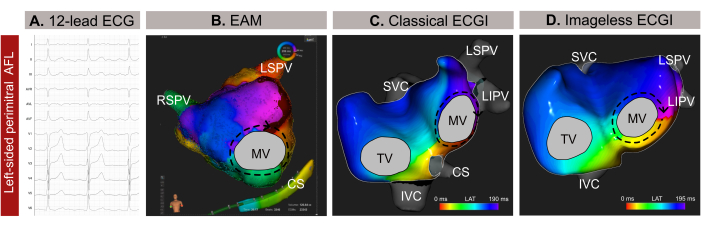
Рисунок 9: Графический пример левосторонней атипичной АФЛ и различные диагностические возможности ЭКГ в 12 отведениях, ЭКГ без изображения и инвазивной ЭМ. (A) Сигналы ЭКГ в 12 отведениях атипичного AFL представляют положительные суправентрикулярные волны в V1. (B) Безобразная ЭКГ с использованием оценки геометрии сердца из SSM и отображением передне-заднего вида. Схема распространения показывает все цвета вокруг МВ, что является типичной картиной для перимитрального AFL. (C) Картирование локальной активации, полученное из ЭАМ и отображающее передне-заднюю проекцию, показывает макро-вход вокруг МВ, подтверждая диагноз с помощью ЭКГ без изображения. Сокращения: ЭКГ: электрокардиограмма; EAM: электроанатомическое картирование; ЭКГИ: электрокардиографическая визуализация. СВЦ: верхняя полая вена; НПВ: нижняя полая вена; КС: коронарный синус; LSPV: левая верхняя легочная вена; RIPV: правая нижняя легочная вена; РСПВ: правая верхняя легочная вена. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
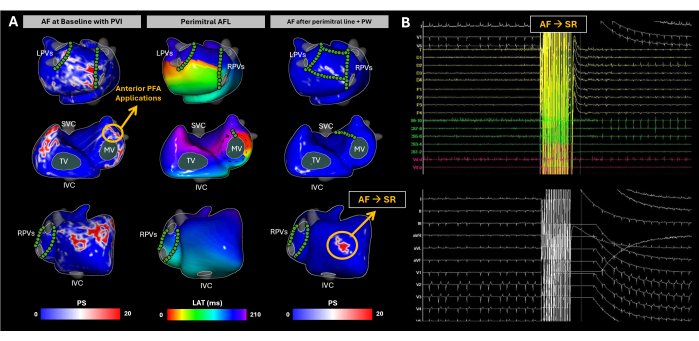
Рисунок 10: Отслеживание эволюции субстрата предсердий во время катетерной абляции ФП с использованием неинвазивного безобразного картирования ЭКГ. (A) Задне-передний, антеро-задний и правый боковые виды ЭКГ без изображения, с участками PFA, отмеченными зелеными кружками. На карте базовой линии PS выделены входы в боковую стенку RA, основание RAA, заднюю стенку LA и основание LAA. PFA на базе LAA перевела ритм на перимитральную AFL. Несмотря на завершение изоляции митральной линии и задней стенки, ФП снова спонтанно индуцировалась. ЭКГ выявила ПС в основании РАА, которое и стало мишенью абляции. В этой области было проведено несколько применений ПФА, и синусовый ритм был восстановлен. (B) ЭКГ в 12 отведениях и внутрисердечные сигналы на момент ФП изменились на SR. Сокращения: SVC: верхняя полая вена; НПВ: нижняя полая вена; ЛЖВ: левые легочные вены; ДПВ: правые легочные вены; ФП: фибрилляция предсердий, СР: синусовый ритм, ПС: фазовые сингулярности, LAT: время локальной активации, TV: трикуспидальный клапан, MV: митральный клапан, PVI: изоляция легочной вены, AFL: трепетание предсердий, PW: задняя стенка, PFA: абляция импульсным полем. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
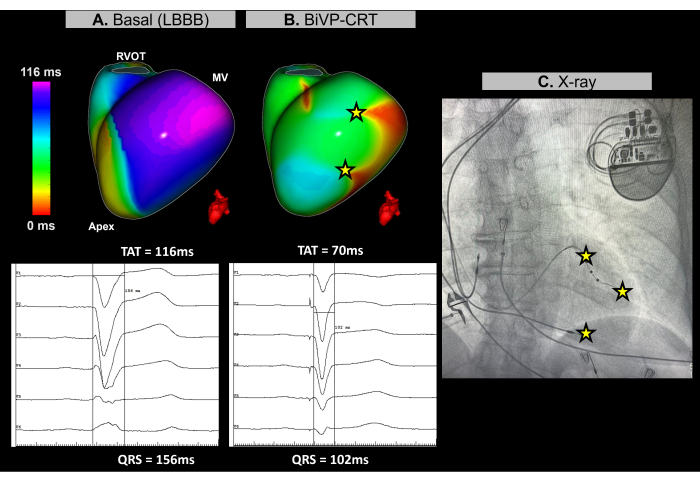
Рисунок 11: Оптимизация бивентрикулярной стимуляции с использованием ЭКГ без изображения. (A) Исходный ритм пациента. На карте ЭКГ без изображения (вид слева) видна поздно активированная область (фиолетовая) в боковой стенке ЛЖ с ТАТ 116 мс, что указывает на диссинхронию желудочков. Это согласуется с исходной ЭКГ, которая показывает широкий комплекс QRS (156 мс) с паттерном БЛНПГ. (B) Конфигурация после имплантации кардиостимулятора. После BiVP с одновременной активацией дистального и проксимального полюсов отведения ЛЖ и атриовентрикулярной задержкой 140 мс, на карте ЭКГ Imageless не видно отсроченных активированных областей (нет фиолетовой области), что указывает на синхронную активацию желудочков и сниженную TAT на 70 мс. Это согласуется с укороченным комплексом QRS, наблюдаемым на итоговой ЭКГ, где продолжительность QRS уменьшается до 102 мс. (C) Передне-задний рентгеновский снимок имплантированного кардиостимулятора, показывающий расположение электродов кардиостимулятора. Активность стимуляции как дистального, так и проксимального полюсов отведения ЛЖ также отражается на карте ЭКГИ. Сокращения: LBНПГ: блокада левой ножки пучка пучка Гиса, BiVP: бивентрикулярная стимуляция, CRT: сердечная ресинхронизирующая терапия, RVOT: выходной тракт правого желудочка, MV: митральный клапан, TAT: общее время активации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
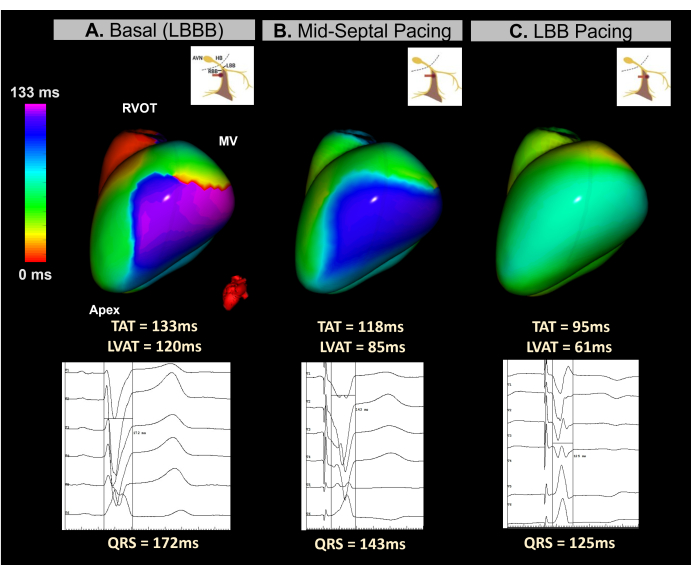
Рисунок 12: Неинвазивная оценка СРТ с помощью стимуляции с помощью проводящей системы с использованием ЭКГ без изображения. (A) Исходный ритм пациента. Карта ЭКГ (лево-боковой вид) указывает на область замедленной активации (фиолетовый) на боковой стенке ЛЖ с TAT 133 мс, что указывает на диссинхронию желудочков. Это соответствует исходной ЭКГ, которая отображает широкий комплекс QRS (172 мс), характерный для БЛНПГ. (B) Промежуточная фаза (среднесептальная стимуляция) во время имплантации отведения LBBP. Неинвазивная карта показывает частичную коррекцию области задержки в ЛЖ со сменой цвета с фиолетового на синий. Это сопровождается уменьшением длительности комплекса QRS. (C) Конечное положение провода LBBP в процессе завинчивания. Карта демонстрирует полную коррекцию области задержки, с переходом цвета от фиолетового к зеленому, что указывает на синхронную активацию обоих желудочков. Сокращения: БЛНПГ: блокада левой ножки пучка Гиса, ЛББ: левая ветвь Гиса, РВОТ: выходной тракт правого желудочка, МВ: митральный клапан, ТАТ: общее время активации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
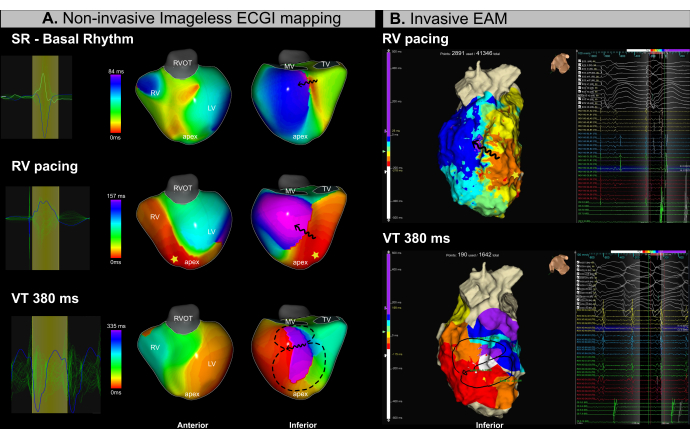
Рисунок 13: Неинвазивная оценка перешейка ЖТ с помощью ЭКГ без изображения. (A) Безобразное картирование ЭКГ во время процедуры абляции ЖТ определяет аритмогенный субстрат и перешеек ЖТ в нижнебазальной и нижнемедиальной областях ЛЖ. Первый ряд соответствует синусовому ритму, средний ряд — апикальной стимуляции ПЖ, а нижний ряд — ЖТ. (B) Инвазивная ЭММ, полученная во время процедуры абляции ЖТ, показывает изохронную активационную картировку в тех же областях, которые были идентифицированы с помощью ЭКГ. Верхний ряд соответствует апикальному темпу RV, а нижний ряд представляет VT. Сокращения: RV: правый желудочек, LV: левый желудочек, SR: синусовый ритм, RVOT: выходной тракт правого желудочка, MV: митральный клапан, TV: трехстворчатый клапан. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
В данном методологическом описании подчеркивается клиническая полезность неинвазивного, однотактного подхода к ЭКГ в режиме реального времени, который может поддерживать различные электрофизиологические процедуры, такие как катетерная абляция и CRT, без необходимости предварительной визуализации сердца, такой как КТ или МРТ 15,17,31,32 В этом отчете Imageless ECGI демонстрирует ключевые технические характеристики, которые могут способствовать ее клиническому внедрению. Несмотря на то, что ЭКГ уже зарекомендовала себя как мощный инструмент для картирования сердца при широком диапазоне аритмий 19,33,34,35,36, она продолжает сталкиваться с рядом клинических и технических проблем 13,14.
Классические системы ЭКГ требуют компьютерной томографии в тот же день, что и кардиологическое картирование, с установленными электродами ЭКГ 9,10,12,37,38. Такой подход увеличивает дополнительное время из-за необходимости сегментации компьютерной томографии (сердца и электродов), что задерживает создание исходной карты ЭКГ примерно на 1-3 часа. В отличие от этого, безобразная система ЭКГ, представленная в этом отчете, использует инфракрасное 3D-сканирование грудной клетки с помощью матричных электродов высокой плотности, которое может быть выполнено всего за несколько минут до процедуры или во время медицинских консультаций. Система автоматически сегментирует торакальные электроды и оценивает геометрию сердца пациента, оптимизируя процесс неинвазивного картирования сердца и значительно сокращая время между прибытием пациента и получением первой карты ЭКГ. Предыдущая валидация безобразного подхода ЭКГ показала, что использование оценки геометрии сердца приводит к минимальным ошибкам, сохраняя точность неинвазивных карт. У пациентов с ФП наблюдалась сильная корреляция между сигналами ЭКГ, полученными на основе оценочных и фактических геометрических форм сердца, даже сгеометрическими переводами. Для регулярных аритмий, таких как сложная предсердная тахикардия, сравнения с ЭАМ продемонстрировали высокую точность в идентификации пораженной сердечной камеры, определении механизма (очаговый или реентерабельный) и выводе о цели абляции31. В случае ЖТ был оценен подход, направленный на направление операторов к областям перешейков ЖТ во время синусового ритма (СИ)39, что показывает потенциал выявления пациентов с риском ЖТ при первичной профилактике. Кроме того, сильная регионарная конгруэнтность между картами активации ЭКГ без изображений и ЭАМ наблюдалась во время кардиостимуляции коронарного синуса, особенно в местах ранней и поздней активации40.
При СРТ морфологические изменения ЭКГ в 12 отведениях в реальном времени обычно используются для подтверждения ресинхронизации во время имплантации отведения, особенно в процедурах CSP, где ЭКГ оценивается на различных этапах установки септального отведения до тех пор, пока не будет достигнута область LBB. Однако опубликованные алгоритмы ЭКГ часто являются сложными, демонстрируют существенные различия между ними, а в некоторых случаях труднореализуемы в клинической практике 41,42,43. Возможно, из-за этой сложности не было последовательно идентифицировано специфического электрокардиографического параметра для кардиостимуляции левой пучковой ветви Гиса (LBBP), который мог бы надежно предсказать, будет ли пациент реагировать на сердечную ресинхронизацию. Подход к ЭКГ без изображения в реальном времени предлагает простое и подробное, пошаговое картирование на протяжении всей имплантации отведения, оценивая коррекцию диссинхронии путем оценки таких параметров, как время активации левого желудочка, как это было продемонстрировано у пациентов с СРТ32 или у пациентов с АВ-блокадой44. Таким образом, при дальнейшем исследовании параметры ЭКГ в реальном времени потенциально могут помочь операторам в оптимизации места имплантации проводников или прогнозировании реакции пациента на СРТ.
Несмотря на то, что потенциал безобразной ЭКГ в реальном времени был представлен в этом методологическом отчете, другие новые неинвазивные подходы к картированию с использованием моделирования аритмии также были направлены на устранение необходимости предварительной процедурной визуализации. Исследование векторного кардиографического картирования аритмогенной вероятности (VMAP) продемонстрировало значительную региональную точность в определении участков желудочковой аритмии45 и показывает многообещающие результаты в определении местоположения драйверов ФП за пределами абляции без PVI46. VMAP использует ЭКГ в 12 отведениях в сочетании с несколькими вычислительными моделями для определения целей аритмии, не полагаясь на геометрические данные, специфичные для пациента. Тем не менее, этот подход может быть неоптимальным для предсердных аритмий, таких как ФП, где высокочастотные компоненты на поверхностной ЭКГ имеют решающее значение для неинвазивного выявления драйверов аритмии. Эти компоненты обычно захватываются электродами на задней и переднебоковой поверхностях27, которые не представлены в стандартной ЭКГ в 12 отведениях, используемой в клинической практике.
Несмотря на необходимость дальнейших клинических исследований, ЭКГ без изображения в реальном времени может стать ценным инструментом для неинвазивного картирования сердца при широком диапазоне аритмий. Его методологическая простота и оптимизированный рабочий процесс пациента в больничных условиях позволяют клиницистам собирать больше клинических данных, что может улучшить как результаты лечения пациентов, так и будущие технологические достижения. В заключение следует отметить, что будущее неинвазивного картирования сердца заключается в продвижении к полностью безобразному подходу, позволяющему быстрее и плавнее интегрировать его в повседневную клиническую практику, от рутинных консультаций до картирования в режиме реального времени во время электрофизиологических процедур.
Раскрытие информации
JRP, BPS, ASC, IHR, RM, CF, EZ, JM, DL, FA, MSG и AMC получили почетные награды от Corify Care SL. AMC, MSG и FA являются соучредителями Corify Care SL, а JRP, BPS, JSC, IHR, JM, DL, JBG, FA, LM, MSG и AMC являются акционерами. TFA получила исследовательские гранты от Biosense-Webster. IRL получала гонорары в качестве лектора и консультанта от Abbott и Biosense-Webster. APS получила гонорары за выступления и консультантов от Bisosense-Webster, Abbott и Boston-Scientific. JMT получала гонорары в качестве лектора и консультанта от Abbott, Boston-Scientific и Medtronic. EA получила гонорары за выступления и консультантов от компаний Biosense-Webster и Bayer. LM сообщает о гонорарах в качестве консультанта, лектора и консультативного совета от Boston-Scientific, Abbott, Johnson & Johnson и Medtronic, а также является акционером Galgo Medical SL. JBG сообщает о гонорарах в качестве консультанта и докладчика от Microport CRM и Abbott, в дополнение к неограниченной грантовой поддержке стипендии от Abbott. MPL получила гонорар за выступления от компании Medtronic.
Благодарности
Это исследование было профинансировано Европейским институтом инноваций и технологий (EIT) в рамках грантового соглашения SAVE-COR No 220385 и гранта CIAICO/2022/020, финансируемого Женералитатом Валенсианы (EFICACIA). Дополнительная поддержка поступила от Generalitat Valenciana (грант CIAPOS/2021/238, ACIF/2021/205, CIBEFP/2022/9), MCIN/AEI/10.13039/501100011033 и ESF Investing in Your Future (грант RYC2018-024346-I), Instituto de Salud Carlos III (грант CIBERCV16 CB16/11/00354) и Каталония, Испания (грант 2021_SGR_01350, SGR21/GENCAT). Мы также признательны за поддержку со стороны Программы CERCA / Женералитата Каталонии. MPL финансируется (2023-2025) через контракт Río Hortega CM22/00107 [Instituto de Salud Carlos III (ISCIII); Fondo Social Europeo (FSE)]. Авторы благодарят Неуса Портеллу и Шейлу Марко за оказание секретарской поддержки, а также врачебным и сестринским бригадам за их клиническую поддержку в Клинической больнице Барселоны, Общей университетской больнице Грегорио Мараньона, Университетской и политехнической больнице Ла Фе. Они также продлеваются благодаря Альмудене Альбертос из Corify Care SL, Мадрид, Испания и Аранче Карраско из Политехнического университета Валенсии.
Материалы
| Name | Company | Catalog Number | Comments |
| ACORYS Mapping System | Corify Care SL | ACORYS | Imageless ECGI system |
| ACORYS 3D Scan Software | Corify Care SL | ACSCAN | 3D scanner app |
| ACORYS Amplifier | Corify Care SL | ACAMP | Biopotential amplifier |
| ACORYS Sensor Vest | Corify Care SL | ACSEN | Sensor vest, 4 components (Front Right, Front Left, Back Right and Back Left) |
| ACORYS Software | Corify Care SL | ACSOF, version 1.2 | Imageless ECGI software |
| Affera mapping system | Medtronic | AFR-00003 | |
| CADENCE Adult mulifuntion defibrillation electrodes | Cardinal Health | 22660R | |
| Catheter extension cable | Medtronic | AFR-00006 | |
| Desktop or portable PC workstation | Any | Windows 11 as the operating system | Imageless ECGI workstation. The processor must be at least an Intel i7 from the 2020 generation or newer. It requires a minimum of 32 GB of RAM and 500 GB of SSD storage. Additionally, a compatible version of .NET Framework must be installed. An internet connection is not required. |
| Dynamic XT 10E 2 5 2 MM Diagnostic Catheter | Boston Scientific | M0042011010 | |
| EP-TRACER 2 ProCart | Cardiotek | The system includes several components provided by the company | |
| External Defibrillator Monitor | PHILLIPS | Efficia DFM100 | |
| Fentanyl | Kern pharma | 1004000143-03 | |
| Heparine | Reig Jofre | 608737.4 O | |
| HexaFlow irrigation pump | Medtronic | AFR-00005 | |
| HexaGen RF generator | Medtronic | AFR-00004 | |
| HexaPulse PF generator | Medtronic | AFR-00008 | |
| INTELLAMAP ORIO Mapping Catheter | Boston Scientific | M004RC64S0 | |
| IntellaNav StablePoint Ablation Catheter | Boston Scientific | M004ERFSDS96200 | |
| iPad mini | Apple | 6th generation A2567 | 3D scanner platform |
| iPadOS | Apple | 15.3 or superior | 3D scanner platform |
| Isolated Ethernet Cable | Corify Care SL | ACNET | Ethernet cable |
| Isoprenaline | Reig Jofre | 7227007 | |
| Left Connector Cable | Corify Care SL | ACCAB_L | Left cables |
| Location Reference Patch Kit | Boston Scientific | M004RAPATCH20 | |
| Location reference patch kit | Medtronic | AFR-00007 | |
| MetriQ Tubing Set | Boston Scientific | M0041170 | |
| Midazolam | Normon | X5XF1 | |
| Physiological Saline Solution for Irrigation | Fabrenius Kabi | br14801 | |
| Propofol | B Braun | 855437.9 OH | |
| Remifentanil | Kern pharma | 672786.7 | |
| RHYTHMIA HD | Boston Scientific | M004 RBINSTALL2ROW0 | |
| Right Connector Cable | Corify Care SL | ACCAB_R | Right cables |
| Single Patient Use ECG Electrodes | Ambu | M-00-S | |
| Sphere-9 mapping and ablation catheter | Medtronic | AFR-00001 | |
| Structure SDK | Structure | 2.2.1 for iOS or superior | 3D scanner platform, infrared structured light camera |
| Structure Sensor Pro | Structure | ST02B. Firmware version 1.2 or superior | 3D scanner platform, infrared structured light camera |
| Sugamadex Teva | Normon | 7340157-OH | |
| Tubing set | Medtronic | AFR-00002 | |
| WorkMate Claris System | Abbott | H700123 | |
| X-Ray C-Arm | Phillips | The system includes several components provided by the company |
Ссылки
- Narayan, S. M., John, R. M. Advanced electroanatomic mapping: current and emerging approaches. Curr Treat Options Cardiovasc Med. 26 (4), 69-91 (2024).
- Raiman, M., Tung, R. Automated isochronal late activation mapping to identify deceleration zones: rationale and methodology of a practical electroanatomic mapping approach for ventricular tachycardia ablation. Comput Biol Med. 102, 336-340 (2018).
- Guichard, J.-B. et al. Substrate mapping for ventricular tachycardia ablation through high-density whole-chamber double extra stimuli. JACC Clin Electrophysiol. 10 (7), 1534-1547 (2024).
- Takigawa, M. et al. Are wall thickness channels defined by computed tomography predictive of isthmuses of postinfarction ventricular tachycardia. Heart Rhythm. 16 (11), 1661-1668 (2019).
- Vázquez-Calvo, S. et al. Noninvasive detection of slow conduction with cardiac magnetic resonance imaging for ventricular tachycardia ablation. Europace. 26 (2), euae025 (2024).
- Sánchez-Somonte, P. et al. Scar channels in cardiac magnetic resonance to predict appropriate therapies in primary prevention. Heart Rhythm. 18 (8), 1336-1343 (2021).
- Roca-Luque, I. et al. Post-ablation cardiac magnetic resonance to assess ventricular tachycardia recurrence (PAM-VT study). Eur Heart J Cardiovasc Imaging. 25 (2), 188-198 (2023).
- Roca-Luque, I. et al. Ventricular scar channel entrances identified by new wideband cardiac magnetic resonance sequence to guide ventricular tachycardia ablation in patients with cardiac defibrillators. Europace. 22 (4), 598-606 (2020).
- Rudy, Y., Burnes, J. E. Noninvasive electrocardiographic imaging. Ann Noninvasive Electrocardiol. 4 (3), 340-359 (1999).
- Haissaguerre, M. et al. Noninvasive panoramic mapping of human atrial fibrillation mechanisms: a feasibility report. J Cardiovasc Electrophysiol. 24 (6), 711-717 (2013).
- Tsyganov, A. et al. Mapping of ventricular arrhythmias using a novel noninvasive epicardial and endocardial electrophysiology system. J Electrocardiol. 51 (1), 92-98 (2018).
- Pereira, H., Niederer, S., Rinaldi, C. A. Electrocardiographic imaging for cardiac arrhythmias and resynchronization therapy. Europace. 22 (10), 1447-1462 (2020).
- Duchateau, J. et al. Performance and limitations of noninvasive cardiac activation mapping. Heart Rhythm. 16 (3), 435-442 (2019).
- Cluitmans, M. et al. Validation and opportunities of electrocardiographic imaging: from technical achievements to clinical applications. Front Physiol. 9, 1305 (2018).
- Molero, R., González-Ascaso, A., Climent, A. M., Guillem, M. S. Robustness of imageless electrocardiographic imaging against uncertainty in atrial morphology and location. J Electrocardiol. 77, 58-61 (2023).
- Rodrigo, M. et al. Noninvasive assessment of complexity of atrial fibrillation: correlation with contact mapping and impact of ablation. Circ Arrhythm Electrophysiol. 13 (3), e007700 (2020).
- Invers-Rubio, E. et al. Regional conduction velocities determined by noninvasive mapping are associated with arrhythmia-free survival after atrial fibrillation ablation. Heart Rhythm. 21 (9), 1570-1580 (2024).
- Fambuena-Santos, C. et al. AF driver detection in pulmonary vein area by electrocardiographic imaging: relation with a favorable outcome of pulmonary vein isolation. Front Physiol. 14, 1057700 (2023).
- San Antonio, R. et al. Optimized single-point left ventricular pacing leads to improved resynchronization compared with multipoint pacing. Pacing Clin Electrophysiol. 44 (3), 519-527 (2021).
- Zacur, E. et al. MRI-Based Heart and Torso Personalization for Computer Modeling and Simulation of Cardiac Electrophysiology. Imaging for Patient-Customized Simulations and Systems for Point-of-Care Ultrasound. 10549, Springer, Cham (2017).
- Bell, J. B., Tikhonov, A. N., Arsenin, V. Y. Solutions of ill-posed problems. Math Comput. 32 (144), 1320 (1978).
- Oster, H. S., Taccardi, B., Lux, R. L., Ershler, P. R., Rudy, Y. Electrocardiographic imaging: noninvasive characterization of intramural myocardial activation from inverse-reconstructed epicardial potentials and electrograms. Circulation. 97 (15), 1496-1507 (1998).
- Figuera, C. et al. Regularization techniques for ECG imaging during atrial fibrillation: a computational study. Front Physiol. 7, 466 (2016).
- Molero, R. et al. Improving electrocardiographic imaging solutions: a comprehensive study on regularization parameter selection in L-curve optimization in the atria. Comput Biol Med. 182, 109141 (2024).
- Hernández-Romero, I. et al. Local conduction velocity estimation during wavefront collisions and reentrant scenarios. 2022 Computing in Cardiology (CinC). Tampere, Finland (2022).
- Rodrigo, M. et al. Technical considerations on phase mapping for identification of atrial reentrant activity in direct- and inverse-computed electrograms. Circ Arrhythm Electrophysiol. 10 (9), e005008 (2017).
- Guillem, M. S. et al. Noninvasive localization of maximal frequency sites of atrial fibrillation by body surface potential mapping. Circ Arrhythm Electrophysiol. 6 (2), 294-301 (2013).
- Pedrón-Torrecilla, J. et al. Noninvasive estimation of epicardial dominant high-frequency regions during atrial fibrillation. J Cardiovasc Electrophysiol. 27 (4), 435-442 (2016).
- Tzeis, S. 2024 European Heart Rhythm Association/Heart Rhythm Society/Asia Pacific Heart Rhythm Society/Latin American Heart Rhythm Society expert consensus statement on catheter and surgical ablation of atrial fibrillation. Europace. 26 (4), euae043 (2024).
- Parreira, L. et al. Noninvasive three-dimensional electrical activation mapping to predict cardiac resynchronization therapy response: site of latest left ventricular activation relative to pacing site. Europace. 25 (4), 1458-1466 (2023).
- Reventos-Presmanes, J. et al. Noninvasive electrocardiographic imaging for the characterization of complex atrial tachyarrhythmias. Europace. 25 (Supplement_1), euad122.229 (2023).
- Regany, M. et al. ECG imaging as a real time tool to guide left bundle branch pacing implant in patients with left bundle branch block and resynchronization therapy indication. Europace. 26 (Supplement_1), euae102.491 (2024).
- Rudy, Y. Noninvasive electrocardiographic imaging of arrhythmogenic substrates in humans. Circ Res. 112 (5), 863-874 (2013).
- Shah, A. J. et al. Validation of novel 3-dimensional electrocardiographic mapping of atrial tachycardias by invasive mapping and ablation. J Am Coll Cardiol. 62 (10), 889-897 (2013).
- Graham, A. J. et al. Evaluation of ECG imaging to map hemodynamically stable and unstable ventricular arrhythmias. Circ Arrhythm Electrophysiol. 13 (2), e007377 (2020).
- Pujol-Lopez, M. et al. Conduction system pacing vs biventricular pacing in heart failure and wide QRS patients. JACC Clin Electrophysiol. 8 (11), 1431-1445 (2022).
- Rudy, Y., Lindsay, B. D. Electrocardiographic imaging of heart rhythm disorders. Cardiac Electrophysiol Clin. 7 (1), 17-35 (2015).
- Haissaguerre, M. et al. Driver domains in persistent atrial fibrillation. Circulation. 130 (7), 530-538 (2014).
- Reventos-Presmanes, J. et al. Noninvasive assessment of the ventricular tachycardia isthmus during sinus rhythm. Europace. 26 (Supplement_1), euae102.687 (2024).
- Ros, S. et al. Imageless electrocardiographic imaging for atrial electrophysiological characterization: a validation study. Europace. 26 (Supplement_1), euae102.690 (2024).
- Wu, S. et al. Left bundle branch pacing for cardiac resynchronization therapy: nonrandomized on-treatment comparison with his bundle pacing and biventricular pacing. Can J Cardiol. 37 (2), 319-328 (2021).
- Pujol-López, M. et al. Stepwise application of ECG and electrogram-based criteria to ensure electrical resynchronization with left bundle branch pacing. Europace. 25 (6), euad128 (2023).
- Zhu, K., Chang, D., Li, Q. Which is more likely to achieve cardiac synchronization: left bundle branch pacing or left ventricular septal pacing. Front Cardiovasc Med. 9, 845312 (2022).
- Martinez-Perez, M. et al. Real-time assessment of LV synchrony in AV block population undergoing LBB pacing using ECG imaging. Europace. 26 (Supplement_1), euae102.487 (2024).
- Krummen, D. E. et al. Forward-solution noninvasive computational arrhythmia mapping: the VMAP study. Circ Arrhythm Electrophysiol. 15 (9) (2022).
- Gu, K. et al. Ablation of non-pulmonary vein atrial fibrillation drivers identified by vMap in addition to pulmonary vein isolation improves procedural outcomes. 29th annual AF Symposium 2024. https://cdn.prod.website-files.com/60f9aad2cca70843f8fa048e/660b432d93bbdc
942469cc1e_AF%20Symposium%202024%20-%20PVI%20Outcomes.pdf (2024).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены