Method Article
非侵襲的無画像心電図イメージングシステムによるリアルタイム心臓マッピング
要約
この研究では、非侵襲的で画像のない心電図イメージングシステムを使用したリアルタイムの心臓マッピングの新しいアプローチを紹介します。このシステムは、処置前のコンピュータ断層撮影や磁気共鳴画像法スキャンを必要とせずに電気生理学的心臓マップを取得することを可能にし、アブレーションや心臓再同期療法インプラントなどの心臓処置を効率的に指導することを可能にします。
要約
複雑性不整脈の管理には、迅速、安全、かつ効果的な心臓マッピングが不可欠ですが、現在の方法では大きな限界があります。12誘導心電図(ECG)は、初期診断には不可欠ですが、カテーテルアブレーションや心臓再同期療法デバイスの埋め込みなどの高度な手順を導くために必要な空間分解能と深さが不足しています。一方、侵襲的なマッピング技術は、詳細な電気的活動を提供しますが、複数のカテーテル留置が必要であり、処置上のリスクと複雑さが増します。これらの方法は時間と費用がかかり、特に心房細動(AF)、不安定性不整脈、心臓再同期療法(CRT)などの動的性不整脈では、リアルタイムの評価が限られています。
この研究では、リアルタイムの心拍間の心臓マップを提供することにより、従来の方法を補完するように設計された非侵襲的で画像のない心電図イメージング (Imageless-ECGI) システムを紹介します。このシステムは、事前のイメージングを必要とせずに、心臓全体の高解像度の電気的活動をキャプチャするため、侵襲的なマッピングに代わる安全で効率的な代替手段を提供します。Imageless-ECGIシステムは、表面記録の即時性と最新の計算モデルの空間精度を組み合わせることで、従来のECGと侵襲的マッピングの間のギャップを埋め、電気生理学研究室のワークフローを変革する可能性があります。
概要
特に心房細動(AF)や心室頻拍(VT)アブレーションなどの複雑な不整脈処置を受けている患者や、ペースメーカーや心臓再同期療法(CRT)デバイスの埋め込み中に、心臓の活動を正確に評価するために、非侵襲的な電気生理学的マッピングの必要性がますます重要になっています。現在、3次元(3D)電気解剖学的マッピング(EAM)は、不整脈2,3を特徴付けるための包括的な機能マップを提供することにより、カテーテルアブレーション1中にオペレーターをガイドするためのゴールドスタンダードであり続けています。ただし、EAM は、AF の動的時空間パターン、非持続性不整脈をキャプチャするには最適ではなく、マッピングには長時間の侵襲的な手順が必要なため、CRT 手順での使用は実用的ではありません。
12誘導心電図(ECG)などの従来の非侵襲的方法は、特定の不整脈病巣(流出路やカスプVTなど)を特定するのに非常に正確ですが、心臓の全体的な電気的挙動に関する洞察は限られています。この制限は、動的で複雑な不整脈への介入を導くためにリアルタイムのマッピングが必要な場合に特に顕著であり、不整脈原性領域の正確な局在化が成功した結果にとって重要です。非侵襲的マッピングは、処置前の計画を強化し、電気生理学的介入中にリアルタイムのフィードバックを提供する上で重要な役割を果たす可能性があります。
電気生理学者を処置前にサポートするために、コンピューター断層撮影法(CT)や磁気共鳴画像法(MRI)などの心臓画像診断法の進歩は、壁の厚さ4や心筋線維症5,6,7,8などの詳細な構造情報を提供するのに効果的であることが証明されています.しかし、これらのモダリティは解剖学的および構造的特徴に焦点を当てており、機能的な電気的マッピングにはギャップが残っています。さらに、高品質の心臓画像を取得するには、特殊なスキャンプロトコル、訓練を受けた人員、特に心線維症の検出のための高度なセグメンテーションや正確な組織特性評価などの複雑な後処理方法が必要です。
従来の心電図イメージング(ECGI)システムは、非侵襲的な選択肢として浮上しており、体表電位(BSP)9,10,11,12に基づいて心臓の電気的活動を再構築することにより有望な結果を提供しています。その可能性にもかかわらず、ECGIシステムは顕著な制限に直面しています13,14。まず、電極の位置を心臓の形状にマッピングするために、処置前のCTスキャンが必要であり、臨床ルーチンの使用が難しくなります。次に、心臓マッピングの逆問題を解決するために使用される従来の正則化手法は、しばしば非生理学的な伝播パターンを導入し、臨床現場での精度を制限します。
この研究の目的は、CT や MRI15 を必要とせずにリアルタイム マッピングが可能な新しい非侵襲的 ECGI システムの特徴と手順を説明することでした。私たちは、イメージレスECGIの進歩を探求し、複雑な不整脈手順の管理におけるEAM、12誘導心電図、古典的ECGIなどの現在の技術の限界を克服する、電気生理学的マッピングの潜在的な臨床応用を提示しました。このアプローチにより、患者の到着から数分以内に心臓マップを作成できるため、ワークフローが合理化され、準備時間が短縮されます。さらに、このシステムは高度な信号処理アルゴリズムを使用して正確な生理学的伝播パターンを生成し、不整脈の局在化と手続き上の結果を改善します。
プロトコル
この方法論は、多施設観察臨床研究で前向きに検証されています。この研究は、ヘルシンキ宣言と関係機関の倫理基準に従って実施されました。研究プロトコルである SAVE-COR (NCT05772182) は、Hospital Universitario Gregorio Marañón、Hospital Clínic de Barcelona、および Hospital Universitari i Politècnic La Fe の倫理委員会によって承認され、すべての患者からインフォームド コンセントが得られました。
注:包含基準と除外基準の詳細な説明は次のとおりです。
包含基準: (i) 侵襲的な電気解剖学的研究および/または腔内ペーシング デバイスの移植の適応。(ii) 研究に含めるためのインフォームド コンセントを取得し、署名した。
除外基準:(i)<18歳。(ii)心内膜カテーテル法を受けることができない(例:妊娠中または授乳中の女性)。(iii)インフォームドコンセントを理解し受け入れる身体的または精神的能力の欠如。(iv) ECGI システムに必要な 3D 胴体再建を可能にするために直立できない。(v) 先天性の病状を有する患者。
1. 手続き前のリアルタイム画像レスECGIシステムの準備
- 生体電位増幅器(図1A)が完全に充電されていることを確認し、電気生理学(EP)ルームテーブルの端、患者の足が配置される場所の近くに置きます。
注:生体電位増幅器( 材料の表を参照)は、電極によって収集された電気信号を増幅およびデジタル化する絶縁された128チャネルデバイスです。 - 一方の端にあるアンプコネクタともう一方の端にあるセンサーベストが接続されている黒いソケットを点検して、左右のケーブルが損傷していないことを確認します(図1B)。
注意: 左右のケーブル( 資料の表を参照)の長さは1.5 mで、センサーベストから生体電位アンプに電気信号を伝送します。 - 左右のコネクタケーブルを生体電位アンプに差し込みます(図1C)。各ケーブルは、ケーブルとアンプの両方で同じ番号で区別されるプラグに関連付けられています。
- 3Dスキャナープラットフォームが完全に充電されていることを確認し、3Dスキャンアプリケーションを開きます。
注:3Dスキャンアプリケーションは、赤外線構造光カメラを使用して患者の胴体の3Dモデル再構築を生成する3Dスキャナープラットフォーム( 材料の表を参照)上で動作するソフトウェアです。また、このアプリケーションは、電極のクイックレスポンス(QR)コードの位置を自動的に検出します。 - PC ワークステーション ( 資料の表を参照) にイメージレス ECGI ソフトウェア ユーザー インターフェイス (UI) がインストールされ、完全に充電されていることを確認します。
注:Imageless ECGIソフトウェア(材料の表を参照)には、信号処理アルゴリズムが組み込まれており、心臓の形状を推定し、心不整脈の診断と治療、または心臓デバイスの埋め込み手順のガイド16,17,18,19のための貴重な情報を提供します.このシステムのUIにより、ユーザーは心電図信号を視覚化、選択、分析でき、心外膜活動のインタラクティブなマップを作成して、心機能の非侵襲的評価を可能にします。 - 絶縁されたイーサネットケーブルを使用して、生体電位増幅器をワークステーションに接続します( 材料の表を参照)。一方の端をアンプのイーサネットポートに挿入し、もう一方の端をワークステーションに挿入します。
注意: 絶縁されたイーサネットケーブルは、生体電位アンプからワークステーションに電気信号を伝送します。 - センサーベストを選択し( 材料の表を参照)、パッケージを検査して、シーリングが損傷していないことを確認します。パッケージが開封されたり損傷したりした場合は、センサーベストを使用しないでください。
- センサーベストのパッケージを開けて、4つのベストコンポーネントが中にあることを確認します。コンポーネントの1つが不足している場合は、別のセンサーベストパッケージを選択してください。
注:センサーベストは、128個の銀電極を備えた高密度電極アレイで、患者の胴体全体にわたる表面の電気的活動を同時にマッピングできます。ベストは放射線透過性で、胴体の左右の前面と後面を覆う4つのパッチが含まれています。各電極の前面にはQRコードが付いており、電極の位置を自動的に識別できます。
2. 患者様の処置前の準備
- 電気生理学的検査またはデバイスの埋め込みと同じ日に患者を病院に入院させます。
- 患者を立っているか座っているか、椅子またはEPテーブルに座らせ、胴体全体に衣服がないことを確認します。
- 患者の皮膚の目視検査を実施して、患者が海岸、傷、またはその他の皮膚状態を持っているかどうかを確認し、これらの領域に電極が付着しないようにします。
- 必要に応じて、髪の毛が大きな人の胴体をグルーミングして、ノイズアーチファクトを最小限に抑え、センサーベストの取り外し時の不快感を軽減します。
- センサーベストの4つの部分(フロントライト、フロントレフト、バックライト、バックレフト)を患者の胴体に正しく配置し(図2A)、必要に応じて電極間の接続部を折りたたんでベストを患者のサイズに調整します。
- オプションで、CRT手順の場合、心臓インプラントが挿入される領域(多くの場合、左胸の上部にあります)に電極を配置することは避けてください。
注意: 印刷されたダッシュとの接続は、それらの領域にアクティブなトラックが存在しないため、必要に応じて安全に切断できます。 - センサーベストの右脚駆動(RLD)電極と参照電極(REF)を、それぞれ右脚と左脚に配置し、他のベスト電極からできるだけ離して配置します。
- 適切な室内照明を確保し、患者の胴体の周囲に直径1.5m以内に物体がないようにしてください。
- 図 2C に示すように、3D 胴体再建の干渉を防ぐために、患者を腕を頭の上に置きます。
- 患者の3D胴体再建を取得します。
- 3Dスキャナープラットフォームをつかみ、3Dスキャンアプリケーションを開きます。
- フロント右ベストコンポーネントの側面にあるQRコードをスキャンして、センサーベストを検証し(図2B)、使い捨てであり、有効期限が切れていないことを確認します。
注:QRコードが検出されると、3Dスキャンアプリケーションにより、3D胴体再構成の取得が可能になります。 - 3Dスキャナープラットフォームを患者の正面の胴体レベルに置き、両手でしっかりと持ち、患者の周りを360°回転させて3D胴体再構成を行います(図2C)。
注:スキャンが進むと、3Dスキャナープラットフォームの赤外線構造化光カメラが胴体の灰色の3D閉じたメッシュを作成し、完全に回転するとプロセスが完了します。通常、3D胴体再構成プロセスが完了するまでに1〜2分かかります。 - 3D 胴体の再構築を目視検査して、胴体全体が灰色の影で覆われていること、および再構築されたメッシュに穴がないことを確認します。
- スキャンが終了したら、3D胴体の再構築をアプリケーションに保存します。
- 患者をEPルームのテーブルに横になってもらいます。
- センサーベストの4つの部分を、対応する左右のコネクタケーブルに接続します(図1D)。フロントライトとバックライトのベストコネクタを右側のケーブルソケットに、フロントレフトとバックレフトのベストコネクタを左のケーブルソケットに取り付けます。
- 生体電位増幅器の電源を入れると、イメージレスECGIソフトウェアがリアルタイムの電気生理学的信号を受信できるようになります。
3. 患者の心筋形状の推定
- ワークステーションにインストールされているリアルタイムのイメージレスECGIソフトウェアにユーザーとしてログインします(図3)。ユーザー名とパスワードを入力します。
- [Add Patient] ボタンをクリックし、UI の [Home Window] で新しい患者を登録するための ID 詳細を入力します (図 4)。次に、患者に関連付けられた新しいセッションを作成し、手順のタイプと次の基本データ(性別、年齢、身長、体重)を提供します。
注:1人の患者が複数のセッションを受けることができます。例えば、フォローアップを伴う臨床試験では、患者が2回目のECGI登録を受けた場合、患者を再度追加することなく新しいセッションを作成することができます。 - USB-Cケーブルを使用して、3Dスキャナープラットフォームをワークステーションに接続します。
- [Load Torso Scan] ボタンをクリックし、3D 胴体の再構築を [Torso Geometry] ウィンドウにアップロードします (図 5)。
注:ソフトウェアは、センサーベストからの128電極の位置を自動的に検出します。各ベストコンポーネントには、フロントライト=レッド、フロントレフト=ブルー、バックライト=ピンク、バックレフト=オレンジという異なる電極色があります。 - 必要に応じて、各電極をクリックして胴体表面に再配置することにより、電極の位置を手動で調整します。
- [Compute Geometry] ボタンと [Estimate Heart Geometry] オプションを選択して、[Torso Geometry] ウィンドウで患者の心臓ジオメトリを推定します (図 5)。
注:ソフトウェアは、以前の文献20で詳述されているように、統計的形状モデル(SSM)(図6A)に基づく方法論を使用して心臓の形状を推定します。このアルゴリズムは、まず患者の3D胴体再構成と基礎データ(性別、年齢、身長、体重)を入力として処理します。その後、SSMは、MRIベースの胴体と心臓の形状を組み込んで、患者の3D胴体メッシュに合うように繰り返し調整します。これにより、患者の体内で最適な心臓の形状、位置、および向きが決まります(図6B)。このプロセスにより、処置前のCTやMRIが不要になり、10〜15分以内に最初の非侵襲的心臓マップを生成できます。3D胴体再構成に十分な解像度がない場合、または推定結果の精度に影響を与える可能性のあるアーティファクトが含まれている場合は、ポップアップメッセージがユーザーに通知されることに注意することが重要です。
4. 心臓再同期療法(CSP-CRT)のための伝導系ペーシングインプラントをリアルタイムにガイドするための非侵襲的画像レスECGIマッピング(ケース4)
- [Amplifier]ウィンドウに移動し、[Connect Amplifier]ボタンをクリックして、リアルタイムの電気生理学的信号の取得を開始します(図7)。さまざまなリード線をクリックして、アンプ画面の信号を視覚化します。
- Real-Time Window(図8)に移動して、リアルタイムの非侵襲的心臓マッピングを取得します。
注:Real-Time Windowは、リアルタイム信号の視覚化、ノイズの多い信号の除外、テンポラルメーカーの作成、分析セグメント(P波やQRS群など)の自動描写、非侵襲的なECGIマップの計算と表示を可能にします。 - ノイズの多い信号を除外するには、 128リード表示 ボタンをクリックし、ノイズの多いリード選択モードとして 「ユーザーのみ 」オプションを選択し、ノイズの多い信号をダブルクリックして除外してから、ECGIマップを生成します。これにより、ECGIは不利な問題であるため、マッピング計算の品質が向上する21。
注:緑色で表示されているセンサーベストリードは、高品質の信号を示し、逆問題の計算に使用されますが、赤で示されているリード線はノイズが多く、解析から除外されます(図8A)。 - 12誘導表示ボタンをクリックすると、推定された12誘導心電図がリアルタイムで視覚化されます(図8B)。
- 信号解析セクションの信号を自動的に更新するために、 RT ON ボタンがアクティブになっていることを確認します(図8C)。このオプションは、解析対象のQRSコンプレックスの開始とオフセットを自動的にトリガーし、定義します。
注: RT ボタンを RT OFF モードに切り替えて信号をフリーズさせることができるため、システムの自動描写が最適でない場合に、ユーザーは手動でQRSコンプレックスを描写できます。 - 「オプション」ボタンをクリックしてECGI活性化マッピング分析を設定し、CSP-CRT手順の最適な基礎リズムマップを自動的に生成します。
- 「 心室の分析 」オプションを選択して、心室のみをマッピングします。
- Activation Times Algorithmのウェーブレットベースの17解析オプションを選択します。
- マッピング タイプ機能の [平均ビート] オプションを選択して、最後の 10 個の QRS コンプレックスの平均ウェーブを計算します。
- 「オフセット補正」、「ビート番号」、および「同期オプション」機能のデフォルト設定はそのままにします。
- マップの視覚化セクションで 2 つのパネル オプションを選択し、左側のマップが 更新 モードに設定されていることを確認して、新しく平均化された QRS コンプレックスが分析されるたびに継続的に更新されるようにします。
- 左側に両心室基底活性化マップを視覚化します(図8D左パネル)。システムは、境界要素法22、23、24に基づいて心臓の心外膜電気的活動を再構築するために、胴体と心臓メッシュとの間の伝達マトリックスを自動的に計算する。
注: 活性化 マップは、心臓心外膜を横切る脱分極の時間的進行を示し、活性化の起源を特定し、リエントラントまたは焦点パターンを特定するのに役立ちます。活性化は、(1)再構成された各電位図を、その時点での傾きに比例するすべての負の傾き時間サンプルと振幅に対する正弦波ウェーブレットの合計に変換し、(2)変換された信号の最大振幅の瞬間を活性化時間の瞬間として選択することによって計算される17。 - 名前を書き込み、 Save Map ボタンをクリックして基本マップを保存し、再現可能になったらマップを フリーズ モードに切り替えます。再現可能なECGIマップは、少なくとも3つの連続するマップにわたって一貫した活性化期間と伝播パターンを持っています。
注:CSP-CRT手順では、基礎マップ(図12A)は、中隔領域の電極ねじ込みプロセス中の左脚領域(図12C)に到達するまでの両心室同期を評価するための参照として機能します。 - ECGI活性化マッピング解析を設定するには、[ オプション ]ボタンをクリックして、中隔領域のねじ込みおよびペーシングプロセス中に最適なマップを取得します。
- 「Analyze Ventricle (心室の分析)」を選択して、心室のみをマッピングします。
- [アクティベーション時間アルゴリズム] でウェーブレットベースの解析オプションを選択します。
- 「マッピングタイプ」の「シングルビート」オプションを選択すると、シングルビートの波を解析して、異なるセプタル位置での同時ねじ込みおよびペーシングプロセス中の心電図信号の変化をキャプチャできます。
- 「オフセット補正」、「ビート番号」、および「同期オプション」機能のデフォルト設定はそのままにします。
- 右側のパネル マップを Update モードに設定して、ねじ込みプロセス中に新しく解析されたシングルビート QRS コンプレックスごとにマップが継続的に更新されるようにします。
- [リンクされた値] メニューを使用して、右側のパネル マップのカラーマップ範囲を基本マップと同期し、[リンクされたカメラ] メニュー (図 8D の右側パネル) を使用してカメラ位置をリンクします。
注:リードが中隔領域にねじ込まれると、さまざまな位置(つまり、右心室中隔、中中隔、深部中隔、および左脚枝)で心拍心ECGIマップが自動的に生成されます。これらのマップは、評価されたすべてのECGIマップ(図12B、C)のカラーマップ範囲を標準化することにより、基礎マップと比較されます。このセットアップにより、リード線をねじ込んでいる間の活性化パターンの変化を明確に視覚化できます。 - 名前を書き込み、各マップ を保存するには、 中隔領域のねじ込みプロセス中に活性化パターンの変化が観察されるたびに、左のバンドル分岐領域に到達するまで続けます。
5. 追加の非侵襲的画像レスECGIマッピング解析
注: 計算された ECGI 信号からさまざまな心臓マップを導き出して、心臓基質の評価、不整脈の特性評価、CRT の評価、または手順中に臨床的に関連するメトリックを抽出できます。生成できるマップの種類は、分析する特定の心拍リズムによって異なり、規則的なリズムと不規則なリズムの両方に対して異なるアプローチが取られます。
- Real-Timeウィンドウの信号解析セクションを使用して、電気生理学的処置中に患者が示す可能性のあるさまざまなリズムを分析します。
- 患者が洞調律、心房または心室のペーシング、心房粗動、心室頻拍などの安定した/規則的なリズムにある場合、マッピングタイプ機能としてシングルビートまたは平均ビート分析を設定し、規則的なリズムを分析します。通常のリズム解析から活性化マップと伝導速度(CV)マップを計算します。
- 患者が心房細動にあるときのマッピングタイプ機能として不規則なリズムのビート分析を使用して、不規則なリズムを分析します。このシステムでは、拡張AFセグメント(1分など)を選択して、QRST複合体を抑制し、AFの動的時空間パターンをキャプチャできます。不規則なリズム解析から位相マップ、ローター ヒストグラム マップ、およびドミナント周波数マップを計算します。
- 必要に応じて、マップ選択のドロップダウンメニューを押し、規則的なリズムが分析 されている場合はアクティベーションマップを選択します。 アクティベーション マップの詳細については、ステップ4.8を参照してください。
- 必要に応じて、マップ選択のドロップダウンメニューを押し、規則的なリズムが解析されている場合は伝導 速度 マップを選択します。
注:伝導速度は、アクティベーションマップから導出されたメトリックです。このメトリクスは、波面が心外膜の各領域を通過するのにかかる時間を表します。CV計算は、心臓表面全体の活性化時間マップの空間勾配に依存しており、速度ベクトルフィールドを適用して効果的な伝播領域を特定します。一様な方向ベクトルを持つ領域は安定した電気的伝搬を示し、一方、角度視差のある領域、つまり非効果的な伝搬を示す領域は、ラジアル基底関数25を用いて補間される。CVは、不整脈の再発率17に関連する基質マッピング中の伝導減速の領域を特定することを可能にする。 - 必要に応じて、マップ選択のドロップダウンメニューを押して、不規則なリズムを分析するときにフェーズマップを選択します。
注:フェーズマップは、活動電位を通じて心筋の定義された領域の進行を経時的に追跡します。このタイプのマップは、心臓電位の進行を表すため、動的です。位相マップでは、ヒルベルト変換を適用して ECGI 信号の位相を計算します。各位相は、信号の各サイクルにわたる活動電位の所与の状態に対応する(静止π、脱分極のπ/2、プラトーの0、再分極の-π)26。 - 必要に応じて、マップ選択のドロップダウンメニューを押して、不規則なリズムを分析するときにローターヒストグラムマップを選択します。
注:Phaseマップから派生したRotor Histogramマップは、Phase特異点の最も頻繁な位置を表したもので、これはリエントラント活動が集中している領域であり、赤で表示されます。簡単に言うと、位相特異点は、位相が-πからπにシフトするキーポイントとして定義され、周囲の位相の段階的な空間的進行を示さないPSは破棄されます。最後に、各ローターのターン数を定量化して、 ローターヒストグラム マップ18を得る。AF中の伝播パターンと再突入を示す特定の領域を特定するアルゴリズムの精度は、心内膜マッピングに対して体系的に評価され、71%の相関が示されています16。 - 必要に応じて、マップ選択のドロップダウンメニューを押して、不規則なリズムを分析するときに ドミナント周波数(DF) マップを選択します。
注:DFマップは、各心臓領域の主要な電気周波数を経時的に表示し、AFのドライバーとして機能する可能性のある急速な電気的活動の領域を特定するのに役立ちます。DFは、ウェルチのピリオドグラム27,28で最も高いパワースペクトル密度を持つ周波数として計算されます。その分析により、心房内の細動活動の安定性が高い領域や変動性のある領域を検出できます。ヒストグラムは、支配的な周波数の時間分布を評価するために使用され、最も関連性の高い電気的活動を明確かつ定量的に表現し、異常な動作を示す領域の特定を容易にします。
結果
症例1-非定型心房粗動のカテーテルアブレーションの計画と指導
この症例は 59 歳の男性 (ボディ マス インデックス -BMI- 30) 患者で、高血圧、喫煙、心臓弁疾患の病歴があり、EHRA IIb 分類、CHA2DS 2-VASc スコアが 1 で、12 誘導心電図に基づく非定型心房粗動 (AFL) によるカテーテル アブレーションの適応があります (図 9A)。患者はカテーテルアブレーションの既往歴がありませんでした。処置前の後期ガドリニウム増強MRI(LGE-MRI)は、左心房(LA)の後壁に広範な線維症を明らかにし、正常なLA面積測定は24cm²で、左心室駆出率(LVEF)は54%に保たれました。
非侵襲的な画像レス ECGI は、カテーテル導入のわずか数分前に大腿骨シースを介して実施されました。QRST複合体を含まないAFLの全サイクル(209 ms)を解析用に選択しました。マッピングにより、僧帽弁(MV)の周囲にマクロリエントラント回路があることが明らかになり、僧帽弁周囲ラインが不整脈終了の最適なアブレーションターゲットとして特定されました(図9B)。これに続いて、接触ベースのEAM(図9C)を実施し、非侵襲的なイメージレスECGIで観察された伝播パターンを確認しました。僧帽周囲線に沿ったアブレーションにより、不整脈は成功裏に終了しました。
この臨床例では、侵襲的なEAMの前に不整脈が正確に特徴付けられ、不整脈の伝播パターンの正確な局在化が可能になり、アブレーション手順が合理化されました。しかし、AFLや限局性頻脈などの複雑な心房頻拍の場合、Imageless ECGIはリアルタイムのシングルビートマッピングを提供するため、持続性のない不整脈の場合に特に価値があります。処置中の不整脈パターンの変化への適応性により、正確でダイナミックなマッピングが保証されます。さらに、反時計回りのAFLの診断は通常、12誘導心電図から簡単ですが、複雑な頻脈性不整脈のメカニズムを正確に特定して特定するのは難しい場合があります。したがって、医療相談または数分前にイメージレスECGIを実施することで、カテーテルアブレーション計画の上流ガイダンスを提供し、不要な経中隔アプローチを排除することにより、手続きの安全性と効率を高めることができます。
症例2 - 持続性心房細動のカテーテルアブレーションにおける相特異点の進化
この症例は、左心室駆出率(LVEF、55%)が保たれ、LAの拡張がなく、ニューヨーク心臓協会(NYHA)の63歳男性患者(BMI31)で、心房細動が持続するためカテーテルアブレーションの適応となりました。処置前のCTまたはMRIイメージングは行われませんでした。患者は、2019 年 12 月に肺静脈隔離 (PVI) のためのカテーテル アブレーションの既往歴がありました。
到着時、患者は心房細動状態にありました。基板マッピングは、アブレーション手順全体を通して画像レスECGIを使用して実施されました(図10A)。ベースラインでは、ECGI は右心房 (RA) 側壁、右心房付属器 (RAA) 基部、左心房後壁 (PW)、および左心房付属器 (LAA) 基部の相特異点を特定しました。これらの知見は、エンドカビタリアンカテーテルを使用して観察された高周波および断片化されたEGMと相関しており、LA EAM再構成によって適切なPVIが確認されました。パルスフィールドアブレーション(PFA)がLAAベースで開始され、AFから非定型AFLへのリズム変化が生じました。画像のないECGIは、冠状静脈洞カテーテルの遠位極からの同調によって確認された僧帽周囲AFLを明らかにしました。僧帽弁線が作成されました。ただし、AFは再誘発されました。その後、完全なPW分離が達成されました。それにもかかわらず、無画像ECGIはRAAベースで有意な位相特異点を特定し続けました。この領域を標的とした複数のPFAアプリケーションにより、洞調律が達成されました(図10B)。
この臨床例は、心房内の電気的活動の変動性が高いため、AFが独自の課題をどのように提示するかを表しています。画像レスECGIは、アブレーション中のAF進行の時空間パターンを効果的にキャプチャし、SRが達成されるまで基質の変更をガイドするために最大3つの非侵襲的マップを取得しました。肺静脈隔離などの標準治療は、再発率が比較的高い29。心房細動治療の主な困難は、(1) PVI のみの恩恵を受ける患者を決定すること、および (2) より広範なアプローチを必要とする患者にとって、アブレーションが最も効果的に不整脈の再発を減らす PVI 領域外の領域を特定することの 2 つの領域にあります。洞調律中、Imageless ECGI は CV マップを生成する能力を実証しており、PVI アブレーションの成功を予測するのに役立つことが証明されています17。しかし、このケースでは、画像レスECGIがAFダイナミクスパターンを同時に捉えたため、臨床医はAFがどのように伝播するかを包括的に把握し、不整脈を引き起こす主要な領域を特定するのに役立ちます。アウトカム分析では、アブレーションされたイメージレス ECGI 検出 AF ドライバーと臨床エンドポイント (長期の不整脈のない生存期間など) との相関関係に焦点を当てて、AF アブレーション戦略の最適化におけるその有用性をさらに検証する必要があります。
症例3 - 心臓再同期療法のための両心室ペーシング最適化の指導
この症例は、非虚血性拡張型心筋症、LVEF が 25% の 67 歳の女性患者であり、処置前 MRI で後期ガドリニウム増強の証拠はなく、ベースライン ECG で左脚ブロック (LBBB) があり、QRS 持続時間が 156 ミリ秒です。患者は、CRT の一部として両心室ペーシング (BiVP) に適応されました。
心臓CRTの処置中、リアルタイムの画像レスECGIを使用して、ペースメーカー埋め込み前後の心室同期を評価しました。ベースラインリズムでは、 図11Aに示されているように、患者の最新の活性化領域が左心室(LV)の基底側壁で特定されました。心室総活性化時間(TAT)は116ミリ秒で測定され、有意な心室非同期性が示されました。ECGI を使用してさまざまなデバイス構成を評価し、最適なセットアップは、LV リードの遠位極と近位極の同時活性化と 140 ミリ秒の房室遅延を使用した BiVP であると決定されました。 図11Bに示すように、3つの心室ペーシングポイントは、遅延活性化領域をもたらさず、同期が成功したことを示し、TATは70ミリ秒に改善されました。
心臓再同期療法は、心不全と長期のQRS患者の心室の電気的協調を回復し、心機能を改善することを目的としています。この場合、Imageless ECGIは、CRT手順中のBiVP最適化を導く上で重要なリアルタイムマッピングを提供しました。これにより、心室活性化パターンの正確な評価が可能になり、最適なデバイス構成を特定するのに役立ち、完全な心室同期が確保されました。ECGIの非侵襲的な性質と即時のフィードバックにより、臨床医はリードプログラミングを洗練することができました。対照的に、研究は、最新の活性化領域30の近くに左心室リードの配置を導くECGIの価値を強調していますが、解剖学的な制約はその適用性を制限する可能性があります。ETGIによって決定される基礎および最終的な再同期パラメータは、TATなど、症状の改善や長期的な心室機能など、CRTに対する患者の臨床反応を経時的にモニタリングすることにより、臨床転帰に関連付ける必要があります。
症例4 - 心臓再同期療法のための伝導系ペーシングインプラントのリアルタイム誘導
この臨床例は、重度の心室機能障害 (LVEF 15%) と QRS 持続時間が 172 ミリ秒の LBBB を持つ 45 歳の女性患者です。患者は、伝導システム (CSP) ペーシング アプローチを使用した植込み型除細動器 CRT に適応されました。
リアルタイムの画像レス ECGI は、デバイスの埋め込み中に利用され、中隔領域での電極ねじ込みのプロセス全体を通じて心室の同期を監視しました。 図12に示すように、ベースラインECGIマップは、LVの側壁を最新の活性化領域として特定し、TATは133ミリ秒でした。電極のねじ込み中の心拍間ECGIマッピングは、心室同期の漸進的な改善を示し、左脚枝に到達すると最適な同期が達成され、95ミリ秒のTATが得られました。
この症例は、CRT処置中にLBBP移植をガイドするリアルタイムイメージレスECGIの可能性を示しました。そのシングルビートのリアルタイムマッピング機能により、心室TATの解析と、中隔領域へのリード移植の各ステップでの再同期が可能になりました。このシステムは、高速で視覚的、かつ解釈しやすい指標を提供し、心電図CSP基準の標準化の欠如に対処しました。BiVP-CRT手順と同様に、Imageless ECGIパラメータが臨床CRT応答と有意に相関しているかどうか、およびそれらが12誘導ECG予測因子とどのように比較されるかを判断するには、さらなる研究が必要です。
症例5 - 心室頻拍のカテーテルアブレーションの計画と指導
この症例は、虚血性心筋症、重度の心室機能障害 (LVEF 15%)、および NYHA クラス II を合併した 53 歳の男性患者 (BMI 25.4) で、再発性 VT によりカテーテル アブレーション手順に紹介されました。術前MRIでは、左心室の下基底部および下内側セグメントに局在する広範な心内膜線維症および不整脈原性チャネルが明らかになった。患者は 2018 年に VT カテーテル アブレーションの既往歴がありました。
同時画像レスECGIマッピング(図13A)と侵襲的EAM(図13B)が手順全体で実行されました。カテーテルアブレーションプロセスには、右心室(RV)の頂端ペーシング中の基質ベースのマッピングと、プログラムされた刺激を使用したVT誘導が含まれていました。画像のない ECGI は、カテーテル導入前の洞調律マッピング中に、左室の下基底部で伝導が遅くなる領域を特定しました。この所見は、MRIで観察された線維症と一致していました。その後の右心室(RV)頂点からのペーシングにより、LVの基底部と内側部での伝導が遅くなることが確認され、この領域が不整脈原性の可能性が高い基質であることが特定されました。サイクル長が380ミリ秒のVTが短時間誘導され、血行動態が不安定なため除細動が必要でした。その結果、獲得できたEAMポイントは限られていました。しかし、単一のVTサイクルを使用して、画像レスECGIは、ペーシングマップで等時性の混雑が観察されたのと同じ領域でVT峡部を成功裏に特定しました。
このVT症例でのリアルタイム画像レスECGIの使用は、VT管理における2つの主要な臨床的課題、すなわち(1)洞調律中の潜在的なアブレーションターゲットの正確な局在化、および(2)血行動態が不安定なVTの特性評価にうまく対処しました。1回の拍動から、VT峡部は基質活性化マップと不整脈活性化マップの両方で正確に同定されました。このシステムにより、オペレーターはアブレーション前またはアブレーション中に不整脈原性基質を特定し、1サイクルからリアルタイムで複数の誘導性VTを特徴付けすることができました。

図1:イメージレスECGIハードウェアコンポーネント (A)特定のケーブル接続ポートを備えたバイポテンシャルアンプ。(B)左右のケーブル、一方の端にアンプコネクタ、もう一方の端にセンサーベストソケットコネクタを装備。(C)バイポテンシャルアンプに接続された左右のケーブルを示す構成。(D)センサーベストをケーブルソケットに接続する手順の概略ワークフロー。 この図の拡大版を表示するには、ここをクリックしてください。

図2:3D胴体再構成スキャナーの手順(A)4つのコンポーネント(Front-Right、Front-Left、Back-Right、Back-Left)で構成される128誘導体表面電位センサーベストは、3D再構成の前に患者の胴体に配置されます。各電極には、自動識別用の一意のQRコードがあります。電極間の接続部は、ベストを患者の体型に合わせて折りたたむことができます。(B)フロントライトコンポーネントのQRコードがベストを検証し、3Dスキャナーアプリケーションが胴体の再構築を開始できるようにします。(C)3Dスキャナープラットフォームでは、3Dスキャナーアプリケーションを介して、赤外線構造化光カメラを使用して再構築された胴体を生成します。略語:FR:フロントライト。FL:左前;BR:右奥;およびBL:左奥。この図の拡大版を表示するには、ここをクリックしてください。
図3:ソフトウェアアクセスに指定されたユーザー名とパスワードが必要な画像なしECGIユーザーインターフェースのログイン画面。 この図の拡大版を表示するには、ここをクリックしてください。
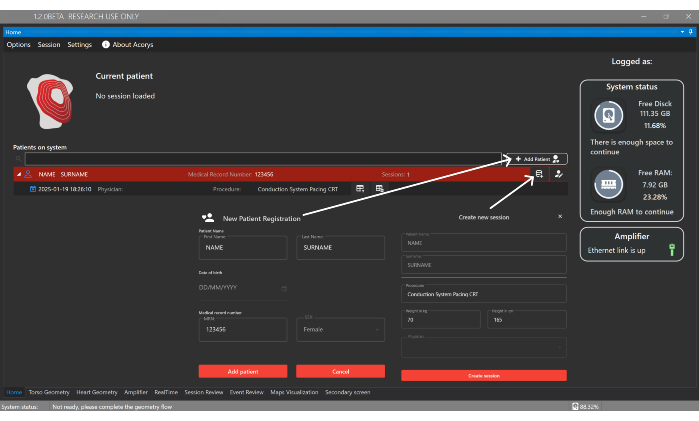
図4:ホームウィンドウ。[ホーム] ウィンドウでは、患者、医師、ユーザーの管理、および患者セッションの構成を行うことができます。また、インポートされたセッションと、システムとアンプのステータスに関する情報も表示されます。この図の拡大版を表示するには、ここをクリックしてください。
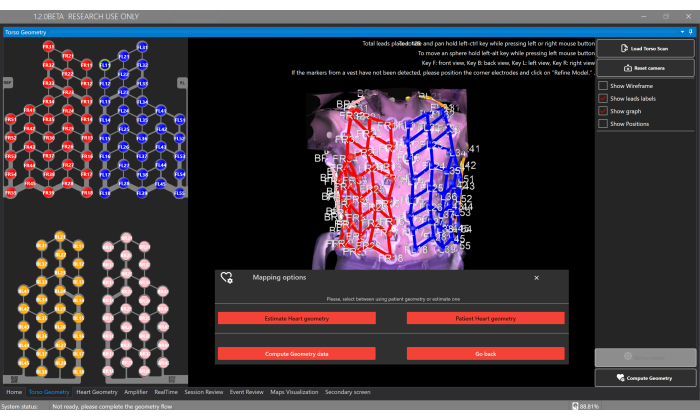
図5:胴体ジオメトリウィンドウ。「Torso Geometry」ウィンドウでは、3D胴体モデルのアップロードと表示、電極のセグメント化、Compute Geometryボタンによる心臓形状のタイプの選択が可能で、これにより推定を行ったり、パーソナライズされたCT/MRIからのセグメンテーションを提供したりすることができます。この図の拡大版を表示するには、ここをクリックしてください。
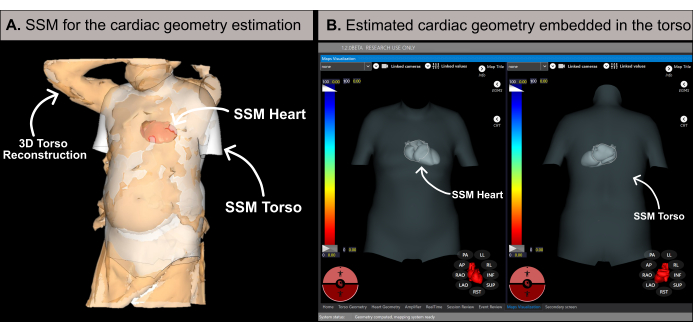
図6:心臓形状推定 (A) 基礎特徴と患者の3D胴体再構成を利用したSSMアルゴリズムにより、心臓形状を推定します。(B)胴体のSSM内の推定心臓形状で、前後(左側)および後前後(右側)のビューが表示されます。略語:3D:立体的。SSM: 統計形状モデル。 この図の拡大版を表示するには、ここをクリックしてください。
図7:アンプウィンドウ。 Amplifierウィンドウを使用すると、Sensor Vestの各電極から取得されている信号をリアルタイムで視覚化できます。この図の拡大版を表示するには、ここをクリックしてください。

図8:リアルタイムウィンドウ(A)高密度電極アレイベストからのアクティブリード線の概略図。緑の電極には良質の信号が含まれていますが、赤い電極にはノイズの多い信号が含まれており、逆問題の計算には関与しません。(B)心電図の12リード線をリアルタイムで推定します。(C)QRSコンプレックス(緑色のウィンドウ)の開始とオフセットの自動トリガーと描写。マッピング計算に参加しているすべてのリードの平均信号は青色で示されています。(D) マップの視覚化セクションは、単一、二重、または 4 つのマップ ビューをサポートします。この例では、CRT プロシージャ中の基底分岐ペーシング (最終マップ) 状態の活性化マップを含むデュアルマッピング ビューを示しています。基礎マップはフリーズ モードになり、静的なままですが、最終的なマップは更新モードになり、新しく分析された QRS コンプレックスごとに再計算されます。この図の拡大版を表示するには、ここをクリックしてください。
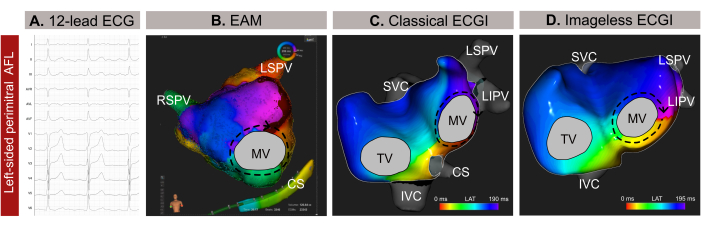
図9:左側非定型AFLのグラフ例と、12誘導心電図、画像レス心電図、および侵襲的EAMのさまざまな診断能力 。(A) 非定型 AFL の 12 誘導心電図信号は、V1 で正の上室波を示します。(B)SSMから推定された心臓形状を使用し、前後図を表示する画像なしECGI。伝搬回路は、僧帽周囲AFLの典型的なパターンであるMVの周囲のすべての色を示します。(C)EAMに由来する局所活性化マッピングと前後図の表示は、MVの周りのマクロ再突入を示し、Imageless ECGIからの診断を確認します。略語:ECG:心電図;EAM:電気解剖学的マッピング;ECGI:心電図イメージング。SVC:上大静脈;IVC:下大静脈;CS:冠状静脈洞;LSPV:左上肺静脈;RIPV:右下肺静脈;RSPV:右上肺静脈。 この図の拡大版を表示するには、ここをクリックしてください。
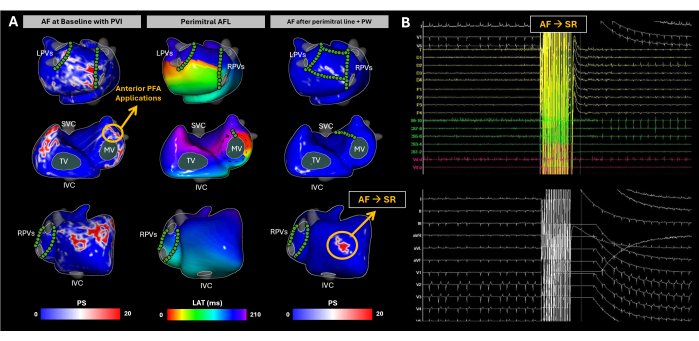
図 10: 非侵襲的な画像レス ECGI マッピングを使用した AF カテーテル アブレーション中の心房基質の進化の追跡 (A) 画像レス ECGI の前後、前後、および右側面図、PFA 部位は緑の円でマークされています。ベースライン PS マップは、RA 側壁、RAA ベース、LA 後壁、および LAA ベース内の再エントリを強調表示します。LAAベースのPFAは、リズムを僧帽側AFLに移行しました。僧帽弁ラインと後壁の分離が完了したにもかかわらず、心房細動は再び自発的に誘発されました。ECGIは、アブレーションターゲットとなったRAAベースでPSを明らかにしました。その領域で複数のPFA適用が行われ、洞調律が回復しました。(B)AFがSRに変化した瞬間の12誘導心電図および心臓内信号。略語:SVC:上大静脈;IVC:下大静脈;LPV:左肺静脈;RPV:右肺静脈;AF:心房細動、SR:洞調律、PS:位相特異点、LAT:局所活性化時間、TV:三尖弁、MV:僧帽弁、PVI:肺静脈隔離、AFL:心房粗動、PW:後壁、PFA:パルスフィールドアブレーション。 この図の拡大版を表示するには、ここをクリックしてください。
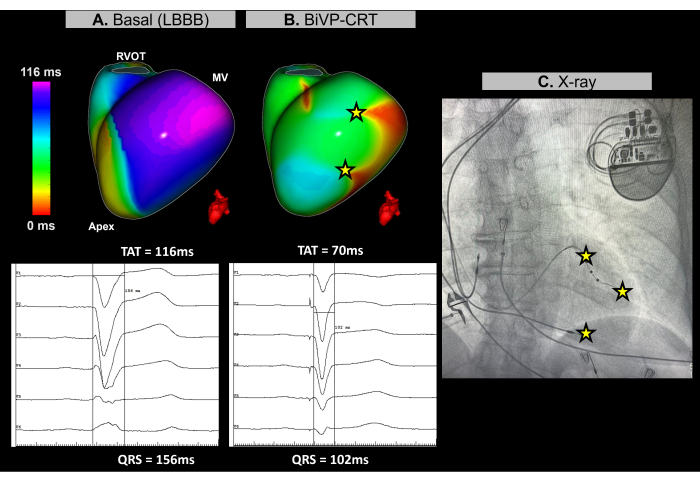
図11:Imageless ECGIを使用した両心室ペーシングの最適化(A)患者のベースラインリズム。Imageless ECGI マップ (左側面図) は、LV の側壁に遅延活性化領域 (紫色) が明らかになり、TAT は 116 ミリ秒で、心室同期障害を示しています。これは、LBBBパターンで広いQRS群(156 ms)を示すベースラインECGと一致します。(B)ペースメーカー移植後の構成。左室リードの遠位極と近位極の同時活性化と 140 ミリ秒の房室遅延を伴う BiVP に続いて、イメージレス ECGI マップは遅延活性化領域 (紫色の領域なし) を示し、同期心室活性化と 70 ミリ秒の TAT の減少を示しています。これは、QRS持続時間が102ミリ秒に減少する最終ECGで観察されたQRS群の短縮と一致しています。LVリードの遠位極と近位極の両方のペーシング活動は、ECGIマップにも反映されます。略語: LBBB: 左脚ブロック、BiVP: 両心室ペーシング、CRT: 心臓再同期療法、RVOT: 右心室流出路、MV: 僧帽弁、TAT: 総活性化時間。この図の拡大版を表示するには、ここをクリックしてください。
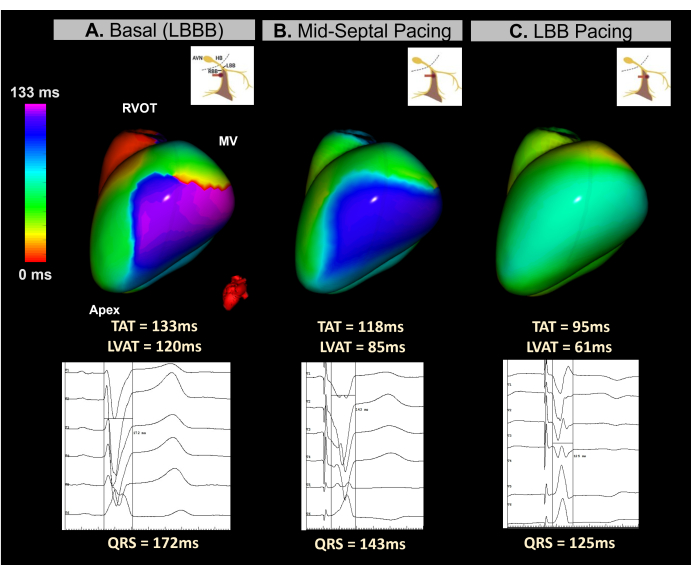
図12:画像レスECGIを使用した伝導システムペーシングによるCRTの非侵襲的評価。ECGI マップ(左側面図)は、左室の外側壁に活性化遅延領域(紫色)を示しており、TATは133ミリ秒で、心室同期障害を示唆しています。これは、LBBB に典型的な広い QRS プレックス (172 ミリ秒) を示すベースライン ECG に対応します。(B)LBBPリードの移植中の中間期(中隔ペーシング)。非侵襲的マップは、LVの遅延領域の部分的な補正を示しており、色が紫から青にシフトしています。これにより、QRS 複素数の持続時間が短縮されます。(C)ねじ込みプロセス中のLBBPリードの最終位置。このマップは、遅延領域の完全な補正を示しており、色が紫から緑に変化し、両心室の同期活性化を示しています。略語:LBBB:左脚枝ブロック、LBB:左脚枝、RVOT:右心室流出路、MV:僧帽弁、TAT:総活性化時間。この図の拡大版を表示するには、ここをクリックしてください。
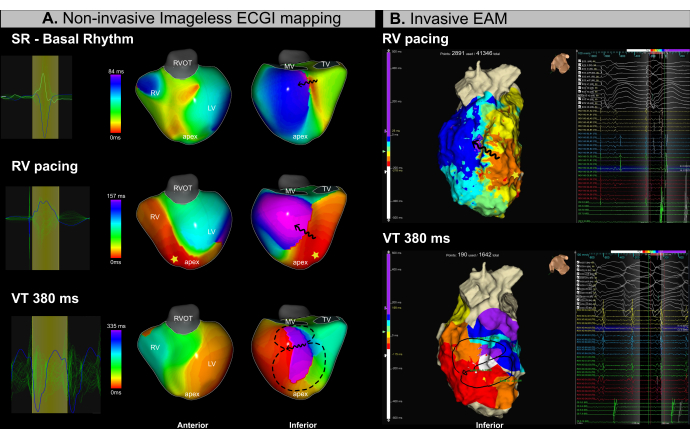
図13:画像レスECGIを使用したVT峡部の非侵襲的評価 (A)VTアブレーション手順中の画像レスECGIマッピングは、LVの下基底領域と下内側領域の不整脈原性基質とVT峡部を特定します。最初の行は洞調律に対応し、中央の行はRVアピカルペーシングに対応し、下の行はVTに対応します。(B)VTアブレーション手順中に得られた侵襲性EAMは、ECGIによって識別された同じ領域における等時性活性化マッピングを示しています。上の行は RV の頂端ペーシングに対応し、下の行は VT を表します。略語:RV:右心室、LV:左心室、SR:洞調律、RVOT:右心室流出路、MV:僧帽弁、TV:三尖弁。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
この方法論的説明は、CTやMRIなどの処置前の心臓画像を必要とせずに、カテーテルアブレーションやCRTなどのさまざまな電気生理学的手順をサポートできる、非侵襲的、シングルビート、およびリアルタイムECGIアプローチの臨床的有用性を強調しています15,17,31,32このレポートでは、Imageless ECGIは、その臨床採用を促進する可能性のある主要な技術的特徴を示しています。ECGIは、広範囲にわたる不整脈19,33,34,35,36にわたる心臓マッピングのための強力なツールであることがすでに証明されていますが、いくつかの臨床的および技術的な課題13,14に引き続き直面しています。
従来のECGIシステムでは、心臓マッピングと同じ日にCTスキャンが必要であり、ECGI電極は9,10,12,37,38に配置されています。このアプローチでは、CTスキャンのセグメンテーション(心臓と電極)が必要なため、余分な時間が追加され、最初のECGIマップの生成が約1〜3時間遅れます。対照的に、このレポートで紹介されている画像レスECGIシステムは、高密度アレイ電極を備えた胸部の赤外線3Dスキャンを利用しており、これは処置のわずか数分前または医療相談中に実行できます15,17。このシステムは、胸部電極を自動的にセグメント化し、患者の心臓形状を推定することで、非侵襲的な心臓マッピングプロセスを合理化し、患者の到着から最初のECGIマップが利用可能になるまでの時間を大幅に短縮します。画像レス ECGI アプローチの以前の検証では、推定された心臓ジオメトリを使用すると、エラーが最小限に抑えられ、非侵襲的マップの精度が維持されることが示されています。心房細動の患者では、推定された心臓の形状と実際の心臓の形状から得られたECGI信号との間に強い相関が観察されました。幾何学的な並進があっても15。複雑性心房頻拍などの通常の不整脈については、EAMとの比較により、関与する心腔の特定、メカニズム(焦点またはリエントラント)の決定、およびアブレーションターゲットの推論において高い精度が示された31。VTの場合、そのアプローチは、洞調律(SR)39中にVT峡部の領域にオペレーターを誘導するために評価されており、これは一次予防においてVTのリスクがある患者を特定する可能性を示しています。さらに、冠状動脈洞のペーシング中、特に早期および後期の活性化部位40において、画像のないECGIとEAMの活性化マップとの間の強い地域的一致が観察された。
CRTでは、12誘導心電図のリアルタイムの形態学的変化は、通常、リード移植中の再同期を確認するために使用されます。特に、LBB領域に到達するまで中隔リード留置のさまざまな段階で心電図が評価されるCSP手順ではそうです。しかし、公表されているECGアルゴリズムはしばしば複雑で、それらの間に大きな違いを示し、場合によっては臨床診療での実装が困難である41,42,43。おそらくこの複雑さのために、左脚枝ペーシング (LBBP) の特定の心電図パラメーターは一貫して特定されていません 患者が心臓の再同期に反応するかどうかを確実に予測できます。リアルタイムの画像レスECGIアプローチは、リード移植全体を通じてシンプルで詳細なビートごとのマッピングを提供し、CRT適応症32またはAVブロック44の患者で示されているように、左心室活性化時間などのパラメータを評価することにより、同期性修正を評価します。したがって、さらなる調査により、リアルタイムのECGIパラメータは、オペレーターがリード移植位置を最適化したり、CRTに対する患者の反応を予測したりする際の指針となる可能性があります。
この方法論レポートでは、リアルタイムの画像レスECGIの可能性が示されていますが、不整脈シミュレーションを使用した他の新しい非侵襲的マッピングアプローチも、処置前のイメージングの必要性を排除することを目的としています。Vectorcardiographic Mapping of Arrhythmogenic Probability (VMAP) 研究は、心室性不整脈部位45 のピンポイントで有意な地域精度を示し、非 PVI アブレーション46 を超えた AF ドライバーの位置を特定することに有望であることを示しています。VMAPは、12誘導心電図と複数の計算モデルを組み合わせて使用し、患者固有の幾何学的データに頼ることなく不整脈のターゲットを特定します。ただし、このアプローチは、表面心電図上の高周波成分が不整脈ドライバーを非侵襲的に特定するために重要であるAFのような心房性不整脈には最適ではない可能性があります。これらの成分は、典型的には、後面および前外側表面27上の電極によって捕捉され、これは臨床診療で使用される標準的な12誘導心電図では表されない。
さらなる臨床研究が必要であるにもかかわらず、リアルタイムの画像レスECGIは、広範囲の不整脈にわたる非侵襲的な心臓マッピングのための貴重なツールになる可能性を秘めています。その方法論のシンプルさと病院環境での患者ワークフローの合理化により、臨床医はより多くの臨床データを収集できるようになり、患者の転帰と将来の技術進歩の両方を改善することができます。結論として、非侵襲的心臓マッピングの未来は、完全に画像レスなアプローチに向けて前進し、日常的な診察から電気生理学的処置中のリアルタイムマッピングまで、日常の臨床診療への迅速かつスムーズな統合を可能にすることにあります。
開示事項
JRP、BPS、JSC、IHR、RM、CF、EZ、JM、DL、FA、MSG、およびAMCはCorify Care SLから名誉賞を受賞しました。AMC、MSG、FAはCorify Care SLの共同創設者であり、JRP、BPS、JSC、IHR、JM、DL、JBG、FA、LM、MSG、AMCは株主です。TFAは、Biosense-Webster社から研究助成金を受けています。IRLは、アボットとバイオセンス・ウェブスターから講師およびコンサルタントとして謝礼を受けています。APS Bisosense-Webster、Abbott、およびBoston-Scientificから講演者およびコンサルタントの謝礼を受けています。JMTは、アボット、ボストン・サイエンティフィック、メドトロニックから講師およびコンサルタントとして謝礼を受けています。EAは、Biosense-WebsterとBayerから講演者およびコンサルタントの謝礼を受けています。LMは、Boston-Scientific、Abbott、Johnson&Johnson、Medtronicのコンサルタント、講師、諮問委員会として謝礼を受けており、Galgo Medical SLの株主でもあります。JBGは、Microport CRMとAbbottからのコンサルタントおよび講演者としての謝礼に加えて、Abbottからのフェローシップに対する無制限の助成金支援も報告しています。MPLは、メドトロニックから講演者謝礼を受けました。
謝辞
この研究は、助成金契約SAVE-COR No 220385に基づく欧州イノベーション技術研究所(EIT)と、バレンシア州政府(EFICACIA)の資金提供を受けた助成金CIAICO/2022/020から資金提供を受けました。追加の支援は、Generalitat Valenciana (grant CIAPOS/2021/238, ACIF/2021/205, CIBEFP/2022/9), MCIN/AEI/10.13039/501100011033 and ESF Investing in Your Future (grant RYC2018-024346-I), Instituto de Salud Carlos III (grant CIBERCV16 CB16/11/00354), and Catalonia, Spain (grant 2021_SGR_01350, SGR21/GENCAT) から寄せられました。また、CERCAプログラム/カタルーニャ州政府からの支援も認めています。MPL は、リオ オルテガの契約 CM22/00107 [Instituto de Salud Carlos III (ISCIII);フォンドソーシャルヨーロッパ(FSE)]。著者は、秘書としてのサポートを提供してくれたNeus PortellaとSheila Marcoに感謝し、Hospital Clínic de Barcelona、Hospital General Universitario Gregorio Marañón、Hospital Universitari i Politècnic La Feでの臨床サポートを提供してくれた医療チームと看護チームに感謝します。また、スペインのマドリードにあるCorify Care SLのAlmudena Albertos氏とバレンシア工科大学のArantxa Carrasco氏にも感謝しています。
資料
| Name | Company | Catalog Number | Comments |
| ACORYS Mapping System | Corify Care SL | ACORYS | Imageless ECGI system |
| ACORYS 3D Scan Software | Corify Care SL | ACSCAN | 3D scanner app |
| ACORYS Amplifier | Corify Care SL | ACAMP | Biopotential amplifier |
| ACORYS Sensor Vest | Corify Care SL | ACSEN | Sensor vest, 4 components (Front Right, Front Left, Back Right and Back Left) |
| ACORYS Software | Corify Care SL | ACSOF, version 1.2 | Imageless ECGI software |
| Affera mapping system | Medtronic | AFR-00003 | |
| CADENCE Adult mulifuntion defibrillation electrodes | Cardinal Health | 22660R | |
| Catheter extension cable | Medtronic | AFR-00006 | |
| Desktop or portable PC workstation | Any | Windows 11 as the operating system | Imageless ECGI workstation. The processor must be at least an Intel i7 from the 2020 generation or newer. It requires a minimum of 32 GB of RAM and 500 GB of SSD storage. Additionally, a compatible version of .NET Framework must be installed. An internet connection is not required. |
| Dynamic XT 10E 2 5 2 MM Diagnostic Catheter | Boston Scientific | M0042011010 | |
| EP-TRACER 2 ProCart | Cardiotek | The system includes several components provided by the company | |
| External Defibrillator Monitor | PHILLIPS | Efficia DFM100 | |
| Fentanyl | Kern pharma | 1004000143-03 | |
| Heparine | Reig Jofre | 608737.4 O | |
| HexaFlow irrigation pump | Medtronic | AFR-00005 | |
| HexaGen RF generator | Medtronic | AFR-00004 | |
| HexaPulse PF generator | Medtronic | AFR-00008 | |
| INTELLAMAP ORIO Mapping Catheter | Boston Scientific | M004RC64S0 | |
| IntellaNav StablePoint Ablation Catheter | Boston Scientific | M004ERFSDS96200 | |
| iPad mini | Apple | 6th generation A2567 | 3D scanner platform |
| iPadOS | Apple | 15.3 or superior | 3D scanner platform |
| Isolated Ethernet Cable | Corify Care SL | ACNET | Ethernet cable |
| Isoprenaline | Reig Jofre | 7227007 | |
| Left Connector Cable | Corify Care SL | ACCAB_L | Left cables |
| Location Reference Patch Kit | Boston Scientific | M004RAPATCH20 | |
| Location reference patch kit | Medtronic | AFR-00007 | |
| MetriQ Tubing Set | Boston Scientific | M0041170 | |
| Midazolam | Normon | X5XF1 | |
| Physiological Saline Solution for Irrigation | Fabrenius Kabi | br14801 | |
| Propofol | B Braun | 855437.9 OH | |
| Remifentanil | Kern pharma | 672786.7 | |
| RHYTHMIA HD | Boston Scientific | M004 RBINSTALL2ROW0 | |
| Right Connector Cable | Corify Care SL | ACCAB_R | Right cables |
| Single Patient Use ECG Electrodes | Ambu | M-00-S | |
| Sphere-9 mapping and ablation catheter | Medtronic | AFR-00001 | |
| Structure SDK | Structure | 2.2.1 for iOS or superior | 3D scanner platform, infrared structured light camera |
| Structure Sensor Pro | Structure | ST02B. Firmware version 1.2 or superior | 3D scanner platform, infrared structured light camera |
| Sugamadex Teva | Normon | 7340157-OH | |
| Tubing set | Medtronic | AFR-00002 | |
| WorkMate Claris System | Abbott | H700123 | |
| X-Ray C-Arm | Phillips | The system includes several components provided by the company |
参考文献
- Narayan, S. M., John, R. M. Advanced electroanatomic mapping: current and emerging approaches. Curr Treat Options Cardiovasc Med. 26 (4), 69-91 (2024).
- Raiman, M., Tung, R. Automated isochronal late activation mapping to identify deceleration zones: rationale and methodology of a practical electroanatomic mapping approach for ventricular tachycardia ablation. Comput Biol Med. 102, 336-340 (2018).
- Guichard, J.-B. et al. Substrate mapping for ventricular tachycardia ablation through high-density whole-chamber double extra stimuli. JACC Clin Electrophysiol. 10 (7), 1534-1547 (2024).
- Takigawa, M. et al. Are wall thickness channels defined by computed tomography predictive of isthmuses of postinfarction ventricular tachycardia. Heart Rhythm. 16 (11), 1661-1668 (2019).
- Vázquez-Calvo, S. et al. Noninvasive detection of slow conduction with cardiac magnetic resonance imaging for ventricular tachycardia ablation. Europace. 26 (2), euae025 (2024).
- Sánchez-Somonte, P. et al. Scar channels in cardiac magnetic resonance to predict appropriate therapies in primary prevention. Heart Rhythm. 18 (8), 1336-1343 (2021).
- Roca-Luque, I. et al. Post-ablation cardiac magnetic resonance to assess ventricular tachycardia recurrence (PAM-VT study). Eur Heart J Cardiovasc Imaging. 25 (2), 188-198 (2023).
- Roca-Luque, I. et al. Ventricular scar channel entrances identified by new wideband cardiac magnetic resonance sequence to guide ventricular tachycardia ablation in patients with cardiac defibrillators. Europace. 22 (4), 598-606 (2020).
- Rudy, Y., Burnes, J. E. Noninvasive electrocardiographic imaging. Ann Noninvasive Electrocardiol. 4 (3), 340-359 (1999).
- Haissaguerre, M. et al. Noninvasive panoramic mapping of human atrial fibrillation mechanisms: a feasibility report. J Cardiovasc Electrophysiol. 24 (6), 711-717 (2013).
- Tsyganov, A. et al. Mapping of ventricular arrhythmias using a novel noninvasive epicardial and endocardial electrophysiology system. J Electrocardiol. 51 (1), 92-98 (2018).
- Pereira, H., Niederer, S., Rinaldi, C. A. Electrocardiographic imaging for cardiac arrhythmias and resynchronization therapy. Europace. 22 (10), 1447-1462 (2020).
- Duchateau, J. et al. Performance and limitations of noninvasive cardiac activation mapping. Heart Rhythm. 16 (3), 435-442 (2019).
- Cluitmans, M. et al. Validation and opportunities of electrocardiographic imaging: from technical achievements to clinical applications. Front Physiol. 9, 1305 (2018).
- Molero, R., González-Ascaso, A., Climent, A. M., Guillem, M. S. Robustness of imageless electrocardiographic imaging against uncertainty in atrial morphology and location. J Electrocardiol. 77, 58-61 (2023).
- Rodrigo, M. et al. Noninvasive assessment of complexity of atrial fibrillation: correlation with contact mapping and impact of ablation. Circ Arrhythm Electrophysiol. 13 (3), e007700 (2020).
- Invers-Rubio, E. et al. Regional conduction velocities determined by noninvasive mapping are associated with arrhythmia-free survival after atrial fibrillation ablation. Heart Rhythm. 21 (9), 1570-1580 (2024).
- Fambuena-Santos, C. et al. AF driver detection in pulmonary vein area by electrocardiographic imaging: relation with a favorable outcome of pulmonary vein isolation. Front Physiol. 14, 1057700 (2023).
- San Antonio, R. et al. Optimized single-point left ventricular pacing leads to improved resynchronization compared with multipoint pacing. Pacing Clin Electrophysiol. 44 (3), 519-527 (2021).
- Zacur, E. et al. MRI-Based Heart and Torso Personalization for Computer Modeling and Simulation of Cardiac Electrophysiology. Imaging for Patient-Customized Simulations and Systems for Point-of-Care Ultrasound. 10549, Springer, Cham (2017).
- Bell, J. B., Tikhonov, A. N., Arsenin, V. Y. Solutions of ill-posed problems. Math Comput. 32 (144), 1320 (1978).
- Oster, H. S., Taccardi, B., Lux, R. L., Ershler, P. R., Rudy, Y. Electrocardiographic imaging: noninvasive characterization of intramural myocardial activation from inverse-reconstructed epicardial potentials and electrograms. Circulation. 97 (15), 1496-1507 (1998).
- Figuera, C. et al. Regularization techniques for ECG imaging during atrial fibrillation: a computational study. Front Physiol. 7, 466 (2016).
- Molero, R. et al. Improving electrocardiographic imaging solutions: a comprehensive study on regularization parameter selection in L-curve optimization in the atria. Comput Biol Med. 182, 109141 (2024).
- Hernández-Romero, I. et al. Local conduction velocity estimation during wavefront collisions and reentrant scenarios. 2022 Computing in Cardiology (CinC). Tampere, Finland (2022).
- Rodrigo, M. et al. Technical considerations on phase mapping for identification of atrial reentrant activity in direct- and inverse-computed electrograms. Circ Arrhythm Electrophysiol. 10 (9), e005008 (2017).
- Guillem, M. S. et al. Noninvasive localization of maximal frequency sites of atrial fibrillation by body surface potential mapping. Circ Arrhythm Electrophysiol. 6 (2), 294-301 (2013).
- Pedrón-Torrecilla, J. et al. Noninvasive estimation of epicardial dominant high-frequency regions during atrial fibrillation. J Cardiovasc Electrophysiol. 27 (4), 435-442 (2016).
- Tzeis, S. 2024 European Heart Rhythm Association/Heart Rhythm Society/Asia Pacific Heart Rhythm Society/Latin American Heart Rhythm Society expert consensus statement on catheter and surgical ablation of atrial fibrillation. Europace. 26 (4), euae043 (2024).
- Parreira, L. et al. Noninvasive three-dimensional electrical activation mapping to predict cardiac resynchronization therapy response: site of latest left ventricular activation relative to pacing site. Europace. 25 (4), 1458-1466 (2023).
- Reventos-Presmanes, J. et al. Noninvasive electrocardiographic imaging for the characterization of complex atrial tachyarrhythmias. Europace. 25 (Supplement_1), euad122.229 (2023).
- Regany, M. et al. ECG imaging as a real time tool to guide left bundle branch pacing implant in patients with left bundle branch block and resynchronization therapy indication. Europace. 26 (Supplement_1), euae102.491 (2024).
- Rudy, Y. Noninvasive electrocardiographic imaging of arrhythmogenic substrates in humans. Circ Res. 112 (5), 863-874 (2013).
- Shah, A. J. et al. Validation of novel 3-dimensional electrocardiographic mapping of atrial tachycardias by invasive mapping and ablation. J Am Coll Cardiol. 62 (10), 889-897 (2013).
- Graham, A. J. et al. Evaluation of ECG imaging to map hemodynamically stable and unstable ventricular arrhythmias. Circ Arrhythm Electrophysiol. 13 (2), e007377 (2020).
- Pujol-Lopez, M. et al. Conduction system pacing vs biventricular pacing in heart failure and wide QRS patients. JACC Clin Electrophysiol. 8 (11), 1431-1445 (2022).
- Rudy, Y., Lindsay, B. D. Electrocardiographic imaging of heart rhythm disorders. Cardiac Electrophysiol Clin. 7 (1), 17-35 (2015).
- Haissaguerre, M. et al. Driver domains in persistent atrial fibrillation. Circulation. 130 (7), 530-538 (2014).
- Reventos-Presmanes, J. et al. Noninvasive assessment of the ventricular tachycardia isthmus during sinus rhythm. Europace. 26 (Supplement_1), euae102.687 (2024).
- Ros, S. et al. Imageless electrocardiographic imaging for atrial electrophysiological characterization: a validation study. Europace. 26 (Supplement_1), euae102.690 (2024).
- Wu, S. et al. Left bundle branch pacing for cardiac resynchronization therapy: nonrandomized on-treatment comparison with his bundle pacing and biventricular pacing. Can J Cardiol. 37 (2), 319-328 (2021).
- Pujol-López, M. et al. Stepwise application of ECG and electrogram-based criteria to ensure electrical resynchronization with left bundle branch pacing. Europace. 25 (6), euad128 (2023).
- Zhu, K., Chang, D., Li, Q. Which is more likely to achieve cardiac synchronization: left bundle branch pacing or left ventricular septal pacing. Front Cardiovasc Med. 9, 845312 (2022).
- Martinez-Perez, M. et al. Real-time assessment of LV synchrony in AV block population undergoing LBB pacing using ECG imaging. Europace. 26 (Supplement_1), euae102.487 (2024).
- Krummen, D. E. et al. Forward-solution noninvasive computational arrhythmia mapping: the VMAP study. Circ Arrhythm Electrophysiol. 15 (9) (2022).
- Gu, K. et al. Ablation of non-pulmonary vein atrial fibrillation drivers identified by vMap in addition to pulmonary vein isolation improves procedural outcomes. 29th annual AF Symposium 2024. https://cdn.prod.website-files.com/60f9aad2cca70843f8fa048e/660b432d93bbdc
942469cc1e_AF%20Symposium%202024%20-%20PVI%20Outcomes.pdf (2024).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved