Method Article
Noninvasive Imageless Electrocardiographic Imaging System을 사용한 실시간 심장 매핑
요약
이 연구는 비침습적 무영상 심전도 이미징 시스템을 사용하여 실시간 심장 매핑을 위한 새로운 접근 방식을 소개합니다. 이 시스템을 사용하면 시술 전 컴퓨터 단층 촬영 또는 자기 공명 영상 스캔 없이 전기 생리학적 심장 지도를 획득할 수 있으므로 절제 및 심장 재동기화 요법 임플란트와 같은 심장 시술에 대한 효율적인 안내를 할 수 있습니다.
초록
빠르고 안전하며 효과적인 심장 매핑은 복합 부정맥 관리에 매우 중요하지만 현재 방법은 상당한 한계에 직면해 있습니다. 12리드 심전도(ECG)는 초기 진단에 필수적이지만 카테터 절제 또는 심장 재동기화 치료 장치 이식과 같은 고급 절차를 안내하는 데 필요한 공간 해상도와 깊이가 부족합니다. 반면, 침습적 매핑 기술은 상세한 전기 활동을 제공하지만 여러 카테터 배치가 필요하므로 절차적 위험과 복잡성이 증가합니다. 이러한 방법은 시간과 비용이 많이 들며 특히 심방세동(AF), 불안정 부정맥 및 심장 재동기화 요법(CRT)과 같은 동적 부정맥에서 제한된 실시간 평가를 제공합니다.
이 연구는 실시간 박동 간 심장 지도를 제공하여 기존 방법을 보완하도록 설계된 비침습적 무영상 심전도 영상(Imageless-ECGI) 시스템을 소개합니다. 사전 시술 이미징이 필요하지 않은 이 시스템은 심장 전체에 걸쳐 고해상도 전기 활동을 캡처하여 침습적 매핑에 대한 보다 안전하고 효율적인 대안을 제공합니다. Imageless-ECGI 시스템은 표면 기록의 즉각성과 최신 계산 모델의 공간 정확도를 결합하여 기존 ECG와 침습적 매핑 간의 격차를 해소하여 전기 생리학 실험실의 작업 흐름을 잠재적으로 변화시킬 수 있습니다.
서문
비침습적 전기생리학적 매핑의 필요성은 특히 심방세동(AF) 및 심실빈맥(VT) 절제술과 같은 복잡한 부정맥 시술을 받는 환자나 심박 조율기 및 심장 재동기화 요법(CRT) 장치 이식 중에 심장 활동을 정확하게 평가하기 위해 점점 더 중요해지고 있습니다. 현재 3차원(3D) 해부학 매핑(EAM)은 부정맥 2,3을 특성화하기 위한 포괄적인 기능 맵을 제공함으로써 카테터 절제1 동안 작업자를 안내하는 황금 표준으로 남아 있습니다. 그러나 EAM은 AF의 동적 시공간 패턴, 비지속 부정맥을 캡처하는 데 차선책이며, 매핑에 필요한 장시간 및 침습적 절차로 인해 CRT 절차에 사용하기가 실용적이지 않습니다.
12리드 심전도(ECG)와 같은 기존의 비침습적 방법은 특정 부정맥 병소(예: 유출로 또는 교두 VT)를 식별하는 데 매우 정확하지만 심장의 전반적인 전기적 거동에 대한 통찰력은 제한적입니다. 이러한 한계는 성공적인 결과를 위해 부정맥 영역의 정확한 위치 파악이 중요한 동적 및 복잡한 부정맥에 대한 개입을 안내하기 위해 실시간 매핑이 필요한 경우에 특히 분명합니다. 비침습적 매핑은 사전 시술 계획을 강화하고 전기생리학적 개입 중에 실시간 피드백을 제공하는 데 중요한 역할을 할 수 있습니다.
전기생리학자의 사전 시술을 지원하기 위해 컴퓨터 단층 촬영(CT) 및 자기 공명 영상(MRI)과 같은 심장 영상 양식의 발전은 벽 두께4 및 심근 섬유증 5,6,7,8을 포함한 자세한 구조 정보를 제공하는 데 효과적인 것으로 입증되었습니다. 그러나 이러한 방식은 해부학적 및 구조적 특징에 초점을 맞추고 있어 기능적 전기 매핑에 격차를 남깁니다. 또한 고품질 심장 이미지를 얻으려면 특수 스캔 프로토콜, 숙련된 인력, 특히 심장 섬유증을 감지하기 위한 고급 세분화 및 정밀한 조직 특성화와 같은 복잡한 후처리 방법이 필요합니다.
고전적인 심전도 영상(ECGI) 시스템은 비침습적 옵션으로 부상했으며, 신체 표면 전위(BSP)9,10,11,12를 기반으로 심장 전기 활동을 재구성하여 유망한 결과를 제공합니다. 잠재력에도 불구하고 ECGI 시스템은 주목할만한 한계에 직면해 있습니다13,14. 첫째, 심장 형상에 전극 위치를 매핑하기 위해 시술 전 CT 스캔이 필요하므로 임상 루틴 사용이 실현 가능하지 않습니다. 둘째, 심장 매핑의 역 문제를 해결하는 데 사용되는 전통적인 정규화 방법은 종종 비생리학적 전파 패턴을 도입하여 임상 환경에서 정확도를 제한합니다.
이 연구의 목표는 CT 또는 MRI15 없이 실시간 매핑이 가능한 새로운 비침습적 ECGI 시스템(Imageless ECGI)의 특징과 절차를 설명하는 것이었습니다. 우리는 Imageless ECGI의 발전을 탐구하고 복잡한 부정맥 절차를 관리하는 데 있어 EAM, 12리드 ECG 및 기존 ECGI와 같은 현재 기술의 한계를 극복하여 전기생리학적 매핑을 위한 잠재적인 임상 응용 프로그램을 제시했습니다. 이 접근 방식을 사용하면 환자가 도착한 후 몇 분 이내에 심장 지도를 만들 수 있어 워크플로를 간소화하고 준비 시간을 단축할 수 있습니다. 또한 이 시스템은 고급 신호 처리 알고리즘을 사용하여 정확한 생리적 전파 패턴을 생성하여 부정맥 국소화 및 절차적 결과를 개선합니다.
프로토콜
이 방법론은 다기관 관찰 임상 연구에서 전향적으로 검증되었습니다. 이 연구는 헬싱키 선언과 관련 기관의 윤리 기준에 따라 수행되었습니다. 연구 프로토콜인 SAVE-COR(NCT05772182)은 Hospital Universitario Gregorio Marañón, Hospital Clínic de Barcelona 및 Hospital Universitari i Politècnic La Fe의 윤리 위원회의 승인을 받았으며 모든 환자로부터 사전 동의를 얻었습니다.
참고: 포함 및 제외 기준에 대한 자세한 설명은 다음과 같습니다.
포함 기준: (i) 침습적 해부학적 연구 및/또는 강내 페이싱 장치의 이식에 대한 적응증. (ii) 연구에 포함시키기 위해 정보에 입각한 동의를 얻고 서명한 경우.
제외 기준: (i) <18세. (ii) 심내막 카테터 삽입을 받을 수 없는 경우(예: 임산부 또는 모유 수유 중인 여성). (iii) 정보에 입각한 동의를 이해하고 수락할 수 없는 신체적 또는 정신적 무능력. (iv) ECGI 시스템에 필요한 3D 몸통 재건을 가능하게 하기 위해 똑바로 설 수 없음. (v) 선천성 병리가 있는 환자.
1. 사전 시술 실시간 무이미지 ECGI 시스템 준비
- 생체 전위 증폭기(그림 1A)가 완전히 충전되었는지 확인하고 환자의 발이 위치할 위치 근처의 전기생리학(EP) 룸 테이블 끝에 놓습니다.
알림: 생체 전위 증폭기( 재료 표 참조)는 전극에 의해 수집된 전기 신호를 증폭 및 디지털화하는 절연 128채널 장치입니다. - 한쪽 끝에 있는 증폭기 커넥터와 다른 쪽 끝에 있는 검은색 소켓을 검사하여 오른쪽 및 왼쪽 케이블이 손상되지 않았는지 확인합니다(그림 1B).
알림: 오른쪽 및 왼쪽 케이블( 재료 표 참조)의 길이는 1.5m이며 센서 조끼에서 생체 전위로 전기 신호를 전송합니다. - 오른쪽 및 왼쪽 커넥터 케이블을 생체 전위 증폭기에 꽂습니다(그림 1C). 각 케이블은 케이블과 증폭기 모두에 대해 동일한 숫자로 구별되는 플러그와 연결됩니다.
- 3D 스캐너 플랫폼이 완전히 충전되었는지 확인하고 3D 스캐닝 응용 프로그램을 엽니다.
참고: 3D 스캐닝 응용 프로그램은 3D 스캐너 플랫폼( 재료 표 참조)에서 실행되는 소프트웨어로, 적외선 구조광 카메라를 사용하여 환자 몸통의 3D 모델 재구성을 생성합니다. 또한 이 애플리케이션은 전극 QR(Quick Response) 코드의 위치를 자동으로 감지합니다. - PC 워크스테이션( 재료 표 참조)에 이미지 없는 ECGI 소프트웨어 UI(사용자 인터페이스)가 설치되어 있고 완전히 충전되어 있는지 확인합니다.
참고: Imageless ECGI 소프트웨어(표 참조)는 신호 처리 알고리즘을 통합하여 심장 형상을 추정하고 심장 부정맥을 진단 및 치료하거나 심장 장치 이식 절차를 안내하기 위한 귀중한 정보를 제공합니다 16,17,18,19. 시스템의 UI를 통해 사용자는 심전도 신호를 시각화, 선택 및 분석하여 심장 기능의 비침습적 평가를 가능하게 하는 심외 활동에 대한 대화형 지도를 만들 수 있습니다. - 절연 이더넷 케이블을 사용하여 생체 전위 증폭기를 워크스테이션에 연결합니다( 자료 표 참조). 한쪽 끝을 ampliifier의 이더넷 포트와 다른 쪽 끝을 워크스테이션에 넣습니다.
알림: 절연 이더넷 케이블은 생체 전위 증폭기에서 워크스테이션으로 전기 신호를 전송합니다. - 센서 조끼를 선택하고( 재료 표 참조) 포장을 검사하고 밀봉이 손상되지 않았는지 확인합니다. 포장이 개봉되었거나 손상된 경우 센서 조끼를 사용하지 마십시오.
- 센서 조끼 포장을 열고 4개의 조끼 구성 요소가 내부에 있는지 확인합니다. 구성 요소 중 하나가 누락된 경우 다른 센서 조끼 포장을 선택하십시오.
알림: 센서 조끼는 128개의 은색 전극이 있는 고밀도 전극 어레이로, 환자의 몸통 전체에 걸쳐 표면 전기 활동을 동시에 매핑할 수 있습니다. 조끼는 방사선 투과성이며 몸통의 전방 및 후방 좌우 표면을 덮는 4 개의 패치가 있습니다. 각 전극의 전면에는 QR 코드가 있어 전극 위치를 자동으로 식별할 수 있습니다.
2. 시술 전 환자 준비
- 전기생리학적 연구 또는 장치 이식과 같은 날에 환자를 병원에 입원시킵니다.
- 환자를 의자나 EP 테이블에 서 있거나 앉게 하고 몸통 전체에 옷이 없는지 확인합니다.
- 환자의 피부를 육안으로 검사하여 환자에게 상처, 상처 또는 기타 피부 상태가 있는지 확인하여 이러한 부위에 전극이 부착되지 않도록 합니다.
- 선택적으로, 머리카락이 많은 개인의 몸통을 손질하여 소음 아티팩트를 최소화하고 센서 조끼를 제거하는 동안 불편함을 줄입니다.
- 센서 조끼의 네 부분(전면 오른쪽, 전면 왼쪽, 후면 오른쪽 및 후면 왼쪽)을 환자의 몸통(그림 2A)에 올바르게 배치하고 필요한 경우 전극 사이의 연결부를 접어 조끼를 환자의 크기에 맞게 조정합니다.
- 선택적으로, CRT 절차의 경우 심장 임플란트가 삽입될 부위(종종 왼쪽 가슴 위쪽에 위치)에 전극을 배치하지 마십시오.
알림: 인쇄된 대시가 있는 연결은 해당 영역에 활성 트랙이 없으므로 필요한 경우 안전하게 끊어질 수 있습니다. - 센서 조끼의 RLD(Right-Leg-Driven) 및 REF(Reference) 전극을 각각 오른쪽 및 왼쪽 다리에 놓고 다른 조끼 전극에서 가능한 한 멀리 떨어뜨립니다.
- 적절한 실내 조명을 확인하고 3D 몸통 복원을 방해하거나 왜곡할 수 있으므로 환자의 몸통 주변 직경 1.5m 이내에 물체가 없는지 확인하십시오.
- 그림 2C에서 볼 수 있듯이 3D 몸통 복원에 대한 간섭을 방지하기 위해 환자를 팔로 머리 위로 위치시킵니다.
- 환자의 3D 몸통 복원을 얻습니다.
- 3D 스캐너 플랫폼을 잡고 3D 스캐닝 응용 프로그램을 엽니다.
- 전면 오른쪽 조끼 구성 요소의 측면에 있는 QR 코드를 스캔하여 센서 조끼를 검증하고(그림 2B) 수명이 다하지 않고 일회용인지 확인합니다.
참고: QR 코드가 감지되면 3D 스캐닝 응용 프로그램을 사용하여 3D 몸통 재구성을 얻을 수 있습니다. - 3D 스캐너 플랫폼을 환자 앞의 몸통 높이에 놓고 양손으로 단단히 잡고 환자 주위를 360° 회전하여 3D 몸통 복원을 획득합니다(그림 2C).
참고: 스캔이 진행됨에 따라 3D 스캐너 플랫폼의 적외선 구조광 카메라는 몸통의 회색 3D 폐쇄 메쉬를 생성하여 전체 회전으로 프로세스를 완료합니다. 일반적으로 3D 몸통 재구성 프로세스는 완료하는 데 1-2분이 걸립니다. - 3D 몸통 복원을 육안으로 검사하여 전체 몸통이 회색 그림자로 덮여 있고 복원된 메쉬에 구멍이 없는지 확인합니다.
- 스캔이 완료되면 응용 프로그램에 3D 몸통 재구성을 저장하십시오.
- 환자를 EP 룸 테이블에 눕히십시오.
- 센서 조끼의 네 부분을 해당 오른쪽 및 왼쪽 커넥터 케이블에 연결합니다(그림 1D). 전면 우측 및 후면 우측 조끼 커넥터를 오른쪽 케이블 소켓에 연결하고 전면 좌측 및 후면 좌측 조끼 커넥터를 왼쪽 케이블 소켓에 연결합니다.
- 생체 전위 증폭기의 전원을 켜면 이미지 없는 ECGI 소프트웨어가 실시간 전기생리학적 신호를 수신할 수 있습니다.
3. 환자의 심장 기하학적 구조 추정
- 워크스테이션에 설치된 실시간 Imageless ECGI 소프트웨어에 사용자로 로그인합니다(그림 3). 사용자 이름과 비밀번호를 입력합니다.
- Add Patient(환자 추가) 버튼을 클릭하고 식별 세부 정보를 입력하여 UI의 홈 창에서 새 환자를 등록합니다(그림 4). 그런 다음 환자와 연결된 새 세션을 만들어 시술 유형과 성별, 나이, 키, 몸무게와 같은 기본 데이터를 제공합니다.
참고: 한 명의 환자가 여러 세션을 가질 수 있습니다. 예를 들어, 후속 조치가 포함된 임상 연구에서 환자가 두 번째 ECGI 등록을 받는 경우 환자를 다시 추가하지 않고도 새 세션을 생성할 수 있습니다. - USB-C 케이블을 사용하여 3D 스캐너 플랫폼을 워크스테이션에 연결합니다.
- Load Torso Scan 버튼을 클릭하고 Torso Geometry Window에서 3D 몸통 재건을 업로드합니다(그림 5).
알림: 소프트웨어는 센서 조끼에서 128개 전극의 위치를 자동으로 감지합니다. 각 조끼 구성 요소에는 서로 다른 전극 색상이 있습니다: 전면 우측 = 빨간색, 전면 좌측 = 파란색, 후면 우측 = 분홍색, 후면 좌측 = 주황색. - 선택적으로 각 전극을 클릭하고 몸통 표면에서 위치를 변경하여 전극 위치를 수동으로 조정합니다.
- Compute Geometry 버튼과 Estimate Heart Geometry 옵션을 선택하여 Torso Geometry Window에서 환자의 심장 형상을 추정합니다(그림 5).
참고: 이 소프트웨어는 이전 문헌20에 자세히 설명된 바와 같이 통계적 형상 모델(SSM)을 기반으로 하는 방법론을 사용하여 심장 기하학을 추정합니다(그림 6A). 이 알고리즘은 먼저 환자의 3D 몸통 재구성 및 기초 데이터(성별, 나이, 키, 체중)를 입력으로 처리합니다. 그 후, MRI 기반 몸통과 심장 기하학을 통합한 SSM은 환자의 3D 몸통 메쉬에 맞게 반복적으로 조정됩니다. 이는 환자의 신체 내에서 최적의 심장 기하학, 위치 및 방향을 결정합니다(그림 6B). 이 프로세스는 시술 전 CT 또는 MRI의 필요성을 제거하여 10-15분 이내에 최초의 비침습적 심장 지도를 생성할 수 있습니다. 팝업 메시지는 3D 몸통 재구성이 충분한 해상도가 부족하거나 추정 결과의 정확도에 영향을 줄 수 있는 아티팩트가 포함되어 있는지 사용자에게 알려준다는 점에 유의해야 합니다.
4. 심장 재동기화 요법(CSP-CRT)을 위한 전도 시스템 페이싱 임플란트 안내를 위한 비침습적 무이미지 ECGI 매핑(사례 4)
- Amplifier Window(증폭기 창)로 이동하여 Connect Amplifier(연결 증폭기) 버튼을 클릭하여 실시간 전기생리학적 신호 수집을 시작합니다(그림 7). 다른 리드를 클릭하여 증폭기 화면에서 신호를 시각화합니다.
- Real-Time Window(그림 8)로 이동하여 실시간 비침습적 심장 매핑을 얻을 수 있습니다.
참고: Real-Time Window를 사용하면 실시간 신호를 시각화하고, 잡음이 있는 신호를 제외하고, 시간 생성기를 생성하고, 분석 세그먼트(예: P파 및 QRS 복합)를 자동으로 설명하고, 비침습적 ECGI 맵을 계산 및 표시할 수 있습니다. - 128개 리드 보기 버튼을 클릭하고, 노이즈 리드 선택 모드로 사용자 전용 옵션을 선택하고, ECGI 맵을 생성하기 전에 노이즈 신호를 두 번 클릭하여 제외하여 노이즈가 있는 신호를 제외합니다. 이것은 ECGI가 잘못 제기된 문제21이기 때문에 매핑 계산 품질을 향상시킵니다.
참고: 녹색으로 표시된 센서 조끼 리드는 양호한 품질의 신호를 나타내며 역 문제 계산에 사용되는 반면, 빨간색으로 표시된 리드는 노이즈가 있어 분석에서 제외됩니다(그림 8A). - 12-리드 보기 버튼을 클릭하면 추정된 12-리드 ECG를 실시간으로 시각화할 수 있습니다(그림 8B).
- RT ON 버튼이 활성화되어 있는지 확인하여 신호 분석 섹션의 신호를 자동으로 업데이트합니다(그림 8C). 이 옵션은 분석할 QRS 복합체의 시작 및 오프셋을 자동으로 트리거하고 정의합니다.
알림: RT 버튼을 RT OFF 모드로 전환하여 신호를 고정할 수 있으므로 시스템의 자동 설명이 최적이 아닐 때 사용자가 QRS 컴플렉스를 수동으로 설명할 수 있습니다. - 옵션 버튼을 클릭하여 ECGI 활성화 매핑 분석을 구성하여 CSP-CRT 절차에 대한 최적의 기초 리듬 맵을 자동으로 생성합니다.
- Analyze Ventricle 옵션을 선택하여 심실만 매핑합니다.
- Activation Times 알고리즘에 대한 웨이블릿 기반17 분석 옵션을 선택합니다.
- 매핑 유형 기능에 대한 평균 비트 옵션을 선택하여 마지막 10개 QRS 복합체의 평균 웨이브를 계산합니다.
- 오프셋 보정(Offset Correction), 비트 번호(Beat Number) 및 동기화 옵션(Sync Option) 기능에 대한 기본 설정을 그대로 둡니다.
- 맵 시각화 섹션에서 두 개의 패널 옵션을 선택하고 왼쪽 맵이 업데이트 모드로 설정되어 있는지 확인하여 새로 평균화된 각 QRS 복합체가 분석될 때마다 지속적으로 업데이트됩니다.
- 왼쪽에서 bi-ventricular basal Activation map을 시각화합니다(그림 8D 왼쪽 패널). 이 시스템은 몸통과 심장 메쉬 사이의 전달 매트릭스를 자동으로 계산하여 경계 요소 방법 22,23,24에 따라 심장의 심외막 전기 활동을 재구성합니다.
참고: 활성화 맵은 심장 심외막을 가로지르는 탈분극의 시간적 진행을 묘사하여 활성화 기원을 정확히 찾아내고 재진입 또는 초점 패턴을 식별하는 데 도움이 됩니다. 활성화는 (1) 각각의 재구성된 전기도를 모든 음의 기울기 시간 샘플에 대한 정현파 웨이블릿의 합으로 변환하고 해당 시간의 기울기에 비례하는 진폭을 선택하고 (2) 변환된 신호의 최대 진폭의 순간을 활성화 시간(17)의 순간으로 선택함으로써 계산됩니다. - 이름을 쓰고 Save Map 버튼을 클릭하여 기본 맵을 저장하고 재현 가능해지면 맵을 Freeze 모드로 전환합니다. 재현 가능한 ECGI 맵은 최소 3개의 연속된 맵에서 일관된 활성화 지속 시간과 전파 패턴을 갖습니다.
참고: CSP-CRT 절차에서 기저 지도(그림 12A)는 왼쪽 다발 분지 영역에 도달할 때까지 중격 영역에서 전극 나사 체결 과정 동안 양심실 동기화를 평가하기 위한 참조 역할을 합니다(그림 12C). - 중격 영역에서 나사 체결 및 페이싱 프로세스 동안 최적의 맵을 얻기 위해 Options 버튼을 클릭하여 ECGI 활성화 매핑 분석을 구성합니다.
- Analyze Ventricle(심실 분석)을 선택하여 심실만 매핑합니다.
- 활성화 시간 알고리즘에 대한 웨이블릿 기반 분석 옵션을 선택합니다.
- 매핑 유형에 대한 단일 비트 옵션을 선택하여 단일 비트의 파동을 분석하여 서로 다른 셉탈 위치에서 동시에 나사 조임 및 페이싱 프로세스 중에 심전도 신호의 변화를 캡처합니다.
- 오프셋 보정(Offset Correction), 비트 번호(Beat Number) 및 동기화 옵션(Sync Option) 기능에 대한 기본 설정을 그대로 둡니다.
- 오른쪽 패널 맵을 업데이트 모드로 설정하여 나사 처리 중에 새로 분석된 각 단일 비트 QRS 복합체로 지속적으로 업데이트되도록 합니다.
- Linked Values 메뉴를 사용하여 오른쪽 패널 맵의 컬러맵 범위를 기본 맵과 동기화하고 Linked Camera 메뉴(그림 8D 오른쪽 패널)를 통해 카메라 위치를 연결합니다.
참고: 리드가 중격 영역에 나사로 고정되면 다양한 위치(즉, 우심실 중격, 중간 중격, 심부 중격 및 왼쪽 다발 가지)에서 박동 간 ECGI 맵이 자동으로 생성됩니다. 이러한 맵은 평가된 모든 ECGI 맵에서 컬러맵 범위를 표준화하여 기본 맵과 비교됩니다(그림 12B, C). 이 설정을 사용하면 리드가 나사로 고정되어 있는 동안 활성화 패턴의 변경 사항을 명확하게 시각화할 수 있습니다. - 이름을 쓰고 셉탈 영역의 스크류 프로세스 중에 활성화 패턴의 변화가 관찰될 때마다 Save Map(맵 저장 ) 버튼을 클릭하여 각 맵을 저장하고, 왼쪽 번들 브랜치 영역에 도달할 때까지 계속합니다.
5. 추가적인 비침습적 무이미지 ECGI 매핑 분석
참고: 계산된 ECGI 신호에서 다양한 심장 맵을 파생하여 심장 기질을 평가하거나, 부정맥을 특성화하거나, CRT를 평가하거나, 시술 중에 임상적으로 관련된 지표를 추출할 수 있습니다. 생성할 수 있는 맵의 유형은 분석되는 특정 심장 리듬에 따라 다르며, 규칙적인 리듬과 불규칙한 리듬 모두에 대한 고유한 접근 방식이 있습니다.
- Real-Time 창의 신호 분석 섹션을 사용하여 전기생리학적 절차 중에 환자가 보일 수 있는 다양한 리듬을 분석합니다.
- 환자가 부비동 리듬, 심방 또는 심실 페이싱, 심방 조동 또는 심실 빈맥과 같은 안정된/규칙적인 리듬에 있을 때 단일 비트 또는 평균 비트 분석을 매핑 유형 기능으로 설정하여 규칙적인 리듬을 분석합니다. 일반 리듬 해석에서 Activation 맵과 CV(Conduction Velocity ) 맵을 계산합니다.
- 환자가 심방세동 상태일 때 불 규칙한 리듬 비트 분석을 매핑 유형 기능으로 사용하여 불규칙한 리듬을 분석합니다. 이 시스템을 사용하면 확장된 AF 세그먼트(예: 1분)를 선택하여 QRST 컴플렉스를 억제하고 AF의 동적 시공간 패턴을 캡처할 수 있습니다. 불규칙 리듬 분석에서 Phase map, Rotor Histogram map 및 Dominant Frequency map을 계산합니다.
- 선택적으로, 맵 선택의 드롭다운 메뉴를 누르고 규칙적인 리듬이 분석된 경우 활성화 맵을 선택합니다. 자세한 활성화 맵 설명은 4.8단계를 참조하십시오.
- 선택적으로, 맵 선택의 드롭다운 메뉴를 누르고 규칙적인 리듬이 분석된 경우 Conduction Velocity 맵을 선택합니다.
참고: 전도 속도는 활성화 맵에서 파생된 메트릭입니다. 이 메트릭은 파면이 심외막의 각 영역을 통과하는 데 걸리는 시간을 나타냅니다. CV 계산은 심장 표면 전반에 걸친 활성화 시간 맵의 공간 그라디언트에 의존하며, 효과적인 전파 영역을 식별하기 위해 속도 벡터 필드가 적용됩니다. 균일한 방향 벡터를 가진 영역은 안정적인 전기 전파를 나타냈고, 비효율적인 전파를 나타내는 각도 격차를 가진 영역은 방사형 기저 함수25를 사용하여 보간됩니다. CV는 부정맥 재발률17과 관련된 기판 매핑 중 전도 감속 영역을 식별할 수 있습니다. - 선택적으로, 맵 선택의 드롭다운 메뉴를 누르고 불규칙한 리듬을 분석할 때 Phase map을 선택합니다.
참고: 위상 맵은 시간 경과에 따른 활동 전위를 통해 정의된 심근 영역의 진행 상황을 추적합니다. 이러한 유형의 지도는 심장 전위의 진행을 나타내기 때문에 동적입니다. 위상 맵에서 힐베르트 변환(Hilbert Transform)이 적용되어 ECGI 신호의 위상을 계산합니다. 각 위상은 신호의 각 주기에 걸쳐 주어진 활동 전위 상태에 해당합니다(휴지의 경우 π, 탈분극의 경우 π/2, 고원의 경우 0, 재분극의 경우 -π)26. - 선택적으로, 맵 선택의 드롭다운 메뉴를 누르고 불규칙한 리듬을 분석할 때 Rotor Histogram 맵을 선택합니다.
참고: 위상 맵에서 파생된 로터 히스토그램 맵은 위상 특이점의 가장 빈번한 위치를 표현한 것으로, 재진입 활동이 집중된 영역이며 빨간색으로 표시됩니다. 요컨대, 위상 특이점(phase singularity)은 위상이 -π에서 π로 이동하는 핵심 지점으로 정의되며, 주변에서 위상의 점진적인 공간적 진행을 보여주지 않는 PS는 폐기됩니다. 마지막으로, 각 로터에 대한 회전 수를 정량화하여 로터 히스토그램 맵(18)을 얻습니다. AF 및 재진입을 보이는 특정 영역 중 전파 패턴을 식별하는 알고리즘의 정밀도는 심내막 매핑에 대해 체계적으로 평가되어 71%16의 상관관계를 보여주었습니다. - 선택적으로, 맵 선택의 드롭다운 메뉴를 누르고 불규칙한 리듬을 분석할 때 Dominant Frequency (DF) 맵을 선택합니다.
참고: DF 맵은 시간 경과에 따른 각 심장 영역의 우세한 전기 주파수를 표시하여 AF의 동인 역할을 할 수 있는 빠른 전기 활동 영역을 식별하는 데 도움이 됩니다. DF는 Welch의 주기도27,28에서 가장 높은 전력 스펙트럼 밀도를 가진 주파수로 계산됩니다. 이를 통해 심방 내 세동 활동의 안정성이나 변동성이 높은 영역을 감지할 수 있습니다. 히스토그램은 지배적인 주파수의 시간적 분포를 평가하는 데 사용되며, 가장 관련성이 높은 전기 활동을 명확하고 정량적으로 표현하고 비정상적인 동작이 있는 영역을 쉽게 식별할 수 있습니다.
결과
사례 1 - 비정형 심방 조동의 카테터 절제 계획 및 안내
이 사례는 고혈압, 흡연, 심장 판막 질환, EHRA IIb 분류, CHA2DS 2-VASc 점수 1의 병력이 있는 59세 남성(체질량 지수 -BMI- 30) 환자로, 12-리드 ECG를 기반으로 한 비정형 심방 조동(AFL)으로 인한 카테터 절제 징후가 있습니다(그림 9A). 환자는 카테터 절제술의 병력이 없었습니다. 시술 전 후기 가돌리늄 강화 MRI(LGE-MRI)는 좌심방(LA)의 후벽에서 광범위한 섬유증을 드러냈으며, 정상 LA 플라마니메트리는 24cm²이고 좌심실 박출률(LVEF)은 54%로 보존되었습니다.
비침습적 무영상 ECGI는 대퇴골 외피를 통해 카테터를 삽입하기 불과 몇 분 전에 수행되었습니다. QRST 복합체가 없는 AFL(209ms)의 전체 사이클을 분석을 위해 선택했습니다. 이 매핑은 승모판막(MV) 주변의 매크로 재진입 회로를 밝혀냈으며, 부정맥 종결을 위한 최적의 절제 대상으로 주위선을 정확히 지적했습니다(그림 9B). 그 후, 접촉 기반 EAM(그림 9C)을 수행하여 비침습적 무Imageless ECGI에서 관찰된 전파 패턴을 확인했습니다. 주위선을 따라 절제하면 부정맥이 성공적으로 종결되었습니다.
이 임상 사례에서는 침습적 EAM 전에 부정맥을 정확하게 특성화하여 부정맥 전파 패턴의 정확한 국소화를 가능하게 하고 절제 절차를 간소화했습니다. 그러나 AFL 또는 국소 빈맥과 같은 복잡한 심방 빈맥의 경우 Imageless ECGI는 실시간 단일 비트 매핑을 제공하므로 비지속적인 부정맥의 경우 특히 유용합니다. 시술 중 부정맥 패턴의 변화에 대한 적응성은 정확하고 역동적인 매핑을 보장합니다. 또한, 시계 반대 방향 AFL의 진단은 일반적으로 12리드 ECG에서 간단하게 내릴 수 있지만, 복잡한 빈맥의 메커니즘을 정확하게 찾고 식별하는 것은 어려울 수 있습니다. 결과적으로, 의료 상담 시 또는 몇 분 전에 Imageless ECGI를 수행하면 카테터 절제 계획에 대한 업스트림 지침을 제공하고 불필요한 경중격 접근법을 제거함으로써 절차의 안전성과 효율성을 향상시킬 수 있습니다.
사례 2 - 지속성 심방세동의 카테터 절제 중 위상 특이점의 진화
이 사례는 좌심실 박출률(LVEF, 55%)이 보존되어 있고 LA가 확장되지 않은 63세 남성 환자(BMI 31)로, 지속적인 심방세동으로 인해 카테터 절제가 필요한 I의 뉴욕심장협회(NYHA)입니다. 시술 전 CT 또는 MRI 영상은 수행되지 않았습니다. 환자는 2019년 12월 폐정맥 격리(PVI)를 위한 카테터 절제 병력이 있었습니다.
도착했을 때 환자는 AF에 있었습니다. 기질 매핑은 절제 절차 전반에 걸쳐 imageless ECGI를 사용하여 수행되었습니다(그림 10A). 기준선에서 ECGI는 우심방(RA) 측벽, 우심방 부속기(RAA) 기저부, 좌심방 후벽(PW) 및 좌심방 부속기(LAA) 기저부에서 위상 특이점을 식별했습니다. 이러한 결과는 엔도캐비타리안 카테터를 사용하여 관찰된 고주파 및 단편화된 EGM과 상관관계가 있었으며, LA EAM 재구성을 통해 적절한 PVI가 확인되었습니다. LAA 베이스에서 펄스장 절제(PFA)가 시작되어 AF에서 비정형 AFL로 리듬 변화가 발생했습니다. 영상이 없는 ECGI는 관상동동 카테터의 원위극에서 동반을 통해 확인된 주위 AFL을 보여주었습니다. 승모판이 만들어졌습니다. 그러나 심방세동이 재유발되었습니다. 그 후, 완전한 PW 분리가 달성되었습니다. 그럼에도 불구하고 imageless ECGI는 RAA 기저에서 중요한 위상 특이점을 계속 식별했습니다. 이 영역을 대상으로 하는 여러 PFA 적용에 따라 부비동 리듬이 달성되었습니다(그림 10B).
이 임상 사례는 심방에서 전기 활동의 높은 가변성으로 인해 AF가 어떻게 독특한 문제를 제시하는지 보여줍니다. 이미지가 없는 ECGI는 절제 중 AF 진행의 시공간 패턴을 효과적으로 캡처했으며, SR이 달성될 때까지 기질 수정을 안내하기 위해 최대 3개의 비침습적 맵을 획득했습니다. 폐정맥 격리와 같은 표준 치료법은 재발률이 상대적으로 높다29. 심방세동 치료의 주요 어려움은 두 가지 영역에 있습니다: (1) PVI만으로 혜택을 받을 환자를 결정하는 것, 그리고 (2) 더 넓은 접근이 필요한 환자를 위해, 절제가 부정맥 재발을 가장 효과적으로 줄일 수 있는 PVI 영역 밖의 영역을 식별하는 것입니다. 부비동 리듬 동안 무이미지ECGI는 PVI 절제 성공을 예측하는 데 유용한 것으로 입증된 CV 맵을 생성하는 능력을 입증했습니다17. 그러나 이 경우 이미지가 없는 ECGI가 AF 역학 패턴을 동시에 캡처하여 임상의에게 AF가 어떻게 전파되는지에 대한 포괄적인 관점을 제공하고 부정맥을 유발하는 주요 영역을 식별하는 데 도움이 되었습니다. 결과 분석은 AF 절제 전략 최적화에 대한 유용성을 추가로 검증하기 위해 절제된 이미지 없는 ECGI 감지 AF 드라이버와 장기 부정맥이 없는 생존과 같은 임상 종점 간의 상관 관계에 초점을 맞춰야 합니다.
사례 3 - 심장 재동기화 치료를 위한 양심실 페이싱 최적화 안내
이 사례는 67세 여성 환자로, 비허혈성 확장성 심근병증이 있고, LVEF가 25%이며, 시술 전 MRI에서 후기 가돌리늄 증강제의 증거가 없으며, 기준선 ECG에서 좌측 다발 가지 블록(LBBB)이 삽입되고 QRS 지속 시간이 156ms입니다. 환자는 CRT의 일부로 양심실 페이싱(BiVP)이 표시되었습니다.
심장 CRT 시술 중에는 실시간 무영상 ECGI를 사용하여 심박 조율기 이식 전후의 심실 동기화를 평가했습니다. 기준선 리듬에서, 환자의 최신 활성화 영역은 그림 11A에 표시된 것처럼 좌심실(LV)의 기저외벽에서 확인되었습니다. 심실 총 활성화 시간(TAT)은 116ms에서 측정되었으며, 이는 상당한 심실 비동시성을 나타냅니다. ECGI를 사용하여 다양한 장치 구성을 평가했으며, 최적의 설정은 LV 리드의 원위 및 근위 극의 동시 활성화와 140ms의 방실 지연을 사용하는 BiVP로 결정되었습니다. 그림 11B에서 볼 수 있듯이, 3개의 심실 페이싱 포인트는 늦게 활성화된 영역이 없었으며, 이는 70ms의 향상된 TAT와 함께 성공적인 동기화를 나타냅니다.
심장 재동기화 요법은 심부전 및 장기적 QRS 환자의 심실의 전기 협응을 회복하고 심장 기능을 개선하는 것을 목표로 합니다. 이 경우 Imageless ECGI는 CRT 절차 중 BiVP 최적화를 안내하는 데 핵심적인 실시간 매핑을 제공했습니다. 이를 통해 심실 활성화 패턴을 정확하게 평가할 수 있었고 최적의 장치 구성을 식별하는 데 도움이 되어 완전한 심실 동기화를 보장할 수 있었습니다. ECGI의 비침습적 특성과 즉각적인 피드백을 통해 임상의는 선도 프로그래밍을 개선할 수 있었습니다. 대조적으로, 연구는 최신 활성화 영역30 근처에서 좌심실 리드 배치를 안내하는 ECGI의 가치를 강조하지만 해부학적 제약으로 인해 적용 가능성이 제한될 수 있습니다. TAT와 같은 ECGI에 의해 결정된 기초 및 최종 재동기화 매개변수는 증상 개선 및 장기적인 심실 기능을 포함하여 시간이 지남에 따라 CRT에 대한 환자의 임상적 반응을 모니터링하여 임상 결과와 관련되어야 합니다.
사례 4 - 유도 유도 시스템, 심장 재동기화 치료를 위한 페이싱 임플란트, 실시간
이 임상 사례는 중증 심실 기능 장애(LVEF 15%)와 QRS 지속 시간이 172ms인 LBBB를 가진 45세 여성 환자입니다. 환자는 전도 시스템(CSP) 페이싱 접근법을 사용하여 이식형 제세동기 CRT를 지시받았습니다.
장치 이식 중에 실시간 무영상 ECGI를 사용하여 중격 영역에서 전극을 나사로 조이는 과정 전반에 걸쳐 심실 동기화를 모니터링했습니다. 그림 12에서 볼 수 있듯이, 기준선 ECGI 맵은 133ms의 TAT로 LV의 측벽을 가장 최근에 활성화된 영역으로 식별했습니다. 전극 나사 체결 중 Beat-to-beat ECGI 매핑은 심실 동기화의 점진적인 개선을 보여주었으며, 왼쪽 다발 분기에 도달했을 때 최적의 동기화가 달성되어 95ms의 TAT를 달성했습니다.
이 사례는 CRT 시술 중 LBBP 이식을 안내하는 실시간 무이미지 ECGI의 잠재력을 보여주었습니다. 단일 비트, 실시간 매핑 기능을 통해 중격 부위의 납 주입의 각 단계에서 심실 TAT와 재동기화를 분석할 수 있었습니다. 이 시스템은 빠르고 시각적이며 해석하기 쉬운 메트릭을 제공하여 심전도 CSP 기준의 표준화 부족 문제를 해결했습니다. BiVP-CRT 절차뿐만 아니라 무이미지 ECGI 매개변수가 임상 CRT 반응과 유의한 상관관계가 있는지 여부와 12-리드 ECG 예측 변수와 어떻게 비교되는지 확인하기 위해 추가 연구가 필요합니다.
Case 5 - 심실빈맥의 카테터 절제 계획 및 안내
이 사례는 허혈성 심근병증, 중증 심실 기능 장애(LVEF 15%)를 앓고 있는 53세 남성 환자(BMI 25.4)로, 재발성 VT로 인해 NYHA 클래스 II로 카테터 절제 시술을 의뢰받았습니다. 시술 전 MRI는 광범위한 심내막 섬유증과 좌심실의 하부-기저부 및 하내측 분절에 국한된 부정맥 생성 채널을 보여주었습니다. 이 환자는 2018년에 VT 카테터 절제 병력이 있었습니다.
시술 전반에 걸쳐 동시 무영상 ECGI 매핑(그림 13A) 및 침습적 EAM(그림 13B)을 수행했습니다. 카테터 절제 과정에는 우심실(RV) 정점 페이싱 및 프로그래밍된 자극을 사용한 VT 유도 중 기질 기반 매핑이 포함되었습니다. 무영상 ECGI는 카테터를 삽입하기 전에 부비동 리듬 매핑 동안 LV의 하부-기저 분절에서 전도가 느려지는 영역을 확인했습니다. 이 소견은 MRI에서 관찰된 섬유증과 일치했다. 이후 우심실(RV) 정점에서 페이싱을 통해 좌심실의 기저 및 내측 분절에서 전도 둔화가 확인되었으며, 이 영역이 부정맥 기질 가능성이 있는 것으로 확인되었습니다. 380ms 사이클 길이의 VT가 잠시 유도되어 혈역학적 불안정성으로 인해 심장율동전환이 필요했습니다. 결과적으로 제한된 수의 EAM 포인트만 획득했습니다. 그러나 단일 VT 사이클을 사용하여 이미지 없는 ECGI는 페이스 맵에서 등시성 밀집이 관찰된 동일한 영역에서 VT 지협을 성공적으로 식별했습니다.
이 VT 사례에서 실시간 무영상 ECGI를 사용하여 VT 관리의 두 가지 주요 임상적 과제, 즉 (1) 부비동 리듬 중 잠재적 절제 대상의 정확한 위치 파악과 (2) 혈역학적 불안정성이 있는 VT의 특성화를 성공적으로 해결했습니다. 단일 박동에서 VT 지협은 기질과 부정맥 활성화 맵 모두에서 정확하게 식별되었습니다. 이 시스템을 통해 작업자는 절제 전이나 절제 중에 부정맥 유발 기질을 식별하고 단일 사이클에서 실시간으로 여러 유도성 VT를 특성화할 수 있었습니다.

그림 1: 이미지가 없는 ECGI 하드웨어 구성 요소. (A) 특정 케이블 연결 포트가 있는 이중 전위 증폭기. (B) 한쪽 끝에는 증폭기 커넥터가 있고 다른 쪽 끝에는 센서 조끼 소켓 커넥터가 있는 오른쪽 및 왼쪽 케이블. (C) 쌍전위 증폭기에 연결된 오른쪽 및 왼쪽 케이블을 보여주는 구성. (D) 센서 조끼를 케이블 소켓에 연결하는 절차의 개략적인 작업 흐름. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 3D 몸통 재건 스캐너 절차. (A) 4가지 구성 요소(Front-Right, Front-Left, Back-Right, Back-Left)로 구성된 128리드 신체 표면 전위 센서 조끼는 3D 재건 전에 환자의 몸통에 배치됩니다. 각 전극에는 자동 식별을 위한 고유한 QR 코드가 있습니다. 전극 사이의 연결부는 조끼를 환자의 체형에 맞게 접을 수 있습니다. (B) 전면 오른쪽 구성 요소의 QR 코드는 조끼의 유효성을 검사하여 3D 스캐너 응용 프로그램이 몸통 재건을 시작할 수 있도록 합니다. (C) 3D 스캐너 응용 프로그램을 통한 3D 스캐너 플랫폼은 적외선 구조광 카메라를 사용하여 복원된 몸통을 생성합니다. 약어: FR: 앞-오른쪽; FL: 앞-왼쪽; BR: 오른쪽 뒤; 및 BL : 왼쪽 뒤. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
그림 3: 소프트웨어 액세스를 위해 지정된 사용자 이름과 암호가 필요한 이미지 없는 ECGI 사용자 인터페이스 로그인 화면. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
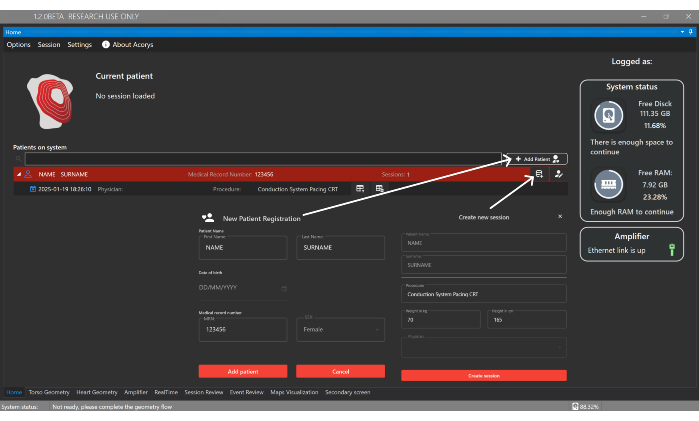
그림 4: 홈 창 홈 창에서는 환자, 의사 및 사용자를 관리할 수 있을 뿐만 아니라 환자 세션을 구성할 수 있습니다. 또한 가져온 세션에 대한 정보와 시스템 및 증폭기의 상태에 대한 정보도 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
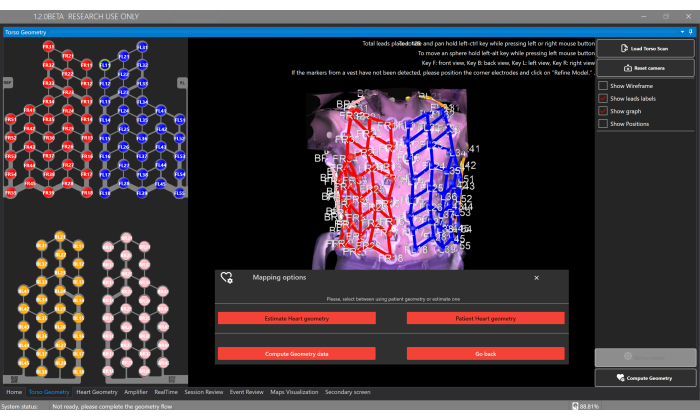
그림 5: 몸통 형상 창. Torso Geometry 창을 통해 사용자는 3D 몸통 모델, 세그먼트 전극을 업로드 및 볼 수 있으며, 추정을 가능하게 하거나 개인화된 CT/MRI에서 세분화를 제공할 수 있는 Compute Geometry 버튼을 통해 심장 지오메트리 유형을 선택할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
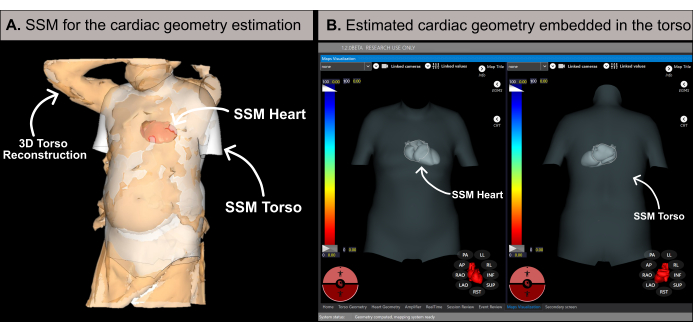
그림 6: 심장 기하학적 추정. (A) 기저 특징과 환자의 3D 몸통 복원을 활용하여 심장 기하학적 구조를 추정하는 SSM 알고리즘. (B) 몸통의 SSM 내에서 추정된 심장 기하학은 전후(왼쪽) 및 후방(오른쪽) 보기를 표시합니다. 약어 : 3D : 3 차원; SSM: 통계적 형상 모델. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
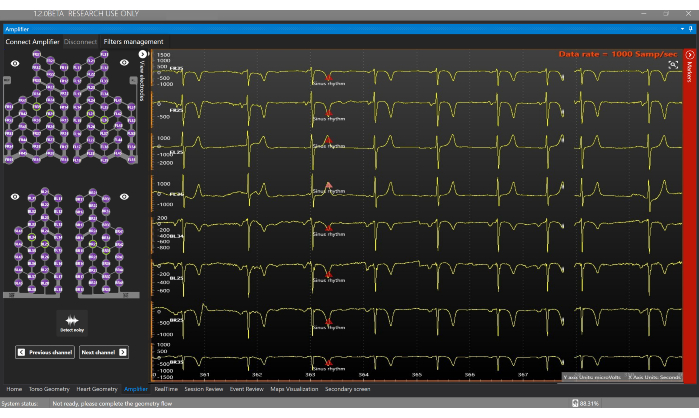
그림 7: 증폭기 창. Ampliifier 창을 사용하면 Sensor Vest의 각 전극에서 얻는 신호를 실시간으로 시각화할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 8: 실시간 창. (A) 고밀도 전극 어레이 조끼의 활성 리드의 개략도. 녹색 전극은 양호한 품질의 신호를 포함하는 반면, 빨간색 전극은 잡음이 있는 신호를 포함하며 역 문제 계산에 참여하지 않습니다. (B) 실시간으로 심전도의 12개 리드를 추정합니다. (C) QRS 복합체(녹색 창)의 시작 및 오프셋의 자동 트리거 및 묘사. 매핑 계산에 참여하는 모든 리드의 평균 신호는 파란색으로 표시됩니다. (D) 맵 시각화 섹션은 단일, 이중 또는 4개의 맵 보기를 지원합니다. 이 예제에서는 CRT 절차 중에 basal 및 left bundle branch pacing(최종 맵) 상태에 대한 활성화 맵이 있는 이중 매핑 보기를 보여 줍니다. 기본 맵은 고정 모드이며 정적 상태로 유지되는 반면 최종 맵은 업데이트 모드에 있으며 새로 분석된 각 QRS 복합체로 다시 계산됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
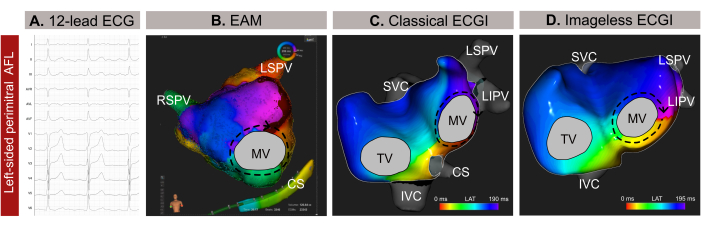
그림 9: 좌측 비정형 AFL의 그래픽 예와 12리드 ECG, 무영상 ECGI 및 침습적 EAM의 다양한 진단 용량 .(A) 비정형 AFL의 12-리드 ECG 신호는 V1에서 양성 상심실파를 나타냅니다. (B) SSM에서 추정된 심장 기하학을 사용하고 전후 보기를 표시하는 이미지 없는 ECGI. 전파 회로는 MV 주변의 모든 색상을 표시하며, 이는 주변 AFL의 일반적인 패턴입니다. (C) EAM에서 파생되고 전후 보기를 표시하는 로컬 활성화 매핑은 MV 주변의 매크로 재진입을 보여 이미지가 없는 ECGI에서 진단을 확인합니다. 약어 : ECG : 심전도; EAM: electroanatomical mapping; ECGI: 심전도 영상. SVC: 상대정맥; IVC: 하대정맥; CS: 관상동; LSPV: 좌측 상폐정맥; RIPV: 오른쪽 하폐정맥; RSPV: 우측 상폐정맥(right superior pulmonary vein). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
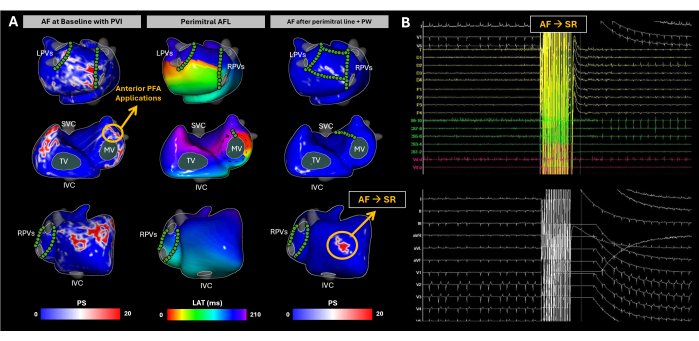
그림 10: 비침습적 무이미지 ECGI 매핑을 사용하여 AF 카테터 절제 중 심방 기질 진화 추적. (A) 녹색 원으로 표시된 PFA 부위가 있는 이미지 없는 ECGI의 Postero-Anterior, Antero-Postero 및 Right Lateral 보기. 기준선 PS 맵은 RA 측벽, RAA 기저부, LA 후벽 및 LAA 기저부의 재진입을 강조 표시합니다. LAA 베이스의 PFA는 리듬을 주변 AFL로 전환했습니다. 승모선과 후벽 격리를 완료했음에도 불구하고 심방세동은 다시 자발적으로 유도되었습니다. ECGI는 절제 표적이 된 RAA 베이스에서 PS를 밝혔습니다. 해당 부위에 여러 차례 PFA를 적용한 결과, 부비동 리듬이 회복되었습니다. (B) AF가 SR로 변경된 순간 12리드 ECG 및 심장 내 신호. 약어: SVC: 상대정맥; IVC: 하대정맥; LPV: 좌측 폐정맥; RPV: 우측 폐정맥; AF: 심방세동, SR: 부비동 리듬, PS: 위상 특이점, LAT: 국소 활성화 시간, TV: 삼첨판막, MV: 승모판막, PVI: 폐정맥 격리, AFL: 심방 조동, PW: 후벽, PFA: 펄스장 절제. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
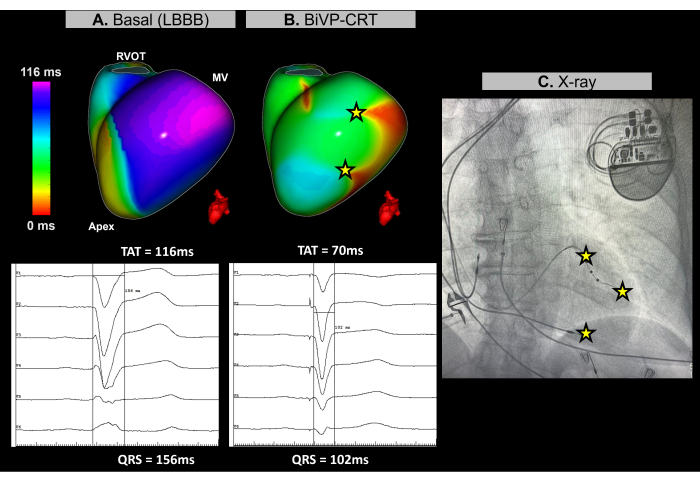
그림 11: Imageless ECGI를 사용한 양심실 페이싱의 최적화. (A) 환자의 기준선 리듬. 이미지가 없는 ECGI 맵(좌측-측면 보기)은 좌심실 측벽에서 늦게 활성화된 영역(보라색)을 보여주며, TAT는 116ms로 심실 비동기화(ventricular dyssynchrony)를 나타냅니다. 이는 LBBB 패턴으로 넓은 QRS 복합체(156ms)를 보여주는 기준선 ECG와 일치합니다. (B) 심박 조율기 이식 후 구성. 좌심실 리드의 원위극과 근위극의 동시 활성화와 140ms의 방실 지연을 동반한 BiVP 후, 무이미지 ECGI 맵은 지연된 활성화 영역(보라색 영역 없음)을 보여주며, 이는 동기 심실 활성화와 70ms의 감소된 TAT를 나타냅니다. 이는 QRS 지속 시간이 102ms로 감소하는 최종 ECG에서 관찰된 단축된 QRS 복합체와 일치합니다.(C) 이식된 심박 조율기의 전후 X선 보기, 심박 조율기 전극의 위치를 보여줍니다. LV 리드의 원위 및 근위 극의 페이싱 활동도 ECGI 맵에 반영됩니다. 약어: LBBB: 좌측 다발 분지 블록, BiVP: 양심실 페이싱, CRT: 심장 재동기화 요법, RVOT: 우심실 유출로, MV: 승모판막, TAT: 총 활성화 시간. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
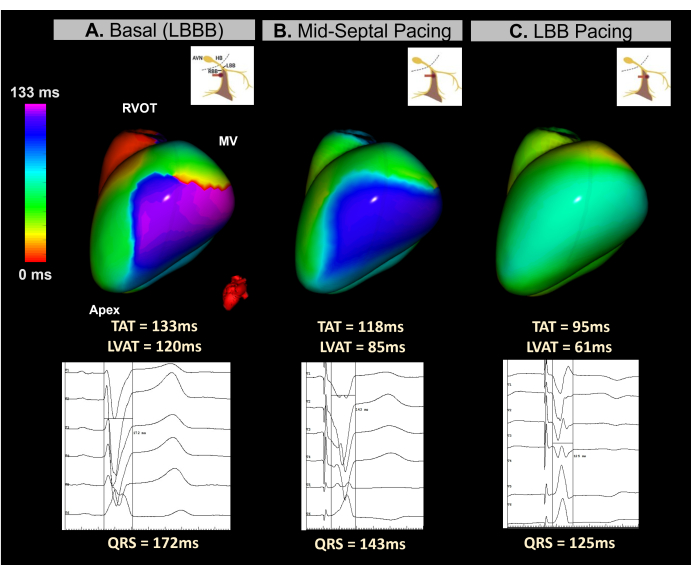
그림 12: 무영상 ECGI를 사용한 전도 시스템 페이싱을 통한 CRT의 비침습적 평가. (A) 환자 기준선 리듬. ECGI 맵(좌측-측면 보기)은 좌심실 측벽의 지연된 활성화 영역(보라색)을 나타내며, TAT는 133ms로 심실 비동기화(ventricular dyssynchrony)를 시사합니다. 이는 LBBB의 일반적인 넓은 QRS 복합체(172ms)를 표시하는 기준선 ECG에 해당합니다. (B) LBBP 리드의 이식 중 중간 단계(중격 페이싱). 비침습적 맵은 LV의 지연된 영역의 부분적인 보정을 보여주며, 색상이 자주색에서 파란색으로 바뀝니다. 이는 QRS 복합 지속 시간의 감소를 동반합니다. (C) 나사 가공 과정에서 LBBP 리드의 최종 위치. 이 지도는 지연된 영역의 완전한 보정을 보여주며, 색상이 보라색에서 녹색으로 전환되어 양쪽 심실의 동시 활성화를 나타냅니다. 약어: LBBB: 왼쪽 번들 분기 블록, LBB: 왼쪽 번들 분기, RVOT: 오른쪽 심실 유출로, MV: 승모판막, TAT: 총 활성화 시간. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
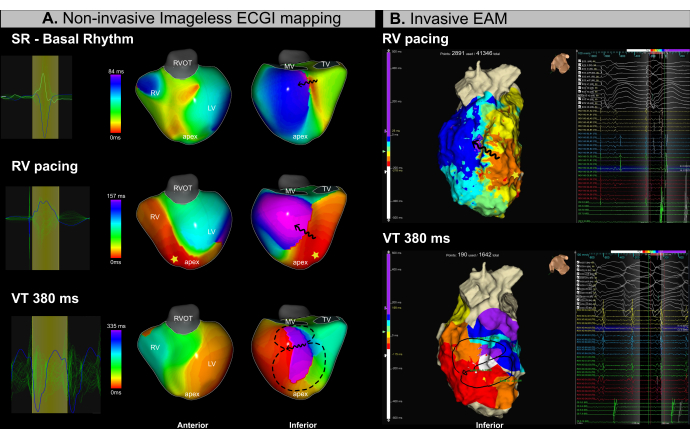
그림 13: 무영상 ECGI를 사용한 VT 지협의 비침습적 평가. (A) VT 절제 절차 중 무이미지 ECGI 매핑은 좌심실의 하부-기저 및 하내측 영역에서 부정맥 기질과 VT 지협을 식별합니다. 첫 번째 행은 부비동 리듬, 중간 행은 RV 정점 페이싱, 맨 아래 행은 VT에 해당합니다. (B) VT 절제 절차 중에 얻은 침습적 EAM은 ECGI에 의해 식별된 동일한 영역에서 등시성 활성화 매핑을 보여줍니다. 맨 위 행은 RV 정점 페이싱에 해당하고 맨 아래 행은 VT를 나타냅니다. 약어: RV: 우심실, LV: 좌심실, SR: 부비동 리듬, RVOT: 우심실 유출로, MV: 승모판막, TV: 삼첨판 판막. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 방법론적 설명은 CT 또는 MRI와 같은 시술 전 심장 영상 없이 카테터 절제 및 CRT와 같은 다양한 전기생리학적 절차를 지원할 수 있는 비침습적, 단일 비트 및 실시간 ECGI 접근법의 임상적 유용성을 강조합니다 15,17,31,32 이 보고서에서 Imageless ECGI는 임상 채택을 촉진할 수 있는 주요 기술적 특징을 보여줍니다. ECGI는 이미 광범위한 부정맥 19,33,34,35,36에 걸쳐 심장 매핑을 위한 강력한 도구임이 입증되었지만, 계속해서 몇 가지 임상적 및 기술적 과제에 직면해 있습니다 13,14.
고전적인 ECGI 시스템은 ECGI 전극이 9,10,12,37,38 위치에 있는 상태에서 심장 매핑과 같은 날에 CT 스캔이 필요합니다. 이 접근 방식은 CT 스캔 분할(심장 및 전극)의 필요성으로 인해 추가 시간이 추가되어 초기 ECGI 맵의 생성이 약 1-3시간 지연됩니다. 대조적으로, 이 보고서에 제시된 이미지 없는 ECGI 시스템은 고밀도 어레이 전극을 사용하여 흉부의 적외선 3D 스캔을 활용하며, 이는 시술 몇 분 전 또는 의료 상담 중에 수행할 수 있습니다15,17. 이 시스템은 흉곽 전극을 자동으로 분할하고 환자의 심장 형상을 추정하여 비침습적 심장 매핑 프로세스를 간소화하고 환자의 도착과 첫 번째 ECGI 맵의 가용성 사이의 시간을 크게 단축합니다. 이미지 없는 ECGI 접근 방식에 대한 이전 검증은 추정된 심장 기하학을 사용하면 오류가 최소화되어 비침습적 지도의 정확성을 유지한다는 것을 보여주었습니다. 심방세동 환자에서는 기하학적 변환(geometric translations)을 사용하더라도 추정된 심장 기하학적 구조와 실제 심장 기하학적 구조에서 파생된 ECGI 신호 간에 강한 상관관계가 관찰되었다15. 복합 심방 빈맥과 같은 일반 부정맥의 경우, EAM과의 비교는 관련된 심실을 식별하고, 기전(국소 또는 재진입)을 결정하고, 절제 대상을 추론하는 데 있어 높은 정확도를 보여주었습니다31. VT의 경우, 이 접근법은 부비동 리듬(SR)39 동안 VT 협부 영역으로 작업자를 안내하는 것으로 평가되었으며, 이는 1차 예방에서 VT 위험이 있는 환자를 식별할 수 있는 잠재력을 보여줍니다. 또한, 관상동동 페이싱 동안, 특히 초기 및 후기 활성화 부위에서 이미지가 없는 ECGI와 EAM 활성화 맵 사이의 강한 지역적 일치가 관찰되었습니다40.
CRT에서 12-리드 ECG의 실시간 형태학적 변화는 일반적으로 리드 이식 중 재동기화를 확인하는 데 사용되며, 특히 LBB 영역에 도달할 때까지 중격 리드 배치의 다양한 단계에서 ECG를 평가하는 CSP 절차에서 사용됩니다. 그러나 발표된 ECG 알고리즘은 종종 복잡하고 간에 상당한 차이점을 보이며 경우에 따라 임상 실습에서 구현하기 어렵습니다 41,42,43. 아마도 이러한 복잡성으로 인해 환자가 심장 재동기화에 반응할지 여부를 안정적으로 예측할 수 있는 좌다발 분기 페이싱(LBBP)에 대한 특정 심전도 매개변수가 일관되게 확인되지 않았습니다. 실시간 무영상 ECGI 접근법은 리드 이식 전반에 걸쳐 간단하고 상세한 비트별 매핑을 제공하며, CRT 적응증32 또는 AV 블록44 환자에서 입증된 바와 같이 좌심실 활성화 시간과 같은 매개변수를 평가하여 동기화 장애 보정을 평가합니다. 따라서 추가 조사를 통해 실시간 ECGI 매개변수는 잠재적으로 작업자가 리드 주입 위치를 최적화하거나 CRT에 대한 환자 반응을 예측하는 데 도움이 될 수 있습니다.
이 방법론 보고서에서는 실시간 무이미지 ECGI의 잠재력이 제시되었지만, 부정맥 시뮬레이션을 사용하는 다른 새로운 비침습적 매핑 접근 방식도 시술 전 이미징의 필요성을 제거하는 것을 목표로 하고 있습니다. VMAP(Vectorcardiographic Mapping of Arrhythmogenic Probability) 연구는 심실 부정맥 부위를 정확히 찾아내는 데 있어 상당한 지역적 정확도를 보여주었으며45 비PVI 절제46 이상의 AF 드라이버의 위치를 식별하는 데 있어 가능성을 보여줍니다. VMAP는 12리드 ECG를 여러 계산 모델과 함께 사용하여 환자별 기하학적 데이터에 의존하지 않고 부정맥 표적을 식별합니다. 그러나 이 접근 방식은 심방세동과 같은 심방 부정맥에 대해 차선책일 수 있으며, 표면 ECG의 고주파 구성 요소가 부정맥 드라이버를 비침습적으로 식별하는 데 중요합니다. 이러한 구성 요소는 일반적으로 후방 및 전방-외측 표면(27)의 전극에 의해 포착되며, 이는 임상 실습에서 사용되는 표준 12-리드 ECG에 표시되지 않습니다.
추가 임상 조사의 필요성에도 불구하고 실시간 무영상 ECGI는 광범위한 부정맥에 대한 비침습적 심장 매핑을 위한 유용한 도구가 될 수 있는 잠재력을 가지고 있습니다. 병원 환경에서 방법론적 단순성과 간소화된 환자 워크플로를 통해 임상의는 더 많은 임상 데이터를 수집할 수 있으며, 이는 환자 결과와 미래의 기술 발전을 모두 개선할 수 있습니다. 결론적으로, 비침습적 심장 매핑의 미래는 일상적인 상담에서 전기 생리학적 절차 중 실시간 매핑에 이르기까지 일상적인 임상 실습에 더 빠르고 원활하게 통합할 수 있도록 하는 완전한 이미지 없는 접근 방식으로 발전하는 데 있습니다.
공개
JRP, BPS, JSC, IHR, RM, CF, EZ, JM, DL, FA, MSG 및 AMC는 Corify Care SL로부터 명예 표창을 받았습니다. AMC, MSG 및 FA는 Corify Care SL의 공동 창립자이며 JRP, BPS, JSC, IHR, JM, DL, JBG, FA, LM, MSG 및 AMC는 주주입니다. TFA는 Biosense-Webster로부터 연구 보조금을 받았습니다. IRL은 Abbott와 Biosense-Webster로부터 강사 및 컨설턴트로 명예 훈장을 받았습니다. APS는 Bisosense-Webster, Abbott 및 Boston-Scientific으로부터 연사 및 컨설턴트 표창을 받았습니다. JMT는 Abbott, Boston-Scientific 및 Medtronic에서 강사 및 컨설턴트로 표창을 받았습니다. EA는 Biosense-Webster와 Bayer로부터 연사 및 컨설턴트 표창을 받았습니다. LM은 Boston-Scientific, Abbott, Johnson&Johnson 및 Medtronic의 컨설턴트, 강사 및 자문 위원회로서 사례생을 보고하고 있으며, Galgo Medical SL의 주주입니다. JBG는 Microport CRM 및 Abbott의 컨설턴트 및 연사로서 사례생을 보고하며, Abbott의 펠로우십에 대한 무제한 보조금 지원을 제공합니다. MPL은 메드트로닉(Medtronic)으로부터 명예 연사 표창을 받았습니다.
감사의 말
이 연구는 보조금 계약 SAVE-COR No 220385에 따라 EIT(European Institute of Innovation and Technology)와 Generalitat Valenciana(EFICACIA)의 자금 지원을 받은 CIAICO/2022/020 보조금에서 자금을 지원받았습니다. 추가 지원은 발렌시아나 총독부(보조금 CIAPOS/2021/238, ACIF/2021/205, CIBEFP/2022/9), MCIN/AEI/10.13039/501100011033 및 ESF Investing in Your Future(보조금 RYC2018-024346-I), Instituto de Salud Carlos III(보조금 CIBERCV16 CB16/11/00354) 및 스페인 카탈루냐(보조금 2021_SGR_01350, SGR21/GENCAT)에서 제공했습니다. 우리는 또한 CERCA 프로그램/카탈루냐 총대(Generalitat de Catalunya)의 지원에 감사드립니다. Río Hortega 계약 CM22/00107 [Instituto de Salud Carlos III (ISCIII)를 통해 MPL 자금 지원(2023-2025); Fondo Social Europeo (FSE)]. 저자는 비서 업무를 지원해 준 Neus Portella와 Sheila Marco, 그리고 Hospital Clínic de Barcelona, Hospital General Universitario Gregorio Marañón, Hospital Universitari i Politècnic La Fe에서 임상 지원을 해준 의료 및 간호 팀에게 감사를 표합니다. 또한 스페인 마드리드에 위치한 Corify Care SL의 Almudena Albertos와 Universitat Politecnica de Valencia의 Arantxa Carrasco 덕분입니다.
자료
| Name | Company | Catalog Number | Comments |
| ACORYS Mapping System | Corify Care SL | ACORYS | Imageless ECGI system |
| ACORYS 3D Scan Software | Corify Care SL | ACSCAN | 3D scanner app |
| ACORYS Amplifier | Corify Care SL | ACAMP | Biopotential amplifier |
| ACORYS Sensor Vest | Corify Care SL | ACSEN | Sensor vest, 4 components (Front Right, Front Left, Back Right and Back Left) |
| ACORYS Software | Corify Care SL | ACSOF, version 1.2 | Imageless ECGI software |
| Affera mapping system | Medtronic | AFR-00003 | |
| CADENCE Adult mulifuntion defibrillation electrodes | Cardinal Health | 22660R | |
| Catheter extension cable | Medtronic | AFR-00006 | |
| Desktop or portable PC workstation | Any | Windows 11 as the operating system | Imageless ECGI workstation. The processor must be at least an Intel i7 from the 2020 generation or newer. It requires a minimum of 32 GB of RAM and 500 GB of SSD storage. Additionally, a compatible version of .NET Framework must be installed. An internet connection is not required. |
| Dynamic XT 10E 2 5 2 MM Diagnostic Catheter | Boston Scientific | M0042011010 | |
| EP-TRACER 2 ProCart | Cardiotek | The system includes several components provided by the company | |
| External Defibrillator Monitor | PHILLIPS | Efficia DFM100 | |
| Fentanyl | Kern pharma | 1004000143-03 | |
| Heparine | Reig Jofre | 608737.4 O | |
| HexaFlow irrigation pump | Medtronic | AFR-00005 | |
| HexaGen RF generator | Medtronic | AFR-00004 | |
| HexaPulse PF generator | Medtronic | AFR-00008 | |
| INTELLAMAP ORIO Mapping Catheter | Boston Scientific | M004RC64S0 | |
| IntellaNav StablePoint Ablation Catheter | Boston Scientific | M004ERFSDS96200 | |
| iPad mini | Apple | 6th generation A2567 | 3D scanner platform |
| iPadOS | Apple | 15.3 or superior | 3D scanner platform |
| Isolated Ethernet Cable | Corify Care SL | ACNET | Ethernet cable |
| Isoprenaline | Reig Jofre | 7227007 | |
| Left Connector Cable | Corify Care SL | ACCAB_L | Left cables |
| Location Reference Patch Kit | Boston Scientific | M004RAPATCH20 | |
| Location reference patch kit | Medtronic | AFR-00007 | |
| MetriQ Tubing Set | Boston Scientific | M0041170 | |
| Midazolam | Normon | X5XF1 | |
| Physiological Saline Solution for Irrigation | Fabrenius Kabi | br14801 | |
| Propofol | B Braun | 855437.9 OH | |
| Remifentanil | Kern pharma | 672786.7 | |
| RHYTHMIA HD | Boston Scientific | M004 RBINSTALL2ROW0 | |
| Right Connector Cable | Corify Care SL | ACCAB_R | Right cables |
| Single Patient Use ECG Electrodes | Ambu | M-00-S | |
| Sphere-9 mapping and ablation catheter | Medtronic | AFR-00001 | |
| Structure SDK | Structure | 2.2.1 for iOS or superior | 3D scanner platform, infrared structured light camera |
| Structure Sensor Pro | Structure | ST02B. Firmware version 1.2 or superior | 3D scanner platform, infrared structured light camera |
| Sugamadex Teva | Normon | 7340157-OH | |
| Tubing set | Medtronic | AFR-00002 | |
| WorkMate Claris System | Abbott | H700123 | |
| X-Ray C-Arm | Phillips | The system includes several components provided by the company |
참고문헌
- Narayan, S. M., John, R. M. Advanced electroanatomic mapping: current and emerging approaches. Curr Treat Options Cardiovasc Med. 26 (4), 69-91 (2024).
- Raiman, M., Tung, R. Automated isochronal late activation mapping to identify deceleration zones: rationale and methodology of a practical electroanatomic mapping approach for ventricular tachycardia ablation. Comput Biol Med. 102, 336-340 (2018).
- Guichard, J.-B. et al. Substrate mapping for ventricular tachycardia ablation through high-density whole-chamber double extra stimuli. JACC Clin Electrophysiol. 10 (7), 1534-1547 (2024).
- Takigawa, M. et al. Are wall thickness channels defined by computed tomography predictive of isthmuses of postinfarction ventricular tachycardia. Heart Rhythm. 16 (11), 1661-1668 (2019).
- Vázquez-Calvo, S. et al. Noninvasive detection of slow conduction with cardiac magnetic resonance imaging for ventricular tachycardia ablation. Europace. 26 (2), euae025 (2024).
- Sánchez-Somonte, P. et al. Scar channels in cardiac magnetic resonance to predict appropriate therapies in primary prevention. Heart Rhythm. 18 (8), 1336-1343 (2021).
- Roca-Luque, I. et al. Post-ablation cardiac magnetic resonance to assess ventricular tachycardia recurrence (PAM-VT study). Eur Heart J Cardiovasc Imaging. 25 (2), 188-198 (2023).
- Roca-Luque, I. et al. Ventricular scar channel entrances identified by new wideband cardiac magnetic resonance sequence to guide ventricular tachycardia ablation in patients with cardiac defibrillators. Europace. 22 (4), 598-606 (2020).
- Rudy, Y., Burnes, J. E. Noninvasive electrocardiographic imaging. Ann Noninvasive Electrocardiol. 4 (3), 340-359 (1999).
- Haissaguerre, M. et al. Noninvasive panoramic mapping of human atrial fibrillation mechanisms: a feasibility report. J Cardiovasc Electrophysiol. 24 (6), 711-717 (2013).
- Tsyganov, A. et al. Mapping of ventricular arrhythmias using a novel noninvasive epicardial and endocardial electrophysiology system. J Electrocardiol. 51 (1), 92-98 (2018).
- Pereira, H., Niederer, S., Rinaldi, C. A. Electrocardiographic imaging for cardiac arrhythmias and resynchronization therapy. Europace. 22 (10), 1447-1462 (2020).
- Duchateau, J. et al. Performance and limitations of noninvasive cardiac activation mapping. Heart Rhythm. 16 (3), 435-442 (2019).
- Cluitmans, M. et al. Validation and opportunities of electrocardiographic imaging: from technical achievements to clinical applications. Front Physiol. 9, 1305 (2018).
- Molero, R., González-Ascaso, A., Climent, A. M., Guillem, M. S. Robustness of imageless electrocardiographic imaging against uncertainty in atrial morphology and location. J Electrocardiol. 77, 58-61 (2023).
- Rodrigo, M. et al. Noninvasive assessment of complexity of atrial fibrillation: correlation with contact mapping and impact of ablation. Circ Arrhythm Electrophysiol. 13 (3), e007700 (2020).
- Invers-Rubio, E. et al. Regional conduction velocities determined by noninvasive mapping are associated with arrhythmia-free survival after atrial fibrillation ablation. Heart Rhythm. 21 (9), 1570-1580 (2024).
- Fambuena-Santos, C. et al. AF driver detection in pulmonary vein area by electrocardiographic imaging: relation with a favorable outcome of pulmonary vein isolation. Front Physiol. 14, 1057700 (2023).
- San Antonio, R. et al. Optimized single-point left ventricular pacing leads to improved resynchronization compared with multipoint pacing. Pacing Clin Electrophysiol. 44 (3), 519-527 (2021).
- Zacur, E. et al. MRI-Based Heart and Torso Personalization for Computer Modeling and Simulation of Cardiac Electrophysiology. Imaging for Patient-Customized Simulations and Systems for Point-of-Care Ultrasound. 10549, Springer, Cham (2017).
- Bell, J. B., Tikhonov, A. N., Arsenin, V. Y. Solutions of ill-posed problems. Math Comput. 32 (144), 1320 (1978).
- Oster, H. S., Taccardi, B., Lux, R. L., Ershler, P. R., Rudy, Y. Electrocardiographic imaging: noninvasive characterization of intramural myocardial activation from inverse-reconstructed epicardial potentials and electrograms. Circulation. 97 (15), 1496-1507 (1998).
- Figuera, C. et al. Regularization techniques for ECG imaging during atrial fibrillation: a computational study. Front Physiol. 7, 466 (2016).
- Molero, R. et al. Improving electrocardiographic imaging solutions: a comprehensive study on regularization parameter selection in L-curve optimization in the atria. Comput Biol Med. 182, 109141 (2024).
- Hernández-Romero, I. et al. Local conduction velocity estimation during wavefront collisions and reentrant scenarios. 2022 Computing in Cardiology (CinC). Tampere, Finland (2022).
- Rodrigo, M. et al. Technical considerations on phase mapping for identification of atrial reentrant activity in direct- and inverse-computed electrograms. Circ Arrhythm Electrophysiol. 10 (9), e005008 (2017).
- Guillem, M. S. et al. Noninvasive localization of maximal frequency sites of atrial fibrillation by body surface potential mapping. Circ Arrhythm Electrophysiol. 6 (2), 294-301 (2013).
- Pedrón-Torrecilla, J. et al. Noninvasive estimation of epicardial dominant high-frequency regions during atrial fibrillation. J Cardiovasc Electrophysiol. 27 (4), 435-442 (2016).
- Tzeis, S. 2024 European Heart Rhythm Association/Heart Rhythm Society/Asia Pacific Heart Rhythm Society/Latin American Heart Rhythm Society expert consensus statement on catheter and surgical ablation of atrial fibrillation. Europace. 26 (4), euae043 (2024).
- Parreira, L. et al. Noninvasive three-dimensional electrical activation mapping to predict cardiac resynchronization therapy response: site of latest left ventricular activation relative to pacing site. Europace. 25 (4), 1458-1466 (2023).
- Reventos-Presmanes, J. et al. Noninvasive electrocardiographic imaging for the characterization of complex atrial tachyarrhythmias. Europace. 25 (Supplement_1), euad122.229 (2023).
- Regany, M. et al. ECG imaging as a real time tool to guide left bundle branch pacing implant in patients with left bundle branch block and resynchronization therapy indication. Europace. 26 (Supplement_1), euae102.491 (2024).
- Rudy, Y. Noninvasive electrocardiographic imaging of arrhythmogenic substrates in humans. Circ Res. 112 (5), 863-874 (2013).
- Shah, A. J. et al. Validation of novel 3-dimensional electrocardiographic mapping of atrial tachycardias by invasive mapping and ablation. J Am Coll Cardiol. 62 (10), 889-897 (2013).
- Graham, A. J. et al. Evaluation of ECG imaging to map hemodynamically stable and unstable ventricular arrhythmias. Circ Arrhythm Electrophysiol. 13 (2), e007377 (2020).
- Pujol-Lopez, M. et al. Conduction system pacing vs biventricular pacing in heart failure and wide QRS patients. JACC Clin Electrophysiol. 8 (11), 1431-1445 (2022).
- Rudy, Y., Lindsay, B. D. Electrocardiographic imaging of heart rhythm disorders. Cardiac Electrophysiol Clin. 7 (1), 17-35 (2015).
- Haissaguerre, M. et al. Driver domains in persistent atrial fibrillation. Circulation. 130 (7), 530-538 (2014).
- Reventos-Presmanes, J. et al. Noninvasive assessment of the ventricular tachycardia isthmus during sinus rhythm. Europace. 26 (Supplement_1), euae102.687 (2024).
- Ros, S. et al. Imageless electrocardiographic imaging for atrial electrophysiological characterization: a validation study. Europace. 26 (Supplement_1), euae102.690 (2024).
- Wu, S. et al. Left bundle branch pacing for cardiac resynchronization therapy: nonrandomized on-treatment comparison with his bundle pacing and biventricular pacing. Can J Cardiol. 37 (2), 319-328 (2021).
- Pujol-López, M. et al. Stepwise application of ECG and electrogram-based criteria to ensure electrical resynchronization with left bundle branch pacing. Europace. 25 (6), euad128 (2023).
- Zhu, K., Chang, D., Li, Q. Which is more likely to achieve cardiac synchronization: left bundle branch pacing or left ventricular septal pacing. Front Cardiovasc Med. 9, 845312 (2022).
- Martinez-Perez, M. et al. Real-time assessment of LV synchrony in AV block population undergoing LBB pacing using ECG imaging. Europace. 26 (Supplement_1), euae102.487 (2024).
- Krummen, D. E. et al. Forward-solution noninvasive computational arrhythmia mapping: the VMAP study. Circ Arrhythm Electrophysiol. 15 (9) (2022).
- Gu, K. et al. Ablation of non-pulmonary vein atrial fibrillation drivers identified by vMap in addition to pulmonary vein isolation improves procedural outcomes. 29th annual AF Symposium 2024. https://cdn.prod.website-files.com/60f9aad2cca70843f8fa048e/660b432d93bbdc
942469cc1e_AF%20Symposium%202024%20-%20PVI%20Outcomes.pdf (2024).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유