滴定法简介
Overview
资料来源: 实验室的博士怡北东东向谭 — — 为科学、 技术和研究机构
滴定法是一种常用的技术,用于定量确定未知确定分析物浓度。1-4它也被称为卷测定容量分析滴定中至关重要。有许多类型的滴定基于他们所利用的反应类型。最常见的类型是酸碱中和滴定和氧化还原滴定。5-11
在典型的滴定过程中,滴定滴定标准溶液逐渐应用与分析物在锥形瓶未知浓度与反应。酸碱中和滴定 pH 指示剂通常需要添加在分析物溶液中指示滴定终点。12而不是添加 ph 值指标,ph 值也可以进行监测在滴定过程中使用 pH 计和终结点以图形方式由 pH 滴定曲线。记录在终点滴定剂体积可以用于计算基于反应化学计量学分析物的浓度。
提出了一种在这个视频的酸碱中和滴定,滴定剂是标准化的氢氧化钠溶液和被测物是国内醋。醋是酸性的液体,常用的作为烹饪调味品或香料。醋主要由乙酸 (CH3COOH) 和水组成。商业醋乙酸含量变化很大,这次实验的目标是确定的商业醋乙酸含量滴定法。
Principles
醋中的醋酸测定基于酸碱滴定法的原理。氢氧化钠和 CH3羧基之间的反应,如方程 1所示:
CH3COOH(aq) + NaOH(aq) → H2O(l) + 代表3CO2(aq) (1)
标准化的 NaOH 溶液逐步加入醋的未知的乙酸浓度直到到达结束点。在酸碱滴定中,ph 值可以被绘制为滴定液添加体积的函数。拐点在曲线上,有酸、 碱溶液中的化学计量比等量的点称为等价点。大多数的酸和碱是无色的没有明显的反应,等价点发生的。观察时已达到等值点,ph 值指示符会添加。终结点不是等价点但 pH 指示剂变色点。它是重要的是选择适当的 pH 指示剂,这样的结束点是尽可能的尽可能滴定等当点。
这种反应的终点,共轭基地代表3CO2是偏碱性。酚酞指示剂有 8.3 — — 10.0,工作 ph 值范围是无色酸性溶液和 pH 8.2 以上洋红色。因此,酚酞是首选的指标,因为它将从无色变为粉红色,在这种情况。执行实验,时,最好保持 pH 指示剂的浓度低,因为自己的 ph 值指标通常与基地反应的弱酸。
添加到结束点处的标准化 NaOH 溶液的体积可以用于计算基于上述方程的化学计量学的醋酸的摩尔浓度。在这个实验中,氢氧化钠滴定是强碱性和分析物乙酸是一种弱酸。
在执行之前的实验,它是重要的是考虑 NaOH 的吸湿性质。此属性需要其解决方案,要规范与稳定的主要标准,如邻苯二甲酸氢钾 (KHC8H4O4)。确切的摩尔浓度的氢氧化钠溶液然后可以准确地确定标准化以后。主要酸标准与氢氧化钠反应方程 2所示:
KHC8H4O4(aq) + NaOH(aq) → H2O(l) + NaKC8H4O4(aq) (2)
下面一节中提出了详细的分步滴定协议。
Procedure
1.标准化氢氧化钠与钾 Hydrogenphthalate (KHC8H4O4)
- 若要开始,必须标准化滴定剂,氢氧化钠。备一只股票 NaOH 溶液溶解约 4 g 的 NaOH 颗粒在去离子水 100 毫升。请注意,氢氧化钠是有害的化学物质,其腐蚀皮肤,刺激眼、 小心谨慎并穿适当的个人防护装备 (PPE),避免皮肤或眼睛接触。
- 使 1:10 稀释的氢氧化钠溶液通过添加一瓶 500 毫升的股票氢氧化钠溶液 25 毫升。氢氧化钠吸收二氧化碳。它是重要的是防止这种情况,从而确保使用煮、 去离子水,烘箱干燥瓶,并迅速盖瓶。使解决方案与去离子的水和奶昔混合达 250 毫升。
- 干 4 — — 5 克的主要标准酸,KHC8H4O4 4 h 在干燥炉 110 ° c,然后冷却 1 h 干燥器中的固。
- 解散约 4 克干 KHC8H4O4在 250 毫升的去离子水。记录质量准确。计算 KHC8H4O4溶液的摩尔浓度。
- 进入干净和干燥的锥形瓶吸管 KHC8H4O4 25 毫升。加入 2 滴酚酞,并轻轻地旋转,拌匀。请注意,酚酞毒性和刺激性,小心避免皮肤或眼睛接触。
- 50 毫升滴定管和漏斗用洗涤剂和水彻底清洗。冲洗用水滴管和冲洗用去离子水的 3 倍。冲洗用稀释的氢氧化钠溶液 3 x,确保 NaOH 才子的整个内表面滴管和排泄废物通过提示。在 ringstand 上装载洗过的滴定管钳钳夹并确保它垂直站立。
- 用稀释的氢氧化钠溶液填充干净滴管。应该指出的是稀释的氢氧化钠用量不需要确切地在零标记,但应该是内规模和足够的至少一个滴定。空气泡沫可能会影响阅读量的准确性。仔细检查为气泡,滴管,轻轻地敲滴管免费他们和打开旋塞阀,让几毫升的滴定液流动通过和同时释放所有残存的空气。通过查看底部的半月板后 10 美国记录这个初始卷读卷。要注意有效数字的阅读。在 mL 中记录到两位小数的值。
- 将锥形烧瓶含有邻苯二甲酸氢钾 (KHC8H4O4) 下滴定管和适当调整高度的滴管。通过慢慢地在 1-2 毫升增量使用一只手来控制流量的调节旋塞阀,和其他旋转烧瓶中添加 NaOH 溶液滴定 KHC8H4O4溶液。
- 接近终点时开始添加滴定剂滴一滴。终结点被到达时溶液变成一个微弱,宿存的粉红色。在滴管中记录稀氢氧化钠的最终数量。
- 重复的滴定法至少两次再获得一致的数据。计算稀释的氢氧化钠溶液的摩尔浓度。
2.醋的标准化的氢氧化钠溶液滴定法
- 氢氧化钠溶液现在标准化,可以作为滴定剂用于分析醋。为了减少辛辣味道的醋,稀释 10 毫升的醋液测试在 1:10 到 100 毫升总体积定量配给。
- 移液器的分析物,对清洁和干燥的锥形瓶 (注意到作为 VA) 25 毫升。加入 2 滴酚酞。
- 用标准化的 NaOH 溶液从程序中的第一个部分填充滴管。记录滴定剂 (V1) 初始音量。
- 逐步将标准化的 NaOH 溶液添加到醋。当滴定剂体积接近预期值时,调整旋塞阀添加滴定剂滴一滴。继续旋转瓶用一只手并保持另一只手准备关闭旋塞阀。一旦被分析物溶液变为淡粉红色,旋流几秒钟以查看是否会褪色。如果颜色仍然存在,滴定到达的结束点。记录滴定剂 (V1') 的最终数量。如果溶液颜色褪色,添加滴定剂的一更多的滴。洗的用洗瓶滴管的尖底。收集在洗过的混合物,看着颜色改变的分析物解。继续直到终点滴定。记录所需的滴定液的量 (Vt1 = V1' V1)。
- 重复至少两次直到在 0.1 毫升的另一个内的三个和谐值滴定获得 (Vt2和 Vt3)。
- 计算滴定剂体积使用三个不同的滴定中获得的三个值的平均值: Vt = (Vt1 + Vt2 + Vt3) / 3。醋中的醋酸的摩尔浓度可以利用方程 3从而计算。
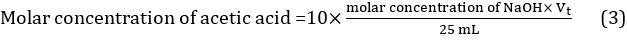
Results
| 单位 | 审判 1 | 审判 2 | 试验 3 | |||
| 体积的稀释的醋酸 (VA) | 毫升 | 25.00 | ||||
| 摩尔浓度的氢氧化钠 (cNaOH) | mol/L | 0.09928 | ||||
| 初始的滴管的 NaOH 看书 | 毫升 | 0.10 | 0。 05 | 1.20 | ||
| 最后滴管的 NaOH 看书 | 毫升 | 18.75 | 18.60 | 19.80 | ||
| 配发的 NaOH 的量 | 毫升 | 18.65 | 18.55 | 18.60 | ||
| 量平均为 NaOH 配发 (Vt) | 毫升 | 18.60 | ||||
表 1。滴定结果。
计算示例:
大规模的 KC8H5O4 = 4.0754 g
摩尔质量的 KC8H5O4 = 204.22 g/mol
8H5O KC4 25.00 毫升标准溶液中的摩尔数 =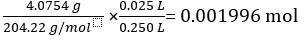
根据方程 2,
稀释的氢氧化钠溶液的浓度 =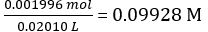
摩尔的氢氧化钠配发 = NaOH × 平均体积的配发的氢氧化钠浓度 = 0.09928 mol/L × 18.60 毫升 = 是 1.847 × 10-3 mol
根据方程 1,
CH3COOH 25.00 毫升稀释的醋的摩尔数 = 1.847 × 10-3 mol
浓度的稀释的醋 =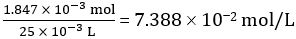
因此未稀释的醋浓度 = 10 × 7.388 102 mol/L = 0.7388 mol/L
上述步骤介绍来说明计算过程;我们可以简单地套用方程 3 以得到高浓度的未稀释的醋,一步到位。
因此 1.000 L 未稀释的醋的包含 CH3COOH 0.7388 的 mol。
CH3COOH 卷 =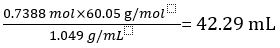
醋的体积分数 = 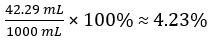
Application and Summary
滴定法是一种重要的化学方法,经常应用在当前化学研究。例如,酸碱滴定被用于确定胺或羟值的示例。胺值定义为毫克 KOH 相当于一克的样品中的胺含量的数目。若要确定羟值,分析物是首先乙酰化使用的醋酸酐,然后用 KOH 滴定。KOH 毫克的大量然后对应于羟基在一克的样品。13另一个例子是温克勒测试,特定类型的氧化还原滴定法用于确定为水质量研究水中溶解氧的浓度。溶解的氧被减少使用硫酸锰 (II),然后与碘化钾来制备碘的反应。因为碘释放的氧含量成正比,氧浓度测定滴定碘硫代硫酸盐用淀粉指标。14
此外,除了基本的化学研究中的应用,滴定法已在工业和日常使用中被广泛采用。在生物柴油产业,首先必须瓦解废植物油 (WVO) 要删除通常的反应,使不受欢迎的肥皂的游离脂肪酸。WVO 部分是用一个基础来确定样本的酸度,因此可以适当地瓦解剩余批次滴定。15本笃十六世的方法,量化尿葡萄糖水平,试验是在医疗保健中显示滴定的重要性的另一个例子。在此滴定,铜离子被减少到亚铜离子由葡萄糖,然后反应与硫氰酸钾,形成白色沉淀,指示该终结点。16
References
- Llc, B. Titration: Ph Indicator, Thermometric Titration, Nonaqueous Titration, Equivalence Point, Acid-Base Titration, Amperometric Titration. General Books LLC, (2010).
- Jacobsen, J. J., Jetzer, K. H., Patani, N., Zweerink, G. & Zimmerman, J. Titration Techniques. J. Chem. Educ. 72, 612, doi:10.1021/ed072p612 (1995).
- Harris, D. C. Quantitative Chemical Analysis. 8th edn, W. H. Freeman, (2010).
- Mattock, G., Taylor, G. R. & Paul, M. A. pH Measurement and Titration. J. Electrochem. Soc. 110, 31C, doi:10.1149/1.2425702 (1963).
- De Levie, R. Aqueous Acid-base Equilibria and Titrations. Oxford University Press, (1999).
- Cannan, R. K. The Acid-Base Titration of Proteins. Chem. Rev. 30, 395-412, doi:10.1021/cr60097a005 (1942).
- Michalowski, T. & Lesiak, A. Acid-Base Titration Curves in Disproportionating Redox Systems. J. Chem. Educ. 71, 632, doi:10.1021/ed071p632 (1994).
- Waser, J. Acid-base Titration and Distribution Curves. J. Chem. Educ. 44, 274, doi:10.1021/ed044p274 (1967).
- Gorbikova, E. A., Vuorilehto, K., Wikström, M. & Verkhovsky, M. I. Redox Titration of All Electron Carriers of Cytochrome c Oxidase by Fourier Transform Infrared Spectroscopy. Biochemistry 45, 5641-5649, doi:10.1021/bi060257v (2006).
- Silverstein, T., Cheng, L. & Allen, J. F. Redox Titration of Multiple Protein Phosphorylations in Pea Chloroplast Thylakoids. Biochim. Biophys. Acta (BBA)-Bioenerg. 1183, 215-220, doi:10.1016/0005-2728(93)90022-8 (1993).
- Lenghor, N., Jakmunee, J., Vilen, M., Sara, R., Christian, G. D. & Grudpan, K. Sequential Injection Redox or Acid-Base Titration for Determination of Ascorbic Acid or Acetic Acid. Talanta 58, 1139-1144, doi:10.1016/S0039-9140(02)00444-7 (2002).
- Mitchell, P., Moyle, J. & Smith, L. Bromthymol Blue as a pH Indicator in Mitochondrial Suspensions. Eur. J. Biochem. 4, 9-19, doi:10.1111/j.1432-1033.1968.tb00166.x (1968).
- Perkins, E. G. Analyses of Fats, Oils and Derivatives. AOCS press, (1993).
- Spellman, F. R. Handbook of Water and Wastewater Treatment Plant Operations. 2 edn, CRC Press, (2009).
- Purcella, G. Do It Yourself Guide to Biodiesel: Your Alternative Fuel Solution for Saving Money, Reducing Oil Dependency, Helping the Planet. Ulysses Press, (2007).
- Nigam. Lab Manual Of Biochemistry. Tata McGraw-Hill Education (2007).
Tags
跳至...
此集合中的视频:

Now Playing
滴定法简介
General Chemistry
425.7K Views

常见的实验室玻璃器皿和用途
General Chemistry
658.9K Views

溶液和浓度
General Chemistry
275.3K Views

固体和液体的密度测定
General Chemistry
556.9K Views

确定在水溶液中的质量百分组成
General Chemistry
383.8K Views

确定经验公式
General Chemistry
183.8K Views

确定离子化合物的溶度积的规则
General Chemistry
141.6K Views

使用 pH 计
General Chemistry
346.9K Views

理想气体定律
General Chemistry
79.4K Views

平衡常数的分光光度法测定
General Chemistry
158.8K Views

Le Châtelier 原则
General Chemistry
265.8K Views

凝固点降低,以确定一种未知的化合物
General Chemistry
160.8K Views

确定率法律和秩序的反应
General Chemistry
196.4K Views

用焓差扫描量热法测量的变化
General Chemistry
44.8K Views

配合化学物
General Chemistry
91.8K Views
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。