确定率法律和秩序的反应
Overview
资料来源: 实验室的博士尼尔 · 艾布拉姆斯 — — 美国纽约州立大学环境科学与林业学院
所有的化学反应,有定义反应物去产品的进度以特定速度。这一比率可以受温度、 浓度和反应物的物理性能。该速率也包括中间体和过渡态,形成的但是既不是反应物,也不是产品。速率定律在反应中定义的每种反应物的作用,可以用于数学模型进行反应所需的时间。速率方程的一般形式如下所示:
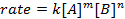
A和B都是不同的分子形态, m和n浓度反应订单, k是速率常数。几乎每个反应的速率变化随着时间的推移,随着反应物的消耗,使有效碰撞不太可能发生。然而,速率常数,任何单一的反应,在给定温度被固定。反应顺序说明了参与反应的分子物种的数量。它是非常重要的是要知道率法,包括速率常数和反应顺序,只可以通过实验确定。在这个实验中,我们将探讨一个方法为确定率法和用它来理解化学的反应的研究进展。
Procedure
1.准备 H2O2稀释
- 股票 3%的双氧水具有浓度 0.882 M.准备 5 稀释从 0.882 M 到 0.176 M (表 1)。准备这些解决方案容积大,但由于溶质是很稀,水卷是加法作准备添加剂。
- 将解决方案放在恒温水浴或离开他们在室温平衡工作台上。20-25 ° C (293-298 K) 温度范围是对这种反应很好。
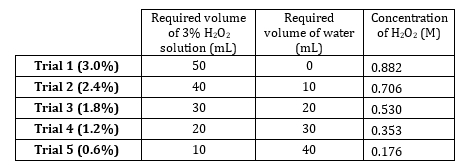
表 1。H2O2使用的解决方案。
2.配制反应釜
- 想确定反应釜容积、 装满水的大测试管子的顶部和 1 孔橡胶塞插入试管直到紧和水推两侧向外和通过的顶部。
Results
Application and Summary
跳至...
此集合中的视频:

Now Playing
确定率法律和秩序的反应
General Chemistry
196.5K Views

常见的实验室玻璃器皿和用途
General Chemistry
659.5K Views

溶液和浓度
General Chemistry
275.6K Views

固体和液体的密度测定
General Chemistry
557.1K Views

确定在水溶液中的质量百分组成
General Chemistry
383.9K Views

确定经验公式
General Chemistry
183.9K Views

确定离子化合物的溶度积的规则
General Chemistry
141.6K Views

使用 pH 计
General Chemistry
347.0K Views

滴定法简介
General Chemistry
425.8K Views

理想气体定律
General Chemistry
79.5K Views

平衡常数的分光光度法测定
General Chemistry
158.9K Views

Le Châtelier 原则
General Chemistry
265.9K Views

凝固点降低,以确定一种未知的化合物
General Chemistry
160.9K Views

用焓差扫描量热法测量的变化
General Chemistry
44.8K Views

配合化学物
General Chemistry
91.8K Views
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。
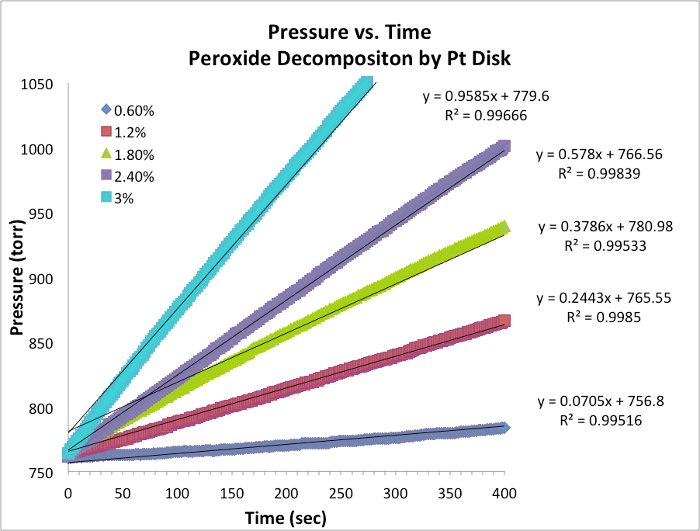
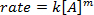 。以自然对数 (ln) 的方程产生一个线性方程
。以自然对数 (ln) 的方程产生一个线性方程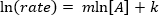 , m,边坡,哪里的反应顺序。
, m,边坡,哪里的反应顺序。