16.9 : Titration of a Polyprotic Acid
A polyprotic acid contains more than one ionizable hydrogen and undergoes a stepwise ionization process. If the acid dissociation constants of the ionizable protons differ sufficiently from each other, then the titration curve for such polyprotic acid generates a distinct equivalence point for each of its ionizable hydrogens. Therefore, titration of a diprotic acid results in the formation of two equivalence points, whereas the titration of a triprotic acid results in the formation of three equivalence points on the titration curve.
Carbonic acid, H2CO3, is an example of a weak diprotic acid. The first ionization of carbonic acid yields hydronium ions and bicarbonate ions in small amounts.
First ionization:
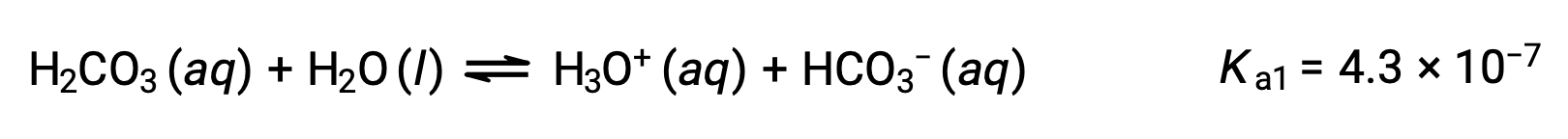
The bicarbonate ion can also act as an acid. It ionizes and forms hydronium ions and carbonate ions in even smaller quantities.
Second ionization:
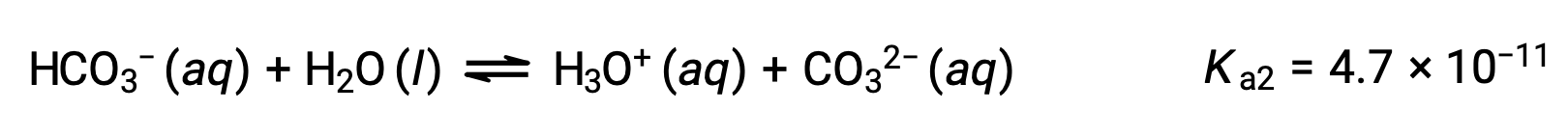
The Ka1 is larger than the Ka2 by a factor of 104. Therefore, when H2CO3 is titrated with a strong base like NaOH, it produces two distinct equivalence points for each ionizable hydrogen.
Phosphoric acid, a triprotic acid, ionizes in three steps:
First ionization:
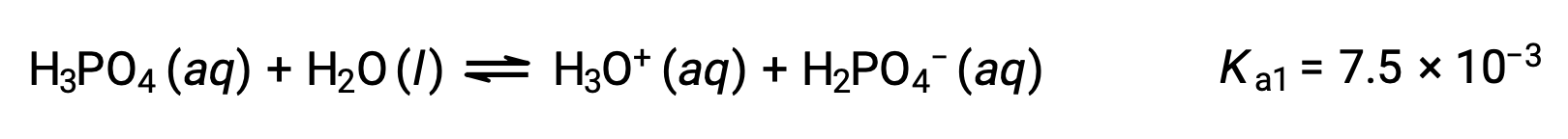
Second ionization:
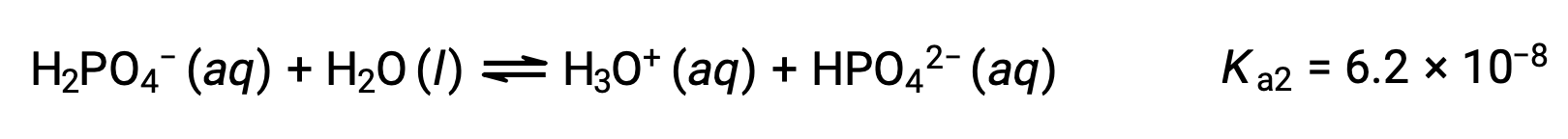
Third ionization:
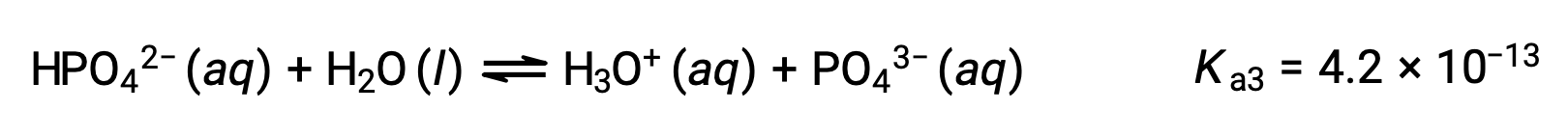
When H3PO4 is titrated with a strong base like KOH, it produces three equivalence points for each ionizable hydrogen. However, as HPO42− is a very weak acid, the third equivalence point is not easily discernible on the titration curve.
This text is adapted from Openstax, Chemistry 2e, Section 14.5: Polyprotic Acids.
Aus Kapitel 16:

Now Playing
16.9 : Titration of a Polyprotic Acid
Säure-Base- und Löslichkeitsgleichgewicht
95.5K Ansichten

16.1 : Gemeinsamer Ioneneffekt
Säure-Base- und Löslichkeitsgleichgewicht
40.8K Ansichten

16.2 : Puffer
Säure-Base- und Löslichkeitsgleichgewicht
163.2K Ansichten

16.3 : Henderson-Hasselbalch-Gleichung
Säure-Base- und Löslichkeitsgleichgewicht
67.9K Ansichten

16.4 : Berechnung von pH-Änderungen in einer Pufferlösung
Säure-Base- und Löslichkeitsgleichgewicht
52.4K Ansichten

16.5 : Wirksamkeit des Puffers
Säure-Base- und Löslichkeitsgleichgewicht
48.3K Ansichten

16.6 : Titrationsberechnungen: Starke Säure - Starke Base
Säure-Base- und Löslichkeitsgleichgewicht
28.9K Ansichten

16.7 : Titrationsberechnungen: Schwache Säure - Starke Base
Säure-Base- und Löslichkeitsgleichgewicht
43.7K Ansichten

16.8 : Indikatoren
Säure-Base- und Löslichkeitsgleichgewicht
47.6K Ansichten

16.10 : Löslichkeits-Gleichgewichte
Säure-Base- und Löslichkeitsgleichgewicht
51.8K Ansichten

16.11 : Faktoren, die die Löslichkeit beeinflussen
Säure-Base- und Löslichkeitsgleichgewicht
32.9K Ansichten

16.12 : Bildung komplexer Ionen
Säure-Base- und Löslichkeitsgleichgewicht
23.0K Ansichten

16.13 : Ausfällung von Ionen
Säure-Base- und Löslichkeitsgleichgewicht
27.4K Ansichten

16.14 : Qualitative Analyse
Säure-Base- und Löslichkeitsgleichgewicht
20.0K Ansichten

16.15 : Säure-Base-Titrationskurven
Säure-Base- und Löslichkeitsgleichgewicht
126.0K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten