Method Article
High Content Screening in Neurodegenerative Diseases
In diesem Artikel
Zusammenfassung
Wir beschreiben eine Methode kombiniert automatisierte Zellkultur mit High-Content-Bildgebung zur Visualisierung und Quantifizierung von mehreren zellulären Prozessen und Strukturen, in einem High-Throughput Weise. Solche Methoden können in der weiteren funktionellen Annotation von Genomen Hilfe sowie zu identifizieren Krankheit Gen-Netzwerke und mögliche Angriffspunkte für Medikamente.
Zusammenfassung
Die funktionellen Annotation von Genomen, Aufbau von molekularen Netzwerken und neuartige Drug-Target-Identifizierung, sind wichtige Herausforderungen, die als eine Angelegenheit von großer Dringlichkeit 1-4 angegangen werden müssen. Mehrere komplementäre den Gebieten der "-Ansätze haben Hinweise auf die genetischen Risikofaktoren und pathogene Mechanismen zahlreicher neurodegenerativer Erkrankungen zur Verfügung gestellt, aber die meisten Ergebnisse noch erfordern eine funktionale Validierung 5. Zum Beispiel ist eine aktuelle genomweiten Assoziationsstudie für Parkinson (PD) identifizierten sich viele neue loci als Risikofaktoren für die Erkrankung, aber die zugrunde liegende ursächliche Variante (n) oder pathogenen Mechanismus nicht 6, 7 bekannt. Da jeder zugehörigen Bereich mehrere Gene enthalten können, wäre die funktionelle Bewertung der einzelnen Gene auf Phänotypen mit der Krankheit assoziiert, mit traditionellen zellbiologischen Techniken zu lange dauern.
Es gibt auch eine Notwendigkeit, die molekularen Netzwerke zu verstehen, die aufGenmutationen, die Phänotypen sie verursachen. Es wird erwartet, dass Krankheitsphänotypen das Ergebnis der vielfältigen Wechselwirkungen, die gestört haben. Wiederaufbau dieser Netzwerke mit traditionellen molekularen Methoden würden zeitaufwendig sein. Darüber hinaus werden Netzwerk-Vorhersagen aus unabhängigen Studien der einzelnen Komponenten, den Reduktionismus Ansatz, wahrscheinlich unterschätzen die Komplexität des Netzwerks 8. Diese Unterschätzung könnte zum Teil erklären die niedrige Erfolgsquote der Arzneimittelzulassung aufgrund von unerwünschten oder toxischen Nebenwirkungen. Der Erwerb von einem Netzwerk Perspektive der Krankheit verbundenen Wege mit HT / HC zelluläre Screening-Methoden, und Feststellung der wichtigsten Knoten innerhalb dieser Signalwege könnte zur Identifizierung von Zielen, die besser geeignet für eine therapeutische Intervention sind zu führen.
High-Throughput-Screening (HTS) ist eine ideale Methode, um diese Probleme 9-12 Adresse. aber die traditionellen Methoden wurden eindimensionale ganzen gut Zell-Assays, die Vereinfachung verwendetstic Anzeigen für komplexe biologische Prozesse. Sie waren nicht in der Lage, gleichzeitig zu quantifizieren viele Phänotypen bei neurodegenerativen Erkrankungen wie axonalen Transport Defizite oder Änderungen in der Morphologie Eigenschaften 13, 14 beobachtet. Dieser Ansatz konnte nicht verwendet werden, um die dynamische Natur der zellulären Prozessen oder pathogene Ereignisse, die in einer Untergruppe von Zellen auftreten zu untersuchen. Zur Quantifizierung solcher Merkmale muss man, um multi-dimensionale Phänotypen bewegen bezeichnet High-Content Screening (HCS) 4, 15-17. HCS ist die zell-basierte Quantifizierung von mehreren Prozessen gleichzeitig, das eine detailliertere Darstellung der zellulären Antwort auf verschiedene Störungen bietet im Vergleich zu HTS.
HCS hat viele Vorteile gegenüber HTS 18, 19, aber die Durchführung einer Hochdurchsatz-(HT)-High-Content-(HC)-Bildschirm in neuronalen Modellen ist problematisch wegen der hohen Kosten, ökologische Vielfalt und menschliche Fehler. Um zelluläre Reaktionen auf eine "phenomics 'scale erkennenmit HC Bildgebung muss man Variation und Fehler zu reduzieren, bei gleichzeitiger Erhöhung der Empfindlichkeit und Reproduzierbarkeit.
Hier beschreiben wir eine Methode, um präzise und zuverlässig durchzuführen shRNA Bildschirme mit automatisierten Zellkultur 20 und HC Imaging in neuronalen Zellen Modellen. Wir beschreiben, wie wir diese Methode verwendet, um Modulatoren für ein bestimmtes Protein, DJ1, die, wenn mutiert Ursachen autosomal rezessiv Parkinsonismus 21 identifizieren.
Die Kombination der Vielseitigkeit der HC-Bildgebung mit HT-Methoden ist es möglich, genau zu quantifizieren eine Vielzahl von Phänotypen. Dies könnte dann genutzt werden, um unser Verständnis des Genoms, die Wege in der Krankheitsentstehung beteiligt sind vorab zu identifizieren sowie potentielle therapeutische Targets werden.
Protokoll
1. Automatisierte adhärente Zellkultur-Verfahren (Abbildung 1) 20
- Bereiten Sie die automatisierte Zellkultur-System für die Eingabe von Zellkultur-Platten. Legen Sie Verbrauchsmaterialien (z. B. Pipettenspitzen, Zellkultur-Platten, Assay-Platten) in das System mit Hilfe der grafischen Benutzeroberfläche (GUI). Für ausreichende Zellkulturmedien, Phosphat-gepufferte Kochsalzlösung (PBS) und Trypsin in das Robot-System.
- Manuelles Samen zwei OmniTray Platten mit 2 x 10 6 Zellen pro Platte, der SH-SY5Y Neuroblastom-Zelllinie. Pflegen Sie Zellen in Opti-MEM mit 10% fötalem Rinderserum (FBS). Legen Sie die Platten in der Zellkultur Roboters über das GUI. Die Zellen werden bei 37 ° C und 5% CO 2 inkubiert werden.
- Wählen Sie die Zellkultur-Protokoll eingeleitet 20 sein muss. Man kann von einem adhärente Zellkultur-Prozess 22, Kultivierung und Expansion von embryonalen Stammzellen (ES-Zellen) der Maus Feeder-Zellen 23 oder Kultivierung der Aussetzung cel wähltels 22.
- Wählen Sie die adhärente Zellkultur-Protokoll (Abbildung 1) und sorgen für adhärente Zelllinie spezifische Parameter-Dateien sind so eingestellt, dass die Einmündung Schwelle (Bereich der OmniTray Platte, die Zellen enthält) auf 70% gesetzt wird. Set insgesamt Trypsinierung Zeit, um zwei Minuten.
- Weisen Sie den Roboter zu neuen OmniTray Platten vorzubereiten, mit einer Aussaat Zellzahl von 2 x 10 6 Zellen pro Platte.
- Eingang OmniTray Platten in die Zellkultur in einem automatisierten adhärente Zellkultur-Protokoll (Abbildung 1). Dieses Protokoll umfasst die folgenden Schritte aus: Platten werden inkubiert und abgebildet, bis sie den vordefinierten Zusammenfluss Schwelle zu erreichen. Wenn Zellen nicht erreichen Zusammenfluss Schwelle innerhalb von 5 Lesungen, sind Platten aus dem System entfernt. Beim Erreichen der benutzerdefinierten Zusammenfluss Schwelle, werden die Zellen gewaschen, trypsiniert und gezählt. Eine vordefinierte Anzahl von Zellen zu neuen OmniTray Platten gegeben und wenn es eine ausreichende Anzahl von Zellen, einer bestimmten tauber von Assay-Platten sind an Deck transportiert und eine definierte Anzahl von Zellen verzichtet in jedes Well. Assay-Platten können direkt abgebildet werden mit dem integrierten Mikroskop oder Output aus dem System zur weiteren Verarbeitung.
- Weisen Sie das System auf 4 Assay-Platten pro OmniTray Platte vorbereiten, mit einer Gesamtfläche von 5.000 Zellen pro Vertiefung.
2. shRNA Virus Produktion und Beschichtung in Assay-Platten (Dauer: 6 Tage)
- Wachsen Bakterien Glycerin Aktien, welche die shRNA-Vektoren (Open Biosystems, TRC1) über Nacht in 2 ml Luria-Bertani-Medium Medien mit 100 ug / ml Ampicillin (Sigma-Aldrich).
- Auszug Plasmide nach dem Protokoll des Herstellers (Promega Wizard MagneSil Tfx).
- Produce Virus mit dem RNAi Consortium High-Throughput Lentivirale Produktion (96-Well-Platte) Protokoll 24. Arbeiten mit Lentivirus ist relativ sicher, weil die Viruspartikel zur Transduktion verwendet replikationsdefizient und Split-Gen Verpackung Strategien sind für ihre Produktion verwendet. Doch bei der Arbeit mit Lentivirus, sind zusätzliche biologische Sicherheit erforderlichen Verfahren, um das Risiko, sich selbst und andere 25 zu minimieren. Alle Experimente müssen in einem MLII oder BSL2 Sicherheitsniveau Labor durchgeführt werden. Alle Kunststoffe (Pipetten, Plastikgeschirr, Medien), die in Kontakt mit Lentivirus Partikel hätte sein sollen mit Bleichmittel für 24 Stunden vor der Entsorgung inkubiert werden.
- Berechnen Sie die Multiplizität der Infektion (MOI) der Lentivirus durch Ermittlung des Prozentsatzes der GFP-positiven Zellen mit dem pLKO.1 GFP-Plasmid (Sigma-Aldrich).
- Platte Lentivirus in Assay-Platten, mit einer MOI von 3.
3. Lentivirale Transduktion und neuronale Differenzierung von SH-SY5Y Zellen (Dauer: 6 Tage)
- Die Zellen werden auf die Assay-Platten gegeben (siehe Schritt 1.7). Last-Assay-Platten, die shRNA Lentivirus in die automatisierte Zellkultur-System.
- Nach 24 Stunden, die Medien auf dieAssay-Platten werden Opti-MEM geändert werden, das 0,5% FBS und 0,1 uM Retinsäure auf die Differenzierung zu beginnen. Differenzierung von SH-SY5Y Zellen ermöglicht die Visualisierung von neuritischen Strukturen und synchronisiert die Zellteilung.
- Weiter Inkubation der Testplatten bei der Differenzierung Medien für 5 Tage. Dies gewährleistet maximale Zuschlag von Ziel-Gen-Expression.
- Am Tag 5 mit 50 uM H 2 O 2 auf die Hälfte der Assay-Platten für 24 Stunden auf die Translokation von DJ1 zu den Mitochondrien stimulieren.
- Am Tag 6, fügen Mitotracker CmxROS (Invitrogen) zu den Zellen, in einer Endkonzentration von 200 nM pro Vertiefung und inkubieren bei 37 ° C für 30 Minuten.
- Man kann das System Speicherfolien direkt mit dem HC-Imager oder Platten können aus dem System zur weiteren Verarbeitung exportiert werden zu unterweisen.
4. Automatisierte Immunfärbung von Assay-Platten (Dauer: 2 Tage)
Die Bildqualität ist paramount für die Durchführung eines empfindlichen und zuverlässigen HCS. Schäden an der zellulären Monoschicht durch ungenaue Pipettieren kann zu schlechter Bildqualität und reproduzierbare Ergebnisse führen. Um Zellschicht Schaden zu minimieren, wurde die Immunfärbung unter Verwendung eines Roboter-Station. Das Verfahren ist ähnlich wie eine, die zuvor 26 beschrieben, sondern wurde angepasst, um den Durchsatz zu erhöhen und Verbrauchsmaterialien Nutzung.
- Fix-Zellen mit 100 ul 4% Paraformaldehyd auf 37 vorgewärmten ° C. Inkubieren für 20 Minuten bei Raumtemperatur.
- Wash-Zellen mit 200 ul PBS für 5 Minuten, 3 mal.
- Inkubieren Testplatten mit 200 ul PBS mit 0,1% Triton (PBST) für 10 Minuten.
- Wash-Zellen mit 200 ul PBS für 5 Minuten, 3 mal.
- Inkubieren Assay-Platten mit 200 pl Blockpuffer (PBST mit 5% FBS) für 1 Stunde bei Raumtemperatur.
- Wash-Zellen mit 200 ul PBS für 5 Minuten, 3 mal.
- Inkubieren mit dem follaufgrund Primärantikörper über Nacht bei 4 ° C:
- Goat DJ1 N20 (Santa Cruz, 5 pg / ml)
- Kaninchen β-III Tubulin (Sigma-Aldrich, 1 pg / ml)
- Am folgenden Tag, waschen Sie die Zellen mit 200 ul PBS für 5 Minuten, 3 mal.
- Inkubieren Testplatten mit den folgenden Sekundärantikörper 1 Stunde bei Raumtemperatur:
- AlexaFluor 488 Esel anti-Ziege (Invitrogen, 2 pg / ml)
- AlexaFluor 647 Ziege Anti-Kaninchen (Invitrogen, 2 pg / ml
- Wash-Zellen mit 200 ul PBS für 5 Minuten, 3 mal.
- Inkubieren Zellen mit Hoechst (Invitrogen, 1 pg / ml) für 10 Minuten.
- Wash-Zellen mit 200 ul PBS für 5 Minuten, 3 mal.
- Shop-Platten bei 4 ° C, bis sie abgebildet werden kann.
5. Hoher Gehalt Bildaufnahme und Bildanalyse (Dauer: 5 Tage)
- Bild insgesamt 30 Felder pro Well mit dem 20x Objektiv. Visualisieren Sie DJ1 mit dem FITC-Filter gesetzt, die Mitochondrien mit der TRITC-Filter gesetzt, β-III Tubulin mit dem Cy5 Filter gesetzt und die Kerne mit dem UV-Filter-Set (Abbildung 3).
- Analysieren Sie die Bilder mit der Compartmental Analysis BioApplication (Cellomics, ThermoFisher), um die durchschnittliche Intensität der Mitotracker Signal innerhalb der Mitochondrien zu bestimmen. (4B, F).
- Zur Bestimmung der durchschnittlichen Überlappung Koeffizient zwischen DJ1 und den Mitochondrien, analysieren die Bilder mit der Cellomics Kolokalisation BioApplication (Cellomics, ThermoFisher). Definieren regions of interest (ROI) wie folgt: ROI A - Kern (Abbildung 4A, E), ROI B - Mitochondrien (Abbildung 4 B, F). Ausschließen ROI A von ROI B der Analyse von nur das Zytoplasma zu gewährleisten. Definieren Sie die Mitochondrien als Zielregion I und DJ1 als Zielregion II (4C, G).
- Analysieren Sie die Bilder mit Hilfe der neuronalen Profiling BioApplication (Cellomics, ThermoFisher), um die durchschnittliche Länge der Neuriten aus der β-III Tubulin-Färbung (Abbildung Spur4D, H).
- Speicherfolien mit dem Opera LX automatisierte konfokalen Leser (Perkin-Elmer). Bild insgesamt 30 Felder pro Well mit dem 60x Objektiv mit Eintauchen in Wasser. Visualisieren Mitochondrien mit der 561 nm-Laser und Kerne mit UV-Anregung.
- Analysieren Sie die Bilder mit der Spot-Edge-Ridge (SER) Texturmerkmalen Algorithmus. Die SER-Ridge-Filter überträgt Intensität in Pixel bilden Kamm-Mustern. Je fragmentierter die Mitochondrien, desto höher ist die SER-Ridge-Score (Abbildung 8).
6. Datennormalisierung und Analyse
- Importieren Sie die Daten aus der Bildanalyse-Software in die BioConductor CellHTS2-Paket für die R-Software-Umgebung (R-Version 2.11.1, BioConductor Version 2.6).
- Logarithmus zur Basis (2) Transformation der Daten vor dem pro Platte Median basierte Normalisierung 27, 28. Wenden Sie nicht die Varianz Anpassung pro Platte.
- Zur Identifizierung von Modifikatoren für einen Phänotyp, verwenden Sie eine Zwei-Wege-ANOVA zwischen den different Behandlungsgruppen dh Scrambled infizierten unbehandelten Zellen vs verschlüsselt Toxin behandelten Zellen vs Zielgen unbehandelten Zellen vs Zielgen behandelten Zellen (Abbildungen 5-7).
7. Repräsentative Ergebnisse
Mutationen innerhalb DJ1 führen zu frühem Beginn-rezessiven Parkinson 21, aber es ist unklar, wie Verlust von DJ1 Anlass zu der Krankheits-Phänotyp. Es ist bekannt, dass defizienten Zellen von DJ1 anfälliger für oxidativen Stress induzierten Zelltod und in Reaktion auf oxidativen Stress, DJ1 transloziert aus dem Zytoplasma in die Mitochondrien 29, 30 sind. Mit dem Bau HC-Assays für diese Phänotypen zu überwachen, können wir Gene identifizieren, die oder regulieren beeinflussen Phänotypen mit DJ1 verbunden. Dieser Ansatz kann helfen, entschlüsseln die Signalwege innerhalb der DJ1 Funktionen und dass in der Krankheitsentstehung beteiligt sein könnten.
Beispiel für eine epistatisch Interaktion mit DJ1 (Abbildung 5): Knockdown von DJ1 in Zellen ausgesetztauf Toxin führt zu einer größeren Verlust der Lebensfähigkeit der Zellen (BAR-B: image-B), um Zellen mit Rührei Lentivirus infiziert Vergleich (BAR-A: image-A). Knockdown des Zielgens A hat eine ähnliche Wirkung wie die in Zellen mit einer DJ1 Knockdown (BAR-C: image-C) beobachtet. Knockdown der beiden DJ1 und Zielgen A führt zu einer deutlich größeren Verlust der Lebensfähigkeit der Zellen als Verlust einer der beiden Gen allein (BAR-D:-D Bild). Dies deutet auf eine epistatisch Interaktion zwischen DJ1 und Zielgen A.
Beispiel eines Gens regulieren DJ1 Translokation (Abbildung 6): Wenn die Zellen mit einem Toxin ausgesetzt sind, DJ1 transloziert aus dem Zytoplasma in die Mitochondrien, die durch eine höhere Überschneidung Koeffizient zwischen DJ1 und die Mitochondrien (BAR-A quantifiziert wird: image Ein Vergleich BAR-C: Bild C). In Zellen, in denen Zielgen B zum Schweigen gebracht worden ist, weniger DJ1 transloziert zu den Mitochondrien, wenn die Zellen sind, um das Toxin ausgesetzt. Dies deutet darauf hin, dass Zielgen B ist auf den Transport von DJ1 in die Mitochondrien beteiligt. (BAR-B: Bild B und BAR-D: Bild D)
Beispiel für ein Gen in Neuronenauswuchs (Abbildung 7) beteiligt: Knockdown des Zielgens C in Wildtyp-SH-SY5Y Zellen führt zu einer deutlichen Erhöhung der Neuritenlänge (BAR-B: image-B), um Zellen mit Lentiviren Ausdruck verschlüsselt infiziert Vergleich shRNA (BAR-A: Bild A). Dieser Effekt wird in Zellen mit Toxin (BAR-C und D) inkubiert verloren.
Beispiel für ein Gen in der mitochondrialen Morphologie (Abbildung 8) beteiligt: Die Infektion von Wildtyp-SH-SY5Y Zellen mit shRNA Targeting-Gen D führt zu einer Abnahme in der mitochondrialen SER-Ridge-Segmentierung Wert (Abbildung 8, Bild C und D) im Vergleich zu Zellen mit Rührei Lentivirus (Abbildung 8, Bild A und B) infiziert.
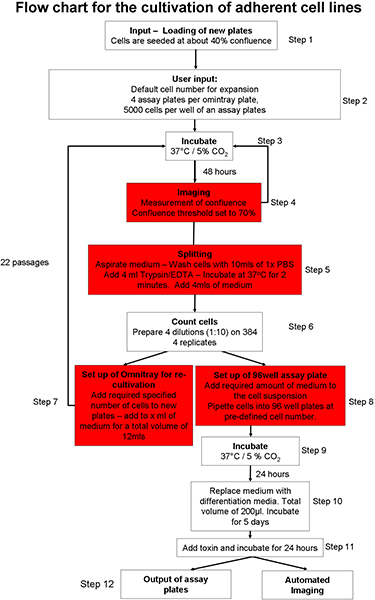
Abbildung 1 Überblick über die automatisierte Zellkultur-Protokoll.:
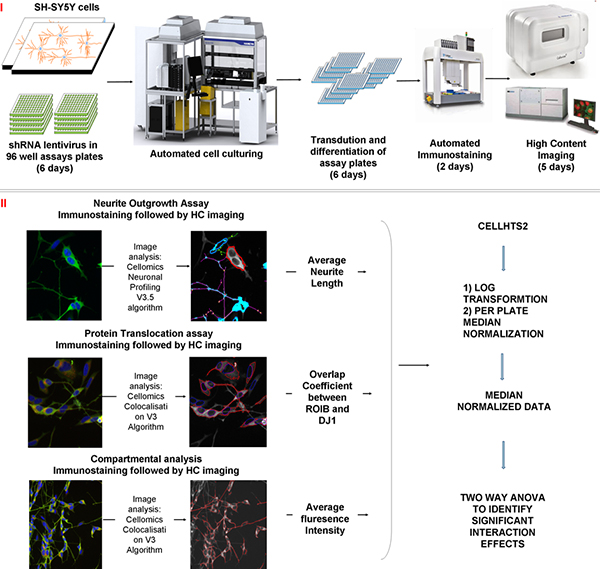
Abbildung 2 Schematische Darstellung der Screening-Prozess, Bildanalyse und statistischen Methoden während der Screening-Verfahren verwendet:. I) Die Zellen werden kultiviert, bis sie konfluent und anschließend vernickelt in der Assay-Platten, die die shRNA Lentivirus sind. Die Zellen werden für 5 Tage differenziert und Toxin wird dann auf die Platten für 24 Stunden zugegeben. Assay-Platten werden von dem System und immungefärbt. Die Zeit, für jeden der Prozesse genommen ist in Klammern angegeben. ii) Daten erfasst mit einem HC-Imager (Zelllebensfähigkeit, Protein-Translokation und Neuronenauswuchs) und einem automatisierten konfokalen Imager (mitochondriale Morphologie). Daten zu CellHTS2 Paket innerhalb R exportiert, Basis (2) transformiert und normalisiert anmelden. Zwei-Wege-ANOVA wird verwendet, um signifikante Wechselwirkungen zwischen den verschiedenen Variablen zu identifizieren.

Abbildung 3. Composite-Bilder von Zellen durch HC Bildgebung erworben. A) Unbehandelte Zellen, B) Zellen mit H 2 O 2 behandelt. DJ1 ist grün, die Mitochondrien in rot und die Zellkerne in blau gekennzeichnet. Neuriten Färbung ist nicht hervorgehoben.
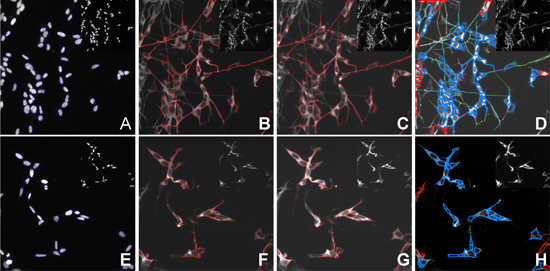
Abbildung 4. Quantifizierung der mehrere zelluläre Funktionen aus einer HCS erhalten. AD) Unbehandelte SH-SY5Y Zellen. EH) H 2 O 2 behandelt SH-SY5Y Zellen. A, E) Kerne Segmentierung und Definition von ROI A, B, F) Identifizierung und Quantifizierung von Mitochondrien, ROI B, C, G) Identifizierung von DJ1, Target-Kanal II; D, G) Identifizierung und Berechnung der durchschnittlichen Neuritenlänge. Cells nahe an den Rand des Bildes aus der Analyse ausgeschlossen. Inset sind Bilder vor der Analyse.

Abbildung 5. Identifizierung eines Gens in Epistase mit DJ1 (Briefe an den Stäben auf die Beschriftung der Bilder entsprechen). Bilder A bis D sind SH-SY5Y Zellen mit Mitotracker CMXRos (rot), die für die Quantifizierung von Zell-Gesundheit verwendet wurde beschriftet.
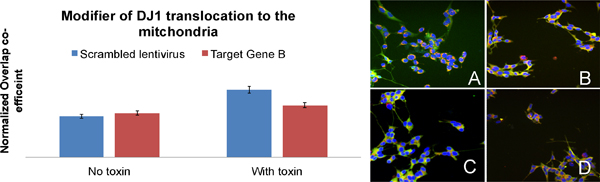
Abbildung 6. Identifizierung eines Gens regulieren DJ1 Translokation (Briefe an den Stäben auf die Beschriftung der Bilder entsprechen). Bilder A bis D sind SH-SY5Y Zellen für DJ1 (grün), Mitochondrien (rot) und Zellkerne (blau), die für die Quantifizierung der DJ1 Translokation in den Mitochondrien eingesetzt wurden beschriftet.
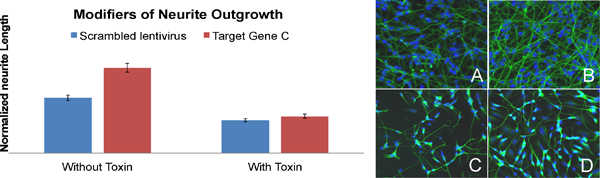
Abbildung 7. Identifizierung eines Gens in Neuronenauswuchs beteiligt (Briefe an den Stäben auf die Beschriftung der Bilder entsprechen). Bilder A bis D sind SH-SY5Y Zellen für β-III Tubulin (grün) und Zellkerne (blau), die für die Quantifizierung der Neuritenlänge verwendet wurden beschriftet.
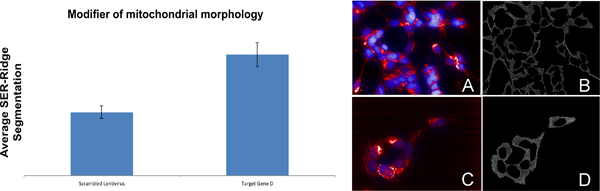
Abbildung 8. Identifizierung eines Gens bei der Regulierung der mitochondrialen Morphologie beteiligt. Bild A und C sind zusammengesetzte Bilder von SH-SY5Y Zellen mit Rührei shRNA oder shRNA Targeting-Gen D bzw. infiziert. Mitochondrien sind rot gefärbt, während Kerne in blau gefärbt sind. Bild B und D sind Visualisierungen der SER-Ridge Quantifizierung.
Diskussion
Mit der sinkenden Kosten für HT / HC zelluläre Screening-Systeme, mit der Verfügbarkeit von leistungsfähigen genomweiten Werkzeuge, um Genfunktionen verändern kombiniert werden HT / HC-Bildschirme zum Alltag in der Wissenschaft. Der Ansatz wurde bereits erfolgreich auf den verschiedensten Bereichen der Forschung wie die Identifizierung von Drug Targets in der Krebstherapie 9, 31-33 und 34-36 der Embryonalentwicklung angelegt und hat sogar das Potenzial für den Einsatz in der Entschlüsselung der Signalwege in neuropsychiatrischen Störungen 37,38 beteiligt. Doch die Umsetzung eines solchen Systems erfordert einen erheblichen Aufwand an Zeit und Aufwand bei der Prozessoptimierung oft unter ein Minimum von 6 Monaten. Alle Schritte, wie Trypsinierung Zeiten, Pipettieren Geschwindigkeiten und Aussaatdichten müssen angepasst werden, um sicherzustellen, dass die Zellen gesund sind und wachsen ständig. Prävention von bakterieller Kontamination ist eine der schwierigsten Herausforderungen für automatisierte Zellkultur mit wöchentlicher Reinigung Protokolle in combination mit konstanter Spülung aller Gleitlagerröhre Linien mit 70% Ethanol, die für frei von Verunreinigungen Kulturen. Es wird auch notwendig sein, die Robotik zu verbessern, so dass zusätzliche Instrumente, wie die konfokale Mikroskope für eine höhere Auflösung und -80 ° C Tiefkühltruhen für Compound Storage integriert werden kann.
Es gibt auch Einschränkungen, die angegangen, um die empfindlichen, Geschwindigkeit und Nutzen dieser Methode, um Gen-Netzwerke zu studieren und zu identifizieren Gene in pathogenen molekularen Mechanismen beteiligt zu verbessern werden müssen.
Zur Durchführung einer HT / HC-Bildschirm und sicherstellen, dass zuverlässige Daten erhoben werden, haben verschiedene Aspekte optimiert werden. Erstens ist die Zuverlässigkeit der Messung entscheidend und ist abhängig von der Robustheit und Empfindlichkeit des Tests. Zum Beispiel sind die oben beschriebenen Assays geeignet für kleinere Bildschirme, sind aber schwierig, auf einer genomweiten Maßstab, aufgrund der Anzahl Verarbeitungsschritte vor der Bildaufnahme erforderlich sind, umzusetzen.So müsste man, um stabile Zelllinien, die Reporter-Gen, das für die direkte Bildgebung erlauben würde und zu einer verminderten Variation aufgrund der reduzierten Anzahl von Bearbeitungsschritten zu konstruieren. Derzeit Gestaltung eines Assays, die genau zeigt und zuverlässig quantifiziert einem Phänotyp von Interesse ist ein großer Engpass bei der HC Screening-Prozess.
Viele Bildschirme sind in Säugetierzellen mit unterschiedlichen RNAi-Bibliotheken, die alle aus dem Off-Target-Effekte, begrenzt Gen-Silencing Effizienz und unvollständiger Genomabdeckung leiden durchgeführt. So Bibliotheken müssen gemacht, die sind spezifischer, potenter und haben eine bessere Abdeckung werden. Die Bemühungen sind im Gange, um zu schaffen, wie Es ist zu hoffen, solche Bemühungen wird die Reproduzierbarkeit der HT / HC Eindrehen verbessern en Treffer.
Eine Einschränkung der viele großformatige Zelle based screens sind, dass sie in Neuroblastom-Zellen durchgeführt werden, weil sie genetisch manipuliert werden kann und kultiviert, um eine große Anzahl mit relativer Leichtigkeit. Allerdings ist die Relevanz der "Besucher" in ex vivo Zellkultur-Modellen zu identifizieren in vivo-Funktion fragwürdig, zumal das Gehirn von hoch spezialisierten Zelltypen, die ein dichtes und kompliziertes Netzwerk von synaptischen Verbindungen zu funktionieren, wie eine hoch integrierte Einheit bilden besteht. Als Folge ist es üblich, dass Zugriffe, die anhand des Screening-Ansatzes oben beschrieben, sind in Sekundär-Bildschirme mit zusätzlichen Techniken und in mehr physiologisch relevanten Modelle 39 validiert. Zur Verbesserung der Übersetzung Zugriffe während HCS identifiziert, müssen repräsentativer und komplexer Modelle, wie zB primären Zellen und differenzierten Stammzellen oder Co-Kultur-Systemen entwickelt und angepasst für HT / HC Ansätze.
ntent "> Mit einer Kombination aus automatisierten Zellkultur-und HC-Bildgebung kann man schnell gewinnen neue Einblicke, wie Neuronen funktionieren und welche Wege sind wichtig, um die Entwicklung der Krankheit. Kombinieren HCS / HTS-Daten mit Informationen aus anderen" Gebieten der "Ansätze generiert, wird es dann möglich sein, eine Systembiologie Überblick über Erkrankungen des Gehirns zu konstruieren, und erleichtert so therapeutischen Entwicklung.Offenlegungen
Wir haben nichts zu offenbaren
Danksagungen
Wir danken dem Hamilton-Programmierer und Spezialisten für anhaltende Unterstützung und Eva Blaas für die technische Unterstützung. T5-207: SJ wird durch Ti-Pharma unterstützt; Diese Arbeit wurde von zwei NWO Investitionszuschüsse (911-07-031 und 40-00506-98-10011), The Prinses Beatrix Fonds Wetenschapsprijs 2009 und der Neuroscience Campus Amsterdam unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenz | Firma | Katalog-Nummer | |
| AI.CELLHOST | HAMILTON | http://www.hamiltonrobotics.com/en-uk/applications/cellomics/ | |
| OPTI-MEM | INVITROGEN | 31985-054 | |
| Retinsäure | SIGMA-ALDRICH | R2625 | |
| OmniTray PLATES | NUNC | 465219 | |
| 96 WELL Kulturplatten | GRENIER | 655086 | |
| DJ1 N20 ANTIKÖRPER | SANTA CRUZ | SC27004 | |
| BETA-III Tubulin-Antikörper | SIGMA-ALDRICH | T3952 | |
| MitoTracker CMXROS | INVITROGEN | M-7512 | |
| Hoechst-33342 | INVITROGEN | H1399 | |
| WASSERSTOFFPEROXID | SIGMA-ALDRICH | 216763-100ML | |
| TRYPSIN | INVITROGEN | 25050014 | |
| Dulbeccos Phosphat-gepufferte Kochsalzlösung | INVITROGEN | 14190086 | |
| Promega Wizard MagneSil TFX | PROMEGA | A2380 | |
| ShRNA CLONES | OPEN BIOSYSTEMS | http://www.openbiosystems.com / RNAi / shRNALibraries / TRCLibraryDetails / | |
| Cellomics Bioanwendungen | THERMO-FISHER | http://www.thermo.com/hcs |
Referenzen
- Geschwind, D. H., Konopka, G. Neuroscience in the era of functional genomics and systems biology. Nature. 461, 908-915 (2009).
- Ge, H., Walhout, A. J., Vidal, M. Integrating 'omic' information: a bridge between genomics and systems biology. Trends. Genet. 19, 551-560 (2003).
- Zhu, H., Snyder, M. 'Omic' approaches for unraveling signaling networks. Curr. Opin. Cell. Biol. 14, 173-179 (2002).
- Jain, S., Heutink, P. From single genes to gene networks: high-throughput-high-content screening for neurological disease. Neuron. 68, 207-217 (2010).
- Manolio, T. A. Finding the missing heritability of complex diseases. Nature. 461, 747-753 (2009).
- Nalls, M. A. Imputation of sequence variants for identification of genetic risks for Parkinson's disease: a meta-analysis of genome-wide association studies. Lancet. 377, 641-649 (2011).
- Simon-Sanchez, J. Genome-wide association study confirms extant PD risk loci among the Dutch. Eur. J. Hum. Genet. 19 (6), 655-661 (2011).
- Van Regenmortel, M. H. Reductionism and complexity in molecular biology. Scientists now have the tools to unravel biological and overcome the limitations of reductionism. EMBO. Rep. 5, 1016-1020 (2004).
- Aherne, G. W., McDonald, E., Workman, P. Finding the needle in the haystack: why high-throughput screening is good for your health. Breast. Cancer. Res. 4, 148-154 (2002).
- An, W. F., Tolliday, N. J. Introduction: cell-based assays for high-throughput screening. Methods. Mol. Biol. 486, 1-12 (2009).
- Mayr, L. M., Bojanic, D. Novel trends in high-throughput screening. Curr. Opin. Pharmacol. 9, 580-588 (2009).
- Hertzberg, R. P., Pope, A. J. High-throughput screening: new technology for the 21st century. Curr. Opin. Chem. Biol. 4, 445-451 (2000).
- Conrad, C., Gerlich, D. W. Automated microscopy for high-content RNAi screening. J. Cell. Biol. 188, 453-461 (2010).
- Thomas, N. High-content screening: a decade of evolution. J. Biomol. Screen. 15, 1-9 (2010).
- Arrasate, M., Finkbeiner, S. Automated microscope system for determining factors that predict neuronal fate. Proc. Natl. Acad. Sci. U. S. A. 102, 3840-3845 (2005).
- Dragunow, M. High-content analysis in neuroscience. Nat. Rev. Neurosci. 9, 779-788 (2008).
- Varma, H., Lo, D. C., Stockwell, B. R. High throughput screening for neurodegeneration and complex disease phenotypes. Comb. Chem. High. Throughput. Screen. 11, 238-248 (2008).
- Durr, O. Robust hit identification by quality assurance and multivariate data analysis of a high-content, cell-based assay. J. Biomol. Screen. 12, 1042-1049 (2007).
- Miller, J. Quantitative relationships between huntingtin levels, polyglutamine length, inclusion body formation, and neuronal death provide novel insight into huntington's disease molecular pathogenesis. J. Neurosci. 30, 10541-10550 (2010).
- Jain, S., Sondervan, D., Rizzu, P., Bochdanovits, Z., Caminada, D., Heutink, P. The Complete Automation of Cell Culture. Journal of Biomolecular Screening. 16 (8), (2011).
- Bonifati, V. Mutations in the DJ-1 gene associated with autosomal recessive early-onset parkinsonism. Science. 299, 256-259 (2003).
- Ricardo, R., Phelan, K. Trypsinizing and Subculturing Mammalian Cells. J. Vis. Exp. (16), e755-e755 (2008).
- Kent, L. Culture and Maintenance of Human Embryonic Stem Cells. J. Vis. Exp. (34), e1427-e1427 (2009).
- Moffat, J. A lentiviral RNAi library for human and mouse genes applied to an arrayed viral high-content screen. Cell. 124, 1283-1298 (2006).
- Volksgezondheid, M. V. Integrale versie van de Regeling genetisch gemodificeerde organismen en het Besluit genetische gemodificeerde. Organismen. , (2004).
- Anderl, J. L., Redpath, S., Ball, A. J. A Neuronal and Astrocyte Co-Culture Assay for High Content Analysis of Neurotoxicity. J. Vis. Exp. (27), e1173-e1173 (2009).
- Wiles, A. M., Ravi, D., Bhavani, S., Bishop, A. J. An analysis of normalization methods for Drosophila RNAi genomic screens and development of a robust validation scheme. J. Biomol. Screen. 13, 777-784 (2008).
- Canet-Aviles, R. M. The Parkinson's disease protein DJ-1 is neuroprotective due to cysteine-sulfinic acid-driven mitochondrial localization. Proc. Natl. Acad. Sci. U. S. A. 101, 9103-9108 (2004).
- Blackinton, J. Formation of a stabilized cysteine sulfinic acid is critical for the mitochondrial function of the parkinsonism protein DJ-1. J. Biol. Chem. 284, 6476-6485 (2009).
- Gupta, P. B. Identification of selective inhibitors of cancer stem cells by high-throughput screening. Cell. 138, 645-659 (2009).
- Luo, J. A genome-wide RNAi screen identifies multiple synthetic lethal interactions with the Ras oncogene. Cell. 137, 835-848 (2009).
- Mouchet, E. H., Simpson, P. B. High-content assays in oncology drug discovery: opportunities and challenges. IDrugs. 11, 422-427 (2008).
- Vogt, A. Automated image-based phenotypic analysis in zebrafish embryos. Dev. Dyn. 238, 656-663 (2009).
- Pardo-Martin, C. High-throughput in vivo vertebrate screening. Nat. Methods. 7, 634-636 (2010).
- Vogt, A., Codore, H., Day, B. W., Hukriede, N. A., Tsang, M. Development of automated imaging and analysis for zebrafish chemical screens. J. Vis. Exp. (40), e1900-e1900 (2010).
- Ross, P. J., Ellis, J. Modeling complex neuropsychiatric disease with induced pluripotent stem cells. F1000. Biol. Rep. 2, 84-84 (2010).
- Ebert, A. D., Svendsen, C. N. Human stem cells and drug screening: opportunities and challenges. Nat. Rev. Drug. Discov. 9, 367-372 (2010).
- An, W. F., Tolliday, N. Cell-based assays for high-throughput screening. Mol. Biotechnol. 45, 180-186 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten