Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Spectral konfokale Bildgebung von fluoreszenzmarkierten Nikotinrezeptoren in Knock-in Mäusen mit chronischer Gabe von Nikotin
In diesem Artikel
Zusammenfassung
Wir haben eine neue Technik zur Quantifizierung nikotinergen Acetylcholin-Rezeptors Veränderungen innerhalb subzellulären Regionen spezifischen Subtypen von ZNS-Neuronen zum besseren Verständnis der Mechanismen der Nikotinabhängigkeit, indem eine Kombination von Ansätzen einschließlich fluoreszierendes Protein Markierung des Rezeptors mit dem Knock-in-Ansatz entwickelt und spektrale konfokale Bildgebung.
Zusammenfassung
Liganden-gesteuerte Ionenkanäle im zentralen Nervensystem (ZNS) werden in zahlreichen Bedingungen mit schweren medizinischen und sozialen Folgen verwickelt. So ist zum Beispiel Sucht nach Nikotin über das Rauchen eine der häufigsten Ursachen für vorzeitigen Tod weltweit (World Health Organization) und wird wahrscheinlich durch eine Veränderung der Ionenkanal-Verteilung im Gehirn 1 verursacht. Chronische Nikotin bei Nagern und Menschen führt zu einer erhöhten Anzahl von nikotinischen Acetylcholinrezeptoren (nAChR) im Hirngewebe 1-3. Ebenso haben Veränderungen in den glutamatergen GluN1 oder GluA1 Kanäle bei der Auslösung von Sensibilisierung mit anderen süchtig machenden Drogen wie Kokain, Amphetamine und Opiate 4-6 in Verbindung gebracht.
Folglich ist die Fähigkeit zu erfassen und zu quantifizieren, Verteilung und Expressionsmuster von spezifischen Ionenkanäle von entscheidender Bedeutung für das Verständnis der Mechanismen der Sucht. Das Studium der Hirnregion-spezifische efgen von einzelnen Drogen wurde durch das Aufkommen von Techniken wie der radioaktiven Liganden vorangetrieben. Jedoch verhindert die geringe räumliche Auflösung des radioaktiven Liganden-Bindung in der Lage, Liganden-gesteuerte Ionenkanäle in spezifischen Subtypen von Neuronen zu quantifizieren.
Genetisch kodierte fluoreszierende Reporter, wie grün fluoreszierende Protein (GFP) und seine vielen Farbvarianten, revolutioniert haben das Feld der Biologie 7. Durch gentechnisch Tagging einen fluoreszierenden Reporter an ein endogenes Protein ein Protein in vivo 10.07 visualisieren können. Ein Vorteil der Fluoreszenz-Tagging Proteine mit einer Sonde ist die Beseitigung von Antikörper Verwendung, die Probleme der Nichtspezifizität und Zugänglichkeit an das Zielprotein aufweisen. Wir haben diese Strategie, um Fluoreszenz-Label nAChRs, das die Studie von Rezeptor-Montage mit Förster Resonance Energy Transfer (FRET) in transfizierten Kulturzellen 11 aktiviert werden. In jüngerer Zeit haben wir die knoc verwendetk-Ingenieur in Annäherung an Mäusen, die mit gelb fluoreszierenden Protein markiert α4 nAChR-Untereinheiten (α4YFP), ermöglicht eine präzise Quantifizierung der Rezeptor ex vivo bei Sub-Mikrometer-Auflösung in ZNS-Neuronen über spektrale konfokale Mikroskopie 12. Die gezielte fluoreszierende Knock-in-Mutation befindet sich im endogenen Locus und unter Kontrolle seines nativen Promotors eingebaut, wodurch ein normales Niveau der Expression und Regulation des Rezeptors, wenn um den unmarkierten Rezeptoren in Wildtyp-Mäusen verglichen. Das Knock-in-Ansatz kann erweitert werden, fluoreszierend markieren andere Ionenkanäle werden und bietet eine leistungsfähige Methode zur Visualisierung und Quantifizierung von Rezeptoren im ZNS.
In diesem Beitrag beschreiben wir eine Methode, um Veränderungen in der nAChR-Expression in spezifischen ZNS-Neuronen nach der Exposition mit chronischem Nikotin zu quantifizieren. Unsere Methoden sind mini-osmotischen Pumpe Implantation, intrakardiale Perfusionsfixierung, Abbildung und Analyse von fluoreszenzmarkierten Nikotinsäure receptor Untereinheiten aus α4YFP knock-in Mäuse (Abb. 1). Wir haben die Verfahren zur Fixierung optimiert, um Autofluoreszenz von festen Gehirn tissue.We minimieren beschreiben im Detail unsere Methode Bildgebung unter Verwendung einer spektralen konfokalen Mikroskop in Verbindung mit einem linearen Entmischung Algorithmus autofluoresent Signal zu subtrahieren, um genau zu erhalten α4YFP Fluoreszenzsignals. Schließlich zeigen wir Ergebnisse von chronischem Nikotin-induzierte Hochregulation von α4YFP Rezeptoren im medialen perforans des Hippocampus.
Protokoll
1. Pump Implantation
- Vor der Implantation Pumpe, füllen und bereitet die Alzet mini-osmotischen Pumpen (Alzet, Modell 2002, Cupertino, USA) man aufpassen, nicht, um Luftblasen zu präsentieren. Dieses Modell der Mini-osmotische Pumpe liefert Lösung bei einer Rate von 0,5 ul / h für 14 Tage. Stellen Sie sicher, sterilen Bedingungen. Wiegen Sie leeren und gefüllten Pumpen. Am Ende des Experiments (10 Tage nach der Implantation), kann die verbleibende Flüssigkeit in der Pumpe mit einer Spritze und Nadel entfernt und gewogen, um die gepumpte Volumen zu berechnen.
- Pumpen mit Kontroll-Lösung enthalten Kochsalzlösung (0,9% w / v, Teknova, S5819, Hollister, USA). (-)-Nikotinhydrogentartrat Salz (Sigma, Cat # N5260) in Kochsalzlösung verdünnt (0,9% w / v) und sterilisiert durch Filtrieren durch einen 0,22 um Filter-End-Spritze, um Nikotin-Lösung, 1 M Stammlösung von herzustellen. Wir haben früher Nikotin bei 0,4 und 2 mg / kg / h (berechnet als freie Base von Nikotin) für 10 Tage verabreicht.
- Bereiten Sie drei Solebäder (drei10 cm Kochsalzlösung gefüllten Petrischalen). Sobald die Pumpe gefüllt worden ist und gedeckelt, waschen Pumpe gründlich in jedem aufeinander folgenden Solebad, um jegliche Spuren des Medikaments auf die äußere Schale zu entfernen. Tauchen Sie ein in Pumpen gefüllt Kochsalzlösung für die Lagerung bis Chirurgie, halten Sie die Steuerungs-und Nikotin-Pumpen in separaten Behältern Kochsalzlösung.
- Um eine gesunde Erholung zu fördern und das Risiko einer postoperativen Infektion, haben saubere Käfige für eine langfristige Erholung vorbereitet.
- Für kurzfristige Erholung unmittelbar nach der Operation, bereiten Sie einen Käfig mit einem Heizkissen und eine Wärmelampe.
- Um chronische Nikotin-Effekte zu untersuchen haben wir 5 bis 6 homozygot α4YFP knock-in Mäuse (2-3 Monate alt) in jeder Gruppe (Kontrolle oder Nikotin). Die α4YFP Knock-in Mauslinie wurden für 10 Generationen der C57BL/6J Mausstamm worden zurückgekreuzt. Wir sorgen dafür, das Alter und Geschlecht von allen Mäusen sind die gleichen für die Studie und dass alle Operationen werden am selben Tag durchgeführt, um die Variabilität zu minimieren. Um zu verhindern hypothermia den Mäusen während und nach der Operation, auszustatten OP-Tisch mit einem Heizkissen im sterilen OP-Tuch abgedeckt.
- Induzieren die α4YFP Knock-in-Maus mit 3 l / min Sauerstoff und 3% Isofluran und dann Aufrechterhaltung der Narkose mit 2,5 l / min Sauerstoff und 1% Isofluran. Wir bevorzugen Isofluran, weil nach Abschluss der Operation Isofluran löscht das System schnell und die Mäuse sind sich dessen bewusst und mobile innerhalb von ~ 2 min. Augentropfen sofort (Tear-Gel, Novartis), um Schädigung der Hornhaut zu vermeiden.
- Die Pumpen werden subkutan über einen Hautschnitt an der Rückseite des Halses implantiert und die Pumpe wird kaudal entlang der Dorsalseite des nach hinten geschoben. Wischen Sie den Bereich auf dem Rücken zwischen den Vorderbeinen mit 95% Ethanol auf das Fell matt. Drücken Sie die Haut mit einer Pinzette 0,8 mm Graefe (Fine Science Tools, 11050-10) und eine 1 cm zentralen seitlichen Schnitt mit Iris Schere (Fine Science Tools, 14060-10).
- Um eine subkutane Platz für die Pumpe zu erstellen, legen Standardmuster Scheres (Fine Science Tools, 14101-14) in den Schnitt und schieben Sie sie vorsichtig in Richtung der kaudalen Ende des Tieres.
- Mit 1,0 mm Graefe Pinzette (Fine Science Tools, 11650-10), entfernen Sie die Pumpe aus Kochsalzlösung. Halten Sie die offenen Einschnitt mit einer Pinzette und setzen Sie die Pumpe in den Einschnitt mit der osmotischen Pumpe Kappe mit Blick auf den kaudalen Ende des Tieres, und schieben Sie die Pumpe bis zum kaudalen Ende.
- Pinch Wunde geschlossen mit 0,8 mm Zange und wenden eine ausreichende Menge an Vetbond (3M, Kat. Nr. 1469SB) kleben. Halten Sie bis Wunde verschlossen wird.
- Entfernen Sie das Tier von Isofluran-Maske, mit dem Analgetikum spritzen, Meloxicam (0,1 mg / kg sc), und in einen kurzfristigen Erholung Käfig, bis bewussten und mobil. Dann in einer langfristigen Erholung Käfig legen mit Futter und Wasser ad libitum zur Verfügung.
2. α4YFP knock-in Mäuse-Fixierung durch intrakardiale Perfusion
- Machen Lösungen einen Tag vor der Prozedur und lassen bei 4 ° C. Um die Variabilität zu minimieren alle Mäusewird am selben Tag und mit der gleichen Charge von Lösungen perfundiert werden.
- Führen Perfusion Fixierungen in einem gut belüfteten Raum. Spülleitung von peristatische Pumpe (Masterflex Easy Load, 7518-00; Masterflex Pumpen Controller, 60648) mit ddH 2 O.
- In ~ 0.0015g von Heparin (Sigma, Cat # H4784), einem Antikoagulans, bis 20 ml PBS pH 7,6 (Invitrogen, Kat. # 70011).
- Anesthetize α4YFP knock-in Mäuse durch die Injektion intramuskulär eine Mischung aus Ketamin (25 mg / kg, Wyeth Animal Health) und medatomidine Hydrochlorid (0,25 mg / kg, Pfizer) in das Hinterbein Muskeln und sofort setzen das Tier zurück in seine Heimat Käfig.
- Pin Tieres zu einem Styropor-Deckel in ein Metallgehäuse eingelegt worden sein. Wischen Thorax mit 95% Ethanol. Pinch Haut mit einer Pinzette Adson (Fine Science Tools, 91106-12) und öffnen Sie die snip Brusthöhle mit Iris-Schere. Klemmen Sie den Brustkorb mit einem ultrafeinen Gefäßklemme (Fine Science Tools, 13021-12) und setzen Sie das Herz.
- Die Pumpe zu starten PBS bei 4 ml / min und insert eine 23G Butterfly-Nadel (Becton Dickinson, 367.253) in den linken Ventrikel des Tieres. Unmittelbar schnippeln den rechten Vorhof, Blut zu erlauben und Perfusat zu entkommen.
- Perfundieren 20 ml PBS (pH 7,6), dann wurden 30 ml 4% Paraformaldehyd (pH 7,6, mit PBS aus einer 16% PFA Lager verdünnt, Electron Microscopy Sciences, Kat. # 15.710), dann 20 ml 5% Saccharose (pH 7,6) . Wir fanden, dass mehr als Fixierung Autofluoreszenz erhöht. Perfusion mit 5% Saccharose spült restliche PFA aus dem Gehirn, die Autofluoreszenz senkt.
- Entfernen Gehirn und Speicher in 30% Saccharose für 3 Tage.
- Um Gehirne für koronale Schnitte frieren, schneiden Sie das Kleinhirn mit einer Rasierklinge und Ort des Gehirns in einem Kunststoff-Einbettform (VWR, Kat. Nr. 18986-1) rostralen Seite nach oben und tauchen in Oktober Montage Compound (Tissue-Tek, Kat. Nr. 4583) . Frieren in Trockeneis und Lagerung bei -20 ° C vor dem Schneiden.
- § Gehirne (30 &mgr; m dick) auf einem Kryostat und dann auf beschichtete Objektträger übertragen. Lagern Sie die Hirnschnitte bei -20 ° C in Dia-Boxen, die ein wasserfreies Calciumsulfat Stein. Die Dia-Box sollte in einem Zip-Lock versiegelten Tüte sein, um Feuchtigkeit zu vermeiden und die anschließende Gefrierbrand, wenn sie bei -20 ° C gelagert
3. Imaging mit fluoreszierenden nAChRs spektrale konfokale Mikroskopie
- Stellen Sie sicher, Dias haben minimale Risiko gegenüber einer Lichtquelle zu minimieren Ausbleichen.
- Coverslip die Gehirn Abschnitt Dias mit einer Halterung Medium, das nicht inhibiert fluoreszierendes Protein Fluoreszenz. Wir haben gute Erfolge mit Mowiol 4-88 (pH 8,5 in Tris-HCl und Glycerin, EMD-Calbiochem, Kat. Nr. 475904), die nach ein paar Stunden aushärtet. Sicherstellen, dass die Mowiol auf Raumtemperatur äquilibriert, bevor Abdeckung rutscht, um Luftblasen zu vermeiden. Verwenden Sie kein Nagellack beim Abrutschen abzudecken, wie es YFP-Fluoreszenz wird zu stillen.
- Die Bilder werden aufgenommen mit einer Nikon C1si spektralen konfokalen Mikroskop-System. Einzelheiten über die Methode der spektralen konfokalen Imaging und Linear Unmixing sind bietend anderswo 13-15. Die Begründung für die Verwendung eines spektralen konfokalen Mikroskops ist, dass feste Hirngewebe inhärenten Autofluoreszenz hat. Spectral konfokale Bildgebung auf der Nikon C1si verwendet ein Array von 32 Photomultiplier-Detektoren, die Probe ein bestimmter Bereich der Wellenlängen von fluoreszierenden emittierten Lichts, gebrochen räumlich in seine verschiedenen Wellenlängen über ein Gitter dispersiven Element wie ein Prisma weißes Licht in brechenden den Farben des Regenbogens 16. Was gesammelt wird, ist ein Lambda-Stapel Bilder - Bilder bei verschiedenen Wellenlängen des Lichts, so dass ein Emissionsspektrum für jedes Pixel eines Lambda-Stapel von Bildern gesammelt gesammelt. Seit YFP und Gewebeautofluoreszenz jeweils charakteristischen spektralen Signaturen haben, kann der Lambda Stack entfalteten unter Verwendung eines linearen algebraischen Algorithmus Entmischung in separate YFP und autofluoreszierenden Signale (Abb. 2) werden. Somit können sehr genaue Quantifizierung von YFP-Fluoreszenz auch in Gewebe mit einem hohen Grad der Au bestimmt werdentofluorescence.
- Verschiedene Einstellungen können die Bildqualität und die Fluoreszenz-Sammlung Effizienz zu optimieren. Wir werden berichten Einstellungen, die wir verwenden in der Regel aber diese Einstellungen können in Abhängigkeit von der Probe und dem konfokalen Mikroskop werden. Um genau zu quantifizieren Veränderungen in α4YFP Untereinheit Ausdruck mit chronischem Nikotin wir sicherstellen, dass die Graustufe Intensität der Signale aller Pixel unter sättigenden Wert sind (<4095 für 12 Bit Graustufen). Darüber hinaus besteht eine mögliche Zunahme des Signals durch den Rezeptor Hochregulation Aufnahme durch Einstellen der konfokalen so, dass Pixel etwa ein Drittel der Sättigung Wert (~ 1300-1400) oder weniger betragen. Sobald die Einstellungen optimiert sind, werden die Einstellungen beibehalten identisch für alle bildgebenden Sessions und Proben.
- Wir verwenden die folgenden Einstellungen für die Bildgebung α4YFP mit einem 60X Öl CFI Plan Apo VC Ziel (1,40 NA, 0,13 mm Arbeitsabstand): 488 nm Laser-Linie bei 15% der maximalen Übertragung eines 40 mW Argon-Laser, Spektraldetektor Gewinn bei 220, Spektralbereich von 496,5 nm bis 656,5 nm bei 5 nm Auflösung abgebildet, wohnen 512 x 512 Pixel über einen 50 um x 50 um-Bereich, ein Medium Pinholegröße (60 mu m Durchmesser), eine 4,08 Mal Pixel, Mittelung über zwei Scans und 12-Bit-Graustufen.
4. Linear Unmixing der spektralen konfokalen Bildern und Bildanalyse
- Um lineare Entmischung auf einer Beispiel-Bild mit einer spektralen konfokalen Mikroskop aufgenommen durchzuführen, muss man zunächst einen Referenzspektrum für YFP und eine Referenz-Spektrum für Gewebeautofluoreszenz.
- Eine wichtige Voraussetzung für jede Referenz-Spektrum ist es, ein hohes Signal-Rausch-Fluoreszenz-Spektrum mit dem gleichen Laser-Linie für die Abbildung Ihrer Proben werden bebildert zu erhalten. Obwohl der 514 nm Laserlinie des Argon hat eine höhere Effizienz auf Anregung YFP wir es vorziehen, Bild YFP mit dem 488 nm Laser-Linie begeistern, denn es gibt bessere Trennung von der maximalen Emission von YFP und der 488 nm-Linie ist weniger likely zu verzerren den Gipfel, und man kann die gesamte YFP Emissionsspektrum einschließlich der Aufstieg zu Höchstleistungen zu erzielen. Wir Bild löslichen YFP in einer Zelllinie transfiziert, so dass eine starke YFP erhalten wird und das resultierende YFP-Spektrum ist in der Bibliothek von Referenzspektren gespeichert. Transfizierte α4YFP überexprimiert in Zelllinien können ebenfalls verwendet, da es wird auch ein hohes Signal zu Hintergrund-Spektrum werden.
- Um eine Referenz Spektrum der Autofluoreszenz wir Autofluoreszenz Bild aus einer Wildtyp-Maus Gehirn Abschnitt aus den verschiedenen Hirnregionen zu erhalten, dass wir Bild von der Maus α4YFP wollen und erhalten ihre entsprechenden Spektren. Wir verwenden das gleiche Laser-Linie, 488 nm, und Bild mit nahezu identischen Parametern, obwohl wir den Detektor Gain verändern können, Laserintensität oder führen durchschnittlich zu bildgebenden Signal-Rausch zu maximieren.
- Nach Erhalten einer spektralen konfokalen Bildes von einem Bereich des Gehirns α4YFP Maus, wird das Bild dann in seine YFP und autofluor entfaltetenescence Signale durch Anwendung eines linearen Entmischung Algorithmus unter Verwendung der Referenz-Spektrum von YFP und das Referenzspektrum von Wildtyp-Maus Autofluoreszenz von der gleichen Hirnregion.
- Die ungemischten α4YFP Bild kann dann in einer Bildanalyse-Software wie ImageJ (geöffnet werden http://rsbweb.nih.gov/ij/ ) und dann die mittleren Pixel-Intensität für den Bereich von Interesse berechnet. Ein Plugin für ImageJ namens "loci_tools.jar" ( http://www.loci.wisc.edu/bio-formats/imagej ) kann zur Nikon ICS / ids konfokalen Dateien zu importieren.
- Wir wiederholen die gleiche lineare Entmischung und Analyse, um Mäuse in der gleichen Hirnregion Wildtyp, um einen Hintergrund Restwert zu erhalten.
- Dann erhält man die korrigierte mittlere Intensität α4YFP durch Subtraktion der Hintergrund Restwert (4,6) von der mittleren unkorrigierten α4YFP Wert (4,5).
5. Repräsentative Ergebnisse
Wir zeigen ein repräsentatives farbechte Projektion eines Lambda-Stapel von Bildern des medialen Habenula aus einer homozygoten α4YFP Maus (3A) mit einer spektralen konfokalen Mikroskop. Wir haben auch das Emissionsspektrum von einem Bereich von Interesse beinhaltet α4YFP positiven Neuronen aus dem gleichen Lambda Stapel-Aufnahme (3B). Eine deutliche Emissions-Peak liegt bei ~ 527 nm erkennbar, das ist der Gipfel Fluoreszenzemission von YFP. Die medialen Bereich benachbart der Habenula ein Emissionsspektrum fehlt eine spektrale Spitze bei 527 nm, was die Abwesenheit von α4YFP nAChR-Untereinheiten. Nach linearen Entmischung mit Referenzspektren von YFP und Mäusehirn Autofluoreszenz mit signifikante Überlappung der Emission (4), Trennung von YFP und Autofluoreszenzlichtbild-Signal möglich was eine α4YFP ungemischten Bild, ein Bild Autofluoreszenzlichtbild ungemischten und einen Rest-Kanal. Klare Lokalisierung von α4YFP Grippeorescence kann in der dicht gepackten Soma des medialen Habenula (Abb. 4) identifiziert werden.
Im Hippocampus α4YFP wird hauptsächlich in der medialen perforans, der Tempero-Ammonium-Pfad und der alveus 12 lokalisiert. Diese sind alle glutamatergen Innervation des Hippocampus. Wir untersuchten die Auswirkungen von chronischem Nikotin auf α4YFP Ausdruck in der hippocampalen perforans (Abb. 5). Chronische Verabreichung von Nikotin (2 mg / kg / h für 10 Tage) führte zu einem signifikanten Anstieg (69 ± 14%) in α4YFP Fluoreszenz von Kontrolle Kochsalzlösung behandelten Mäusen zu einer chronischen Nikotin behandelten Mäusen (p = 0,001, Wilcoxon-Rangsummentest) ( Abb.. 5).
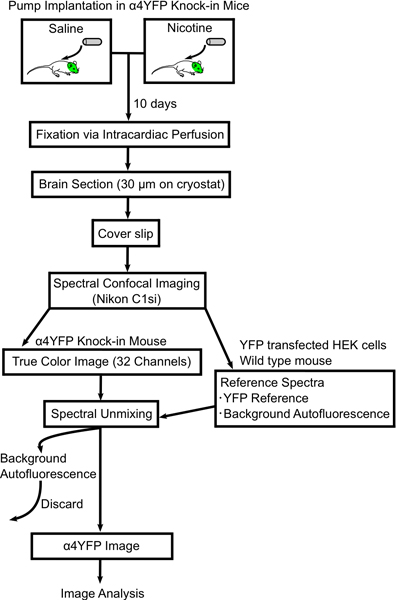
Abbildung 1. Ablaufschema Verfahren, um Veränderungen im Bild α4YFP nAChR-Untereinheiten mit chronischem Nikotin. Mini-osmotischen Pumpen sind entweder mit Kochsalzlösung oder Nikotin gefüllt und subkutan in ALP & implantiertha; 4YFP homozygote Mäuse. Nach 10 Tagen Mäusen perfundiert werden und mit 4% Paraformaldehyd und der Mäusehirne befestigt werden geschnitten (30 um dick) auf Folien. Das Gehirn Abschnitt basiert auf einer spektralen konfokalen Mikroskop (Nikon C1si) abgebildet und spektral in YFP und autofluoreszierenden Bilder unvermischt. Dann werden die Bilder α4YFP werden weiter mit ImageJ-Software analysiert.
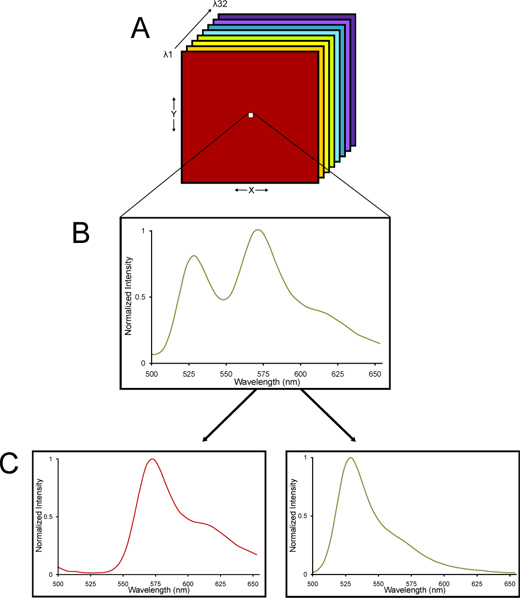
2. Eine schematische Darstellung eines Lambda-Stapel aus einer spektralen konfokalen Mikroskop abgebildet und linear in seine spektralen Komponenten vermischt. (A) einer Lambda-Stapel von Bildern gesammelt. (B) einer Lambda-Stapel besteht aus Bildern mit verschiedenen Wellenlängen des Lichts erfasst, so dass ein Emissionsspektrum für jedes Pixel über die gesamte Stapel gesammelt wird. (C) Seit YFP und Gewebeautofluoreszenz jeweils charakteristischen spektralen Signaturen haben, kann der Lambda Stack entfalteten unter Verwendung eines linearen algebraischen Algorithmus Entmischung in s werdeneparate YFP und autofluoreszierenden Signale. Somit können sehr genaue Quantifizierung der YFP-Fluoreszenz auch in Gewebe mit einem hohen Maß an Autofluoreszenz bestimmt werden.

Abbildung 3. Spectral konfokalen Bild einer Hirnregion auszudrücken α4YFP nAChRs. (A) Ein wahrer Farbprojektionssystem einer Lambda-Stapel von Bildern des medialen Habenula von einem α4YFP Maus mit einem Nikon C1si spektralen konfokalen Mikroskop. (B) Rollen von Spektren aus einer Region von Interesse, die α4YFP enthaltenden Neuronen (grün) und einen Bereich von Interesse außerhalb des medialen Habenula (rot) enthält.
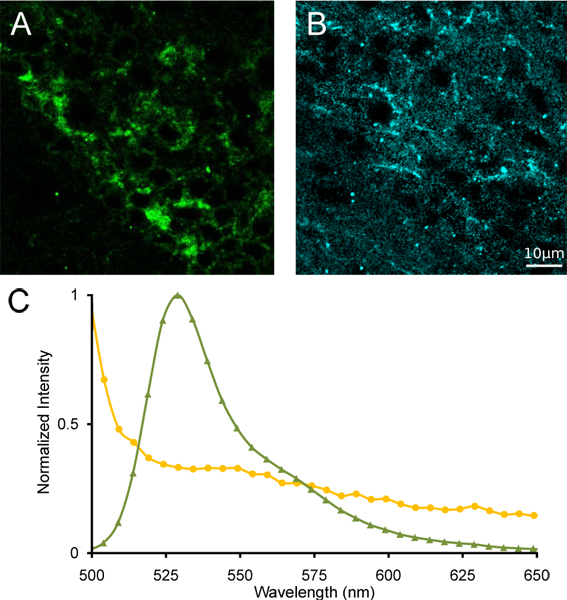
Abbildung 4. Lineare Entmischung des medialen Habenula. (A) Bilder von ungemischten α4YFP und (B) Autofluoreszenz folgende lineare Entmischung. (C) Referenzspektren von YFP (grün TriWinkel) und Autofluoreszenz (gelbe Kreise) für die Entmischung eingesetzt.

Abbildung 5. Hochregulation von α4 nAChR im Hippocampus von α4YFP knock-in Mäusen, die chronische Nikotin. (A) mit lückenlos aneinandergereihten Montage α4YFP Fluoreszenz des Hippocampus. Die beiden gestrichelten Auswahl Bereichen sind die ungefähren Positionen auf dem unteren Schenkel des perforans des Hippocampus, wo Analysen für jede Maus durchgeführt wurden. (B) α4YFP Fluoreszenz war signifikant höher in der perforans von Mäusen, die chronische Nikotin als chronische Salzlösung (*, p = 0,001, Wilcoxon-Rangsummentest). Die Ergebnisse stellen den Mittelwert ± SEM von n = 20 Messungen für beide Kochsalzlösung und chronische Nikotin behandelten Mäusen (5 Mäuse für jede Behandlungsgruppe).

Abbildung 6. Bessere depth Expression α4YFP um Antikörpermarkierung verglichen. XZ orthogonale Ansichten α4YFP Fluoreszenz (A) und VGLUT2 Antikörpers mit Cy5 als sekundäre Markierung (B). (C) zeigt eine größere Rollen Fluoreszenzsignalintensität Abbau über die Tiefe für die Antikörper-Färbung (schwarze Quadrate), um α4YFP (offene Kreise) verglichen.
Diskussion
Verwendung einer fluoreszierenden Rezeptors in einer Knock-in Mausmodell Menge und Lokalisierung eines bestimmten Ions Kanal zu bestimmen bietet eine Reihe von Vorteilen. Im Gegensatz zu Proteinen wie Aktin, das ubiquitär in allen Zellen exprimiert wird, sind die Ionenkanäle in weit geringerer Anzahl vorhanden und ihre Expression variiert zwischen neuronaler Subtypen machen eine genaue Analyse über traditionelle immunhistochemischen Techniken eine Herausforderung. Die α4YFP Genprodukt wird in WT Ebenen zum Ausdru...
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
Anthony Renda wurde von einem University of Victoria Graduate Fellowship Award unterstützt. Myre und Winifred Sim Fund, einer kanadischen Stiftung für Innovation Finanzhilfe, wird British Columbia Knowledge Development Fund - Diese Arbeit wurde von einem Natural Sciences and Engineering Research Council von Kanada Discovery Grant, ein NARSAD Young Investigator Award (bis RN), eine Victoria-Stiftung unterstützt und ein Natural Sciences and Engineering Research Council von Kanada Research Tools und Instrumentation Grant. Wir danken Jillian McKay, Christina Barnes, Ariel Sullivan, Jennifer MacDonald und Daniel Morgado für exzellente Maus Tierhaltung.
Materialien
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| Mini-osmotische Pumpen | Alzet | Modell 2002 | |
| Kochsalzlösung | Teknova | S5819 | |
| (-)-Nicotin Wasserstoff Tartratsalz | Sigma | N5260 | |
| Augentropfen | Novartis | Tear-Gel | |
| Vetbond Leim | 3M | 1469SB | |
| Heparin-Natrium-Salz | Sigma | H4784 | |
| 10x PBS | Invitrogen | 70011 | |
| Ketamin | Wyeth Tiergesundheit | 0856-4403-01 | |
| medatomidine Hydrochlorid | Pfizer | 1950673 | |
| 23G Butterfly-Nadel | Becton Dickinson | 367253 | |
| Paraformaldehyd | Electron Microscopy Sciences | 15710 | |
| Kunststoff Einbettform | VWR | 18986-1 | |
| Oktober Einbettkunststoff | Tissue-Tek | 4583 | |
| Mowiol 4-88 | EMD-Calbiochem | 475904 | pH 8,5 |
Referenzen
- Perry, D. C., Davila-Garcia, M. I., Stockmeier, C. A., Kellar, K. J. Increased nicotinic receptors in brains from smokers: membrane binding and autoradiography studies. J. Pharmacol. Exp. Ther. 289, 1545-1552 (1999).
- Schwartz, R. D., Kellar, K. J. Nicotinic cholinergic receptor binding sites in the brain: regulation in vivo. Science. 220, 214-216 (1983).
- Marks, M. J., Burch, J. B., Collins, A. C. Effects of chronic nicotine infusion on tolerance development and nicotinic receptors. J. Pharmacol. Exp. Ther. 226, 817-8125 (1983).
- Carlezon, W. A. J., Nestler, E. J. Elevated levels of GluR1 in the midbrain: a trigger for sensitization to drugs of abuse. Trends Neurosci. 25, 610-615 (2002).
- Fitzgerald, L. W., Ortiz, J., Hamedani, A. G., Nestler, E. J. Drugs of abuse and stress increase the expression of GluR1 and NMDAR1 glutamate receptor subunits in the rat ventral tegmental area: common adaptations among cross-sensitizing agents. J. Neurosci. 16, 274-2782 (1996).
- Saal, D., Dong, Y., Bonci, A., Malenka, R. C. Drugs of abuse and stress trigger a common synaptic adaptation in dopamine neurons. Neuron. 37, 577-5782 (2003).
- Tsien, R. Y. The green fluorescent protein. Annu. Rev. Biochem. 67, 509-544 (1998).
- Chalfie, M., Tu, Y., Euskirchen, G., Ward, W. W., Prasher, D. C. Green fluorescent protein as a marker for gene expression. Science. 263, 802-805 (1994).
- Feng, G., Mellor, R. H., Bernstein, M., Keller-Peck, C., Nguyen, Q. T., Wallace, M. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28, 41-51 (2000).
- Livet, J., Weissman, T. A., Kang, H., Draft, R. W., Lu, J., Bennis, R. A. Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system. Nature. 450, 56-62 (2007).
- Nashmi, R., Dickinson, M. E., McKinney, S., Jareb, M., Labarca, C., Fraser, S. E. Assembly of α4β2 nicotinic acetylcholine receptors assessed with functional fluorescently labeled subunits: effects of localization, trafficking, and nicotine-induced upregulation in clonal mammalian cells and in cultured midbrain neurons. J. Neurosci. 23, 11554-11567 (2003).
- Nashmi, R., Xiao, C., Deshpande, P., McKinney, S., Grady, S. R., Whiteaker, P. Chronic nicotine cell specifically upregulates functional α4* nicotinic receptors: basis for both tolerance in midbrain and enhanced long-term potentiation in perforant path. J. Neurosci. 27, 8202-8218 (2007).
- Dickinson, M. E., Bearman, G., Tilie, S., Lansford, R., Fraser, S. E. Multi-spectral imaging and linear unmixing add a whole new dimension to laser scanning fluorescence microscopy. BioTechniques. 31, 1272-1278 (2001).
- Nashmi, R., Fraser, S. E., Lester, H., Dickinson, M. E., Periasamy, A., Day, R. N. . Molecular imaging: fret microscopy and spectroscopy. , 180-192 (2005).
- Zimmermann, T., Rietdorf, J., Girod, A., Georget, V., Pepperkok, R. Spectral imaging and linear un-mixing enables improved FRET efficiency with a novel GFP2-YFP FRET pair. FEBS Lett. 531, 245-249 (2002).
- Larson, J. M. The Nikon C1si combines high spectral resolution, high sensitivity, and high acquisition speed. Cytometry A. 69, 825-8234 (2006).
- Melvin, N. R., Sutherland, R. J. Quantitative caveats of standard immunohistochemical procedures: implications for optical disector-based designs. J. Histochem. Cytochem. 58, 577-5784 (2010).
- Jones, I. W., Wonnacott, S. Why doesn't nicotinic ACh receptor immunoreactivity knock out. Trends Neurosci. 28, 343-345 (2005).
- Moser, N., Mechawar, N., Jones, I., Gochberg-Sarver, A., Orr-Urtreger, A., Plomann, M. Evaluating the suitability of nicotinic acetylcholine receptor antibodies for standard immunodetection procedures. J. Neurochem. , (2007).
- Whiteaker, P., Cooper, J. F., Salminen, O., Marks, M. J., McClure-Begley, T. D., Brown, R. W., Collins, A. C., Lindstrom, J. M. Immunolabeling demonstrates the interdependence of mouse brain a4 and b2 nicotinic acetylcholine receptor subunit expression. The Journal of Comparative Neurology. 499, 1016-1038 (2006).
- Marks, M. J., McClure-Begley, T. D., Whiteaker, P., Salminen, O., Brown, R. W. B., Cooper, J., Collins, A. C., Lindstrom, J. M. Increased nicotinic acetylcholine receptor protein underlies chronic nicotine-induced up-regulation of nicotinic agonist binding sites in mouse brain. The Journal of Pharmacology and Experimental Therapeutics. , 337-3187 (2011).
- Marks, M. J., Rowell, P. P., Cao, J. Z., Grady, S. R., McCallum, S. E., Collins, A. C. Subsets of acetylcholine-stimulated 86[Rb]+ efflux and 125[I]-epibatidine binding sites in C57BL/6 mouse brain are differentially affected by chronic nicotine treatment. Neuropharmacology. 46, 1141-1157 (2004).
- King, S. L., Caldarone, B. J., Picciotto, M. R. Beta2-subunit-containing nicotinic acetylcholine receptors are critical for dopamine-dependent locomotor activation following repeated nicotine administration. Neuropharmacology. 47, 132-139 (2004).
- Robinson, S. F., Marks, M. J., Collins, A. C. Inbred mouse strains vary in oral self-selection of nicotine. Psychopharmacology (Berl). 124, 332-339 (1996).
- Sparks, J. A., Pauly, J. R. Effects of continuous oral nicotine administration on brain nicotinic receptors and responsiveness to nicotine in C57Bl/6 mice. Psychopharmacology (Berl). , 141-145 (1999).
- Rahman, S., Zhang, J., Engleman, E. A., Corrigall, W. A. Neuroadaptive changes in the mesoaccumbens dopamine system after chronic nicotine self-administration: a microdialysis study. Neuroscience. 129, 415-4124 (2004).
- Picciotto, M. R., Zoli, M., Rimondini, R., Lena, C., Marubio, L. M., Pich, E. M. Acetylcholine receptors containing the β2 subunit are involved in the reinforcing properties of nicotine. Nature. 391, 173-177 (1998).
- Fowler, C. D., Lu, Q., Johnson, P. M., Marks, M. J., Kenny, P. J. Habenular α5 nicotinic receptor subunit signalling controls nicotine intake. Nature. 471, 597-601 (2011).
- Maskos, U., Molles, B. E., Pons, S., Besson, M., Guiard, B. P., Guilloux, J. P. Nicotine reinforcement and cognition restored by targeted expression of nicotinic receptors. Nature. 436, 103-107 (2005).
- Matta, S. G., Balfour, D. J., Benowitz, N. L., Boyd, R. T., Buccafusco, J. J., Caggiula, A. R., Craig, C. R., Collins, A. C., Damaj, M. I., Donny, E. C., Gardiner, P. S., Grady, S. R., Heberlein, U., Leonard, S. S. Guidelines on nicotine dose selection for in vivo research. Psychopharmacology. 190, 269-319 (2007).
- Lang, T., Rizzoli, S. O. Membrane protein clusters at nanoscale resolution: more than pretty pictures. Physiology (Bethesda). 25, 116-1124 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten