JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
만성 니코틴 관리와 마우스 노크 인의 Fluorescently 태그를 Nicotinic 수용체의 분광 공촛점 이미징
요약
우리는 더 나은 접근 장물과 스펙트럼을 사용하여 수용체의 형광 단백질 태그를 포함한 접근 방법의 조합을 사용하여 니코틴 중독의 메커니즘을 이해하기 위해 CNS의 뉴런의 특정 subtypes의 subcellular 지역 내에서 nicotinic 아세틸콜린 수용체 변화를 quantifying의 소설 기법을 개발했습니다 공촛점 이미징.
초록
중추 신경계 (CNS)의 리간드 게이트 이온 채널은 심각한 의료 및 사회적 결과와 다양한 조건에 연루된다. 예를 들어, 담배 흡연을 통해 니코틴에 대한 중독은 조기 사망 전 세계 (세계 보건기구)의 주요 원인이며 가능성이 뇌 1 이온 채널 배포판의 변경에 의해 발생합니다. 1-3 뇌 조직의 nicotinic 아세틸콜린 수용체 (nAChRs)의 증가 숫자 모두 설치류 동물과 인간 결과에서 만성 니코틴 노출. 마찬가지로, glutamatergic GluN1 또는 GluA1 채널의 변경 같은 코카인, 암페타민과 약물 4-6와 같은 다른 중독성 약물에 sensitization를 실행에 연루되었습니다.
따라서 특정 이온 채널의 유통 및 표현 패턴을 매핑하고 계량하는 능력은 중독의 메커니즘을 이해하는데에 매우 중요합니다. 뇌의 특정 지역과 관련된 EF의 연구개별 약물 fects 같은 방사성 리간드와 같은 기술의 출현에 의해 승진되었다. 그러나 방사성 리간드 바인딩의 낮은 공간 해상도는 뉴런의 특정 subtypes에 리간드 게이트 이온 채널을 계량하는 능력을 방지한다.
같은 녹색 형광 단백질 (GFP) 및 여러 색상의 변형과 같은 유전적으로 인코딩 형광등 기자는 생물학 7 분야에 혁명을했습니다. 유전자 태그를 추가하여 하나가 생체내 7-10에서 단백질을 시각화 수있는 내생 단백질에 형광 기자. 프로브로 fluorescently 태그 단백질의 한 가지 이점은 nonspecificity하고 대상 단백질에 대한 접근의 문제가 항체 이용 철폐입니다. 우리는 교양 transfected 세포 11 포스터 공명 에너지 전송 (무서워)를 사용하여 수용체 어셈블리의 연구를 활성화 fluorescently 라벨 nAChRs,이 전략을 사용했습니다. 최근에는 우리가 knoc를 사용한K-의 스펙트럼 공촛점 현미경을 통해 12 CNS의 뉴런에서 submicrometer 해상도의 수용체 전의 생체내의 정확한 양을 정함있게 α4 nAChR의 subunits (α4YFP를) 태그로 노란색 형광 단백질과 엔지니어 마우스에 접근합니다. 타겟팅 형광 장물에 돌연변이 wildtype 생쥐에서 태그가 지정되지 않은 수용체에 비해 표현과 수용체의 규제의 정상적인 수준을 생산, 내생 현장에와 토착 발기인의 통제하에 통합됩니다. 이 장물의 접근법은 fluorescently 다른 이온 채널에 태그를 확장하고 CNS에있는 수용체를 시각화하고 quantifying의 강력한 접근 방식을 제공 할 수 있습니다.
본 논문에서 우리는 만성 니코틴에 노출된 후 특정 CNS의 뉴런에 nAChR 표현의 변화를 계량하기위한 방법론을 설명합니다. 우리의 방법은 미니 삼투 펌프 주입, intracardiac 관류 고정, 이미징 및 fluorescently 태그가 nicotinic 레크 리에의 분석을 포함에서 eptor의 subunits α4YFP 장물의 생쥐 (그림 1). 우리는 자세하게 정확하게 α4YFP 형광 신호를 얻기 위해 autofluoresent 신호를 뺀것하는 선형 스펙트럼 unmixing 알고리즘과 함께 스펙트럼 공촛점 현미경을 사용하여 우리의 이미징 방법론에 대해 설명 고정 뇌 tissue.We에서 autofluorescence을 최소화하기 위해 고정 기술을 최적화했습니다. 마지막으로, 우리는 해마의 중간 perforant 경로에 α4YFP 수용체의 만성 니코틴을 유발 upregulation 결과를 보여줍니다.
프로토콜
1. 펌프 주입
- 펌프 주입하기 전에, 작성하여 공기 방울을 소개하지 않는 신중하다고 Alzet 미니 삼투 펌프 (Alzet, 모델 2002, 쿠퍼 티노, 미국) 준비합니다. 미니 삼투 펌프의이 모델은 14 일 동안 0.5 μl / 시간의 속도로 솔루션을 제공합니다. 멸균 조건을 확인합니다. 비어 및 채워진 펌프를 달다. 실험 (십일 주입 후)의 결론에서 펌프에 남아있는 액체는 주사기와 바늘로 제거하고 펌핑 볼륨을 계산하는 데 무게하실 수 있습니다.
- 제어 솔루션과 펌프는 (0.9 %는 W / V, Teknova, S5819, 홀리스터, 미국) 염분이 포함되어 있습니다. (-)-니코틴 수소 주석산 소금 (시그마, 고양이 # N5260) 식염수에 희석된다 (0.9 % W / V) 및 0.22 μm의 주사기 엔드 필터를 통해 여과하여 멸균 니코틴 용액의 1 M 주식 솔루션을 준비합니다. 우리는 이전에 10 일간 0.4과 2 밀리그램 / ㎏ / HR (니코틴 자유 기지로 계산)에 니코틴을 투여했습니다.
- 세 식염수 욕조을 (3 준비10cm의 염분)은 배양 접시를 가득 채웠다. 펌프가 충만하고 공을되면 바깥쪽에 약물의 성분을 제거하는 각 연속 식염 온천에 철저하게 펌프를 씻는다. 잠그다 별도 식염수 용기에 제어 및 니코틴 펌프를 유지, 수술까지 저장 용량을 생리 식염수에 펌프를 가득 채웠다.
- 건강 회복을 촉진하고 사후 수술 감염의 위험을 줄이려면 장기적인 복구를 위해 준비 깨끗한 새장을합니다.
- 즉시 수술에 따라 단기 회복 들어, 손난로 및 가열 램프가 들어있는 새장을 준비합니다.
- 만성 니코틴 효과를 조사하기 위해 우리는 5-6 homozygous α4YFP을 가지고 노크 -에서 각 그룹의 생쥐 (2-3 개월) (컨트롤이나 니코틴). α4YFP 노크는 기능에 마우스 라인 C57BL/6J 마우스 변형까지 10 세대에 backcrossed되었습니다. 우리 모두는 생쥐의 연령과 성별에이 연구를 위해 동일하고 모든 수술이 다양성을 최소화하기 위해 같은 날 수행되었는지 확인하기 바랍니다. HY을 방지하려면수술 도중과 이후 생쥐에 pothermia은 무균 수술 드레이프로 덮여 가열 패드로 수술 테이블을 장비.
- 3 L / 분, 산소 3 % isoflurane과 α4YFP 장물에 마우스를 유도하고 2.5 L / 분 산소의 마취 및 1% isoflurane를 유지합니다. 수술의 완료에 isoflurane 빠르게 시스템을 지웁니다 때문에 isoflurane 마취를 선호하고 마우스 ~ 2 분 이내에 의식 및 모바일입니다. 각막 손상을 피하기 위해 (눈물 - 젤, 노바티스) 즉시 drops 눈을 적용합니다.
- 펌프는 목 뒤쪽에 피부 절개를 통해 subcutaneously 이식하고 펌프 뒤쪽의 등 부분의 측면 아래로 caudally 밀고있다. 무광택 ~ 95 %의 에탄올 모피 입은 앞발 사이의 뒷면에 영역을 닦아주십시오. 0.8mm Graefe의 포셉과 피부 (파인 과학 도구, 11050-10)을 꼬집어 및 홍채 가위 (파인 과학 도구, 14060-10)를 사용 1cm 중앙 측면 몫을합니다.
- 표준 패턴 가위를 넣고 펌프를위한 피하 공간을 만들려면S (파인 과학 도구, 14101-14) 절개로와 동물의 꼬리 끝쪽으로 신중하게 그들을 밀어.
- 1.0 mm Graefe의 포셉 (파인 과학 도구, 11650-10)를 사용하여 염분으로부터 펌프를 제거합니다. 절개 열린 이용하여 집게를 잡고 동물의 꼬리 끝을 마주 삼투 펌프 캡과 함께 절개로 펌프를 삽입하고 꼬리 끝까지 펌프를 눌러.
- 핀치는 0.8mm 집게를 사용하여 종료 떠나서 Vetbond의 적절한 금액 (3M, 고양이 # 1469SB) 접착제를 적용합니다. 상처는 봉쇄 때까지.
- isoflurane 마스크에서 동물을 제거 의식 및 모바일 때까지 단기 복구 케이지로, 진통제와 함께 meloxicam (0.1 밀리그램 / kg SC) 및 장소를 주입. 그렇다면 음식과 물을 가능한 광고 libitum으로 장기적인 복구 케이지에 넣습니다.
2. α4YFP 노크 -에서 마우스 고정 intracardiac 재관류에 의해
- 절차는 이전 솔루션을 하루 만들어 모든 생쥐 변화를 최소화하기 위해 4 ° C.에두고같은 날과 솔루션 같은 배치와 perfused됩니다.
- 통풍이 잘 영역에서 재관류의 fixations을 수행합니다. ddH 2 O에있는; peristatic 펌프 (Masterflex 펌프 컨트롤러, 60,648 Masterflex 쉽고로드, 7518-00)의 플러쉬 라인
- 20 ML PBS pH는 7.6 (Invitrogen, 고양이 # 70011)로 헤파린의 ~ 0.0015g (시그마, 고양이 # H4784), 항응고제를 추가합니다.
- 마취 α4YFP 뒷다리 다리 근육에 intramuscularly 300ml의 혼합 (25 밀리그램 / kg, Wyeth 동물 건강)과 medatomidine 하이드로 클로라이드 (0.25 밀리그램 / kg, 화이자)를 주입하여 노크 -에서 마우스와 즉시 해당 가정 케이지로 다시 동물을 놓습니다.
- 금속 트레이에 삽입 스티로폼 뚜껑에 동물을 핀. 95 % 에탄올로 흉부를 닦아주십시오. adson 포셉 (파인 과학 도구, 91106-12) 및 싹둑와 핀치 피부는 홍채 가위로 흉강을 엽니다. 울트라 미세 hemostat (파인 과학 도구, 13021-12)를 사용 ribcage를 고정하고 심장을 폭로.
- 네 ML / 분 전에서 PBS를 펌핑 시작동물의 좌심실에 23G 나비 바늘 (Becton 디킨슨, 367,253)를 nsert. 즉시 혈액을 허용하고 피해 perfusate 권리 중앙홀을 자르지.
- PBS (산도 7.6)의 20 ML을 Perfuse, 4 % paraformaldehyde (16% PFA 혈통 PBS에 희석 산도 7.6, 전자 현미경 과학, 고양이 # 15710)를 입력한 다음 30 ML, 5 % 자당의 다음 20ml (산도 7.6) . 우리는 이상의 고정은 autofluorescence 증가 것으로 나타났습니다. 5 % 자당과 재관류는 autofluorescence 감소 두뇌에서 잔류 PFA을 물에 빨고.
- 3 일간 30 % 자당의 두뇌와 저장소를 제거합니다.
- 코로나 sectioning 위해 머리를 고정하기 위해, 10 월 마운트 컴파 운드 (조직 - 테크, 고양이 # 4583)에서 (VWR, 고양이 # 18986-1) 플라스틱 삽입 몰드에서 주동이의 측면 위쪽 및 잠수함을 면도날과 장소 두뇌와 소뇌 잘라 . 깔끔히 전에 -20 ° C에서 드라이 아이스와 저장소에 정지해.
- 그라 이오 스탯의 다음 섹션 두뇌 (30 μm의 두께)는 코팅 슬라이드로 전송할 수 있습니다. & -20에서 뇌 부분을 저장있길 졌는데, 한 명은 무수 칼슘 황산염의 석재를 포함하는 슬라이드 상자에 C #. -20 ° C.에 저장하면 슬라이드 박스는 습기를 방지하고 후속 냉동된 자국하도록 지퍼 잠금 밀폐 봉지에 있어야
3. 스펙트럼 공촛점 현미경을 사용하여 이미징 형광의 nAChRs
- 슬라이드 photobleaching 최소화하기 위해 어떠한 광원에 대한 최소한의 노출을 확인합니다.
- 형광 단백질 형광을 억제하지 않는 장착 매체와 두뇌 섹션 슬라이드를 Coverslip. 우리는 몇 시간 후에 견고하게 Mowiol 4-88의 좋은 성공 (트리스-HCL과 글리세롤의 산도 8.5, EMD-Calbiochem, 고양이 # 475904)를합니다. Mowiol가 기포를 방지하기 위해 줄어 드 커버하기 전에 실온에 equilibrates 확인하십시오. 그것이 YFP의 형광을 끄지하므로 걸리고 표지 때 매니큐어네 사용하지 마십시오.
- 이미지는 니콘 C1si 스펙트럼 공촛점 현미경 시스템을 사용 찾았습니다. 스펙트럼 공촛점 이미징 및 선형 unmixing의 방법에 관한 세부 사항 제공합니다라 다른 곳에서 13-15. 스펙트럼 공촛점 현미경을 사용하기위한 근거는 고정된 뇌 조직은 고유 autofluorescence를 가지고있다는 것입니다. 니콘 C1si의 스펙트럼 공촛점 영상이 예제는 형광 방출되는 빛의 파장의 지정된 범위가 단지 색상의 무지개로 하얀 빛을 refracting 프리즘처럼 격자 흩어지는 요소를 통해 자사의 다양한 파장에 spatially 굴절되는 32 photomultiplier 튜브 감지기의 배열을 사용 16. 방출 스펙트럼은 이미지의 람다 스택의 각 픽셀에 대해 수집된 있도록 빛의 다른 파장에서 수집된 이미지 - 어떻게 수집되는 것은 영상의 람다 스택입니다. YFP 및 조직 autofluorescence 각 특성 스펙트럼 서명을 가지고 있기 때문에, 람다 스택은 별도의 YFP 및 autofluorescent 신호 (그림 2)로 선형 unmixing 대수 알고리즘을 사용하여 deconvolved 수 있습니다. 따라서 YFP 형광 매우 정확한 양을 정함은 AU의 상당 수준에서도 조직에서 확인할 수 있습니다tofluorescence.
- 각종 설정은 이미지 품질과 형광 수집 효율을 최적화하기 위해 조정할 수 있습니다. 우리는 우리가 일반적으로 사용하는 설정을보고되지만 이러한 설정은 샘플과 공촛점 현미경에 따라 조정할 수 있습니다. 정확하게 α4YFP subunit 발현의 변화를 정할 만성 니코틴과 함께 우리는 모두 픽셀의 신호의 그레이 스케일 수준의 강도가 (12 비트 그레이 스케일을위한 <4095) 포화 값 이하임을 보장합니다. 더욱이, 우리는 그 픽셀 하나 주변의 포화 값 중 세번째 (~ 1300년부터 1400년까지) 이하가되도록 공촛점 설정을 조정하여 인해 수용체 upregulation에 신호의 잠재적인 증가를 위해 숙박이 가능합니다. 설정이 최적화되면, 설정은 모든 이미징 세션과 샘플이 동일 유지됩니다.
- 40 MW 아르곤 레이저의 15 % 최대한의 전송에서 488 nm의 레이저 라인 : 우리는 60X 석유 CFI 계획 APO VC 목표 (1.40 NA, 0.13 mm 작동 거리)를 사용하여 이미징 α4YFP에 대해 다음 설정을 사용, 220의 분광 검출기 이득, 5 nm의 해상도에서 496.5 nm의로 656.5 nm의에서 몇 군데 스펙트럼 범위, 50 μm의 X 50 μm의 영역 이상 512 X 512 픽셀, 중형 핀홀 크기 (60 μm의 제품 diam), 4.08 픽셀은 시간을 머물러 이 검사와 그레이 스케일의 12 비트 이상의 평균.
4. 스펙트럼 공촛점 이미지 및 이미지 분석의 선형 unmixing
- 스펙트럼 공촛점 현미경으로 찍은 샘플 이미지를 선형 스펙트럼 unmixing을 수행하려면, 하나는 먼저 YFP의 참조 스펙트럼과 조직 autofluorescence의 참조 스펙트럼을 획득해야합니다.
- 어떤 기준 스펙트럼을위한 중요한 요건은 샘플 이미지에 사용된 것과 같은 레이저 라인 군데 소음 형광 스펙트럼에 높은 신호를 얻을 것입니다. 아르곤의 514 nm의 레이저 라인은 더 YFP의 피크 방출의 분리와 488 nm의 라인이 덜 줄것은가 있기 때문에 우리는 488 nm의 레이저 라인과 이미지 YFP 것을 선호 YFP를 자극 높은 여기 효율성을 가지고 있지만ikely 피크를 왜곡하고 하나는 최대 상승을 포함한 전체 YFP 방출 스펙트럼을 얻을 수 있습니다. 우리는 이미지 용해 YFP 강력한 YFP 신호가 얻어진다 있도록 세포주에 transfected 및 결과 YFP 스펙트럼을 참조 스펙트럼 우리의 라이브러리에 저장됩니다. 또한 배경 스펙트럼에 높은 신호를 제공하므로 세포 라인 표현여 Transfected α4YFP도 사용할 수 있습니다.
- 우리가 α4YFP 마우스의 이미지를 의도하는 다양한 두뇌 지역에서 wildtype 마우스 뇌 섹션에서 autofluorescence 우리 이미지 autofluorescence의 참조 스펙트럼을 구하여 해당 스펙트럼을 구하십시오.하려면 우리가, 레이저 강도를 검출기 이득을 변경하거나 노이즈에 신호를 최대화하기 위해 평균 이미징을 수행할 수도 있지만 우리는 같은 레이저 라인, 488 nm의, 거의 동일한 매개 변수를 사용하여 이미지를 사용합니다.
- α4YFP 마우스의 뇌 영역에서 스펙트럼 공촛점 이미지를 획득하면 이미지가 자사의 YFP 및 autofluor로 deconvolved된다동일한 뇌 영역에서 YFP의 참조 스펙트럼과 wildtype 마우스 autofluorescence의 참조 스펙트럼을 사용하여 선형 스펙트럼 unmixing 알고리즘을 적용하여 escence 신호.
- unmixed α4YFP 이미지는 다음과 같은 ImageJ (같은 이미지 분석 소프트웨어에서 열 수 http://rsbweb.nih.gov/ij/ ) 후 평균 픽셀의 강도는 관심 지역에 대해 계산됩니다. ImageJ를위한 플러그인은 "loci_tools.jar"(라고 http://www.loci.wisc.edu/bio-formats/imagej ) 니콘 ICS / ID가 공촛점 파일을 가져올 수 있습니다.
- 우리는 배경 잔여 가치를 얻기 위해 동일한 뇌 영역에 마우스를 wildtype하는 동일한 선형 스펙트럼 unmixing와 분석을 반복합니다.
- 그런 다음 하나는 의미 uncorrected α4YFP 값 (4.5)에서 배경 잔류 값 (4.6) 빼는 방법으로 수정 평균 α4YFP 강도를 얻습니다.
5. 대표 결과
우리는 스펙트럼 공촛점 현미경으로 찍은 homozygous α4YFP 마우스 (그림 3A)에서 중간 habenula의 이미지 람다 스택의 대표적인 진정한 컬러 투영을 보여줍니다. 우리는 또한 동일한 람다 스택 이미지 (그림 3B)에서 α4YFP 긍정적인 뉴런을 포함하는 관심 영역에서 발광 스펙트럼을 보여줍니다. 뚜렷한 발광 피크는 ~ 527 nm의에서 분명 어느 YFP의 정상 형광 방출이다. 중간 habenula 이웃 지역 α4YFP nAChR의 subunits의 부재를 나타내는 527 nm의 스펙트럼에서 피크가 부족 발광 스펙트럼을 보여줍니다. 중요한 방출의 중첩 (그림 4), YFP의 분리 및 autofluorescent 신호 YFP의 참조 스펙트럼과 마우스 뇌 autofluoresence를 사용하여 선형 스펙트럼 unmixing을 준수하면 매우 저조한 α4YFP unmixed 이미지, autofluorescent unmixed 이미지와 나머지 채널이 가능합니다. α4YFP 독감의 지우기 지방화orescence는 중간 habenula (그림 4)의 단단히 포장 소마에서 확인할 수 있습니다.
해마의 α4YFP에서는 주로 중간 perforant 경로 tempero-ammonic 경로와 alveus 12 현지있다. 이들은 해마의 모든 glutamatergic innervation 있습니다. 우리는 hippocampal perforant 경로 (그림 5)에서 α4YFP 표현에 만성 니코틴의 효과를 조사했다. 니코틴의 만성 행정 (10 일간 2 밀리그램 / ㎏ / HR)은 만성적인 니코틴 취급 생쥐 (P = 0.001, 윌콕슨이 순위 합계 테스트)에 대한 제어 염분 처리된 생쥐에서 α4YFP 형광 크게 증가 (69 ± 14 %) 결과 ( 그림. 5).
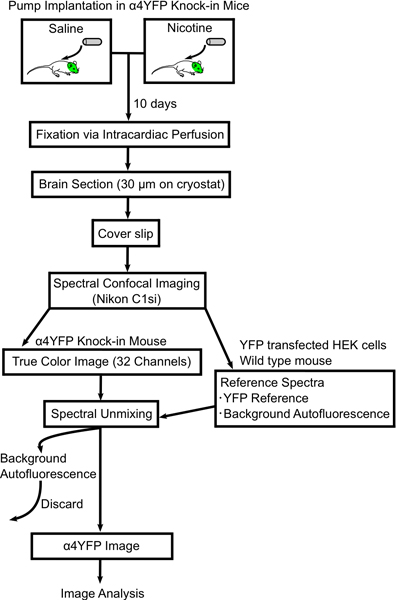
만성 니코틴과 α4YFP의 nAChR의 subunits의 이미지 변화 과정을 보여주는 그림 1. 플로우 차트. 미니 삼투 펌프는 염분이나 니코틴 하나 가득하고 & 탁월한에 subcutaneously 이식된다헥타르; 4YFP homozygous 생쥐. 10 일 마우스가 4 % paraformaldehyde와 마우스 머리로 perfused 및 고정 후 슬라이드에 (30 μm의 두께) sectioned 있습니다. 뇌 부분 스펙트럼 공촛점 현미경 (니콘 C1si)에 몇 군데와 spectrally YFP 및 autofluorescent 이미지로 unmixed있다. 그런 다음 α4YFP 이미지는 ImageJ 소프트웨어와 더 분석하고 있습니다.
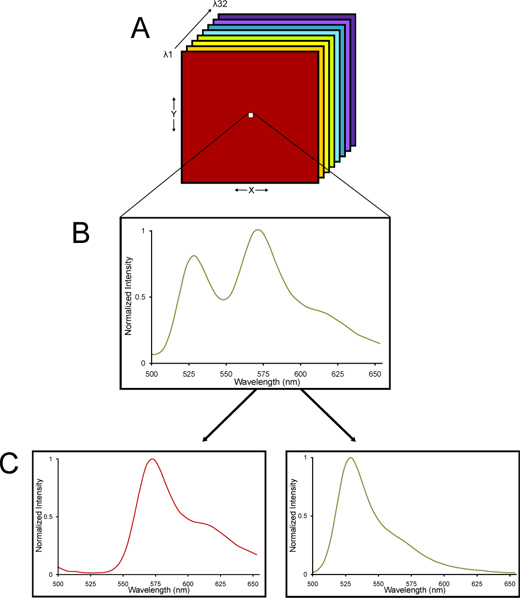
그림 2. 스펙트럼 공촛점 현미경에서 몇 군데와 선형의 스펙트럼 구성 요소로 unmixed 람다 스택의 개략도. () 이미지의 람다 스택이 수집됩니다. (B) 람다 스택 방출 스펙트럼은 전체 스택에 걸쳐 각 픽셀에 대해 수집하도록 빛의 다른 파장에서 수집된 이미지로 구성되어 있습니다. YFP 및 조직 autofluorescence는 각 특성 스펙트럼 서명을 가지고 있기 때문에 (C), 람다 스택은의로 선형 unmixing 대수 알고리즘을 사용하여 deconvolved 수eparate YFP 및 autofluorescent 신호. 따라서 YFP 형광 매우 정확 부량도 autofluorescence 높은 수준과 조직을 결정하실 수 있습니다.

그림 3. α4YFP의 nAChRs을 표현하는 뇌 영역의 스펙트럼 공촛점 이미지입니다. 니콘 C1si 스펙트럼 공촛점 현미경으로 촬영한 α4YFP 마우스 중간 habenula의 이미지 람다 스택의 () 진정한 컬러 투영. (B) α4YFP 포함하는 뉴런 (녹색), 그리고 중간 habenula (적색) 이외의 관심 영역을 포함하고 관심 영역에서 스펙트럼의 음모.
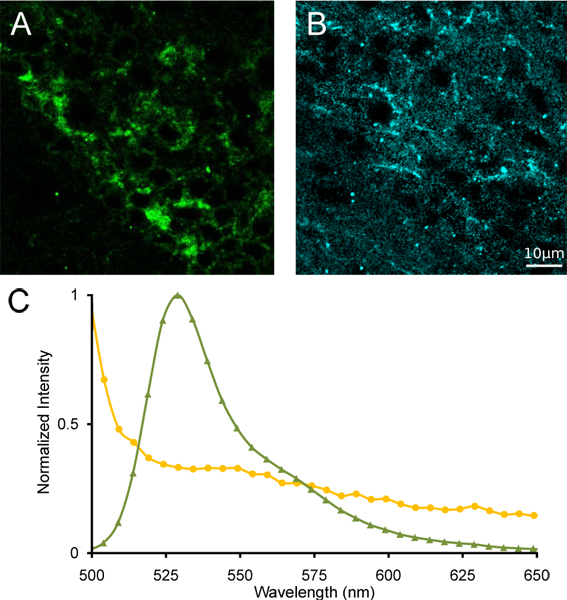
그림 4. 중간 habenula의 선형 스펙트럼 unmixing. unmixed α4YFP의 () 이미지와 (B) autofluorescence 따라 선형 스펙트럼 unmixing. YFP의 (C) 참조 스펙트럼 (녹색 트라이앵글)와 autofluorescence (노란색 동그라미)은 스펙트럼 unmixing을 위해 사용됩니다.

그림 5.의 해마에서 α4 nAChRs의 Upregulation α4YFP 장물의 만성 니코틴에 노출된 생쥐. () 해마에서 α4YFP 형광 타일 몽타주. 두 점선 선택 영역 분석은 각각의 마우스에 대해 수행되었다 해마의 perforant 경로의 열등한 사지의 대략적인 위치입니다. (B) α4YFP 형광 만성 식염수 (*, P = 0.001, 윌콕슨이 순위 합계 테스트)보다 만성 니코틴에 노출된 생쥐들의 perforant 경로에 상당히 높은했습니다. 결과가 나타내는 의미 ± SEM N에서 염분과 만성 모두 니코틴 취급 생쥐 (각 치료 그룹 5 생쥐)에 대한 측정 = 20.을

그림 6. 나은 Dα4YFP의 epth 표현은 항체 라벨링에 비해. 보조 라벨 (B)와 Cy5와 α4YFP 형광 ()와 VGlut2 항체의 XZ 직교 전망이 있습니다. (C) α4YFP (오픈 원)에 비해 항체 염색법 (검은색 사각형)에 대한 심도 이상의 큰 형광 신호 강도 저하를 보여주는 음모.
Access restricted. Please log in or start a trial to view this content.
토론
수량 및 특정 이온 채널의 지방화를 결정하는 장물의 마우스 모델에서 형광 수용체의 사용은 장점 번호를 제공합니다. 이러한 ubiquitously 모든 셀에 표시됩니다 actin 등의 단백질과 대조적으로 이온 채널이 훨씬 더 적은 숫자로 존재하는 그들의 표정은 도전하는 전통 immunohistochemical 기법을 통해 정확한 분석하기의 연결을 subtypes 사이에 다릅니다. α4YFP 유전자 제품은 동일한 발기인, 강화와 인신 ...
Access restricted. Please log in or start a trial to view this content.
공개
우리는 공개 할게 없다.
감사의 말
앤서니 Renda는 빅토리아 대학원 화목 상을 대학에 의해 지원되었다. Myre와 위너 프 리드 그렇소 기금, 혁신 기금, 브리티시 컬럼비아 기술 개발 기금을위한 캐나다 재단 -이 연구는 자연 과학 및 캐나다의 발견 그랜트 공학 연구 협의회, NARSAD 젊은 탐정 수상 (RN까지), 빅토리아 재단에 의해 지원되었다 그리고 자연 과학 및 캐나다 연구 도구 및 계측 그랜트 공학 연구 협의회. 우리는 우수한 마우스 축산을 위해 질리언 맥케이, 크리스티나 반즈, 에리얼 설리반, 제니퍼 맥도날드와 다니엘 Morgado 감사드립니다.
Access restricted. Please log in or start a trial to view this content.
자료
| 시약의 이름 | 회사 | 카탈로그 번호 | 댓글 |
| 미니 삼투 펌프 | Alzet | 모델 2002 | |
| 식염 | Teknova | S5819 | |
| (-)-니코틴 수소 주석산 소금 | 시그마 | N5260 | |
| 점안액 | 노바티스 | 눈물 - 겔 | |
| Vetbond 접착제 | 3M | 1469SB | |
| 헤파린 나트륨 소금 | 시그마 | H4784 | |
| 10X PBS | Invitrogen | 70,011 | |
| 케타민을 | WyetH 동물 건강 | 0856-4403-01 | |
| medatomidine 하이드로 클로라이드 | 화이자 | 1,950,673 | |
| 23G 나비 바늘 | Becton 디킨슨 | 367,253 | |
| paraformaldehyde | 전자 현미경 과학 | 15,710 | |
| 플라스틱 삽입 몰드 | VWR | 18986-1 | |
| 10월 장착 컴파 운드 | 조직 - 테크 | 4583 | |
| Mowiol 4-88 | EMD-Calbiochem | 475,904 | 산도 8.5 |
참고문헌
- Perry, D. C., Davila-Garcia, M. I., Stockmeier, C. A., Kellar, K. J. Increased nicotinic receptors in brains from smokers: membrane binding and autoradiography studies. J. Pharmacol. Exp. Ther. 289, 1545-1552 (1999).
- Schwartz, R. D., Kellar, K. J. Nicotinic cholinergic receptor binding sites in the brain: regulation in vivo. Science. 220, 214-216 (1983).
- Marks, M. J., Burch, J. B., Collins, A. C. Effects of chronic nicotine infusion on tolerance development and nicotinic receptors. J. Pharmacol. Exp. Ther. 226, 817-8125 (1983).
- Carlezon, W. A. J., Nestler, E. J. Elevated levels of GluR1 in the midbrain: a trigger for sensitization to drugs of abuse. Trends Neurosci. 25, 610-615 (2002).
- Fitzgerald, L. W., Ortiz, J., Hamedani, A. G., Nestler, E. J. Drugs of abuse and stress increase the expression of GluR1 and NMDAR1 glutamate receptor subunits in the rat ventral tegmental area: common adaptations among cross-sensitizing agents. J. Neurosci. 16, 274-2782 (1996).
- Saal, D., Dong, Y., Bonci, A., Malenka, R. C. Drugs of abuse and stress trigger a common synaptic adaptation in dopamine neurons. Neuron. 37, 577-5782 (2003).
- Tsien, R. Y. The green fluorescent protein. Annu. Rev. Biochem. 67, 509-544 (1998).
- Chalfie, M., Tu, Y., Euskirchen, G., Ward, W. W., Prasher, D. C. Green fluorescent protein as a marker for gene expression. Science. 263, 802-805 (1994).
- Feng, G., Mellor, R. H., Bernstein, M., Keller-Peck, C., Nguyen, Q. T., Wallace, M. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28, 41-51 (2000).
- Livet, J., Weissman, T. A., Kang, H., Draft, R. W., Lu, J., Bennis, R. A. Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system. Nature. 450, 56-62 (2007).
- Nashmi, R., Dickinson, M. E., McKinney, S., Jareb, M., Labarca, C., Fraser, S. E. Assembly of α4β2 nicotinic acetylcholine receptors assessed with functional fluorescently labeled subunits: effects of localization, trafficking, and nicotine-induced upregulation in clonal mammalian cells and in cultured midbrain neurons. J. Neurosci. 23, 11554-11567 (2003).
- Nashmi, R., Xiao, C., Deshpande, P., McKinney, S., Grady, S. R., Whiteaker, P. Chronic nicotine cell specifically upregulates functional α4* nicotinic receptors: basis for both tolerance in midbrain and enhanced long-term potentiation in perforant path. J. Neurosci. 27, 8202-8218 (2007).
- Dickinson, M. E., Bearman, G., Tilie, S., Lansford, R., Fraser, S. E. Multi-spectral imaging and linear unmixing add a whole new dimension to laser scanning fluorescence microscopy. BioTechniques. 31, 1272-1278 (2001).
- Nashmi, R., Fraser, S. E., Lester, H., Dickinson, M. E. Molecular imaging: fret microscopy and spectroscopy. Periasamy, A., Day, R. N. , Oxford University Press. 180-192 (2005).
- Zimmermann, T., Rietdorf, J., Girod, A., Georget, V., Pepperkok, R. Spectral imaging and linear un-mixing enables improved FRET efficiency with a novel GFP2-YFP FRET pair. FEBS Lett. 531, 245-249 (2002).
- Larson, J. M. The Nikon C1si combines high spectral resolution, high sensitivity, and high acquisition speed. Cytometry A. 69, 825-8234 (2006).
- Melvin, N. R., Sutherland, R. J. Quantitative caveats of standard immunohistochemical procedures: implications for optical disector-based designs. J. Histochem. Cytochem. 58, 577-5784 (2010).
- Jones, I. W., Wonnacott, S. Why doesn't nicotinic ACh receptor immunoreactivity knock out. Trends Neurosci. 28, 343-345 (2005).
- Moser, N., Mechawar, N., Jones, I., Gochberg-Sarver, A., Orr-Urtreger, A., Plomann, M. Evaluating the suitability of nicotinic acetylcholine receptor antibodies for standard immunodetection procedures. J. Neurochem. , (2007).
- Whiteaker, P., Cooper, J. F., Salminen, O., Marks, M. J., McClure-Begley, T. D., Brown, R. W., Collins, A. C., Lindstrom, J. M. Immunolabeling demonstrates the interdependence of mouse brain a4 and b2 nicotinic acetylcholine receptor subunit expression. The Journal of Comparative Neurology. 499, 1016-1038 (2006).
- Marks, M. J., McClure-Begley, T. D., Whiteaker, P., Salminen, O., Brown, R. W. B., Cooper, J., Collins, A. C., Lindstrom, J. M. Increased nicotinic acetylcholine receptor protein underlies chronic nicotine-induced up-regulation of nicotinic agonist binding sites in mouse brain. The Journal of Pharmacology and Experimental Therapeutics. , 337-3187 (2011).
- Marks, M. J., Rowell, P. P., Cao, J. Z., Grady, S. R., McCallum, S. E., Collins, A. C. Subsets of acetylcholine-stimulated 86[Rb]+ efflux and 125[I]-epibatidine binding sites in C57BL/6 mouse brain are differentially affected by chronic nicotine treatment. Neuropharmacology. 46, 1141-1157 (2004).
- King, S. L., Caldarone, B. J., Picciotto, M. R. Beta2-subunit-containing nicotinic acetylcholine receptors are critical for dopamine-dependent locomotor activation following repeated nicotine administration. Neuropharmacology. 47, 132-139 (2004).
- Robinson, S. F., Marks, M. J., Collins, A. C. Inbred mouse strains vary in oral self-selection of nicotine. Psychopharmacology (Berl). 124, 332-339 (1996).
- Sparks, J. A., Pauly, J. R. Effects of continuous oral nicotine administration on brain nicotinic receptors and responsiveness to nicotine in C57Bl/6 mice. Psychopharmacology (Berl). , 141-145 (1999).
- Rahman, S., Zhang, J., Engleman, E. A., Corrigall, W. A. Neuroadaptive changes in the mesoaccumbens dopamine system after chronic nicotine self-administration: a microdialysis study. Neuroscience. 129, 415-4124 (2004).
- Picciotto, M. R., Zoli, M., Rimondini, R., Lena, C., Marubio, L. M., Pich, E. M. Acetylcholine receptors containing the β2 subunit are involved in the reinforcing properties of nicotine. Nature. 391, 173-177 (1998).
- Fowler, C. D., Lu, Q., Johnson, P. M., Marks, M. J., Kenny, P. J. Habenular α5 nicotinic receptor subunit signalling controls nicotine intake. Nature. 471, 597-601 (2011).
- Maskos, U., Molles, B. E., Pons, S., Besson, M., Guiard, B. P., Guilloux, J. P. Nicotine reinforcement and cognition restored by targeted expression of nicotinic receptors. Nature. 436, 103-107 (2005).
- Matta, S. G., Balfour, D. J., Benowitz, N. L., Boyd, R. T., Buccafusco, J. J., Caggiula, A. R., Craig, C. R., Collins, A. C., Damaj, M. I., Donny, E. C., Gardiner, P. S., Grady, S. R., Heberlein, U., Leonard, S. S. Guidelines on nicotine dose selection for in vivo research. Psychopharmacology. 190, 269-319 (2007).
- Lang, T., Rizzoli, S. O. Membrane protein clusters at nanoscale resolution: more than pretty pictures. Physiology (Bethesda). 25, 116-1124 (2010).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유