È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Spectral Imaging di fluorescenza confocale tag recettori nicotinici a Knock-in topi con la somministrazione cronica alla nicotina
In questo articolo
Riepilogo
Abbiamo sviluppato una nuova tecnica di quantificazione dei recettori nicotinici dell'acetilcolina cambiamenti all'interno delle regioni subcellulari di sottotipi specifici di neuroni del sistema nervoso centrale per comprendere meglio i meccanismi della dipendenza da nicotina utilizzando una combinazione di approcci tra tagging proteina fluorescente del recettore con il knock-in approccio e spettrale confocale.
Abstract
Ligand-canali ionici nel sistema nervoso centrale (CNS) sono coinvolti in numerose condizioni con gravi conseguenze mediche e sociali. Per esempio, la dipendenza da nicotina tramite il fumo di tabacco è la principale causa di morte prematura in tutto il mondo (World Health Organization) ed è probabilmente causato da un'alterazione della distribuzione dei canali ionici nel cervello 1. L'esposizione cronica alla nicotina sia nei roditori e nell'uomo i risultati in aumento del numero di recettori nicotinici dell'acetilcolina (nAChR) nei tessuti cerebrali 1-3. Allo stesso modo, alterazioni nei glutamatergici GluN1 o GluA1 canali sono stati implicati nello scatenare sensibilizzazione ad altre sostanze stupefacenti come la cocaina, anfetamine e oppiacei 4-6.
Di conseguenza, la capacità di mappare e quantificare i modelli di distribuzione e di espressione di specifici canali ionici è di fondamentale importanza per comprendere i meccanismi della dipendenza. Lo studio del cervello specifica di un'area efGli effetti di singoli farmaci è stata avanzata con l'avvento di tecniche come ligandi radioattivi. Tuttavia, la bassa risoluzione spaziale di legame ligando radioattivo impedisce la possibilità di quantificare ligando canali ionici in specifici sottotipi di neuroni.
Geneticamente codificati reporter fluorescenti, come ad esempio la proteina fluorescente verde (GFP) e le sue molte varianti di colore, hanno rivoluzionato il campo della biologia 7. Con tagging geneticamente un reporter fluorescente ad una proteina endogena è possibile visualizzare le proteine in vivo 7-10. Un vantaggio di proteine fluorescenti etichettatura con una sonda è l'eliminazione dell'uso di anticorpo, che hanno il problema della aspecificità e accessibilità alla proteina bersaglio. Abbiamo usato questa strategia per fluorescente nAChRs etichette, che hanno permesso lo studio di montaggio del recettore con Förster Resonance Energy Transfer (FRET) trasfettate in cellule in coltura 11. Più recentemente, abbiamo usato il Knock-in approccio alla topi ingegnere con giallo proteina fluorescente con tag a4 subunità nAChR (α4YFP), che consente una precisa quantificazione del recettore ex vivo a risoluzione submicrometer nei neuroni del SNC attraverso la microscopia confocale spettrale 12. Il mirata fluorescente knock-in mutazione è incorporato nel locus endogeno e sotto il controllo del suo promotore nativo, producendo normali livelli di espressione e regolazione del recettore rispetto ai recettori untagged nei topi di tipo selvatico. Il knock-in approccio può essere esteso per codificare fluorescente altri canali ionici e offre un approccio efficace di visualizzazione e quantificare i recettori nel SNC.
In questo articolo descriviamo una metodologia per quantificare i cambiamenti nell'espressione nAChR in specifici neuroni del sistema nervoso centrale dopo l'esposizione cronica alla nicotina. I nostri metodi includono mini-pompa osmotica l'impianto, la fissazione perfusione intracardiaca, imaging e analisi di fluorescenza tagged rec nicotinicosubunità eptor da α4YFP topi knock-in (Fig. 1). Abbiamo ottimizzato la tecnica di fissazione per minimizzare autofluorescenza da tissue.We cervello fisso descrivere in dettaglio la metodologia di immagini utilizzando un microscopio confocale spettrale in combinazione con un algoritmo lineare unmixing spettrale per sottrarre il segnale autofluoresent per ottenere con precisione α4YFP segnale di fluorescenza. Infine, mostrare i risultati di nicotina cronica indotta upregulation dei recettori α4YFP nel percorso perforante mediale dell'ippocampo.
Protocollo
1. Pompa impianto
- Prima dell'impianto della pompa, riempire e preparare le Alzet mini-pompe osmotiche (Alzet, Modello 2002, Cupertino, USA) facendo attenzione a non introdurre bolle d'aria. Questo modello di mini-osmotica pompa eroga soluzione ad una velocità di 0,5 pl / h per 14 giorni. Garantire condizioni di sterilità. Pesare pompe di vuoti e pieni. Al termine dell'esperimento (10 giorni dopo l'impianto), il liquido rimanente nel pompa può essere rimosso con una siringa e pesato per calcolare il volume pompato.
- Le pompe con soluzione di controllo contengono salina (0,9% w / v, Teknova, S5819, Hollister, USA). Per preparare la soluzione di nicotina, una soluzione stock 1 M di (-)-nicotina sale tartrato acido (Sigma, cat # N5260) viene diluito in soluzione salina (0,9% w / v) e sterilizzato per filtrazione attraverso una siringa 0,22 um-end filtro. Abbiamo precedentemente somministrato nicotina a 0,4 e 2 mg / kg / hr (calcolato in base libera di nicotina) per 10 giorni.
- Preparare tre bagni salina (tre10 salina centimetri riempito capsule di Petri). Una volta che la pompa è stato riempito e sigillato, lavare accuratamente la pompa di ogni bagno successive soluzione fisiologica per rimuovere eventuali tracce del farmaco sul guscio esterno. Immergere riempito pompe in soluzione salina per lo stoccaggio fino a un intervento chirurgico, mantenendo il controllo e le pompe di nicotina in contenitori separati saline.
- Per favorire una ripresa sana e ridurre il rischio di infezione post-chirurgica, hanno gabbie pulite preparati a lungo termine di recupero.
- Per la ripresa a breve termine subito dopo l'intervento, preparare una gabbia contenente un rilievo di riscaldamento e una lampada di calore.
- Per esaminare gli effetti della nicotina cronici dobbiamo 5-6 α4YFP omozigote knock-in topi (2-3 mesi) in ciascun gruppo (di controllo o di nicotina). Il knock-in α4YFP linea di topi sono stati re-incrociata per 10 generazioni, al ceppo di topi C57BL/6J. Facciamo che l'età e il sesso di tutti i topi sono uguali per lo studio e che tutti gli interventi chirurgici vengono eseguiti nello stesso giorno per ridurre al minimo la variabilità. Per impedire HYpothermia ai topi durante e dopo l'intervento chirurgico, dotare tavolo operatorio con un tampone sterile riscaldante rivestito in telo chirurgico.
- Indurre il α4YFP topo knock-in con 3 L / min di ossigeno e il 3% isoflurano e poi mantenere l'anestesia a 2,5 L / min di ossigeno e 1% isoflurano. Noi preferiamo anestesia con isoflurano causa a completamento dell'intervento isoflurano cancella il sistema rapido ed i topi sono consapevoli e mobile all'interno ~ 2 min. Applicare collirio immediatamente (tear-Gel, Novartis) per evitare danni alla cornea.
- Le pompe sono impiantato per via sottocutanea attraverso un'incisione cutanea sul retro del collo e la pompa viene spinto caudalmente lungo il dorso della schiena. Pulire l'area sul retro tra le zampe anteriori con 95% di etanolo al matte la pelliccia. Pizzicare la pelle con 0,8 mm pinza Graefe (strumenti per le scienze Belle 11050-10) e fare un cm 1 taglio centrale laterale che utilizza le forbici iris (strumenti per le scienze Belle, 14060-10).
- Per creare uno spazio sottocutaneo per la pompa, inserire forbice modello standards (Strumenti Scienza Arti, 14101-14), nell'incisione e spingere con la massima attenzione verso la fine caudale dell'animale.
- Utilizzando 1.0 mm pinze Graefe (strumenti per le scienze Belle, 11650-10), rimuovere la pompa dal salino. Tenere le pinze aperte mediante incisione e inserire la pompa nell'incisione con il tappo pompa osmotica affacciata all'estremità caudale dell'animale e spingere la pompa al fine caudale.
- Pinch ferita chiusa 0,8 mm con pinze e applicare una quantità adeguata di Vetbond (3M, cat # 1469SB) colla. Tenere premuto fino a quando ferita è sigillata.
- Rimuovere l'animale dalla maschera isoflurano, iniettare con l'analgesico, meloxicam (0,1 mg / kg sc), e il luogo in un breve termine gabbia di recupero fino al cosciente e mobile. Quindi mettere in un lungo periodo di recupero con gabbia ad libitum cibo e acqua a disposizione.
2. α4YFP knock-in fissazione mouse perfusione intracardiaca
- Fai soluzioni un giorno prima procedura e lasciare a 4 ° C. Per minimizzare la variabilità tutti i topisaranno perfusi lo stesso giorno e con lo stesso lotto di soluzioni.
- Eseguire fissazioni di perfusione in una zona ben ventilata. Linea Flush della pompa peristatic (Load Masterflex Easy, 7518-00; Masterflex Pump Controller, 60.648) con ddh 2 O.
- Aggiungi ~ 0.0015g di eparina (Sigma, cat # H4784), un anticoagulante, a 20 ml di PBS pH 7,6 (Invitrogen, cat # 70011).
- Anestetizzare α4YFP knock-in topo iniettando per via intramuscolare una miscela di ketamina (25 mg / kg, la salute degli animali Wyeth) e cloridrato medatomidine (0,25 mg / kg, Pfizer) nel muscolo della zampa posteriore e collocare immediatamente l'animale di nuovo nella sua gabbia di casa.
- Pin animale ad un coperchio di polistirolo inserito in un vassoio di metallo. Pulire torace con il 95% di etanolo. Pinch pelle con Adson pinza (strumenti per le scienze Belle 91106-12) e tagliare aprire la cassa toracica con le forbici iris. Fissare la cassa toracica con un emostatico ultra fine (strumenti per le scienze Belle 13021-12) ed esporre il cuore.
- Iniziare a pompare PBS a 4 ml / min ed iNSERIRE un ago 23G farfalla (Becton Dickinson, 367.253) nel ventricolo sinistro dell'animale. Immediatamente snip l'atrio destro per permettere al sangue e perfusato a fuggire.
- Perfondere 20 ml di PBS (pH 7,6), quindi 30 ml di paraformaldeide al 4% (pH 7,6, diluito con PBS da un archivio di PFA 16%, Sciences microscopia elettronica, cat # 15.710), quindi 20 ml di 5% di saccarosio (pH 7,6) . Abbiamo scoperto che più aumenta la fissazione autofluorescenza. Perfusione con 5% di saccarosio risciacqua residua PFA dal cervello, che abbassa autofluorescenza.
- Togliere il cervello e conservare nel 30% di saccarosio per 3 giorni.
- Per congelare il cervello per il sezionamento coronale, tagliare il cervelletto con una lametta e il cervello svolge in uno stampo in plastica embedding (VWR, cat # 18986-1) parte rostrale e immergerlo in Compound ottobre montaggio (Tissue-Tek, cat # 4583) . Congelare in ghiaccio secco e conservare a -20 ° C prima di affettarlo.
- Sezione cervelli (30 micron di spessore) su un criostato e poi il trasferimento al vetrini rivestiti. Conservare le sezioni di cervello a -20 ° C in scatole di diapositive contenenti una pietra solfato di calcio anidro. La casella di scorrimento dovrebbe essere in un sacchetto di chiusura lampo sigillato per evitare l'umidità e la successiva masterizzazione freezer, se conservato a -20 ° C.
3. Imaging nAChRs fluorescenti a spettrale microscopia confocale
- Assicurarsi diapositive hanno una minima esposizione a qualsiasi fonte di luce per ridurre al minimo photobleaching.
- Coprioggetti i vetrini cerebrali sezione con un mezzo di fissaggio che non inibisce la fluorescenza proteina fluorescente. Abbiamo un buon successo con Mowiol 4-88 (pH 8,5 in Tris-HCl e glicerolo, EMD-Calbiochem, cat # 475904), che indurisce dopo poche ore. Assicurarsi che il Mowiol equilibra a temperatura ambiente prima di scivolare coperchio in modo da evitare bolle d'aria. Non usare lo smalto quando si coperchio scivolare come spegnerà fluorescenza YFP.
- Le immagini vengono acquisite utilizzando una Nikon C1si sistema spettrale microscopio confocale. Dettagli per il calcolo delle spettrale confocale e unmixing lineari sono provvisted altrove 13-15. Il razionale per l'utilizzo di un microscopio confocale spettrale è che il tessuto cerebrale fisso ha autofluorescenza intrinseca. Spectral confocale sul C1si Nikon utilizza un array di 32 rilevatori di tubi fotomoltiplicatori quel campione un determinato intervallo di lunghezze d'onda della luce fluorescente emessa, rifratta spazialmente nelle sue diverse lunghezze d'onda tramite un elemento dispersivo reticolo proprio come un prisma di rifrazione della luce bianca in un arcobaleno di colori 16. Che cosa è raccolto lambda è una pila di immagini - immagini raccolte in diverse lunghezze d'onda della luce in modo che uno spettro di emissione sono raccolti per ogni pixel di una pila di immagini lambda. Poiché YFP autofluorescenza e tessuti hanno ciascuno caratteristici firme spettrali, la pila lambda possono essere deconvolved utilizzando un algoritmo lineare unmixing algebrica in YFP separato e segnali autofluorescenti (Fig. 2). Così, quantificazione molto accurata di YFP fluorescenza può essere determinato anche in tessuto con livelli significativi di autofluorescence.
- Le diverse impostazioni possono essere regolate per ottimizzare la qualità dell'immagine e l'efficienza di raccolta fluorescenza. Ci riporterà le impostazioni che usano di solito, ma queste impostazioni possono essere regolate a seconda del campione e il microscopio confocale. Per quantificare con precisione i cambiamenti nell'espressione subunità α4YFP con la nicotina cronica garantire che il livello di scala di grigio di intensità dei segnali di tutti i pixel sono al di sotto del valore di saturazione (<4.095 per 12 bit scala di grigio). Inoltre, per accogliere potenziale aumento del segnale a causa della sovra-regolazione del recettore regolando le impostazioni confocale in modo che i pixel sono circa un terzo del valore di saturazione (~ 1300-1400) o meno. Una volta che le impostazioni sono ottimizzate, le impostazioni vengono mantenute identiche per tutte le sessioni di imaging e di campioni.
- Usiamo le seguenti impostazioni per l'imaging α4YFP utilizzando un olio di 60X CFI Plan Apo VC obiettivo (NA 1,40, 0,13 mm di distanza lavoro): 488 nm laser linea al 15% di trasmissione massima di 40 mW Argon laser, Guadagno rivelatore spettrale a 220, gamma spettrale ripreso da 496,5 a 656,5 nm nm a 5 risoluzione nm, 512 x 512 pixel su un um x 50 um zona 50, una dimensione media foro (60 diam um), un pixel 4,08 tempo di sosta, media di oltre due scansioni e 12 bit di scala di grigi.
4. Unmixing lineare di immagini spettrali confocale e analisi di immagine
- Per eseguire lineare unmixing spettrale su un'immagine campione prelevato con un microscopio confocale spettrale, si deve prima acquisire uno spettro di riferimento per YFP e uno spettro di riferimento per autofluorescenza dei tessuti.
- Un requisito importante per qualsiasi spettro di riferimento è quello di ottenere un segnale alto a spettro del rumore di fluorescenza ripreso con la linea laser stessa utilizzata per l'imaging dei campioni. Sebbene la linea laser 514 nm di Argon ha una maggiore efficienza di eccitazione per eccitare YFP preferiamo YFP immagine con la linea 488 nm del laser perché vi è una migliore separazione dal picco di emissione della YFP e la linea 488 nm è meno likely di falsare la vetta e si può ottenere l'intero spettro di emissione YFP tra cui l'ascesa al picco. Abbiamo YFP immagine solubile transfettato in una linea cellulare in modo che un segnale YFP forte e si ottiene lo spettro YFP risultante viene memorizzato nella nostra libreria di spettri di riferimento. Α4YFP trasfettate sopra espressa in linee cellulari possono anche essere utilizzati in quanto fornirà un segnale alto alla spettro di fondo.
- Per ottenere uno spettro di riferimento di autofluorescenza ci autofluorescenza immagine da una sezione di tipo selvatico cervello di topo dalle varie regioni del cervello che abbiamo intenzione di immagine dal mouse α4YFP e ottenere la loro spettri corrispondente. Usiamo la stessa linea laser, 488 nm, e l'immagine con parametri quasi identici, anche se possono alterare il guadagno del rivelatore, l'intensità del laser o eseguire l'imaging media per massimizzare il segnale al rumore.
- Dopo aver ottenuto una immagine confocale spettrale da una regione del cervello di topo α4YFP, l'immagine viene poi deconvolved nella sua YFP e autofluorsegnali escence applicando un algoritmo lineare unmixing spettrale utilizzando lo spettro di riferimento della YFP e lo spettro di riferimento di autofluorescenza del mouse tipo selvatico della stessa regione cerebrale.
- L'immagine α4YFP miscelato può poi essere aperto in un software di analisi di immagine come ImageJ ( http://rsbweb.nih.gov/ij/ ) e quindi l'intensità media dei pixel viene calcolato per la regione di interesse. Un plugin per ImageJ chiamato "loci_tools.jar" ( http://www.loci.wisc.edu/bio-formats/imagej ) può essere utilizzato per importare Nikon ics / ids file confocale.
- Si ripete la stessa unmixing lineare spettrale e analisi di tipo selvatico topi nella stessa regione cerebrale per ottenere un valore residuo di fondo.
- Poi, si ottiene la corretta intensità α4YFP media sottraendo il valore residuo di fondo (4.6) dal valore medio non corretta α4YFP (4.5).
5. Risultati rappresentativi
Abbiamo mostra una proiezione rappresentante vero colore di una pila lambda di immagini del habenula mediale da un topo omozigote α4YFP (Fig. 3A) preso con un microscopio confocale spettrale. Abbiamo inoltre mostra lo spettro di emissione da una regione di interesse contenente α4YFP neuroni positivi dalla stessa immagine pila lambda (fig. 3B). Un picco di emissione distinta è evidente a ~ 527 nm, che è il picco di emissione di fluorescenza di YFP. La regione confinante con lo habenula mediale presenta uno spettro di emissione manca un picco spettrale a 527 nm, che indica l'assenza di α4YFP subunità nAChR. Dopo lineare unmixing spettrale utilizzando spettri di riferimento YFP e cervello autofluoresence topo con sovrapposizione significative di emissione (Fig. 4), la separazione dei segnali e YFP autofluorescente è possibile cedimento un'immagine α4YFP mescolate, un'immagine autofluorescente mescolate e un canale resto. La localizzazione di chiara influenza α4YFPorescence può essere identificato nel soma fitto del menisco mediale habenula (Fig. 4).
Nel α4YFP ippocampo è localizzato principalmente nel percorso perforante mediale, la temporo-ammonico percorso e il alveus 12. Questi sono tutti innervazione glutamatergica dell'ippocampo. Abbiamo esaminato gli effetti della nicotina cronica sull'espressione α4YFP nel percorso perforante ippocampale (Fig. 5). La somministrazione cronica di nicotina (2 mg / kg / ora per 10 giorni) ha determinato un aumento significativo (69 ± 14%) in α4YFP fluorescenza da topi di controllo trattati con soluzione salina per topi alla nicotina cronici trattati (p = 0,001, test di Wilcoxon rank sum) ( Fig. 5).
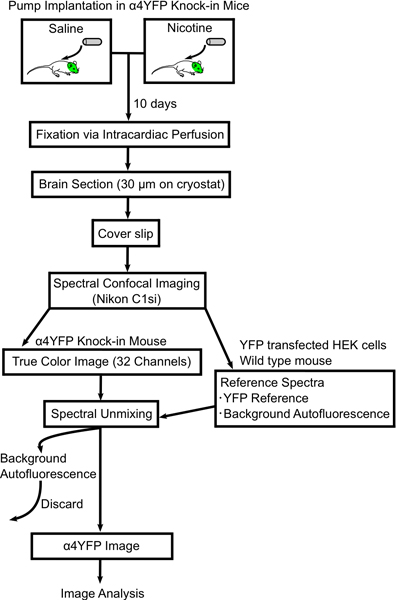
Figura 1. Diagramma di flusso che mostra procedura per l'immagine cambia in subunità nAChR α4YFP con nicotina cronica. Mini-osmotici pompe sono riempita di soluzione fisiologica o nicotina e impiantato per via sottocutanea in & alpha; 4YFP topi omozigoti. Dopo 10 giorni i topi sono perfusi e fissate con paraformaldeide al 4% e il cervello del mouse sono sezionate (30 micron di spessore) su vetrini. La sezione di cervello è ripreso su un microscopio confocale spettrale (Nikon C1si) e spettralmente puro nella YFP immagini e autofluorescente. Poi le immagini vengono analizzate α4YFP ulteriormente con il software ImageJ.
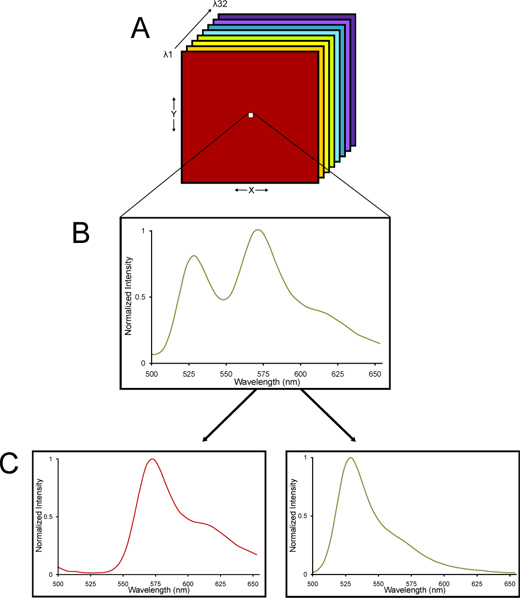
Figura 2. Un diagramma schematico di una pila lambda ripreso da un microscopio confocale spettrale e linearmente puro nella sue componenti spettrali. (A) Una pila lambda di immagini viene raccolta. (B) Una pila lambda consiste di immagini raccolte a differenti lunghezze d'onda in modo che uno spettro di emissione viene raccolto per ciascun pixel attraverso l'intera pila. (C) Poiché YFP e autofluorescenza dei tessuti hanno ciascuno caratteristiche firme spettrali, lo stack lambda può essere deconvolved utilizzando un algoritmo lineare unmixing algebrica in sYFP eparate e segnali autofluorescenti. Così, quantificazione molto accurata di YFP fluorescenza può essere determinato anche in tessuto con elevati livelli di autofluorescenza.

Figura 3. Confocale spettrale immagine di una regione del cervello che esprime nAChRs α4YFP. (A) A proiezione vero colore di una pila lambda di immagini del habenula mediale da un mouse α4YFP presa con un microscopio Nikon C1si spettrale confocale. (B) Piazzole di spettri di una regione di interesse, che comprende i neuroni contenenti α4YFP (verde), ed una regione di interesse al di fuori del habenula mediale (rosso).
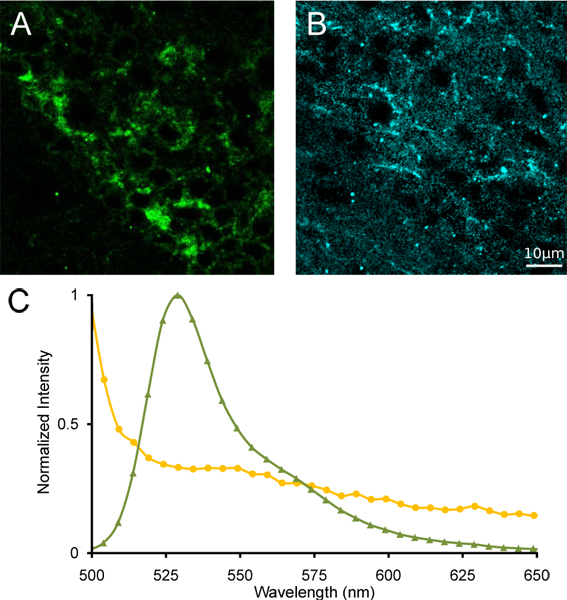
Figura 4. Lineare unmixing spettrale del habenula mediale. (A) Immagini di α4YFP non miscelati e (B) a seguito di autofluorescenza unmixing lineare spettrale. (C) spettri di riferimento YFP (verde triangoli) e autofluorescenza (cerchi gialli) utilizzato per unmixing spettrale.

Figura 5. Upregulation di a4 nAChRs nell'ippocampo di α4YFP knock-in topi esposti alla nicotina cronica. (A) Un montaggio di piastrelle α4YFP fluorescenza dall'ippocampo. Le due aree di selezione sono tratteggiate le posizioni approssimative sulla parte inferiore del percorso perforante dell'ippocampo in cui sono state eseguite analisi per ciascun topo. (B) α4YFP fluorescenza è stata significativamente maggiore nel percorso perforante di topi esposti alla nicotina cronica della soluzione salina cronica (*, p = 0,001, test di Wilcoxon rank sum). I risultati rappresentano la media ± SEM di n = 20 misure per topi alla nicotina sia saline e cronica trattati (5 topi per ogni gruppo di trattamento).

Figura 6. Meglio despressione di epth α4YFP rispetto all'etichettatura degli anticorpi. XZ viste ortogonali di α4YFP fluorescenza (A) e VGlut2 anticorpo con Cy5 come etichetta secondaria (B). (C) grafici che mostrano una maggiore intensità del segnale di fluorescenza degradazione della profondità di colorazione anticorpale (quadrati neri) rispetto al α4YFP (cerchi vuoti).
Discussione
L'uso di un recettore fluorescente in un knock-in modello di topo per determinare la quantità e la localizzazione di un canale ionico specifico fornisce un certo numero di vantaggi. In contrasto con proteine come actina, che è ubiquitariamente espresso in tutte le cellule, canali ionici sono presenti in numero molto inferiore e la loro espressione varia tra sottotipi neuronali rendendo accurata analisi mediante tradizionali tecniche immunoistochimiche impegnativi. Il prodotto genico α4YFP è espressa a l...
Divulgazioni
Non abbiamo nulla da rivelare.
Riconoscimenti
Antonio Renda è stata sostenuta da una Università di Victoria Graduate Fellowship Award. Questa ricerca è stata sostenuta da un scienze naturali e ingegneria Research Council of Canada Discovery Grant, uno NARSAD Young Investigator Award (per RN), una Fondazione Victoria - Myre e Winifred Sim Fund, una Fondazione canadese per l'innovazione sovvenzione, un Fondo di conoscenza Columbia Britannica per lo sviluppo e scienze naturali e ingegneria Research Council del Canada strumenti di ricerca e Grant Strumentazione. Ringraziamo Jillian McKay, Christina Barnes, Ariel Sullivan, Jennifer MacDonald e Daniel Morgado per l'allevamento del mouse eccellente.
Materiali
| Nome del reattivo | Azienda | Numero di catalogo | Comments |
| mini-pompe osmotiche | Alzet | modello 2002 | |
| salino | Teknova | S5819 | |
| (-)-Nicotina idrogeno sale tartrato | Sigma | N5260 | |
| colliri | Novartis | Tear-Gel | |
| Vetbond colla | 3M | 1469SB | |
| sale di sodio eparina | Sigma | H4784 | |
| 10x PBS | Invitrogen | 70011 | |
| ketamina | Wyeth Animal Health | 0856-4403-01 | |
| medatomidine cloridrato | Pfizer | 1950673 | |
| 23G farfalla ago | Becton Dickinson | 367253 | |
| paraformaldeide | Scienze della microscopia elettronica | 15710 | |
| embedding stampi in plastica | VWR | 18986-1 | |
| Ottobre Compound di montaggio | Tissue-Tek | 4583 | |
| Mowiol 4-88 | EMD-Calbiochem | 475904 | pH 8,5 |
Riferimenti
- Perry, D. C., Davila-Garcia, M. I., Stockmeier, C. A., Kellar, K. J. Increased nicotinic receptors in brains from smokers: membrane binding and autoradiography studies. J. Pharmacol. Exp. Ther. 289, 1545-1552 (1999).
- Schwartz, R. D., Kellar, K. J. Nicotinic cholinergic receptor binding sites in the brain: regulation in vivo. Science. 220, 214-216 (1983).
- Marks, M. J., Burch, J. B., Collins, A. C. Effects of chronic nicotine infusion on tolerance development and nicotinic receptors. J. Pharmacol. Exp. Ther. 226, 817-8125 (1983).
- Carlezon, W. A. J., Nestler, E. J. Elevated levels of GluR1 in the midbrain: a trigger for sensitization to drugs of abuse. Trends Neurosci. 25, 610-615 (2002).
- Fitzgerald, L. W., Ortiz, J., Hamedani, A. G., Nestler, E. J. Drugs of abuse and stress increase the expression of GluR1 and NMDAR1 glutamate receptor subunits in the rat ventral tegmental area: common adaptations among cross-sensitizing agents. J. Neurosci. 16, 274-2782 (1996).
- Saal, D., Dong, Y., Bonci, A., Malenka, R. C. Drugs of abuse and stress trigger a common synaptic adaptation in dopamine neurons. Neuron. 37, 577-5782 (2003).
- Tsien, R. Y. The green fluorescent protein. Annu. Rev. Biochem. 67, 509-544 (1998).
- Chalfie, M., Tu, Y., Euskirchen, G., Ward, W. W., Prasher, D. C. Green fluorescent protein as a marker for gene expression. Science. 263, 802-805 (1994).
- Feng, G., Mellor, R. H., Bernstein, M., Keller-Peck, C., Nguyen, Q. T., Wallace, M. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28, 41-51 (2000).
- Livet, J., Weissman, T. A., Kang, H., Draft, R. W., Lu, J., Bennis, R. A. Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system. Nature. 450, 56-62 (2007).
- Nashmi, R., Dickinson, M. E., McKinney, S., Jareb, M., Labarca, C., Fraser, S. E. Assembly of α4β2 nicotinic acetylcholine receptors assessed with functional fluorescently labeled subunits: effects of localization, trafficking, and nicotine-induced upregulation in clonal mammalian cells and in cultured midbrain neurons. J. Neurosci. 23, 11554-11567 (2003).
- Nashmi, R., Xiao, C., Deshpande, P., McKinney, S., Grady, S. R., Whiteaker, P. Chronic nicotine cell specifically upregulates functional α4* nicotinic receptors: basis for both tolerance in midbrain and enhanced long-term potentiation in perforant path. J. Neurosci. 27, 8202-8218 (2007).
- Dickinson, M. E., Bearman, G., Tilie, S., Lansford, R., Fraser, S. E. Multi-spectral imaging and linear unmixing add a whole new dimension to laser scanning fluorescence microscopy. BioTechniques. 31, 1272-1278 (2001).
- Nashmi, R., Fraser, S. E., Lester, H., Dickinson, M. E., Periasamy, A., Day, R. N. . Molecular imaging: fret microscopy and spectroscopy. , 180-192 (2005).
- Zimmermann, T., Rietdorf, J., Girod, A., Georget, V., Pepperkok, R. Spectral imaging and linear un-mixing enables improved FRET efficiency with a novel GFP2-YFP FRET pair. FEBS Lett. 531, 245-249 (2002).
- Larson, J. M. The Nikon C1si combines high spectral resolution, high sensitivity, and high acquisition speed. Cytometry A. 69, 825-8234 (2006).
- Melvin, N. R., Sutherland, R. J. Quantitative caveats of standard immunohistochemical procedures: implications for optical disector-based designs. J. Histochem. Cytochem. 58, 577-5784 (2010).
- Jones, I. W., Wonnacott, S. Why doesn't nicotinic ACh receptor immunoreactivity knock out. Trends Neurosci. 28, 343-345 (2005).
- Moser, N., Mechawar, N., Jones, I., Gochberg-Sarver, A., Orr-Urtreger, A., Plomann, M. Evaluating the suitability of nicotinic acetylcholine receptor antibodies for standard immunodetection procedures. J. Neurochem. , (2007).
- Whiteaker, P., Cooper, J. F., Salminen, O., Marks, M. J., McClure-Begley, T. D., Brown, R. W., Collins, A. C., Lindstrom, J. M. Immunolabeling demonstrates the interdependence of mouse brain a4 and b2 nicotinic acetylcholine receptor subunit expression. The Journal of Comparative Neurology. 499, 1016-1038 (2006).
- Marks, M. J., McClure-Begley, T. D., Whiteaker, P., Salminen, O., Brown, R. W. B., Cooper, J., Collins, A. C., Lindstrom, J. M. Increased nicotinic acetylcholine receptor protein underlies chronic nicotine-induced up-regulation of nicotinic agonist binding sites in mouse brain. The Journal of Pharmacology and Experimental Therapeutics. , 337-3187 (2011).
- Marks, M. J., Rowell, P. P., Cao, J. Z., Grady, S. R., McCallum, S. E., Collins, A. C. Subsets of acetylcholine-stimulated 86[Rb]+ efflux and 125[I]-epibatidine binding sites in C57BL/6 mouse brain are differentially affected by chronic nicotine treatment. Neuropharmacology. 46, 1141-1157 (2004).
- King, S. L., Caldarone, B. J., Picciotto, M. R. Beta2-subunit-containing nicotinic acetylcholine receptors are critical for dopamine-dependent locomotor activation following repeated nicotine administration. Neuropharmacology. 47, 132-139 (2004).
- Robinson, S. F., Marks, M. J., Collins, A. C. Inbred mouse strains vary in oral self-selection of nicotine. Psychopharmacology (Berl). 124, 332-339 (1996).
- Sparks, J. A., Pauly, J. R. Effects of continuous oral nicotine administration on brain nicotinic receptors and responsiveness to nicotine in C57Bl/6 mice. Psychopharmacology (Berl). , 141-145 (1999).
- Rahman, S., Zhang, J., Engleman, E. A., Corrigall, W. A. Neuroadaptive changes in the mesoaccumbens dopamine system after chronic nicotine self-administration: a microdialysis study. Neuroscience. 129, 415-4124 (2004).
- Picciotto, M. R., Zoli, M., Rimondini, R., Lena, C., Marubio, L. M., Pich, E. M. Acetylcholine receptors containing the β2 subunit are involved in the reinforcing properties of nicotine. Nature. 391, 173-177 (1998).
- Fowler, C. D., Lu, Q., Johnson, P. M., Marks, M. J., Kenny, P. J. Habenular α5 nicotinic receptor subunit signalling controls nicotine intake. Nature. 471, 597-601 (2011).
- Maskos, U., Molles, B. E., Pons, S., Besson, M., Guiard, B. P., Guilloux, J. P. Nicotine reinforcement and cognition restored by targeted expression of nicotinic receptors. Nature. 436, 103-107 (2005).
- Matta, S. G., Balfour, D. J., Benowitz, N. L., Boyd, R. T., Buccafusco, J. J., Caggiula, A. R., Craig, C. R., Collins, A. C., Damaj, M. I., Donny, E. C., Gardiner, P. S., Grady, S. R., Heberlein, U., Leonard, S. S. Guidelines on nicotine dose selection for in vivo research. Psychopharmacology. 190, 269-319 (2007).
- Lang, T., Rizzoli, S. O. Membrane protein clusters at nanoscale resolution: more than pretty pictures. Physiology (Bethesda). 25, 116-1124 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon