Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Спектральный конфокальной микроскопии флуоресцентно помеченный никотиновые рецепторы в плей-офф у мышей с хроническим Никотин администрации
В этой статье
Резюме
Мы разработали новый метод количественной никотиновые рецепторы ацетилхолина изменений в субклеточных регионах конкретных подтипов нейронах ЦНС, чтобы лучше понять механизмы никотиновой зависимости с помощью комбинации подходов, в том числе люминесцентные пометки белка рецептора помощи стука в подходе и спектральные конфокальной микроскопии.
Аннотация
Ligand-gated ion channels in the central nervous system (CNS) are implicated in numerous conditions with serious medical and social consequences. For instance, addiction to nicotine via tobacco smoking is a leading cause of premature death worldwide (World Health Organization) and is likely caused by an alteration of ion channel distribution in the brain1. Chronic nicotine exposure in both rodents and humans results in increased numbers of nicotinic acetylcholine receptors (nAChRs) in brain tissue1-3. Similarly, alterations in the glutamatergic GluN1 or GluA1 channels have been implicated in triggering sensitization to other addictive drugs such as cocaine, amphetamines and opiates4-6.
Consequently, the ability to map and quantify distribution and expression patterns of specific ion channels is critically important to understanding the mechanisms of addiction. The study of brain region-specific effects of individual drugs was advanced by the advent of techniques such as radioactive ligands. However, the low spatial resolution of radioactive ligand binding prevents the ability to quantify ligand-gated ion channels in specific subtypes of neurons.
Genetically encoded fluorescent reporters, such as green fluorescent protein (GFP) and its many color variants, have revolutionized the field of biology7.By genetically tagging a fluorescent reporter to an endogenous protein one can visualize proteins in vivo7-10. One advantage of fluorescently tagging proteins with a probe is the elimination of antibody use, which have issues of nonspecificity and accessibility to the target protein. We have used this strategy to fluorescently label nAChRs, which enabled the study of receptor assembly using Förster Resonance Energy Transfer (FRET) in transfected cultured cells11.More recently, we have used the knock-in approach to engineer mice with yellow fluorescent protein tagged α4 nAChR subunits (α4YFP), enabling precise quantification of the receptor ex vivo at submicrometer resolution in CNS neurons via spectral confocal microscopy12. The targeted fluorescent knock-in mutation is incorporated in the endogenous locus and under control of its native promoter, producing normal levels of expression and regulation of the receptor when compared to untagged receptors in wildtype mice. This knock-in approach can be extended to fluorescently tag other ion channels and offers a powerful approach of visualizing and quantifying receptors in the CNS.
In this paper we describe a methodology to quantify changes in nAChR expression in specific CNS neurons after exposure to chronic nicotine. Our methods include mini-osmotic pump implantation, intracardiac perfusion fixation, imaging and analysis of fluorescently tagged nicotinic receptor subunits from α4YFP knock-in mice (Fig. 1). We have optimized the fixation technique to minimize autofluorescence from fixed brain tissue.We describe in detail our imaging methodology using a spectral confocal microscope in conjunction with a linear spectral unmixing algorithm to subtract autofluoresent signal in order to accurately obtain α4YFP fluorescence signal. Finally, we show results of chronic nicotine-induced upregulation of α4YFP receptors in the medial perforant path of the hippocampus.
протокол
1. Насос имплантации
- До имплантации насоса, заполнить и подготовить Alzet мини-осмотического насоса (Alzet, модель 2002, Купертино, США), будьте осторожны, чтобы не вводить пузырьков воздуха. Эта модель мини-осмотического насоса обеспечивает решение по ставке 0,5 мкл / час в течение 14 дней. Убедитесь, стерильных условиях. Взвесьте пустых и заполненных насосов. В конце эксперимента (через 10 дней после имплантации), оставшуюся жидкость в насосе может быть удалена с помощью шприца и иглы и вес для расчета объема перекачиваемой.
- Насосы с контрольным раствором содержат физиологический раствор (0,9% вес / объем, Teknova, S5819, Hollister, США). Для подготовки решения никотина, 1 М исходный раствор (-)-никотин соль тартрат водорода (Sigma, кот # N5260) разводят в физиологическом растворе (0,9% вес / объем) и стерилизуют фильтрацией через 0,22 мкм шприц-конце фильтра. Ранее мы уже вводить никотин в 0,4 и 2 мг / кг / час (в расчете на свободное основание никотина) в течение 10 дней.
- Подготовить три солевые ванны (три10 см, заполненный солевым чашки Петри). Когда насос был заполнен, максимум, промыть насос тщательно в каждом последующем солевые ванны, чтобы удалить все следы препарата на внешней оболочке. Погрузитесь заполнены насосов в солевом растворе для хранения до операции, сохраняя контроль и никотина насосов в отдельных солевой контейнеров.
- Для формирования здорового восстановления и снизить риск послеоперационных инфекций, иметь чистые клетки готовы к долгосрочному восстановлению.
- Для краткосрочного восстановления сразу после операции, подготовить клетки содержащие грелку и тепловой лампой.
- Для изучения хронических эффектов никотина, у нас есть от 5 до 6 гомозиготных α4YFP нокаут у мышей (2-3 месяцев) в каждой группе (контрольной или никотина). Α4YFP нокаут у мышей линии были backcrossed в течение 10 поколений напряжение мыши C57BL/6J. Мы уверены, что возраст и пол всех мышей одинаковы для изучения, и что все операции выполняются в тот же день, чтобы минимизировать изменчивость. Для предотвращения гиpothermia мышам во время и после операции, оборудовать операционный стол с грелку рассматривается в стерильных хирургических драпировка.
- Вызвать α4YFP стук в мышь с 3 л / мин кислорода и 3% изофлуран и поддержания анестезии в 2,5 л / мин кислорода и 1% ИФ. Мы предпочитаем ИФ анестезией, потому что по завершении операции ИФ очищает систему быстро и мышей сознательного и мобильный в пределах ~ 2 мин. Применение глазных капель сразу (Tear-гель, Novartis), чтобы избежать повреждения роговицы.
- Насосы имплантировали подкожно через разрез кожи на шее и насоса выталкивается вниз каудально спинной части спины. Протрите область на спине между передними конечностями с 95% этанола, матовая шерсть. Зажмите кожу 0,8 щипцы Грефе (Fine инструментов науки, 11050-10) и сделать 1 см центральной боковой разрез использование диафрагмы ножницы (Fine инструментов науки, 14060-10).
- Чтобы создать пространство для подкожного насоса, вставить стандартный шаблон ножницамис (изобразительных средств наук, 14101-14) в разрез и подтолкнуть их внимательно к хвостовому концу животных.
- Использование 1,0 мм Грефе пинцет (Fine инструментов науки, 11650-10), снять насос с физиологическим раствором. Держите разрез открытым с помощью щипцов и вставить насос в разрез с крышкой осмотического насоса перед хвостовой конец животных и нажмите насоса до хвостового конца.
- Pinch рану закрыть использованием 0,8 щипцы и применять достаточное количество Vetbond (3M, кот # 1469SB) клея. Держите, пока рана решена.
- Удалить из животных ИФ маски, вводить с обезболивающим, мелоксикам (0,1 мг / кг подкожно), а место в краткосрочной восстановления клетки до сознательного и мобильный телефон. Затем поместите в долгосрочное восстановление клетке с пищей и водой доступны без ограничений.
2. α4YFP стучать в мышь фиксации внутрисердечного перфузией
- Сделать решения за один день до процедуры и оставить на 4 ° С. Для уменьшения изменчивости всех мышейбудет озарен в тот же день и с той же самой партии решения.
- Выполните перфузии фиксации в хорошо проветриваемом помещении. Флеш линии peristatic насоса (Masterflex Easy Load, 7518-00; Masterflex контроллер насоса, 60648) с DDH 2 O.
- Добавить ~ 0.0015g гепарина (Sigma, кот # H4784), антикоагулянтов, до 20 мл PBS рН 7,6 (Invitrogen, кошка # 70011).
- Обезболить α4YFP нокаут у мышей путем инъекций внутримышечно смесь кетамина (25 мг / кг, Wyeth Animal Health) и medatomidine гидрохлорида (0,25 мг / кг, Pfizer) в задние мышцы ног и сразу же поместить животное обратно в дом клетке.
- Прикрепите животного крышка пенопласт вставлен в металлический лоток. Протирайте грудь с 95% этанола. Pinch кожи Адсон щипцы (Fine инструментов науки, 91106-12) и СНиП открыть грудной полости с помощью ножниц радужной оболочки. Зажим грудной клетки использованием сверхтонкого кровоостанавливающего (Fine инструментов науки, 13021-12), а также подвергать сердце.
- Начало насосных PBS в 4 мл / мин, и явставляйте 23G иглы бабочки (Becton Dickinson, 367253) в левый желудочек животного. Сразу отрезать правое предсердие, чтобы кровь и перфузат бежать.
- Заливать 20 мл PBS (рН 7,6), а затем 30 мл 4% параформальдегид (рН 7,6, разбавляют PBS с 16% PFA акций, наук Электронная микроскопия, кошке # 15710), затем 20 мл 5% сахарозы (рН 7,6) . Мы обнаружили, что за фиксация увеличивает флуоресценции. Перфузии с 5% сахарозы промывку остаточной PFA из головного мозга, что снижает флуоресценции.
- Удалить мозга и магазинов в 30% сахарозы в течение 3 дней.
- Чтобы заморозить мозг для корональных срезов, отрезали мозжечка с лезвием и место мозга в пластиковых форм вложения (VWR, кошка # 18986-1) ростральной вверх и погрузите в октябре Монтаж соединений (ткань-Tek, кошка # 4583) . Заморозить в сухой лед и хранить при температуре -20 ° C до нарезки.
- Раздел мозги (30 мкм) на криостате и затем переносить их на покрытие слайдов. Хранить мозга разделов при -20 иградусов, в ящиках в слайд, содержащий один камень безводный сульфат кальция. Слайд поле должно быть в почтовый замок герметичный пакет, чтобы избежать влаги и последующего холодильных ожогов при хранении при температуре -20 ° C.
3. Флуоресцентных изображений с использованием спектральных nAChRs конфокальной микроскопии
- Убедитесь, слайды с минимальным воздействием любого источника света, чтобы минимизировать фотообесцвечивания.
- Покровное слайды мозг раздел монтажа среде, не ингибирует люминесцентные флуоресценции белка. У нас есть хороший успех с Mowiol 4-88 (рН 8,5 в Трис-HCl и глицерин, EMD-Calbiochem, кот # 475904), которая затвердевает через несколько часов. Убедитесь, что Mowiol уравновешивает до комнатной температуры крышки скольжения для того, чтобы избежать воздушных пузырей. Не используйте лак для ногтей, когда крышка скольжения, как он будет утолять YFP флуоресценции.
- Изображения получены с помощью Nikon C1si спектральных конфокальной системы микроскопа. Подробная информация о методе спектрального конфокальной микроскопии и линейных unmixing обеспеченыг в другом месте 13-15 лет. Основанием для использования спектральных конфокальной микроскопии является то, что фиксированные ткани мозга присущи флуоресценции. Спектральный конфокальной микроскопии на Nikon C1si использует массив из 32 детекторов ФЭУ, что образец указанного диапазона длин волн флуоресцентного излучаемого света, преломленные в его пространственно различных длин волн с помощью дисперсионного элемента решетки, как призма преломляющей белый свет на все цвета радуги 16. То, что собранные лямбда стека изображений - изображения, собранных на различных длинах волн света, так что спектр излучения, собранные для каждого пикселя лямбда стека изображений. С YFP и тканей флуоресценции имеют характерные спектральные подписи, стек лямбда можно deconvolved помощью линейного unmixing алгебраических алгоритмов в отдельные YFP и autofluorescent сигналов (рис. 2). Таким образом, очень точная количественная оценка YFP флуоресценции можно определить даже в ткани со значительным уровнем а.е.tofluorescence.
- Различные параметры могут быть скорректированы для оптимизации качества изображения и флуоресценции коллекции. Мы будем сообщать настройки мы обычно используем, но эти параметры могут быть скорректированы в зависимости от образца и конфокальной микроскопии. Для точной количественной оценки изменений в α4YFP выражение подразделение с хронической никотиновой мы гарантируем, что уровень интенсивности серого масштаба сигналы всех пикселей ниже насыщения значение (<4095 в течение 12 серое бит). Кроме того, мы приспособить для возможного увеличения сигнала за счет рецепторов регуляция, регулируя конфокальной параметры так, чтобы пиксели около одной трети от насыщения значение (~ 1300-1400) или меньше. После настройки оптимизированы настройки сохраняются одинаковые для всех изображений сессий и образцов.
- Мы используем следующие настройки для работы с изображениями α4YFP использованием 60X нефти CFI Plan Apo VC задача (1.40 Н.А., 0,13 мм рабочее расстояние): 488 нм лазера на уровне 15% максимальной передачи 40 мВт лазер аргона, Спектральный коэффициент усиления детектора на 220, спектральный диапазон отображаемого от 496,5 нм до 656,5 нм в 5 нм разрешение 512 х 512 пикселей более 50 мкм х 50 мкм области, средний размер отверстия (диаметр 60 мкм), 4,08 пикселя выдержки, среднем в течение двух сканирования и 12 бит серого.
4. Линейный unmixing спектральных конфокальных изображений и анализа изображений
- Для выполнения линейных спектральных unmixing по образцу изображение, снятое со спектральной конфокальной микроскопии, необходимо сначала получить ссылку спектр YFP и ссылки спектр флуоресценции ткани.
- Важным условием для любой ссылки спектр получить высокое отношение сигнал-шум спектр флуоресценции, полученную с той же линии лазера, используемого для работы с изображениями ваших образцов. Несмотря на 514 нм лазера аргона имеет более высокую эффективность возбуждения для возбуждения YFP мы предпочитаем образ YFP с 488 нм лазерный луч, потому что нет лучшего отделения от пика излучения YFP и 488 нм линии менее лikely исказить пика и можно получить весь спектр излучения YFP включая приход к вершине. Мы изображение растворимый YFP трансфекции в клеточной линии, так что сильный сигнал YFP получается и в результате спектр YFP хранится в нашей библиотеке ведения спектров. Трансфицированных α4YFP более выражено в клеточных линиях, также может быть использован, так как это также обеспечит высокий сигнал на фоне спектра.
- Чтобы получить ссылку спектр флуоресценции мы изображений флуоресценции от дикого раздел мозга мышей из различных регионов мозга, которые мы намерены изображения с мышью α4YFP и получить соответствующие спектры. Мы используем те же линии лазера 488 нм, и изображение, используя почти одинаковые параметры, но мы можем изменить детектор усиления интенсивности лазерного излучения или выполнить средний изображений максимального сигнала к шуму.
- После получения спектральной конфокальной изображение из области мозга мыши α4YFP, изображение то deconvolved в свою YFP и autofluorфлуоресценции сигналы путем применения линейных спектральных алгоритм unmixing используя ссылку спектр YFP и ссылки спектр флуоресценции мыши дикого типа из той же области мозга.
- Несмешанные изображение α4YFP могут быть открыты в программное обеспечение для анализа изображений, таких как ImageJ ( http://rsbweb.nih.gov/ij/ ) и средней интенсивности пикселя рассчитывается для интересующей нас области. Плагин для ImageJ называется "loci_tools.jar" ( http://www.loci.wisc.edu/bio-formats/imagej ) могут быть использованы для импорта Nikon ICS / идентификаторы конфокальной файлов.
- Мы повторяем те же линейные спектральные unmixing и анализа мышей дикого типа в той же области мозга для получения фона остаточной стоимости.
- Тогда получаем исправленный интенсивность средняя α4YFP путем вычитания фона остаточной стоимости (4.6) от среднего значения неисправленных α4YFP (4.5).
5. Представитель Результаты
Мы покажем, представителем истинной проекции цвета лямбда стека изображений медиальной уздечка с гомозиготной мыши α4YFP (рис. 3А), взятые со спектральной конфокальной микроскопии. Мы также показываем, спектр излучения из области интересов содержащие α4YFP положительные нейроны из одного стека лямбда-изображение (рис. 3В). Отчетливый пик выбросов бросается в глаза при ~ 527 нм, что пик флуоресценции от YFP. Регион соседних медиальной уздечка показывает спектр излучения не хватает спектрального пика на 527 нм, что свидетельствует об отсутствии α4YFP подразделения нАХР. После линейных спектральных unmixing с использованием эталонных спектров YFP и autofluoresence мозга мыши со значительным перекрытием излучения (рис. 4), разделение YFP и autofluorescent сигнал можно урожайность α4YFP несмешанные изображения, autofluorescent несмешанные изображения и остальные канала. Очистить локализации гриппа α4YFPценции могут быть определены в плотно сома медиальной уздечка (рис. 4).
В гиппокампе α4YFP локализуется главным образом в средней путь перфорантных, Темперо-аммиачной пути и полость 12. Все эти глутаматергической иннервации гиппокампа. Мы изучили влияние никотина на хронический α4YFP выражение в гиппокампе путь перфорантных (рис. 5). При длительном приеме никотина (2 мг / кг / ч в течение 10 дней) привели к значительному увеличению (69 ± 14%) в α4YFP флуоресценции от контроля солевой мышей с хроническим никотином мышей (р = 0,001, Вилкоксона ранга сумма тест) ( Рис. 5).
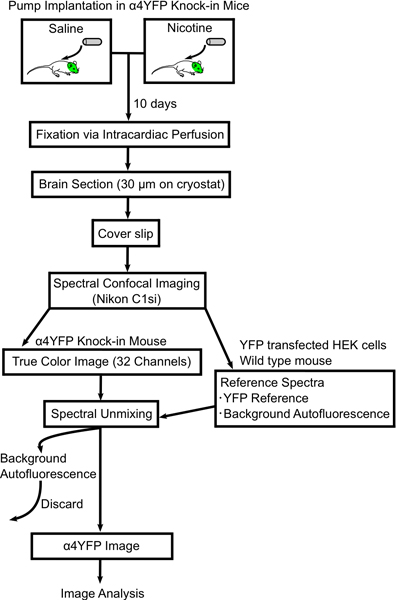
Рисунок 1. Блок-схема процедуры для изменения изображения в α4YFP нАХР подразделения с хроническими никотина. Мини-осмотического насоса заполнены или физиологического раствора или никотина и имплантированный под кожу и вершинуга; 4YFP гомозиготных мышей. Через 10 дней мышей перфузии и фиксировали 4% параформальдегида и мыши мозги подразделяются (30 мкм) на слайдах. Мозг разделе отображается на спектральные конфокальной микроскопии (Nikon C1si) и спектрально несмешанные в YFP и autofluorescent изображений. Тогда α4YFP изображения дальнейшего анализа с помощью программного обеспечения ImageJ.
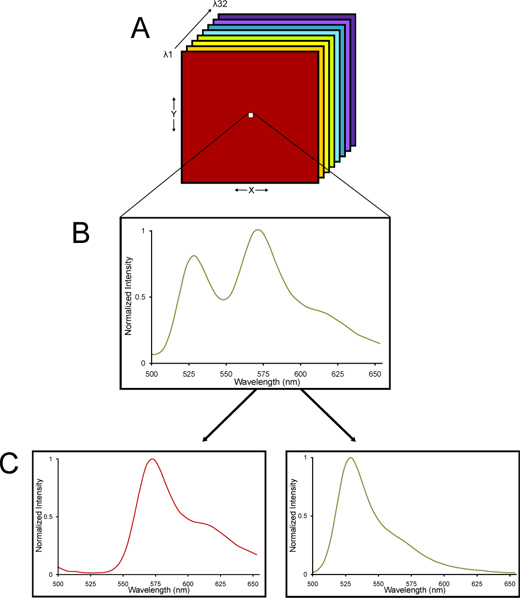
Рисунок 2. Схема лямбда-стек от отображаемого спектральной конфокальной микроскопии и линейно несмешанные на спектральные составляющие. (А), лямбда-стека изображений собирается. (B) стека лямбда состоит из изображений, собранных на различных длинах волн света, так что спектр излучения собираются для каждого пикселя по всему стеку. (C) С YFP и тканей флуоресценции имеют характерные спектральные подписи, стек лямбда можно deconvolved помощью линейного unmixing алгебраический алгоритм в сeparate YFP и autofluorescent сигналов. Таким образом, очень точная количественная оценка YFP флуоресценции можно определить даже в тканях с высоким уровнем флуоресценции.

Рисунок 3. Спектральный конфокальной изображения головного мозга, выразив α4YFP nAChRs. (A) истинно проекции цвета лямбда стека изображений медиальной уздечка из α4YFP мыши приняты с Nikon C1si спектральных конфокальной микроскопии. (B) участков спектра из области интереса, который включает в себя α4YFP содержащих нейронов (зеленый), и область интересов вне медиальной уздечка (красный).
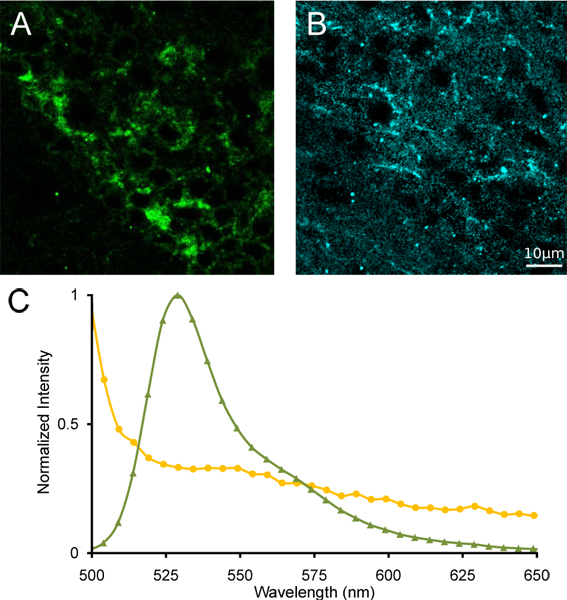
Рисунок 4. Линейный спектральный unmixing медиальной уздечка. () Изображения несмешанные α4YFP и (B) флуоресценции после линейных спектральных unmixing. (C) ссылка спектры YFP (зеленый трехуглов) и флуоресценции (желтые круги), используемых для спектрального unmixing.

Рисунок 5. Регуляция α4 nAChRs в гиппокампе α4YFP нокаут у мышей с хроническим никотина. (A) черепичными монтаж α4YFP флуоресценции от гиппокампа. Двумя пунктирными области отбора приблизительные места на нижней конечности перфорантных пути гиппокампа, где проводились анализы для каждой мыши. (B) α4YFP флуоресценции была значительно выше в перфорантных пути мышей, подвергнутых воздействию никотина, чем хронический хронический физиологический раствор (*, р = 0,001, Вилкоксона ранга сумма теста). Результаты представляют среднее ± стандартная ошибка среднего из п = 20 измерений для солевых и хронической никотиновой мышей (5 мышей для каждой группы).

Рисунок 6. Лучше гepth выражение α4YFP по сравнению с антителами маркировки. XZ ортогональной видом α4YFP флуоресценции (А) и VGlut2 антитела с Cy5 в качестве вторичного метки (B). (C) Земельные участки проявляют все большую флуоресценции деградации интенсивности сигнала по глубине для окрашивания антителами (черные квадраты) по сравнению с α4YFP (кружки).
Обсуждение
Использование флуоресцентных рецепторов в нокаут в мышиной модели для определения количества и локализации конкретных ионного канала обеспечивает ряд преимуществ. В отличие от белков, таких как актин, который повсеместно экспрессируется во всех клетках, ионные каналы, которые прис...
Раскрытие информации
Нам нечего раскрывать.
Благодарности
Энтони Ренда была поддержана Университета Виктории премию стипендий. Это исследование было поддержано естественным наукам и инженерным исследованиям Совета Канады Discovery Грант, NARSAD премия для молодых следователь (РН), Виктория Foundation - Myre и Уинифред Сим фонда, Канадского фонда инноваций грант Британской Колумбии знаний Фонда развития и естественным наукам и инженерным исследованиям Совета Канады исследовательских инструментов и приборов Грант. Мы благодарим Джиллиан Маккей, Кристина Барнс, Ариэль Sullivan, Дженнифер Макдональд и Даниэль Morgado за отличную хозяйства мыши.
Материалы
| Название реагента | Компания | Номер по каталогу | Комментарии |
| мини-осмотического насоса | Alzet | Модель 2002 | |
| солевой | Teknova | S5819 | |
| (-)-Никотин водорода тартрата | Сигма | N5260 | |
| глазные капли | Novartis | Tear-гель | |
| Vetbond клей | 3М | 1469SB | |
| гепарина натриевую соль | Сигма | H4784 | |
| 10х PBS | Invitrogen | 70011 | |
| кетамин | Wyetч здоровья животных | 0856-4403-01 | |
| medatomidine гидрохлорид | Pfizer | 1950673 | |
| 23G иглы бабочки | Becton Dickinson | 367253 | |
| параформальдегид | Электронная микроскопия наук | 15710 | |
| пластиковые формы вложения | VWR | 18986-1 | |
| Октябрь Монтаж соединений | Ткань-Tek | 4583 | |
| Mowiol 4-88 | EMD-Calbiochem | 475904 | рН 8,5 |
Ссылки
- Perry, D. C., Davila-Garcia, M. I., Stockmeier, C. A., Kellar, K. J. Increased nicotinic receptors in brains from smokers: membrane binding and autoradiography studies. J. Pharmacol. Exp. Ther. 289, 1545-1552 (1999).
- Schwartz, R. D., Kellar, K. J. Nicotinic cholinergic receptor binding sites in the brain: regulation in vivo. Science. 220, 214-216 (1983).
- Marks, M. J., Burch, J. B., Collins, A. C. Effects of chronic nicotine infusion on tolerance development and nicotinic receptors. J. Pharmacol. Exp. Ther. 226, 817-8125 (1983).
- Carlezon, W. A. J., Nestler, E. J. Elevated levels of GluR1 in the midbrain: a trigger for sensitization to drugs of abuse. Trends Neurosci. 25, 610-615 (2002).
- Fitzgerald, L. W., Ortiz, J., Hamedani, A. G., Nestler, E. J. Drugs of abuse and stress increase the expression of GluR1 and NMDAR1 glutamate receptor subunits in the rat ventral tegmental area: common adaptations among cross-sensitizing agents. J. Neurosci. 16, 274-2782 (1996).
- Saal, D., Dong, Y., Bonci, A., Malenka, R. C. Drugs of abuse and stress trigger a common synaptic adaptation in dopamine neurons. Neuron. 37, 577-5782 (2003).
- Tsien, R. Y. The green fluorescent protein. Annu. Rev. Biochem. 67, 509-544 (1998).
- Chalfie, M., Tu, Y., Euskirchen, G., Ward, W. W., Prasher, D. C. Green fluorescent protein as a marker for gene expression. Science. 263, 802-805 (1994).
- Feng, G., Mellor, R. H., Bernstein, M., Keller-Peck, C., Nguyen, Q. T., Wallace, M. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28, 41-51 (2000).
- Livet, J., Weissman, T. A., Kang, H., Draft, R. W., Lu, J., Bennis, R. A. Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system. Nature. 450, 56-62 (2007).
- Nashmi, R., Dickinson, M. E., McKinney, S., Jareb, M., Labarca, C., Fraser, S. E. Assembly of α4β2 nicotinic acetylcholine receptors assessed with functional fluorescently labeled subunits: effects of localization, trafficking, and nicotine-induced upregulation in clonal mammalian cells and in cultured midbrain neurons. J. Neurosci. 23, 11554-11567 (2003).
- Nashmi, R., Xiao, C., Deshpande, P., McKinney, S., Grady, S. R., Whiteaker, P. Chronic nicotine cell specifically upregulates functional α4* nicotinic receptors: basis for both tolerance in midbrain and enhanced long-term potentiation in perforant path. J. Neurosci. 27, 8202-8218 (2007).
- Dickinson, M. E., Bearman, G., Tilie, S., Lansford, R., Fraser, S. E. Multi-spectral imaging and linear unmixing add a whole new dimension to laser scanning fluorescence microscopy. BioTechniques. 31, 1272-1278 (2001).
- Nashmi, R., Fraser, S. E., Lester, H., Dickinson, M. E., Periasamy, A., Day, R. N. . Molecular imaging: fret microscopy and spectroscopy. , 180-192 (2005).
- Zimmermann, T., Rietdorf, J., Girod, A., Georget, V., Pepperkok, R. Spectral imaging and linear un-mixing enables improved FRET efficiency with a novel GFP2-YFP FRET pair. FEBS Lett. 531, 245-249 (2002).
- Larson, J. M. The Nikon C1si combines high spectral resolution, high sensitivity, and high acquisition speed. Cytometry A. 69, 825-8234 (2006).
- Melvin, N. R., Sutherland, R. J. Quantitative caveats of standard immunohistochemical procedures: implications for optical disector-based designs. J. Histochem. Cytochem. 58, 577-5784 (2010).
- Jones, I. W., Wonnacott, S. Why doesn't nicotinic ACh receptor immunoreactivity knock out. Trends Neurosci. 28, 343-345 (2005).
- Moser, N., Mechawar, N., Jones, I., Gochberg-Sarver, A., Orr-Urtreger, A., Plomann, M. Evaluating the suitability of nicotinic acetylcholine receptor antibodies for standard immunodetection procedures. J. Neurochem. , (2007).
- Whiteaker, P., Cooper, J. F., Salminen, O., Marks, M. J., McClure-Begley, T. D., Brown, R. W., Collins, A. C., Lindstrom, J. M. Immunolabeling demonstrates the interdependence of mouse brain a4 and b2 nicotinic acetylcholine receptor subunit expression. The Journal of Comparative Neurology. 499, 1016-1038 (2006).
- Marks, M. J., McClure-Begley, T. D., Whiteaker, P., Salminen, O., Brown, R. W. B., Cooper, J., Collins, A. C., Lindstrom, J. M. Increased nicotinic acetylcholine receptor protein underlies chronic nicotine-induced up-regulation of nicotinic agonist binding sites in mouse brain. The Journal of Pharmacology and Experimental Therapeutics. , 337-3187 (2011).
- Marks, M. J., Rowell, P. P., Cao, J. Z., Grady, S. R., McCallum, S. E., Collins, A. C. Subsets of acetylcholine-stimulated 86[Rb]+ efflux and 125[I]-epibatidine binding sites in C57BL/6 mouse brain are differentially affected by chronic nicotine treatment. Neuropharmacology. 46, 1141-1157 (2004).
- King, S. L., Caldarone, B. J., Picciotto, M. R. Beta2-subunit-containing nicotinic acetylcholine receptors are critical for dopamine-dependent locomotor activation following repeated nicotine administration. Neuropharmacology. 47, 132-139 (2004).
- Robinson, S. F., Marks, M. J., Collins, A. C. Inbred mouse strains vary in oral self-selection of nicotine. Psychopharmacology (Berl). 124, 332-339 (1996).
- Sparks, J. A., Pauly, J. R. Effects of continuous oral nicotine administration on brain nicotinic receptors and responsiveness to nicotine in C57Bl/6 mice. Psychopharmacology (Berl). , 141-145 (1999).
- Rahman, S., Zhang, J., Engleman, E. A., Corrigall, W. A. Neuroadaptive changes in the mesoaccumbens dopamine system after chronic nicotine self-administration: a microdialysis study. Neuroscience. 129, 415-4124 (2004).
- Picciotto, M. R., Zoli, M., Rimondini, R., Lena, C., Marubio, L. M., Pich, E. M. Acetylcholine receptors containing the β2 subunit are involved in the reinforcing properties of nicotine. Nature. 391, 173-177 (1998).
- Fowler, C. D., Lu, Q., Johnson, P. M., Marks, M. J., Kenny, P. J. Habenular α5 nicotinic receptor subunit signalling controls nicotine intake. Nature. 471, 597-601 (2011).
- Maskos, U., Molles, B. E., Pons, S., Besson, M., Guiard, B. P., Guilloux, J. P. Nicotine reinforcement and cognition restored by targeted expression of nicotinic receptors. Nature. 436, 103-107 (2005).
- Matta, S. G., Balfour, D. J., Benowitz, N. L., Boyd, R. T., Buccafusco, J. J., Caggiula, A. R., Craig, C. R., Collins, A. C., Damaj, M. I., Donny, E. C., Gardiner, P. S., Grady, S. R., Heberlein, U., Leonard, S. S. Guidelines on nicotine dose selection for in vivo research. Psychopharmacology. 190, 269-319 (2007).
- Lang, T., Rizzoli, S. O. Membrane protein clusters at nanoscale resolution: more than pretty pictures. Physiology (Bethesda). 25, 116-1124 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены