Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Intravitalmikroskopie der Milz: Quantitative Analyse von Parasite Mobility und die Durchblutung
In diesem Artikel
Zusammenfassung
Wir zeigen das Verfahren für die Durchführung Intravitalmikroskopie der Milz mit GFP transgenen Malaria-Parasiten und die Quantifizierung der Parasiten Mobilität und die Durchblutung in diesem Organ.
Zusammenfassung
Das Aufkommen der Intravitalmikroskopie in experimentellen Nagetier Malaria-Modellen hat große Fortschritte zur Kenntnis Parasit-Wirt-Interaktionen 1,2 zulässig. So haben in-vivo-Bildgebung des Malaria-Parasiten während der Pre-erythrozytären Stadien der aktiven Eingang des Parasiten in die Haut Lymphknoten 3, die komplette Entwicklung des Parasiten in der Haut 4 und die Bildung einer Hepatozyten-derived merosome die Migration gewährleisten aufgedeckt und Freisetzung von Merozoiten in den Blutstrom 5. Darüber hinaus hat die Entwicklung der einzelnen Parasiten in Erythrozyten vor kurzem dokumentiert mit 4D-Bildgebung und forderten unsere aktuelle Sicht auf den Protein-Export in Malaria-6. So hat intravitales Imaging radikal unsere Sicht auf wichtige Ereignisse in Plasmodium Entwicklung verändert. Leider Studien der dynamischen Lauf der Malaria-Parasiten durch die Milz, eine große Lymphorgane exquisit abgestimmt, um infizierte rote b klarelood Zellen fehlen aufgrund technischer Einschränkungen.
Mit dem Mausmodell der Malaria Plasmodium yoelii in Balb / c Mäusen, haben wir intravital Bildgebung der Milz durchgeführt und berichtet ein Differential Umbau von IT und die Einhaltung der von Parasiten befallenen roten Blutkörperchen (pRBCs) zur Barriere Zellen Fibroblasten Ursprung in der roten Pulpa während der Infektion mit dem nicht-tödlichen Parasiten line P.yoelii 17X zu Infektionen mit dem P.yoelii 17XL tödlichen Parasiten Linie 7 entgegen. Zur Erreichung dieser Schlussfolgerungen wurde eine spezielle Methodik mit ImageJ freie Software entwickelt, um die Charakterisierung der schnellen dreidimensionalen Bewegung der Single-pRBCs ermöglichen. Ergebnisse mit diesem Protokoll erhalten erlauben die Bestimmung Geschwindigkeit, Richtung und Verweildauer des Parasiten in der Milz, bei der alle Parameter die Einhaltung in vivo. Darüber hinaus berichten wir über die Methodik zur Quantifizierung des Blutflusses mittels Intravitalmikroskopie und die Verwendung von verschiedenen Farbstoffe, um einen Einblick in die komplexe Struktur der Mikrozirkulation der Milz zu gewinnen.
Ethik und Verlustrechnung
Alle Tierversuche wurden an die Tierhaltung der Universität von Barcelona in Übereinstimmung mit den Richtlinien und Protokolle von der Ethikkommission für Tierversuche der Universität Barcelona CEEA-UB (: 5429 Protokoll Nr. DMAH) genehmigt durchgeführt. Weibliche Balb / c-Mäuse von 6-8 Wochen alt wurden von Charles River Laboratories erhalten.
Protokoll
Diese Methode wurde in der Forschung in 7 gemeldet werden.
1. Tierische Infektion mit dem grün fluoreszierenden Protein (GFP) transgenen Parasiten
- P. yoelii-GFP transgenen Linien der 17XL und 17X wurden unter Verwendung der gleichen Vektoren, Targeting-Strategie und Protokolle an anderer Stelle beschrieben für P. berghei 8. Sie bringen die Mutante 3 Variante des GFP 9 unter den allgegenwärtigen Förderer P. berghei Elongationsfaktor 1 (Pbeef1a), die konstitutive Expression von GFP anweist, Cytosol während der gesamten intra-erythrozytären Entwicklungszyklus Parasiten.
- Inject Tieren intraperitoneal Parasiten befallenen roten Blutkörperchen (pRBCs) von P. yoelii-GFP transgenen Linien 17XL und 17X aus dem Schwanz Blut des Spenders Mäuse bei 5-10% Parasitämie erhalten und verdünnt in PBS. Verwenden Sie eine Dosis von 5x10 5 pRBCs / Maus, um eine periphere Parasitämie von 1% am Tag 3 post-infecti erreichenon (pi).
- Am Tag 3 pi, überprüfen Sie, ob Parasitämie von Mäusen sowohl mit Parasiten infiziert Linien ist die gleiche, indem Sie einen Blutausstrich mit einem Tropfen Blut Schwanz der Giemsa-Färbung und Beobachtung unter einem Lichtmikroskop mit einem 100x Öl-Objektiv an. Parasitämie wird durch Berechnung des Prozentsatzes der pRBCs über insgesamt Erythrozyten in drei optischen Feldern von ca. 300 RBCs geschätzt.
- Kontrolltiere mit FITC-markierten Erythrozyten injiziert werden verwendet, um die Bewegung dieser Zellen in normalen Milzen zu charakterisieren.
2. Labeling der roten Blutkörperchen mit FITC und Einspritzung zu Kontrolltieren
- Sammeln Sie 1 ml der insgesamt Blut durch Herzpunktion einer Balb / c-Maus in 200 ul PBS mit Ethylendiamintetraessigsäure (EDTA) (100 g / L, pH 7,4) und waschen Sie die RBC Pellet in PBS / EDTA (0,1 g / L, pH 7,4) durch Zentrifugation bei 300 xg für 5 Minuten (min) bei Raumtemperatur (RT).
- Resuspendieren 200 ul der RBC Pellet in 300 μ l PBS / EDTA (0,1 g / L, pH 8) mit FITC (10 g / L) und Inkubation für 2 Stunden bei Raumtemperatur im Dunkeln unter leichtem Schütteln. Nach dieser Zeit wird der Überstand entfernt und die Zellen fünfmal (300 xg, 5 min, RT) in PBS / EDTA (0,1 g / L, pH 7,4).
- Für in-vivo-Experimenten, verdünnte 10 ul des FITC-markierten RBC Pellet in 200 ul PBS und intravenös zu einer Balb / c-Maus, um 1% FITC-Erythrozyten in Umlauf gelangen.
3. Chirurgische Verfahren
- Bereiten injizierbare Betäubungsmittel von 100 mg / kg Ketamin und 5 mg / kg Midazolam pro Dosis nach dem Körpergewicht des Tieres zusammen. Spritzen Sie die Maus intraperitoneal mit einer Dosis des Anästhetikums. Readminister die Hälfte der Dosis alle 30 min zur Aufrechterhaltung der Maus Vollzeit betäubt.
- Halten Sie die Maustaste warm und überprüfen, ob die Maus vollständig narkotisiert (in der Regel nach 5-20 min) durch Einklemmen des Fußes Pad, bevor Sie fortfahren.
- Umerleichtern intravenöse Verabreichung von Substanzen im Verlauf des Experiments kanülieren die Schwanzvene der Maus über eine 27G Kanüle. Prüfen Sie, ob die Nadel auch im Inneren der Vene durch die Injektion von 20-50 ul Kochsalzlösung positioniert und verschließen Sie diese mit Klebeband. Wenn es behindert, wiederholen Sie die Kanülierung vor der Vene. Seien Sie vorsichtig, um nicht vorstellen Luftblasen.
- Setzen Sie den unteren Teil der Milz durch einen kleinen Schnitt in der Haut und Muskulatur auf der linken Rückenseite des Tieres. Legen Sie die Milz, wo weniger Atem Bewegung wird beobachtet und gelten PBS auf der Oberfläche ausgesetzt, damit es mit der Maus Haar und hydratisiert zu reinigen.
- Seal ein Deckglas von 60x24mm mit Cyanacrylat-Klebstoff (Super Glue-3 Loctite), um die Haut um die Milz zur Visualisierung zu ermöglichen.
4. Imaging von lebenden Parasiten in der Milz
- Intravitalmikroskopie Experimente wurden in einem Leica TCS SP5-konfokalen Mikroskop (Leica durchgeführtMicrosystems, Heidelberg, Deutschland) mit einer Inkubationszeit mit Temperaturregelung, ein APO 63x Glyzerinimmersion Objektiv (NA 1,3), Resonanz-Scanner mit 8000 Zeilen / s und eine Argon (488 nm) und HeNe (594 nm, 633 nm ausgestattet) Lasern. Zusätzliche Laser, wie blaue Diode (405 nm) und Diode-Pumpen-Solid-State-(561 nm), kann zur Anregung von Sonden in Tabelle 1 aufgelistet erforderlich sein.
- Legen Sie das Tier auf der Bühne des Mikroskops mit dem Cover-rutschte Milz nach unten, um das Ziel. Ein allgemeiner Blick auf die Mikrozirkulation Struktur der Milz kann optional wird über einen 20x-Objektiv. RBC Reflexion hingegen wird es hilfreich sein, den verschiedenen Regionen von Interesse, um Bild zu wählen bei höherer Vergrößerung danach.
- Schwerpunkt der ausgewählten Regionen von Interesse mit 63x Glyzerinimmersion Objektiv mit Gewebe-Autofluoreszenz. GFP Parasiten beobachtet werden, die durch verschiedene Bereiche der Milz.
- Die Fluoreszenz ist auf zwei verschiedenen cha aufgezeichnetnnels (Anregung / Emissionswellenlänge 488/505-580 nm für FITC / GFP und 488/570-630 nm für die Gewebe-Autofluoreszenz) mit der Lochkamera Set bis 3,0 Airy-Einheiten. RBC Reflexion (488/480-495 nm), zusammen mit Fluoreszenzfarbstoffen, um das Blut Gefäßsystem (siehe Tabelle 1) Label, werden verwendet, um zusätzliche Informationen über die Zone abgebildet und in den Blutstrom nachfolgend beschriebenen Versuche zu erhalten.
- Machen Sie Bilder durch fünf Z-Stapel für eine Tiefe von 8 um, weil der Dreidimensionalität der Orgel, mit einer Geschwindigkeit von 8 kHz, um Videos von 1,5 min zu erzeugen.
- Videoaufnahme von verschiedenen Zonen der Milz für die quantitative Analyse.
5. Intravitalmikroskopie der Mikrovaskulatur der Milz und der Bildaufnahme zur Messung des Blutflusses
- Vital Fluoreszenzsonden in isotonischer Kochsalzlösung gelöst werden, um die Schwanzvene während des Experiments zur Abbildung der Gefäße und einen Einblick in die Struktur der Milz injiziert werden. Eine Listevon Sonden und deren Anwendung ist in Tabelle 1 10 vorgestellt.
- Zur Beschriftung des Gefäßsystems mit fluoreszierenden Dextran, vorzubereiten 1 mg von 70 kDa Dextran mit Texas Red markierten in 100 ul Kochsalzlösung.
- Verwenden Sie den kanülierten Schwanzvene der fluoreszierenden Dextran, das Tier abzubildenden injizieren.
- Stellen Sie die Gefäße horizontal in Richtung des Laser-Scanning, optische Feld Drehung (nicht beeinflussen, Geschwindigkeit). Verwenden Sie xy und xt Linie Scan-Modi in das zentrale Lumen des Gefäßes. Verwenden Sie die bidirektionale Abtastung mit einer Linie durchschnittlich 32 bei einer Geschwindigkeit von 8 kHz, um ein Bild von 512x512 Pixeln zu erhalten.
- Erwerben Sie Bilder von Schiffen auf drei verschiedenen Kanälen (Anregung / Emissionswellenlänge 488/505-580 nm, 594/605-660 nm, 488/480-495 nm für FITC / GFP, Dextran-Texas Red und Erythrozyten-Reflexion bezeichnet).
- Nehmen Sie Bilder von Schiffen mit unterschiedlichen Durchmessern und über verschiedene Phasen des Herzzyklus, um Schwankungen auszugleichen. In diesen Bildern wird der Streifen, die aus beweglichen Zellen verwendet, um den Blutfluss 11 zu quantifizieren.
6. Bildverarbeitung und quantitative Analyse von Parasiten Mobilität mit ImageJ Software
- Erstellen Sie ein Echtzeit-Video aus der Bildsequenz generiert mit ImageJ-Software (Version 1.39o, Wayne Rasband, NIH, www.macbiophotonics.ca ).
- Öffnen Sie die ". Lif"-Datei in ImageJ keeping "xyzct" Reihenfolge und getrennte Kanäle.
- Registrieren einige nützliche Informationen aus den Metadaten-Datei: dblvoxelX-Voxel-width, dblvoxelY-Voxel-Höhe, dblvoxelZ-Voxel-Tiefe und Frame-Intervall zwischen aufeinanderfolgenden Z-Rahmen und zwischen den Stapeln. Diese Informationen werden für die Kalibrierung verwendet werden.
- Subtrahieren Autofluoreszenz (Kanal 2) auf die GFP-Parasit-Bilder (Kanal 1). Filtern Sie die Bilder mit Gaußschen Weichzeichner = 1 ist. Bitte daran erinnern, dass mit Gaußschen Weichzeichner in Bildern muss für Publikationen beste deklariert werdenns. Speichern Sie die Datei "animal1_m1_substract.seq".
- Ein Z-codierte Farb-Video als unterstützendes Material für die quantitative Analyse von Parasiten Mobilität geschaffen, wie es Einteilchen-Identifikation in sich schnell bewegenden Teilchen und Z-Bewegung Charakterisierung erleichtern.
- Konvertieren Sie die Stapel auf Bild 5D, mit dritten Dimension wird die Z und vierte Dimension die Zeit ist. Geben Sie eine andere Farbe zu jedem Z und Overlay.
- Projekt alle Z mit maximaler Intensität über alle Zeiträume zu einer Z-codierte Farb-Video zu erstellen. Save as "animal1_m1_Z_color.avi".
- Einstufen und kennzeichnen alle Partikel, die in den ersten 10 Zeitrahmen des Videos angezeigt werden nach der Anzahl der Frames des Wohnsitzes (1 bis 10). In jedem Video, werden mit 20 Teilchen nach der Proportionen erhalten verfolgt werden. Insgesamt werden 120 Parasiten von 3 Tieren quantifiziert werden, mit sechs Videos / Tier, die verschiedene Zonen der Milz.
- Melden Sie den Rahmen des Wohnsitzes auf jedem Zund über den gesamten Film für alle die Partikel zu quantifizieren.
- Führen 4D (x, y, z, t) manuelle Verfolgung von Partikeln mit der MTrackJ plugin (geschrieben von E. Meijering). Öffnen Sie die Datei "animal1_m1_substract.seq" als Bild 5D und setzen Bildeigenschaften mithilfe der Informationen registriert werden, bevor von Pixel-Breite, Höhe, Tiefe (in um) und Stack-Intervall (in sec). Konfigurieren Sie den Track-Einstellungen wie folgt: "das nächste Mal verschieben" und "gelten lokalen Cursor-bright centroid/25x25pixel". Konfigurieren Sie die Anzeige: "show Herkunft", "Bild anzeigen", "zeigen aktive Spur", "zeigen nur Spuren im aktuellen Kanäle", "zeigen nur Track-Punkt zum aktuellen Zeitpunkt".
- Fügen Sie einen Titel für jedes Teilchen. Betrachten Sie Bewegung in Z-Achse nur dann, wenn Verschiebung höher als 6 pm (mittlerer Durchmesser für eine PRBC) ist. Befolgen Sie die Partikel über maximal 100 Frames.
- Speichern Sie die x, y, z und t-Koordinaten aus dem Track als "animal1_m1_p1" gemessen. Xls.
- Maßnahmen zur Verschiebung (D = SQRT ((x endgültigen-X inital) 2 + (y final-y inital) 2 + (z final-z inital) 2); Weglänge (P = Σ n = 0 → endgültige SQRT ((x n +1-x n) 2 + ( y n +1-y n) 2 + (z n +1-z n) 2) mit n angibt, jede Position verfolgt; mittlere Geschwindigkeit und Verweilzeit lässt sich anhand der Werte von x, y, z werden, t-Koordinaten erfasst kalibriert nach den Daten registriert. Directionality der Partikel wird als Quotient aus Verschiebung vs Weglänge definiert, mit Werten von knapp 1 zeigt gerichtete Bewegung und Werte nahe 0 anzeigt, verhaltene Bewegung 12. Eine Vorlage für die Berechnung erleichtert wird beigelegt.
7. Berechnung des volumetrischen Blutflusses
- Volumetrische Blutfluss wird als Q = V * π * D v 2 / 4, mit V, Erythrozyten-Geschwindigkeit über den Querschnitt einer voraussichtlichennd D v, Lumen Gefäßdurchmesser 11.
- Zur Berechnung V, messen Sie den Winkel (θ) von fünf Partikel Streifen zeigt helle Reflexion (RBC) und vier Teilchen-Streifen zeigt grüne Fluoreszenz (PRBC-GFP) in jedem xt Bild mit ImageJ-Software. Messen Lumen Gefäßdurchmesser auf der xy-Bild.
- Die Geschwindigkeit wird dann als Ausdruck V = 1/tan (θ) * D e / D v für Erythrozyten (D e = 6 pm) und Lumen Gefäßdurchmesser zu normalisieren.
- Quantify ein Minimum von drei Schiffen mit unterschiedlichen Durchmessern und fünf xt Bilder für jedes Schiff.
8. Die statistische Analyse
- Für die statistische Analyse, Grundstück Richtwirkung, mittlere Geschwindigkeit und Verweilzeit-Verteilungen und die Gleichheit-of-Mediane Test in STATA (IC10) auf Unterschiede zwischen den beiden Parasiten Linien zu beurteilen.
9. Repräsentative Ergebnisse
Intravital imaGing der GFP Parasiten in der Milz zeigten Unterschiede in der Mobilität zwischen den beiden Stämmen des Parasiten. Quantitative Analyse der Mobilität Parameter der einzelnen Parasiten angegebenen Geschwindigkeit, mangelnde Ausrichtung und Augmented Verweilzeit des Parasiten von Mäusen mit 17X Stamm infiziert reduziert. Darüber hinaus wurde volumetrischen Blutflusses in den Gefäßen nicht zwischen den Stämmen 7 verändert. Die technische Vorgehensweise ist in Abbildung 1A dargestellt. Abbildung 1B zeigt eine allgemeine Ansicht einer normalen Milz einer Maus mit FITC-markierten Erythrozyten injiziert, mit einer Zoom-in in der roten Pulpa und eine andere in ein Gefäß (Abbildung 1B, Zoom in 1 bzw. 2). Gefäßsystem wurde durch Injektion von 70 kDa Dextran-Texas Red zusammen mit Erythrozyten Reflexion hingegen belegt. Andere fluoreszierende Farbstoffe in Tabelle 1 zusammengefasst werden verwendet, um Informationen auf der Orgel wird abgebildet, wie Hoechst (Abbildung 1C, 1D) zu gewinnen.
Real-time Bildgebung von Parasiten der 17XL und 17X Stamm ist in Movies 1 und 2 dargestellt,mit einigen 17X-PRBC (Movie 2) zeigt eine Rolling-Circle Verhalten. Quantitative Analyse der Mobilität Parameter wurde durch die Verfolgung einzelner Parasiten mit Hilfe von Z-codierte Farbbilder erreicht. Abbildung 2A zeigt eine Z-Projektion eines Z-codierte Farbe Stapel, wo die eingeschlossenen Teilchen scheint Bewegung in verschiedenen Ebenen. Abbildung 2B und 2C stellen die Tracks für unterschiedliche Parasiten in 17X und 17XL Infektion bzw.. Die Ergebnisse aus Richtwirkung und Verweilzeit aller Teilchen quantifiziert werden als Dichteverteilung Karte Parasiten Bevölkerung in Abbildung 2D und 2E, bzw. präsentiert. Zur Überwachung des Blutflusses in der Milz mit Intravitalmikroskopie wurden die Streifen in xt Bilder der zentrale Lumen der Gefäße, die aus der Erythrozyten-Bewegung erhalten gemessen an Geschwindigkeit 11 zu berechnen. Die Bilder zeigen eine xy-Scan eines Schiffes (Abb. 2F) mit den entsprechenden xt Zeilenkameras (Abbildung 2G).
| Fluorescent Probe | Lokalisierung | 1-Photonen-Anregung (nm) | 2 Photonen Anregung (nm) | Detected Emission (nm) | Menge / Maus Gewicht |
| Hoechst 33342 | Membranpermeablen DNA-bindende Sonde. Es Etiketten Kerne aller Zellen (lebende und tote) nach intravenöser Injektion. | 405 | 800 | 410-480 | 12,5 g / Kg |
| Propidiumiodid | Membran-impermeante DNA-bindende Sonde. Es Etiketten Kernen der Zellen mit beeinträchtigter Membran (apoptotischen und nekrotischen Zellen). | 561 | 800 | 570-650 | 250 mg / Kg |
| 70.000 mol wt Dextran-Fluorescent (FITC, Texas Red) | Fluid-Phase-Marker, die hingegen von Plasma verbessert. | FITC 488 Texas Red 594 | 800 | 500-540 600-650 | 50 mg / Kg |
| Natrium Fluorescein | Bulk-Fluid-Phase Albumin Marker, der Kontrast des Plasmas erhöht. | 488 | 800 | 500-540 | 2 mmol / kg |
| Evans Blue | Bulk-Fluid-Phase Albumin Marker, der Kontrast des Plasmas erhöht. | 633 | nd | 645-700 | 20 mg / Kg |
| Rhodamine R6 | Vital-Sonde, die in aktiven Mitochondrien akkumuliert. Es Etiketten Endothelien und zirkulierende weiße Blutkörperchen nach intravenöser Injektion. | 561 | 800 | 570-650 | 25 mg / Kg |
| Fluospheres-1micron Durchmesser | Perlen, die von Zellen mit Phagozytoseaktivität uptaken sind. | 488 | 800 | 500-540 | nd |
| Alexa488-markierten Fibrin IIβ Chain-spezifischen Antikörper | Prüfpunkt, der Etiketten Fibrin IIβ Kette | 488 | 800 | 500-540 | 0,3 mg / kg |
Tabelle 1. Fluoreszenzsonden für Intravitalmikroskopie. Vital Fluoreszenzfarbstoffe mit verschiedenen Lokalisierungen, die verwendet werden, um die Milz in vivo-Label werden können. Anregung / Emission (Exc / em) reicht, um mit Ein-Photonen-(oder Zwei-Photonen-Mikroskopie) zur Verfügung gestellt werden. Die Dosis angezeigt ist in 0,1-0,2 ml Kochsalzlösung Puffer gelöst und injiziert, um die Schwanzvene der Maus. [Nb: nicht in dieser Studie ermittelt.
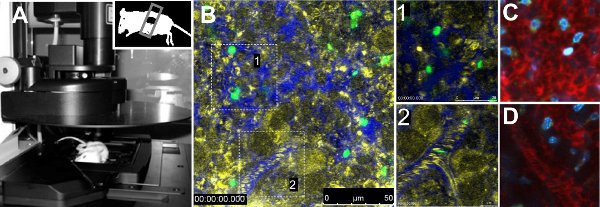
Abbildung 1. Intravital Mikroskopie der Milz. A. Leica TCS SP5-konfokalen Mikroskop mit einer Maus auf der Bühne des Mikroskops platziert. Die Maus hat den unteren Teil der Milz freigelegt und mit einem Deckglas versiegelt. B. Bild einer repräsentativen Bereich der Milz von einem nicht-infizierten Tieres mit FITC-markierten Erythrozyten injiziert und70 kDa Dextran-Texas Red, um das Gefäßsystem zu visualisieren. Reflection (gelb), sind Dextran (blau) und FITC-Erythrozyten (grün) dargestellt. Blow-ups in weißen Kästchen stellen Open-Verkehr (1) und nahe-Kreislauf (2) Bereiche. Open-Kreislauf (C) und Close-Zirkulation (D) mit 70 kDa Dextran (rot) und Hoechst 33342 (blau) gefärbt.
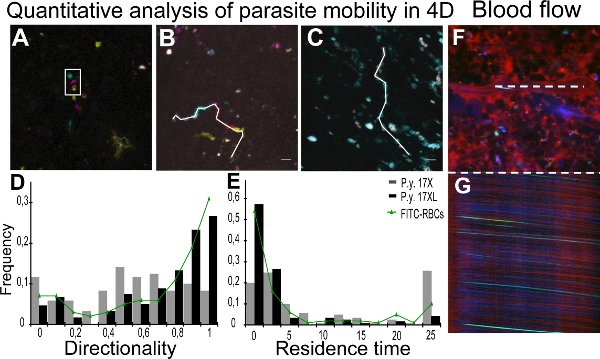
Abbildung 2. Quantifizierung der Parasiten Mobilität und Durchblutung. AC. Quantitative Analyse der Bewegung von Teilchen in den vier Dimensionen (4D) ist mit farblich Bildverarbeitung erleichtert. A.-Tracking wurde mit der Tiefeninformation von Z-codierte Farbbilder, vertreten durch Maximum Intensity Projection von fünf verschiedenen Tiefen durchgeführt. Weißes Rechteck repräsentiert den gleichen Teilchen in unterschiedlichen Z in einem Zeitpunkt. Unterschiedliche Positionen werden aufgrund Zeitspannen zwischen dem Erwerbverschiedener Z Bilder. Tiefe Code:. Gelb (0 um), orange (2 um), pink (4 um), blau (6 Mikrometer), grün (8 um) B, farbige C. Zeit Projektionen der Teilchen-Bewegung mit jedem Zeitintervall als: grau (0-2,4 sec), cyan (2,4 bis 4,8 sec), Magenta (4,8 bis 7,0 sec), rot (7,0 bis 9,4 sec) und gelb (9,4 bis 11,8 sec). Weiße Linie stellt 4D manuelle Verfolgung von Partikeln 17X (11,8 s) (B) und 17XL (4,8 sec) (C) GFP Parasiten mit MTrackJ. D, E. Verteilung der Dichte der GFP Partikel von den Werten der Richtwirkung (D) und Verweilzeit (E). Daten zu 120 Partikel jeder Zeile von Parasiten und 100 FITC-markierten Erythrozyten aus drei unabhängigen Experimenten mit der Gleichheit-of-Mediane Test analysiert entsprechen. Die 17X/17XL/FITC-RBCs Mediane 0.53/0.75/0.85 (D) und 4.61/0.67/0.9 sec (E). Unterschiede zwischen den beiden Linien in rong> (D) und (E) sind statistisch signifikant (P <0,001). Die Unterschiede zwischen den FITC-markierten Erythrozyten und 17XL Parasiten sind statistisch nicht signifikant (P> 0,05). F, G. Milz Blutfluss Messungen. Darstellung von xy Bild (F) und xt Bild (G) von einer Line-Scan des zentralen Lumen des betreffenden Schiffes (weiße Linie). Spleen Schiff zeigt Plasma mit 70 kDa Dextran (rot), PRBC (grün) und Erythrozyten-Reflexion (blau).
Filme 1 und 2. Zeitraffer-Intravitalmikroskopie Bilder des murinen Milz mit 17XL (1) oder 17X infiziert (2) GFP-transgenen Parasiten bei 10% Parasitämie (Z-Maximum-Projektion). Parasite und Gewebe-Autofluoreszenz sind grün bzw. rot dargestellt. Scale-Balken 10 um und das Zeitintervall in Sekunden.
v "> Klicken Sie hier, um Movie 1 zu sehen.
Klicken Sie hier, um Movie 2 zu sehen.
Diskussion
Die Umsetzung der Intravitalmikroskopie der Milz in diesem Nagetier Malaria-Modell eröffnet die Möglichkeit zur Untersuchung der dynamischen Passage der Parasiten durch dieses Organ, das bisher als eine "black-box" aufgrund technischer Überlegungen. In hier, war eine große Mühe geben, um eine quantitative Methode, die vergleichende Analyse der verschiedenen Parasiten Linien an den Einzel-und Bevölkerungszahlen ermöglicht anzupassen. Im Gegensatz zu anderen Geweben und Zellen, die zuvor in Malaria 3...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Wir sind besonders dankbar, S. Graewe und V. Heussler für die Erstausbildung und kontinuierliche Eingang in Intravitalmikroskopie der Malaria-Parasiten, die J. Burns für die Spende von GFP transgenen Parasiten, A. Bosch (Konfokale Unit, CCIT-UB, IDIBAPS) Unterstützung bei der Bildanalyse und Quantifizierung und P. Astola für die technische Unterstützung. Wir danken R. Tous und I. Caralt für die Videoproduktion. MF ist ein Empfänger ein Promotionsstipendium von der Allgemeinheit von Katalonien. HAP ist ein ICREA Forschungs-Professor. Die Arbeit im Labor von HAP wird von der Europäischen Gemeinschaft Siebten Rahmenprogramms (FP7/2007-2013) unter Finanzhilfevereinbarung Nr. 242095, von der Privatstiftung CELLEX (Katalonien, Spanien), und durch das spanische Ministerium für Wissenschaft und Innovation (gefördert SAF2009-07760).
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| Leica TCS SP5-konfokalen Mikroskop | Leica Microsystems, Heidelberg, Deutschland | TCS SP5-Serien-Nr. 5100000419 | |
| Ketamin (Ketolar 50 mg / ml) | Pfizer | 631028 | |
| Midazolam 15 mg / 3 ml | Normon | 838193 | |
| 70.000 MW Dextran, konjugiert mit Texas Red | Molecular Probes | D1830 | |
| Fluoresceinisothiocyanat, Isomer I (FITC) | Sigma | F7250 | |
| Hoechst 33342 | Sigma | H1399 | |
| Giemsa-Färbung | Sigma | GS1 | Working-Lösung wird auf 10% in destilliertem Wasser |
| Super Glue-3 Loctite | Loctite | 9975-0880 |
Referenzen
- Amino, R., Menard, R., Frischknecht, F. In vivo imaging of malaria parasites--recent advances and future directions. Curr. Opin. Microbiol. 8, 407-414 (2005).
- Heussler, V., Doerig, C. In vivo imaging enters parasitology. Trends. Parasitol. 22, 192-195 (2006).
- Amino, R., Thiberge, S., Blazquez, S., Baldacci, P., Renaud, O., Shorte, S. Imaging malaria sporozoites. in the dermis of the mammalian. 2, 1705-1712 (2007).
- Gueirard, P., Tavares, J., Thiberge, S., Bernex, F., Ishino, T., Milon, G. Development of the malaria parasite in the skin of the mammalian host. Proc. Natl. Acad. Sci. U. S. A. 107, 18640-18645 (2010).
- Sturm, A., Amino, R., van de Sand, C., Regen, T., Retzlaff, S., Rennenberg, A. Manipulation of host hepatocytes by the malaria parasite for delivery into liver sinusoids. Science. 313, 1287-1290 (2006).
- Gruring, C., Heiber, A., Kruse, F., Ungefehr, J., Gilberger, T. W., Spielmann, T. Development and host cell modifications of Plasmodium falciparum blood stages in four dimensions. Nat. Commun. 2, 165-165 (2011).
- Martin-Jaular, L., Ferrer, M., Calvo, M., Rosanas-Urgell, A., Kalko, S., Graewe, S. Strain-specific spleen remodelling in Plasmodium yoelii infections in Balb/c mice facilitates adherence and spleen macrophage-clearance escape. Cell. Microbiol. 13, 109-122 (2011).
- Linden, M. v. a. n. d. e. r., R, . A Plasmodium berghei reference line that constitutively expresses GFP at a high level throughout the complete life cycle. Mol. Biochem. Parasitol. 137, 23-33 (2004).
- Cormack, B. P., Valdivia, R. H., Falkow, S. FACS-optimized mutants of the green fluorescent protein. 173, 33-38 (1996).
- Dunn, K. W., Sandoval, R. M., Kelly, K. J., Dagher, P. C., Tanner, G. A., Atkinson, S. J. Functional studies of the kidney of living animals using multicolor two-photon microscopy. Am. J. Physiol. Cell. Physiol. 283, C905-C916 (2002).
- Zhong, Z., Petrig, B. L., Qi, X., Burns, S. A. In vivo measurement of erythrocyte velocity and retinal blood flow using adaptive optics scanning laser ophthalmoscopy. Opt. Express. 16, 12746-12756 (2008).
- Miller, M. J., Wei, S. H., Parker, I., Cahalan, M. D. Two-photon imaging of lymphocyte motility and antigen response in intact lymph node. Science. 296, 1869-1873 (2002).
- Bowdler, A. J. . The complete spleen. , (2002).
- Grayson, M. H., Hotchkiss, R. S., Karl, I. E., Holtzman, M. J., Chaplin, D. D. Intravital microscopy comparing T lymphocyte trafficking to the spleen and the mesenteric lymph node. Am. J. Physiol. Heart. Circ. Physiol. 284, H2213-H2226 (2003).
- Khandoga, A. G., Khandoga, A., Reichel, C. A., Bihari, P., Rehberg, M., Krombach, F. In vivo imaging and quantitative analysis of leukocyte directional migration and polarization in inflamed tissue. PLoS. One. 4, 4693-4693 (2009).
- Weiss, L., Geduldig, U., Weidanz, W. Mechanisms of splenic control of murine malaria: reticular cell activation and the development of a blood-spleen barrier. Am. J. Anat. 176, 251-285 (1986).
- Swirski, F. K., Nahrendorf, M., Etzrodt, M., Wildgruber, M., Cortez-Retamozo, V., Panizzi, P. Identification of splenic reservoir monocytes and their deployment to inflammatory sites. Science. 325, 612-616 (2009).
- Grayson, M. H., Chaplin, D. D., Karl, I. E., Hotchkiss, R. S. Confocal fluorescent intravital microscopy of the murine spleen. J. Immunol. Methods. 256, 55-63 (2001).
- Bajenoff, M., Glaichenhaus, N., Germain, R. N. Fibroblastic reticular cells guide T lymphocyte entry into and migration within the splenic T cell zone. J. Immunol. 181, 3947-3954 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten