Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Microscopie intravitale de la rate: Analyse quantitative de la mobilité des parasites et la circulation sanguine
Dans cet article
Résumé
Nous montrons la méthode pour effectuer la microscopie intravitale de la rate à l'aide des parasites du paludisme transgéniques GFP et la quantification de la mobilité et la circulation sanguine du parasite au sein de cet organe.
Résumé
L'avènement de la microscopie intravitale dans des modèles expérimentaux de paludisme des rongeurs a permis des avancées majeures à la connaissance de parasite-hôte 1,2 interactions. Ainsi, l'imagerie in vivo des parasites du paludisme au cours stades pré-érythrocytaires ont révélé l'entrée active de parasites dans les ganglions lymphatiques peau 3, le développement complet du parasite dans la peau 4, et la formation d'un merosome hépatocytes dérivés pour assurer la migration et libération de mérozoïtes dans la circulation sanguine 5. Par ailleurs, le développement de parasites individuels dans les érythrocytes a été récemment documenté en utilisant l'imagerie 4D et a contesté notre point de vue actuel sur l'exportation de protéines dans le paludisme 6. Ainsi, l'imagerie intravitale a radicalement changé notre vision sur les événements clés dans le développement de Plasmodium. Malheureusement, les études sur le passage dynamique des parasites du paludisme à travers la rate, un organe majeur lymphoïdes délicieusement adapté à claire rouge infecté bcellules lood manquent en raison de contraintes techniques.
En utilisant le modèle murin de paludisme à Plasmodium yoelii de souris Balb / c, nous avons mis en imagerie intravitale de la rate et rapporté un remodelage différentiel de lui et l'adhérence des globules rouges parasités (culot globulaire) à des cellules d'origine fibroblastique barrière dans la pulpe rouge pendant l'infection par le parasite du non-létales ligne 17X P.yoelii par opposition aux infections à la ligne P.yoelii 17XL mortelle du parasite 7. Pour arriver à ces conclusions, une méthodologie spécifique en utilisant le logiciel libre ImageJ a été développé pour permettre la caractérisation de la vitesse en trois dimensions des mouvements mono-culot globulaire. Les résultats obtenus avec ce protocole permettra de déterminer le temps de vitesse, la directivité et de séjour des parasites dans la rate, tous les paramètres d'adressage adhésion in vivo. En outre, nous présentons la méthodologie pour la quantification du flux sanguin en utilisant la microscopie intravitale et l'utilisation de DIFdifférents agents colorants pour mieux comprendre la structure complexe de la microcirculation de la rate.
Déclaration d'éthique
Toutes les études animales ont été effectuées dans les installations animales de l'Université de Barcelone, en conformité avec les directives et protocoles approuvés par le comité d'éthique pour l'expérimentation animale de l'Université de Barcelone CEEA-UB (Protocole n ° DMAH: 5429). Femme souris Balb / c de 6-8 semaines d'âge ont été obtenues de Charles River Laboratories.
Protocole
Cette méthode a été utilisée dans la recherche présentée dans 7.
1. L'infection des animaux avec des parasites vert fluorescent protéine transgénique (GFP)
- P. yoelii-GFP lignées transgéniques d'17XL et 17X ont été générés en utilisant les mêmes vecteurs, stratégie de ciblage et les protocoles décrits par ailleurs pour P. berghei 8. Ils expriment le mutant 3 variantes de la GFP 9 sous le promoteur ubiquitaire de P. berghei allongement facteur 1 (Pbeef1a), qui dirige l'expression constitutive de la GFP au parasite cytosol durant la totalité du cycle intra-érythrocytaire de développement.
- Injecter par voie intrapéritonéale animaux avec les globules rouges parasités (culot globulaire) de P. yoelii-GFP lignées transgéniques et 17XL 17X obtenu à partir du sang de la queue des souris donneuses au parasitémie 5-10% et dilué dans du PBS. Utilisez une dose de 5x10 5 culots globulaires / souris pour atteindre une parasitémie périphérique de 1% au jour 3 après-infectisur (PI).
- Au jour 3 pi, vérifiez que la parasitémie de souris infectées par les deux lignes parasites est le même en faisant un frottis sanguin avec une goutte de sang de la queue suivie d'une coloration de Giemsa et observation sous un microscope optique avec un objectif 100x. Parasitémie est estimée en calculant le pourcentage de globules rouges au cours culot globulaire total dans trois champs optiques d'environ 300 globules rouges.
- Contrôle des animaux injectés avec les globules rouges marqués au FITC peuvent être utilisés pour caractériser le mouvement de ces cellules dans la rate normale.
2. Étiquetage des globules rouges avec FITC et l'injection à des animaux témoins
- Collecter 1 ml de sang total par ponction cardiaque de souris Balb / c dans 200 ul de PBS contenant l'acide éthylène diamine tétraacétique (EDTA) (100 g / L, pH 7,4) et laver le culot de RBC dans le PBS / EDTA (0,1 g / L, pH 7,4) par centrifugation à 300 xg pendant 5 minutes (min) à température ambiante (TA).
- Resuspendre 200 pl de la pastille de RBC dans 300 μ l de PBS / EDTA (0,1 g / l, pH 8) contenant FITC (10 g / L) et incuber pendant 2 heures à température ambiante dans l'obscurité sous agitation douce. Passé ce délai, le surnageant est éliminé et les cellules lavées cinq fois (300 xg, 5 min, RT) dans du PBS / EDTA (0,1 g / l, pH 7,4).
- Pour les expériences in vivo, diluer 10 pl de la marqué FITC granulés RBC dans 200 ul de PBS et injecter par voie intraveineuse à une souris Balb / c en vue d'atteindre 1% au FITC globules rouges en circulation.
3. Les interventions chirurgicales
- Préparer anesthésique injectable composé de 100 mg / kg de kétamine et de 5 mg / kg de dose par midazolam en fonction du poids de l'animal. Injecter par voie intrapéritonéale à la souris avec une dose d'anesthésique. Readminister moitié de la dose toutes les 30 min pour maintenir la souris anesthésiée à temps plein.
- Gardez la souris chaude et vérifiez que la souris est complètement anesthésié (généralement après 5-20 min), en pinçant le coussinet plantaire avant de procéder.
- En vue defaciliter l'administration intraveineuse de substances au cours de l'expérience, cathétériser la veine de queue de la souris à l'aide d'une canule 27G. Vérifiez que l'aiguille est bien positionné à l'intérieur de la veine en injectant 20 à 50 pi de tampon salin et le sceller avec du ruban adhésif. Si l'obstrue, répétez la canulation amont de la veine. Faites attention à ne pas introduire de bulles d'air.
- Exposer la partie inférieure de la rate par une petite incision dans la peau et la musculature du côté gauche dorsale de l'animal. Placer la rate où le mouvement est observé moins le souffle et d'appliquer PBS sur la surface exposée à la garder propre du poil de la souris et hydratée.
- Joint une lamelle de 60x24mm avec de la colle cyanoacrylate (Super Glue-3 Loctite) à la peau environnante de la rate pour permettre la visualisation.
4. Imagerie des parasites qui vivent dans la rate
- Expériences de microscopie intravitale ont été réalisées dans un Leica TCS-SP5 microscope confocal (LeicaSun Microsystems, Heidelberg, Allemagne) équipé d'un système d'incubation avec contrôle de température, une lentille de 63x APO objectif de glycérol immersion (NA 1.3), un scanner de résonance à 8000 lignes / s et une Argon (488 nm) et HeNe (594 nm, 633 nm) des lasers. Les lasers supplémentaires, tels que diode bleue (405 nm) et une diode de pompe-à l'état solide (561 nm), peut être nécessaire pour l'excitation des sondes énumérées au tableau 1.
- Placez l'animal sur la scène du microscope à la couverture a glissé vers le bas la rate à l'objectif. Une vue générale de la structure de la microcirculation de la rate peut éventuellement être visualisées en utilisant un objectif 20x. Contrairement réflexion RBC sera utile pour sélectionner les différentes régions d'intérêt pour l'image à fort grossissement plus tard.
- Accent dans les régions d'intérêt sélectionnées avec l'objectif de glycérol objectif 63x en immersion à l'aide d'autofluorescence des tissus. Les parasites GFP sont observées en passant par les différentes zones de la rate.
- La fluorescence est enregistrée sur deux différents channels (excitation / émission de longueur d'onde 488/505-580 nm pour FITC / GFP et 488/570-630 nm pour l'autofluorescence des tissus) avec l'ensemble sténopé à 3,0 unités d'Airy. RBC réflexion (488/480-495 nm), avec des colorants fluorescents pour marquer les vaisseaux sanguins (voir tableau 1), sont utilisés pour obtenir des informations supplémentaires sur la zone observée et dans les expériences décrites ci-dessous le flux sanguin.
- Capturez des images à travers cinq Z-stacks couvrant une profondeur de 8 um en raison de la tridimensionnalité de l'orgue, à une vitesse de 8 kHz pour produire des vidéos de 1,5 minutes.
- Enregistrer des vidéos des différentes zones de la rate pour une analyse quantitative.
5. Microscopie intravitale de la microvascularisation de la rate et d'acquisition d'image pour mesurer le débit sanguin
- Vital sondes fluorescentes dissous dans une solution saline isotonique peut être injecté pour la veine de queue lors de l'expérience à l'image de l'aperçu vascularisation et de gagner dans la structure de la rate. Une listede sondes et de leur application est présentée au tableau 1 10.
- Pour l'étiquette du système vasculaire avec fluorescente dextrane, préparer 1 mg de 70 kDa dextrane marqués au Texas Red dans 100 ul de tampon salin.
- Utilisez la veine de la queue canule pour injecter le dextran fluorescent à l'animal d'être imagé.
- Régler les vaisseaux à l'horizontale, dans la direction de balayage laser, par rotation du champ optique (sans incidence sur la vitesse). Utilisez xy et xt ligne de balayage des modes dans la lumière centrale du navire. Utilisez la numérisation bidirectionnelle avec une moyenne de 32 lignes à une vitesse de 8 kHz pour obtenir une image de 512x512 pixels.
- Acquérir les images de bateaux sur trois canaux différents (excitation / émission de longueur d'onde 488/505-580 nm, 594/605-660 nm, 488/480-495 nm pour FITC / GFP, dextrane-Texas Red et la réflexion des érythrocytes, respectivement).
- Prenez des photos de navires de différents diamètres et plus les différentes phases du cycle cardiaque pour compenser les fluctuations. Dans ces images, les stries résultant de cellules en mouvement sera utilisé pour quantifier le flux sanguin 11.
6. Traitement de l'image et l'analyse quantitative de la mobilité des parasites à l'aide du logiciel ImageJ
- Créer une vidéo en temps réel de la séquence d'images générées à l'aide logiciel ImageJ (version 1.39o, Wayne Rasband, NIH, www.macbiophotonics.ca ).
- Ouvrez le fichier ". FRV" fichier dans ImageJ garder "xyzct" séquence et des canaux séparés.
- S'enregistrer quelques informations utiles à partir du fichier de métadonnées: dblvoxelX-voxel-largeur, dblvoxelY-voxel-hauteur, dblvoxelZ-voxel profondeur et l'intervalle de trame entre consécutifs Z-cadres et entre les piles. Cette information sera utilisée pour l'étalonnage.
- Soustraire autofluorescence (canal 2) aux images GFP-parasite (canal 1). Filtrer les images avec flou gaussien = 1. S'il vous plaît rappeler que l'aide filtre flou gaussien dans les images doivent être déclarés pour publications. Enregistrer le fichier "animal1_m1_substract.seq".
- Une vidéo de couleur Z-codé est créé comme matériel d'appui pour l'analyse quantitative de la mobilité du parasite, car elle facilitera l'identification de particules isolées dans les particules en mouvement rapide et Z-mouvement de caractérisation.
- Convertir la pile à l'image 5D, avec la troisième dimension est la dimension Z et quatrième étant le temps. Donner une couleur différente pour chaque Z et la superposition.
- Projet tous les Z en utilisant l'intensité maximale sur tous les délais pour créer une vidéo de couleur Z-codé. Enregistrer en tant que "animal1_m1_Z_color.avi".
- Classer et étiqueter toutes les particules qui apparaissent dans les 10 premières périodes de la vidéo en fonction du nombre de cadres de résidence (de 1 à 10). Dans chaque vidéo, 20 particules seront suivis suivant les proportions obtenues. Au total, 120 parasites seront quantifiés à partir de 3 animaux, en utilisant six vidéos / animaux représentant les différentes zones de la rate.
- Signaler les cadres de résidence sur chaque Zet plus le film en entier pour toutes les particules doivent être quantifiés.
- Effectuer 4D (x, y, z, t) suivi manuel de particules en utilisant le plugin MTrackJ (écrit par E. Meijering). Ouvrez le fichier "animal1_m1_substract.seq" comme l'image 5D et définir les propriétés de l'image en utilisant les informations enregistrées avant de la largeur en pixels, hauteur, profondeur (en um) et l'intervalle de pile (en secondes). Configurer les paramètres de suivi de la manière suivante: "passer à la prochaine fois» et «appliquer locales curseur lumineux centroid/25x25pixel". Configurer l'affichage: "montrer l'origine", "l'image voir", "montrer la piste active", "ne montrent que des pistes présentes dans les canaux actuels", "ne montrent que suivre le point au moment actuel».
- Ajouter une piste pour chaque particule. Considérez mouvement dans l'axe Z que si le déplacement est supérieur à 6 um (diamètre moyen d'un culot globulaire). Suivez les particules sur un maximum de 100 images.
- Enregistrer les coordonnées x, y, z et t coordonnées mesuré à partir de la piste comme "animal1_m1_p1". Xls.
- Mesures pour le déplacement (D = SQRT ((x finales-X inital) 2 + (y-y inital finale) 2 + (z-z inital dernière) 2); longueur du chemin (P = Σ n = 0 → SQRT finale ((x n +1-x n) 2 + ( Y n +1-y n) 2 + (z n 1-z n) 2) avec n indiquant chaque position suivi; vitesse moyenne et temps de séjour peut être calculé en utilisant les valeurs de x, y, z, t coordonne le suivi calibré Selon les données enregistrées. Directionnalité des particules est définie comme le quotient de déplacement vs longueur du chemin, avec des valeurs proches de 1 indiquant un mouvement dirigé et des valeurs proches de 0 mouvement restreinte indiquant 12. Un modèle de calcul est facilitée clos.
7. Calcul du flux sanguin volumétrique
- Le flux sanguin volumétrique est estimé que Q = V * π * D v 2 / 4, avec V, la vitesse des érythrocytes au cours de la coupe transversale, unee D v, diamètre du vaisseau lumière 11.
- Pour calculer V, mesurer les angles (θ) de cinq traînées de particules montrant une réflexion lumineuse (RBC) et de quatre traînées de particules montrant la fluorescence verte (GFP-CGR) dans chaque image en utilisant le logiciel ImageJ XT. Mesurer le diamètre du vaisseau lumière sur l'image xy.
- La vitesse est alors exprimé en V = 1/tan (θ) * D e / D v pour normaliser érythrocytaire (D e = 6 m) et diamètres de vaisseau lumen.
- Quantifier un minimum de trois navires de différents diamètres et cinq images xt pour chaque navire.
8. L'analyse statistique
- Pour directionnalité analyse graphique de statistique, la vitesse moyenne et le temps de séjour en tant que distributions de densité et d'utiliser le test d'égalité-de-terre-pleins dans STATA (IC10) pour évaluer les différences entre les deux lignes parasites.
9. Les résultats représentatifs
Intravitale IMAGing des parasites GFP dans la rate a révélé des différences dans la mobilité entre les deux souches de parasites. L'analyse quantitative des paramètres de mobilité des parasites seule indication baisse de la vitesse, le manque de directivité et le temps de séjour augmentée de parasites des souris infectées par la souche 17X. Par ailleurs, le flux sanguin dans les vaisseaux volumétrique n'a pas été modifiée entre les souches 7. La procédure technique est présenté dans la Figure 1A. Figure 1B montre une vue générale d'une rate normale de souris injectées avec des globules rouges marqués au FITC, avec un zoom dans la dans la pulpe rouge et une autre à un navire (figure 1B, zoom en 1 et 2, respectivement). Vascularisation a été démontré par l'injection de 70 kDa Dextran-Texas Red ensemble avec un contraste de réflexion érythrocytaire. Autres colorants fluorescents résumées dans le tableau 1 peut être utilisé pour obtenir des informations sur l'orgue étant imagées, comme Hoechst (figure 1C, 1D).
Imagerie en temps réel des parasites de la souche et 17XL 17X est présentée dans les films 1 et 2,avec quelques-17X CGR (Film 2) montrant un comportement de cercle roulant. L'analyse quantitative des paramètres de mobilité a été atteint grâce à un suivi individuel des parasites à l'aide d'images en couleurs de Z-codé. La figure 2A montre un Z-projection d'une pile de couleur Z-codé, où la particule apparaît encerclée mouvement dans des plans différents. Figure 2B et 2C représentent les pistes pour différents parasites dans l'infection et 17XL 17X, respectivement. Les résultats de la directivité et le temps de résidence de toutes les particules quantifiés sont présentés comme une carte de distribution de densité de la population de parasites dans la figure 2D et 2E, respectivement. Pour surveiller la circulation sanguine dans la rate en utilisant la microscopie intravitale, les stries obtenues dans les images xt de la lumière centrale de navires résultant du mouvement des érythrocytes a été mesurée pour calculer la vitesse 11. Les images montrent un scan xy d'un navire (figure 2F) avec les correspondants de balayage de ligne xt (figure 2G).
| Prob fluorescente | Localisation | Une excitation photonique (nm) | 2 excitation photonique (nm) | Émission détectée (nm) | Quantité / souris de poids |
| Hoechst 33342 | Membrane-perméants liaison à l'ADN de la sonde. Il étiquettes noyaux de toutes les cellules (vivantes et mortes) après injection intraveineuse. | 405 | 800 | 410-480 | 12,5 g / kg |
| L'iodure de propidium | Membrane-imperméants liaison à l'ADN de la sonde. Il étiquettes noyaux des cellules avec une membrane compromise (cellules apoptotiques et nécrotiques). | 561 | 800 | 570-650 | 250 mg / kg |
| 70000 poids moléculaire Dextran-fluorescent (FITC, Texas Red) | En phase liquide marqueur qui améliore le contraste de plasma. | FITC 488 Texas Red 594 | 800 | 500-540 600-650 | 50 mg / kg |
| Fluorescéine | Vrac en phase liquide marqueur de l'albumine qui améliore le contraste de plasma. | 488 | 800 | 500-540 | 2 mmol / kg |
| Bleu Evans | Vrac en phase liquide marqueur de l'albumine qui améliore le contraste de plasma. | 633 | ND | 645-700 | 20 mg / kg |
| Rhodamine R6 | Sonde Vital qui s'accumule dans les mitochondries actives. Il étiquettes cellules des endothéliums et circulant blanche après une injection intraveineuse. | 561 | 800 | 570-650 | 25 mg / kg |
| Fluospheres-1micron diamètre | Perles qui sont absorbés par les cellules ayant une activité phagocytaire. | 488 | 800 | 500-540 | ND |
| Alexa488 marqué IIβ de fibrine de la chaîne d'anticorps spécifiques | Sonde cette chaîne étiquettes IIβ de fibrine | 488 | 800 | 500-540 | 0,3 mg / kg |
Tableau 1. Sondes fluorescentes pour la microscopie intravitale. Vital colorants fluorescents avec des localisations différentes qui peuvent être utilisés pour étiqueter la rate in vivo. Excitation / émission (Exc / em) varie pour être utilisé avec un photon (ou microscopie à deux photons) sont fournis. La dose indiquée est dissous dans 0,1-0,2 ml de tampon saline et injectées dans la veine queue de la souris. [Nd: non déterminé dans cette étude.
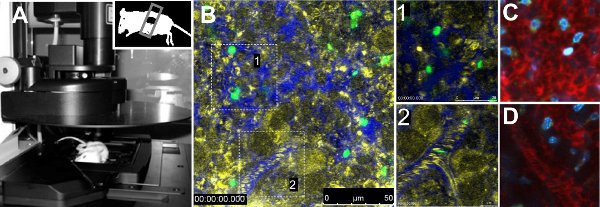
Figure 1. Microscopie intravitale de la rate. A. Leica TCS SP5-microscope confocal avec une souris placée sur la platine du microscope. La souris a la partie inférieure de la rate exposée et scellé avec une lamelle. Image B. d'une zone représentative de la rate d'un animal non infecté injecte marqué FITC globules rouges et70 kDa-Texas Red dextran de visualiser la vascularisation. Réflexion (jaune), le dextran (bleu) et les globules rouges au FITC (vert) sont représentées. Blow-up dans des boîtes blanches représentent ouvert circulation (1) et près de circulation (2) domaines. Ouvrez-circulation (C) et à proximité-circulation (D) taché de 70 kDa (rouge) de dextrane et Hoechst 33342 (bleu).
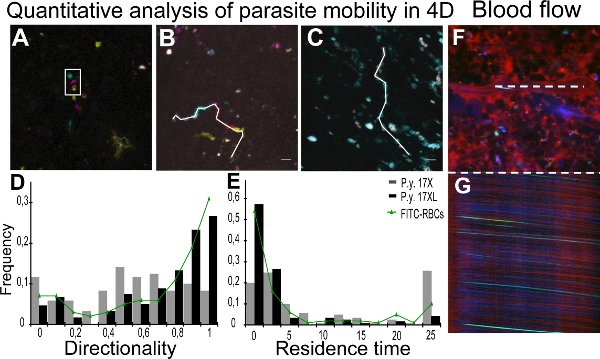
Figure 2. Quantification de la mobilité et la circulation sanguine du parasite. AC. L'analyse quantitative du mouvement des particules dans les quatre dimensions (4D) est facilitée par l'utilisation de traitement d'image couleur. Tracking A. a été réalisée avec les informations de profondeur à partir d'images couleur de Z-codé, représentée par projection d'intensité maximale de cinq profondeurs différentes. Rectangle blanc représente la même particule à différents Z en un point du temps. Différentes positions sont dues à des laps de temps entre l'acquisitiondes images Z différent. Code Profondeur:. Jaune (0 um), orange (2 um), rose (4 um), bleu (6 um), vert (8 um) B, C. Temps projections du mouvement des particules à chaque intervalle de temps de couleur comme: gris (0 à 2,4 sec), le cyan (2.4 à 4.8 sec), magenta (4,8 à 7,0 sec), rouge (7,0 à 9,4 sec) et jaune (09/04 au 11/08 sec). La ligne blanche représente 4D manuelle de suivi de particules de 17X (11,8 s) (B) et 17XL (4,8 sec) (C) en utilisant les parasites GFP MTrackJ. D, E. Distribution de la densité de particules GFP par des valeurs de directivité (D) et temps de séjour (E). Les données correspondent à 120 particules de chaque ligne de parasites et 100 globules rouges marqués au FITC à partir de trois expériences indépendantes analysés avec le test d'égalité-de-terre-pleins. Les médianes sont 17X/17XL/FITC-RBCs 0.53/0.75/0.85 (D) et 4.61/0.67/0.9 sec (E). Différences entre les deux lignes dans rong> (D) et (E) sont statistiquement significatives (P <0,001). Les différences entre les globules rouges marqués au FITC et les parasites 17XL sont pas statistiquement significatives (P> 0,05). F, G. mesures Spleen flux sanguin. Représentation de l'image xy (F) et XT image (G) à partir d'un balayage linéaire de la lumière centrale du même navire (ligne blanche). Navire de la rate montrant plasma avec 70 kDa (rouge) de dextrane, CGR (vert) et la réflexion des érythrocytes (en bleu).
Films 1 et 2. Time-lapse images de microscopie intravitale de la rate de souris infectées par 17XL (1) ou 17X (2) GFP-transgéniques parasites à la parasitémie à 10% (Z-maximale de projection). Parasite et autofluorescence des tissus sont indiquées en vert et rouge respectivement. Barres d'échelle représentent 10 um et l'intervalle de temps est en secondes.
v "> Cliquez ici pour regarder le film 1.
Cliquez ici pour voir le film 2.
Discussion
La mise en œuvre de la microscopie intravitale de la rate dans ce modèle du paludisme des rongeurs a ouvert la possibilité d'enquêter sur le passage dynamique des parasites par cet organe qui a été jusqu'à présent considéré comme une «boîte noire» en raison de considérations techniques. Ici, un effort majeur a été mis à adapter une méthode quantitative qui permet une analyse comparative des lignes parasites différents niveaux unique et de la population. Contrairement à d'autres tissus et ...
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Nous sommes particulièrement reconnaissants à S. et V. Graewe Heussler pour la formation initiale et continue en entrée microscopie intravitale des parasites du paludisme, de J. Burns pour le don de la GFP parasites transgéniques, à A. Bosch (Unité confocale, CCIT-UB, IDIBAPS) d'assistance dans l'analyse d'image et de la quantification et à P. Astola d'assistance technique. Nous remercions Tous R. et I. Caralt pour la production vidéo. MF est un bénéficiaire d'une bourse d'études supérieures de la Généralité de Catalogne. HAP est un professeur de recherche ICREA. Le travail dans le laboratoire de HAP est financé par le Programme de la Communauté européenne septième programme-cadre (FP7/2007-2013) sous convention de subvention n ° 242095, par le privé CELLEX Foundation (Catalogne, Espagne), et par le ministère espagnol de la science et l'innovation ( SAF2009-07760).
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | Commentaires |
| Leica TCS SP5-microscope confocal | Leica Microsystems, Heidelberg, Allemagne | TCS-SP5 N ° de série. 5100000419 | |
| La kétamine (Ketolar 50 mg / ml) | Pfizer | 631028 | |
| Le midazolam 15 mg / 3 ml | Normon | 838193 | |
| 70000 MW Dextran, conjugué au Texas Red | Molecular Probes | D1830 | |
| Isothiocyanate de fluorescéine, l'isomère I (FITC) | Sigma | F7250 | |
| Hoechst 33342 | Sigma | H1399 | |
| Giemsa | Sigma | GS1 | Solution de travail est à 10% dans de l'eau distillée |
| Super Glue-3 Loctite | Loctite | 9975-0880 |
Références
- Amino, R., Menard, R., Frischknecht, F. In vivo imaging of malaria parasites--recent advances and future directions. Curr. Opin. Microbiol. 8, 407-414 (2005).
- Heussler, V., Doerig, C. In vivo imaging enters parasitology. Trends. Parasitol. 22, 192-195 (2006).
- Amino, R., Thiberge, S., Blazquez, S., Baldacci, P., Renaud, O., Shorte, S. Imaging malaria sporozoites. in the dermis of the mammalian. 2, 1705-1712 (2007).
- Gueirard, P., Tavares, J., Thiberge, S., Bernex, F., Ishino, T., Milon, G. Development of the malaria parasite in the skin of the mammalian host. Proc. Natl. Acad. Sci. U. S. A. 107, 18640-18645 (2010).
- Sturm, A., Amino, R., van de Sand, C., Regen, T., Retzlaff, S., Rennenberg, A. Manipulation of host hepatocytes by the malaria parasite for delivery into liver sinusoids. Science. 313, 1287-1290 (2006).
- Gruring, C., Heiber, A., Kruse, F., Ungefehr, J., Gilberger, T. W., Spielmann, T. Development and host cell modifications of Plasmodium falciparum blood stages in four dimensions. Nat. Commun. 2, 165-165 (2011).
- Martin-Jaular, L., Ferrer, M., Calvo, M., Rosanas-Urgell, A., Kalko, S., Graewe, S. Strain-specific spleen remodelling in Plasmodium yoelii infections in Balb/c mice facilitates adherence and spleen macrophage-clearance escape. Cell. Microbiol. 13, 109-122 (2011).
- Linden, M. v. a. n. d. e. r., R, . A Plasmodium berghei reference line that constitutively expresses GFP at a high level throughout the complete life cycle. Mol. Biochem. Parasitol. 137, 23-33 (2004).
- Cormack, B. P., Valdivia, R. H., Falkow, S. FACS-optimized mutants of the green fluorescent protein. 173, 33-38 (1996).
- Dunn, K. W., Sandoval, R. M., Kelly, K. J., Dagher, P. C., Tanner, G. A., Atkinson, S. J. Functional studies of the kidney of living animals using multicolor two-photon microscopy. Am. J. Physiol. Cell. Physiol. 283, C905-C916 (2002).
- Zhong, Z., Petrig, B. L., Qi, X., Burns, S. A. In vivo measurement of erythrocyte velocity and retinal blood flow using adaptive optics scanning laser ophthalmoscopy. Opt. Express. 16, 12746-12756 (2008).
- Miller, M. J., Wei, S. H., Parker, I., Cahalan, M. D. Two-photon imaging of lymphocyte motility and antigen response in intact lymph node. Science. 296, 1869-1873 (2002).
- Bowdler, A. J. . The complete spleen. , (2002).
- Grayson, M. H., Hotchkiss, R. S., Karl, I. E., Holtzman, M. J., Chaplin, D. D. Intravital microscopy comparing T lymphocyte trafficking to the spleen and the mesenteric lymph node. Am. J. Physiol. Heart. Circ. Physiol. 284, H2213-H2226 (2003).
- Khandoga, A. G., Khandoga, A., Reichel, C. A., Bihari, P., Rehberg, M., Krombach, F. In vivo imaging and quantitative analysis of leukocyte directional migration and polarization in inflamed tissue. PLoS. One. 4, 4693-4693 (2009).
- Weiss, L., Geduldig, U., Weidanz, W. Mechanisms of splenic control of murine malaria: reticular cell activation and the development of a blood-spleen barrier. Am. J. Anat. 176, 251-285 (1986).
- Swirski, F. K., Nahrendorf, M., Etzrodt, M., Wildgruber, M., Cortez-Retamozo, V., Panizzi, P. Identification of splenic reservoir monocytes and their deployment to inflammatory sites. Science. 325, 612-616 (2009).
- Grayson, M. H., Chaplin, D. D., Karl, I. E., Hotchkiss, R. S. Confocal fluorescent intravital microscopy of the murine spleen. J. Immunol. Methods. 256, 55-63 (2001).
- Bajenoff, M., Glaichenhaus, N., Germain, R. N. Fibroblastic reticular cells guide T lymphocyte entry into and migration within the splenic T cell zone. J. Immunol. 181, 3947-3954 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon