É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Microscopia intravital do Baço: Análise Quantitativa da Mobilidade Parasite e do fluxo sanguíneo
Neste Artigo
Resumo
Nós mostramos o método para a realização de microscopia intravital do baço usando parasitas da malária transgênica GFP ea quantificação da mobilidade do parasita e do fluxo sanguíneo dentro do órgão.
Resumo
O advento da microscopia intravital em modelos de malária experimental de roedores tem permitido grandes avanços para o conhecimento de parasita-hospedeiro 1,2 interações. Assim, em imagem in vivo de parasitas da malária durante a pré-eritrocítica estágios revelaram a entrada ativa de parasitas da pele em nós linfáticos 3, o desenvolvimento completo do parasita na pele 4, ea formação de um hepatócito merosome derivados para garantir a migração e liberação de merozoítos na corrente sanguínea 5. Além disso, o desenvolvimento de parasitos nos eritrócitos foi recentemente documentado usando imagens 4D e desafiou a nossa visão atual sobre a exportação de proteínas em malária 6. Assim, imagens intravital mudou radicalmente a nossa opinião sobre eventos-chave no desenvolvimento de Plasmodium. Infelizmente, os estudos da passagem dinâmica de parasitas da malária através do baço, um órgão linfóide importante primorosamente adaptada para limpar infectados vermelho bcélulas lood faltam devido a limitações técnicas.
Utilizando o modelo murino de malária Plasmodium yoelii em camundongos Balb / c, temos implementado imagem intravital do baço e relatou uma remodelação diferencial dele e aderência de glóbulos vermelhos parasitados (pRBCs) às células de origem fibroblástica barreira na polpa vermelha durante a infecção com o parasita não-letal de linha P.yoelii 17x em oposição a infecções letais com o 17XL P.yoelii linha parasita 7. Para chegar a estas conclusões, uma metodologia específica usando o software livre ImageJ foi desenvolvido para permitir a caracterização do movimento tridimensional rápida de single-pRBCs. Resultados obtidos com este protocolo permite determinar a direcionalidade, velocidade e tempo de residência de parasitas no baço, todos os parâmetros referentes a adesão in vivo. Além disso, relatamos a metodologia de quantificação do fluxo sanguíneo através de microscopia intravital eo uso de diferendiferentes corantes para obter insights sobre a estrutura da microcirculação complexas do baço.
Declaração de Ética
Todos os estudos com animais foram realizados no biotério da Universidade de Barcelona, em conformidade com as diretrizes e protocolos aprovados pelo Comitê de Ética em Experimentação Animal da Universidade de Barcelona-UB CEEA (Protocolo n º DMAH: 5429). Feminino camundongos Balb / c de 6-8 semanas de idade foram obtidos a partir Charles River Laboratories.
Protocolo
Este método foi utilizado na pesquisa relatada em 7.
1. Infecção animal com proteína fluorescente verde parasitas (GFP) transgênico
- Linhas P. yoelii-GFP transgênicas de 17XL e 17x foram gerados usando os mesmos vetores, visando estratégias e protocolos descritos em outra parte para P. berghei 8. Eles expressam a variante mutante do GFP 3 9 sob o promotor onipresente de P. berghei fator de elongação 1 (Pbeef1a), que direciona expressão constitutiva de GFP ao parasita citosol durante o ciclo intra-eritrocítica inteira de desenvolvimento.
- Injetar intraperitonealmente com animais parasitados glóbulos vermelhos (pRBCs) de P. yoelii-GFP transgênicos linhas 17XL e 17x obtidos a partir do sangue da cauda dos camundongos doadores a parasitemia 5-10% e diluído em PBS. Use uma dose de 5x10 5 pRBCs / mouse para chegar a uma parasitemia periférica de 1% no 3 º dia pós-infectiem (pi).
- No dia 3 pi, verifique se parasitemia de camundongos infectados com ambas as linhas parasita é o mesmo, fazendo um esfregaço de sangue com uma gota de sangue da cauda seguida pela coloração Giemsa e observação em microscópio de luz com um objetivo de petróleo 100x. Parasitemia é estimado através do cálculo do percentual de pRBCs mais de hemácias total em três campos ópticos de aproximadamente 300 hemácias.
- Animais do grupo controle injetados com FITC marcado hemácias podem ser usadas para caracterizar o movimento destas células em baço normal.
2. Marcação das células vermelhas do sangue com FITC e injeção para controlar animais
- Coletar 1 ml de sangue total por punção cardíaca, de um rato Balb / c, em 200 mL de PBS contendo ácido etilenodiaminotetracético (EDTA) (100 g / L, pH 7,4) e lavar o pellet RBC em PBS / EDTA (0,1 g / L, pH 7,4) por meio de centrifugação a 300 xg por 5 minutos (min) à temperatura ambiente (RT).
- Ressuspender 200 mL de sedimento RBC em 300 emu; l de PBS / EDTA (0,1 g / L, pH 8) contendo FITC (10 g / L) e incubar por 2 horas em temperatura ambiente no escuro com leve agitação. Após esse tempo, o sobrenadante é removido e as células lavadas cinco vezes (300 xg, 5 min, RT), em PBS / EDTA (0,1 g / L, pH 7,4).
- Para experimentos in vivo, diluir 10 ml do FITC-rotulados RBC pellet em 200 mL de PBS e injectar por via intravenosa a um rato Balb / c, a fim de chegar a 1% FITC-hemácias em circulação.
3. Procedimentos cirúrgicos
- Prepare anestésico injetável composto de 100 mg / kg de ketamina e 5 mg / kg de dose por Midazolam de acordo com o peso do animal. Injetar a via intraperitoneal rato com uma dose de anestésico. Readministrar metade da dose a cada 30 minutos para manter o mouse em tempo integral anestesiados.
- Mantenha o mouse quente e verifique se o mouse é completamente anestesiados (geralmente após 50-20 min) apertando a almofada do pé antes de prosseguir.
- A fim defacilitar a administração intravenosa de substâncias durante o curso do experimento, canular a veia da cauda do rato usando uma cânula 27G. Verifique se a agulha está bem posicionada no interior da veia, injetando 20-50 mL de tampão salina e selá-lo com fita adesiva. Se ela obstrui, repita o montante canulação da veia. Tenha cuidado para não introduzir bolhas de ar.
- Expor a parte inferior do baço através de uma pequena incisão na pele e musculatura no lado esquerdo dorsal do animal. Coloque o baço, onde o movimento da respiração é menos observada e aplicar PBS na superfície exposta para mantê-lo limpo do cabelo do mouse e hidratada.
- Selar uma tampa de deslizamento de 60x24mm com adesivo de cianoacrilato (Super Glue Loctite-3) para a pele ao redor do baço para permitir a visualização.
4. Imagens de parasitas que vivem no baço
- Experimentos de microscopia intravital foram realizadas em um microscópio confocal Leica TCS-SP5 (LeicaMicrosystems, Heidelberg, Alemanha) equipado com um sistema de incubação, com controle de temperatura, uma APO 63x glicerol lente objetiva de imersão (NA 1.3), scanner de ressonância em 8000 linhas / s e um argônio (488 nm) e HeNe (594 nm, 633 nm) lasers. Lasers adicionais, tais como diodos azul (405 nm) eo diodo bomba-estado sólido (561 nm), pode ser necessária para a excitação de sondas listadas na Tabela 1.
- Colocar o animal no palco do microscópio com a tampa escorregou-baço virado para baixo para o objectivo. Uma visão geral da estrutura da microcirculação do baço pode ser opcionalmente visualizado utilizando objetiva de 20x. RBC contraste reflexão será útil para selecionar diferentes regiões de interesse para a imagem em maior ampliação depois.
- Foco as regiões selecionadas de interesse com 63x lente objetiva de imersão utilizando glicerol autofluorescência de tecidos. Parasitas GFP são observados passando por diferentes áreas do baço.
- Fluorescência é gravado em dois diferentes channels (excitação / emissão de comprimento de onda 488/505-580 nm para FITC / GFP e 488/570-630 nm para autofluorescência do tecido) com o conjunto de pinhole para 3,0 unidades de Airy. RBC reflexão (488/480-495 nm), juntamente com corantes fluorescentes para rotular a vasculatura arterial (ver Tabela 1), são usados para obter informações adicionais sobre a zona que está sendo fotografada e nos experimentos de fluxo sanguíneo descrito abaixo.
- Capturar imagens através de cinco Z-pilhas que cobrem uma profundidade de 8 M por causa da tridimensionalidade do órgão, a uma velocidade de 8 kHz para gerar videos de 1,5 min.
- Gravar vídeos de diferentes zonas do baço para análise quantitativa.
5. Microscopia intravital da microvasculatura do baço e de aquisição de imagens para medição de fluxo de sangue
- Vital sondas fluorescentes dissolvido em solução salina pode ser injetado na veia da cauda durante o experimento para a imagem da vasculatura e ganhar insight dentro da estrutura do baço. Uma listade sondas e sua aplicação é apresentada na Tabela 1 10.
- Para rotular o sistema vascular com dextran fluorescentes, prepare 1 mg de 70 kDa dextran marcado com Texas Red em 100 l de tampão salina.
- Use a veia da cauda canulados para injetar o dextran fluorescentes para o animal que está sendo fotografada.
- Definir os vasos na horizontal, na direção de varredura a laser, por rotação do campo óptico (que não afetam a velocidade). Use xy e xt line modos de digitalização no lúmen central do navio. Use a digitalização bidirecional com uma média de 32 linhas a uma velocidade de 8 kHz para obter uma imagem de 512x512 pixels.
- Aquisição de imagens de vasos em três canais diferentes (excitação / emissão de comprimento de onda 488/505-580 nm, 594/605-660 nm, 488/480-495 nm para FITC / GFP, dextran-Texas Red e reflexão de eritrócitos, respectivamente).
- Captar imagens de vasos com diâmetros diferentes e mais de diferentes fases do ciclo cardíaco para compensar flutuações. Nessas imagens, as estrias resultantes de células de movimento serão utilizados para quantificar o fluxo sangüíneo 11.
6. Processamento de imagem e análise quantitativa da mobilidade do parasita usando software ImageJ
- Criar um vídeo em tempo real a partir da seqüência de imagens geradas usando software ImageJ (versão 1.39o, Wayne Rasband, NIH, www.macbiophotonics.ca ).
- Abra o ". Lif" arquivo em ImageJ manter "xyzct" seqüência e canais separados.
- Registrar algumas informações úteis a partir do arquivo de metadados: dblvoxelX-voxel de largura, dblvoxelY-voxel de altura, dblvoxelZ-voxel profundidade e intervalo entre quadros consecutivos Z-frames e entre as pilhas. Esta informação será utilizada para calibração.
- Subtrair autofluorescência (canal 2) às imagens GFP-parasita (canal 1). Filtrar as imagens com Gaussian Blur = 1. Por favor, recordar que o uso de filtro gaussian blur em imagens precisa ser declarado para publications. Salvar o arquivo "animal1_m1_substract.seq".
- Um vídeo de cor Z-coded é criado como material de suporte para a análise quantitativa da mobilidade do parasita, uma vez que irá facilitar a identificação única de partículas em partículas em movimento rápido e Z-movimento caracterização.
- Converter a pilha para Imagem 5D, com terceira dimensão é a dimensão Z e quarto sendo o tempo. Dar uma cor diferente a cada Z e sobreposição.
- Projeto de todos os Z usando intensidade máxima sobre todos os prazos para criar um vídeo de cor Z-codificado. Salvar como "animal1_m1_Z_color.avi".
- Classificar e rotular todas as partículas que aparecem nos primeiros 10 frames tempo do vídeo de acordo com o número de quadros de residência (1-10). Em cada vídeo, 20 partículas serão rastreadas seguir as proporções obtidas. No total, 120 parasitas serão quantificados de 3 animais, utilizando seis vídeos / animal representando diferentes zonas do baço.
- Relatório os quadros de residência em cada Ze sobre o filme inteiro para todas as partículas a serem quantificados.
- Executar 4D (x, y, z, t) de controle manual de partículas utilizando o plugin MTrackJ (escrito por E. Meijering). Abra o arquivo "animal1_m1_substract.seq" como imagem 5D e definir as propriedades da imagem utilizando as informações registradas antes de pixels de largura, altura, profundidade (em mm) eo intervalo de pilha (em seg). Configurar as definições de faixa como se segue: "passar para a próxima vez" e "aplicar locais cursor brilhante centroid/25x25pixel". Configure mostrando: "show origem", "imagem show", "show faixa ativa", "mostrar somente as faixas presentes em canais atuais", "mostram apenas os pontos da trajetória no tempo atual".
- Adicionar uma faixa para cada partícula. Considere o movimento no eixo Z apenas se o deslocamento é maior do que 6 mM (diâmetro médio de um CGV). Siga as partículas ao longo de um máximo de 100 frames.
- Save the x, y, z e t coordenadas medidas da pista de atletismo "animal1_m1_p1". Xls.
- Medidas para o deslocamento (D = SQRT ((x finais-X inital) 2 + (y final-y inital) 2 + (z-z finais inital) 2); comprimento do caminho (P = Σ n = 0 → SQRT final ((x n +1-x n) 2 + ( y n +1-y n) 2 + (z-z n +1 n) 2) com n indicando cada posição rastreados, velocidade média e tempo de permanência pode ser calculada usando os valores de x, y, z, t coordenadas rastreado calibrado de acordo com os dados cadastrados. Direcionalidade das partículas é definida como o quociente de deslocamento versus comprimento do caminho, com valores de cerca de um movimento dirigido e indicando valores de perto de 0 movimento indicando contida 12. Um modelo para os cálculos é facilitada fechado.
7. Cálculo do fluxo de sangue volumétrica
- O fluxo de sangue volumétrica é estimado como Q = V * π * D v 2 / 4, com V, a velocidade sobre a seção de eritrócitos a cruz umD nd v, lumen diâmetro do vaso 11.
- Para calcular V, medir os ângulos (θ) de cinco faixas de partículas mostrando reflexo luminoso (RBC) e quatro faixas de partículas mostrando fluorescência verde (CGV-GFP) em cada imagem xt usando software ImageJ. Medir o diâmetro dos vasos luz na imagem xy.
- A velocidade é então expresso como V = 1/tan (θ) e * D / D v para normalizar para eritrócitos (D e = 6 mm) e diâmetros navio lúmen.
- Quantificar um mínimo de três vasos com diâmetros diferentes e cinco imagens xt para cada navio.
8. Análise estatística
- Para estatística direcionalidade enredo, análise, velocidade média e tempo de permanência, distribuições de densidade e usar o teste de igualdade de medianas em-STATA (IC10) para avaliar as diferenças entre as duas linhas do parasita.
9. Resultados representante
Intravital imaging de parasitas GFP no baço revelou diferenças na mobilidade entre as duas cepas de parasitas. Análise quantitativa dos parâmetros de mobilidade dos parasitas único indicado reduziu a velocidade, a falta de direcionalidade e tempo de residência aumentado de parasitas de camundongos infectados com a cepa 17x. Além disso, o fluxo sanguíneo nos vasos volumétrica não foi alterado entre as linhagens 7. O procedimento técnico é apresentado na Figura 1A. A Figura 1B mostra uma visão geral de um baço normal de um rato injetado com FITC marcado hemácias, com um zoom in na polpa vermelha e outra para uma embarcação (Figura 1B, zoom em 1 e 2, respectivamente). Vascularização foi evidenciado pela injeção de 70 kDa Dextran-Texas Red juntamente com contraste reflexão eritrócitos. Outros corantes fluorescentes resumidos na Tabela 1 pode ser usada para obter informações sobre o órgão a ser fotografada, como Hoechst (Figura 1C, 1D).
Imagens em tempo real de parasitas da cepa 17XL e 17x é apresentado no Cinema 1 e 2,com algumas 17x-CGV (Movie 2), mostrando um comportamento círculo de enrolar. Análise quantitativa dos parâmetros de mobilidade foi conseguido através de rastreamento de parasitas individuais com a ajuda de imagens Z-coded cor. Figura 2A mostra uma Z-projeção de uma pilha de cor Z-coded, onde a partícula aparece rodeado movendo-se em diferentes planos. Figura 2B e 2C representam as faixas para diferentes parasitas na infecção 17x e 17XL, respectivamente. Resultados da direcionalidade e tempo de residência de todas as partículas quantificados são apresentados como um mapa de distribuição da densidade da população de parasitas na Figura 2D e 2E, respectivamente. Para monitorar o fluxo de sangue no baço usando microscopia intravital, as listras em imagens obtidas xt do lúmen central de vasos resultante do movimento de eritrócitos foram medidos para calcular a velocidade 11. As imagens mostram uma varredura xy de um navio (Figura 2F) com o correspondente xt linha de varredura (Figura 2G).
| Prob fluorescentese | Localização | Um fóton de excitação (nm) | 2 Excitação fóton (nm) | Emissão detectada (nm) | Quantidade / mouse peso |
| Hoechst 33342 | Membrana permeante-DNA-binding sonda. É etiquetas núcleos de todas as células (vivos e mortos) após a injeção intravenosa. | 405 | 800 | 410-480 | 12,5 g / kg |
| Iodeto de propídio | Membrana impermeant-DNA-binding sonda. É etiquetas núcleos de células com membrana comprometida (células apoptóticas e necróticas). | 561 | 800 | 570-650 | 250 mg / Kg |
| 70.000 mol wt Dextran-fluorescente (FITC, Texas Red) | Fase fluida marcador que melhora o contraste da plasma. | FITC 488 Texas Red 594 | 800 | 500-540 600-650 | 50 mg / Kg |
| Fluoresceína sódica | Marcador de fase fluida granel albumina que melhora o contraste da plasma. | 488 | 800 | 500-540 | 2 mmol / Kg |
| Evans Blue | Marcador de fase fluida granel albumina que melhora o contraste da plasma. | 633 | nd | 645-700 | 20 mg / Kg |
| Rodamina R6 | Sonda vital que se acumula na mitocôndria ativa. É etiquetas endotélio e células brancas circulantes após a injeção intravenosa. | 561 | 800 | 570-650 | 25 mg / Kg |
| Fluospheres-1micron diâmetro | Contas que são captado por células com atividade fagocitária. | 488 | 800 | 500-540 | nd |
| Alexa488 marcado IIβ fibrina cadeia de anticorpo específico | Sonda que os rótulos cadeia IIβ de fibrina | 488 | 800 | 500-540 | 0,3 mg / Kg |
Tabela 1. Sondas fluorescentes para microscopia intravital. Vital corantes fluorescentes com localizações diferentes que podem ser usados para rotular o baço in vivo. Excitação / emissão (Exc / em) varia para ser usado com um fóton (ou microscopia de dois fótons) são fornecidos. A dose indicada é dissolvido em 0,1-0,2 ml de tampão salina e injetadas na veia da cauda do rato. [Nd: não determinado neste estudo.
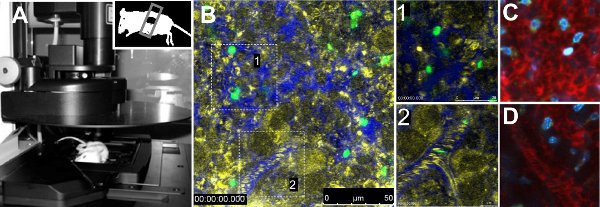
Figura 1. Microscopia intravital do baço. A. Leica TCS-SP5 microscópio confocal com um rato colocado no palco do microscópio. O mouse tem a parte inferior do baço expostos e selado com uma tampa de deslizamento. B. Imagem de uma área representativa do baço de um animal não-infectado injetados com FITC marcado hemácias e70 kDa Dextran-Texas Red para visualizar a vascularização. Reflexão (amarelo), Dextran (azul) e FITC-hemácias (verde) são mostradas. Blow-ups em caixas brancas representam a circulação aberta (1) e close-circulação (2) áreas. -Circulação aberta (C) e close-circulação (D) corados com 70 kDa dextran (vermelho) e Hoechst 33342 (azul).
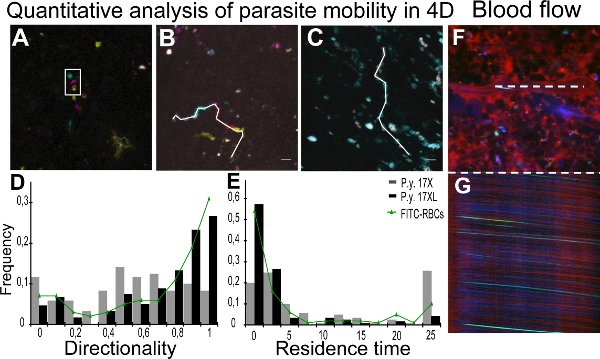
Figura 2. Quantificação do parasita mobilidade e fluxo sanguíneo. AC. Análise quantitativa do movimento de partículas em quatro dimensões (4D) é facilitada pela utilização de um código de cores de processamento de imagem. Rastreamento A. foi realizada com a informação de profundidade a partir de imagens Z-coded cor, representada usando projeção de intensidade máxima de cinco diferentes profundidades. Branco retângulo representa a mesma partícula em Z diferentes em um só ponto do tempo. Diferentes posições são devido a lapsos de tempo entre a aquisiçãode imagens diferentes Z. Código de profundidade:. Amarela (0 mm), laranja (2 mm), rosa (4 mm), azul (6 mm), verde (8 mm) B, C. Tempo projeções do movimento de partículas em cada intervalo de tempo coloridos como: cinza (0-2,4 sec), ciano (2,4-4,8 segundos), magenta (4,8-7,0 segundos), vermelho (7,0-9,4 segundos) e amarelo (9,4-11,8 sec). Linha branca representa 4D rastreamento manual de partículas de 17x (11,8 s) (B) e 17XL (4,8 seg) (C) parasitas GFP utilizando MTrackJ. D, E. Distribuição da densidade de partículas GFP pelos valores da direcionalidade (D) e tempo de residência (E). Dados correspondem a 120 partículas de cada linha de parasitas e 100 hemácias FITC marcado a partir de três experimentos independentes analisadas com o teste de igualdade-de-medianas. As medianas são 17X/17XL/FITC-RBCs 0.53/0.75/0.85 (D) e 4.61/0.67/0.9 sec (E). Diferenças entre as duas linhas em rong> (D) e (E) são estatisticamente significativas (P <0,001). Diferenças entre FITC marcado hemácias e parasitas 17XL não são estatisticamente significativas (P> 0,05). F, G. Baço medições de fluxo de sangue. Representação de xy imagem (F) e imagem xt (G) de uma linha de varredura do lúmen central do mesmo navio (linha branca). Navio baço mostrando plasma com 70 kDa dextran (vermelho), CGV (verde) e de reflexão de eritrócitos (azul).
Filmes 1 e 2. Time-lapse imagens de microscopia intravital do baço de camundongos infectados com 17XL (1) ou 17x (2) GFP-parasitas transgênicos na parasitemia de 10% (Z-projeção máxima). Parasita e autofluorescência de tecidos são mostrados em verde e vermelho, respectivamente. Barras de escala representam 10 mm e o intervalo de tempo é em segundos.
v "> Clique aqui para assistir o filme 1.
Clique aqui para assistir o filme 2.
Discussão
A implementação da microscopia intravital do baço, neste modelo de malária de roedor abriu a possibilidade de investigar a passagem dinâmica de parasitas através deste órgão, que até agora tem sido considerada uma "caixa-preta", devido a considerações técnicas. Aqui, um grande esforço foi colocado para adaptar um método quantitativo que permite a análise comparativa das diferentes linhas de parasita nos níveis individual e populacional. Em contraste com outros tecidos e células que tinham sido...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Estamos particularmente gratos ao S. Graewe e Heussler V. para a formação inicial e contínua de entrada em microscopia intravital de parasitas da malária, a J. Burns para a doação de parasitas GFP transgênicos, a A. Bosch (Unidade Confocal, CCIT-UB, IDIBAPS) de assistência em análise de imagem e quantificação e P. Astola para assistência técnica. Agradecemos a R. e I. Tous Caralt para produção de vídeo. MF é um receptor de uma bolsa de pós-graduação da Generalidade da Catalunha. HAP é um professor e pesquisador ICREA. Trabalho no laboratório de HAP é financiado pelo Programa da Comunidade Europeia Sétimo Programa-Quadro (FP7/2007-2013), sob subvenção N ° 242095, pela Fundação Privada Cellex (Catalunha, Espanha), e pelo Ministério espanhol da Ciência e Inovação ( SAF2009-07760).
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
| Leica TCS-SP5 microscópio confocal | Leica Microsystems, Heidelberg, Alemanha | TCS-SP5 n º de série. 5100000419 | |
| Ketamina (Ketolar 50 mg / ml) | Pfizer | 631028 | |
| Midazolam 15 ml mg / 3 | Normon | 838193 | |
| 70.000 MW Dextran, conjugado com Texas Red | Sondas moleculares | D1830 | |
| Isotiocianato de fluoresceína, isômero I (FITC) | Sigma | F7250 | |
| Hoechst 33342 | Sigma | H1399 | |
| Giemsa | Sigma | GS1 | Solução de trabalho é de 10% em água destilada |
| Super Glue-3 Loctite | Loctite | 9975-0880 |
Referências
- Amino, R., Menard, R., Frischknecht, F. In vivo imaging of malaria parasites--recent advances and future directions. Curr. Opin. Microbiol. 8, 407-414 (2005).
- Heussler, V., Doerig, C. In vivo imaging enters parasitology. Trends. Parasitol. 22, 192-195 (2006).
- Amino, R., Thiberge, S., Blazquez, S., Baldacci, P., Renaud, O., Shorte, S. Imaging malaria sporozoites. in the dermis of the mammalian. 2, 1705-1712 (2007).
- Gueirard, P., Tavares, J., Thiberge, S., Bernex, F., Ishino, T., Milon, G. Development of the malaria parasite in the skin of the mammalian host. Proc. Natl. Acad. Sci. U. S. A. 107, 18640-18645 (2010).
- Sturm, A., Amino, R., van de Sand, C., Regen, T., Retzlaff, S., Rennenberg, A. Manipulation of host hepatocytes by the malaria parasite for delivery into liver sinusoids. Science. 313, 1287-1290 (2006).
- Gruring, C., Heiber, A., Kruse, F., Ungefehr, J., Gilberger, T. W., Spielmann, T. Development and host cell modifications of Plasmodium falciparum blood stages in four dimensions. Nat. Commun. 2, 165-165 (2011).
- Martin-Jaular, L., Ferrer, M., Calvo, M., Rosanas-Urgell, A., Kalko, S., Graewe, S. Strain-specific spleen remodelling in Plasmodium yoelii infections in Balb/c mice facilitates adherence and spleen macrophage-clearance escape. Cell. Microbiol. 13, 109-122 (2011).
- Linden, M. v. a. n. d. e. r., R, . A Plasmodium berghei reference line that constitutively expresses GFP at a high level throughout the complete life cycle. Mol. Biochem. Parasitol. 137, 23-33 (2004).
- Cormack, B. P., Valdivia, R. H., Falkow, S. FACS-optimized mutants of the green fluorescent protein. 173, 33-38 (1996).
- Dunn, K. W., Sandoval, R. M., Kelly, K. J., Dagher, P. C., Tanner, G. A., Atkinson, S. J. Functional studies of the kidney of living animals using multicolor two-photon microscopy. Am. J. Physiol. Cell. Physiol. 283, C905-C916 (2002).
- Zhong, Z., Petrig, B. L., Qi, X., Burns, S. A. In vivo measurement of erythrocyte velocity and retinal blood flow using adaptive optics scanning laser ophthalmoscopy. Opt. Express. 16, 12746-12756 (2008).
- Miller, M. J., Wei, S. H., Parker, I., Cahalan, M. D. Two-photon imaging of lymphocyte motility and antigen response in intact lymph node. Science. 296, 1869-1873 (2002).
- Bowdler, A. J. . The complete spleen. , (2002).
- Grayson, M. H., Hotchkiss, R. S., Karl, I. E., Holtzman, M. J., Chaplin, D. D. Intravital microscopy comparing T lymphocyte trafficking to the spleen and the mesenteric lymph node. Am. J. Physiol. Heart. Circ. Physiol. 284, H2213-H2226 (2003).
- Khandoga, A. G., Khandoga, A., Reichel, C. A., Bihari, P., Rehberg, M., Krombach, F. In vivo imaging and quantitative analysis of leukocyte directional migration and polarization in inflamed tissue. PLoS. One. 4, 4693-4693 (2009).
- Weiss, L., Geduldig, U., Weidanz, W. Mechanisms of splenic control of murine malaria: reticular cell activation and the development of a blood-spleen barrier. Am. J. Anat. 176, 251-285 (1986).
- Swirski, F. K., Nahrendorf, M., Etzrodt, M., Wildgruber, M., Cortez-Retamozo, V., Panizzi, P. Identification of splenic reservoir monocytes and their deployment to inflammatory sites. Science. 325, 612-616 (2009).
- Grayson, M. H., Chaplin, D. D., Karl, I. E., Hotchkiss, R. S. Confocal fluorescent intravital microscopy of the murine spleen. J. Immunol. Methods. 256, 55-63 (2001).
- Bajenoff, M., Glaichenhaus, N., Germain, R. N. Fibroblastic reticular cells guide T lymphocyte entry into and migration within the splenic T cell zone. J. Immunol. 181, 3947-3954 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados