Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Klinische Tests und Rückenmark Removal in einem Mausmodell für Amyotrophe Lateralsklerose (ALS)
In diesem Artikel
Zusammenfassung
Ein Mausmodell für amyotrophe Lateralsklerose (ALS) ist klinisch geprüft und auf der Verhaltensebene. Als Voraussetzung für eine Begleitperson immunhistologische Analyse der Zubereitung des Rückenmarks wird im Detail dargestellt.
Zusammenfassung
Amyotrophe Lateralsklerose (ALS) ist eine tödlich verlaufende neurodegenerative Erkrankung, die sich in progressive Degeneration der Motoneuronen. Peak-Erkrankungsalter liegt rund 60 Jahre für die sporadische Krankheit und rund 50 Jahre für die Erbkrankheit. Aufgrund seiner fortschreitenden Verlauf, sterben 50% der Patienten innerhalb von 30 Monaten nach Einsetzen der Symptome. Um neue Behandlungsmöglichkeiten für diese Krankheit zu bewerten, wurden genetische Mausmodelle der ALS basierend auf menschlichen familiäre Mutationen im SOD-Gens, wie die SOD1 (G93A) eine Mutation erzeugt. Die wichtigsten Aspekte, die im Modell ausgewertet werden müssen, sind das Gesamtüberleben, die klinische Verlauf und die Motorik. Hier haben wir die klinische Bewertung zu demonstrieren, zeigen die Leitung von zwei Verhaltens-motorischen Tests und liefern quantitative Scoring-Systeme für alle Parameter. Da eine eingehende Analyse des ALS-Maus-Modell erfordert in der Regel eine immunhistochemische Untersuchung des Rückenmarks zeigen wir, ihre Vorbereitung im Detail tun, die Anwendung derRsaI Laminektomie Methode. Beispielhafte histologischen Befunde werden demonstriert. Die umfassende Anwendung der dargestellten Untersuchungsmethoden in Studien am Mausmodell der ALS wird es dem Forscher, um zuverlässig zu testen zukünftige therapeutische Optionen, die eine Grundlage für spätere klinische Studien am Menschen liefern kann.
Protokoll
Die Tiere wurden vom Jackson Laboratory (# 002726) 1 gekauft. Sie sind klinisch erzielte und einer Prüfung der motorischen Funktion (Rotarod Test) und der Muskelkraft (hängende Draht-Test). Alle diese Tests und die spätere Tötung der Tiere, um das Rückenmark vorbereitet haben in sehr enger Übereinstimmung mit den örtlichen Richtlinien für die ordnungsgemäße Durchführung von Tierversuchen durchgeführt worden.
1. Clinical Score
Neben der Beurteilung des Körpergewichts Mäuse auf Anzeichen von motorischen Defizit mit dem folgenden 4-Punkt-Scoring-System 2 untersucht:
4 Punkte: normal (keine Anzeichen für motorische Störungen)
3 Punkte: Hinterbein Zittern sind offensichtlich, wenn am Schwanz aufgehängt
2 Punkte: Gangstörungen vorhanden sind
1 Punkt: Ziehen von mindestens einem Hinterbein
0 Punkte: symmetrischLähmung, die Unfähigkeit, sich nach rechts oder Verlust von 20% der maximalen Körpergewicht, in diesem Fall werden die Tiere getötet und sofort das Experiment beendet
2. Tests der motorischen Funktion und Muskelkraft
Draht hängen
Dieser Test wird verwendet, um die Muskelkraft 3, 4 zu bewerten. Alle Tiere diesen Test mindestens ein oder zwei Tage nach dem Rotarod-Test. Jede Maus auf einem maßgeschneiderten Drahtdeckel mit Abständen von 0,8 cm gelegt und vorsichtig auf den Kopf gestellt, abgedeckt 60 cm über einem Strohhalm unten. Nach der Ausbildung in drei aufeinander folgenden Mal von mindestens 180 s die Latenz zu fallen, wird gemessen. Jede Maus wird bis zu drei Versuche zu halten, um den Deckel umgekehrt für maximal 180 s und die längste Periode aufgezeichnet wird.
Rotarod-Test
Die Rotarod Apparat (Ugo Basile, Comerio, Italien) wurde eingesetzt, um motorische Koordination, Gleichgewicht und motorische Lernfähigkeit 3, 4 zu messen. Eine gute Leistung erfordert ein hohes Maß an sensomotorische Koordination. Die Maschine sollte in einem ruhigen und nicht störende Umwelt auf ablenkende Reize für das Tier zu vermeiden getestet platziert werden. Es besteht aus einer computergesteuerten motorisch drehbaren Spindel und fünf Spuren für fünf Mäusen. Fälle der Mäuse werden automatisch durch Druck auf eine Kunststoffplatte am Boden erkannt wird. Nach der Ausbildung in drei aufeinander folgenden Mal von mindestens 180 s bei einer konstanten Geschwindigkeit von 15 UpM die Zeit, für die ein Tier auf der Drehstange bleiben kann gemessen wird. Jedes Tier durchläuft drei Versuche und die längste Wartezeit, ohne zu fallen wird aufgezeichnet. Die Zeit von 180 s wird als Cut-Off-Zeit gewählt, weil die Mehrheit der signifikanten Unterschiede in der motorischen Koordination in diesem Zeitrahmen erkannt werden.
3. Spinal Cord Vorbereitung
- Die Tiere werden durch CO 2-Insufflation in Übereinstimmung mit den lokalen Richtlinien getötet und werden sofort transkardial mit PBS-Lösung mit einem 4% Paraformaldehyd-Lösung, gefolgt perfundiert.
- Um das Rückenmark der Maus geopfert herzustellen, wird das Tier auf einem Operationstisch angeordnet und die vier Glieder auf der Seite befestigt ist, um die Rückseite der Maus freizulegen.
- Ein kurzer Waschgang mit einer 70% igen Ethanol-Lösung reinigt die Stelle der Dissektion und flacht das Fell.
- Dann wird die Haut mit einem scharfen Skalpell in der Mittellinie eingeschnitten. Zur Erleichterung Schneiden der Haut auf beiden Seiten gestreckt wird. Falls Beinmuskeln müssen vorbereitet werden, hat sich ihre Haut auch eingeschnitten werden.
- Nach dem Hautschnitt abgeschlossen ist, wird es zur Seite mit einer Pinzette, um die zugrunde liegende oberflächliche Faszie des Körpers aussetzen gezogen.
- Die Muskulatur des Halses und des Lig. nuchae müssen entfernt werden und sind ca.refully vorbereitet. Achten Sie darauf, um tief und Läsion des Rückenmarks einzuschneiden. Die Schultermuskulatur kann auch entfernt werden, um besser entlarven die Wirbelsäule werden.
- Dann werden die paravertebralen Muskeln werden aus der gesamten Wirbelsäule entfernt.
- Zum Öffnen der Wirbelsäule mehrere Laminektomien müssen durchgeführt werden. Man sollte aus dem oberen Teil Schädelknochen an der Stelle der Gelenkverbindung Atlas-Hinterhauptbein starten.
- Am einfachsten ist es, die Fixierung der oberen zwei Gliedmaßen zu entfernen und überfordern den Hals, um besser in der Lage, um die Laminektomie des ersten Wirbel durchzuführen. Diese werden entfernt, ohne den freiliegenden zervikalen Rückenmarks gezogen.
- Mehr Wirbeln durch erste Durchschneiden der Wirbelbögen an beiden Seiten mit abgewinkelten Scheren und dann Ziehen an den Dornfortsätzen entfernt. Verbleibende seitlichen Teile der Wirbel zu entfernen, um später eine vollständige Entfernung des Rückenmarks zu erleichtern.
- Einen anatomischen Stützpunkt der Lenden-spinal Kabel ist die Anschwellung, die auch in der zervikalen Rückenmarks.
- Nach Abschluss der Laminektomie des gesamten Rückenmarks, stellen Sie sicher, dass Sie auch durchschneiden alle ventralen Wurzeln und lassen das Rückenmark von der Dura mater der Hirnhäute.
- Dann wird der zervikalen Rückenmarks nach kranial und schneiden Sie beginnen, um das Rückenmark zu entfernen.
- Schließlich das Rückenmark auch am distalen Cauda-equina geschnitten, um vollständig freigegeben.
- Letztlich wird das Rückenmark in einen postfixating Lösung (z. B. 4% Paraformaldehyd) über Nacht gelegt und kann weiter verarbeitet werden. Wir in der Regel Gefrier das Rückenmark, um es für immunhistologische Analyse vorzubereiten.
4. Repräsentative Ergebnisse
Die Technik des Rückenmarks Vorbereitung stellt den Schwerpunkt dieses Video Artikel. Es ist eine wesentliche Voraussetzung für den späteren Gewebe-Schnitte und letztlich für immunhistologische Analyse der Spinal Kabel Abschnitten. Als Beispiel für ein Endergebnis, eine immunhistochemische Aufarbeitung des Vorderhorn Bereich des Maus Lendenrückenmark einer Wildtyp (wt) und einer SOD G93A Transgen (tg) der Maus nachgewiesen wird. Motorneuronen mit einem primären Anti-ChAT-Antikörper und nachfolgender fluoreszierende Kennzeichnung mit einem sekundären Cy3-Antikörper identifiziert werden. Darüber hinaus hat eine nukleare Gegenfärbung mit DAPI (4,6-Diamino-2-phenylindol) durchgeführt (Abb. 1).
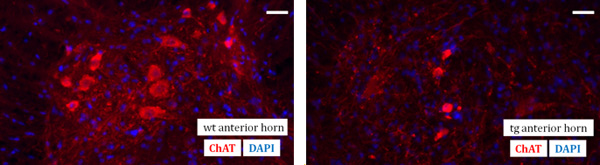
Abbildung 1. Fluorescent Mikrofotografien Visualisierung der Immundetektion von Motoneuronen mit Anti-ChAT-Antikörper (rot) und Zellkernen Gegenfärbung mit DAPI (blau) in der Maus Lendenrückenmark Vorderhorn eines Wildtyp (wt) (links) und der ein SOD G93A transgenen (tg) (rechts) Maus im Alter von 130 Tagen. Maßstab: 40 um.
Wie die immunhistochemische Analysedie SOD G93A Mäusen ist nicht das primäre Anwendungsbereich dieses Artikels entnehmen Sie bitte der Original-Publikation, in denen diese transgenen Mäuse charakterisiert worden sind und neuere therapeutische Ansätze, die studieren für weitere Referenz 1, 5, 6. Wenn therapeutische Wirkungen auf den immunhistologischen Ebene klar definiert sind differenziert werden quantitative Auswertung Algorithmen sollte von einem stereologische Software (siehe zum Beispiel 7) aufgebracht unterstützt werden.
Diskussion
Die SOD1 (G93A) genetisches Mausmodell ist ein wertvolles Tiermodell, um den Krankheitsverlauf der progressiven Motoneuron Verlust vergleichbar mit menschlichen amyotrophe Lateralsklerose 8 zu studieren. Eine Vielzahl von unterschiedlichen Behandlung Paradigmen in diesem Modell geprüft, und eine Grundlage für die spätere Prüfung in klinischen Studien am Menschen 8-10. Um der Lage sein, erhebliche Unterschiede in einer experimentellen Studie zur Therapie bei diesen Mäusen erkennen, ist es von e...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
LT hat Zuschüsse aus dem Forschungsförderungsprogramm der Universitätsmedizin Göttingen erhalten. PL und MB wurden von der DFG-Forschungszentrum für Molekulare Physiologie des Gehirns (CMPB), Göttingen unterstützt. Die Autoren danken Dr. Lars Tatenhorst um Unterstützung bei der Videografie und Birgit Liebau für die Hilfe bei Audio-und Videobearbeitung.
Materialien
| Name | Company | Catalog Number | Comments |
| Hersteller | Bestellinformationen | ||
| Verhaltenstests | |||
| Rota-Rod für Mäuse | Ugo Basile, Comerio, Italien | # 47600 | |
| Draht hängen Gerät | Maßgeschneidert | ||
| Spinal Cord Vorbereitung | |||
| OP-Tisch Betriebslampe Schutzhandschuhe | |||
| "Iris" Schere, abgewinkelt, um Seite | Fine Science Tools, Heidelberg, Deutschland | 14063-09 | |
| Cohan-Vannas Frühling Schere, gerade | Fine Science Tools, Heidelberg, Deutschland | 15000-10 | |
| Mikropinzetten | Hammacher, Solingen, Deutschland | HWC 111-10 | |
| Scalpel "Präzisa plus" | Dahlhausen, Köln, Deutschland | 11.000.00.510, Fig. 10 | |
Referenzen
- Gurney, M. E. Motor neuron degeneration in mice that express a human Cu, Zn superoxide dismutase mutation. Science. 264 (5166), 1772-1775 (1994).
- Weydt, P. Assessing disease onset and progression in the SOD1 mouse model of ALS. Neuroreport. 14 (7), 1051-1054 (2003).
- Crawley, J. N. Behavioral phenotyping strategies for mutant mice. Neuron. 57 (6), 809-818 (2008).
- Miana-Mena, F. J. Optimal methods to characterize the G93A mouse model of ALS. Amyotroph. Lateral Scler. Other Motor Neuron Disord. 6 (1), 55-62 (2005).
- Zhong, Z. Activated protein C therapy slows ALS-like disease in mice by transcriptionally inhibiting SOD1 in motor neurons and microglia cells. J. Clin. Invest. 119 (11), 3437-3449 (2009).
- Pitzer, C. Granulocyte-colony stimulating factor improves outcome in a mouse model of amyotrophic lateral sclerosis. Brain. 131 (Pt. 12), 3335-3347 (2008).
- Gowing, G. Ablation of proliferating microglia does not affect motor neuron degeneration in amyotrophic lateral sclerosis caused by mutant superoxide dismutase. J. Neurosci. 28 (41), 10234-10244 (2008).
- Scott, S. interpretation of studies in the standard murine model of ALS. Amyotroph Lateral Scler. 9 (1), 4-15 (2008).
- Turner, B. J., Talbot, K. Transgenics, toxicity and therapeutics in rodent models of mutant SOD1-mediated familial ALS. Prog Neurobiol. 85 (1), 94-134 (2008).
- Corse, A. M. Preclinical testing of neuroprotective neurotrophic factors in a model of chronic motor neuron degeneration. Neurobiol Dis. 6 (5), 335-346 (1999).
- Knippenberg, S. Significance of behavioural tests in a transgenic mouse model of amyotrophic lateral sclerosis (ALS). Behav Brain Res. 213 (1), 82-87 (2010).
- Burgess, R. W., Cox, G. A., Seburn, K. L. Neuromuscular disease models and analysis. Methods Mol. Biol. 602, 347-393 (2010).
- Hayworth, C. R., Gonzalez-Lima, F. Pre-symptomatic detection of chronic motor deficits and genotype prediction in congenic B6.SOD1(G93A) ALS mouse model. Neuroscience. 164 (3), 975-985 (2009).
- Ludolph, A. C. Guidelines for preclinical animal research in ALS/MND: A consensus meeting. Amyotroph Lateral Scler. 11 (1-2), 38-45 (2010).
- Boillee, S. Onset and progression in inherited ALS determined by motor neurons and microglia. Science. 5778 (3), 1389-1392 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten