Method Article
Die Verwendung von
In diesem Artikel
Zusammenfassung
Die Larve der Wachsmotte Galleria mellon wurde vor kurzem als ein in vivo Modell, um Legionella pneumophila-Infektion zu studieren etabliert. Hier zeigen wir grundlegende Techniken, die Pathogenese von Legionellen in den Larven charakterisieren, einschließlich Impfung, Messung der bakteriellen Virulenz und Replikation sowie die Extraktion und Analyse von infizierten Blutzellen.
Zusammenfassung
Legionella pneumophila ist der Erreger einer schweren Lungenentzündung namens Legionärskrankheit, eine wichtige menschliche Krankheitserreger, der infiziert und repliziert in Alveolarmakrophagen. Seine Virulenz hängt von der Dot / Icm Typ-IV-Sekretionssystem (T4SS), die unerlässlich ist, um eine Replikation permissive Vakuole als Legionella Vakuole (LCV) bekannt zu etablieren. L. pneumophila-Infektion in Mäusen modelliert werden, aber die meisten Mausstämmen nicht permissive, was zu der Suche nach neuen Infektionsmodellen. Wir haben kürzlich gezeigt, dass die Larven der Wachsmotte Galleria mellon eignen sich für die Untersuchung von L. pneumophila-Infektion. G. mellon wird zunehmend als Infektionsmodell für menschliche Krankheitserreger verwendet, und eine gute Korrelation zwischen Virulenz der verschiedenen Bakterienarten gibt es in der Insekten-und in Säugetiermodellen. Ein wichtiger Bestandteil der Immunabwehr der Larven sind Blutzellen, Berufal Phagozyten, die bis Eindringlinge zu nehmen und zu zerstören. L. pneumophila in der Lage ist, zu infizieren, einen Transporter und replizieren in diesen Zellen. Protokolle zur Analyse von L. Hier zeigen wir, pneumophila Virulenz in G. mellon-Modell, darunter, wie man Infektions L. wachsen pneumophila, vorzubehandeln, die Larven mit Inhibitoren, infizieren die Larven und wie auf infizierte Zellen für die Quantifizierung und Immunfluoreszenz-Mikroskopie zu extrahieren. Wir beschreiben auch, wie bakterielle Replikation und Fitness im Wettbewerb Assays quantifizieren. Diese Ansätze ermöglichen die schnelle Screening von Mutanten Faktoren in L. wichtig festzustellen, pneumophila Virulenz, beschreibt ein neues Werkzeug, um unser Verständnis dieses komplexen Krankheitserreger unterstützen.
Einleitung
Tiermodellen der Infektion wurden bei der Bestimmung der Virulenzfaktoren von unschätzbarem Wert erwiesen. Allerdings haben wirbellosen Modelle erhöhte Aufmerksamkeit als eine praktikable Alternative zu traditionellen Säugetiermodelle der Infektion gewonnen. Die Larven der Wachsmotte Galleria mellon wird zunehmend verwendet, um eine Reihe von wichtigen Humanpathogene, einschließlich Gram-positiven und Gram-1-negativen Bakterien 2,3 und mehrere pathogene Pilze 4,5 studieren. Verwendung eines Insekten-Modell hat eine Reihe von Vorteilen gegenüber traditionellen Säugermodellen als wirbel, G. mellon unterliegt nicht den ethischen Grenzen der Säugetier-Modelle. Darüber hinaus können die Larven leicht aufrechterhalten werden, ohne Anästhesie durch Injektion infiziert zogen Vorbehandlung mit chemischen Inhibitoren 6 und aufrechtzuerhalten Inkubation bei 37 ° C 7. Interessanterweise konnte eine gute Korrelation zwischen der Pathogenität von mehreren Mikroorganismen in G. mellonella und Säugetiermodelle der Infektion wurde 2,8 etabliert. Der besseren Verständnis des Immunsystems von G. mellon auch bei der Charakterisierung dieser Modellorganismus unterstützt. Obwohl Insekten nicht über ein adaptives Immunsystem wie in Säugetieren gefunden, haben sie anspruchsvolle Mobilfunk-und Oberarmabwehrkräfte einschließlich der Produktion von antimikrobiellen Peptiden 9. Blutzellen sind die wichtigsten Vermittler der zellulären Abwehrkräfte und sind die zahlreichen Zelltyp in der Hämolymphe (oder Blut) von G. gefunden mellon 10, Diese Zellen sind professionelle Phagozyten und ähnliche Funktionen an humanen Makrophagen und Neutrophile sowohl Aufnahme und abbauenden Bakterien in einer phago-lysosomalen Kompartiment 10,11 und bildet Knötchen um eindringende Bakterien, bakteriellen Replikations physisch beschränken 12.
Legionella pneumophila ist ein Erreger, der schwere Atem pneumoni verursachta (Legionärskrankheit) bei empfindlichen Bevölkerungsgruppen wie ältere Menschen oder immungeschwächten 13. Legionellen ubiquitär sowohl Umwelt-und künstlichen Wasserquellen, wo es ist ein Krankheitserreger der verschiedenen Arten von Süßwasser 14,15 Amöben gefunden. Legionellen überlebt und repliziert innerhalb dieser professionellen Phagozyten durch Verwendung eines Multiprotein-Komplexes als Dot / Icm (in Organellen Handel defekt / intrazelluläre Vermehrung) bekannten Typ 4 Sekretionssystem (T4SS) bis über 275 Effektor-Proteine in der Wirtszelle 16-20 translozieren. Diese Proteine dienen, die normalen Wirtszelle phagocytic Wege untergraben, die zur Schaffung des Legionella Vakuole (LCV) mit. Die LCV vermeidet Fusion mit Lysosomen und stattdessen rekrutiert endoplasmatischen Retikulum (ER) abgeleiteten Vesikeln, was in einem spezialisierten Kompartiment, das die raue ER 21,22 ähnelt. L. pneumophila gilt als eine zufällige menschlichen Wegogen, die gleichen Strategien, die es ermöglichen, innerhalb von Amöben zu replizieren, auch die Replikation in menschlichen Alveolarmakrophagen 23.
Säugetierwirte als Modelle für menschliche Legionella-Infektion einschließlich Mäusen und Meerschweinchen 24,25 gekennzeichnet. Die Mehrheit der Mausstämme sind jedoch resistent gegen Legionella-Infektion 26 mit Ausnahme des Inzucht Albino A / J-Maus, die eine leichte, selbstbegrenzenden Infektion 24 entwickelt. Obwohl das Meerschweinchen-Modell ähnelt mehr 25 Menschen eine Krankheit, das Fehlen von Mutanten und erhöhten Kosten schreckt ihre Verwendung 27. Außerdem haben mehrere wirbel Modelle für Legionella pneumophila-Infektion entwickelt, einschließlich Caenorhabditis elegans 28, Drosophila melanogaster 29 und verschiedene Arten von Amöben 30-32. Allerdings haben diese Modelle Schwächen, Virulenz im C. elegans System ist nicht Dot / ICM-abhängige 28, die Begrenzung der Nutzen dieses Modells. Die Drosophila-Modell hat sich in der Untersuchung von bakteriellen Virulenzfaktoren und 29 scheint jedoch vielversprechend erwiesen, dieses Modell nicht vollständig charakterisiert. Einzellige Amöben sind die Umwelt Gastgeber von L. pneumophila und eignen sich für die Untersuchung der Wirkung von Virulenz-Faktoren auf molekularer Ebene 33 fehlt jedoch mehrere wichtige Mediatoren von Säuger-Wirtszellantwort auf eine Infektion wie Caspasen 34. Die Schwächen der bestehenden Modelle, zusammen mit den hohen Kosten und ethische Bedenken auf Säugetier Experimente verwandt, hat mit der Suche nach anderen geeigneten Modellorganismen 29,35 geführt.
Wir haben kürzlich gezeigt, dass G. mellon ist ein geeignetes Modell für L. pneumophila Pathogenese 36,37. Dieses Protokoll beschreibt die experimentelle Techniken für infizieren verwendeting G. mellon Larven, Analyse Larven Moral, Extrahieren Hämozyten für Zähl-und Immunfluoreszenz und die Bestimmung der Replikation von lebensfähigen Keimzahl von infizierten Larven.
Protokoll
1. Vorbereitung von L. pneumophila für Infektions
- Vorbereitung Kohle Hefeextrakt (CYE) Platten (2 g / L Aktivkohle, 10 g / L Hefeextrakt, 13 g / l Agar, 10 g / l N-(2-Acetamido)-2-aminothanesulfonic Säure (ACES), 1 g / l α-Ketoglutarat, 0,4 g / l L-Cystein-HCl und 0,25 g / l Eisenpyrophosphat, pH 6.9).
Hinweis: Falls erforderlich, fügen Kanamycin (25 ug / ml) und / oder Chloramphenicol (6 pg / ml), um Platten CyE.- Führen Sie alle L. pneumophila Arbeit an biologischen Sicherheit Stufe 2 (BSL-2) in einer mikrobiellen Sicherheitsschrank (MSC) in Übereinstimmung mit den lokalen Vorschriften.
- Streak L. pneumophila von -80 ° C Glycerin-Stamm auf CYE Platten
- Inkubation erfolgt für 4 Tage bei 37 ° C.
Hinweis: Die Inkubation der Platten für 4 Tage die Virulenz von L. deutlich erhöht pneumophila in G. mellon über Inkubation für 3 Tage. - Einen Tag vor der Infektion, eine Schleife zu suspendieren full von Bakterien (die mehrere Kolonien) in 1 ml vorgewärmtem (37 ° C) ACES Hefeextrakt (AYE) Brühe und die Extinktion bei 600 nm (OD 600) unter Verwendung eines Spektrophotometers.
- Impfen ein frisches 3 ml AYE Kultur (mit Antibiotika falls erforderlich) zu einer endgültigen OD 600 von 0,1.
- Fügen Sie eine Medien nur steuern, um die Sterilität der Medien zu gewährleisten.
- Inkubieren bei 37 ° C in einem Schüttelinkubator bei 200 UpM für 21 Stunden.
Hinweis: Die Bakterien sollten, um post-exponentiellen Phase für die Infektion 38 angebaut werden. Wachsen für 21 Stunden ermöglicht Experimente standardisiert werden.
Hinweis: Wenn für die Proteininduktion erforderlich, fügen Sie 0,5 mM Isopropyl-β-D-1-(IPTG) über Nacht. - Messen Sie die OD 600 (Bakterien sollten in post-exponentiellen Wachstumsphase, OD 600 von 2,5 bis 3 sein).
- Verdünnte Bakterienkultur bis 1 × 10 9 CFU / ml in steriler Dulbecco-phosphatgepufferter Kochsalzlösung (D-PBS) zu ergeben.
Anmerkung: Basierend auf früheren Ergebnissen, eine OD 600 von 1 entspricht 1 x 10 9 CFU / ml, dies sollte jedoch für verschiedene L. bestätigt pneumophila-Stämme.
Hinweis: wenn die Induktion eines Proteins aus einem Plasmid benötigt wird mit 1 mM IPTG zu dem Inokulum. - Teller des Inokulums, wie in Abschnitt 9 als Kontrolle zu gewährleisten, die erwartete CFU im Impfstoff vorhanden ist, beschrieben.
2. Vorbereitung der Larven
- Kaufen Sie ausreichend G. mellon Larven von einem kommerziellen Anbieter. Die Larven werden mit 5 oder 6. Larvenstadium Stufe (etwa zwischen 2-3 cm Länge) geliefert und sind für den Einsatz sofort.
Hinweis: Eine Methode, die beschreiben, wie hinten Larven zuvor 39 beschrieben.
Hinweis: Die Larven können bei Raumtemperatur für bis zu zwei Wochen gelagert und Lebensmittel nicht erfordert. Sofort verwerfen jede Larven Anzeichen von Verpuppung. - Bereiten Sie den Behälter für Larve von Placten einen Kreis von 10 cm Filterpapier in den Boden einer 10 cm Petrischale.
- Mit stumpfer Spitze Pinzette, legen zehn gesunden Larven von etwa gleicher Größe in der Petrischale.
Hinweis: Entsorgen Sie ungesund braun gefärbte oder fleckig suchen Insekten. Gesunde Larven gleichmäßig cremig ohne Bereiche mit dunklen Verfärbungen gefärbt und sind in der Lage, sich schnell, wenn rechts gewendet.
3. Die Infektion von G. mellon Larven
- Vorbereitung der Injektion Plattform durch Abkleben einen Kreis von Filterpapier auf die Oberfläche.
- Kleben Sie einen P1000 Spitze horizontal auf das Filterpapier, eine Injektion Plattform. Das nicht steril sein.
- Sterilisieren einer Mikrotiterplatte 20 &mgr; l-Spritze durch Ansaugen von 70% Ethanol und Inkubation für mindestens 10 min.
- Tragen Sie pannensichere Handschuhe während der Injektion,
- Entfernen Sie das restliche Ethanol durch Ansaugen und Ausstoßen sterilem Wasser mehrmals.
- Using die Spritze ansaugen 10 ul der L. pneumophila 1 × 10 9 CFU / ml Suspension.
- Nehmen Sie eine Larve und vorsichtig, aber fest drehen ihn auf den Rücken, über dem P1000 Spitze gebogen.
- Setzen Sie die Spitze der Spritze über den vorderen rechten proleg der Larven.
- Sanft, legen Sie die Spitze der Nadel in die proleg, um sicherzustellen, dass es innerhalb der Larven ist, und gleichmäßig zu injizieren alle der Spritzeninhalt.
Hinweis: Wenn die Spritze richtig eingelegt ist, sollte es möglich sein, holen die Larven nur mit der Spritze, um es in die Kammer zu stellen.- Nach der Injektion beobachten, die Larven für einige Sekunden. Die Larven beginnen, nach ein paar Sekunden kriechen sollte aber Flüssigkeit nicht ausscheiden.
- Kurz beobachten die Larven ein paar Stunden nach der Infektion, Infektion mit 10 7 CFU L. pneumophila 130b keine Symptome innerhalb der ersten 5-8 h pi verursachen Deshalb, wenn Larven wenden grau / schwarz vor diesem Punkt, ter Experiment sollte abgebrochen werden.
Hinweis: Inokulation von Larven mit 1 mM IPTG nicht über den Verlauf des Experiments beeinflussen Larven Lebensfähigkeit. - In der gleichen Weise, injizieren insgesamt 10 Larven pro Zustand einschließlich 10 Larven mit D-PBS injiziert, um als Kontrolle zu analysieren Larvensterblichkeit zu dienen.
- Tape-Petrischalen verschlossen und in Auffang.
- Inkubieren in einem bakteriellen Standard-Inkubator bei 37 ° C, für die Dauer des Experiments.
4. Vorbehandlung der Larven mit einem chemischen Inhibitor
- Vor der Infektion, bereiten Larven zur Injektion, wie in Abschnitt 3.1-3.6 beschrieben.
- Injizieren 10 &mgr; l einer 100 &mgr; M Lösung von Cytochalasin D in die vordere, linke proleg von 10 Larven.
Hinweis: Inhibitor in einer anderen proleg von Bakteriensuspension injiziert, um eine Verletzung der Larven zu reduzieren. - Spritzen Sie 10 ul DMSO in 10 Larven als Kontrolle.
- Inkubation bei Larven37 ° C für 4 Stunden.
- Inject vorbehandelt Larven wie in Abschnitt 3 beschrieben in den vorderen rechten Proleg entweder mit 1 x 10 7 CFU von WT L. pneumophila oder eine PBS-Kontrolle.
5. Analyse der Sterblichkeit der Larven
- Bei 18 Stunden nach der Infektion (pi), untersuchen alle infizierten Larven für die Mortalität.
- Um die Sterblichkeit zu überprüfen, benutzt stumpfer Spitze Pinzette drehen Sie den Larven und suchen für die Bewegung der Beine, sollten gesunde Larven sich schnell aufzurichten. Pigmentierung zeigt eine starke Immunreaktion auf eine Infektion. Wenn es eine Bewegung, zählen als lebendig.
- Rekordzahl von toten und lebenden Larven.
- Wiederholen Sie diesen Vorgang bei allen anderen Zeitpunkten gewählt.
Hinweis: Wenn die Inkubation für mehr als drei Tage lang fortgesetzt, Puppen kann gesehen werden. Entfernen Sie alle Puppen und einschläfern durch Einfrieren bei - 20 ° C vor der Metamorphose stattfinden kann.
6. Extraktion von Hämolymphe
- Zufällig wählen Sie dreiLarven und in einen 14-ml-Röhrchen zu ausgewählten Zeitpunkten wie 5 und 18 Stunden pi,
- Stellen Sie das Röhrchen auf Eis für 5-10 min, bis keine Bewegung der Beine der Larven beobachtet werden.
- Legen Sie die betäubt Larven auf einer Petrischale, und mit einem Skalpell, einen Einschnitt zwischen zwei Segmenten in der Nähe der Schwanz der Larven.
- Drücken Sie die Larven in ein steriles 1,5 ml-Zentrifugenröhrchen, die Hämolymphe zu sammeln.
- Pool Hämolymphe aus mindestens drei Personen. Eine Larven gibt zwischen 15-50 ul Hämolymphe je nach Größe.
Anmerkung: Während der Hämolymphe Extraktion ist es sehr einfach, den Darm zu stören, was zu einer potentiellen Kontamination der Proben. Kontamination zu reduzieren, indem die Larven in der Nähe der Schwanz (vom Darm) wird jedoch Antibiotikaselektion immer erforderlich, wenn das Ausplattieren der Bakterien.
Hinweis: Um die Hämolymphe von Bräunung und Koagulieren, Prozess die Hämolymphe innerhalb von 10 Minuten nach der Entnahme zu verhindern.
- Pool Hämolymphe aus mindestens drei Personen. Eine Larven gibt zwischen 15-50 ul Hämolymphe je nach Größe.
- Entsorgen Sie den Larvenkörper in eine neue 14 ml Falcon-Röhrchen, Dichtung und Ort bei - 20 ° C über Nacht, um sicherzustellen, die Larven tot sind.
- Autoklav toten Larven und entsorgen nach den örtlichen Vorschriften.
7. Bestimmung der Lebensfähigkeit Hemocyte
- Extrahieren Hämolymphe wie oben beschrieben.
- Mischungs 20 ul extrahiert Hämolymphe mit 20 ul 0,02% (v / v) Trypanblau in PBS in einer Vertiefung einer 96-Well-Platte.
- Inkubation für 5 min bei RT.
- Last 10 ul Hämolymphe auf eine Hämozytometers und zählen praktikable (nicht blau)-Zellen.
- Graf jede Probe in dreifacher Ausfertigung an Fehler zu reduzieren.
8. Die Verarbeitung der Heraus Hämozyten für Immunfluoreszenz-Mikroskopie
- Mischen Sie die gepoolten Hämolymphe aus mindestens drei Larven und Pipette auf einem 10-15 mm Deckglas in einer 24-Well-Platte extrahiert.
Hinweis: Die Deckgläser benötigen keine Behandlung, wie Blutzellen kann auf Glas haften. - 0,5 ml des D-PBS und gut mischen durch Pipettieren von oben und unten.
- Zentrifugieren der Platte 10 min bei 500 × g bei Raumtemperatur (RT) unter Verwendung eines Aerosoldichte Zentrifugenhalter.
- Untersuchen Sie jede Vertiefung mit einem inversen Mikroskop zu überprüfen, dass die Blutzellen haben, eingehalten werden.
- Entfernen Sie den Überstand und sorgfältig waschen Sie die Zellen dreimal durch Zugabe von 0,5 ml D-PBS auf die Wand des Bohrlochs, rockt die Platte 2-3x und Entfernen der D-PBS mit einer Pipette.
- Fixieren die Zellen durch Zugabe von 0,5 ml 4% (v / v) Paraformaldehyd (PFA) in PBS.
- Inkubieren der Zellen für 20-30 min bei RT.
- Mit D-PBS waschen die Zellen dreimal wie zuvor.
- 0,5 ml 15 mM NH 4 Cl in PBS Rest PFA löschen und Inkubation bei RT für 15 min.
- Mit D-PBS Waschen Sie die Zellen dreimal.
Anmerkung: In diesem Stadium können die Deckgläser über Nacht bei 4 ° C gelagert werden - 0,5 ml 0,1% Triton X-100 in PBS und Inkubation für 5 min bei RT, um Zellen zu permeabilisieren.
- Block 1 h mit Blockierlösung (2% (w / v) BSA in PBS).
- Inkubation für 1 h bei RT im Dunkeln mit dem primären Antikörper in Blockierungslösung zu der vom Hersteller angegebenen Verdünnung verdünnt.
- 3x Waschen mit PBS.
- Inkubation für 1 Stunde mit dem sekundären Antikörper und DAPI-Visualisierung von Bakterien, wie oben.
- 3x mit PBS waschen.
- Montieren Sie die Deckgläschen mit einem Tropfen Reagenz Montage auf Glasobjektträger.
- Inkubieren über Nacht im Dunkeln bei RT, um den Montagelösung vollständig trocknen.
- Bild gleitet auf einem Fluoreszenzmikroskop.
9. Die Quantifizierung der bakteriellen CFU
- In 100 ug / ml Spectinomycin Platten CyE Verunreinigungen durch Darmflora zu vermeiden. L. pneumophila Stamm 130b ist von Natur aus resistent gegen Spectinomycin 40.
- Vor der Hämolymphe Extraktion, wiegen 1,5-ml-Zentrifugenröhrchen.
- Auszug Hämolymphe, wie in Abschnitt 6 beschrieben und legen in t gewogenUBEs, fügen 1 ul von 5 mg / ml Digitonin, gut mischen und Inkubation für 5 min bei RT, um Blutzellen zu lysieren.
- Erneut wiegen, das Rohr mit Hämolymphe und bestimmen das Gewicht der Hämolymphe extrahiert.
- Führen zehnfache serielle Verdünnungen der Hämolymphe in sterilen AYE Medien.
- Mit einem Stift, teilen Sie die Basis eines CYE Platte in sechs gleich große Sektoren und Label.
- Platte drei Tropfen von 25 &mgr; l jeder Verdünnung (beginnend mit der verdünnten) in jedem Abschnitt der Platte.
- Die Platten mit den Deckel über Nacht bei 37 ° C inkubieren Upmost
- Sobald die Tropfen vollständig getrocknet, drehen Sie die Platte über und bei 37 ° C für mindestens weitere zwei Tage.
- Quantifizierung der Bakterien durch Zählen der Kolonien auf jeder Verdünnung entnommen und zu normalisieren, um dem Gewicht der Hämolymphe extrahiert.
10. Bestimmung der Competitive Index (CI)
- Bestätigen Sie, dass beide Stämme wachsen ebenso gut in Bouillonkultur und CYE-Agar-Platten Prior, um zu versuchen, die Wettbewerbsindex.
- Bereiten WT oder Kanamycin resistente Mutante Bakteriensuspensionen, wie in Kapitel 1 beschrieben und Mischung in einem Verhältnis von 1:1.
- Platte serielle Verdünnungen des Inokulums auf CYE Spectinomycin (100 ug / ml) und Spectinomycin CYE / Kanamycin
- Larven zu infizieren und zu extrahieren Hämolymphe zu geeigneten Zeitpunkten, wie oben beschrieben.
- Bestimmen Keimzahl durch Extraktion Hämolymphe und Beschichtung serielle Verdünnungen auf CYE Spectinomycin und CYE Spectinomycin / Kanamycin.
- Berechnen Sie die Wettbewerbsindex (CI), wie folgt: CI = (Mutante Ausgang / WT-Ausgabe) / (Mutante Inokulum / WZ-Impfstoff).
Ergebnisse
Hier wird gezeigt, dass G. mellon ist eine geeignete, einfach zu bedienen Modell zu studieren L. pneumophila-Infektion. Zuvor wurde gezeigt, dass L. pneumophila Virulenz in Makrophagen, Amöben und Säugetiermodelle abhängig von der Anwesenheit des Dot / Icm Sekretionssystem 41-43. G. mellon Larven wurden infiziert, wie oben beschrieben, und der Virulenz des Wildtyps (WT) und Dot / ICM-defizienten Stamm verglichen. Infektion mit 10 7 CFU von L. pneumophila Stamm 130b in Folge 100% Mortalität innerhalb von 24 Stunden nach der Infektion (pi). Jedoch die L. Δ DOTA pneumophila-Stamm, der nicht über eine funktionelle Dot / Icm T4SS Sekretionssystem war avirulent in diesem Test (Fig. 1). Dies zeigt, dass L. pneumophila Virulenz in G. mellon hängt von der Translokation von Dot / Icm Effektoren, so dass dieses Modell geeignet für die Charakterisierung vondie Funktion dieser Proteine.
Kürzlich wurde gezeigt, dass die Hemmung der Phagozytose durch Cytochalasin Behandlung die anfällig für die Infektion von Larven der Hefe Candida albicans 6. Als L. pneumophila ist ein intrazelluläres Pathogen, wurde beschlossen, festzustellen, ob die Aufnahme der Bakterien ist von entscheidender Bedeutung in der Pathogenese in diesem Modell. Larven wurden mit 10 &mgr; l 100 &mgr; M Cytochalasin D (CyD) für 4 h bei 37 ° C vorbehandelt, dann mit 10 7 CFU von WT L. infiziert pneumophila 130b und Mortalität bei 24 Stunden pi Behandlung mit dem Inhibitor allein überwacht hatte keinen Einfluss auf das Überleben der Larven. Jedoch angezeigt vorbehandelt, infizierten Larven signifikant höhere Überlebensrate (p = 0,0066, ungepaarter t-Test) im Vergleich zu DMSO-behandelten infizierten Insekten (Abbildung 2). Die Wirkung der Behandlung wurde durch CyD 48 h pi (Ergebnisse nicht gezeigt) aufgehoben, kann dies aufgrund der Halbwertszeit des Medikaments in G.mellon. Dies zeigt, dass die Aufnahme von L. pneumophila in G. mellonBlutZellen ist ein entscheidender Aspekt der bakteriellen Virulenz.
Um die Expression zu bestätigen und zu bestimmen, die subzelluläre Lokalisierung eines Effektor-Protein G. mellon, Blutzellen wurden gewonnen und für die Immunfluoreszenzmikroskopie weiterverarbeitet. Die Larven wurden mit WT-und Δ Dota L. pneumophila 130b ein Fragment des gut definierten T4SS Effektor, SidC 41-918, 4 N-terminalen HA-Tags fusioniert ausdrücken infiziert. Dieser Effektor wurde gezeigt, um die LCV über eine Phosphoinositid-4-phosphat-Bindungsdomäne 44 zu binden. Mit Anti-HA-(rot) und Anti-Legionellen-(grün) Antikörper, 4HA-SidC 41-918 an der LCV in infizierten Blutzellen lokalisiert (Abbildung 3). Diese Lokalisierung hat zuvor in der Amöben Dictyostelium discoideum und in Säuger Makrophagen 44,45 Bestätigung der c gezeigtomparability dieses Modells.
Die Bedeutung der Proteine für die Virulenz ist in der Regel durch den Vergleich der Wachstumskinetik von Wildtyp und Mutante Bakterien bestimmt. Um die bakterielle Replikation Kinetik über den Verlauf der Infektion zu verfolgen, wurden drei Larven zu jedem Zeitpunkt geopfert (0, 5, 18 und 24 Stunden pi), die Hämolymphe gesammelt und vereinigt und das CFU/0.1g extrahierter Hämolymphe bestimmt. Nach einer ersten Bad im 5 h pi, der CFU der WT Bakterien um bis zu 24 h pi jedoch die Δ Dota Belastung erfährt keine Replikation und ist bei 18 h pi (Abbildung 4) gelöscht.
Die Fähigkeit von L. pneumophila zur Lyse der Makrophagen in einer T4SS abhängig führen seit langem dokumentiert 46, jedoch keine ähnlichen Studien in vivo durchgeführt. Die Konzentration von zirkulierenden Blutzellen wurde bei 5, 18 bestimmt, und 24 Stunden pi Larven infiziert wurden mit WT oder Δ DotA L. pneumophila 130b, Blutzellen von infizierten Insekten und lebensfähigen Zellen unter Verwendung des Trypanblau-Ausschlussverfahren gezählt extrahiert. Bei 5 h pi keinen Unterschied in hemocyte Zählungen zwischen den Stämmen konnte (Fig. 5) ersichtlich. Doch bei 18 h pi gab es einen signifikanten Rückgang der hemocyte Konzentration in WT, aber nicht Δ Dota, infizierten Larven. Dieser Unterschied blieb nach 24 Stunden pi Der Abfall der Blutzellen-Nummer, verbunden mit der Anwesenheit von intrazellulären Bakterien, wie durch Immunfluoreszenz gesehen, legt nahe, dass L. pneumophila repliziert innerhalb von Blutzellen lysiert sie dann, so dass die Bakterien zu mehreren Replikationsrunden durchlaufen.
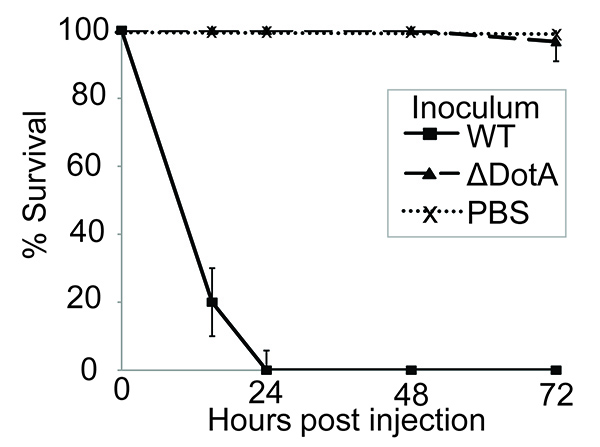
Fig. 1 ist. Infektion mit L. pneumophila induziert Dot / ICM-abhängigen Larvensterblichkeit. 10 Larven wurden mit PBS allein oder 10 infiziert 7 CFU von Wildtyp (WT) oder Δ Dota L. pneumophila 130b, bei 37 ° C für 72 h und zum Zeitpunkt des Todes der Larven aufgenommen inkubiert. Alle Larven mit dem WT infiziert erlag der Infektion innerhalb von 24 Stunden nach der Infektion (pi), jedoch keine Mortalität wurde in Larven mit PBS allein oder der Δ Dota Stamm beimpft gesehen. Die Ergebnisse sind der Mittelwert von drei getrennten Experimenten ± Standardabweichung.
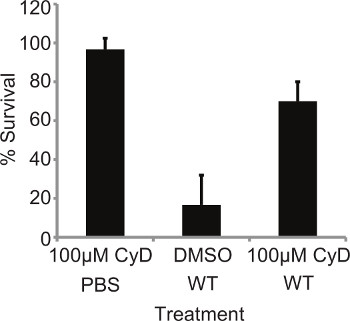
2. Die Sterblichkeit ist abhängig von bakteriellen Internalisierung. L. 10 pneumophila Larven wurden mit 10 ul 100 uM Cytochalasin D (CyD) für 4 h bei 37 ° C, dann mit 10 7 WT und Mortalität nach 24 Stunden pi Vorbereitete Larven infiziert überwacht vorbehandelt, zeigten eine signifikant (P = 0,0066, ungepaarter t-Test) vermindert Sterblichkeit. Die Ergebnisse stellen den mean von vier unabhängigen Experimenten ± Standardabweichungen mit 10 Larven pro Zustand.
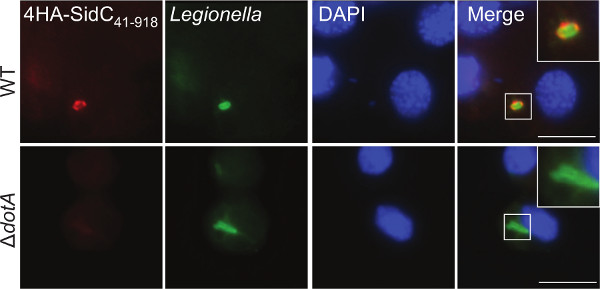
3. Immunfluoreszenz-Bildgebung der Effektor-Proteine in Blutzellen extrahiert. Hämozyten wurden von Larven, die mit L. infiziert extrahiert pneumophila 130b WT Δ oder Dota-exprimierenden 4HA SidC 41-918 bei 5 h pi wurden die Zellen mit anti-HA-(rot) und Anti-Legionellen-(grün) Antikörpern und DNA-Farbstoff DAPI (blau), um die Kerne zu visualisieren gefärbt. 4HA-SidC 41-918 beobachtet umliegenden WT, aber nicht Δ Dota, Bakterien. Maßstabsbalken 5 um.
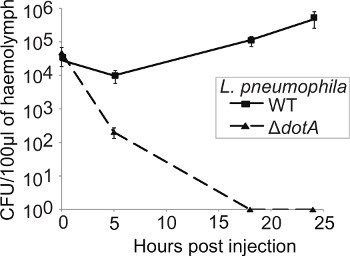
4. L. pneumophila repliziert in G. mellonella in einem Dot / ICM-abhängige Weise. Larven wurden mit WT oder Δ Dota L. pneumophila und bei 0, 5, 18 infiziert und 24 h pi die Hämolymphe von drei infizierten Insekten gesammelt, auf CYE-Platten und die CFU bestimmt und zu dem Inokulum und dem Gewicht der Hämolymphe extrahiert normalisiert. WT L. pneumophila repliziert im Laufe des Experiments, während das Δ DOTA Stamm wurde innerhalb von 18 h pi Ergebnisse gelöscht sind der Mittelwert von drei unabhängigen Experimenten ± Standardabweichung.
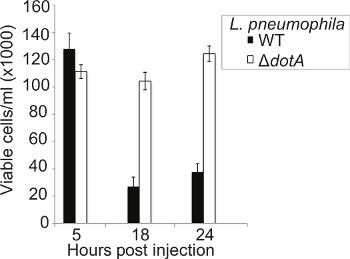
5. Infektion mit L. WT pneumophila führt zu erheblichen hemocyte Zerstörung. Hämozyten wurden bei 5, 18 extrahiert und 24 h pi aus Larven mit WT oder Δ Dota L. pneumophila und lebensfähigen Zellen mit einer Zählkammer gezählt infiziert. Kein Unterschied in derAnzahl der Zellen wurde mit 5 hr pi zwischen den Stämmen gesehen, jedoch bei 18 h pi nur etwa 15% der Blutzellen in Larven mit dem WT-Stamm infiziert, verglichen mit der Δ DOTA Stamm bleiben. Die Ergebnisse sind der Mittelwert von drei getrennten Experimenten ± Standardabweichung.
Diskussion
Die Galleria mellonLarven Modell für Legionella pneumophila-Infektion ist ein nützliches Werkzeug für die in-vivo-Studien der Pathogenese. Hier wird gezeigt, dass eine Anzahl von Aspekten der Makrophageninfektion in G. rekapitulieren mellon Modell, einschließlich der Rolle der Dot / Icm T4BSS in der Virulenz und bakterielle Replikation und der Lokalisation der Dot / ICM-Effektor SidC. Darüber hinaus zeigen wir, dass ein chemischer Inhibitor der Aktin-Polymerisation reduziert Larvensterblichkeit, imitiert ergibt macophages 47 erhalten, und Nachweisen, daß die Internalisierung von den Bakterien benötigt, um Larvensterblichkeit führen. Zuvor wurde gezeigt, daß die Variationen in der Virulenz von L. pneumophila-Stämme in anderen Infektionsmodellen gesehen in G. prüft werden mellon und die Induktion von Virulenzfaktoren in post-exponentiellen Wachstumsphase zur Behandlung von bakteriellen Virulenz erforderlich 36, bestätigt, dass G. mellon ist ein geeignetes Modell für L. pneumophila-Infektion.
Die Bestimmung der CFU von L. pneumophila infizierten Larven von entweder einzeln oder in Mischinfektionen, die Nützlichkeit des Modells erhöht. Zuvor mehreren Faktoren entdeckt worden, dass subtile Effekte auf bakterielle Replikation in einem oder mehreren Modellen von Infektion 29,48-51 haben. Obwohl die Larven nicht ein adaptives Immunsystem besitzen, die Anwesenheit der angeborenen Immunantwort bietet eine stärkere Auswahl im Vergleich zu Makrophagen allein, die dazu dienen können, subtile Phänotypen zu verstärken. Daher ist es möglich, dass, während diese Stämme werden wahrscheinlich nicht wesentlich Larvensterblichkeit auswirken, können sie zeigen, verminderte bakterielle Replikation oder Fitness in der G. mellon Modell. Neben der Replikation von L. pneumophila in den Larven haben wir bedeutende hemocyte Erschöpfung spät in der Infektion gezeigt. Als L.pneumophila wird erwartet, um Wirtszellen zu lysieren, am Ende seines Replikationszyklus, Messen hemocyte Verarmungs kann auch als eine indirekte Messung der bakteriellen Replikation dienen. Hemocyte Erschöpfung zuvor mit Insektensterblichkeit in 3,52 Infektion korreliert, auch wenn die letzten Ergebnisse deuten darauf hin, dass dieses Bild ist komplexer als erste belived 37. Kürzlich wurde gezeigt, dass Verhungern der Larven führt zu einer erhöhten Anfälligkeit für Infektionen durch eine Unterdrückung von Immunantworten 53. Bei den hier beschriebenen Tests wurden Larven nicht für die Dauer der Untersuchung zugeführt und es ist nicht bekannt, wie gut gefüttert Larven würde L. antworten pneumophila-Infektion.
Einer der Vorteile von G. mellon als Modellorganismus ist die einfache Extraktion und Quantifizierung von Blutzellen von infizierten Larven. Vorherige Videos wurden verschiedene Methoden zur Extraktion von Blutzellen von Insekten 54,55 jedoch gezeigt, die erfüllthod ist einfach und eignet sich für die sofortige Verarbeitung vorgestellt. Einmal extrahiert können Blutzellen leicht quantifiziert werden, Immunfluoreszenz, Transmissionselektronenmikroskopie 36 verwendet oder Durchflusszytometrie oder 56 kultiviert und ex vivo infiziert 3 ermöglicht die Reaktion der Zellen auf eine Infektion, im Detail untersucht werden. Dies erhöht die Flexibilität des Modells. Eine Einschränkung in G. Immunfluoreszenz mellon ist das begrenzte Angebot von Antikörpern gegen G. validiert mellon Proteinen. Studien haben jedoch die Schaffung von Antikörpern gegen Proteine Larven 57 und Antikörper gegen menschliche Immun verwandte Proteine nachgewiesen wurden gefunden, um G. erkennen mellon Proteine 11 zeigen das Potenzial für Immunfluoreszenz auf G. mellonBlutZellen.
Die Leichtigkeit der G. mellon Infektion ermöglicht eine schnelle, mittlere Durchsatz-Screening Das könnteverwendet, um die Virulenz von verschiedenen Legionella-Arten und Stämme zu vergleichen und könnte verwendet werden, um zuvor identifizierte Virulenzfaktoren wie Adhäsionsmoleküle 58 oder der Typ-2-Sekretionssystem 59, die für die Virulenz in anderen Modellen benötigt werden weiter analysieren. Darüber hinaus wird die Verwendung dieses Modells die Identifizierung und weiteren Charakterisierung neuer Virulenzfaktoren einschließlich sezerniert und transloziert Effektor-Proteine ermöglichen. Kürzlich wurde gefunden, dass die Phospholipase-C-Aktivität von L. gezeigten pneumophila hat eine Rolle in G. mellon Virulenz 60 und dass der Dot / Icm Effektorprotein SDHA ist für die Virulenz 37 erforderlich. Darüber hinaus haben wir kürzlich gezeigt, dass es eine Korrelation zwischen den in G. beobachteten Phänotypen mellon und im A / J-Mausstamm 37.
Dies unterstreicht den Wert dieses Werkzeug, um Umwelt Protozoen und einzelligen Wirt und muri ergänzenne Infektionsmodellen. Die G. mellon Modell wird in Zukunft noch wertvoller werden, sobald die Larven genomischen Sequenz verfügbar sein wird und mehr genetische Werkzeuge etabliert sind. Schritte in diese Richtung sind die jüngsten Publikation der Immun-Transkriptom-61 und die Bildung einer Initiative zur Gen-Silencing in Lepidoptera spp 62 voranzutreiben.
Durch die Verwendung von G. mellon Larven, haben wir eine Reihe von einfachen, schnellen Auslesen der bakteriellen Virulenz, die verwendet werden können, die Pathogenese von L. untersuchen pneumophila. Gründung dieser Assays und breiter Screening von L. pneumophila-Stämme und Serogruppen wird den Nutzen dieses neuen Werkzeugs erhöhen und zu unserem Verständnis von L. beitragen pneumophila Pathogenese.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
CR Harding wurde von der Wellcome Trust-Stipendium WT086724 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Material/ Equipment | |||
| ACES yeast extract (AYE) broth | 4 g ACES, 4 g yeast extract, 0.4 g α-ketoglutarate, pH 6.9, 400 ml H2O, autoclaved, 4 ml iron solution*, 4 ml cysteine solution* *add sterile ingredients after autoclaving | ||
| Charcoal buffered yeast extract (CYE) plates | As above, with the addition of 0.6 g activated charcoal and 6 g agar | ||
| Sterile iron solution (Ferric Pyrophosphate) | Sigma | P6526 | 0.6 mM solution, sterile filtered |
| Sterile cysteine solution | Sigma | C7880 | 3.3 mM solution, sterile filtered |
| G. mellonella (waxworms) | Livefood UK | W250 | |
| Anti-HA-Tetramethyl Rhodamine Isothiocyanate (TRITC) | Sigma | H9037 | |
| Anti-Legionella LPS | Cambridge Biosciences | PA1-7227 | |
| Anti-Rabbit IgG Alexa488 | Jackson Immunoreach | 711-485-152 | |
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Sigma | I6758 | |
| Dulbeccos phosphate buffered saline (D-PBS) | Sigma | D8662 | |
| Paraformaldehyde | Agar Scientific | R1026 | |
| Ammonium chloride (NH4Cl) | Sigma | A9434 | |
| Trypan Blue solution | Sigma | T8154 | |
| Digitonin | Sigma | D141 | |
| Cytochalasin D | Biomol International | BML-T109-0001 | |
| [header] | |||
| Material | |||
| Microtiter Syringe | Sigma | 24544 | |
| Cell counter, double, Improved Neubauer | VWR | 631-0926 | |
| Centrifuge | For centrifuging plates | ||
| Fluorescence microscope | Any microscope with appropriate filters for the required fluorophores | ||
| Inverted microscope | For viable cell counting | ||
| Puncture-proof glove | Turtleskin | ||
Referenzen
- Olsen, R. J., Watkins, M. E., Cantu, C. C., Beres, S. B., Musser, J. M. Virulence of serotype M3 Group A Streptococcus strains in wax worms (Galleria mellonella larvae. Virulence. 2, 111-119 (2011).
- Jander, G., Rahme, L. G., Ausubel, F. M. Positive correlation between virulence of Pseudomonas aeruginosa mutants in mice and insects. J. Bacteriol. 182, 3843-3845 (2000).
- Mukherjee, K., et al. Galleria mellonella as a model system for studying Listeria pathogenesis. Appl. Environ. Microbiol. 76, 310-317 (2010).
- Mowlds, P., Barron, A., Kavanagh, K. Physical stress primes the immune response of Galleria mellonella larvae to infection by Candida albicans. Microbes Infect. 10, 628-634 (2008).
- Renwick, J., Daly, P., Reeves, E. P., Kavanagh, K. Susceptibility of larvae of Galleria mellonella to infection by Aspergillus fumigatus is dependent upon stage of conidial germination. Mycopathologia. 161, 377-384 (2006).
- Banville, N., Fallon, J., McLoughlin, K., Kavanagh, K. Disruption of haemocyte function by exposure to cytochalasin b or nocodazole increases the susceptibility of Galleria mellonella larvae to infection. Microbes Infect. 13, 1191-1198 (2012).
- Mowlds, P., Kavanagh, K. Effect of pre-incubation temperature on susceptibility of Galleria mellonella larvae to infection by Candida albicans. Mycopathologia. 165, 5-12 (2008).
- Joyce, S. A., Gahan, C. G. Molecular pathogenesis of Listeria monocytogenes in the alternative model host Galleria mellonella. Microbiology. 156, 3456-3468 (2010).
- Mak, P., Zdybicka-Barabas, A., Cytrynska, M. A different repertoire of Galleria mellonella antimicrobial peptides in larvae challenged with bacteria and fungi. Dev. Comp. Immunol. 34, 1129-1136 (2010).
- Lavine, M. D., Strand, M. R. Insect hemocytes and their role in immunity. Insect Biochem. Mol. Biol. 32, 1295-1309 (2002).
- Bergin, D., Reeves, E. P., Renwick, J., Wientjes, F. B., Kavanagh, K. Superoxide production in Galleria mellonella hemocytes: identification of proteins homologous to the NADPH oxidase complex of human neutrophils. Infect. Immun. 73, 4161-4170 (2005).
- Ratcliffe, N. A., Gagen, S. J. Studies on the in vivo cellular reactions of insects: an ultrastructural analysis of nodule formation in Galleria mellonella. Tissue Cell. 9, 73-85 (1977).
- Fraser, D. W., et al. Legionnaires' disease: description of an epidemic of pneumonia. N. Engl. J. Med. 297, 1189-1197 (1977).
- Rowbotham, T. J. Preliminary report on the pathogenicity of Legionella pneumophila for freshwater and soil amoebae. J. Clin. Pathol. 33, 1179-1183 (1980).
- Fields, B. S. The molecular ecology of legionellae. Trends Microbiol. 4, 286-290 (1996).
- Berger, K. H., Isberg, R. R. Two distinct defects in intracellular growth complemented by a single genetic locus in Legionella pneumophila. Mol. Microbiol. 7, 7-19 (1993).
- Segal, G., Purcell, M., Shuman, H. A. Host cell killing and bacterial conjugation require overlapping sets of genes within a 22-kb region of the Legionella pneumophila genome. Proc. Natl. Acad. Sci. U.S.A. 95, 1669-1674 (1998).
- Vogel, J. P., Andrews, H. L., Wong, S. K., Isberg, R. R. Conjugative transfer by the virulence system of Legionella pneumophila. Science. 279, 873-876 (1998).
- Zhu, W., et al. Comprehensive identification of protein substrates of the Dot/Icm type IV transporter of Legionella pneumophila. PLoS One. 6, e17638 (2011).
- Burstein, D., et al. Genome-scale identification of Legionella pneumophila effectors using a machine learning approach. PLoS Pathog. 5, e1000508 (2009).
- Horwitz, M. A. The Legionnaires' disease bacterium (Legionella pneumophila) inhibits phagosome-lysosome fusion in human monocytes. J. Exp. Med. 158, 2108-2126 (1983).
- Swanson, M. S., Isberg, R. R. Association of Legionella pneumophila with the macrophage endoplasmic reticulum. Infect. Immun. 63, 3609-3620 (1995).
- Segal, G., Shuman, H. A. Legionella pneumophila utilizes the same genes to multiply within Acanthamoeba castellanii and human macrophages. Infect. Immun. 67, 2117-2124 (1999).
- Brieland, J., et al. Replicative Legionella pneumophila lung infection in intratracheally inoculated A/J mice. A murine model of human Legionnaires' disease. Am. J. Pathol. 145, 1537-1546 (1994).
- Baskerville, A., Fitzgeorge, R. B., Broster, M., Hambleton, P., Dennis, P. J. Experimental transmission of legionnaires' disease by exposure to aerosols of Legionella pneumophila. Lancet. 2, 1389-1390 (1981).
- Wright, E. K., et al. Naip5 affects host susceptibility to the intracellular pathogen Legionella pneumophila. Curr. Biol. 13, 27-36 (2003).
- Padilla-Carlin, D. J., McMurray, D. N., Hickey, A. J. The guinea pig as a model of infectious diseases. Comp. Med. 58, 324-340 (2008).
- Komura, T., Yasui, C., Miyamoto, H., Nishikawa, Y. Caenorhabditis elegans as an alternative model host for Legionella pneumophila, and protective effects of Bifidobacterium infantis. Appl. Environ. Microbiol. 76, 4105-4108 (2011).
- Kubori, T., Shinzawa, N., Kanuka, H., Nagai, H. Legionella metaeffector exploits host proteasome to temporally regulate cognate effector. PLoS Pathog. 6, e1001216 (2010).
- Abu Kwaik, Y. The phagosome containing Legionella pneumophila within the protozoan Hartmannella vermiformis is surrounded by the rough endoplasmic reticulum. Appl. Environ. Microbiol. 62, 2022-2028 (1996).
- Molmeret, M., Horn, M., Wagner, M., Santic, M., Abu Kwaik, Y. Amoebae as training grounds for intracellular bacterial pathogens. Appl. Environ. Microbiol. 71, 10-1128 (2005).
- Solomon, J. M., Rupper, A., Cardelli, J. A., Isberg, R. R. Intracellular growth of Legionella pneumophila in Dictyostelium discoideum, a system for genetic analysis of host-pathogen interactions. Infect. Immun. 68, 2939-2947 (2000).
- Hilbi, H., Weber, S. S., Ragaz, C., Nyfeler, Y., Urwyler, S. Environmental predators as models for bacterial pathogenesis. Environ. Microbiol. 9, 563-575 (2007).
- Khoa, D. B., Trang, L. T., Takeda, M. Expression analyses of caspase-1 and related activities in the midgut of Galleria mellonella during metamorphosis. Insect Mol Biol. 21, 247-256 (2012).
- Brassinga, A. K., et al. Caenorhabditis is a metazoan host for Legionella. Cell Microbiol. 12, 343-361 (2011).
- Harding, C. R., et al. Legionella pneumophila pathogenesis in the Galleria mellonella infection model. Infect. Immun. 80, 2780-2790 (2012).
- Harding, C. R., et al. The Dot/Icm effector SdhA is necessary for virulence of Legionella pneumophila in Galleria mellonella and A/J mice. Infect. Immun. 81, 10-1128 (2013).
- Byrne, B., Swanson, M. S. Expression of Legionella pneumophila virulence traits in response to growth conditions. Infect. Immun. 66, 3029-3034 (1998).
- Ramarao, N., Nielsen-Leroux, C., Lereclus, D. The insect Galleria mellonella as a Powerful Infection Model to Investigate Bacterial Pathogenesis. J. Vis. Exp. , e4392 (2012).
- Suter, T. M., Viswanathan, V. K., Cianciotto, N. P. Isolation of a gene encoding a novel spectinomycin phosphotransferase from Legionella pneumophila. Antimicrob. Agents Chemother. 41, 1385-1388 (1997).
- Hilbi, H., Segal, G., Shuman, H. A. Icm/dot-dependent upregulation of phagocytosis by Legionella pneumophila. Mol. Microbiol. 42, 603-617 (2001).
- Watarai, M., et al. Legionella pneumophila is internalized by a macropinocytotic uptake pathway controlled by the Dot/Icm system and the mouse Lgn1 locus. J. Exp. Med. 194, 1081-1096 (2001).
- Santic, M., Asare, R., Doric, M., Abu Kwaik, Y. Host-dependent trigger of caspases and apoptosis by Legionella pneumophila. Infect. Immun. 75, 2903-2913 (2007).
- Weber, S. S., Ragaz, C., Reus, K., Nyfeler, Y., Hilbi, H. Legionella pneumophila exploits PI(4)P to anchor secreted effector proteins to the replicative vacuole. PLoS Pathog. 2 (4), e46 (2006).
- Luo, Z. Q., Isberg, R. R. Multiple substrates of the Legionella pneumophila Dot/Icm system identified by interbacterial protein transfer. Proc. Natl. Acad. Sci. U.S.A. 101, 841-846 (2004).
- Alli, O. A., et al. Temporal pore formation-mediated egress from macrophages and alveolar epithelial cells by Legionella pneumophila. Infect. Immun. 68, 6431-6440 (2000).
- Elliott, J. A., Winn, W. C. Treatment of alveolar macrophages with cytochalasin D inhibits uptake and subsequent growth of Legionella pneumophila. Infect. Immun. 51, 31-36 (1986).
- Cirillo, S. L., Yan, L., Littman, M., Samrakandi, M. M., Cirillo, J. D. Role of the Legionella pneumophila rtxA gene in amoebae. Microbiology. 148, 1667-1677 (2002).
- Ridenour, D. A., Cirillo, S. L., Feng, S., Samrakandi, M. M., Cirillo, J. D. Identification of a gene that affects the efficiency of host cell infection by Legionella pneumophila in a temperature-dependent fashion. Infect. Immun. 71, 6256-6263 (2003).
- Samrakandi, M. M., Cirillo, S. L., Ridenour, D. A., Bermudez, L. E., Cirillo, J. D. Genetic and phenotypic differences between Legionella pneumophila strains. J. Clin. Microbiol. 40, 1352-1362 (2002).
- Lomma, M., et al. The Legionella pneumophila F-box protein Lpp2082 (AnkB) modulates ubiquitination of the host protein parvin B and promotes intracellular replication. Cell. Microbiol. , (2010).
- Champion, O. L., et al. Galleria mellonella as an alternative infection model for Yersinia pseudotuberculosis. Microbiology. 155, 1516-1522 (2009).
- Banville, N., Browne, N., Kavanagh, K. Effect of nutrient deprivation on the susceptibility of Galleria mellonella larvae to infection. Virulence. 3, 497-503 (2012).
- Qayum, A. A., Telang, A. A protocol for collecting and staining hemocytes from the yellow fever mosquito Aedes aegypti. J. Vis. Exp. , e2772 (2011).
- Stoepler, T. M., Castillo, J. C., Lill, J. T., Eleftherianos, I. A simple protocol for extracting hemocytes from wild caterpillars. J. Vis. Exp. , e4173 (2012).
- Garcia-Garcia, E., Garcia-Garcia, P. L., Rosales, C. An fMLP receptor is involved in activation of phagocytosis by hemocytes from specific insect species. Dev. Comp. Immunol. 33, 728-739 (2009).
- Bogus, M., Scheller, K. Allatotropin released by the brain controls larval molting in Galleria mellonella by affecting juvenile hormone synthesis. Int. J. Dev. Biol. 40, 205-210 (1996).
- Chang, B., Kura, F., Amemura-Maekawa, J., Koizumi, N., Watanabe, H. Identification of a novel adhesion molecule involved in the virulence of Legionella pneumophila. Infect. 73, 4272-4280 (2005).
- Cianciotto, N. P. Many substrates and functions of type II secretion: lessons learned from Legionella pneumophila. Future Microbiol. 4, 797-805 (2009).
- Aurass, P., et al. The Legionella pneumophila Dot/Icm-secreted effector PlcC/CegC1 together with PlcA and PlcB promotes virulence and belongs to a novel zinc metallophospholipase C family present in bacteria and fungi. J. Biol. Chem. , (2013).
- Vogel, H., Altincicek, B., Glockner, G., Vilcinskas, A. A comprehensive transcriptome and immune-gene repertoire of the lepidopteran model host Galleria mellonella. BMC Genomics. 12, 1471-2164 (2011).
- Terenius, O., et al. RNA interference in Lepidoptera: an overview of successful and unsuccessful studies and implications for experimental design. J. Insect. Physiol. 57, 231-245 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten