Method Article
Utilisation d'
Dans cet article
Résumé
La larve de la fausse teigne Galleria mellonella a récemment été créé comme un modèle in vivo pour étudier Legionella pneumophila infection. Ici, nous démontrons techniques fondamentales pour caractériser la pathogenèse de Legionella dans les larves, y compris l'inoculation, la mesure de la virulence bactérienne et la réplication ainsi que l'extraction et l'analyse des hémocytes infectés.
Résumé
Legionella pneumophila, l'agent causal d'une pneumonie sévère nommé la maladie du légionnaire, est un important agent pathogène humain qui infecte et se réplique dans les macrophages alvéolaires. Sa virulence dépend du système Dot / Icm de type IV de la sécrétion (T4SS), ce qui est essentiel pour établir une vacuole permissive de réplication connu sous le nom de Legionella contenant des vacuoles (LCV). L. infection pneumophila peut être modélisée chez la souris mais la plupart des souches de souris ne sont pas permissive, ce qui conduit à la recherche de nouveaux modèles d'infection. Nous avons récemment montré que les larves de la fausse teigne Galleria mellonella sont adaptés pour l'étude de L. infection d'pneumophila. G. mellonella est de plus en plus utilisé comme un modèle d'infection par des agents pathogènes humains et une bonne corrélation existe entre la virulence de plusieurs espèces bactériennes chez l'insecte et dans des modèles de mammifères. Un élément clé de défenses immunitaires, les larves sont hémocytes, professionphagocytes al, qui prennent et détruisent les envahisseurs. L. pneumophila est capable d'infecter, former un LCV et se répliquer dans ces cellules. Ici, nous démontrons protocoles d'analyse L. pneumophila dans la virulence G. modèle de mellonella, y compris la façon de cultiver L. infectieuse pneumophila, prétraiter les larves avec des inhibiteurs, infecter les larves et comment extraire les cellules infectées pour la quantification et la microscopie d'immunofluorescence. Nous décrivons également comment quantifier la réplication bactérienne et remise en forme dans les analyses de la concurrence. Ces approches permettent la sélection rapide de mutants pour déterminer des facteurs importants en L. pneumophila virulence, décrivant un nouvel outil pour aider notre compréhension de ce pathogène complexe.
Introduction
Des modèles animaux de l'infection sont avérés extrêmement précieux dans la détermination des facteurs de virulence bactérienne. Cependant, les modèles d'invertébrés ont gagné une attention accrue comme une alternative viable aux modèles traditionnels de mammifères de l'infection. Les larves de la fausse teigne Galleria mellonella est de plus en plus utilisé pour étudier un certain nombre d'agents pathogènes humains importants, y compris les bactéries Gram-positives et Gram-1 négatifs 2,3 et plusieurs champignons pathogènes 4,5. En utilisant un modèle d'insecte possède un certain nombre d'avantages par rapport aux modèles de mammifères traditionnelles, un invertébré, G. mellonella n'est pas soumis aux limitations éthiques de modèles de mammifères. En outre, les larves peuvent être facilement maintenue, infecté par injection sans anesthésie, subit un traitement préalable avec des inhibiteurs chimiques 6 et à maintenir l'incubation à 37 ° C 7. Fait intéressant, une bonne corrélation entre le pouvoir pathogène de plusieurs micro-organismes dans G. mellonella et modèles de mammifères de l'infection a été créé 2,8. La compréhension accrue du système immunitaire de G. mellonella a également contribué à la caractérisation de cet organisme modèle. Bien que les insectes n'ont pas un système immunitaire adaptative que l'on trouve chez les mammifères, ils ont les défenses cellulaires et humérus sophistiqués, y compris la production de peptides antimicrobiens 9. Hémocytes sont le principal médiateur de défenses cellulaires et sont les plus nombreux types de la cellule trouvée dans l'hémolymphe (ou de sang) de G. mellonella 10, Ces cellules sont des phagocytes professionnels et exercent des fonctions analogues à des macrophages et des neutrophiles humains à la fois prenant et bactéries dégradant dans un compartiment de phagocytose lysosomale 10,11 et formant des nodules autour de l'invasion des bactéries, limiter physiquement la réplication bactérienne 12.
Legionella pneumophila est un agent pathogène respiratoire qui entraîne pneumoni graveun (maladie du légionnaire) dans les populations sensibles comme les personnes âgées ou immunodéprimées 13. Legionella se trouve ubiquitaire dans les sources d'eau à la fois l'environnement et l'homme, où il est un agent pathogène de diverses espèces de frais amibes d'eau 14,15. Legionella survit et reproduit dans ces phagocytes professionnels en utilisant un complexe multi-protéique appelé Dot / Icm (défectueux dans le trafic des organites de multiplication / intracellulaire) de type 4 système de sécrétion (T4SS) permettant de transférer plus de 275 protéines effectrices dans la cellule hôte 16-20. Ces protéines servent à contourner les voies phagocytaires de la cellule hôte normales, conduisant à la création de la Legionella contenant des vacuoles (LCV). Le LCV évite la fusion avec les lysosomes et recrute réticulum endoplasmique place (ER) des vésicules dérivées, résultant dans un compartiment spécialisé qui ressemble le RE rugueux 21,22. L. pneumophila est considéré comme un chemin humaine accidentelledu fibrinogène; les mêmes stratégies qui lui permettent de se répliquer au sein des amibes, permettent également la réplication dans les macrophages alvéolaires humains 23.
Hôtes mammifères ont été caractérisés comme des modèles d'infection humaine Legionella y compris les souris et les cobayes 24,25. Cependant, la majorité des souches de souris résistantes à l'infection à Legionella 26 à l'exception de l'albinos consanguine souris A / J, qui développe une auto-limitation de l'infection bénigne 24. Bien que le modèle Guinée de porc ressemble davantage à la maladie humaine 25, le manque de mutants et augmentation des coûts décourage leur utilisation 27. En outre, plusieurs modèles d'invertébrés ont été développés pour Legionella pneumophila infection y compris Caenorhabditis elegans 28, Drosophila melanogaster 29 et plusieurs espèces d'amibes 30-32. Cependant, ces modèles ont des faiblesses, de la virulence de la C. elegans Système n'est pas Dot / Icm-dépendante 28, ce qui limite l'utilité de ce modèle. Le modèle drosophile a prouvé son efficacité dans l'étude des facteurs de virulence bactérienne 29 et semble prometteuse cependant, ce modèle n'a pas été pleinement caractérisé. Amibes unicellulaires sont les hôtes de l'environnement de L. pneumophila et sont idéales pour l'étude de l'action de facteurs de virulence au niveau moléculaire 33 manquent cependant plusieurs médiateurs importants de la réponse de la cellule hôte de mammifère à une infection telle que caspases 34. Les faiblesses des modèles existants, ainsi que le coût élevé et les préoccupations éthiques liées à l'expérimentation de mammifère, a conduit à la recherche d'autres organismes modèles appropriés 29,35.
Nous avons récemment démontré que G. mellonella est un modèle adapté à L. pneumophila pathogenèse 36,37. Ce protocole détaille les techniques expérimentales utilisées pour infectertion G. larves de mellonella, analyse morale larvaire, l'extraction hémocytes pour le comptage et l'immunofluorescence et la détermination de la réplication par UFC viable compte de larves infectées.
Protocole
Une. Préparation de L. pneumophila de l'infection
- Préparer le charbon de bois extrait de levure (CYE) des plaques (charbon de bois à 2 g / L actif, 10 g / L d'extrait de levure, 13 g / L d'agar-agar, 10 g / l de N-(2-acétamido)-2-aminothanesulfonic acide (ACES), une g / L α-cétoglutarate, 0,4 g / L de L-cystéine HCl et 0,25 g / l de pyrophosphate ferrique, pH 6,9).
Remarque: Si nécessaire, ajouter de la kanamycine (25 pg / ml) et / ou le chloramphenicol (6 pg / ml) à Cye plaques.- Effectuer tous L. travail pneumophila au niveau de confinement 2 biosécurité (BSL-2) dans une enceinte de sécurité microbiologique (MSC) dans le respect des règles locales.
- Série L. pneumophila partir de -80 ° C stocks de glycerol sur des plaques de CYE
- Incuber les plaques pendant 4 jours à 37 ° C.
Note: L'incubation des plaques pendant 4 jours augmente considérablement la virulence de L. pneumophila dans G. mellonella sur incubation pendant 3 jours. - Un jour avant l'infection, remettre en suspension un fu de bouclell de bactéries (contenant plusieurs colonies) dans 1 ml d'préchauffé (37 ° C) ACES extrait de levure (AYE) de bouillon et de mesurer l'absorbance à 600 nm (DO 600) à l'aide d'un spectrophotomètre.
- Inoculer une culture 3 ml de AYE frais (avec des antibiotiques si nécessaire) à une DO finale 600 de 0,1.
- Inclure une des médias seulement contrôler pour garantir la stérilité des médias.
- Incuber à 37 ° C dans un incubateur à agitation par secousses à 200 tours par minute pendant 21 heures.
Remarque: Les bactéries sont cultivées à la phase post-exponentielle de l'infection 38. De plus en plus pendant 21 heures permet expériences pour être normalisés.
Remarque: Si nécessaire pour induction de protéines, ajouter 0,5 mM isopropyle β-D-1-thiogalactopyranoside (IPTG) durant la nuit. - Mesurer la DO 600 (bactéries doivent être en phase de croissance post-exponentielle, OD 600 2,5-3).
- Diluer la culture bactérienne pour donner 1 x 10 9 CFU / ml dans une solution saline tamponnée au phosphate de Dulbecco stérile (D-PBS).
Remarque: Sur la base des résultats antérieurs, une DO 600 de 1 correspond à 1 x 10 9 UFC / ml, mais cela doit être confirmé pour différentes L. souches pneumophila.
Remarque: si l'induction d'une protéine à partir d'un plasmide est nécessaire, ajouter de l'IPTG 1 mM pour l'inoculum. - Plaque de l'inoculum comme décrit dans l'article 9 comme un contrôle pour assurer la CFU attendu est présent dans l'inoculum.
2. Préparation des larves
- Achetez suffisante G. mellonella larves d'un fournisseur commercial. Les larves sont expédiés à l'étape 5 e ou 6 e stade (environ entre 2-3 cm de longueur) et sont adaptés à l'utilisation immédiatement.
Note: Une méthode décrivant comment à l'arrière larves a été décrit précédemment 39.
Remarque: Les larves peuvent être entreposés à la température ambiante pendant jusqu'à deux semaines, ce qui ne nécessite pas l'alimentation. Jeter immédiatement les larves montrant des signes de la nymphose. - Préparer le contenant pour larve par plaction d'un cercle de 10 cm de papier-filtre dans le fond d'une boîte de Petri de 10 cm.
- En utilisant des pinces à bout émoussé, placer dix larves saines de taille à peu près similaire dans la boîte de Pétri.
Remarque: Jeter les insectes de couleur brune ou couperosées recherche malsaines. Larves saines sont uniformément de couleur crème avec des pas de zones de coloration foncée et sont capables de se redresser rapidement si remis.
3. Infection de G. mellonella larves
- Préparer la plate-forme d'injection en collant un cercle de papier filtre sur la surface.
- Fixez solidement la pointe d'un P1000 horizontalement sur le papier filtre pour créer une plate-forme d'injection. Cela n'a pas besoin d'être stérile.
- Stériliser une seringue microtitration de 20 ul en aspirant 70% d'éthanol et en incubant pendant au moins 10 min.
- Porter ponction preuve gants lors de l'injection,
- Retirez tout éthanol résiduel par aspiration et l'expulsion de l'eau stérile à plusieurs reprises.
- Using la seringue, aspirer 10 pi du L. pneumophila 1 x 10 9 UFC / ml suspension.
- Prenez une larve et doucement mais fermement tourner sur le dos, penché sur la pointe de la P1000.
- Placer l'embout de la seringue sur le devant, fausse-patte droite de la larve.
- Doucement, insérez la pointe de l'aiguille dans la fausse-patte, en s'assurant qu'il est à l'intérieur des larves, et en douceur injecter la totalité du contenu de la seringue.
Remarque: Si la seringue est insérée correctement, il devrait être possible de ramasser les larves en utilisant uniquement la seringue pour le placer dans la chambre.- Après l'injection, observer les larves pendant quelques secondes. Les larves se met à ramper au bout de quelques secondes, mais ne devrait pas excréter fluide.
- Observer brièvement les larves de quelques heures après l'infection, l'infection de 10 7 UFC L. pneumophila 130b ne provoque pas de symptômes dans le premier 5-8 h pi Par conséquent, si les larves sont en train de gris / noir avant ce point, til l'expérience doit être interrompu.
Remarque: L'inoculation de larves avec 1 mM d'IPTG n'affecte pas la viabilité des larves au cours de l'expérience. - De la même façon, injecter un total de 10 larves par 10 larves état comprenant une injection de D-PBS pour servir de contrôle pour analyser la mortalité des larves.
- Bande des boîtes de Pétri fermées et placer dans un confinement secondaire.
- Incuber dans un incubateur bactérien standard à 37 ° C, pendant toute la durée de l'expérience.
4. Le prétraitement des larves avec un inhibiteur chimique
- Avant l'infection, préparer les larves pour injection comme décrit dans la section 3.1 à 3.6.
- Injecter 10 ul d'une solution 100 uM de cytochalasine D à l'avant, fausse-patte de 10 larves poste.
Remarque: Inhibiteur est injecté dans une fausse-patte différente de la suspension bactérienne pour réduire les blessures aux larves. - Injecter 10 ul de DMSO à 10 larves de témoin.
- Incuber larves à37 ° C pendant 4 heures.
- Injecter larves prétraité comme décrit dans l'article 3 à l'avant, à droite Proleg avec soit 1 x 10 7 UFC de WT L. pneumophila ou un contrôle PBS.
5. Analyse de la mortalité des larves
- À 18 h post infection (pi), d'examiner toutes les larves infectées de la mortalité.
- Pour vérifier la mortalité, utiliser des pinces à bout émoussé de remettre les larves et regarder pour le mouvement des jambes, les larves saines devrait se redresser rapidement. Pigmentation indique une réaction immunitaire à l'infection. S'il ya un mouvement, compter aussi vivant.
- Un nombre record de larves mortes et vivantes.
- Répétez ce processus à tous les autres points de temps choisis.
Remarque: Si l'incubation est poursuivie pendant plus de trois jours, les nymphes peut être vu. Retirez tout pupes et euthanasier par congélation à - 20 ° C, avant la métamorphose peut se produire.
6. Extraction de l'hémolymphe
- Choisir au hasard troisles larves et les placer dans un tube de 14 ml à des moments choisis, tels que 5 et 18 heures pi,
- Placer ce tube sur de la glace pendant 5 à 10 min, jusqu'à ce que aucun mouvement des jambes de la larve peut être observée.
- Placer les larves anesthésiés sur une boîte de Petri et, à l'aide d'un scalpel, une incision entre les deux segments proches de la queue de la larve.
- Pressez les larves dans un tube de 1,5 ml centrifugeuse stérile pour recueillir l'hémolymphe.
- Piscine hémolymphe d'au moins trois personnes. Un larves donne entre 15-50 ul d'hémolymphe selon la taille.
Remarque: Au cours de l'extraction de l'hémolymphe il est très facile de perturber l'intestin, entraînant une contamination des échantillons. Réduire la contamination en réduisant les larves près de la queue (loin de l'intestin), cependant, le choix des antibiotiques sera toujours nécessaire lorsque l'étalement de la bactérie.
Remarque: Pour éviter l'hémolymphe de brunir et de coagulation, processus dans l'hémolymphe 10 min après la collecte.
- Piscine hémolymphe d'au moins trois personnes. Un larves donne entre 15-50 ul d'hémolymphe selon la taille.
- Jeter le corps de la larve dans un nouveau 14 ml tube Falcon, joint et au lieu de - 20 ° C pendant la nuit pour assurer les larves sont morts.
- Autoclave larves mortes et éliminer conformément aux réglementations locales.
7. Détermination de la viabilité hémocytaire
- Extraire hémolymphe comme décrit ci-dessus.
- Mélanger 20 ul d'hémolymphe a extrait avec 20 ul de 0,02% (v / v) de bleu trypan dans du PBS dans un puits d'une plaque à 96 puits.
- Incuber pendant 5 min à température ambiante.
- Charge de 10 ul d'hémolymphe sur un hémocytomètre et compter les cellules viables (pas bleu).
- Comptez chaque échantillon en trois exemplaires pour réduire les erreurs.
8. Traitement des Extrait hémocytes pour immunofluorescence Microscopie
- Mélanger l'hémolymphe mis en commun extraite à partir d'au moins trois des larves et la pipette sur une lamelle de verre de 10 à 15 mm dans une plaque à 24 puits.
Remarque: Lamelles de ne nécessitent pas de traitement comme hémocytes peut adhérer au verre. - Ajouter 0,5 ml de D-PBS et bien mélanger par aspiration et refoulement.
- Centrifuger la plaque pendant 10 min à 500 x g à la température ambiante (RT) en utilisant un support de plaque de la centrifugeuse étanche aux aérosols.
- Examiner chaque puits en utilisant un microscope inversé à vérifier que les hémocytes ont adhéré.
- Retirer soigneusement le surnageant et laver les cellules trois fois en ajoutant 0,5 ml de D-PBS à la paroi du puits, en faisant tourner la plaque 2 à 3 fois et à éliminer le D-PBS avec une pipette.
- Fixer les cellules par addition de 0,5 ml de 4% (v / v) de paraformaldehyde (PFA) dans du PBS.
- Incuber les cellules pendant entre 20 à 30 min à température ambiante.
- Laver les cellules trois fois avec du D-PBS, comme précédemment.
- Ajouter 0,5 ml de 15 mM de NH 4 Cl dans une solution PBS pour étancher PFA résiduel et incuber à température ambiante pendant 15 min.
- Laver les cellules trois fois avec du D-PBS.
Remarque: A ce stade, les lamelles peuvent être stockées pendant une nuit à 4 ° C. - Ajouter 0,5 ml de 0,1% de Triton X-100 dans du PBS et incuber pendant 5 minutes à température ambiante pour perméabiliser les cellules.
- Bloc pendant 1 heure avec une solution de blocage (2% (p / v) de BSA dans du PBS).
- Incuber pendant 1 heure à température ambiante dans l'obscurité avec l'anticorps primaire dilué dans la solution de blocage à la dilution indiquée par le fabricant.
- Laver 3 fois avec PBS.
- Incuber pendant 1 heure avec l'anticorps secondaire et du DAPI pour la visualisation des bactéries comme ci-dessus.
- Laver 3 fois avec PBS.
- Monter les lamelles à l'aide d'une goutte de réactif de montage sur des lames de verre.
- Incuber une nuit dans l'obscurité à la température ambiante pour sécher complètement la solution de montage.
- Image en coulisse sur un microscope à fluorescence.
9. Quantification des bactéries UFC
- Ajouter 100 ug / ml de spectinomycine pour Cye plaques pour éviter la contamination par la flore intestinale. L. souche pneumophila 130b est naturellement résistant à la spectinomycine 40.
- Avant l'extraction de l'hémolymphe, peser 1,5 ml tubes de centrifugation.
- Extrait hémolymphe comme décrit dans l'article 6 et placer dans un t peséubes, ajouter 1 pl de 5 mg / ml digitonine, bien mélanger et incuber pendant 5 min à température ambiante pour lyser hémocytes.
- Peser à nouveau le tube avec l'hémolymphe et déterminer le poids de l'hémolymphe extrait.
- Effectuer dix dilutions en série de pliage de l'hémolymphe dans les médias de AYE stérile.
- L'utilisation d'un stylo, diviser la base d'une plaque de CYE en six secteurs et étiquette égales.
- Plate trois gouttes de 25 ul de chaque dilution (en commençant par la plus diluée) dans chaque section de la plaque.
- Incuber les plaques avec les couvercles UPMOST nuit à 37 ° C.
- Une fois que les gouttes ont séché complètement, tournez la plaque sur et incuber à 37 ° C pendant au moins deux jours supplémentaires.
- Quantifier les bactéries extraites par comptage des colonies à chaque dilution et pour normaliser au poids de l'hémolymphe extrait.
10. Détermination de l'indice de compétition (IC)
- Vérifiez que les deux souches se développent aussi bien dans le bouillon de culture et sur des plaques d'agar CYE prior de tenter l'indice de compétitivité.
- Préparer des suspensions bactériennes mutantes résistantes WT ou kanamycine comme décrit dans la section 1 et mélanger dans un rapport de 1:1.
- Plate dilutions en série de l'inoculum sur CYE spectinomycine (100 ug / ml) et CYE spectinomycine / kanamycine
- Infecter les larves et extrait hémolymphe à des points de temps appropriés tels que décrits ci-dessus.
- Déterminer les numérations viables par extraction hémolymphe et étalant des dilutions en série sur CYE spectinomycine et CYE spectinomycine / kanamycine.
- Calculer l'indice concurrentiel (CI) comme suit: CI = (sortie mutant sortie / WT) / (inoculum mutant / WT inoculum).
Résultats
Ici il est démontré que G. mellonella est une réponse appropriée, facile à utiliser modèle pour étudier L. infection d'pneumophila. Auparavant, il a été montré que L. virulence pneumophila dans les macrophages, les amibes et les modèles de mammifères est dépendante de la présence du système de sécrétion de Dot / Icm 41 à 43. G. larves de mellonella ont été infectées comme décrit ci-dessus et la virulence de la souche sauvage (WT) et une souche de point / Icm déficiente comparée. Infection à 10 7 UFC de L. souche pneumophila 130b entraîné une mortalité de 100% dans les 24 heures post-infection (pi). Cependant, le L. souche pneumophila Δ DotA, qui ne dispose pas d'un système fonctionnel de la sécrétion Dot / Icm T4SS, était virulent dans cet essai (Figure 1). Ceci démontre que L. pneumophila virulence dans G. mellonella dépend de la translocation des effecteurs Dot / Icm, faisant de ce modèle adapté pour la caractérisation desla fonction de ces protéines.
Récemment, il a été montré que l'inhibition de la phagocytose par traitement de la cytochalasine augmenté susceptibly des larves à l'infection par des levures Candida albicans 6. Comme L. pneumophila est un pathogène intracellulaire, il a été décidé de déterminer si l'absorption de la bactérie est crucial dans la pathogénie dans ce modèle. Les larves ont été prétraitée avec 10 ul de 100 uM de cytochalasine D (CyD) pendant 4 h à 37 ° C, puis infectées avec 10 7 CFU de L. WT pneumophila 130b et la mortalité suivie à 24 h pi traitement avec l'inhibiteur seul n'a pas d'incidence sur la survie des larves. Toutefois, préalablement traité, les larves infectées affiché survie significativement plus importante (p = 0,0066, test t non apparié) par rapport à du DMSO-traitée, les insectes infectés (Figure 2). L'effet du traitement a été abolie par CyD 48 h pi (résultats non présentés), ce qui peut être dû à la demi-vie du médicament dans G.mellonella. Ceci démontre que l'absorption de L. pneumophila dans G. mellonella hémocytes est un aspect crucial de la virulence bactérienne.
Afin de valider l'expression et de déterminer la localisation subcellulaire d'une protéine effectrice dans G. mellonella, hémocytes ont été extraites et traitées pour la microscopie d'immunofluorescence. Les larves ont été infectées par le WT et Δ Dota L. pneumophila 130b expression d'un fragment de l'effecteur T4SS bien définie, SIDC 41-918, fusionné à 4 étiquettes N-terminaux HA. Cette effecteur a été démontrée pour lier le LCV via un domaine phospho-4-phosphate liaison 44. Utilisant des anticorps anti-HA (rouge) et anti-légionelles (vert) anticorps, 4HA-SIDC 41-918 localisée au LCV dans les hémocytes infectés (Figure 3). Cette localisation a été démontré précédemment dans la amibes Dictyostelium discoideum et dans les macrophages de mammifères 44,45 confirmant la comparability de ce modèle.
L'importance des protéines de virulence est généralement déterminée en comparant la cinétique de type sauvage et mutantes de bactéries croissance. Afin de suivre la cinétique de réplication bactérienne au cours de l'infection, trois larves ont été sacrifiés à chaque point de temps (0, 5, 18, et 24 h pi), l'hémolymphe recueilli et mis en commun et la CFU/0.1g d'hémolymphe extrait déterminé. Après une baisse initiale à 5 h pi, l'UFC des bactéries WT augmente jusqu'à 24 h pi Toutefois, la souche Δ Dota subit pas de réplication et est effacé à 18 h pi (Figure 4).
La capacité de L. pneumophila pour provoquer la lyse des macrophages de manière T4SS dépendant depuis longtemps documenté 46, mais pas d'études similaires ont été réalisées in vivo. La concentration des hémocytes circulants a été déterminée à 5, 18, et 24 h pi larves ont été infectées par le WT ou Δ Dota L. pneumophila 130b, hémocytes extraits d'insectes infectées et les cellules viables comptées en utilisant la méthode d'exclusion au bleu trypan. À 5 h pi pas de différence de nombre de hémocytes entre les souches pourrait être considéré (Figure 5). Cependant, à 18 h pi il y avait une baisse significative de la concentration en hémocytes dans WT, mais pas Δ DOTA, larves infectées. Cette différence a persisté à 24 h pi La baisse du nombre d'hémocytes, combinée à la présence de bactéries intracellulaires comme on le voit par immunofluorescence, suggère que L. pneumophila réplique à l'intérieur hémocytes puis les lyse, permettant aux bactéries de se soumettre à plusieurs cycles de réplication.
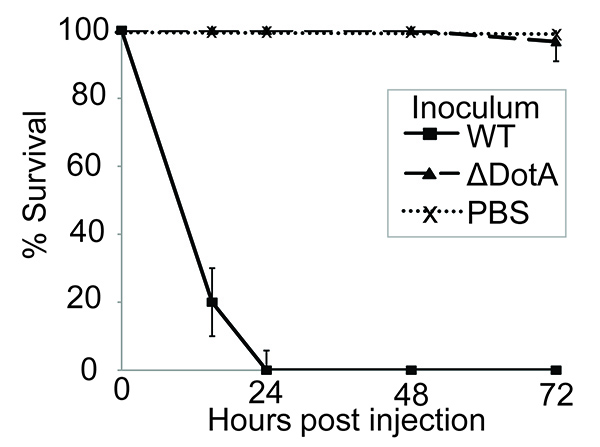
Figure 1. L'infection par L. pneumophila induit Dot / Icm dépendant mortalité larvaire. 10 larves ont été infectées avec du PBS seul ou 10 7 CFU de type sauvage (WT) ou Δ Dota L. pneumophila 130b, incubées à 37 ° C pendant 72 heures et l'heure de la mort des larves enregistrée. Toutes les larves infectées par le WT a succombé à l'infection dans les 24 heures post-infection (pi), mais pas de mortalité a été observée chez les larves inoculées avec du PBS seul ou la souche Δ DOTA. Les résultats sont la moyenne de trois expériences distinctes, ± écart-type.
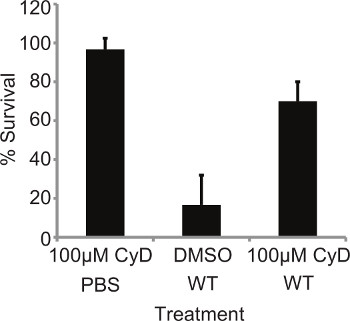
Figure 2. La mortalité dépend de l'internalisation bactérienne. 10 L. pneumophila larves ont été prétraités avec 10 pi de 100 uM cytochalasine D (CyD) pour 4 heures à 37 ° C alors infecté par 10 7 WT et la mortalité suivie à 24 h pi larves prétraité démontré de façon significative (P = 0,0066, test t apparié) réduit mortalité. Les résultats représentent la mean de quatre expériences indépendantes ± écarts-types avec 10 larves par état.
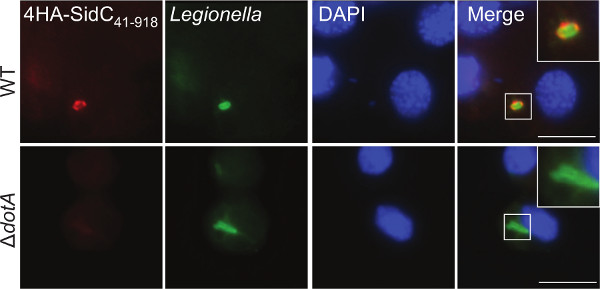
Figure 3. imagerie par immunofluorescence des protéines effectrices dans les hémocytes extraits. hémocytes ont été extraites à partir de larves infectées par L. pneumophila 130b WT ou Δ Dota exprimer 4HA-SIDC 41-918 à 5 h cellules pi ont été colorées en utilisant anti-HA (rouge) et anti-légionelles (vert) et DAPI anticorps tache d'ADN (bleu) pour visualiser les noyaux. 4HA-SIDC 41-918 a été observée WT environnante, mais pas Δ DOTA, les bactéries. La barre d'échelle 5 um.
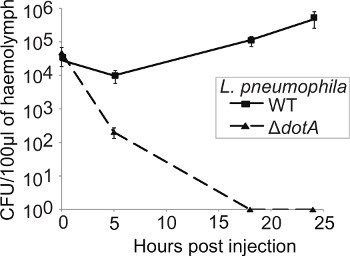
Figure 4. L. pneumophila reproduit dans G. mellonella manière Dot / Icm-dépendante. larves ont été infectés par pneumophila WT ou Δ Dota L. et à 0, 5, 18, et 24 h pi l'hémolymphe de trois insectes infectés communs, plaqué sur des plaques de CYE et la CFU déterminé et normalisée à l'inoculum et à la masse de l'hémolymphe extrait. WT L. pneumophila répliqué au cours de l'expérience alors que la souche Δ DotA a été autorisé dans les 18 h Résultats pi sont la moyenne de trois expériences distinctes ± écart-type.
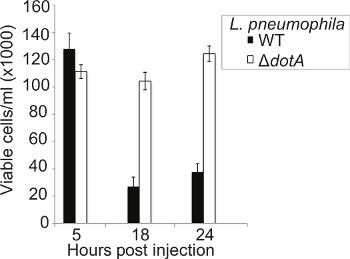
Figure 5. L'infection par le WT L. résultats pneumophila dans la destruction des hémocytes importante. hémocytes ont été extraites à 5, 18, et 24 h pi de larves infectées par pneumophila WT ou Δ Dota L. et cellules viables comptés en utilisant un hémocytomètre. Aucune différence dans l'nombre de cellules a été observée à 5 h pi entre les souches mais à 18 h pi seulement environ 15% des hémocytes rester chez les larves infectées par la souche WT par rapport à la souche Δ DOTA. Les résultats sont la moyenne de trois expériences distinctes, ± écart-type.
Discussion
Modèle larvaire La Galleria de Legionella pneumophila infection est un outil utile pour les études in vivo de la pathogenèse. Ici, il est indiqué qu'un certain nombre d'aspects de l'infection des macrophages peut être récapitulé dans le G. modèle de mellonella, y compris le rôle de la Dot / Icm T4BSS dans la virulence et la réplication bactérienne et la localisation de la Dot / Icm effecteur SIDC. De plus, nous démontrons que un inhibiteur chimique de polymérisation de l'actine réduit significativement la mortalité des larves, mimant les résultats obtenus dans macophages 47 et les preuves que l'internalisation des bactéries est nécessaire pour provoquer la mortalité des larves. Auparavant, il a été démontré que les variations de virulence entre L. souches pneumophila vu dans d'autres modèles d'infection peuvent être vérifiés dans G. mellonella et que l'induction de facteurs de virulence en phase de croissance post-exponentielle est requis pour la virulence bactérienne 36, ce qui confirme que G. mellonella est un modèle adapté à L. infection d'pneumophila.
La détermination de la CFU de L. pneumophila de larves infectées soit seuls, soit dans les infections mixtes accroît fortement l'utilité du modèle. Auparavant, plusieurs facteurs ont été découvertes qui ont des effets subtils sur la replication bactérienne dans un ou plusieurs modèles d'infection 29,48-51. Bien que les larves ne possèdent pas de système immunitaire adaptatif, la présence de la réponse immunitaire innée sélection fournit plus forte par rapport à eux seuls les macrophages, qui peuvent servir à amplifier les phénotypes subtiles. Par conséquent, il est possible que, bien que ces souches ne seront probablement pas affecter de manière significative la mortalité des larves, ils peuvent démontrer diminué réplication bactérienne ou remise en forme dans le G. modèle de mellonella. Ainsi que la réplication de L. pneumophila dans les larves, nous avons montré un appauvrissement important hémocytaire la fin de l'infection. Comme L.pneumophila est prévu pour lyser des cellules hôtes, à la fin de son cycle de replication, la mesure de l'épuisement hémocytes peuvent également servir de mesure indirecte de la replication bactérienne. Hémocyte épuisement a déjà été corrélée à la mortalité des insectes dans l'infection 3,52, bien que des résultats récents suggèrent que cette situation est plus complexe que la première belived 37. Récemment, il a été montré que la famine de larves entraîne une augmentation de la susceptibilité à l'infection par une suppression des réponses immunitaires 53. Dans les essais décrits ici, les larves n'ont pas été nourris pendant la durée de l'étude et on ne sait pas à quel point larves nourries répondrait à L. infection d'pneumophila.
L'un des avantages de G. mellonella en tant qu'organisme modèle est la facilité d'extraction et la quantification des hémocytes de larves infectées. Vidéos antérieures ont montré diverses méthodes pour extraire les hémocytes d'insectes 54,55 Cependant, le METhod présenté ici est simple et approprié pour un traitement immédiat. Une fois extrait, hémocytes peuvent être facilement quantifiés, utilisés pour l'immunofluorescence, microscopie électronique à transmission 36 ou 56 cytométrie de flux ou de culture et infectées ex vivo 3 permettant la réponse des cellules à l'infection à étudier en détail. Ceci augmente considérablement la souplesse du modèle. Une mise en garde à l'immunofluorescence dans G. mellonella est l'offre limitée d'anticorps validé contre G. protéines mellonella. Cependant, des études ont démontré la création d'anticorps contre les protéines larvaires 57 et des anticorps dirigés contre des protéines immunitaires liées humains ont été trouvés à reconnaître G. protéines mellonella 11 démontrant la possibilité d'immunofluorescence sur G. hémocytes de mellonella.
La facilité de G. infection mellonella permet écrans de débit rapide, moyenne qui pourraitêtre utilisé pour comparer la virulence de diverses espèces et souches de Legionella et pourrait être utilisé pour analyser en outre des facteurs de virulence identifiés précédemment telles que des molécules d'adhérence ou 58 le système de sécrétion de type 2 59 qui sont requis pour la virulence dans d'autres modèles. En outre, l'utilisation de ce modèle permet en outre l'identification et la caractérisation de nouveaux facteurs de virulence, y compris des protéines effectrices sécrétées et une translocation. Récemment, il a été montré que l'activité de la phospholipase C L. pneumophila a un rôle dans G. mellonella virulence 60 et que le point / Icm protéine effectrice SDHA est requis pour la virulence 37. En outre, nous avons récemment démontré qu'il existe une corrélation entre les phénotypes observés dans G. mellonella et dans la souche de souris A / J 37.
Cela souligne la valeur cet outil pour compléter protozoaire environnement et hôte unicellulaire et murimodèles d'infection de ne. Le G. modèle de mellonella deviendra encore plus précieux à l'avenir, une fois la séquence génomique larvaire sera disponible et des outils génétiques sont plus en place. Mesures dans ce sens comprennent la récente publication des détails du transcriptome lié au système immunitaire 61 et la formation d'une initiative visant à faire progresser l'inactivation de gène chez les Lépidoptères spp 62.
En utilisant G. larves de mellonella, nous avons un certain nombre de lectures simples et rapides de la virulence bactérienne qui peuvent être utilisés pour étudier la pathogenèse de L. pneumophila. Mise en place de ces tests et le dépistage plus large de L. souches pneumophila sérogroupe et d'accroître l'utilité de ce nouvel outil et contribueront à notre compréhension de L. pneumophila pathogenèse.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
CR Harding a été pris en charge par la bourse d'études WT086724 Wellcome Trust.
matériels
| Name | Company | Catalog Number | Comments |
| Material/ Equipment | |||
| ACES yeast extract (AYE) broth | 4 g ACES, 4 g yeast extract, 0.4 g α-ketoglutarate, pH 6.9, 400 ml H2O, autoclaved, 4 ml iron solution*, 4 ml cysteine solution* *add sterile ingredients after autoclaving | ||
| Charcoal buffered yeast extract (CYE) plates | As above, with the addition of 0.6 g activated charcoal and 6 g agar | ||
| Sterile iron solution (Ferric Pyrophosphate) | Sigma | P6526 | 0.6 mM solution, sterile filtered |
| Sterile cysteine solution | Sigma | C7880 | 3.3 mM solution, sterile filtered |
| G. mellonella (waxworms) | Livefood UK | W250 | |
| Anti-HA-Tetramethyl Rhodamine Isothiocyanate (TRITC) | Sigma | H9037 | |
| Anti-Legionella LPS | Cambridge Biosciences | PA1-7227 | |
| Anti-Rabbit IgG Alexa488 | Jackson Immunoreach | 711-485-152 | |
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Sigma | I6758 | |
| Dulbeccos phosphate buffered saline (D-PBS) | Sigma | D8662 | |
| Paraformaldehyde | Agar Scientific | R1026 | |
| Ammonium chloride (NH4Cl) | Sigma | A9434 | |
| Trypan Blue solution | Sigma | T8154 | |
| Digitonin | Sigma | D141 | |
| Cytochalasin D | Biomol International | BML-T109-0001 | |
| [header] | |||
| Material | |||
| Microtiter Syringe | Sigma | 24544 | |
| Cell counter, double, Improved Neubauer | VWR | 631-0926 | |
| Centrifuge | For centrifuging plates | ||
| Fluorescence microscope | Any microscope with appropriate filters for the required fluorophores | ||
| Inverted microscope | For viable cell counting | ||
| Puncture-proof glove | Turtleskin | ||
Références
- Olsen, R. J., Watkins, M. E., Cantu, C. C., Beres, S. B., Musser, J. M. Virulence of serotype M3 Group A Streptococcus strains in wax worms (Galleria mellonella larvae. Virulence. 2, 111-119 (2011).
- Jander, G., Rahme, L. G., Ausubel, F. M. Positive correlation between virulence of Pseudomonas aeruginosa mutants in mice and insects. J. Bacteriol. 182, 3843-3845 (2000).
- Mukherjee, K., et al. Galleria mellonella as a model system for studying Listeria pathogenesis. Appl. Environ. Microbiol. 76, 310-317 (2010).
- Mowlds, P., Barron, A., Kavanagh, K. Physical stress primes the immune response of Galleria mellonella larvae to infection by Candida albicans. Microbes Infect. 10, 628-634 (2008).
- Renwick, J., Daly, P., Reeves, E. P., Kavanagh, K. Susceptibility of larvae of Galleria mellonella to infection by Aspergillus fumigatus is dependent upon stage of conidial germination. Mycopathologia. 161, 377-384 (2006).
- Banville, N., Fallon, J., McLoughlin, K., Kavanagh, K. Disruption of haemocyte function by exposure to cytochalasin b or nocodazole increases the susceptibility of Galleria mellonella larvae to infection. Microbes Infect. 13, 1191-1198 (2012).
- Mowlds, P., Kavanagh, K. Effect of pre-incubation temperature on susceptibility of Galleria mellonella larvae to infection by Candida albicans. Mycopathologia. 165, 5-12 (2008).
- Joyce, S. A., Gahan, C. G. Molecular pathogenesis of Listeria monocytogenes in the alternative model host Galleria mellonella. Microbiology. 156, 3456-3468 (2010).
- Mak, P., Zdybicka-Barabas, A., Cytrynska, M. A different repertoire of Galleria mellonella antimicrobial peptides in larvae challenged with bacteria and fungi. Dev. Comp. Immunol. 34, 1129-1136 (2010).
- Lavine, M. D., Strand, M. R. Insect hemocytes and their role in immunity. Insect Biochem. Mol. Biol. 32, 1295-1309 (2002).
- Bergin, D., Reeves, E. P., Renwick, J., Wientjes, F. B., Kavanagh, K. Superoxide production in Galleria mellonella hemocytes: identification of proteins homologous to the NADPH oxidase complex of human neutrophils. Infect. Immun. 73, 4161-4170 (2005).
- Ratcliffe, N. A., Gagen, S. J. Studies on the in vivo cellular reactions of insects: an ultrastructural analysis of nodule formation in Galleria mellonella. Tissue Cell. 9, 73-85 (1977).
- Fraser, D. W., et al. Legionnaires' disease: description of an epidemic of pneumonia. N. Engl. J. Med. 297, 1189-1197 (1977).
- Rowbotham, T. J. Preliminary report on the pathogenicity of Legionella pneumophila for freshwater and soil amoebae. J. Clin. Pathol. 33, 1179-1183 (1980).
- Fields, B. S. The molecular ecology of legionellae. Trends Microbiol. 4, 286-290 (1996).
- Berger, K. H., Isberg, R. R. Two distinct defects in intracellular growth complemented by a single genetic locus in Legionella pneumophila. Mol. Microbiol. 7, 7-19 (1993).
- Segal, G., Purcell, M., Shuman, H. A. Host cell killing and bacterial conjugation require overlapping sets of genes within a 22-kb region of the Legionella pneumophila genome. Proc. Natl. Acad. Sci. U.S.A. 95, 1669-1674 (1998).
- Vogel, J. P., Andrews, H. L., Wong, S. K., Isberg, R. R. Conjugative transfer by the virulence system of Legionella pneumophila. Science. 279, 873-876 (1998).
- Zhu, W., et al. Comprehensive identification of protein substrates of the Dot/Icm type IV transporter of Legionella pneumophila. PLoS One. 6, e17638 (2011).
- Burstein, D., et al. Genome-scale identification of Legionella pneumophila effectors using a machine learning approach. PLoS Pathog. 5, e1000508 (2009).
- Horwitz, M. A. The Legionnaires' disease bacterium (Legionella pneumophila) inhibits phagosome-lysosome fusion in human monocytes. J. Exp. Med. 158, 2108-2126 (1983).
- Swanson, M. S., Isberg, R. R. Association of Legionella pneumophila with the macrophage endoplasmic reticulum. Infect. Immun. 63, 3609-3620 (1995).
- Segal, G., Shuman, H. A. Legionella pneumophila utilizes the same genes to multiply within Acanthamoeba castellanii and human macrophages. Infect. Immun. 67, 2117-2124 (1999).
- Brieland, J., et al. Replicative Legionella pneumophila lung infection in intratracheally inoculated A/J mice. A murine model of human Legionnaires' disease. Am. J. Pathol. 145, 1537-1546 (1994).
- Baskerville, A., Fitzgeorge, R. B., Broster, M., Hambleton, P., Dennis, P. J. Experimental transmission of legionnaires' disease by exposure to aerosols of Legionella pneumophila. Lancet. 2, 1389-1390 (1981).
- Wright, E. K., et al. Naip5 affects host susceptibility to the intracellular pathogen Legionella pneumophila. Curr. Biol. 13, 27-36 (2003).
- Padilla-Carlin, D. J., McMurray, D. N., Hickey, A. J. The guinea pig as a model of infectious diseases. Comp. Med. 58, 324-340 (2008).
- Komura, T., Yasui, C., Miyamoto, H., Nishikawa, Y. Caenorhabditis elegans as an alternative model host for Legionella pneumophila, and protective effects of Bifidobacterium infantis. Appl. Environ. Microbiol. 76, 4105-4108 (2011).
- Kubori, T., Shinzawa, N., Kanuka, H., Nagai, H. Legionella metaeffector exploits host proteasome to temporally regulate cognate effector. PLoS Pathog. 6, e1001216 (2010).
- Abu Kwaik, Y. The phagosome containing Legionella pneumophila within the protozoan Hartmannella vermiformis is surrounded by the rough endoplasmic reticulum. Appl. Environ. Microbiol. 62, 2022-2028 (1996).
- Molmeret, M., Horn, M., Wagner, M., Santic, M., Abu Kwaik, Y. Amoebae as training grounds for intracellular bacterial pathogens. Appl. Environ. Microbiol. 71, 10-1128 (2005).
- Solomon, J. M., Rupper, A., Cardelli, J. A., Isberg, R. R. Intracellular growth of Legionella pneumophila in Dictyostelium discoideum, a system for genetic analysis of host-pathogen interactions. Infect. Immun. 68, 2939-2947 (2000).
- Hilbi, H., Weber, S. S., Ragaz, C., Nyfeler, Y., Urwyler, S. Environmental predators as models for bacterial pathogenesis. Environ. Microbiol. 9, 563-575 (2007).
- Khoa, D. B., Trang, L. T., Takeda, M. Expression analyses of caspase-1 and related activities in the midgut of Galleria mellonella during metamorphosis. Insect Mol Biol. 21, 247-256 (2012).
- Brassinga, A. K., et al. Caenorhabditis is a metazoan host for Legionella. Cell Microbiol. 12, 343-361 (2011).
- Harding, C. R., et al. Legionella pneumophila pathogenesis in the Galleria mellonella infection model. Infect. Immun. 80, 2780-2790 (2012).
- Harding, C. R., et al. The Dot/Icm effector SdhA is necessary for virulence of Legionella pneumophila in Galleria mellonella and A/J mice. Infect. Immun. 81, 10-1128 (2013).
- Byrne, B., Swanson, M. S. Expression of Legionella pneumophila virulence traits in response to growth conditions. Infect. Immun. 66, 3029-3034 (1998).
- Ramarao, N., Nielsen-Leroux, C., Lereclus, D. The insect Galleria mellonella as a Powerful Infection Model to Investigate Bacterial Pathogenesis. J. Vis. Exp. , e4392 (2012).
- Suter, T. M., Viswanathan, V. K., Cianciotto, N. P. Isolation of a gene encoding a novel spectinomycin phosphotransferase from Legionella pneumophila. Antimicrob. Agents Chemother. 41, 1385-1388 (1997).
- Hilbi, H., Segal, G., Shuman, H. A. Icm/dot-dependent upregulation of phagocytosis by Legionella pneumophila. Mol. Microbiol. 42, 603-617 (2001).
- Watarai, M., et al. Legionella pneumophila is internalized by a macropinocytotic uptake pathway controlled by the Dot/Icm system and the mouse Lgn1 locus. J. Exp. Med. 194, 1081-1096 (2001).
- Santic, M., Asare, R., Doric, M., Abu Kwaik, Y. Host-dependent trigger of caspases and apoptosis by Legionella pneumophila. Infect. Immun. 75, 2903-2913 (2007).
- Weber, S. S., Ragaz, C., Reus, K., Nyfeler, Y., Hilbi, H. Legionella pneumophila exploits PI(4)P to anchor secreted effector proteins to the replicative vacuole. PLoS Pathog. 2 (4), e46 (2006).
- Luo, Z. Q., Isberg, R. R. Multiple substrates of the Legionella pneumophila Dot/Icm system identified by interbacterial protein transfer. Proc. Natl. Acad. Sci. U.S.A. 101, 841-846 (2004).
- Alli, O. A., et al. Temporal pore formation-mediated egress from macrophages and alveolar epithelial cells by Legionella pneumophila. Infect. Immun. 68, 6431-6440 (2000).
- Elliott, J. A., Winn, W. C. Treatment of alveolar macrophages with cytochalasin D inhibits uptake and subsequent growth of Legionella pneumophila. Infect. Immun. 51, 31-36 (1986).
- Cirillo, S. L., Yan, L., Littman, M., Samrakandi, M. M., Cirillo, J. D. Role of the Legionella pneumophila rtxA gene in amoebae. Microbiology. 148, 1667-1677 (2002).
- Ridenour, D. A., Cirillo, S. L., Feng, S., Samrakandi, M. M., Cirillo, J. D. Identification of a gene that affects the efficiency of host cell infection by Legionella pneumophila in a temperature-dependent fashion. Infect. Immun. 71, 6256-6263 (2003).
- Samrakandi, M. M., Cirillo, S. L., Ridenour, D. A., Bermudez, L. E., Cirillo, J. D. Genetic and phenotypic differences between Legionella pneumophila strains. J. Clin. Microbiol. 40, 1352-1362 (2002).
- Lomma, M., et al. The Legionella pneumophila F-box protein Lpp2082 (AnkB) modulates ubiquitination of the host protein parvin B and promotes intracellular replication. Cell. Microbiol. , (2010).
- Champion, O. L., et al. Galleria mellonella as an alternative infection model for Yersinia pseudotuberculosis. Microbiology. 155, 1516-1522 (2009).
- Banville, N., Browne, N., Kavanagh, K. Effect of nutrient deprivation on the susceptibility of Galleria mellonella larvae to infection. Virulence. 3, 497-503 (2012).
- Qayum, A. A., Telang, A. A protocol for collecting and staining hemocytes from the yellow fever mosquito Aedes aegypti. J. Vis. Exp. , e2772 (2011).
- Stoepler, T. M., Castillo, J. C., Lill, J. T., Eleftherianos, I. A simple protocol for extracting hemocytes from wild caterpillars. J. Vis. Exp. , e4173 (2012).
- Garcia-Garcia, E., Garcia-Garcia, P. L., Rosales, C. An fMLP receptor is involved in activation of phagocytosis by hemocytes from specific insect species. Dev. Comp. Immunol. 33, 728-739 (2009).
- Bogus, M., Scheller, K. Allatotropin released by the brain controls larval molting in Galleria mellonella by affecting juvenile hormone synthesis. Int. J. Dev. Biol. 40, 205-210 (1996).
- Chang, B., Kura, F., Amemura-Maekawa, J., Koizumi, N., Watanabe, H. Identification of a novel adhesion molecule involved in the virulence of Legionella pneumophila. Infect. 73, 4272-4280 (2005).
- Cianciotto, N. P. Many substrates and functions of type II secretion: lessons learned from Legionella pneumophila. Future Microbiol. 4, 797-805 (2009).
- Aurass, P., et al. The Legionella pneumophila Dot/Icm-secreted effector PlcC/CegC1 together with PlcA and PlcB promotes virulence and belongs to a novel zinc metallophospholipase C family present in bacteria and fungi. J. Biol. Chem. , (2013).
- Vogel, H., Altincicek, B., Glockner, G., Vilcinskas, A. A comprehensive transcriptome and immune-gene repertoire of the lepidopteran model host Galleria mellonella. BMC Genomics. 12, 1471-2164 (2011).
- Terenius, O., et al. RNA interference in Lepidoptera: an overview of successful and unsuccessful studies and implications for experimental design. J. Insect. Physiol. 57, 231-245 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon