Method Article
Utilização de
Neste Artigo
Resumo
A larva da cera traça Galleria mellonella foi recentemente estabelecido como um modelo in vivo para estudar a infecção Legionella pneumophila. Aqui, nós demonstramos técnicas fundamentais para caracterizar a patogênese da Legionella nas larvas, incluindo a inoculação, a medida da virulência bacteriana e replicação, bem como extração e análise de hemócitos infectados.
Resumo
Legionella pneumophila, o agente causador de uma pneumonia grave denominada doença do legionário, é um importante patógeno humano que infecta e replica dentro de macrófagos alveolares. A sua virulência depende do sistema Dot / Icm secreção de tipo IV (T4SS), que é essencial para estabelecer um vacúolo permissiva replicação conhecido como o vacúolo que contém a Legionella (LCV). L. infecção pneumophila pode ser modelado em ratos no entanto a maioria das linhagens de camundongos não são permissivas, levando à busca de modelos de infecção da novela. Mostrámos recentemente que as larvas da traça da cera Galleria mellonella são adequados para investigação de L. infecção pneumophila. G. mellonella é cada vez mais usado como um modelo de infecção por patógenos humanos e existe uma boa correlação entre a virulência de várias espécies bacterianas no inseto e em modelos de mamíferos. Um componente-chave de defesas imunológicas do larvas são hemócitos, profissãofagócitos ai, que ocupam e destroem invasores. L. pneumophila é capaz de infectar, formar um LCV e replicam no interior dessas células. Aqui demonstramos protocolos para analisar L. virulência pneumophila no G. modelo mellonella, incluindo como crescer L. infecciosa pneumophila, pré-tratamento das larvas com inibidores, infectar as larvas e como extrair células infectadas para quantificação e microscopia de imunofluorescência. Nós também descrevem a forma de quantificar a replicação bacteriana e fitness em ensaios de competição. Estas aproximações permitem o rápido rastreio de mutantes para determinar factores importantes em L. virulência pneumophila, descrevendo uma nova ferramenta para ajudar a nossa compreensão desse complexo patógeno.
Introdução
Os modelos animais de infecção provaram inestimável para a determinação de fatores de virulência bacteriana. No entanto, os modelos de invertebrados ganharam maior atenção como uma alternativa viável aos modelos tradicionais de mamíferos de infecção. As larvas da traça da cera, Galleria mellonella está cada vez mais a ser usado para estudar uma série de agentes patogénicos humanos importantes, incluindo bactérias Gram-positivas e Gram-1 negativas bactérias 2,3 e vários fungos patogénicos 4,5. Usando um modelo de insectos tem um número de vantagens em relação aos modelos de mamíferos tradicionais, como um invertebrado, G. mellonella não está sujeito às limitações éticas de modelos de mamíferos. Além disso, as larvas podem ser facilmente mantida, infectados por injecção, sem anestesia, são submetidos a pré-tratamento com inibidores químicos 6 e manter a incubação a 37 ° C 7. Curiosamente, uma boa correlação entre a patogenicidade de vários microorganismos em G. mellonella e modelos de infecção de mamíferos tem sido estabelecida 2,8. O aumento da compreensão do sistema imunológico de G. mellonella também ajudou na caracterização deste organismo modelo. Embora insetos não têm um sistema imunológico adaptativo como encontrado em mamíferos, eles têm defesas celulares e úmero sofisticadas, incluindo a produção de peptídeos antimicrobianos 9. Hemócitos são o principal mediador das defesas celulares e são o tipo de células mais numerosas encontrado na hemolinfa (ou sangue) de G. mellonella 10, Estas células são fagócitos profissionais e executar funções semelhantes a macrófagos e neutrófilos humanos por ambos tendo-se e degradar as bactérias num compartimento phago-lisossomal 10,11 e formando nódulos torno bactérias invasoras, restringir fisicamente a replicação bacteriana 12.
Legionella pneumophila é um agente patogénico respiratório que provoca Pneumoni graveum (doença dos legionários) em populações suscetíveis, como idosos ou imunocomprometidos 13. Legionella é encontrado onipresente em fontes de água, tanto ambientais e antrópicos, onde é um patógeno de várias espécies de água doce amebas 14,15. Legionella sobrevive e replica dentro destes fagócitos profissionais utilizando um complexo multi-proteína conhecida como o Dot / Icm (defeituoso no tráfico organelo multiplicação / intracelular) do tipo 4 sistema de secreção (T4SS) para translocar mais de 275 proteínas efectoras dentro da célula hospedeira 16-20. Essas proteínas servem para subverter os caminhos normais fagocíticas célula hospedeira, levando à criação da Legionella contendo vacúolo (LCV). O LCV evita a fusão com os lisossomas e recruta vez do retículo endoplasmático (ER) de vesículas derivado, o que resulta em um compartimento especializado que se assemelha a RE rugoso 21,22. L. pneumophila é considerado um percurso humano acidentalogen; as mesmas estratégias que permitem replicar dentro de amebas, também permitir a replicação nos macrófagos alveolares humanos 23.
Hospedeiros mamíferos têm sido caracterizadas como modelos para a infecção por Legionella humana, incluindo ratos e cobaias 24,25. No entanto, a maioria das estirpes de ratinhos são resistentes à infecção por Legionella 26 com a excepção de o consanguínea albino A / J de ratinho, o qual desenvolve um ligeiro, auto-limitante de infecção de 24. Embora o modelo de cobaia se assemelha mais de perto a doença humana 25, a falta de mutantes e aumento do custo desencoraja a sua utilização 27. Além disso, vários modelos de invertebrados têm sido desenvolvidos para a infecção por Legionella pneumophila incluindo Caenorhabditis elegans 28, Drosophila melanogaster 29 e várias espécies de amebas 30-32. No entanto, estes modelos têm fraquezas, virulência do C. elegans Sistema não é Dot / Icm-dependente 28, o que limita a utilidade deste modelo. O modelo de Drosophila revelou-se eficaz na investigação de fatores de virulência bacteriana 29 e parece ser promissor no entanto, este modelo não foi totalmente caracterizada. Amebas unicelulares são os anfitriões ambientais de L. pneumophila e são ideais para investigar a ação de fatores de virulência em um nível molecular 33 porém faltam várias importantes mediadores da resposta da célula hospedeiro mamífero para infecção, como caspases 34. Os pontos fracos dos modelos existentes, juntamente com o alto custo e as preocupações éticas relacionadas com a experimentação de mamíferos, tem levado à busca de outros organismos modelo apropriadas 29,35.
Temos demonstrado recentemente que G. mellonella é um modelo adequado para L. pneumophila patogênese 36,37. Este protocolo detalha as técnicas experimentais utilizadas para infectarção G. larvas mellonella, analisando moralidade larval, extraindo hemócitos para contagem e imunofluorescência e determinar replicação viável UFC conta de larvas infectadas.
Protocolo
1. Preparação de L. pneumophila para a Infecção
- Prepare carvão de extracto de levedura (CYE) placas (carvão 2 g / L activada, 10 g / L de extracto de levedura, 13 g / L de agar, 10 g / L de N-(2-acetamido)-2-aminothanesulfonic ácido (ACES), 1 g / L α-cetoglutarato, 0,4 g / L de L-cisteína HCl e 0,25 g / l pirofosfato férrico, pH 6,9).
Nota: Se for necessário, adicionar à canamicina (25 ug / ml) e / ou cloranfenicol (6 ug / ml) para placas de CYE.- Realizar todos L. pneumophila trabalho a nível de contenção de biossegurança 2 (BSL-2) em um gabinete de segurança microbiana (MSC) em conformidade com as regras locais.
- Streak L. pneumophila de -80 ° C stocks de glicerol em placas CYE
- Incubar as placas durante 4 dias a 37 ° C.
Nota: A incubação das placas durante 4 dias aumenta significativamente a virulência de L. pneumophila em G. mellonella sobre incubação por 3 dias. - Um dia antes da infecção, ressuspender um fu laçoll de bactérias (contendo várias colónias) em 1 ml de pré-aquecido (37 ° C) ACES extracto de levedura (EJA) caldo e medir a absorvância a 600 nm (OD600) usando um espectrofotómetro.
- Semear uma nova cultura de 3 ml EJA (com antibióticos, se necessário) para um final de OD 600 de 0,1.
- Incluir uma mídia só controlar para garantir a esterilidade da mídia.
- Incubar a 37 ° C numa incubadora com agitação a 200 rpm durante 21 horas.
Nota: As bactérias devem ser cultivadas para a fase pós-exponencial para a infecção 38. Crescente por 21 hr permite experimentos a serem padronizados.
Nota: Se for necessário para a indução da proteína, adicionar 0,5 mM de isopropil β-D-1-tiogalactopiranósido (IPTG) durante a noite. - Medir o OD 600 (bactérias devem estar em fase de crescimento pós-exponencial, OD 600 2,5-3).
- Dilui-se a cultura bacteriana para dar 1 x 10 9 CFU / ml em tampão fosfato salino estéril de Dulbecco (D-PBS).
Nota: Com base nos resultados anteriores, uma OD 600 de 1 corresponde a 1 x 10 9 CFU / ml, no entanto, isto deve ser confirmado por diferentes L. cepas pneumophila.
Nota: se for necessária a indução de uma proteína a partir de um plasmídeo, adicionar 1 mM de IPTG para o inoculo. - Placa do inoculo, tal como descrito na secção 9, como um controlo, para assegurar o CFU esperada está presente no inoculo.
2. Preparação de Larvas
- Compre suficiente G. mellonella larvas de um fornecedor comercial. As larvas são enviados na fase 5 º ou 6 º instar (aproximadamente entre 2-3 cm de comprimento) e são adequados para o uso imediatamente.
Nota: Um método que descreve como a traseira larvas foi descrito previamente 39.
Nota: As larvas podem ser armazenadas à temperatura ambiente até duas semanas, e não necessitam de alimentos. Descartar imediatamente qualquer larvas mostrando sinais de pupação. - Prepare o recipiente para larva por placção de um círculo de 10 cm de papel de filtro na parte inferior de um prato de 10 centímetros de Petri.
- Com uma pinça sem corte, coloque dez larvas saudáveis de tamanho aproximadamente semelhante na placa de Petri.
Nota: Descarte insalubres insetos marrons colorido ou manchadas procurando. Larvas saudáveis são uniformemente cremoso colorido, sem áreas de manchas escuras e são capazes de endireitar-se rapidamente se virou.
3. Infecção de G. mellonella Larvas
- Prepare a plataforma injecção gravando um círculo de papel de filtro para a superfície.
- Segurança gravam uma dica P1000 horizontalmente para o papel de filtro para criar uma plataforma de injeção. Isto não necessita de ser estéril.
- Esterilizar uma seringa de microtitulação de 20 ul por aspiração de etanol a 70% e incubando durante pelo menos 10 min.
- Usar luvas prova de punção enquanto está a injectar,
- Remova qualquer etanol residual por aspiração e expulsão de água estéril várias vezes.
- Using a seringa, 10 ml de aspirado de L. pneumophila 1 x 10 9 suspensão UFC / ml.
- Tome uma larva e suavemente, mas com firmeza transformá-lo em suas costas, inclinou-se sobre a ponta P1000.
- Coloque a ponta da seringa sobre o proleg frente, à direita das larvas.
- Gentilmente, insira a ponta da agulha no proleg, certificando-se de que ele está dentro das larvas, e suavemente injetar todo o conteúdo da seringa.
Nota: Se a seringa está inserido corretamente, deve ser possível para pegar as larvas usando apenas a seringa para colocá-lo na câmara.- Após injecção, as larvas observar durante alguns segundos. As larvas vão começar a engatinhar depois de alguns segundos, mas não deve excretar fluido.
- Resumidamente observar as larvas de algumas horas após a infecção; infecção com 10 7 CFU L. pneumophila 130b não causa sintomas nas primeiras 5-8 horas pi Portanto, se as larvas estão virando cinza / preto antes desse ponto, tele experimento deve ser interrompido.
Nota: A inoculação de larvas com IPTG 1 mM não afecta a viabilidade das larvas ao longo do curso do experimento. - Do mesmo modo, injecta-se um total de 10 larvas por cada condição, incluindo 10 larvas injectadas com D-PBS para servir como um controlo para analisar a mortalidade das larvas.
- Tape placas de Petri fechada e coloque em contenção secundária.
- Incubar numa incubadora bacteriano padrão a 37 ° C, durante a duração da experiência.
4. O pré-tratamento das larvas com um inibidor químico
- Antes da infecção, as larvas se preparar para injecção, tal como descrito na secção de 3,1-3,6.
- Injectar 10 mL de uma solução de citocalasina D 100 pM para a frente, para a esquerda proleg de 10 larvas.
Nota: Inibidor é injectado num proleg diferente da suspensão bacteriana para reduzir o prejuízo para as larvas. - Injectar 10 mL de DMSO em 10 larvas como um controlo.
- Incubar larvas em37 ° C durante 4 h.
- Injetar larvas pré-tratados como descrito na seção 3 na frente, certo proleg com 1 x 10 7 UFC de L. WT pneumophila ou um controle PBS.
5. Análise da Mortalidade larval
- Aos 18 hr pós infecção (pi), examine todas as larvas infectadas para a mortalidade.
- Para verificar a mortalidade, use uma pinça sem corte para virar as larvas e procurar o movimento das pernas, as larvas saudável deve endireitar-se rapidamente. Pigmentação indica uma reação imunológica forte à infecção. Se houver qualquer movimento, contam como vivo.
- Número recorde de larvas mortas e vivas.
- Repita esse processo em todos os outros pontos de tempo escolhido.
Nota: Se a incubação continuou por mais de três dias, as pupas podem ser vistos. Remova qualquer pupas e eutanásia por congelamento a - 20 ° C antes de metamorfose pode ocorrer.
6. Extração de hemolinfa
- Aleatoriamente selecionar trêslarvas e colocar num tubo de 14 ml em pontos de tempo seleccionados, tais como 5 e 18 horas pi,
- Colocar este tubo em gelo durante 5-10 minutos, até que nenhum movimento das pernas, as larvas podem ser observadas.
- Coloque as larvas anestesiados para uma placa de Petri e, usando um bisturi, fazer uma incisão entre dois segmentos próximos da cauda das larvas.
- Esprema as larvas em um tubo de centrífuga de 1,5 ml estéril para recolher a hemolinfa.
- Hemolinfa Piscina de pelo menos três indivíduos. Uma larva dá entre 15-50 mL de hemolinfa dependendo do tamanho.
Nota: Durante a extracção, hemolinfa que é muito fácil para interromper o intestino, resultando na contaminação potencial das amostras. Reduzir a contaminação por corte as larvas perto da cauda (distância a partir do intestino), no entanto, a selecção de antibiótico será sempre necessária quando o plaqueamento as bactérias.
Nota: Para evitar hemolinfa escureçam e coagulante, processo hemolinfa dentro de 10 minutos após a coleta.
- Hemolinfa Piscina de pelo menos três indivíduos. Uma larva dá entre 15-50 mL de hemolinfa dependendo do tamanho.
- Descartar o corpo de larvas para um novo tubo de 14 ml de Falcon, de vedação e lugar, a - 20 ° C durante a noite para assegurar que as larvas estão mortas.
- Autoclave larvas mortas e dispor de acordo com as regras locais.
7. Determinação da Viabilidade de hemócitos
- Extrair hemolinfa como descrito acima.
- Misturar 20 ul de hemolinfa foi extraída com 20 mL de 0,02% (v / v) de azul de tripano em PBS em um poço de uma placa de 96 poços.
- Incubar durante 5 min à temperatura ambiente.
- Carga 10 mL de hemolinfa em um hemocitômetro e contar células (azul) não viáveis.
- Conte cada amostra em triplicado para reduzir o erro.
8. Processamento de Extraído Hemócitos para imunofluorescência Microscopia
- Misture a hemolinfa reunidas extraída de, pelo menos, três larvas e pipeta para uma lamela de vidro de 10-15 mm de uma placa de 24 poços.
Nota: Lamelas não necessitam de tratamento como hemócitos pode aderir ao vidro. - Adicionar 0,5 ml de D-PBS e misture bem por pipetagem cima e para baixo.
- Centrifuga-se o prato durante 10 minutos a 500 xg, à temperatura ambiente (RT), utilizando um suporte de placa de centrífuga anti-aerossol.
- Examine cada cavidade utilizando um microscópio invertido para verificar se os hemócitos aderiram.
- Remover o sobrenadante e lava-se cuidadosamente as células três vezes por adição de 0,5 ml de D-PBS para a parede do poço, balançando o prato 2-3x e removendo o D-PBS com uma pipeta.
- Fixar as células por adição de 0,5 ml de 4% (v / v) de paraformaldeído (PFA) em PBS.
- Incubar as células de entre 20-30 minutos à temperatura ambiente.
- Lave as células três vezes com D-PBS, como antes.
- Adicionar 0,5 ml de 15 mM NH 4 Cl em PBS para extinguir a PFA residual e incubar à temperatura ambiente durante 15 min.
- Lave as células três vezes com D-PBS.
Nota: Nesta fase, as lamelas podem ser armazenadas durante a noite a 4 ° C. - Adicionar 0,5 ml de 0,1% de Triton X-100 em PBS e incubar durante 5 min à temperatura ambiente para permeabilizar as células.
- Bloco durante 1 hora com solução de bloqueio (2% (w / v) de BSA em PBS).
- Incubar durante 1 hora à temperatura ambiente no escuro, com o anticorpo primário diluído em solução de bloqueio na diluição indicada pelo fabricante.
- Lavar 3x com PBS.
- Incubar durante 1 hora com o anticorpo secundário e DAPI para visualização de bactérias como acima.
- Lavar 3x com PBS.
- Montar as lamelas utilizando uma gota de reagente de montagem sobre lâminas de vidro.
- Incubar durante a noite no escuro à temperatura ambiente para secar totalmente a solução de montagem.
- Imagem desliza sobre um microscópio de fluorescência.
9. Quantificação de bacteriana CFU
- Adicione 100 g / ml spectinomicina para CYE placas para evitar a contaminação pela flora intestinal. L. 130b pneumophila tensão é naturalmente resistente à espectinomicina 40.
- Antes de extração de hemolinfa, pesar 1,5 ml tubos de centrífuga.
- Extraia hemolinfa como descrito na seção 6 e coloque em pesava tubes, adicionar 1 ml de 5 mg / ml de digitonina, misturar bem e incubar durante 5 min à temperatura ambiente para lisar os hemócitos.
- Pesar novamente o tubo com hemolinfa e determinar o peso da hemolinfa extraída.
- Realize dez diluições vezes de hemolinfa em mídia EJA estéril.
- Usando uma caneta, divida a base de uma placa de CYE em seis sectores iguais e rótulo.
- Placa de três gotas de 25 ul de cada diluição (começando com o mais diluído) em cada secção da placa.
- Incubar as placas com as tampas Upmost durante a noite a 37 ° C.
- Uma vez que as gotas secaram completamente, para girar a placa por cima e incubar a 37 ° C durante, pelo menos mais dois dias.
- Quantificar as bactérias extraídas por contagem das colónias em cada diluição e normalizam-se ao peso da hemolinfa extraída.
10. Determinação do Índice Competitiva (IC)
- Confirme que ambas as cepas crescem igualmente bem em caldo de cultura e em placas de ágar CYE prior para tentar o índice competitivo.
- Preparar suspensões bacterianas mutantes resistentes WT ou canamicina como descrito na seção 1 e misture em uma proporção de 1:1.
- Diluições em série da placa do inóculo para CYE espectinomicina (100 mg / ml) e CYE spectinomicina / canamicina
- Infectar larvas e extracto de hemolinfa em momentos adequados, tal como descrito acima.
- Determinar a contagem de viáveis por meio da extração de hemolinfa e chapeamento de diluições em série para spectinomicina CYE e CYE spectinomicina / canamicina.
- Calcular o índice competitiva (IC), como se segue: IC = (saída de mutante / saída WT) / (inoculo mutante / WT inoculo).
Resultados
Aqui é demonstrado que G. mellonella é um modelo apropriado, fácil de usar para estudar L. infecção pneumophila. Anteriormente, demonstrou-se que o L. virulência pneumophila em macrófagos, amebas e modelos de mamíferos é dependente da presença do sistema de secreção Dot / Icm 41-43. G. larvas mellonella foram infectadas tal como descrito acima e a virulência do tipo selvagem (WT) e uma estirpe de Dot / Icm deficiente comparado. A infecção com 10 7 CFU da L. 130b pneumophila esforço resultou em 100% de mortalidade dentro de 24 horas pós-infecção (pi). No entanto, a L. pneumophila Δ DOTA estirpe, que não tem um sistema de secreção Dot / Icm T4SS funcional, foi avirulenta neste ensaio (Figura 1). Isto demonstra que o L. virulência pneumophila em G. mellonella depende da translocação de efetores Dot / ICM, tornando este modelo adequado para caracterização dea função destas proteínas.
Recentemente, foi mostrado que a inibição da fagocitose por tratamento citocalasina aumentou a susceptibly das larvas para a infecção pelos fungos Candida albicans 6. Como L. pneumophila é um agente patogénico intracelular, foi decidido determinar se a absorção das bactérias é crucial na sua patogénese neste modelo. As larvas foram pré-tratadas com 10 ul de 100 uM citocalasina D (CyD) durante 4 horas a 37 ° C, em seguida, infectadas com 10 7 CFU da L. WT 130b pneumophila e mortalidade monitorados em 24 horas pi O tratamento com o inibidor só não afetou a sobrevivência das larvas. No entanto, pré-tratado, as larvas infectadas apresentado sobrevivência significativamente maior (P = 0,0066, teste T desemparelhado) em comparação com tratados com DMSO, os insectos infectados (Figura 2). O efeito do tratamento CyD foi abolida por 48 hr pi (resultados não apresentados), o que pode ser devido à meia-vida do fármaco no G.mellonella. Isso demonstra que a absorção de L. pneumophila em G. mellonella hemócitos é um aspecto crucial da virulência bacteriana.
A fim de validar expressão e determinar a localização subcelular de uma proteína efectora em G. mellonella, hemócitos foram extraídos e processados para microscopia de imunofluorescência. As larvas foram infectadas com WT e Δ DOTA L. pneumophila 130b expressando um fragmento do efector T4SS bem definida, SIDC 41-918, fundido com quatro etiquetas HA N-terminal. Este efector, foi demonstrado que se ligam a LCV através de um domínio de fosfoinositido-4--fosfato de ligação 44. Utilizando anti-HA (vermelho) e de anti-Legionella (verde) anticorpos, 4HA-SIDC 41-918 localizada no LCV em hemócitos infectados (Figura 3). Esta localização foi previamente mostrado na discoideum amebas Dictyostelium e em macrófagos de mamíferos 44,45 confirmando o comparability deste modelo.
A importância das proteínas de virulência é geralmente determinada por comparação da cinética de crescimento de tipo selvagem e as bactérias mutantes. De modo a seguir a cinética de replicação bacterianas durante o curso da infecção, três larvas foram sacrificados em cada ponto de tempo (0, 5, 18, e 24 h pi), a hemolinfa recolhidas e combinadas e o CFU/0.1g de hemolinfa extraída determinada. Depois de um mergulho inicial em 5 pi h, a UFC de bactérias WT aumenta até 24 horas pi no entanto, a estirpe Δ DOTA sofre nenhuma replicação e é eliminada a 18 hr pi (Figura 4).
A capacidade de L. pneumophila para provocar a lise dos macrófagos de um modo dependente-T4SS tem sido documentada 46, no entanto, não há estudos semelhantes foram realizados in vivo. A concentração de hemócitos em circulação foi determinada aos 5, 18, e 24 hr pi larvas foram infectadas com WT ou Δ Dota L. pneumophila 130b, hemócitos extraídos de insetos infectados e células viáveis contadas usando o método de exclusão do azul de tripan. Às 5 horas pi nenhuma diferença significativa na contagem de hemócitos entre as estirpes pode ser visto (Figura 5). No entanto, às 18 horas pi houve uma queda significativa na concentração de hemócitos no WT, mas não Δ Dota, larvas infectadas. Esta diferença persistiu às 24 horas pi A queda no número de hemócitos, combinada com a presença de bactérias intracelulares, como visto por imunofluorescência, sugere que L. pneumophila replica dentro hemócitos então lisa-los, permitindo que as bactérias se submeter a várias rodadas de replicação.
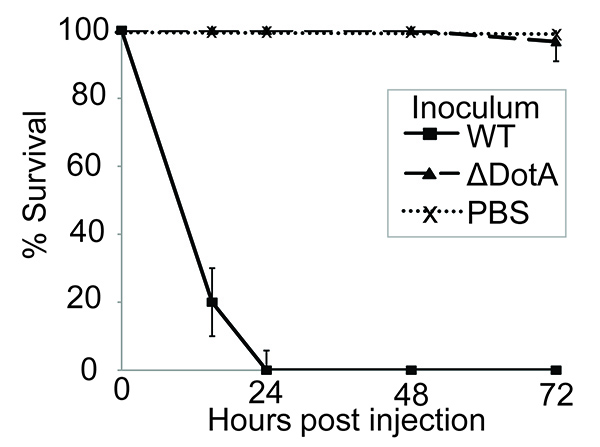
Figura 1. A infecção com L. pneumophila induz Dot / Icm-dependente de mortalidade das larvas. de 10 larvas infectadas com PBS sozinho ou 10 7 UFC de tipo selvagem (WT) ou Δ Dota L. pneumophila 130b, incubados a 37 ° C durante 72 horas e no momento da morte das larvas gravado. Todas as larvas infectadas com o WT sucumbiu a uma infecção dentro de 24 horas pós-infecção (pi), no entanto nenhuma mortalidade foi observada em larvas inoculadas com PBS sozinho ou a tensão Δ Dota. Os resultados são a média de três experiências separadas, ± desvio-padrão.
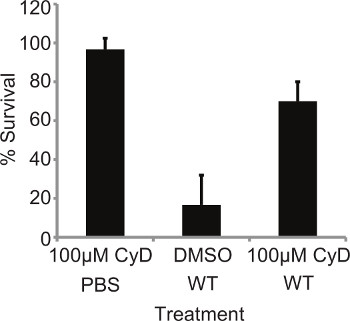
Figura 2. A mortalidade é dependente da internalização bacteriana. De 10 L. pneumophila larvas foram pré-tratadas com 10 ul de 100 uM citocalasina D (CyD) durante 4 horas a 37 ° C, em seguida, infectadas com 10 7 WT e mortalidade monitorizada a 24 hr pi larvas pré-tratado demonstraram significativamente (P = 0,0066, teste t ímpar) reduzida mortalidade. Os resultados representam a mean de em quatro experimentos independentes ± desvios-padrão com 10 larvas por condição.
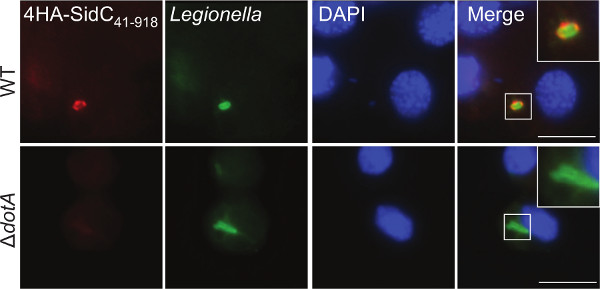
Figura 3. Imunofluorescência de imagens de proteínas efectoras em hemócitos extraídos. Hemócitos foram extraídos a partir de larvas infectadas com L. pneumophila 130b WT ou Δ Dota expressar 4HA-SIDC 41-918 em 5 hr pi As células foram coradas com anti-HA (vermelho) e anti-Legionella (verde) anticorpos e mancha DNA DAPI (azul) para visualizar os núcleos. 4HA-SIDC 41-918 foi observada WT circundante, mas não Δ Dota, bactérias. Barra de escala de 5 mM.
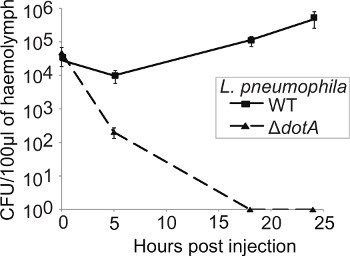
Figura 4. L. pneumophila replica dentro G. mellonella de um modo Dot / Icm-dependente. larvas foram infectadas com pneumophila WT ou Δ DOTA L. e a 0, 5, 18, e 24 hr pi da hemolinfa de três insectos infectadas reunidas, colocadas em placas de CYE e o CFU determinada e normalizada para o inoculo e com o peso de hemolinfa extraída. WT L. pneumophila replicado ao longo do experimento, enquanto a tensão Δ Dota foi liberado dentro de 18 horas pi Os resultados são a média de três experimentos separados ± desvio padrão.
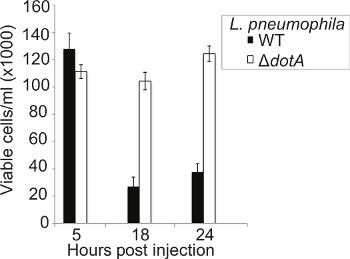
Figura 5. Infecção com WT L. Resultados pneumophila em destruição de hemócitos significativa. Hemócitos foram extraídos a 5, 18, e 24 hr pi de larvas infectadas com pneumophila WT ou Δ DOTA L. e contadas as células viáveis utilizando um hemocitómetro. Nenhuma diferença nanúmero de células foi observada em 5 horas pi entre as cepas porém em 18 horas pi apenas aproximadamente 15% dos hemócitos em larvas permanecem infectados com a cepa WT em comparação com a cepa Δ Dota. Os resultados são a média de três experiências separadas, ± desvio-padrão.
Discussão
O Galleria mellonella modelo larval para a infecção Legionella pneumophila é uma ferramenta útil para estudos in vivo de patogênese. Aqui mostra-se que um certo número de aspectos da infecção de macrófagos pode ser recapitulado no G. modelo mellonella, incluindo o papel do Dot / Icm T4BSS na virulência e replicação bacteriana e da localização do Dot / Icm efetuador SIDC. Além disso, demonstra-se que um inibidor químico de polimerização de actina reduz significativamente a mortalidade das larvas, que imita os resultados obtidos em macophages 47 e provas de que a internalização das bactérias é necessário para fazer com que a mortalidade das larvas. Anteriormente, demonstrou-se que as variações na virulência de L. cepas pneumophila visto em outros modelos de infecção pode ser verificado em G. mellonella e que a indução de fatores de virulência em fase de crescimento pós-exponencial é necessário para a virulência bacteriana 36, confirmando que G. mellonella é um modelo adequado para L. infecção pneumophila.
Determinando o CFU de L. pneumophila de larvas infectadas quer isoladamente ou em infecções mistas aumenta grandemente a utilidade do modelo. Anteriormente, vários fatores têm sido descoberto que têm efeitos sutis sobre replicação bacteriana em um ou mais modelos de infecção 29,48-51. Embora as larvas não possuem um sistema imunitário adaptativo, a presença da resposta imune inata proporciona selecção mais forte em comparação com os macrófagos sozinhos, o que pode servir para amplificar fenótipos subtis. Portanto, é possível que, enquanto essas cepas provavelmente não afetará significativamente a mortalidade larval, eles podem demonstrar diminuição da replicação bacteriana ou adequação no G. modelo mellonella. , Bem como a replicação de L. pneumophila nas larvas, mostramos esgotamento hemocyte significativa no final de infecção. Como L.pneumophila é esperado para lisar as células hospedeiras, no final do seu ciclo de replicação, medir o esgotamento de hemócitos também pode servir como uma medida indirecta da replicação bacteriana. Esgotamento hemócitos foi previamente correlacionado com a mortalidade de insetos em infecção 3,52, embora os resultados recentes sugerem que esta situação é mais complexa do que a primeira belived 37. Recentemente, demonstrou-se que a carência de larvas leva a um aumento da susceptibilidade à infecção por meio de uma supressão das respostas imunes 53. Nos ensaios aqui descritos, as larvas não foram alimentados durante a duração do estudo e não se sabe como bem larvas alimentadas com responderia a L. infecção pneumophila.
Uma das vantagens de G. mellonella como um organismo modelo é a facilidade de extracção e quantificação de hemócitos de larvas infectadas. Vídeos anteriores demonstraram vários métodos para extração de hemócitos de insetos 54,55 no entanto, o conheceuhod aqui apresentada é simples e adequado para processamento imediato. Uma vez extraído, hemócitos pode ser facilmente quantificado, utilizado para imunofluorescência, a microscopia electrónica de transmissão 36 ou 56 por citometria de fluxo ou cultivadas e infectadas ex vivo 3 permitindo que a resposta das células à infecção a ser investigada em detalhe. Isto aumenta significativamente a flexibilidade do modelo. Uma ressalva para imunofluorescência em G. mellonella é a oferta limitada de anticorpos validados contra G. proteínas mellonella. No entanto, estudos têm demonstrado a criação de anticorpos contra as proteínas de larvas 57 e anticorpos contra as proteínas imuno-relacionadas humanos foram encontrados para reconhecer G. proteínas mellonella 11, demonstrando o potencial de imunofluorescência em G. hemócitos mellonella.
A facilidade de G. infecção mellonella permite rápidos, telas de médio rendimento que poderiamser utilizado para comparar a virulência das várias espécies de Legionella e as estirpes e poderia ser utilizado para analisar ainda factores de virulência previamente identificados, tais como moléculas de adesão 58 ou o sistema de secreção de tipo 2 59, que são necessários para virulência em outros modelos. Além disso, a utilização deste modelo irá permitir a identificação e a caracterização adicional de novos factores de virulência incluindo as proteínas efectoras segregadas e translocados. Recentemente, tem sido mostrado que a actividade da fosfolipase C de L. pneumophila tem um papel em G. mellonella virulência 60 e que a proteína efectora Dot / Icm SdhA é necessária para a virulência 37. Além disso, foi demonstrado recentemente que existe uma correlação entre os fenótipos observados em G. mellonella e no camundongo linhagem A / J 37.
Isto sublinha o valor desta ferramenta para complementar protozoário unicelular ambiental e de acolhimento e murimodelos de infecção ne. O G. mellonella modelo vai se tornar ainda mais valioso no futuro, uma vez que a seqüência genômica larval estará disponível e as ferramentas mais genéticos são estabelecidas. Passos nessa direção incluem a recente publicação que detalha o transcriptoma imune relacionados com 61 ea formação de uma iniciativa para avançar silenciamento gênico em Lepidoptera spp 62.
Usando G. larvas mellonella, que tem uma série de leituras simples e rápidos de virulência bacteriana que podem ser utilizados para investigar a patogênese de L. pneumophila. Estabelecimento destes ensaios de triagem e mais ampla de L. cepas pneumophila sorogrupos e vai aumentar a utilidade desta nova ferramenta e vai contribuir para a nossa compreensão da L. patogênese pneumophila.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
CR Harding foi apoiado pelo studentship WT086724 Wellcome Trust.
Materiais
| Name | Company | Catalog Number | Comments |
| Material/ Equipment | |||
| ACES yeast extract (AYE) broth | 4 g ACES, 4 g yeast extract, 0.4 g α-ketoglutarate, pH 6.9, 400 ml H2O, autoclaved, 4 ml iron solution*, 4 ml cysteine solution* *add sterile ingredients after autoclaving | ||
| Charcoal buffered yeast extract (CYE) plates | As above, with the addition of 0.6 g activated charcoal and 6 g agar | ||
| Sterile iron solution (Ferric Pyrophosphate) | Sigma | P6526 | 0.6 mM solution, sterile filtered |
| Sterile cysteine solution | Sigma | C7880 | 3.3 mM solution, sterile filtered |
| G. mellonella (waxworms) | Livefood UK | W250 | |
| Anti-HA-Tetramethyl Rhodamine Isothiocyanate (TRITC) | Sigma | H9037 | |
| Anti-Legionella LPS | Cambridge Biosciences | PA1-7227 | |
| Anti-Rabbit IgG Alexa488 | Jackson Immunoreach | 711-485-152 | |
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Sigma | I6758 | |
| Dulbeccos phosphate buffered saline (D-PBS) | Sigma | D8662 | |
| Paraformaldehyde | Agar Scientific | R1026 | |
| Ammonium chloride (NH4Cl) | Sigma | A9434 | |
| Trypan Blue solution | Sigma | T8154 | |
| Digitonin | Sigma | D141 | |
| Cytochalasin D | Biomol International | BML-T109-0001 | |
| [header] | |||
| Material | |||
| Microtiter Syringe | Sigma | 24544 | |
| Cell counter, double, Improved Neubauer | VWR | 631-0926 | |
| Centrifuge | For centrifuging plates | ||
| Fluorescence microscope | Any microscope with appropriate filters for the required fluorophores | ||
| Inverted microscope | For viable cell counting | ||
| Puncture-proof glove | Turtleskin | ||
Referências
- Olsen, R. J., Watkins, M. E., Cantu, C. C., Beres, S. B., Musser, J. M. Virulence of serotype M3 Group A Streptococcus strains in wax worms (Galleria mellonella larvae. Virulence. 2, 111-119 (2011).
- Jander, G., Rahme, L. G., Ausubel, F. M. Positive correlation between virulence of Pseudomonas aeruginosa mutants in mice and insects. J. Bacteriol. 182, 3843-3845 (2000).
- Mukherjee, K., et al. Galleria mellonella as a model system for studying Listeria pathogenesis. Appl. Environ. Microbiol. 76, 310-317 (2010).
- Mowlds, P., Barron, A., Kavanagh, K. Physical stress primes the immune response of Galleria mellonella larvae to infection by Candida albicans. Microbes Infect. 10, 628-634 (2008).
- Renwick, J., Daly, P., Reeves, E. P., Kavanagh, K. Susceptibility of larvae of Galleria mellonella to infection by Aspergillus fumigatus is dependent upon stage of conidial germination. Mycopathologia. 161, 377-384 (2006).
- Banville, N., Fallon, J., McLoughlin, K., Kavanagh, K. Disruption of haemocyte function by exposure to cytochalasin b or nocodazole increases the susceptibility of Galleria mellonella larvae to infection. Microbes Infect. 13, 1191-1198 (2012).
- Mowlds, P., Kavanagh, K. Effect of pre-incubation temperature on susceptibility of Galleria mellonella larvae to infection by Candida albicans. Mycopathologia. 165, 5-12 (2008).
- Joyce, S. A., Gahan, C. G. Molecular pathogenesis of Listeria monocytogenes in the alternative model host Galleria mellonella. Microbiology. 156, 3456-3468 (2010).
- Mak, P., Zdybicka-Barabas, A., Cytrynska, M. A different repertoire of Galleria mellonella antimicrobial peptides in larvae challenged with bacteria and fungi. Dev. Comp. Immunol. 34, 1129-1136 (2010).
- Lavine, M. D., Strand, M. R. Insect hemocytes and their role in immunity. Insect Biochem. Mol. Biol. 32, 1295-1309 (2002).
- Bergin, D., Reeves, E. P., Renwick, J., Wientjes, F. B., Kavanagh, K. Superoxide production in Galleria mellonella hemocytes: identification of proteins homologous to the NADPH oxidase complex of human neutrophils. Infect. Immun. 73, 4161-4170 (2005).
- Ratcliffe, N. A., Gagen, S. J. Studies on the in vivo cellular reactions of insects: an ultrastructural analysis of nodule formation in Galleria mellonella. Tissue Cell. 9, 73-85 (1977).
- Fraser, D. W., et al. Legionnaires' disease: description of an epidemic of pneumonia. N. Engl. J. Med. 297, 1189-1197 (1977).
- Rowbotham, T. J. Preliminary report on the pathogenicity of Legionella pneumophila for freshwater and soil amoebae. J. Clin. Pathol. 33, 1179-1183 (1980).
- Fields, B. S. The molecular ecology of legionellae. Trends Microbiol. 4, 286-290 (1996).
- Berger, K. H., Isberg, R. R. Two distinct defects in intracellular growth complemented by a single genetic locus in Legionella pneumophila. Mol. Microbiol. 7, 7-19 (1993).
- Segal, G., Purcell, M., Shuman, H. A. Host cell killing and bacterial conjugation require overlapping sets of genes within a 22-kb region of the Legionella pneumophila genome. Proc. Natl. Acad. Sci. U.S.A. 95, 1669-1674 (1998).
- Vogel, J. P., Andrews, H. L., Wong, S. K., Isberg, R. R. Conjugative transfer by the virulence system of Legionella pneumophila. Science. 279, 873-876 (1998).
- Zhu, W., et al. Comprehensive identification of protein substrates of the Dot/Icm type IV transporter of Legionella pneumophila. PLoS One. 6, e17638 (2011).
- Burstein, D., et al. Genome-scale identification of Legionella pneumophila effectors using a machine learning approach. PLoS Pathog. 5, e1000508 (2009).
- Horwitz, M. A. The Legionnaires' disease bacterium (Legionella pneumophila) inhibits phagosome-lysosome fusion in human monocytes. J. Exp. Med. 158, 2108-2126 (1983).
- Swanson, M. S., Isberg, R. R. Association of Legionella pneumophila with the macrophage endoplasmic reticulum. Infect. Immun. 63, 3609-3620 (1995).
- Segal, G., Shuman, H. A. Legionella pneumophila utilizes the same genes to multiply within Acanthamoeba castellanii and human macrophages. Infect. Immun. 67, 2117-2124 (1999).
- Brieland, J., et al. Replicative Legionella pneumophila lung infection in intratracheally inoculated A/J mice. A murine model of human Legionnaires' disease. Am. J. Pathol. 145, 1537-1546 (1994).
- Baskerville, A., Fitzgeorge, R. B., Broster, M., Hambleton, P., Dennis, P. J. Experimental transmission of legionnaires' disease by exposure to aerosols of Legionella pneumophila. Lancet. 2, 1389-1390 (1981).
- Wright, E. K., et al. Naip5 affects host susceptibility to the intracellular pathogen Legionella pneumophila. Curr. Biol. 13, 27-36 (2003).
- Padilla-Carlin, D. J., McMurray, D. N., Hickey, A. J. The guinea pig as a model of infectious diseases. Comp. Med. 58, 324-340 (2008).
- Komura, T., Yasui, C., Miyamoto, H., Nishikawa, Y. Caenorhabditis elegans as an alternative model host for Legionella pneumophila, and protective effects of Bifidobacterium infantis. Appl. Environ. Microbiol. 76, 4105-4108 (2011).
- Kubori, T., Shinzawa, N., Kanuka, H., Nagai, H. Legionella metaeffector exploits host proteasome to temporally regulate cognate effector. PLoS Pathog. 6, e1001216 (2010).
- Abu Kwaik, Y. The phagosome containing Legionella pneumophila within the protozoan Hartmannella vermiformis is surrounded by the rough endoplasmic reticulum. Appl. Environ. Microbiol. 62, 2022-2028 (1996).
- Molmeret, M., Horn, M., Wagner, M., Santic, M., Abu Kwaik, Y. Amoebae as training grounds for intracellular bacterial pathogens. Appl. Environ. Microbiol. 71, 10-1128 (2005).
- Solomon, J. M., Rupper, A., Cardelli, J. A., Isberg, R. R. Intracellular growth of Legionella pneumophila in Dictyostelium discoideum, a system for genetic analysis of host-pathogen interactions. Infect. Immun. 68, 2939-2947 (2000).
- Hilbi, H., Weber, S. S., Ragaz, C., Nyfeler, Y., Urwyler, S. Environmental predators as models for bacterial pathogenesis. Environ. Microbiol. 9, 563-575 (2007).
- Khoa, D. B., Trang, L. T., Takeda, M. Expression analyses of caspase-1 and related activities in the midgut of Galleria mellonella during metamorphosis. Insect Mol Biol. 21, 247-256 (2012).
- Brassinga, A. K., et al. Caenorhabditis is a metazoan host for Legionella. Cell Microbiol. 12, 343-361 (2011).
- Harding, C. R., et al. Legionella pneumophila pathogenesis in the Galleria mellonella infection model. Infect. Immun. 80, 2780-2790 (2012).
- Harding, C. R., et al. The Dot/Icm effector SdhA is necessary for virulence of Legionella pneumophila in Galleria mellonella and A/J mice. Infect. Immun. 81, 10-1128 (2013).
- Byrne, B., Swanson, M. S. Expression of Legionella pneumophila virulence traits in response to growth conditions. Infect. Immun. 66, 3029-3034 (1998).
- Ramarao, N., Nielsen-Leroux, C., Lereclus, D. The insect Galleria mellonella as a Powerful Infection Model to Investigate Bacterial Pathogenesis. J. Vis. Exp. , e4392 (2012).
- Suter, T. M., Viswanathan, V. K., Cianciotto, N. P. Isolation of a gene encoding a novel spectinomycin phosphotransferase from Legionella pneumophila. Antimicrob. Agents Chemother. 41, 1385-1388 (1997).
- Hilbi, H., Segal, G., Shuman, H. A. Icm/dot-dependent upregulation of phagocytosis by Legionella pneumophila. Mol. Microbiol. 42, 603-617 (2001).
- Watarai, M., et al. Legionella pneumophila is internalized by a macropinocytotic uptake pathway controlled by the Dot/Icm system and the mouse Lgn1 locus. J. Exp. Med. 194, 1081-1096 (2001).
- Santic, M., Asare, R., Doric, M., Abu Kwaik, Y. Host-dependent trigger of caspases and apoptosis by Legionella pneumophila. Infect. Immun. 75, 2903-2913 (2007).
- Weber, S. S., Ragaz, C., Reus, K., Nyfeler, Y., Hilbi, H. Legionella pneumophila exploits PI(4)P to anchor secreted effector proteins to the replicative vacuole. PLoS Pathog. 2 (4), e46 (2006).
- Luo, Z. Q., Isberg, R. R. Multiple substrates of the Legionella pneumophila Dot/Icm system identified by interbacterial protein transfer. Proc. Natl. Acad. Sci. U.S.A. 101, 841-846 (2004).
- Alli, O. A., et al. Temporal pore formation-mediated egress from macrophages and alveolar epithelial cells by Legionella pneumophila. Infect. Immun. 68, 6431-6440 (2000).
- Elliott, J. A., Winn, W. C. Treatment of alveolar macrophages with cytochalasin D inhibits uptake and subsequent growth of Legionella pneumophila. Infect. Immun. 51, 31-36 (1986).
- Cirillo, S. L., Yan, L., Littman, M., Samrakandi, M. M., Cirillo, J. D. Role of the Legionella pneumophila rtxA gene in amoebae. Microbiology. 148, 1667-1677 (2002).
- Ridenour, D. A., Cirillo, S. L., Feng, S., Samrakandi, M. M., Cirillo, J. D. Identification of a gene that affects the efficiency of host cell infection by Legionella pneumophila in a temperature-dependent fashion. Infect. Immun. 71, 6256-6263 (2003).
- Samrakandi, M. M., Cirillo, S. L., Ridenour, D. A., Bermudez, L. E., Cirillo, J. D. Genetic and phenotypic differences between Legionella pneumophila strains. J. Clin. Microbiol. 40, 1352-1362 (2002).
- Lomma, M., et al. The Legionella pneumophila F-box protein Lpp2082 (AnkB) modulates ubiquitination of the host protein parvin B and promotes intracellular replication. Cell. Microbiol. , (2010).
- Champion, O. L., et al. Galleria mellonella as an alternative infection model for Yersinia pseudotuberculosis. Microbiology. 155, 1516-1522 (2009).
- Banville, N., Browne, N., Kavanagh, K. Effect of nutrient deprivation on the susceptibility of Galleria mellonella larvae to infection. Virulence. 3, 497-503 (2012).
- Qayum, A. A., Telang, A. A protocol for collecting and staining hemocytes from the yellow fever mosquito Aedes aegypti. J. Vis. Exp. , e2772 (2011).
- Stoepler, T. M., Castillo, J. C., Lill, J. T., Eleftherianos, I. A simple protocol for extracting hemocytes from wild caterpillars. J. Vis. Exp. , e4173 (2012).
- Garcia-Garcia, E., Garcia-Garcia, P. L., Rosales, C. An fMLP receptor is involved in activation of phagocytosis by hemocytes from specific insect species. Dev. Comp. Immunol. 33, 728-739 (2009).
- Bogus, M., Scheller, K. Allatotropin released by the brain controls larval molting in Galleria mellonella by affecting juvenile hormone synthesis. Int. J. Dev. Biol. 40, 205-210 (1996).
- Chang, B., Kura, F., Amemura-Maekawa, J., Koizumi, N., Watanabe, H. Identification of a novel adhesion molecule involved in the virulence of Legionella pneumophila. Infect. 73, 4272-4280 (2005).
- Cianciotto, N. P. Many substrates and functions of type II secretion: lessons learned from Legionella pneumophila. Future Microbiol. 4, 797-805 (2009).
- Aurass, P., et al. The Legionella pneumophila Dot/Icm-secreted effector PlcC/CegC1 together with PlcA and PlcB promotes virulence and belongs to a novel zinc metallophospholipase C family present in bacteria and fungi. J. Biol. Chem. , (2013).
- Vogel, H., Altincicek, B., Glockner, G., Vilcinskas, A. A comprehensive transcriptome and immune-gene repertoire of the lepidopteran model host Galleria mellonella. BMC Genomics. 12, 1471-2164 (2011).
- Terenius, O., et al. RNA interference in Lepidoptera: an overview of successful and unsuccessful studies and implications for experimental design. J. Insect. Physiol. 57, 231-245 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados