Method Article
Die Multi-Organ Chip - Ein Mikrofluidik-Plattform für langfristige Multi-Gewebe Cokultur
In diesem Artikel
Zusammenfassung
Here, we present a protocol to coculture primary cells, tissue models and punch biopsies in a microfluidic multi-organ chip for up to 28 days. Human dermal microvascular endothelial cells, liver aggregates and skin biopsies were successfully combined in a common media circulation.
Zusammenfassung
The ever growing amount of new substances released onto the market and the limited predictability of current in vitro test systems has led to a high need for new solutions for substance testing. Many drugs that have been removed from the market due to drug-induced liver injury released their toxic potential only after several doses of chronic testing in humans. However, a controlled microenvironment is pivotal for long-term multiple dosing experiments, as even minor alterations in extracellular conditions may greatly influence the cell physiology. We focused within our research program on the generation of a microengineered bioreactor, which can be dynamically perfused by an on-chip pump and combines at least two culture spaces for multi-organ applications. This circulatory system mimics the in vivo conditions of primary cell cultures better and assures a steadier, more quantifiable extracellular relay of signals to the cells.
For demonstration purposes, human liver equivalents, generated by aggregating differentiated HepaRG cells with human hepatic stellate cells in hanging drop plates, were cocultured with human skin punch biopsies for up to 28 days inside the microbioreactor. The use of cell culture inserts enables the skin to be cultured at an air-liquid interface, allowing topical substance exposure. The microbioreactor system is capable of supporting these cocultures at near physiologic fluid flow and volume-to-liquid ratios, ensuring stable and organotypic culture conditions. The possibility of long-term cultures enables the repeated exposure to substances. Furthermore, a vascularization of the microfluidic channel circuit using human dermal microvascular endothelial cells yields a physiologically more relevant vascular model.
Einleitung
Aktuelle Monolage oder Suspensionszellkultur-Assays für die Arzneimittelentwicklung, versäumen es, den menschlichen zellulären Mikroumgebung zu emulieren und damit zu einem raschen Entdifferenzierung und Funktionsverlust in primären humanen Zellkulturen. Gewebemodelle mit höherer physiologischer Relevanz sind erforderlich, um die Wirksamkeit und Sicherheit von Verbindungen vor Zutritt zu klinischen Studien vorherzusagen. Vor kurzem haben in vitro-Standardzellkulturtechniken von zweidimensionalen Schichtkulturen zu dreidimensionale mehrzellige Modelle entwickelt, mit dem Ziel, die in vivo Gewebemikroumgebung nachzuahmen. Diese Systeme wurden bereits wesentliche Verbesserungen gegen genauere Vorhersage der Wirkungsweise der Verbindungen 1,2 gezeigt. Weiterhin Anpassung der in vitro-Kulturbedingungen für die hoch spezialisierten Anforderungen von Zellen ist von besonderem Interesse.
Unter Standardbedingungen in vitro, eine Vielzahl von wichtigen cultur Parameter wie Nährstoff und Versorgung mit Sauerstoff, die Entfernung von Akkumulieren Produkte und mechanische Kraft auf die Zellen wirkt, oft nicht vollständig in den meisten Fällen überprüft wird. Viele Organe besitzen physiologisch relevanten Konzentrationsgradienten von Stoffen und gelösten Sauerstoff. Allerdings sind diese hoch reguliert und optimierten Bedingungen in deutlichem Widerspruch zu den unkontrollierbaren Diffusionsgradienten um Gewebe unter in vitro Bedingungen, was zu einer sehr instabilen Umfeld und die Begrenzung der Zellentwicklung 3. Somit mäßigere und insbesondere mehr quantifizierbar in vitro-Bedingungen sind erforderlich, um Zellen über längere Zeit zu halten lebensfähigen und differenziert. Perfundiert Systemen, bei denen Komponenten des Mediums werden regelmässig entnommen und ersetzt, sind oft besser charakterisiert und kontrollierbar als statische Kulturen hinsichtlich der direkten Umgebung des Gewebes. Unter statischen Bedingungen Diffusionsgradienten Zellsekrete und das Kulturmedium Nährstoffekönnte kultivierten Zellen 3 umgeben. Einführung in gut charakterisierten mittleren Flussraten um das Gewebe ermöglichen die Zellsekret mit dem Vollmedium durch Perfusion mischen. Dies ermöglicht die Erzeugung definierter zelluläre Mikroumgebung, um eine stabile Zell Phänotyp und metabolisierende Enzymexpression in der ganzen Testzeit: 4.
Jüngste Entwicklungen in der Multi-Organ-Chip (MOC) -basierte Systeme kombinieren die Vorteile eines kontrollierten Medium Umströmung konstruiert Gewebe mit den kleinen, mittleren und Zellmasse Anforderungen der Mikrobioreaktoren, was zu einer reduzierten Menge an Substanz während der Prüfung erforderlich ist. Mehrere Mikrofluidik-Systeme für die Gewebekultur wurden bisher 5,6 beschrieben. Tissue-Fluid-Verhältnisse innerhalb dieser Systeme spielen eine besonders wichtige Rolle bei der Simulation von physiologisch relevanten Zellübersprechen. Aufgrund technischer Beschränkungen, wie die Verwendung von externen Pumpen und Medienspeicher, thE insgesamt zirkulierenden Mediavolumen in den meisten Systemen ist zu groß im Vergleich zu den Gewebevolumen. Die Gruppe von Shuler et al. Waren die ersten, ein System eine ordnungsgemäße Verweilzeiten von Stoffen in den Zellkulturräumen und in vivo relevanten Gewebe-zu-Flüssigkeitsverhältnisse 7,8 zu entwickeln. Dies wurde durch die Skalierung des externen Reservoir auf eine Platte mit 96 Vertiefungen, die auch für die "anderen Geweben" Raum erreicht. Um die zirkulierenden Mediavolumen innerhalb unserer MOC Plattform zu minimieren, haben wir ein Schlauch On-Chip-Mikropumpe, wodurch die Notwendigkeit für externe Medien Schaltungen. Diese Mikropumpe in der Lage ist, das System mit einer wählbaren Anzahl von Medienfließgeschwindigkeiten und Scherbeanspruchungsgeschwindigkeit 9 zu betreiben. Mikrofluidische Kanalsystem von 500 um Breite und 100 um Höhe verbindet zwei standardisierte Gewebekulturflächen, die jeweils die Größe einer einzelnen Vertiefung einer Platte mit 96 Vertiefungen. Das Festhalten an der Größe der Industrie-Standard-Well-Plattes ermöglicht die Integration von bereits vorhandenen Gewebemodelle im Transwell-Format produziert. Weiterhin ist die vertikale Position der Transwell-Zellkultur-Einsätze einstellbar, so dass die Kultivierung der Gewebemodellen, die nicht nur direkt an den Fluidfluss ausgesetzt sind, können aber auch angehoben und von den Grundstrom abgeschirmt werden. Ebenso sind Luft-Flüssigkeit-Grenzfläche Kulturen möglich mit diesem System.
Das MOC-Plattform aus einem Polydimethylsiloxan (PDMS) Schicht 2 mm hoch ist und einen Glasobjektträger mit einer Grundfläche von 75 x 25 mm 2, die permanent durch Niederdruck-Plasmaoxidations gebunden sind, um die fluiddichte mikrofluidischen Schaltkreis zu bilden, hergestellt. Die PDMS-Schicht der jeweiligen Kanäle und Zellkulturabteile enthält, wird durch Standard-Weichlithographie und Replika Form 9 produziert. Die Mikrofluidik-Design der MOC in dieser Studie verwendet wurde, bestand aus zwei separaten mikrofluidische Schaltkreise pro Chip, die jeweils mit zwei Zell cultur Fächer durch ein Kanalsystem 100 & mgr; m hoch miteinander verbunden. Dies erlaubt die Leistung von zwei einzelnen zwei Gewebe Cokulturen mit einem Multi-Organ-Chip. Pumpfrequenzen wurden eingestellt, um mittlere Durchflussmengen von 40 ml / min zu erhalten.
Diese zweiGewebe MOC Gestaltung vorgesehen die Fähigkeit, eine Leber Sphäroid und eine Haut-Stanzbiopsie in getrennten Kulturräume Kokultur, wenn auch in einer gemeinsamen Medienschaltung unter physiologischen Flussbedingungen. Differentiated HepaRG Zellen wurden mit menschlichen Lebersternzellen (HHSteC) in einem Verhältnis von 24 zusammengefasst: 1, um eine homogene Sphäroide zu bilden. Dieses Verhältnis wurde als optimal herausgestellt, da in früheren Experimenten 10 beobachtet, obwohl fast das Doppelte der Anzahl der Leberzellen wurden verwendet, verglichen mit der in vivo Situation. Die Haut wurde in einer Luft-Flüssigkeit-Grenzfläche in einem Transwell-Zellkultureinsatz kultiviert, so dass die topische Substanz Belichtung. Diese Gewebemodelle wurden für 28 d kokultiviertays im MOC, um die Vollständigkeit des Systems zu demonstrieren. Weiterhin wurde die mikrofluidische Kanalschaltung der Chips vollständig humane dermale mikrovaskuläre Endothelzellen (HDMEC) bedeckt, um das Gefäßsystem genauer zu simulieren.
Protokoll
HINWEIS: Human Jugend Vorhaut wurde mit Einwilligung nach Aufklärung und Ethik-Zulassung (Ethic Ausschuss Charité Universitätsmedizin, Berlin, Deutschland), in Übereinstimmung mit den einschlägigen Gesetzen, von einem Kinderchirurgie nach Routine-Beschneidung.
1. Herstellung von Gewebeäquivalenten zum Anbau in der MOC
- Aggregieren HepaRG und HHSteC in hängenden Tropfen Platten zu Leber Sphäroiden zu generieren.
- Um die Trypsinisierung von HepaRG Zellen in Zellkulturflaschen gewachsen zu erreichen (75 cm 2), entfernen Sie das Medium von konfluenten, differenziert Monolayer-Kulturen, waschen mit PBS zweimal, und 3 ml 0,05% Trypsin / EDTA. Inkubieren für 3 bis 5 min bei 37 ° C und stoppt die Reaktion durch Zugabe von 6 ml Trypsininhibitor.
- Centrifuge HepaRG Zellen bei 150 xg für 5 min, zu entfernen Überstand, Zellpellet in 1 ml HepaRG Zellkulturmedium, und zählen Zellen. Die Lebensfähigkeit der Zellen sollte> 90% sein.
- InUm die Trypsinisierung von HHSteC Zellen zu erreichen, entfernen Sie das Medium von Monolayer-Kulturen, waschen mit PBS zweimal, und 3 ml 0,05% Trypsin / EDTA. Inkubation für 5 min bei 37 ° C und stoppt die Reaktion durch Zugabe von 6 ml Trypsininhibitor.
- Zentrifugieren Sie die HHSteC Zellen bei 150 xg für 5 min, zu entfernen Überstand, Zellpellet in 1 ml HepaRG Zellkulturmedium, und zählen Zellen.
- Kombinieren HepaRG und HHSteC in einem Verhältnis von 24: 1 in HepaRG Zellkulturmedium. Um dies zu tun, stellen Sie die Zellzahlen durch Verdünnen Zellsuspensionen in HepaRG Zellkulturmedium und fügen Sie 1 x 10 5 Zellen / ml HHSteC bis 4,8 x 10 6 Zellen / ml HepaRG Zellen. Vorsichtig mischen.
- Bereiten Sie eine Fallplatte hängen durch Zugabe von 2 ml PBS zu dem hängenden Tropfen und Aufnahmeplatte.
- Je 20 ul der Zellsuspension in jede Vertiefung der Hängetropfenplatte. Immer bereiten rund 10% mehr hängende Tropfen, als Sie brauchen, um Aggregate zu holen, da einige Aggregate duri verlorenng den Vorgang. Die Platte vorsichtig in einem 37 ° C Inkubator. Warten 48 h für die Sphäroide zu bilden.
- Um die Sphäroiden abrufen, lesen Pipettenspitzen mit breiten Spitze Endungen verwenden oder schneiden die Spitzen der 1 ml Pipettenspitzen mit einem sterilen Messer, um die Öffnung auf etwa 2 bis 3 mm zu erweitern. Verwenden Sie diese Pipettenspitzen, um die Kügelchen ohne Unterbrechung mit ihnen umgehen.
- Abwaschen Sphäroide vorsichtig von der Hängetropfenplatte durch wiederholtes Hinzufügen von 1 ml Medium auf die Oberseite der Vertiefungen des hängenden Tropfens Platte unter Verwendung einer Pipette. Waschen Sie die Platte, bis alle Sphäroiden abgefallen. Sphäroide sind etwas scheibenförmig mit einem mittleren Durchmesser von 300 bis 400 & mgr; m und einer Höhe von 200 bis 300 um an dieser Stelle.
- Sammeln Sie die Kügelchen in der Aufnahmeplatte und übertragen Sie sie auf 24-Well-Ultra-Low-Befestigungsplatten mit maximal 20 Kügelchen pro Vertiefung mit den vorbereiteten Pipettenspitzen. Stellen Sie die Medienvolumen in jede Vertiefung 0,5 ml. Verwenden Sie 20 Aggregate inoculate eine MOC Schaltung, eine Miniaturisierung Rate von 1 / 100.000 in Bezug auf in vivo Zellzahlen zu erhalten.
- Die Sphäroide bei 37 ° C und 5% CO 2 bis zur weiteren Verwendung in der MOC. Länger als drei Tage vor der Verwendung nicht lagern die Sphäroide, um die Vergleichbarkeit zu gewährleisten. Pflegen Sie die Aggregate für mindestens einen Tag im Ultra-Low-Befestigungsplatten, die homogene Sphäroiden abzurufen.
- Verfolgen Sie eine von zwei Ansätzen zur Hautgewebe Äquivalente zu erwirtschaften: die Verwendung von Stanzbiopsien (1.2.1) oder die Verwendung von fertigen in vitro Gewebemodelle (1.3.1).
- Schneiden Transwells mit einer Glühlampe Messer unter dem Bügel zu 96-Well-Zellkulturplatten und Speicher unter sterilen Bedingungen bis zur weiteren Verwendung vor.
- Sterilisieren Vorhaut Proben in 80% Ethanol für 30 Sekunden und schneiden Sie den Ring offen. Proben sollten eine mittlere Höhe von 2 mm aufweisen.
- Verwenden Sie eine Biopsie Schlag in Biopsien von 4,5 mm Durchmesser geschnitten, um eine gleiche miniaturiza erhaltention-Verhältnis sowohl für Leber und Haut. Laden Sie die Biopsien in die vorbereitete 96-Loch-Transwell mit einer Pinzette fügt. Achten Sie darauf, die Biopsien mit der epidermalen Seite nach oben zu positionieren.
- Platz Zellkultur-Einsätze mit Biopsien in einer Aufnahmeplatte, die HepaRG Zellkulturmedium und speichern bei 37 ° C und 5% CO 2 bis zur weiteren Verwendung im MOC. Speichern Sie keine Proben, die länger als 2 bis 3 Std.
- Integrieren Sie fertige In-vitro-Hautmodelle, von verschiedenen Anbietern gekauft, in das MOC, um sicherzustellen, dass sie in 96-Well Transwell-Format sind. Verwenden der durch den Hersteller oder, wenn eine Co-Kultur mit einem anderen Gewebe wird in einem weiteren Schritt vorgesehen ist, mit einem Minimalmedium Abstützen beider Gewebe geliefert Zellkulturmedium. Testen Sie die jeweiligen Minimalmedium in vor statischen Experimenten für seine Fähigkeit, das Gewebe zu unterstützen.
- Abrufen Hautmodelle aus der Halteplatte und schneiden Sie die 96-Loch-Einsätze unterhalb der Halterung mit einer Glühlampe Messer.
- Setzen Sie die Einsätze in die Aufnahmeplatte und Speicher bei 37 ° C und 5% CO 2 bis zur weiteren Verwendung im MOC. Speichern Sie keine Proben, die länger als einen Tag.
2. MOC Fabrication
- Mischen der PDMS und Härter in einem Verhältnis von 10: 1 (v / v) und gebe die Mischung unter Vakuum für 15 min, um Luftblasen zu entfernen.
- Inzwischen Behandlung einer Polycarbonat-Platte mit der Siliziumkautschukadditiv bei 80 ° C für 20 min.
- Legen Teflon Schrauben in entsprechende Löcher der Deckplatte, die vier PDMS freien Zellkulturfächer und die sechs PDMS Membranen, 500 um dicker der Mikropumpe zu schaffen,.
- Stecken Sie das vorbereitet Deckplatte mit dem Master-Form der beiden mikrovaskuläre Schaltungen und injizieren die entgaste PDMS. Darauf achten, dass Luftblasen in das System zu integrieren. Wenn Blasen entstehen, versuchen, sie durch Kippen des Geräts entfernen.
- Inkubieren des Systems bei 80 ° C für 60 min, um die PDMS-Schicht auszuhärten.
- Entfernen Sie die Mutterform und die Teflon-Schrauben aus dem Gerät und verbinden Sie die PDMS-Schicht auf einem Glasobjektträger mit einem 75 x 25 mm 2-Bilanz mit Niederdruck-Plasmaoxidations.
- Schrauben Spezialgewinde MOC Adapter an allen vier Zellkulturabteile der Deckplatte.
- Schließen Sie Spritzen mit Kulturmedium zu Luer x ¼-28 männlich Adapter und schrauben Sie sie auf die MOC-Adaptern der Deckplatte.
- Spritzen Sie das Medium in den mikrofluidischen Kreis, indem Sie wiederholt nach unten schieben und ziehen Sie die Spritzen Kolben.
- Überprüfen Sie die korrekte Befüllung der Kanäle mit Medium unter dem Mikroskop.
3. Endothelialisierung des MOC
- Vor der MOC, spülen jedes MOC Kreis mit endothelialen Zellwachstumsmedium endothelializing und inkubieren sie statisch für drei Tage bei 37 ° C und 5% CO 2.
- Sterilisieren Sie die MOCs mit einem Ethanol abwischen und sie unter einer Sterilbank. Ichn Zusätzlich zu sterilisieren zwei Paar Zangen und zwei Sechskantschlüssel für die weitere Verwendung.
- Lösen Sie die Kappen der Gewebekulturraum des MOC mit den Sechskantschlüssel und entfernen Sie die Kappen mit der Pinzette. Nach dem Einlegen der Medium, Verschlüsse wieder auf den MOCs auf die gleiche Weise.
- Um die Trypsinisierung von humanen dermalen mikrovaskulären Endothelzellen (HDMEC) zu erzielen, entfernen Sie das Medium aus den Monolayer-Kulturen, waschen mit PBS zweimal, und 3 ml 0,05% Trypsin / EDTA. Inkubation für 5 min bei 37 ° C und stoppt die Reaktion durch Zugabe von 6 ml Trypsininhibitor.
- Zentrifugieren Sie die HDMEC bei 220 xg für 5 min, zu entfernen Überstand, Zellpellet in 1 ml der endothelialen Zellwachstumsmedium und Zellen zu zählen. Die Lebensfähigkeit der Zellen sollte> 90% sein.
- Stellen Sie die Zellzahl in der Zellsuspension bis zu einer Endkonzentration von 2 x 10 7 Zellen / ml von mit Endothelzellen-Wachstumsmedium verdünnt wird und übertragen 250 ul esEine 1 ml-Spritze. Anwenden dieses Konzentration der Zellen an die MOC, die Miniaturisierung von 1 / 100.000 für alle Organe zu halten.
- Verbinden Sie die Spritze mit einem Luer x ¼-28 Stecker-Adapter, vertreiben die Luft aus dieser Armatur, und schrauben Sie ihn in eine spezielle Gewinde MOC-Adapter. Schließen Sie den Adapter an eine der beiden Kammern jedes MOC Kreis.
- Schließen Sie eine leere Spritze auf die gleiche Weise zu der zweiten Kammer des MOC Kreis.
- Injizieren Sie die Zellen gleichmäßig nach unten drücken und nach oben ziehen die beiden Spritzenkolben mehrmals in einer fortlaufenden Weise. Steuern Sie die Infusion von Zellen unter dem Mikroskop.
- Inkubieren MOC bei 37 ° C und 5% CO 2 unter statischen Bedingungen für 3 Stunden, damit sich die Zellen an den Kanalwänden zu haften.
- Entfernen Sie den Chip aus dem Inkubator, legen Sie sie unter einem Laminar-Flow-Bank, und ersetzen Sie die Spritzen und die MOC-Adapter mit Spezialgewinde MOC Zellkulturräume.
- Fügen Sie 400 ul frisches Medium mit einem comAbteilung jedes MOC Kreis und lassen Sie es bündig durch die Kanäle durch hydrostatischen Druck. Danach ersetzen Sie das Medium in beiden Fächern mit 300 ul frisches Medium.
- Schließen Sie die Fächer mit Kappen, wie in 3.1.2 beschrieben.
- Schließen Sie den Chip an die Pumpensteuerung. Passen die Pumpgeschwindigkeit auf eine Frequenz von 0.475 Hz und pflegen den Chip bei 37 ° C und 5% CO 2.
- Ersetzen Sie das Medium jedes MOC Fach alle ein bis zwei Tage und Überwachung der Zellmorphologie durch Lichtmikroskopie.
4. Laden des Chip-
- Stellen Sie das MOC unter der Sterilbank und öffnen Sie sie, wie in Schritt 3.1.2 beschrieben.
- Entfernen Sie die Medien aus den Zellkulturräumen und ersetzen Sie es mit 300 ml frisches HepaRG Zellkulturmedium.
- Übertragen Sie 20 vorgeformten Kügelchen auf eine Gewebekulturraum jedes MOC Schaltung mit den Pipettenspitzen mit einer breiten Öffnung (siehe Schritte 1.1.8 / 9). Schließen Sie die cap mit einer Pinzette und Sechskantschlüssel.
- Transfer 96-well Zellkultureinsätze, die Hautäquivalente mit dem übrigen Zellkulturraum jedes MOC Schaltung mit einer Pinzette. Kümmern zu Blasenbildung unter der Membran des Hautäquivalents vermeiden. Um dies zu tun, legen Transwells an einer leicht geneigten Winkel und sanft nach unten drücken. Entfernen überschüssigen Mediums um die Transwell wird von unten mit einer Pipette eingeschoben.
- Schließen Sie den Deckel mit einer Pinzette und Sechskantschlüssel.
5. Anschluss des Chip an die Pumpensteuerung
- Stellen Sie die Betriebsparameter in den Steuergeräten für die Werte erwünscht. Ändern Luftdruck von 0 bis 8000 mbar, Vakuum von 0 bis -800 mbar und Pumpfrequenz von 0,24 bis 2,4 Hz. Stellen Sie die Pumprichtung nach rechts oder links.
- Die MOC enthält Gewebeäquivalenten entfernen unter der Sterilbank und an die Pumpensteuergeräte.
- Im Anschluss an die numeratIonen auf den Rohren, legen Sie Luftdruckschläuche an die entsprechenden Armaturen auf der MOC.
- Pflegen Sie die MOC bei 37 ° C und 5% CO 2 im Brutschrank oder, im Falle von lebendem Gewebe-Bildgebung, mit dem MOC Support, um den Chip auf 37 ° C erwärmen und zu pflegen den Chip außerhalb des Inkubators. Verwenden Sie den erwärmten Träger, um Zellen im MOC unter einem Standardmikroskop zu kultivieren.
6. Darstellende Medien Börsen, Sampling Medien und Exposition gegenüber Stoffen
- Eine regelmäßige Austausch von Medien jeden Tag oder jeden zweiten Tag, unter Berücksichtigung der Art der Gewebekultur und die metabolische Aktivität der Zellen.
- Rufen Sie die MOC aus dem Inkubator und unter dem Mikroskop, um Medien Durchflussraten zu steuern und auf Kontamination zu beobachten ist.
- Trennen Sie das MOC von der Pumpensteuereinheit, indem Sie das Luftdruckschlauch. Sterilisieren Sie die MOC mit Ethanol Tücher und setzt es unter der Sterilbank.
- Öffnen Sie die Gewebekultur-Datei herunterladenartment enthaltend die Leber Sphäroide wie in Schritt 3.1.2 beschrieben.
- Entfernen Sie bis zu 200 & mgr; l aus dem Fach mit einer Pipette ohne Unterbrechung der Sphäroide und speichern Sie das Medium in eine leere Vertiefung einer Deepwell-Platte. Analysieren Sie den Medien Probe direkt oder schließen Sie die Deepwell-Platte und die Medien Proben bei -80 ° C für weitere Analysen zu speichern.
- Ersetzen Sie das Medium des MOC mit bis zu 250 & mgr; l frisches Zellkulturmedium und schließen Sie den Deckel. Der Unterschied in der Menge des Mediums entfernt und ersetzt Konten für den Verlust aufgrund von geringen Mengen Austreten des Chips beim Schließen des Systems.
- Öffnen Sie den Deckel des Zellkulturraum halten die Hautäquivalente an dieser Stelle für die Gewebe Unversehrtheit zu überprüfen. Darauf achten, dass Luftblasen in das System einzuführen. Schließen Sie den Deckel.
- Den Schlauch der Pumpe Steuereinheit mit der MOC, gemäß Schritt 5.3, und legen Sie das MOC in einem Inkubator.
7. Analysieren Tägliche Medien Proben und Führen On-line-Analyse
- Analysieren Gewebekulturleistung online mit Live Cell Imaging oder offline, durch die Analyse der täglichen Medienproben. Führen Sie diesen durch Standardroutine enzymatische Tests (zB Laktat-Dehydrogenase (LDH) Aktivität) oder ELISA (zB Albumin-Konzentration). Ein Online-Analyse im Folgenden beschrieben.
- Entfernen Sie die Medien des endothelialisiert MOC, wie in den Schritten 6.1.1 bis 6.1.4 beschrieben, und ersetzen Sie es in beiden Gewebekulturfächer mit 200 ul 10 ug / ml Fluorophor konjugiert acetyliert Low-Density Lipoprotein (LDL) Lösung (in verdünnter Zellkulturmedien).
- Schließen Sie die Kappen. Schließen Sie das MOC in die Pumpensteuerung gemäß Schritt 5.3 und pumpen es für 30 Minuten bei 0.475 Hz, um die Lösung gleichmäßig in der mikrofluidischen Kreis zu verteilen.
- Stoppen Sie die Pumpen und inkubieren Sie die MOC statisch 3,5 Stunden lang bei 37 ° C und 5% CO 2.
- Ähnliche to Schritt 7.2, entfernen Sie das acetylierte LDL-Lösung aus beiden Fächern und ersetzen Sie es mit 400 ul frisches Medium in einer der beiden Kammern.
- Warten Sie 3 bis 5 Minuten, um den hydrostatischen Druck fahren des Mediums durch den mikrofluidischen Kanal Stromkreise an.
- Ersetzen Sie das Medium, das durch die mit 300 ul frisches Medium durchströmt hat und auch die zweite Gewebekulturraum zu füllen mit 300 ul frisches Medium.
- Schließen Sie das MOC, gemäß Schritt 3.1.2. Legen Sie es unter einem Fluoreszenzmikroskop und beobachten das Zellwachstum und die Lebensfähigkeit.
- Setzen Sie den Bunt MOC zurück in den Inkubator zu Anbau weiter. Entfernen Sie den Fleck aus den Zellen austritt mit jeder folgenden Medienwechsel.
8. Rufen Gewebeäquivalenten aus dem MOC und Führen Endpunktanalysen
- Abrufen Gewebeäquivalente aus dem MOC am Ende des Experiments für die Endpunktanalysen.
- Um die Leber und Haut e Abrufenquivalents von der MOC, entfernen Sie die Medien aus jeder Gewebekulturraum, wie in den Schritten 6.1.1 bis 6.1.4 beschrieben.
- Entfernen Sie die 96-Loch-Zellkultur-Einsätzen die Haut vor der MOC mit einer Pinzette enthält. Ziehen Sie die Membran vorsichtig vom Einsatz durch Greif es auf der einen Seite mit einer Pinzette und ziehen Sie es auf. Darauf achten, dass das Hautäquivalent an dieser Stelle zu verlieren.
- Frieren Sie die Membran hält die Hautäquivalents in Kryo-Einbettmasse und bewahren Sie sie bei -80 ° C bis zur weiteren Analyse.
- Entfernen Sie die Leberäquivalente in ähnlicher Weise aus Gewebekulturraum durch Pipettieren sie mit geschnittenen Pipettenspitzen (siehe Schritt 1.1.8 / 9).
- Betten Sie die Leber Sphäroiden in Kryo-Einbettmasse. Achten Sie darauf, nicht zu viel Flüssigkeit zu übertragen und überschüssige Flüssigkeit mit einer Pipette zu entfernen. Nachdem Sie die Sphäroiden auf die Einbettmasse und Entfernen des Mediums, fügen Sie weitere Kryo-Verbindung auf die Oberseite der Sphäroide vollständig umschließt sie.
- Frieren Sie die Leberäquivalente und bewahren Sie sie bei -80 ° C bis zur weiteren Analyse.
- Führen Endpunktanalyse, indem die Gewebeäquivalenten in einer Kryo-Mikrotom bis 8 um Abschnitte und Färbung für gewebespezifische Marker, wie in den vorangegangenen Protokolle 10 beschrieben.
Ergebnisse
Standard-in vitro-Zellkulturen sind unter statischen Bedingungen durchgeführt, wodurch die Diffusion von Sauerstoff und Nährstoffzufuhr zu den Geweben. Fluidische Systeme und zeigt eine verbesserte Versorgungs Eigenschaften, sind oft durch ihre großen mittleren Anforderungen behindert, mit unphysiologisch hoch mittel, um Gewebe-Verhältnisse. Somit sind Metaboliten verdünnt und die Zellen sind nicht in der Lage, ihre Umgebung zu konditionieren. Die in dieser Studie präsentierten MOC verbindet zwei getrennte Gewebekulturfächer, die jeweils die Größe einer einzelnen Vertiefung einer Standard-96-Well-Platte durch eine mikrofluidische Kanalsystem. Die geringe Größe des Systems und der Integration der Pumpe auf dem Chip ermöglicht dem System, bei Medienvolumen von nur 200 bis 800 & mgr; l zu arbeiten. Dies entspricht einer Gesamt systemische Medium, um Gewebe-Verhältnis von 8: 1 bis 31: 1, jeweils für die Leber und das Hautgewebe Cokulturen (mit einer Gesamtgewebevolumen von etwa 26 ul). Die gesamte extrazelluläre Flüssigkeitsvolumen in ein Mann mit einem Gewicht von 73 kg 14,6 L ist, dessen interkapilläre Fluidvolumen 5,1 L, die zu einer physiologischen extrazellulären Flüssigkeit zu Gewebe-Verhältnis von 1: 4. Daher ist die Menge des Druckmaterials im gesamten Umlaufsystem im MOC noch größer als bei der physiologischen Situation; und noch stellt es die kleinste Mahlkörper um Gewebe Verhältnis bisher für Multiorgansysteme 5 gemeldet. Als Industrie-Standard-Gewebekulturformate erhalten bleiben, sind die Forscher in der Lage, bestehende und bereits validierten statischen Gewebemodelle in einem gemeinsamen Flüssigkeitsstrom zu kombinieren. 1 zeigt die schematische Darstellung einer Versuchsanordnung möglicher MOC einzelnen Gewebe oder Multi-Tissue Co-Kulturen. Primäre Gewebebiopsien und in vitro -generated Gewebeäquivalenten von Zelllinien oder primären Zellen können oder indem sie direkt in die Gewebekultur kultiviert Fächer entweder mit 96-Loch-Zellkultureinsätze werden. Da die Kanalsystem Verbinden der Zellkulturabteile nur 100 μm hoch ist, wird Gewebe-Äquivalente mehr als diese Dimensionen innerhalb der Kulturfächer halten. Die Endothelialisierung des MOC Kreis mit primärem HDMECs ermöglicht einen weiteren Schritt hin zu mehr physiologischen Kulturbedingungen durch die Bereitstellung einer biologischen Gefäßstruktur.
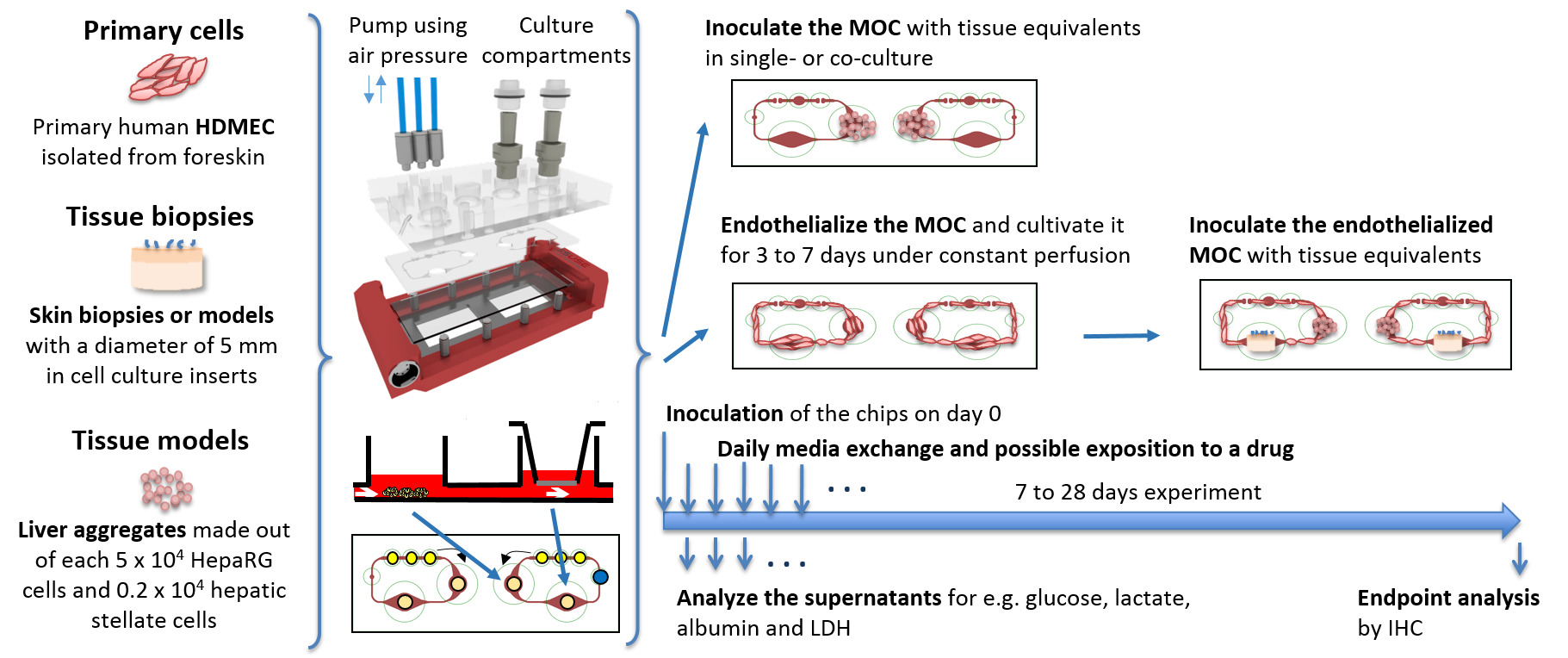
Abb. 1: Schematische Darstellung der MOC Kulturen Tissue Mittel werden unter Standard-in-vitro-Bedingungen hergestellt, in das MOC impft und als einzelne Kulturen oder Co-Kulturen unter dynamischen Bedingungen kultiviert. Tägliche Medienproben und Endpunktanalysen durchgeführt. Der Luftdruck zum Antrieb der Pumpe wird durch die drei blauen Röhren zum MOC von oben verbunden ist. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
Nach der Endothelialisierung Protokoll wird eine konfluente HDMEC Abdeckung des mikrofluidischen Kanal Schaltung innerhalb von vier Tagen nach der dynamischen Kultur erhalten wird, wie in 2 gezeigt. Die Zellen leicht haften an den Wänden der MOC Kanals schaffen eine konfluente Monoschicht und länglich entlang der Scher Stress (2B). Ferner decken Zellen den gesamten Umfang der Kanäle, wie bereits 9 angegeben. Nach vier Tagen Kultivierung wurde keine weitere Änderung in endothelial Morphologie beobachtet, bis zum Ende der Kultur.
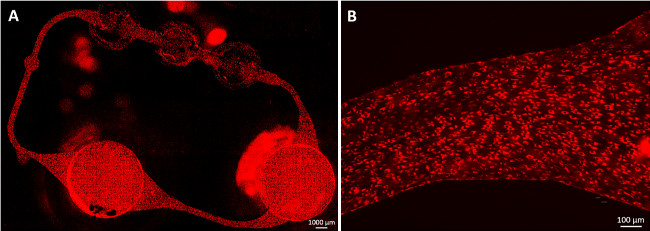
Fig. 2: endothelialisiert MOC Kanäle Humane dermale mikrovaskuläre Endothelzellen (HDMEC) gebildet eine konfluente Monoschicht in der mikrofluidischen Schaltung. Die Zellen wurden mit acetyliertem LDL nach 23 Tagen des MOC Kultur gefärbt. (A) Das ganze microvascular Schaltung wurde mit Zellen und (B) Zellen entlang der Scherspannung längliche bedeckt. Maßstabsbalken: (A) 1000 um und (B) 100 um.
In einem weiteren Experiment werden konsistente scheibenförmigen Leberzell Sphäroide aus HepaRG und HHSteC während zwei Tagen hängenden Tropfen Kultur gebildet, wie dies Modellsystems wurde zuvor als geeignet für den Arzneimittelstoffwechsel berichteten Studien 11-13. Zu Demonstrationszwecken wurde ein Gewebekultur-Kammer jeder MOC Schaltung 20 Sphäroide in 96-Well-Zellkulturplatten ausgesät und Gewebe wurden über 14 Tage unter dynamischen Bedingungen kultiviert unter Verwendung von nicht-endothelialisiert MOCs. Eine beliebige Anzahl von Aggregaten oder Höhe der Primärmaterial kann entweder direkt in die Fächer oder unter Verwendung von Zellkultureinsätzen integrieren. Immunfluoreszenzfärbung der Sphäroide nach dem Abrufen aus dem MOC zeigt eine starke, homogene Ausdruck für liver-typische Cytokeratin 8/18 und Phase I metabolisierende Enzyme Cytochrom P450 3A4 und 7A1 (3A und 3B). Anfärbung kanalikulären transporter Multi-Drug-Resistenzprotein 2 (MRP-2) zeigte eine polarisierte Phänotyp und die Existenz von rudimentären Gallenkanälchen artigen Netzwerken (3C).
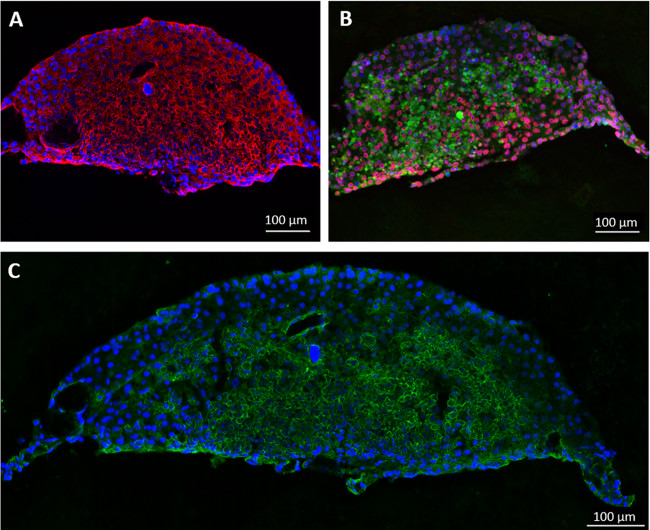
Abbildung 3 :. Die Kultivierung der menschlichen künstliche Leber Mikrogewebe in den MOC. Liver Aggregate für 14 Tage im MOC kultiviert wurden (A) Cytokeratin 8/18 (rot) und (B) Cytochrom P450 3A4 (rot) und 7A1 (grün) gefärbt. (C) Die Expression von kanalikulären Transporter MRP-2 (grün), blau Kernfärbung. Maßstabsbalken: 100 um.
Da die Produktion von Albumin ist eine wesentliche Voraussetzung für Lebergewebekulturen, hat es been ausgewählt, um Leber-typische Aktivität im MOC überwachen. Analysieren täglichen Medienproben für Albuminproduktion eine deutliche Steigerung der Produktionsrate in MOC Kulturen im Vergleich zu statischen Kulturen (Figur 4) und die Werte in der Literatur 11 gemeldet. Der Anstieg der Albuminsyntheserate könnte die erhöhte Sauerstoff- und Nährstoffversorgung im MOC Kulturen zurückzuführen. Folglich ist die Lage, MOC Leber Aggregate über eine Kulturdauer von 14 Tagen in einer metabolisch aktiven Zustand aufrechtzuerhalten, Verbesserung leber typisches Verhalten, wie Albumin Produktion.

Abbildung 4: Vierzehn-Tage-Leber Sphäroid Leistung im MOC Albumin Produktion von Leber einzigen Gewebekulturen in der MOC und in statischer Kultur.. Daten sind Mittelwerte ± SEM (n = 4).
Subsystemic chronischen Toxizität Erprobung chemikalien und Kosmetika an Tieren erfordert 21 bis 28 Tagen nach der Exposition, wie von der OECD-Richtlinie definiert nicht. 410 "bei wiederholter Gabe dermale Toxizität: 21/28 tägigen Studie." Die langfristigen Haut Leber Co-Kulturen werden hier bis zu 28 Tage veranschaulicht, mit regulatorischen Anforderungen gerecht zu werden. Ein Luft-Flüssigkeits-Grenzfläche ist für spätere Hautsubstanzen Belichtung durch Kultivieren von Hautbiopsien in 96-Well-Zellkultur-Einsätzen versehen ist. Die Co-Kultur-Experiment ist beispielhaft in endothelialisiert MOCs durchgeführt, um zu beweisen, ob ein Drei-Gewebe Co-Kultur in einer gemeinsamen Medien Schaltung kann lebensfähig und über 28 Tage metabolisch aktiv gehalten werden.
Analyse der LDH-Aktivität in den Medien-Überstände zeigten eine stetig abnehmende Ebene in den ersten acht Tagen der Kultur, die bei etwa 80 U / l danach (5) konstant blieb. Dies zeigt eine künstliche, aber stabile Gewebeumsatz im System zu späteren Zeitpunkten. Vergleicht man die drei Teil Kokultur Lebereinzel-tissue und Leber-endotheliale Co-Kultur-Experimente konnte eine signifikant verminderte LDH Ebene gefunden werden, vor allem in den ersten Tagen in Kulturen ohne die Haut. Der Zelltod innerhalb dieser ersten Periode hoher LDH-Aktivität erfolgte vor allem in der Hautkulturabteil als Haut einzigen Gewebe MOC Kulturen zeigte (Daten nicht gezeigt). Dies könnte an der verwundeten Umgebung der Biopsie als Ergebnis des Stanz der Haut sein.
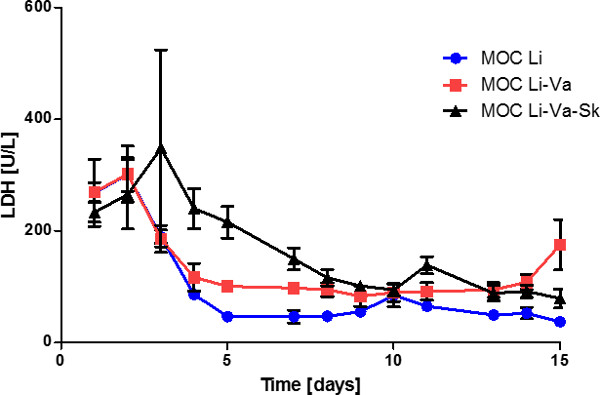
Abbildung 5: Fünfzehn Tage Gewebeentwicklung im MOC LDH-Aktivität in den Medienüberständen von Leber einzigen Gewebekulturen (MOC Li), Leber-Kulturen in endothelialisiert MOCs (MOC Li-Va) und Leber-Haut Co-Kulturen in endothelialisiert MOC (MOC Li. -Va-Sk). Daten sind Mittelwerte ± SEM (n = 4).
Während der 28-tägigen Züchtungsperiode, Leber Sphäroiden auf die Unterseite des MOC a geklebtnd Zellen entwickelte sich aus und bilden eine mehrschichtige Verbindung zwischen benachbarten Kügelchen. Das ist nicht zu behindern Gewebe Funktionalität. Endpoint-Analyse mittels Immunfluoreszenz zeigte, dass Leber-Sphäroiden noch nach 28 Tagen MOC Kokultur metabolisch aktiv, wie von Cytochrom P450 3A4-Färbung (6A) gezeigt. HHSteC wurden während der gesamten Leberäquivalent verteilt, wie von Vimentin Färbung (6B) gezeigt. Eine Erhöhung der Vimentin Färbeintensität könnte in Bereichen, in denen Zellen waren aus Sphäroiden gewachsen zu beachten. Färbung für von Willebrand-Faktor (vWF), daß Endothelzellen, nicht tief in das Gewebe eingedrungen ist, waren aber in direkten Zell-Zell-Kontakt mit den äußeren Hepatozyten (6C).
Immunohistochemie-Färbung der Hautbiopsien zeigten eine Expression von Tenascin C und Kollagen IV in der Basalmembran (6D), während die Färbung des statischen Kontrolle zeigte elevated Ebenen der Tenascin C (6E). Tenascin C wurde gezeigt, dass bei der Wundheilung, entzündlichen Prozessen und Fibrose hochreguliert, was vermuten lässt induzierten fibrotischen Prozessen in statische, nicht aber in dynamischen Kulturen 14,15.
Stabile Zell-Lebensfähigkeit und Funktionsfähigkeit von Geweben nach 28 Tagen Cokultur im MOC beweisen, dass das System in der Lage ist, eine Kombination von bis zu drei Gewebe in einer gemeinsamen Medienschaltung aufrechtzuerhalten. Primärzellen sowie Gewebemodelle und Biopsien, gleichzeitig im MOC System gepflegt werden.
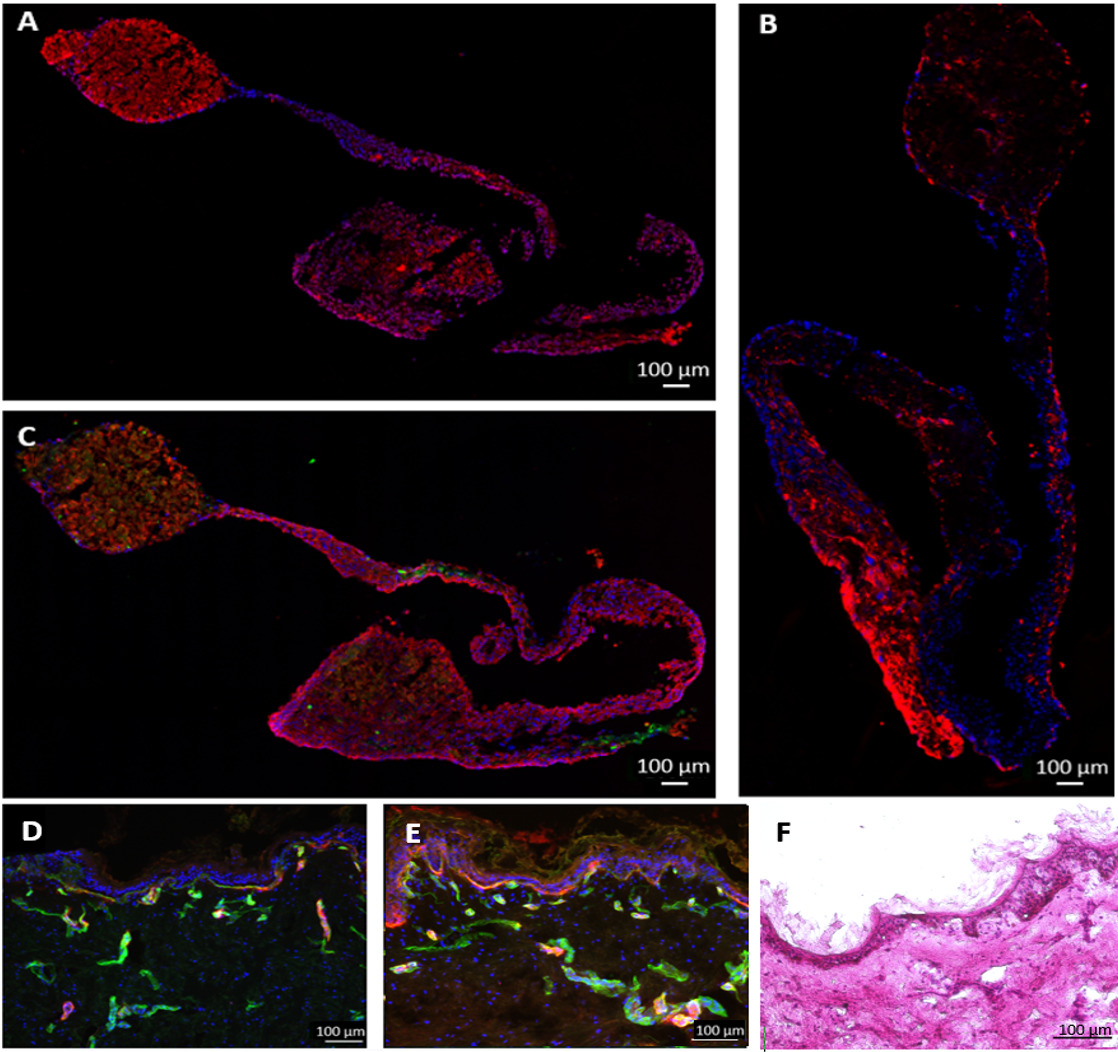
Fig. 6: Entwicklung mehrGewebeKulturen über 28 Tage Liver Äquivalente und Hautbiopsien wurden in eine endothelialisiert MOC und Zellfunktionalität kultiviert wurde durch Immunfärbung von (A) Phase I gezeigt Enzymen Cytochrom P4503A4 (rot), (B) Vimentin (rot), (C) Cytokeratin 8/18 (rot) und vWF (grün) im Lebergewebe. Hautbiopsien für 28 Tage (D) in der MOC oder (E) unter statischen Bedingungen kokultiviert wurden Tenascin C (rot) und Kollagen IV (grün), blau Kernfärbung gefärbt. (F) H & E-Färbung der Haut nach 28 Tagen MOC Kultur. Maßstabsbalken: 100 um.
Diskussion
Die hier beschriebene MOC-Plattform stellt ein stabiles und leistungsfähiges Werkzeug für den Anbau von Geweben unterschiedlicher Herkunft bei dynamischen Mediumströmungsbedingungen über längere Zeiträume Kultur 10,16. In diesem Beispiel wurde die Plattform verwendet, um primäre Zellen (HDMEC), Gewebeäquivalente aus einer Zelllinie erzeugt (Leber Aggregate) und eine Co-Kultur des vorgenannten mit einer Gewebebiopsie zu kultivieren. Das MOC konnte die drei Teil Kokultur für bis zu 28 Tage in einem kombinierten Mittelkreislauf aufrecht zu erhalten. Nach bestem Wissen der Autoren ist dies das erste Mal, ein Multi-Gewebe Kokultur einschließlich Biopsien, primären Zellen und Zelllinien wurde über vier Wochen durchgeführt.
Einer der größten Nachteile von mikrofluidischen Systemen ist die Affinität von kleinen Molekülen auf dem Oberflächenmaterial des fluidischen Schaltung haften. Da das Verhältnis Oberfläche zu Volumen insbesondere in mikrofluidischen Systemen hoch ist, wird dieser Effekt noch deutlicher 17 . Die stabile HDMEC Deckung der Kanäle, hier eingeführt wird, könnte als eine biologische Barriere, die das Anhaften von Molekülen an die MOC handeln. Ferner kann es als hemokompatible Gefäß für ganze Blutzirkulation dienen und verhindern die Blutgerinnung. Jedoch ist die Verwendung von Vollblut als Medium Substitution nicht durchführbar als eine vollständige Vaskularisierung der Organäquivalente ist noch nicht erreicht worden. Bestehende Arbeiten an der Gefäßversorgung von in vitro -generated Gewebe ist viel versprechend und weist den Weg für weitere Studien 18,19.
Es ist wohlbekannt, dass Hepatozyten neigen, ihre Leber-spezifische Funktionen über die Zeit unter statischen zweidimensionalen in-vitro-Kulturbedingungen 20 verlieren. Metabolisierenden Enzymen, wie das Cytochrom P450-Familie, sind von besonderer Bedeutung, wenn der Stoffwechsel einer bestimmten Medikament untersucht werden soll. Cytochrom P450 3A4, ein Enzym, das an der Biotransformation von vielen Fremdstoffen verwandt und Cytochrom-P450-7A, which in Gallensäuresynthese im MOC kultiviert über 14 Tage beteiligt sind, wurden in Leber exprimiert Aggregate. Dies weist auf die Erhaltung einer metabolisch aktiven Phänotyp, so dass für Studien zur Metabolisierung. Die erhöhte Albuminproduktion von Aggregaten in der MOC im Vergleich zu statischen Kulturen ist ein weiteres Indiz für eine ausreichende Kulturbedingungen. Die während dieser Studie beobachtet Albuminproduktionsraten waren vergleichbar oder sogar höher als von mikrofluidischen Chips, einschließlich HepG2 Zellen 21 erhalten zuvor berichteten Werten - 23, jedoch Werte erreichte nicht diejenigen von primären humanen Hepatozyten 24. Weiterhin MOC System in seiner temporären Layout nicht für eine separate Segregation von Gallen ermöglichen. Zellen in den Aggregat polarisiert und ausgebildet Gallenkanälchen artige Strukturen, wie von MRP-2-Färbung dargestellt. Allerdings wurden diese Kanälchen nicht zu einem technischen Kanal Sammeln der Galle verbunden. Diese nicht-physiologischen Mischunging der Galle mit der Blutkammer hat in einer künftigen Neugestaltung des Systems angesprochen werden.
Die Einstellung der Fließeigenschaften von großer Bedeutung ist 25, insbesondere im Hinblick auf die Gewebe gegen Scherbeanspruchung empfindlich, wie die Leber. Der Betrag der Scherspannung durch das Gewebe wahrgenommen kann auf zwei Arten geändert werden: Zum einen kann der Luftdruck benutzt Festlegung der Membrane der Pumpe zu drücken abgesenkt werden sollen, um Spitzenscherspannungswerte in dem System. Zweitens kann das Gewebe in einer extrazellulären Matrix Schichtung oder eingebettet in Transwell-Kulturplatten gezüchtet werden. Letztere schirmen die Gewebe von den Grundstrom mit einer porösen Membran. Diese Einstellungen müssen auf individueller Basis für jedes Organ Äquivalent vor Beginn der MOC-Experiment durchgeführt werden. Bei einer pulsatilen Betriebs 2.4 Hz, zum Beispiel, die zu einer hohen, aber immer noch physiologischen Herzaktivität von 144 Schlägen entspricht / min bei Menschen, die Scherspannung in der MessKanäle der mikrovaskulären Schaltung erreicht ca. 25 dyn / cm 2. Dies entspricht einer physiologischen Scherspannung bei dem höheren Ende der Skala in Mikrovaskulatur und ist deshalb gut geeignet für Versuche mit einer Endothelialisierung der Kanäle. Da jedoch die Strom mikrofluidischen Anordnung des MOC System präsentiert nur aus einer Medienleitung, die den zwei Organkompartimenten, einer Pumpgeschwindigkeit und Scherspannungsrate wurde für das gesamte System gewählt werden. Daher ist eine exakte Einstellung der Fließeigenschaften auf die Bedürfnisse jedes einzelnen Organs nicht immer durchführbar.
Weiterhin Sorgfalt bei der Anpassung der Zellen an das gemeinsame Medium entnommen werden. Die Zellen werden in der MOC in einem kombinierten Medienschaltung kultiviert daher keine einzelne Zellkulturmedien kann für jede Gewebemodell verwendet werden, ist der Standard für die in vitro Zellkultur. Eine minimale kombinierte Medienformulierung muss vorher und t definiert werdener Zellen brauchen, um stufenweise zu dieser neuen Medien angepasst werden. Ein Anpassungsverfahren von 80% / 20% alten zu den neuen Medien für zwei Tage, dann 50% / 50%, gefolgt von 20% / 80% und eine vollständige Austausch immer auf eine angemessene Zelllebensfähigkeit und Funktionalität der Kulturen in unserer Hand geführt.
Der Strom mikrofluidischen Anordnung des MOC System erlaubt die Co-Kultur von bis zu drei Geweben. A Kokultur von mindestens zehn wichtigsten Organe des menschlichen Körpers notwendig ist, um die Homöostase zu erreichen. Daher ist das vorgestellte System in der Lage, spezifische Gewebegewebeinteraktion, aber nicht die wahre systemische Reaktion auf eine Substanz vorherzusagen. Eine Weiterentwicklung des MOC mehr Organhöhlen sind vorgesehen. Außerdem wird die Gültigkeit des Systems ist es, mit einem Satz von Referenzverbindungen angezeigt. Vorzugsweise Verbindungen, die während der klinischen Studien (wie zB Troglitazon) gescheitert sind, für ihre Leistung in dem MOC untersucht werden. Während, ist eine echte Validierung solcher komplexen Systeme noch b behinderty die fehlende Standardisierung über Biomarker und Endpunkte für die funktionelle Bewertung, sammeln mehr Daten zur Toxizität Leistung dieser und ähnlicher Systeme wird ihre Zuverlässigkeit und Einsatzbereich zu erweitern.
Offenlegungen
Uwe Marx ist Geschäftsführer der TissUse GmbH, die produziert und vertreibt die Multi-Organ-Chip-Plattform in dem Artikel verwendet. Diese Publikation wurde von einem preis von Corning Inc. gewährt finanziert
Danksagungen
Die Arbeit wurde vom Bundesministerium für Bildung und Forschung gefördert wurde, GO-Bio Grant No 0.315.569.
Materialien
| Name | Company | Catalog Number | Comments |
| HepaRG cells | Biopredic International | undifferentiated cells | |
| HHSteC | ScienCell Research Laboratories | cells and all culture supplements | |
| HepaRG Medium | Sigma-Aldrich | William's Medium E 10% FCS 100 U/ml penicillin 100 µg/ml streptomycin 5 µg/ml human insulin 2 mM L-glutamine 5 x 10-5 M hydrocortisone hemisuccinate | |
| HDMEC Medium | PromoCell | Endothelial Cell Growth Medium MV2 with Supplement-Pack MV2 and 1% penicillin-streptomycin | |
| Dimethyl sulfoxide | Carl Roth | add 2% to HepaRG media | |
| Trypsin/EDTA | Biowest | ||
| Trypsininhibitor | Carl Roth | ||
| MAXYMum Recovery Tips | Corning | 1,000 µl Pipet Tips Wide Bore | |
| 384-Well Hanging Drop Plate | 3D Biomatrix | Perfecta 3D 384-Well Hanging Drop Plate | |
| Tissue culture flasks | Corning | 75 cm2 | |
| Ultra-low attachment plate | Corning | 24-well | |
| Transwell cell culture inserts | Corning | 96-well unit, 0.4 µm pore size | |
| Deep well plates | Corning | 96-well, 1 ml | |
| Biopsy punch | Stusche | 4.5 mm | |
| Glass microscope slide | Menzel | footprint of 75 x 25 mm | |
| Polydimethylsiloxane | Dow Corning | Sylgard 184 | |
| Silicon rubber additive | Wacker Chemie | Wacker Primer G790 | |
| Tubes for air pressure | SMC Pneumatik GmbH | Polyurethan-Schlauch, metrisch | |
| Alumin ELISA | Bethyl Laboratories | Human Albumin ELISA Quantitation Set | |
| Lactate dehydrogenase assay | Stanbio Laboratory | LDH Liqui-UV kit | |
| Alexa Fluor 594 acetylated LDL | Invitrogen | 1 mg/ml |
Referenzen
- Kelm, J. M., Fussenegger, M. Microscale tissue engineering using gravity-enforced cell assembly. Trends in biotechnology. 22 (4), 195-202 (2004).
- Marx, U., Walles, H., et al. Human-on-a-chip Developments: A Translational Cutting-edge Alternative to Systemic Safety Assessment and Efficiency Evaluation of Substances in Laboratory Animals and Man. ATLA. 40 (5), 235-257 (2012).
- Baudoin, R., Griscom, L., Prot, J. M., Legallais, C., Leclerc, E. Behavior of HepG2/C3A cell cultures in a microfluidic bioreactor. Biochemical Engineering Journal. 53 (2), 172-181 (2011).
- Dash, A., Inman, W., et al. Liver tissue engineering in the evaluation of drug safety. Expert opinion on drug metabolism & toxicology. 5 (10), 1159-1174 (2009).
- Materne, E. -M., Tonevitsky, A. G., Marx, U. Chip-based liver equivalents for toxicity testing--organotypicalness versus cost-efficient high throughput. Lab on a chip. 13 (18), 3481-3495 (2013).
- Huh, D., Torisawa, Y., Hamilton, G. a, Kim, H. J., Ingber, D. E. Microengineered physiological biomimicry: organs-on-chips. Lab on a chip. 12 (12), 2156-2164 (2012).
- Sin, A., Chin, K. C., Jamil, M. F., Kostov, Y., Rao, G., Shuler, M. L. The design and fabrication of three-chamber microscale cell culture analog devices with integrated dissolved oxygen sensors. Biotechnology progress. 20 (1), 338-345 (2004).
- Tatosian, D. a, Shuler, M. L. A novel system for evaluation of drug mixtures for potential efficacy in treating multidrug resistant cancers. Biotechnology and bioengineering. 103 (1), 187-198 (2009).
- Schimek, K., Busek, M., et al. Integrating biological vasculature into a multi-organ-chip microsystem. Lab on a chip. 13 (18), 3588-3598 (2013).
- Wagner, I., Materne, E. -M., et al. A dynamic multi-organ-chip for long-term cultivation and substance testing proven by 3D human liver and skin tissue co-culture. Lab on a chip. 13 (18), 3538-3547 (2013).
- Vieira, U., et al. HepaRG human hepatic cell line utility as a surrogate for primary human hepatocytes in drug metabolism assessment in vitro. Journal of pharmacological and toxicological methods. 63 (1), 59-68 (2010).
- Abu-Absi, S. F., Hansen, L. K., Hu, W. -S. Three-dimensional co-culture of hepatocytes and stellate cells. Cytotechnology. 45 (3), 125-140 (2004).
- Leite, S. B., Wilk-Zasadna, I., et al. Three-dimensional HepaRG model as an attractive tool for toxicity testing. Toxicological sciences. 130 (1), 106-116 (2012).
- Chiquet-Ehrismann, R. Tenascins. The international journal of biochemistry & cell biology. 36 (6), 986-990 (2004).
- Sidgwick, G. P., Bayat, A. Extracellular matrix molecules implicated in hypertrophic and keloid scarring. Journal of the European Academy of Dermatology and Venereology JEADV. 26 (2), 141-152 (2012).
- Ataç, B., Wagner, I., et al. Skin and hair on-a-chip: in vitro skin models versus ex vivo tissue maintenance with dynamic perfusion. Lab on a chip. 13 (18), 3555-3561 (2013).
- Wu, M. -H., Huang, S., Lee, G. -B. Microfluidic cell culture systems for drug research. Lab on a chip. 10 (8), 939-956 (2010).
- Schanz, J., Pusch, J., Hansmann, J., Walles, H. Vascularised human tissue models A new approach for the refinement of biomedical research. Journal of Biotechnology. 148 (1), 56-63 (2010).
- Holnthoner, W., Hohenegger, K., et al. Adipose-derived stem cells induce vascular tube formation of outgrowth endothelial cells in a fibrin matrix. J Tissue Eng Regen Med. , (2012).
- Dunn, J. C. Y., Yarmush, M. L., Koebe, H. G., Tompkins, R. G. Hepatocyte function and extracellular matrix geometry: long-term culture in a sandwich configuration. FASEB Journal. 3, 174-177 (1989).
- Leclerc, E., Sakai, Y., Fujii, T. Microfluidic PDMS (polydimethylsiloxane) bioreactor for large-scale culture of hepatocytes. Biotechnology progress. 20 (3), 750-755 (2004).
- Kim, M. S., Yeon, J. H., Park, J. -K. A microfluidic platform for 3-dimensional cell culture and cell-based assays. Biomedical microdevices. 9 (1), 25-34 (2007).
- Prot, J. -M., Aninat, C., et al. Improvement of HepG2/C3A Cell Functions in a Microfluidic Biochip. Biotechnology and bioengineering. 108 (7), 1704-1715 (2011).
- Riccalton-Banks, L., Liew, C., Bhandari, R., Fry, J., Shakesheff, K. Long-term culture of functional liver tissue: three-dimensional coculture of primary hepatocytes and stellate cells. Tissue engineering. 9 (3), 401-410 (2003).
- Powers, M. J., Domansky, K., et al. A Microfabricated Array Bioreactor for Perfused 3D Liver Culture. Biotechnology and Bioengineering. 78 (3), 257-269 (2002).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten