Method Article
Le Multi-Chip organes - Une plate-forme microfluidique à long terme Coculture multi-tissus
Dans cet article
Résumé
Here, we present a protocol to coculture primary cells, tissue models and punch biopsies in a microfluidic multi-organ chip for up to 28 days. Human dermal microvascular endothelial cells, liver aggregates and skin biopsies were successfully combined in a common media circulation.
Résumé
The ever growing amount of new substances released onto the market and the limited predictability of current in vitro test systems has led to a high need for new solutions for substance testing. Many drugs that have been removed from the market due to drug-induced liver injury released their toxic potential only after several doses of chronic testing in humans. However, a controlled microenvironment is pivotal for long-term multiple dosing experiments, as even minor alterations in extracellular conditions may greatly influence the cell physiology. We focused within our research program on the generation of a microengineered bioreactor, which can be dynamically perfused by an on-chip pump and combines at least two culture spaces for multi-organ applications. This circulatory system mimics the in vivo conditions of primary cell cultures better and assures a steadier, more quantifiable extracellular relay of signals to the cells.
For demonstration purposes, human liver equivalents, generated by aggregating differentiated HepaRG cells with human hepatic stellate cells in hanging drop plates, were cocultured with human skin punch biopsies for up to 28 days inside the microbioreactor. The use of cell culture inserts enables the skin to be cultured at an air-liquid interface, allowing topical substance exposure. The microbioreactor system is capable of supporting these cocultures at near physiologic fluid flow and volume-to-liquid ratios, ensuring stable and organotypic culture conditions. The possibility of long-term cultures enables the repeated exposure to substances. Furthermore, a vascularization of the microfluidic channel circuit using human dermal microvascular endothelial cells yields a physiologically more relevant vascular model.
Introduction
Monocouche ou suspension actuelle des essais de culture cellulaire pour le développement de médicaments ne parviennent pas à imiter le microenvironnement cellulaire humaine et, par conséquent, conduire à une dédifférenciation rapide et perte de fonction dans des cultures primaires de cellules humaines. modèles de tissus avec pertinence physiologique supérieur sont nécessaires pour prédire l'efficacité et l'innocuité de composés avant de les admettre à des essais cliniques. Récemment, des techniques standard de culture de cellules in vitro ont évolué à partir des cultures monocouches bidimensionnelles vers des modèles multi-cellulaires tridimensionnels, dans le but d'imiter le microenvironnement vivo dans des tissus. Ces systèmes ont déjà montré des améliorations importantes en vue de prédiction plus précise le mode d'action des composés 1,2. En outre, l'adaptation des conditions de culture in vitro pour les besoins hautement spécialisés de cellules est d'un intérêt particulier.
Selon la norme dans des conditions in vitro, une importante variété de culparamètres ture, tels que l'approvisionnement en éléments nutritifs et de l'oxygène, l'élimination de produits qui se accumulent, et la force mécanique agissant sur les cellules ne peuvent souvent pas être contrôlés soigneusement dans la plupart des cas. De nombreux organes possèdent des gradients de concentration physiologiquement pertinents de substances et de l'oxygène dissous. Cependant, ces conditions très réglementés et optimisées sont en nette opposition avec les gradients de diffusion incontrôlables autour de tissus dans des conditions in vitro, conduisant à un environnement très instable et en limitant le développement cellulaire 3. Ainsi, plus stable et surtout plus quantifiables dans des conditions in vitro sont tenus de garder les cellules viables et différenciée sur des périodes de temps prolongées. Systèmes perfusés, où les composants moyennes sont régulièrement enlevés et substitués, sont souvent mieux caractérisé et contrôlable que les cultures statiques concernant l'environs directs des tissus. Dans des conditions statiques, des gradients de diffusion des sécrétions cellulaires et milieu de culture nutrimentspeut entourer les cellules cultivées trois. Présentation bien caractérisés des débits moyens autour des tissus permettent les sécrétions cellulaires pour mélanger avec le milieu riche grâce à la perfusion. Ceci permet la génération de micro-environnements cellulaires définies, en assurant un phénotype cellulaire stable et expression enzyme métabolisant pendant toute la durée de l'essai 4.
Les développements récents dans la puce multi-organes (MOC) à base de systèmes combinent les avantages d'un débit moyen contrôlée tissus avec les petites exigences de moyennes et de masse cellulaire de bioréacteurs à micro autour d'ingénierie, conduisant à une quantité réduite de substance nécessaire au cours des essais. Plusieurs systèmes microfluidiques pour la culture de tissus ont été décrits à ce jour 5,6. Ratios Tissue-à-fluide au sein de ces systèmes jouent un rôle particulièrement important dans la simulation diaphonie cellulaire physiologiquement pertinents. Toutefois, en raison de limitations techniques, comme l'utilisation de pompes et réservoirs externes des médias, ee circulation globale du volume des médias dans la plupart des systèmes est trop grande par rapport aux volumes de tissus. Le groupe de Shuler et al. A été le premier à développer un système garantissant des temps de séjour appropriés de substances dans les compartiments de culture cellulaire et in vivo pertinentes ratios 7,8 tissus à fluide dans. Ceci a été réalisé en escaladant le réservoir externe jusqu'à une plaque de 96 puits, représentant également le compartiment «autres tissus". Afin de minimiser le volume des médias circulant dans notre plate-forme de MOC, nous avons intégré une pompe péristaltique micropompe sur puce, éliminant le besoin de circuits de supports externes. Cette micropompe est en mesure de faire fonctionner le système à un nombre sélectionnable de vitesses d'écoulement de médias et des taux de contrainte de cisaillement 9. Système de canal microfluidique de 500 um de largeur et de hauteur 100 um relie deux espaces de culture de tissu standard, chacun ayant la taille d'un seul puits d'une plaque à 96 puits. Adhérant à la taille de l'industrie plaque à puits standards permet l'intégration de modèles de tissus existants déjà produites dans le format Transwell. Par ailleurs, la position verticale du Transwell inserts de culture cellulaire est réglable, ce qui permet la culture des modèles de tissus qui ne sont pas seulement directement exposée à l'écoulement de fluide, mais peut aussi être soulevé et protégé contre le courant sous-jacent. De même, les cultures de l'interface air-liquide sont réalisables en utilisant ce système.
La plate-forme MOC est fabriqué à partir d'un polydiméthylsiloxane (PDMS) couche 2 mm de haut et une lame de microscope en verre avec une empreinte de 75 x 25 mm 2, qui sont liés de façon permanente par oxydation au plasma à basse pression pour former le circuit microfluidique étanche aux fluides. La couche de PDMS contenant les canaux respectifs et les compartiments de culture cellulaire est produite par lithographie douce réplique moulage standard et 9. La conception de la MOC microfluidique utilisé au cours de cette étude comportait deux circuits microfluidiques séparées par puce, tenant chacun deux cellules culture compartiments reliés entre eux par un système de canaux 100 um haute. Cela a permis l'exécution de deux co-cultures de deux tissus individuels en utilisant une puce multi-organes. Fréquences de pompage ont été ajustés pour obtenir des débits moyens de 40 pl / min.
Cette conception de MOC deux tissus à condition que la capacité de co-cultiver un sphéroïde de foie et une biopsie de poinçon de la peau dans des espaces de culture distinctes, quoique dans un circuit de médias combinés dans des conditions d'écoulement physiologiques. La différenciation des cellules HepaRG ont été agrégées avec des cellules étoilées hépatiques humaines (HHSteC) à un rapport de 24: 1 pour former des sphéroïdes homogènes. Ce ratio a été jugée optimale, comme observé dans les expériences précédentes 10, même si, près de deux fois le nombre d'hépatocytes ont été utilisés par rapport à la situation in vivo. La peau a été cultivée à une interface air-liquide à l'intérieur d'un insert de culture cellulaire Transwell, permettant ainsi l'exposition de la substance de traitement. Ces modèles de tissus ont été co-cultivées pendant 28 joursays de la MOC pour démontrer l'exhaustivité de ce système. En outre, le circuit de canal microfluidique des puces a été entièrement recouverte par les cellules endotheliales microvasculaires dermiques humaines (HDMEC) pour simuler plus étroitement le système vasculaire.
Protocole
REMARQUE: prépuce mineurs humain a été obtenu avec le consentement éclairé et l'approbation éthique (Comité d'éthique Charité University Medicine, Berlin, Allemagne), en conformité avec les lois pertinentes, d'une chirurgie pédiatrique après la circoncision de routine.
1. Production d'équivalents de tissus pour la culture dans la MOC
- Agréger HepaRG et HHSteC en accrochant plaques de chute pour générer sphéroïdes du foie.
- Afin de réaliser le traitement à la trypsine des cellules HepaRG cultivées dans des flacons de culture cellulaire (75 cm2), enlever le moyen de confluence, les cultures monocouches dissociés, laver deux fois avec du PBS, et ajouter 3 ml de 0,05% de trypsine / EDTA. Incuber pendant 3 à 5 min à 37 ° C et d'arrêter la réaction en ajoutant 6 ml d'inhibiteur de la trypsine.
- Centrifuger les cellules HepaRG à 150 g pendant 5 min, retirez surnageant, resuspendre le culot cellulaire dans 1 ml de milieu de culture de cellules HepaRG, et compter les cellules. La viabilité cellulaire devrait être> 90%.
- EnAfin d'atteindre l'trypsinisation des cellules HHSteC, éliminer le milieu de cultures en monocouche, laver deux fois avec du PBS, et ajouter 3 ml de 0,05% de trypsine / EDTA. Incuber pendant 5 min à 37 ° C et d'arrêter la réaction en ajoutant 6 ml d'inhibiteur de la trypsine.
- Centrifuger les cellules HHSteC à 150 g pendant 5 min, retirez surnageant, resuspendre le culot cellulaire dans 1 ml de milieu de culture de cellules HepaRG, et compter les cellules.
- Moissonneuse HepaRG HHSteC et à un rapport de 24: 1 à HepaRG milieu de culture cellulaire. Pour ce faire, ajuster le nombre de cellules par dilution de suspensions de cellules HepaRG dans un milieu de culture de cellules et ajouter 1 x 10 5 cellules / ml HHSteC à 4,8 x 10 6 cellules / ml de cellules HepaRG. Mélanger soigneusement.
- Préparer une plaque de goutte suspendue par addition de 2 ml de PBS à la goutte suspendue et la plaque récepteur.
- Introduire à la pipette 20 ul de la suspension cellulaire dans chaque puits de la plaque de goutte pendante. Préparez toujours environ 10% de plus pendaison chute que vous avez besoin de récupérer des agrégats, comme certains agrégats sont perdus Durila procédure ng. Placez délicatement la plaque dans un incubateur à 37 ° C. Attendre 48 heures pour les sphéroïdes pour former.
- Afin de récupérer les sphéroïdes, veillez à utiliser des embouts de pipette avec terminaisons effleura le ballon ou couper les pointes de 1 ml conseils de pipettes avec un couteau stérile afin d'élargir l'ouverture à environ 2-3 mm. Utilisez ces embouts de pipette pour gérer les sphéroïdes sans les perturber.
- Laver soigneusement sphéroïdes de la plaque de goutte suspendue de façon répétée en ajoutant 1 ml de milieu à la partie supérieure des puits de la plaque de goutte suspendue à l'aide d'une pipette. Laver la plaque jusqu'à ce que tous les sphéroïdes ont tombé. Sphéroïdes sont d'un diamètre moyen de 300 à 400 um et une hauteur de 200 à 300 um à ce point légèrement en forme de disque.
- Recueillir les sphéroïdes dans la plaque du récepteur et de les transférer à des plaques de fixation 24 puits ultra-faible avec un maximum de 20 sphéroïdes par puits en utilisant les embouts de pipette préparés. Ajustez les volumes des médias dans chaque puits pour 0,5 ml. Utilisez 20 agrégats à l'INOculer une MOC circuit pour obtenir un taux de miniaturisation de 1/100 000 en ce qui concerne le nombre de cellules dans vivo.
- Incuber les sphéroïdes à 37 ° C et 5% de CO 2 jusqu'à utilisation ultérieure dans le GPM. Ne pas stocker les sphéroïdes plus de trois jours avant utilisation pour assurer la comparabilité. Cultiver les agrégats pendant au moins un jour dans des plaques de fixation ultra-basses à récupérer les sphéroïdes homogènes.
- Poursuivre ou l'autre des deux approches pour générer des équivalents de tissus de la peau: l'utilisation de biopsies (1.2.1) ou l'utilisation de ready-made dans les modèles de tissus in vitro (1.3.1).
- Couper avec un couteau Transwells à incandescence dessous du support pour préparer 96 puits inserts de culture cellulaire et de stocker dans des conditions stériles jusqu'à utilisation ultérieure.
- Stériliser échantillons prépuce à 80% d'éthanol pendant 30 secondes et coupez l'anneau ouvert. Les échantillons doivent avoir une hauteur moyenne de 2 mm.
- Utiliser un poinçon de biopsie pour couper biopsies de 4,5 mm de diamètre pour obtenir une égalité miniaturizarapport tion pour le foie et la peau. Chargez les biopsies dans le prêt de 96 puits transwell insère avec une pince. Prenez soin de positionner les biopsies avec le côté épidermique vers le haut.
- Lieu de culture cellulaire insère avec des biopsies dans une plaque de réception contenant HepaRG milieu de culture cellulaire et conserver à 37 ° C et 5% de CO 2 jusqu'à utilisation ultérieure dans le MOC. Ne pas stocker les échantillons de plus de 2 à 3 h.
- Intégrer ready-made dans les modèles in vitro de la peau, acheté auprès de divers fournisseurs, dans le MOC, de se assurer qu'ils sont en 96 puits transwell le format. Utilisation du milieu de culture des cellules fournies par le vendeur ou, si une co-culture avec un autre tissu est prévu dans une autre étape, en utilisant un milieu minimal avec support des deux tissus. Testez le milieu minimal respective dans des expériences antérieures statiques pour sa capacité à soutenir les tissus.
- Récupérer modèles de peau de la plaque de support et couper les inserts 96 et ci-dessous le support avec un couteau à incandescence.
- Placez les inserts de nouveau dans la plaque réceptrice et conserver à 37 ° C et 5% de CO 2 jusqu'à utilisation ultérieure dans le MOC. Ne pas stocker les échantillons de plus d'une journée.
2. Fabrication MOC
- Mélanger les PDMS et l'agent de durcissement dans un rapport de 10: 1 (v / v) et placer le mélange sous vide pendant 15 minutes pour éliminer les bulles d'air.
- Pendant ce temps, traiter une plaque de couvercle de polycarbonate avec l'additif de caoutchouc de silicone à 80 ° C pendant 20 min.
- Insérer les vis en Téflon trous respectifs de la plaque de couvercle afin de créer les quatre libres PDMS-compartiments de culture de cellules et les membranes six PDMS, 500 um d'épaisseur, de la micropompe.
- Branchez la plaque de couvercle prêt à le moule maître des deux circuits microvasculaires et injecter les PDMS dégazée. Prenez soin de ne pas intégrer les bulles d'air dans le système. Si des bulles apparaissent, essayer de les enlever en inclinant l'appareil.
- Incuber le système à 80 ° C pendant 60 minutes pour durcir la couche de PDMS.
- Retirer le moule maître et les vis en Téflon et le dispositif de lier la couche de PDMS à une lame de verre avec une empreinte 75 x 25 mm 2, en utilisant une oxydation au plasma à basse pression.
- Vis spéciale adaptateurs fil de MOC à tous les quatre compartiments de culture cellulaire de la plaque de couvercle.
- Connectez seringues contenant un milieu de culture pour luer femelle x ¼-28 adaptateurs mâles et les visser aux adaptateurs MOC de la plaque de couvercle.
- Injecter du milieu dans le circuit microfluidique en appuyant à plusieurs reprises vers le bas et tirant vers le haut les seringues plongeurs.
- Vérifier le bon remplissage des canaux avec le milieu sous le microscope.
3. endothélialisation de la MOC
- Avant endothelializing le GPM, chaque circuit de rinçage GPM avec du milieu de croissance des cellules endotheliales et incuber statiquement pendant trois jours à 37 ° C et 5% de CO 2.
- Stériliser les GPM en utilisant un mélange éthanol essuyer et de les placer sous un banc à flux laminaire. Jen outre, stériliser deux paires de pinces et deux clés hexagonales pour une utilisation ultérieure.
- Desserrer les bouchons du compartiment de culture de tissus de la MOC en utilisant les touches hexagonaux et retirer les bouchons en utilisant les forceps. Après avoir inséré le support, les bouchons de retour sur les GPM de la même manière.
- Afin de réaliser le traitement à la trypsine de microvasculaires dermiques cellules endothéliales humaines (HDMEC), éliminer le milieu à partir des cultures monocouches, laver deux fois avec du PBS, et ajouter 3 ml de 0,05% de trypsine / EDTA. Incuber pendant 5 min à 37 ° C et d'arrêter la réaction en ajoutant 6 ml d'inhibiteur de la trypsine.
- Centrifuger la HDMEC à 220 xg pendant 5 min, retirer le surnageant, remettre en suspension le culot cellulaire dans 1 ml de milieu de croissance des cellules endotheliales, et compter les cellules. La viabilité cellulaire devrait être> 90%.
- Ajuster le nombre de cellules dans la suspension de cellules à une concentration finale de 2 x 10 7 cellules / ml par dilution avec un milieu de croissance des cellules endotheliales et transférer 250 pl de ce àune seringue de 1 ml. Appliquer cette concentration de cellules à la MOC pour maintenir le taux de miniaturisation de 1/100 000 pour tous les organes.
- Connectez la seringue à un luer femelle x ¼-28 adaptateur mâle, d'expulser l'air de ce raccord, et le visser à un adaptateur spécial fil de MOC. Branchez l'adaptateur à l'un des deux compartiments de chaque circuit MOC.
- Connectez un seringue vide de la même manière pour le second compartiment du circuit MOC.
- Injecter les cellules uniformément en poussant et en tirant les deux plongeurs seringue plusieurs fois de manière consécutive. Contrôle de la perfusion des cellules au microscope.
- Incuber la MOC à 37 ° C et 5% de CO 2 dans des conditions statiques pendant 3 heures pour permettre aux cellules d'adhérer aux parois du canal.
- Retirez la puce de l'incubateur, le placer sous un banc à flux laminaire, et remplacer les seringues et les adaptateurs MOC avec filetage MOC chambres de culture de cellules spéciales.
- Ajouter 400 pi de milieu frais à une comDépartement de chaque circuit MOC et laissez rincer à travers les canaux de la pression hydrostatique. Ensuite, remplacer le milieu dans les deux compartiments avec 300 pi de milieu frais.
- Fermez les compartiments utilisant des amorces, comme décrit au paragraphe 3.1.2.
- Connectez la puce à l'unité de commande de la pompe. Ajuster la vitesse de pompage à une fréquence de 0,475 Hz et cultiver la puce à 37 ° C et 5% de CO 2.
- Remplacer le milieu de chaque compartiment MOC chaque un à deux jours et de suivre la morphologie des cellules au microscope optique.
4. Chargement de la puce
- Placez le MOC sous le banc d'écoulement laminaire et l'ouvrir, comme décrit à l'étape 3.1.2.
- Retirez le support des compartiments de culture de tissus et la remplacer par 300 pi de milieu de culture de cellules fraîches HepaRG.
- Transférer 20 sphéroïdes préformés à une tissu compartiment de culture de chaque circuit MOC en utilisant les embouts de pipette avec une large ouverture (voir les étapes 1.1.8 / 9). Fermez le cap aide de pinces et les clés hexagonales.
- Transférer 96 puits inserts de culture cellulaire contenant des équivalents de peau restant au compartiment de culture de tissu de chaque circuit de MDC en utilisant une pince. Prenez soin d'éviter la formation de bulles sous la membrane de l'équivalent de peau. Pour ce faire, insérez Transwells à un angle légèrement incliné et pousser doucement. Retirez l'excès autour de la moyenne transwell étant poussée vers le haut par le bas avec une pipette.
- Fermez le bouchon en utilisant des pinces et les clés hexagonales.
5. Connexion de la puce à l'unité de commande de pompe
- Paramètres opérationnels fixés dans les unités de contrôle aux valeurs souhaitées. Modifier la pression de l'air de 0 à 8000 mbar, de vide de 0 à -800 mbar, et le pompage de fréquence de 0,24 à 2,4 Hz. Réglez la direction de pompage dans le sens horaire ou antihoraire.
- Retirez les GPM contenant équivalents de tissus sous le banc d'écoulement laminaire et le connecter à des unités de commande de la pompe.
- Après l'numeration sur les tubes, insérer un tube de pression d'air aux raccords respectifs sur le GPM.
- Cultiver le MOC à 37 ° C et 5% de CO 2 dans un incubateur ou, dans le cas de l'imagerie de tissus vivants, utiliser le support MOC pour chauffer la puce à 37 ° C et de cultiver la puce à l'extérieur de l'incubateur. Utilisez le support chauffé à cultiver des cellules dans la MOC sous un microscope standard.
6. Effectuer échanges des médias, échantillonnage médias et l'exposition aux substances
- Effectuer l'échange de médias routine tous les jours ou tous les deux jours, compte tenu du type de tissu en culture et l'activité métabolique des cellules.
- Récupérer le MOC de l'incubateur et l'observer au microscope pour contrôler médias débits et vérifier la contamination.
- Débranchez le MOC de l'unité de commande de la pompe en débranchant le tube de pression d'air. Stériliser le MOC en utilisant des lingettes d'éthanol et de le mettre sous le banc d'écoulement laminaire.
- Ouvrez l'échantillon de culture de tissusartment contenant les sphéroïdes du foie, tel que décrit dans l'étape 3.1.2.
- Retirez jusqu'à 200 pi du compartiment aide d'une pipette sans perturber les sphéroïdes et stocker le milieu dans un puits vide d'une plaque de puits profonds. Analyser l'échantillon de médias directement ou fermer la plaque de puits profonds et de stocker les échantillons de médias à -80 ° C pour analyse ultérieure.
- Remplacez le support de la MOC avec un milieu de culture cellulaire jusqu'à 250 pi fraîche et refermer le bouchon. La différence dans la quantité de milieu retiré et représente la perte remplacé en raison de faibles quantités se échappent de la puce lors de la fermeture du système.
- Ouvrez le bouchon du compartiment de culture de tissus tenant les équivalents de peau à ce stade pour vérifier intégrité des tissus. Prenez soin de ne pas introduire de bulles d'air dans le système. Fermez le bouchon.
- Raccordez le tube de l'unité de commande de la pompe à la MOC, selon l'étape 5.3, et placer la MOC dans un incubateur.
7. L'analyse des échantillons Daily médias et effectuer l'analyse en ligne
- Analyser les performances de culture tissulaire en ligne en utilisant l'imagerie de cellules vivantes ou hors ligne, en analysant les échantillons de presse quotidiens. Effectuer ce dernier par Standard dosages enzymatiques de routine (par exemple lactate déshydrogénase (LDH) d'activité) ou ELISA (par exemple concentration d'albumine). Une analyse en ligne est décrite dans ce qui suit.
- Retirez le support de la MOC endothélialisée, comme décrit dans les étapes 6.1.1 à 6.1.4, et de le remplacer dans les deux compartiments de culture de tissus avec 200 pi de 10 ug lipoprotéines (LDL) solution à faible densité / ml fluorophore conjugué acétylé (dilué dans milieux de culture cellulaire).
- Fermez les bouchons. Connectez le MOC à l'unité de commande de la pompe, selon l'étape 5.3, et pomper pendant 30 min à 0,475 Hz pour distribuer la solution de manière homogène dans le circuit microfluidique.
- Arrêtez le pompage et incuber le MOC statique pendant 3,5 heures à 37 ° C et 5% de CO 2.
- T similaireso l'étape 7.2, éliminer la solution de LDL acétylé des deux compartiments et le remplacer par 400 pi de milieu frais dans l'un des deux compartiments.
- Attendez 3-5 min pour laisser la pression hydrostatique entraîner le support à travers le circuit de canal microfluidique.
- Remplacer le milieu qui se est écoulé à travers avec 300 pi de milieu frais et remplir également le deuxième compartiment de culture de tissu avec 300 pi de milieu frais.
- Fermez le MOC, selon l'étape 3.1.2. Mettez-le sous un microscope à fluorescence et observer la croissance et la viabilité cellulaire.
- Placez le MOC taché dans l'incubateur de continuer la culture. Retirez la tache se échapper des cellules avec chaque remplacement d'information suivant.
8. Récupérer équivalents de tissus de la MOC et effectuer des analyses de point final
- Récupérer équivalents de tissus de la MOC à la fin de l'expérience pour les analyses de point de terminaison.
- Afin de récupérer le foie et la peau equivalents de la MOC, retirez le support de chaque compartiment de culture de tissu, comme décrit dans les étapes 6.1.1 à 6.1.4.
- Retirer les inserts de culture cellulaire de 96 puits contenant la peau de la MOC en utilisant une pince. Décoller la membrane de l'insert avec soin en le saisissant sur un côté avec une pince et en le tirant vers le bas. Prenez soin de ne pas perdre l'équivalent de la peau à ce stade.
- Geler la membrane titulaires de l'équivalent de la peau dans le composé de cryo-enrobage et le conserver à -80 ° C jusqu'à analyse plus approfondie.
- Retirez les équivalents de foie similaire du compartiment de culture de tissus en les pipetage utilisant des embouts de pipette coupées (voir l'étape 1.1.8 / 9).
- Incluez les sphéroïdes de foie dans le composé de cryo-enrobage. Prenez soin de ne pas transférer trop de liquide et enlever tout excès de liquide avec une pipette. Après avoir placé les sphéroïdes sur la masse d'enrobage et l'élimination du milieu, ajouter en outre composé cryo sur le dessus des sphéroïdes pour enfermer complètement.
- Geler les équivalents de foie et le conserver à -80 ° C jusqu'à analyse plus approfondie.
- Effectuer une analyse point final en coupant les équivalents de tissus dans un cryo-microtome à huit sections um et coloration des marqueurs spécifiques de tissus, tel que décrit dans les protocoles précédents 10.
Résultats
Standard in vitro de cultures de tissus sont réalisées dans des conditions statiques, ce qui limite la diffusion de l'oxygène et des nutriments aux tissus alimentation. Systèmes fluidiques, présentant des caractéristiques améliorées d'approvisionnement, sont souvent entravées par leurs grandes exigences moyennes, ayant non physiologiquement moyen élevé des ratios de tissus. Ainsi, les métabolites et les cellules sont diluées ne sont pas en mesure de conditionner leur environnement. Le GPM présentée dans cette étude relie deux compartiments de culture de tissu distinctes, chacune de la taille d'un seul puits d'une plaque à 96 puits standard, par un système de canal microfluidique. La petite taille du système et l'intégration de la pompe sur la puce permet au système de fonctionner à des volumes de médias de seulement 200 à 800 pi. Cela correspond à un moyen systémique totale ratio du tissu de 8: 1 à 31: 1, respectivement, pour les co-cultures de tissus du foie et de la peau (d'un volume de tissu total d'environ 26 ul). Le volume de liquide extra-cellulaire total dans un homme pesant 73 kg est de 14,6 L, dont le volume de fluide est intercapillaire 5,1 L, ce qui conduit à un fluide physiologique extracellulaire rapport à des tissus de 1: 4. Par conséquent, le montant des médias dans l'ensemble du système de circulation dans la MOC est encore plus grande par rapport à la situation physiologique; et pourtant, il représente le plus petit médias ratio de tissu signalé jusqu'ici pour les systèmes multi-organes 5. Comme formats standards de culture de tissus de l'industrie sont conservés, les chercheurs sont en mesure de combiner des modèles de tissus statique existants et déjà validées au sein d'un flux de fluide commun. La figure 1 montre le schéma d'un dispositif expérimental de co-cultures possibles de tissus seule MOC ou multi-tissus. Biopsies tissulaires primaires et in vitro -generated équivalents de tissus de lignées de cellules primaires ou des cellules peuvent être cultivées soit en utilisant des inserts de 96 puits de culture de cellules ou en les plaçant directement dans les compartiments de culture de tissus. Comme le système de canaux reliant les compartiments de culture cellulaire ne est que de 100 μm de haut, équivalents de tissu dépassant ces dimensions sera maintenue dans les compartiments de culture. Le endothélialisation du circuit GPM avec HDMECs primaires permet un autre pas en avant vers plus de conditions de culture physiologiques en fournissant une structure vasculaire biologique.
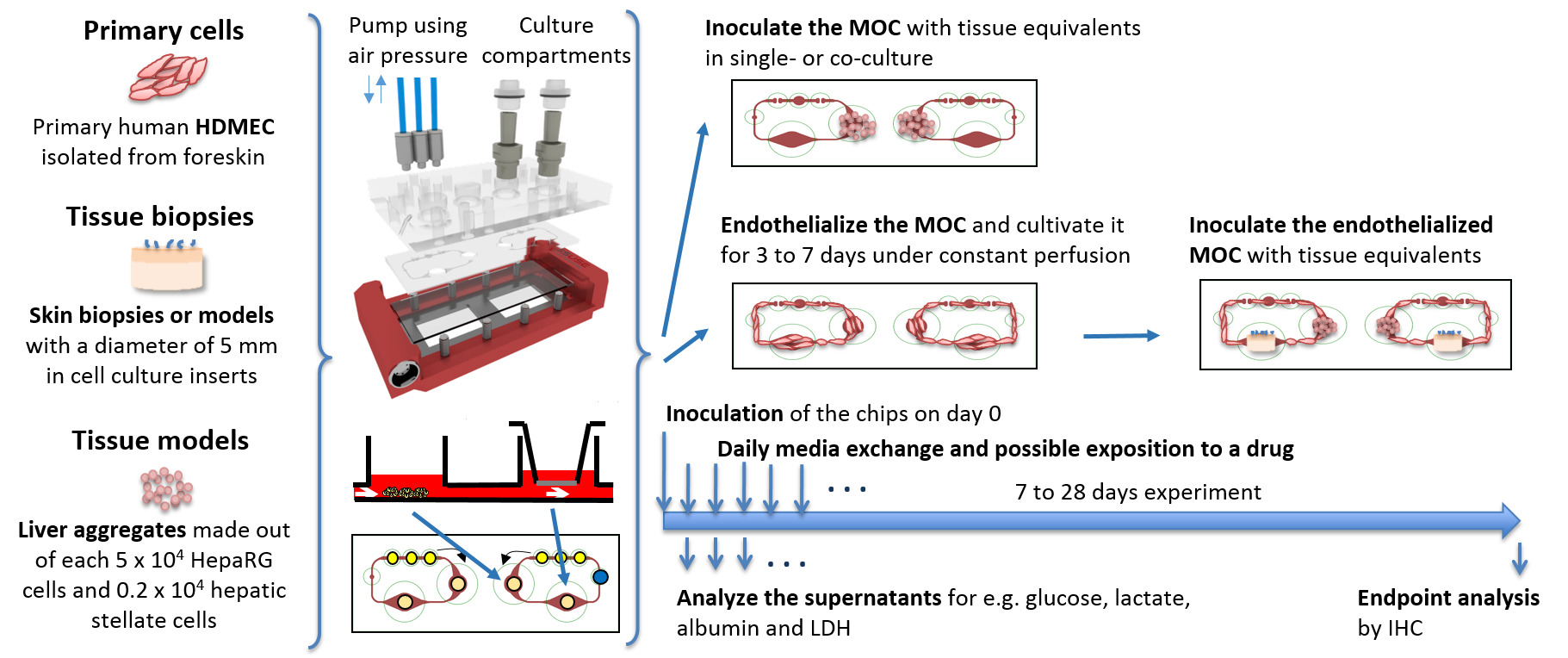
Figure 1:. Équivalents de tissus Représentation schématique des cultures MOC sont préparés dans des conditions standard in vitro, inoculé dans la MOC et cultivé comme cultures simples ou co-cultures dans des conditions dynamiques. Échantillons de presse quotidiens et des analyses de point de terminaison sont effectuées. La pression d'air pour entraîner la pompe est appliquée par les trois tubes bleus reliés à la MOC d'en haut. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
En suivant le protocole de l'endothélialisation, un confluent HDMEC couverture du circuit de canal microfluidique est obtenu dans les quatre jours de culture dynamique, comme représenté sur la Figure 2. Les cellules adhèrent facilement aux parois du canal de MDC, créent une monocouche confluente, et allongés le long du cisaillement le stress (figure 2B). En outre, les cellules couvrent la totalité de la circonférence des canaux, comme indiqué précédemment neuf. Aucune autre modification de la morphologie de l'endothélium a été observée après quatre jours de culture, jusqu'à la fin de la culture.
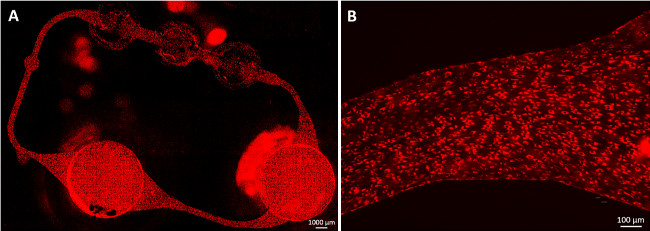
Figure 2:. Endothélialisée canaux MOC de cellules endothéliales microvasculaires dermiques humains (HDMEC) ont formé une monocouche confluentes dans le circuit microfluidique. Les cellules ont été colorées avec LDL acétylé après 23 jours de culture MOC. (A) L'ensemble de mcircuit icrovascular était couvert de cellules et (B) cellules allongées le long de la contrainte de cisaillement. Barres d'échelle: (A) 1 000 um et (B) 100 uM.
Dans une autre expérience, des cellules hépatiques sphéroïdes en forme de disque cohérentes sont formées à partir HepaRG et HHSteC pendant deux jours de culture de la goutte suspendue, comme ce système modèle a été précédemment rapporté comme étant appropriés pour le métabolisme des médicaments études de 11-13. A des fins de démonstration, un compartiment de culture de tissu de chaque circuit de MDC a été ensemencé avec 20 sphéroïdes à 96 puits dans des inserts de culture de cellules et les tissus ont été cultivées pendant 14 jours dans des conditions dynamiques en utilisant GPM non endothélialisée. Ne importe quel nombre d'agrégats ou la quantité de matière première peut être intégré directement dans les compartiments ou en utilisant des inserts de culture cellulaire. La coloration par immunofluorescence des sphéroïdes après extraction de la MOC montre, une expression homogène solide pour liver-cytokératine 8/18 typique de phase I et les enzymes du métabolisme du cytochrome P450 3A4 et 7A1 (figure 3A et 3B). Coloration de transporteur canaliculaire multi-drogues protéine de résistance 2 (MRP-2) a révélé un phénotype polarisé et l'existence de réseaux de canalicules biliaires comme rudimentaire (figure 3C).
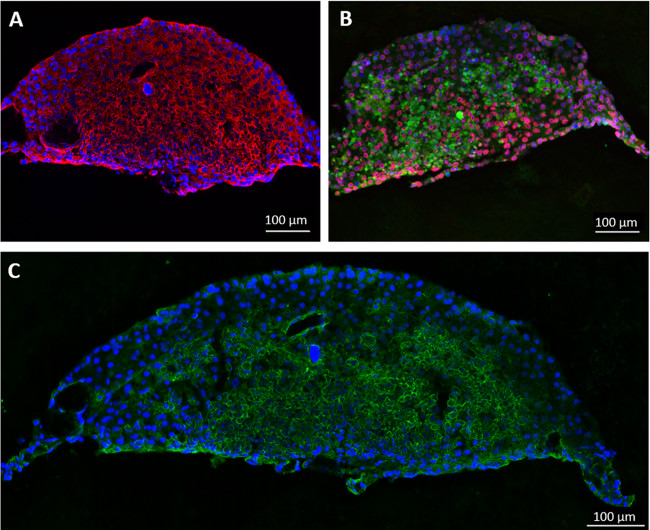
Figure 3 :. La culture de foie artificiel micro-tissus humains dans les agrégats MOC. Hépatiques cultivées pendant 14 jours dans la MOC ont été colorées pour (A) cytokératine 8/18 (rouge) et (B) du cytochrome P450 3A4 (rouge) et 7A1 (vert). (C) Expression de transporteur canaliculaire MRP-2 (vert), la coloration nucléaire bleue. Barres d'échelle: 100 um.
Comme la production d'albumine est une condition sine qua non de la culture de tissus du foie, il a abeillen sélectionné pour surveiller l'activité du foie-typique de la MOC. L'analyse des échantillons de milieu pour la production quotidienne de l'albumine montre une augmentation significative du taux de production dans des cultures MOC par rapport à des cultures statiques (figure 4) et à des valeurs 11 rapportées dans la littérature. L'augmentation du taux de synthèse de l'albumine peut être attribuée à l'apport d'oxygène et de nutriments augmenté dans les cultures MOC. Ainsi, la MOC est en mesure de maintenir les agrégats du foie sur une période de 14 jours de culture dans un état métaboliquement active, améliorer le comportement du foie typiques, tels que la production d'albumine.

Figure 4: Quatorze jours-performances sphéroïde du foie dans la MOC production d'albumine de cultures de tissus simples hépatiques dans le GPM et en culture statique.. Les données sont des moyennes ± SEM (n = 4).
Tests répétés Subsystemic de toxicité dose de chemicals et cosmétiques sur des animaux nécessite de 21 à 28 jours d'exposition, tel que défini par la directrice de l'OCDE no. 410 "à dose répétée Toxicité cutanée: Étude 21/28 jours." Cocultures peau foie à long terme sont illustrés ici pour un maximum de 28 jours pour faire face aux exigences réglementaires. Une interface air-liquide est prévu pour l'exposition de substance dermique plus tard en cultivant des biopsies cutanées de 96 puits dans des inserts de culture cellulaire. L'expérience de co-culture est réalisée à titre d'exemple en GPM endothélialisées de prouver si une co-culture de trois tissus dans un circuit de support combiné peut être conservé viable et métaboliquement actif de plus de 28 jours.
Analyse de l'activité de la LDH dans le surnageant des médias a révélé un niveau baisse constante au cours des huit premiers jours de culture, qui est demeuré constant à environ 80 U / l par la suite (figure 5). Ceci indique une rotation des tissus artificiels mais stable dans le système à des moments ultérieurs. En comparant la coculture trois tissu à simple du foieexpériences de co-culture et du foie -Tissu-endothélial, un niveau de LDH diminué de façon significative n'a pu être trouvée, surtout pendant les premiers jours dans les cultures non compris la peau. La mort cellulaire dans ce première période de forte activité de la LDH se est produite principalement dans le compartiment de la culture de la peau, la peau tissu unique de cultures MOC révélé (données non présentées). Cela peut être dû à la zone blessée entourant la biopsie par suite de la perforation de la peau.
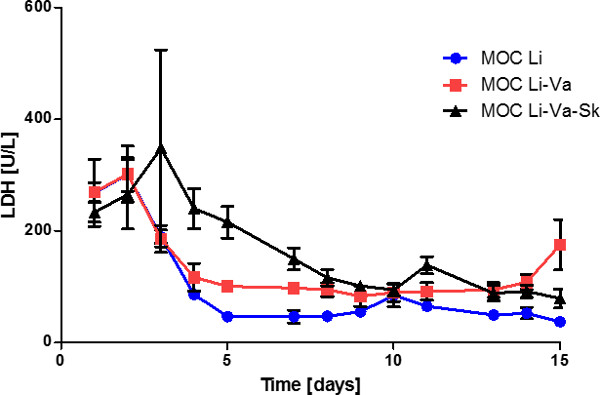
Figure 5: la performance des tissus quinze jours dans l'activité de la LDH MOC dans les surnageants de médias de cultures foie de tissus unique (MOC Li), cultures de foie GPM endothélialisées (MOC Li-Va) et co-cultures foie peau dans endothélialisée MOC (MOC Li. -va-Sk). Les données sont des moyennes ± SEM (n = 4).
Pendant la période de culture de 28 jours, les sphéroïdes de foie ont adhéré au bas de l'une de MDCnd cellules sont nées, formant une connexion entre multicouche sphéroïdes adjacentes. Ce ne entrave pas la fonctionnalité des tissus. Endpoint analyse par immunofluorescence a montré que sphéroïdes hépatiques étaient encore métaboliquement active après 28 jours de co-culture MOC, comme indiqué par le cytochrome P450 3A4 coloration (figure 6A). HHSteC ont été distribuées dans l'ensemble équivalent de foie, comme indiqué par la coloration de la vimentine (Figure 6B). Une augmentation de l'intensité de coloration de la vimentine a pu être observée dans les zones où les cellules étaient cultivées sur des sphéroïdes. La coloration pour le facteur de von Willebrand (vWF) ont montré que les cellules endotheliales ne ont pas pénétré profondément dans le tissu, mais sont en contact cellule-cellule direct avec les hépatocytes extérieures (Figure 6C).
Coloration immunohistochimique des biopsies cutanées a montré une expression de la ténascine C et de collagène IV dans la membrane basale (Figure 6D), tandis que la coloration de la commande statique montré elevatniveaux és de la ténascine C (figure 6E). La ténascine C a été montré pour être régulée à la hausse au cours de la cicatrisation des blessures, les processus inflammatoires et de la fibrose, suggérant induite dans les processus fibrotiques statique, mais pas dans des cultures dynamiques 14,15.
La viabilité des cellules est stable et la fonctionnalité des tissus après une coculture de 28 jours dans le GPM prouvent que le système est capable de maintenir une combinaison de jusqu'à trois tissus dans un circuit de média commun. Les cellules primaires, ainsi que des modèles de tissus et des biopsies, peuvent être cultivées simultanément dans le système MOC.
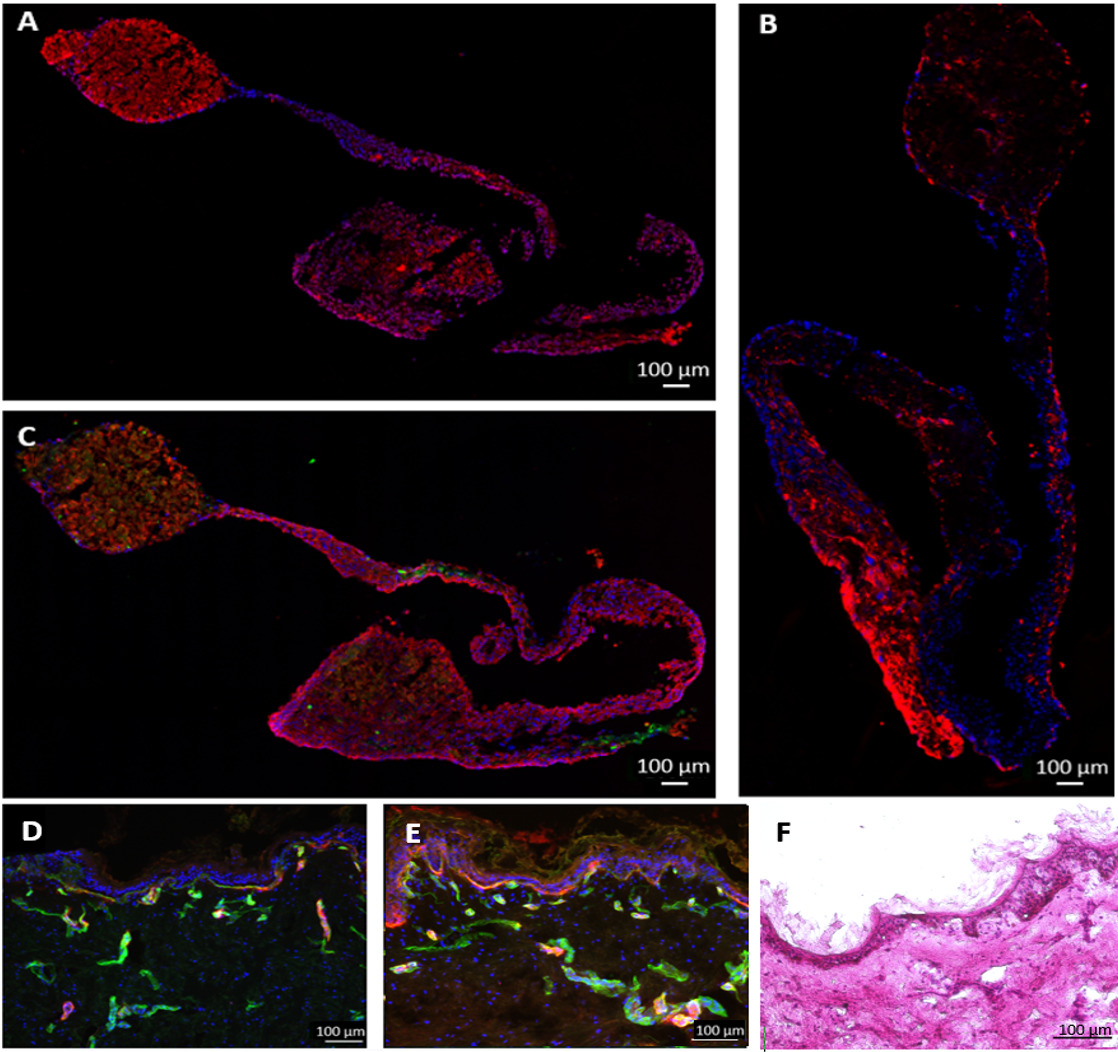
Figure 6:. Le rendement de cultures multiples de tissu sur 28 jours équivalents du foie et des biopsies de peau ont été cultivées dans une fonctionnalité MOC et endothélialisées cellule a été démontrée par immunocoloration de (A) Phase I enzymes du cytochrome P4503A4 (rouge), (B) la vimentine (rouge), (C) la cytokératine 8/18 (rouge) et vWF (vert) dans le tissu hépatique. Les biopsies cutanées co-cultivés pendant 28 jours (D) dans la MOC ou (E) dans des conditions statiques ont été colorées pour la ténascine c (rouge) et le collagène IV (vert), la coloration nucléaire bleue. (F) H & E coloration de la peau après 28 jours de culture MOC. Barres d'échelle: 100 um.
Discussion
La plate-forme MOC décrit ici représente un outil stable et puissant pour cultiver des tissus d'origines diverses au dynamiques conditions d'écoulement moyennes sur des périodes prolongées de culture 10,16. Dans cet exemple, la plate-forme a été utilisé pour cultiver les cellules primaires (HDMEC), des équivalents de tissus produits par une lignée de cellules hépatiques (granulats), et une co-culture de ce qui précède avec une biopsie de tissu. Le MOC a été en mesure de soutenir la co-culture de trois tissus pour un maximum de 28 jours dans un circuit de fluide combiné. Au meilleur de la connaissance des auteurs, ce est la première fois qu'un co-culture multi-tissus, y compris les biopsies, les cellules primaires et des lignées cellulaires a été effectuée sur quatre semaines.
L'un des principaux inconvénients des systèmes microfluidiques est l'affinité de petites molécules à adhérer au matériau de la surface du circuit fluidique. Comme le rapport surface sur volume est particulièrement élevée dans les systèmes microfluidiques, cet effet devient encore plus prononcée 17 . La couverture de HDMEC stable des canaux, présenté ici, pourrait agir comme une barrière biologique empêchant l'adhésion de molécules à la MOC. En outre, il peut servir de récipient hémocompatible pour la circulation de sang total, ce qui empêche la coagulation du sang. Cependant, l'utilisation de sang entier comme un moyen substitution ne est pas possible tant que la vascularisation complet des équivalents d'organes n'a pas encore été atteint. Travaux sur la vascularisation des tissus in vitro -generated existante est prometteur et guide la voie à d'autres études 18,19.
Il est bien connu que les hépatocytes ont tendance à perdre leurs fonctions spécifiques du foie au cours du temps dans des conditions de culture statique à deux dimensions 20 in vitro. Enzymes métabolisant, telles que la famille du cytochrome P450, sont d'une importance particulière si le métabolisme d'un certain médicament doit être étudié. Cytochrome P450 3A4, une enzyme liée à la biotransformation de nombreux xénobiotiques, et le cytochrome P450 7A, wUEL est impliqué dans la synthèse d'acides biliaires, ont été exprimées dans le foie agrégats en culture dans le GPM de plus de 14 jours. Ceci indique que le maintien d'un phénotype métaboliquement active, ce qui permet pour les études de métabolisme des médicaments. Le taux de production d'albumine a augmenté de granulats dans le GPM par rapport à des cultures statiques est une indication supplémentaire pour des conditions de culture appropriées. Les taux de production d'albumine observés lors de cette étude étaient comparables ou même supérieures aux valeurs précédemment rapportées obtenus par puces microfluidiques dont les cellules HepG2 21-23, cependant, les valeurs ne ont pas atteint ceux de cultures d'hépatocytes humains primaires 24. En outre, le système MOC, dans son agencement temporaire, ne permet pas une séparation distincte de la bile. Dans les cellules biliaires structures polarisées et formés agrégées canalicules-like, comme le montre MRP-2 coloration. Toutefois, ces canalicules sont reliés à un canal de collecte technique la bile. Ce mélange non physiologiquetion de la bile avec le compartiment de sang doit être abordée dans un avenir refonte du système.
L'ajustement des caractéristiques d'écoulement est d'une grande importance 25, en particulier en ce qui concerne les tissus sensibles au cisaillement, tels que le foie. La quantité de contrainte de cisaillement perçue par le tissu peut être modifié de deux manières: d'abord, la pression de l'air utilisé pour pousser vers le bas les membranes de la pompe peut être réduit, ce qui diminue les valeurs maximales de contrainte de cisaillement dans le système. D'autre part, les tissus peuvent être incorporés dans une matrice extracellulaire ou superposition en culture dans des inserts de culture Transwell. Ce dernier bouclier les tissus du courant sous-jacent d'une membrane poreuse. Ces ajustements doivent être effectuées sur une base individuelle pour chaque équivalent d'organe avant de commencer l'expérience MOC. Lors d'une opération pulsatoire de 2,4 Hz, par exemple, ce qui correspond à une activité élevée, mais encore physiologique, coeur de 144 battements / min chez l'homme, la contrainte de cisaillement mesurée de lacanaux du circuit microvasculaire atteint environ 25 dyn / cm 2. Ceci correspond à une contrainte de cisaillement physiologique à l'extrémité supérieure de l'échelle dans microvascularisation et est donc bien applicable pour des expériences comprenant une endothélialisation des canaux. Cependant, comme la mise en page microfluidique actuel du système MOC présenté se compose d'un seul circuit de médias reliant les deux compartiments d'organes, une vitesse de pompage et taux de cisaillement de stress doit être choisi pour l'ensemble du système. Par conséquent, un réglage précis de caractéristiques d'écoulement aux besoins de chaque organe unique ne est pas toujours faisable.
En outre, les soins doit être pris en ajustant les cellules dans le milieu commun. Les cellules sont cultivées dans du MDC dans un circuit combiné des médias, par conséquent, aucun des milieux de culture cellulaire particulier peut être utilisée pour chaque modèle de tissu, comme ce est la norme pour la culture in vitro de cellules dans. Une formulation médiatique combinée minimale doit être défini à l'avance et tcellules-il besoin d'être ajusté par étapes pour ce nouveau média. Une procédure d'ajustement de 80% / 20% vieux pour les nouveaux médias pendant deux jours, puis 50% / 50% suivie par 20% / 80%, et un échange complet toujours conduit à une viabilité cellulaire raisonnable et la fonctionnalité de cultures dans nos mains.
La disposition microfluidique actuel du système MOC permet la co-culture de tissus jusqu'à trois. Une co-culture d'au moins dix la organes les plus importantes du corps humain est nécessaire pour atteindre l'homéostasie. Par conséquent, le système présenté est capable de prédire les interactions tissu-spécifique d'un tissu, mais pas la vraie réponse systémique à une substance. Un autre développement de la MOC pour inclure plusieurs cavités d'organes est envisagé. En outre, la validité du système doit être indiqué au moyen d'un ensemble de composés de référence. De préférence, les composés qui ont échoué au cours des essais cliniques (tels que la troglitazone) doivent être testés pour leur performance dans le MOC. Considérant que, une véritable validation de ces systèmes complexes est encore entravée by l'absence de normalisation concernant les biomarqueurs et des paramètres pour l'évaluation fonctionnelle, la collecte de plus de données sur la performance et la toxicité de ce systèmes similaires permettra d'élargir leur fiabilité et leur domaine d'application.
Déclarations de divulgation
Uwe Marx est le PDG de TissUse GmbH qui produit et commercialise la plate-forme puce multi-organes utilisés dans l'article. Cette publication a été financée par une bourse accordée par Corning Inc.
Remerciements
Le travail a été financé par le Ministère fédéral allemand de l'éducation et de la recherche, GO-Bio Grant n ° 0315569.
matériels
| Name | Company | Catalog Number | Comments |
| HepaRG cells | Biopredic International | undifferentiated cells | |
| HHSteC | ScienCell Research Laboratories | cells and all culture supplements | |
| HepaRG Medium | Sigma-Aldrich | William's Medium E 10% FCS 100 U/ml penicillin 100 µg/ml streptomycin 5 µg/ml human insulin 2 mM L-glutamine 5 x 10-5 M hydrocortisone hemisuccinate | |
| HDMEC Medium | PromoCell | Endothelial Cell Growth Medium MV2 with Supplement-Pack MV2 and 1% penicillin-streptomycin | |
| Dimethyl sulfoxide | Carl Roth | add 2% to HepaRG media | |
| Trypsin/EDTA | Biowest | ||
| Trypsininhibitor | Carl Roth | ||
| MAXYMum Recovery Tips | Corning | 1,000 µl Pipet Tips Wide Bore | |
| 384-Well Hanging Drop Plate | 3D Biomatrix | Perfecta 3D 384-Well Hanging Drop Plate | |
| Tissue culture flasks | Corning | 75 cm2 | |
| Ultra-low attachment plate | Corning | 24-well | |
| Transwell cell culture inserts | Corning | 96-well unit, 0.4 µm pore size | |
| Deep well plates | Corning | 96-well, 1 ml | |
| Biopsy punch | Stusche | 4.5 mm | |
| Glass microscope slide | Menzel | footprint of 75 x 25 mm | |
| Polydimethylsiloxane | Dow Corning | Sylgard 184 | |
| Silicon rubber additive | Wacker Chemie | Wacker Primer G790 | |
| Tubes for air pressure | SMC Pneumatik GmbH | Polyurethan-Schlauch, metrisch | |
| Alumin ELISA | Bethyl Laboratories | Human Albumin ELISA Quantitation Set | |
| Lactate dehydrogenase assay | Stanbio Laboratory | LDH Liqui-UV kit | |
| Alexa Fluor 594 acetylated LDL | Invitrogen | 1 mg/ml |
Références
- Kelm, J. M., Fussenegger, M. Microscale tissue engineering using gravity-enforced cell assembly. Trends in biotechnology. 22 (4), 195-202 (2004).
- Marx, U., Walles, H., et al. Human-on-a-chip Developments: A Translational Cutting-edge Alternative to Systemic Safety Assessment and Efficiency Evaluation of Substances in Laboratory Animals and Man. ATLA. 40 (5), 235-257 (2012).
- Baudoin, R., Griscom, L., Prot, J. M., Legallais, C., Leclerc, E. Behavior of HepG2/C3A cell cultures in a microfluidic bioreactor. Biochemical Engineering Journal. 53 (2), 172-181 (2011).
- Dash, A., Inman, W., et al. Liver tissue engineering in the evaluation of drug safety. Expert opinion on drug metabolism & toxicology. 5 (10), 1159-1174 (2009).
- Materne, E. -M., Tonevitsky, A. G., Marx, U. Chip-based liver equivalents for toxicity testing--organotypicalness versus cost-efficient high throughput. Lab on a chip. 13 (18), 3481-3495 (2013).
- Huh, D., Torisawa, Y., Hamilton, G. a, Kim, H. J., Ingber, D. E. Microengineered physiological biomimicry: organs-on-chips. Lab on a chip. 12 (12), 2156-2164 (2012).
- Sin, A., Chin, K. C., Jamil, M. F., Kostov, Y., Rao, G., Shuler, M. L. The design and fabrication of three-chamber microscale cell culture analog devices with integrated dissolved oxygen sensors. Biotechnology progress. 20 (1), 338-345 (2004).
- Tatosian, D. a, Shuler, M. L. A novel system for evaluation of drug mixtures for potential efficacy in treating multidrug resistant cancers. Biotechnology and bioengineering. 103 (1), 187-198 (2009).
- Schimek, K., Busek, M., et al. Integrating biological vasculature into a multi-organ-chip microsystem. Lab on a chip. 13 (18), 3588-3598 (2013).
- Wagner, I., Materne, E. -M., et al. A dynamic multi-organ-chip for long-term cultivation and substance testing proven by 3D human liver and skin tissue co-culture. Lab on a chip. 13 (18), 3538-3547 (2013).
- Vieira, U., et al. HepaRG human hepatic cell line utility as a surrogate for primary human hepatocytes in drug metabolism assessment in vitro. Journal of pharmacological and toxicological methods. 63 (1), 59-68 (2010).
- Abu-Absi, S. F., Hansen, L. K., Hu, W. -S. Three-dimensional co-culture of hepatocytes and stellate cells. Cytotechnology. 45 (3), 125-140 (2004).
- Leite, S. B., Wilk-Zasadna, I., et al. Three-dimensional HepaRG model as an attractive tool for toxicity testing. Toxicological sciences. 130 (1), 106-116 (2012).
- Chiquet-Ehrismann, R. Tenascins. The international journal of biochemistry & cell biology. 36 (6), 986-990 (2004).
- Sidgwick, G. P., Bayat, A. Extracellular matrix molecules implicated in hypertrophic and keloid scarring. Journal of the European Academy of Dermatology and Venereology JEADV. 26 (2), 141-152 (2012).
- Ataç, B., Wagner, I., et al. Skin and hair on-a-chip: in vitro skin models versus ex vivo tissue maintenance with dynamic perfusion. Lab on a chip. 13 (18), 3555-3561 (2013).
- Wu, M. -H., Huang, S., Lee, G. -B. Microfluidic cell culture systems for drug research. Lab on a chip. 10 (8), 939-956 (2010).
- Schanz, J., Pusch, J., Hansmann, J., Walles, H. Vascularised human tissue models A new approach for the refinement of biomedical research. Journal of Biotechnology. 148 (1), 56-63 (2010).
- Holnthoner, W., Hohenegger, K., et al. Adipose-derived stem cells induce vascular tube formation of outgrowth endothelial cells in a fibrin matrix. J Tissue Eng Regen Med. , (2012).
- Dunn, J. C. Y., Yarmush, M. L., Koebe, H. G., Tompkins, R. G. Hepatocyte function and extracellular matrix geometry: long-term culture in a sandwich configuration. FASEB Journal. 3, 174-177 (1989).
- Leclerc, E., Sakai, Y., Fujii, T. Microfluidic PDMS (polydimethylsiloxane) bioreactor for large-scale culture of hepatocytes. Biotechnology progress. 20 (3), 750-755 (2004).
- Kim, M. S., Yeon, J. H., Park, J. -K. A microfluidic platform for 3-dimensional cell culture and cell-based assays. Biomedical microdevices. 9 (1), 25-34 (2007).
- Prot, J. -M., Aninat, C., et al. Improvement of HepG2/C3A Cell Functions in a Microfluidic Biochip. Biotechnology and bioengineering. 108 (7), 1704-1715 (2011).
- Riccalton-Banks, L., Liew, C., Bhandari, R., Fry, J., Shakesheff, K. Long-term culture of functional liver tissue: three-dimensional coculture of primary hepatocytes and stellate cells. Tissue engineering. 9 (3), 401-410 (2003).
- Powers, M. J., Domansky, K., et al. A Microfabricated Array Bioreactor for Perfused 3D Liver Culture. Biotechnology and Bioengineering. 78 (3), 257-269 (2002).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon