Method Article
Il Chip Multi-organo - Una piattaforma Microfluidic per lungo termine co-coltura Multi-tessuto
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Here, we present a protocol to coculture primary cells, tissue models and punch biopsies in a microfluidic multi-organ chip for up to 28 days. Human dermal microvascular endothelial cells, liver aggregates and skin biopsies were successfully combined in a common media circulation.
Abstract
The ever growing amount of new substances released onto the market and the limited predictability of current in vitro test systems has led to a high need for new solutions for substance testing. Many drugs that have been removed from the market due to drug-induced liver injury released their toxic potential only after several doses of chronic testing in humans. However, a controlled microenvironment is pivotal for long-term multiple dosing experiments, as even minor alterations in extracellular conditions may greatly influence the cell physiology. We focused within our research program on the generation of a microengineered bioreactor, which can be dynamically perfused by an on-chip pump and combines at least two culture spaces for multi-organ applications. This circulatory system mimics the in vivo conditions of primary cell cultures better and assures a steadier, more quantifiable extracellular relay of signals to the cells.
For demonstration purposes, human liver equivalents, generated by aggregating differentiated HepaRG cells with human hepatic stellate cells in hanging drop plates, were cocultured with human skin punch biopsies for up to 28 days inside the microbioreactor. The use of cell culture inserts enables the skin to be cultured at an air-liquid interface, allowing topical substance exposure. The microbioreactor system is capable of supporting these cocultures at near physiologic fluid flow and volume-to-liquid ratios, ensuring stable and organotypic culture conditions. The possibility of long-term cultures enables the repeated exposure to substances. Furthermore, a vascularization of the microfluidic channel circuit using human dermal microvascular endothelial cells yields a physiologically more relevant vascular model.
Introduzione
Monostrato o di sospensione attuali test di coltura cellulare per lo sviluppo di farmaci non riescono a emulare il microambiente delle cellule umane e, quindi, portare a una de-differenziazione rapida e perdita di funzione in colture primarie di cellule umane. Sono necessari modelli di tessuto con una maggiore rilevanza fisiologica di predire l'efficacia e la sicurezza di composti per ammetterli alla sperimentazione clinica. Recentemente, di serie nelle tecniche di coltura cellulare in vitro hanno evoluto da colture monostrato bidimensionali verso modelli multi-cellulari tridimensionali, con l'obiettivo di imitare il vivo microambiente tessuto. Questi sistemi hanno già mostrato importanti miglioramenti verso previsione più accurata della modalità di azione dei composti 1,2. Inoltre, adattando le condizioni di coltura in vitro delle esigenze altamente specializzate di cellule è di particolare interesse.
In serie in condizioni in vitro, una serie di importanti culture parametri, quali la fornitura di nutrienti e ossigeno, la rimozione dei prodotti accumulando e forza meccanica che agiscono sulle cellule spesso non possono essere controllati accuratamente nella maggioranza dei casi. Molti organi possiedono gradienti di concentrazione fisiologicamente rilevanti di sostanze e di ossigeno disciolto. Tuttavia, tali condizioni altamente regolamentati e ottimizzati sono in netta opposizione ai gradienti di diffusione incontrollabili intorno tessuti in condizioni in vitro, che porta a un ambiente altamente instabile e limitando sviluppo cellulare 3. Così, sono richiesti più stabile e soprattutto più quantificabile in condizioni in vitro per mantenere le cellule vitali e differenziato per periodi di tempo prolungati. Sistemi di perfusione, in cui i componenti di media vengono regolarmente rimossi e sostituiti, sono spesso meglio caratterizzati e controllabile di culture statiche riguardanti la circostante diretta dei tessuti. In condizioni statiche, gradienti di diffusione di secrezioni cellulari e medie cultura nutrientipotrebbe circondare cellule in coltura 3. Introduzione ben caratterizzati portate medie intorno ai tessuti permettono secrezioni cellulari per mescolare con il ricco mezzo attraverso perfusione. Ciò consente la generazione di microambienti cellulari definiti, assicurando un fenotipo cellulare stabile e metabolizzare espressione dell'enzima per tutta la durata del test 4.
I recenti sviluppi in chip di multi-organo (MOC) a base di sistemi uniscono i vantaggi di un flusso medio controllato attorno tessuti con le piccole esigenze medie e di massa delle cellule di bioreattori microscala ingegnerizzati, portando ad una ridotta quantità di sostanza necessaria durante il test. Diversi sistemi microfluidici per coltura tissutale sono state descritte finora 5,6. Tissue-a-liquido rapporti all'interno di questi sistemi svolgono un ruolo fondamentale soprattutto nella simulazione fisiologicamente rilevanti crosstalk cellulare. Tuttavia, a causa di limitazioni tecniche, come l'uso di pompe esterne e serbatoi multimediali, the nel complesso il volume circolante media la maggior parte dei sistemi è troppo grande rispetto ai volumi di tessuto. Il gruppo di Shuler et al. Sono stati i primi a sviluppare un sistema che garantisca tempi di permanenza propri di sostanze all'interno dei compartimenti di coltura cellulare e in vivo rilevanti rapporti 7,8 tessuto-to-fluido. Questo è stato ottenuto scalando il serbatoio esterno fino a una piastra a 96 pozzetti, che rappresenta anche il comparto "altri tessuti". Per minimizzare il volume circolante media all'interno nostra piattaforma MOC, abbiamo integrato un peristaltica on-chip micropompa, eliminando la necessità di circuiti supporti esterni. Questa micropompa è in grado di operare il sistema ad un numero selezionabile di velocità di flusso media e tassi di sollecitazione di taglio 9. Un sistema canale microfluidico di 500 micron di larghezza e 100 micron altezza interconnette due spazi coltura tissutale standardizzati, ciascuna avente la dimensione di un singolo pozzetto di una piastra a 96 pozzetti. Aderendo alle dimensioni dell'industria pozzetti di series permette l'integrazione di modelli di tessuto già esistenti prodotte nel formato transwell. Inoltre, la posizione verticale transwell inserti di coltura cellulare è regolabile, permettendo la coltivazione di modelli di tessuto che non solo direttamente esposti al flusso di fluido, ma può anche essere sollevato e schermato dalla corrente sottostante. Allo stesso modo, le culture di interfaccia aria-liquido sono fattibili con questo sistema.
La piattaforma MOC è fabbricato da un polidimetilsilossano (PDMS) strato di 2 mm e un vetrino da microscopio in vetro con un ingombro di 75 x 25 mm 2, che sono legati in modo permanente a bassa ossidazione del plasma pressione per formare il circuito di microfluidica tenuta di fluido. Lo strato PDMS contenente i rispettivi canali e vani di colture cellulari è prodotto da litografia soft di serie e replica stampaggio 9. Il design microfluidica del MOC utilizzata durante questo studio consisteva di due circuiti separati microfluidica per chip, ciascuno con due celle ccompartimenti ulture interconnessi da un sistema di canali 100 micron alta. Questo ha permesso l'esecuzione di due co-colture di due tessuti singoli con un chip multi-organo. Frequenze di pompaggio sono stati adeguati per produrre medie portate di 40 microlitri / min.
Questo disegno MOC due tessuti disponibile la capacità di co-coltura uno sferoide fegato e una biopsia cutanea in spazi coltura separati, anche se in un circuito di media combinata in condizioni di flusso fisiologiche. Cellule differenziate HepaRG sono stati aggregati insieme con le cellule umane epatiche stellate (HHSteC) in un rapporto di 24: 1 per formare sferoidi omogenee. Questo rapporto è risultato ottimale, come osservato negli esperimenti precedenti 10, anche se, quasi il doppio del numero di epatociti sono stati utilizzati rispetto alla situazione in vivo. La pelle era coltivato ad una interfaccia aria-liquido all'interno di un inserto di coltura cellulare transwell, consentendo in tal modo l'esposizione sostanza topica. Questi modelli di tessuto sono stati cocultivated per 28 days del MOC per dimostrare la completezza di questo sistema. Inoltre, il circuito di canale microfluidico dei chip è stato completamente ricoperto con le cellule endoteliali microvascolari cutanea umana (HDMEC) per simulare più strettamente il sistema vascolare.
Protocollo
NOTA: prepuce giovanile umana è stato ottenuto con il consenso informato ed etica approvazione (Comitato Etico dell'Università Charité Medicina, Berlino, Germania), nel rispetto delle leggi vigenti, da una chirurgia pediatrica dopo circoncisioni di routine.
1. Produzione di equivalenti dei tessuti per la coltivazione in MOC
- Aggregare HepaRG e HHSteC in appeso lastre goccia per generare sferoidi fegato.
- Per conseguire la tripsinizzazione delle cellule HepaRG coltivate in fiaschi di coltura cellulare (75 cm 2), rimuovere il terreno da confluenti, colture monostrato differenziate, lavare con PBS due volte, e aggiungere 3 ml di 0,05% tripsina / EDTA. Incubare per 3 a 5 min a 37 ° C e fermare la reazione aggiungendo 6 ml di inibitore della tripsina.
- Cellule Centrifuga HepaRG a 150 xg per 5 minuti, togliere il surnatante, risospendere il pellet cellulare in 1 ml di mezzo di coltura cellulare HepaRG, e contare le cellule. La vitalità cellulare deve essere> 90%.
- InPer conseguire la tripsinizzazione delle cellule HHSteC, rimuovere il terreno da colture monostrato, lavare con PBS due volte, e aggiungere 3 ml di 0,05% tripsina / EDTA. Incubare per 5 min a 37 ° C e fermare la reazione aggiungendo 6 ml di inibitore della tripsina.
- Centrifugare le cellule HHSteC a 150 xg per 5 min, rimuovere il surnatante, risospendere il pellet cellulare in 1 ml di mezzo di coltura cellulare HepaRG, e contare le cellule.
- Combinare HepaRG e HHSteC con un rapporto di 24: 1 in HepaRG mezzo di coltura cellulare. Per fare ciò, regolare il numero di cellule diluendo sospensioni cellulari in HepaRG mezzo di coltura cellulare e aggiungere 1 x 10 5 cellule / ml HHSteC a 4,8 x 10 6 cellule / ml HepaRG cellule. Mescolare con cura.
- Preparare un piatto goccia appeso aggiungendo 2 ml di PBS al calo pensile e piano di appoggio.
- Pipettare 20 ml di sospensione cellulare in ciascun pozzetto della piastra goccia pendente. Preparare sempre circa il 10% in più appeso gocce che è necessario recuperare aggregati, come alcuni aggregati sono persi during la procedura. Posizionare con cura la piastra in un incubatore C 37 °. Attendere 48 ore per i sferoidi per formare.
- Al fine di recuperare i sferoidi, assicurarsi di utilizzare le punte delle pipette con terminazioni punta larghe o tagliare la punta delle punte 1 ml pipette con un coltello sterile, per ampliare l'apertura di circa 2 o 3 mm. Utilizzare questi suggerimenti pipette per gestire le sferoidi senza interrompere.
- Lavare accuratamente sferoidi dalla piastra goccia pendente aggiungendo ripetutamente 1 ml di media per la parte superiore dei pozzetti della piastra appeso goccia con una pipetta. Lavare la piastra fino a quando tutti gli sferoidi sono cadute. Spheroids sono leggermente con un diametro medio di 300 a 400 micron e un'altezza di 200 a 300 micron, a questo punto discoidale.
- Raccogliere le sferoidi nella piastra ricevente e trasferirli piastre di fissaggio 24-ben ultra-bassi con un massimo di 20 sferoidi per bene con le punte delle pipette preparati. Regolare i volumi media in ogni pozzetto a 0,5 ml. Utilizzare 20 aggregati Inocolare un circuito MOC ad ottenere un tasso di miniaturizzazione di 1 / 100.000 per quanto riguarda in numero di cellule in vivo.
- Incubare le sferoidi a 37 ° C e 5% CO 2 fino a nuovo uso nella MOC. Non conservare sferoidi più di tre giorni prima dell'uso per assicurare la comparabilità. Coltivate aggregati per almeno un giorno piastre di fissaggio ultra-bassa per recuperare i sferoidi omogenee.
- Perseguire uno dei due approcci per generare equivalenti tessuto cutaneo: l'uso di biopsie (1.2.1) o l'uso di ready-made in modelli in vitro di tessuti (1.3.1).
- Tagliare transwells con un coltello incandescente sotto la staffa per preparare 96 pozzetti inserti di coltura cellulare e conservare in condizioni di sterilità fino a nuovo uso.
- Sterilizzare campioni prepuzio in 80% di etanolo per 30 secondi e tagliare l'anello aperto. I campioni devono avere una altezza media di 2 mm.
- Utilizzare una biopsia per tagliare biopsie da 4,5 mm di diametro per ottenere una parità miniaturizaRapporto zione sia per il fegato e la pelle. Caricare le biopsie nel preparato 96 pozzetti transwell inserti con una pinza. Fare attenzione a posizionare le biopsie con il lato rivolto verso l'alto epidermica.
- Cultura Cellule di posizione inserisce con biopsie in un piatto ricevitore contenenti HepaRG coltura cellulare e conservare a 37 ° C e 5% di CO 2 fino a nuovo uso nella MOC. Non conservare i campioni più di 2 o 3 ore.
- Integrare ready-made in modelli in vitro della pelle, acquistato da diversi fornitori, nel MOC, facendo in modo che essi siano in 96 pozzetti transwell formato. Utilizzare il mezzo di coltura cellulare fornito dal venditore o, se è previsto un co-coltura con un altro tessuto in un ulteriore passo, utilizzare un terreno minimo supporto sia nei tessuti. Testare rispettivo terreno minimo in esperimenti statici precedenti per la sua capacità di sostenere i tessuti.
- Recuperare i modelli di pelle dalla piastra di supporto e tagliare gli inserti 96 pozzetti di sotto della staffa con un coltello incandescente.
- Posizionare gli inserti indietro nella piastra ricevente e conservare a 37 ° C e 5% CO 2 fino a nuovo uso nella MOC. Non conservare campioni più lunghi di un giorno.
2. Fabrication MOC
- Mescolare le PDMS e agente indurente in un rapporto di 10: 1 (v / v) e posizionare la miscela sotto vuoto per 15 minuti per rimuovere le bolle d'aria.
- Nel frattempo, il trattamento di un coperchio piastra in policarbonato con l'additivo gomma siliconica a 80 ° C per 20 min.
- Inserire viti Teflon in rispettivi fori della piastra di copertura per creare quattro free-PDMS compartimenti coltura cellulare e le sei PDMS membrane, 500 micron di spessore, della micropompa.
- Collegare il coperchio piastra pronti a stampo maestro dei due circuiti microvascolari e iniettare le PDMS degassati. Fare attenzione a non integrare le bolle d'aria nel sistema. Se bolle emergono, provare a rimuoverli inclinando il dispositivo.
- Incubare il sistema a 80 ° C per 60 min per curare il livello PDMS.
- Togliere lo stampo master e le viti in Teflon dal dispositivo e legare lo strato PDMS di un vetrino con un ingombro 75 x 25 mm 2 con bassa ossidazione del plasma pressione.
- Vite speciale adattatori filo MOC a tutte e quattro compartimenti coltura cellulare della copertura piastra.
- Collegare siringhe contenenti terreno di coltura a femmina Luer x ¼-28 adattatori maschio e avvitarli agli adattatori MOC della copertura piastra.
- Iniettare il medium nel circuito microfluidica ripetutamente spingendo e tirando le siringhe pistoni.
- Controllare il corretto riempimento dei canali con liquido sotto il microscopio.
3. endotelizzazione del MOC
- Prima endothelializing la MOC, flush ogni circuito MOC con mezzo di crescita delle cellule endoteliali e incubare staticamente per tre giorni a 37 ° C e 5% di CO 2.
- Sterilizzare i MOCS utilizzando una etanolo wipe e metterli sotto una panca a flusso laminare. Ion Inoltre, sterilizzare due paia di pinze e due chiavi esagonali per un ulteriore uso.
- Allentare i tappi del vano di coltura di tessuti del MOC utilizzando i tasti esagonali e rimuovere i tappi con le pinze. Dopo aver inserito il supporto, avvitare tappi indietro alle MOCS nello stesso modo.
- Per conseguire la tripsinizzazione delle cellule endoteliali microvascolari cutanea umane (HDMEC), rimuovere il terreno dalle colture monostrato, lavare con PBS due volte, e aggiungere 3 ml di 0,05% tripsina / EDTA. Incubare per 5 min a 37 ° C e fermare la reazione aggiungendo 6 ml di inibitore della tripsina.
- Centrifugare il HDMEC a 220 xg per 5 minuti, togliere il surnatante, risospendere il pellet in 1 ml di mezzo di crescita delle cellule endoteliali, e contare le cellule. La vitalità cellulare deve essere> 90%.
- Regolare il numero di cellule in sospensione cellulare ad una concentrazione finale di 2 x 10 7 cellule / ml diluendo con endoteliale mezzo di crescita cellulare e trasferire 250 ul di auna siringa da 1 ml. Applicare questa concentrazione di cellule al MOC per mantenere il tasso di miniaturizzazione 1 / 100.000 per tutti gli organi.
- Collegare la siringa di una femmina Luer x ¼-28 adattatore maschio, espellere l'aria di questo montaggio, e la vite ad uno speciale adattatore filettato MOC. Collegare l'adattatore ad uno dei due compartimenti di ciascun circuito MOC.
- Collegare una siringa vuota allo stesso modo al secondo compartimento del circuito MOC.
- Iniettare le cellule in modo uniforme spingendo verso il basso e tirando i due stantuffi siringa più volte in modo consecutivo. Controllare l'infusione di cellule al microscopio.
- Incubare la MOC a 37 ° C e 5% CO 2 in condizioni statiche per 3 ore per permettere alle cellule di aderire alle pareti del canale.
- Rimuovere il chip dal termostato, posizionarlo sotto un banco a flusso laminare, e sostituire le siringhe e gli adattatori MOC con speciali filo MOC camere di coltura cellulare.
- Aggiungere 400 ml di mezzo fresco a una compartimento di ogni circuito MOC e farlo lavare attraverso i canali per pressione idrostatica. Successivamente, sostituire il mezzo in entrambi i compartimenti con 300 ml di mezzo fresco.
- Chiudere i comparti con cappucci, come descritto in 3.1.2.
- Collegare il chip alla centralina pompa. Regolare la velocità di pompaggio ad una frequenza di 0.475 Hz e coltivare il chip a 37 ° C e 5% CO 2.
- Sostituire il supporto di ogni compartimento MOC ogni uno o due giorni e monitorare la morfologia delle cellule al microscopio ottico.
4. Caricamento del Chip
- Posizionare il MOC sotto la panca flusso laminare e aprirlo, come descritto al punto 3.1.2.
- Togliere la carta dal compartimenti coltura di tessuti e sostituirlo con 300 ml di fresco terreno di coltura cellulare HepaRG.
- Trasferire 20 sferoidi preformate per un tessuto compartimento cultura di ogni circuito di MOC con i puntali delle pipette con un'ampia apertura (vedere i passaggi 1.1.8 / 9). Chiudere la cap con pinze e chiavi esagonali.
- Trasferire 96 pozzetti inserti di coltura cellulare contenente equivalenti della pelle per il restante comparto coltura di tessuti di ogni circuito MOC con pinze. Fare attenzione ad evitare la formazione di bolle sotto la membrana dell'equivalente pelle. Per fare questo, inserire transwells ad un angolo leggermente inclinato e spingere delicatamente verso il basso. Rimuovere eccesso di terreno intorno al transwell essere spinto verso l'alto dal basso con una pipetta.
- Chiudere il tappo con pinze e chiavi esagonali.
5. Collegamento del Chip all'Unità Comando Pompa
- Impostare i parametri di funzionamento delle unità di controllo ai valori desiderati. Modifica pressione da 0 a 8000 mbar, vuoto da 0 a -800 mbar, e pompaggio frequenza 0,24-2,4 Hz. Impostare la direzione di pompaggio in senso orario o antiorario.
- Rimuovere le MOC contenente equivalenti di tessuto da sotto il banco a flusso laminare e collegarlo alle unità di controllo della pompa.
- Dopo la numeration sui tubi, inserire tubi pressione ai rispettivi raccordi sul MOC.
- Coltivare MOC a 37 ° C e 5% CO 2 in un incubatore o, nel caso di immagini tessuto vivo, utilizzare il supporto MOC per riscaldare il chip a 37 ° C e coltivare il chip all'esterno dell'incubatrice. Utilizzare il supporto riscaldato a coltivare cellule del MOC al microscopio standard.
6. Esecuzione scambi Media, Sampling Media e l'esposizione a sostanze
- Eseguire scambio supporti routine ogni giorno o ogni altro giorno, considerando il tipo di tessuto coltivato e l'attività metabolica delle cellule.
- Recuperare il MOC dal termostato e osservare al microscopio per il controllo dei media portata e verificare la contaminazione.
- Scollegare il MOC dalla centralina pompa scollegando il tubo della pressione dell'aria. Sterilizzare il MOC con salviette etanolo e metterla sotto il banco a flusso laminare.
- Aprire la coltura di tessuti compartment contenente sferoidi fegato, come descritto al punto 3.1.2.
- Rimuovere fino a 200 microlitri dal vano usando una pipetta senza interrompere sferoidi e conservare il terreno in un pozzetto vuoto di una piastra di pozzo. Analizzare il campione dei media direttamente o chiudere la piastra profondo bene e conservare i campioni di media a -80 ° C per ulteriori analisi.
- Sostituire il supporto del MOC con un massimo di 250 microlitri fresco mezzo di coltura cellulare e chiudere il tappo. La differenza nella quantità di mezzo rimosso e conti per la perdita sostituito a causa di piccole quantità fuoriuscita del chip quando si chiude il sistema.
- Aprire il tappo del vano coltura tissutale tenendo gli equivalenti della pelle a questo punto per verificare integrità dei tessuti. Fare attenzione a non introdurre bolle d'aria nel sistema. Chiudere il tappo.
- Collegare il tubo di regolazione della pompa al MOC, secondo la fase 5.3, e posizionare il MOC in un incubatore.
7. Analizza Campioni giornaliera media e eseguire on-line di analisi
- Analizzare tessuto prestazioni cultura on-line utilizzando l'imaging cellulare dal vivo o offline, analizzando i campioni di media al giorno. Eseguire la seconda da test standard di routine enzimatici (ad es lattato deidrogenasi (LDH) di attività) o ELISA (ad esempio la concentrazione di albumina). Un'analisi linea è descritta nel seguito.
- Rimuovere il supporto del MOC endotelizzazione, come descritto nei punti da 6.1.1 a 6.1.4, e sostituirlo in entrambi i comparti di coltura tissutale con 200 ml di soluzione di 10 mg / ml fluoroforo coniugato acetilato lipoproteine a bassa densità (LDL) (diluito in cell terreni di coltura).
- Chiudere i tappi. Collegare MOC alla centralina pompa, secondo la fase 5.3, e la pompa per 30 min a 0.475 Hz per distribuire uniformemente la soluzione nel circuito microfluidica.
- Arrestare il pompaggio e incubare il MOC staticamente per 3,5 ore a 37 ° C e 5% CO 2.
- T Simileo punto 7.2, rimuovere la soluzione LDL acetilata da entrambi i compartimenti e sostituirlo con 400 ml di terreno fresco in uno dei due scomparti.
- Attendere da 3 a 5 minuti per lasciare che la pressione idrostatica guidare il mezzo attraverso il circuito canale microfluidica.
- Sostituire il mezzo che ha fluito attraverso con 300 ml di mezzo fresco e anche riempire il secondo scomparto coltura di tessuti con 300 ml di terreno fresco.
- Chiudere la MOC, secondo passo 3.1.2. Mettere sotto un microscopio a fluorescenza e osservare la crescita cellulare e la vitalità.
- Posizionare la MOC macchiato di nuovo in incubatrice per continuare la coltivazione. Rimuovere la macchia fuoriuscire le cellule con ciascun seguente sostituzione dei supporti.
8. Recuperare equivalenti tessuto dal MOC e eseguire analisi end-point
- Recupera equivalenti di tessuti del MOC alla fine dell'esperimento per le analisi degli endpoint.
- Per recuperare il fegato e la pelle equivalents dal MOC, rimuovere il supporto per ciascun compartimento di coltura tissutale, come descritto ai punti 6.1.1 a 6.1.4.
- Rimuovere gli inserti di coltura cellulare a 96 pozzetti contenenti la pelle dal MOC con pinze. Rimuovere la membrana accuratamente dall'inserto afferrandolo su un lato con una pinza e tirandolo verso il basso. Fare attenzione a non perdere l'equivalente della pelle, a questo punto.
- Congelare la membrana che tiene l'equivalente in pelle composto crio embedding e conservarlo a -80 ° C fino a quando ulteriori analisi.
- Rimuovere gli equivalenti del fegato in modo simile dal vano di coltura tissutale pipettando utilizzando puntali per pipette taglio (vedi punto 1.1.8 / 9).
- Incorpora sferoidi fegato in compound-crio embedding. Fare attenzione a non trasferire troppo liquido e rimuovere il liquido in eccesso con una pipetta. Dopo aver posizionato sferoidi sul composto incorporamento e la rimozione del mezzo, aggiungere ulteriore composto cryo sulla sommità degli sferoidi loro racchiudere completamente.
- Congelare gli equivalenti fegato e conservarlo a -80 ° C fino ad ulteriore analisi.
- Effettuare analisi endpoint tagliando gli equivalenti di tessuto in un crio-microtomo a 8 micron sezioni e colorazione per marcatori tessuto-specifiche, come descritto nelle precedenti protocolli 10.
Risultati
Standard in vitro colture tissutali vengono eseguite in condizioni statiche, limitando la diffusione di ossigeno e nutrienti fornitura ai tessuti. Sistemi fluidici, mostrando le caratteristiche di alimentazione migliorate, sono spesso ostacolate dal loro grandi esigenze medie, avendo non fisiologicamente alta media di rapporti tessuti. Così, metaboliti vengono diluiti e cellule non sono in grado di condizionare l'ambiente circostante. Il MOC presentato in questo studio collega due compartimenti separati coltura di tessuti, ciascuno delle dimensioni di un singolo pozzetto di una piastra a 96 pozzetti standard da un sistema di canale microfluidico. La piccola scala del sistema e l'integrazione della pompa sul chip permette al sistema di funzionare a volumi di media di soli 200 a 800 microlitri. Ciò corrisponde ad un supporto sistemico totale rapporto tissutale di 8: 1 a 31: 1, rispettivamente, per i co-colture di tessuto di fegato e la pelle (aventi un volume totale del tessuto di circa 26 microlitri). Il volume del liquido extracellulare totale in un uomo del peso di 73 kg è 14,6 L, di cui il volume di fluido infracapillari è 5.1 L, portando ad un fluido fisiologico extracellulare rapporto tissutale di 1: 4. Pertanto, la quantità di materiale in tutto il sistema di circolazione nel MOC è ancora più grande rispetto alla situazione fisiologica; e tuttavia, rappresenta la più piccola media per rapporto tessuto segnalato finora per sistemi multi-organo 5. Come si mantengono industriali standard formati coltura tissutale, i ricercatori sono in grado di combinare modelli tessuti statici esistenti e già validati all'interno di un flusso di fluido comune. La Figura 1 mostra lo schema di una configurazione sperimentale di possibili co-colture tissutali MOC singolo o multi-tessuto. Biopsie dei tessuti primari e in vitro -Generata equivalenti di tessuto da linee cellulari o cellule primarie possono essere coltivati sia con inserti in colture cellulari a 96 pozzetti o mettendoli direttamente nei compartimenti coltura di tessuti. Come il sistema di canali di interconnessione dei comparti di coltura cellulare è a soli 100 μm di altezza, gli equivalenti dei tessuti che superano queste dimensioni sarà mantenuta entro i comparti della cultura. La endotelizzazione del circuito MOC con HDMECs primarie consente un ulteriore passo in avanti verso una maggiore condizioni di coltura fisiologiche fornendo una struttura vascolare biologica.
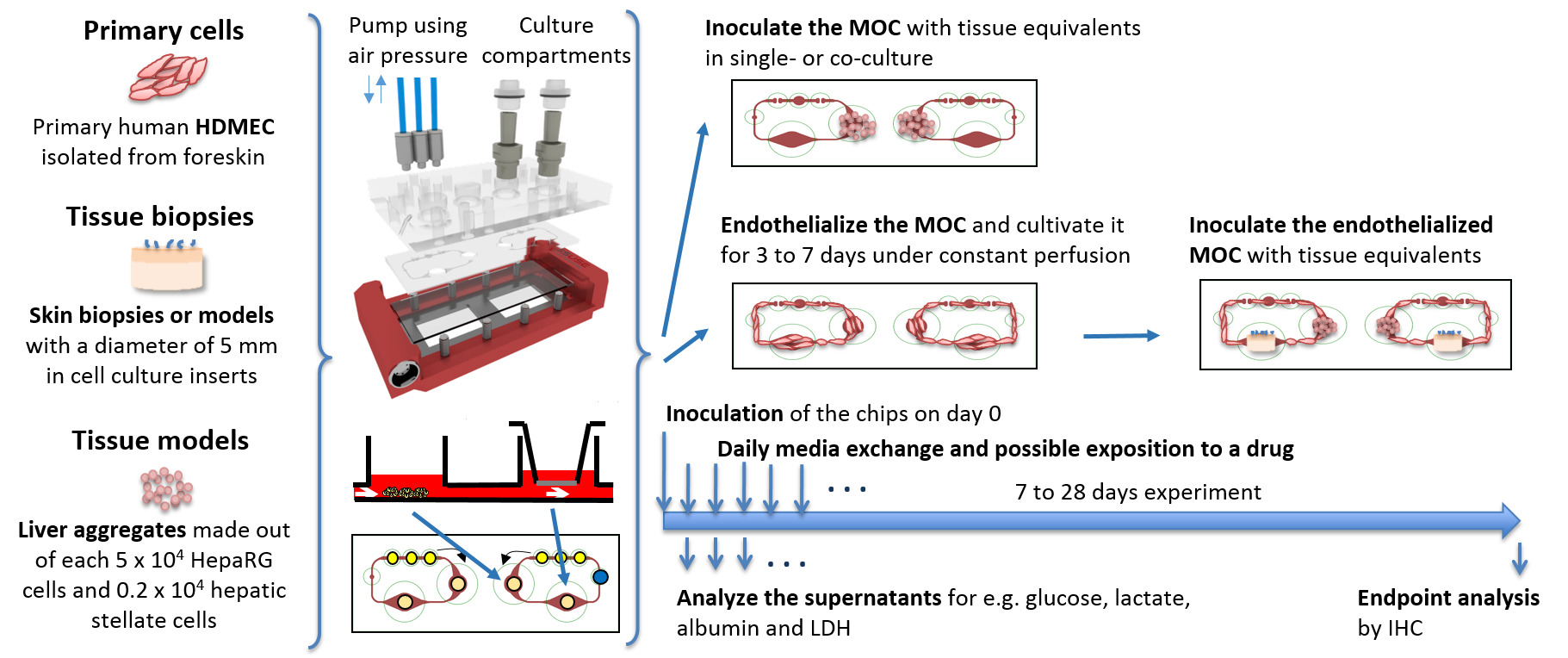
Figura 1:. Rappresentazione schematica di culture MOC equivalenti tessuti sono preparati in condizioni standard in vitro, inoculato nel MOC e coltivato come culture singoli o co-colture in condizioni dinamiche. Vengono eseguiti campioni multimediali giornaliere e analisi dell'endpoint. La pressione dell'aria per azionare la pompa viene applicato attraverso i tre tubi blu collegati al MOC dall'alto. Clicca qui per vedere una versione più grande di questa figura.
Seguendo il protocollo endotelizzazione, una copertura HDMEC confluenti del circuito canale microfluidico è ottenuta entro quattro giorni di coltura dinamica, come mostrato nella Figura 2. Cellule facilmente aderiscono alle pareti del canale MOC, creano un monostrato confluente, e allungano lungo il taglio lo stress (Figura 2B). Inoltre, cellule coprono l'intera circonferenza dei canali, come riportato in precedenza 9. Nessun ulteriore cambiamento nella morfologia endoteliale è stata osservata dopo quattro giorni di coltivazione fino alla fine della cultura.
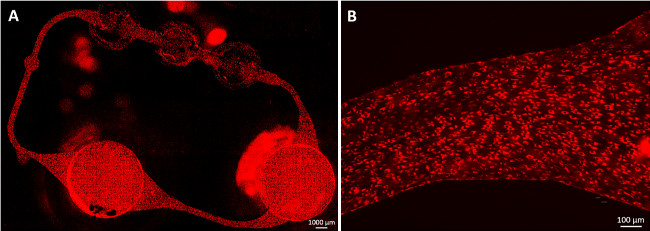
Figura 2:. Endotelizzazione canali MOC cellule endoteliali dermiche microvascolari umano (HDMEC) formano un monostrato confluente nel circuito microfluidica. Le cellule sono state colorate con LDL acetilata dopo 23 giorni di coltura MOC. (A) L'intero mCircuito icrovascular era coperto di cellule e (B), le cellule allungate lungo la sollecitazione di taglio. Barre di scala: (A) 1.000 micron e (B) 100 micron.
In un altro esperimento, sferoidi di cellule del fegato a forma di disco consistenti sono formate da HepaRG e HHSteC durante due giorni di appendere cultura goccia, in quanto questo modello di sistema è stato precedentemente segnalato come adatta per il metabolismo dei farmaci Studi 11 - 13. A scopo dimostrativo, un compartimento coltura di tessuti di ogni circuito MOC è stato seminato con 20 sferoidi in inserti di colture cellulari da 96 pozzetti e tessuti sono stati coltivati oltre 14 giorni in condizioni dinamiche utilizzando MOCS non endotelizzazione. Qualsiasi numero di aggregati o quantità di materiale primario può essere integrato direttamente nei vani o utilizzando inserti di coltura cellulare. Immunofluorescenza degli sferoidi dopo il recupero dal MOC mostra una forte, espressione omogenea per liver-tipico citocheratina 8/18 e di fase I che metabolizzano enzimi del citocromo P450 3A4 e 7A1 (Figure 3A e 3B). La colorazione del trasportatore canalicolare multi-drug resistance protein 2 (MRP-2) ha rivelato un fenotipo polarizzato e l'esistenza di reti canalicoli-like biliari rudimentale (Figura 3C).
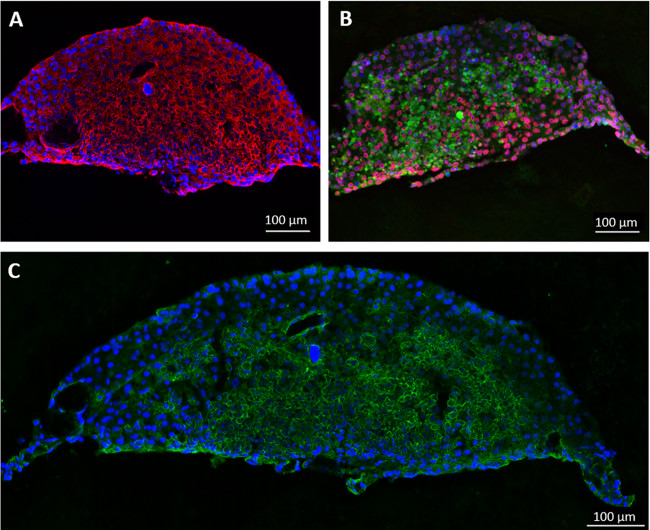
Figura 3 :. Coltivazione di fegato artificiale micro-tessuti umani negli aggregati MOC. Fegato coltivati per 14 giorni nel MOC erano macchiati per (A) citocheratina 8/18 (rosso) e (B) del citocromo P450 3A4 (rosso) e 7A1 (verde). (C) Espressione di canalicular transporter MRP-2 (verde), colorazione nucleare blu. Bar Scala: 100 micron.
Poiché la produzione di albumina è una condizione essenziale delle colture di tessuti del fegato, ha apen selezionato per monitorare l'attività del fegato-tipico della MOC. Analizzando campioni di supporti giornalieri per la produzione di albumina mostra un aumento significativo della velocità di produzione in colture MOC rispetto a colture statiche (Figura 4) e ai valori riportati in letteratura 11. L'aumento del tasso di sintesi di albumina può essere attribuito alla maggiore ossigeno e nutrienti fornitura in culture MOC. Quindi, il MOC è in grado di sostenere aggregati fegato su un periodo di coltura di 14 giorni in uno stato metabolicamente attiva, migliorando il comportamento fegato tipica, come la produzione di albumina.

Figura 4: Quattordici giorni prestazioni sferoide fegato nel MOC produzione Albumina di fegato singole culture di tessuti in MOC e nella cultura statica.. I dati sono medie ± SEM (n = 4).
Subsystemic ripetute test di tossicità dose di Chemicals e cosmetici su animali richiede 21 a 28 giorni di esposizione, come definiti dalla linea guida dell'OCSE n. 410 "di dosi ripetute dermica acuta: 21/28 giorni di studio." Co-colture di pelle di fegato a lungo termine sono esemplificati qui per fino a 28 giorni per far fronte ai requisiti normativi. Un'interfaccia aria-liquido è previsto per dopo l'esposizione sostanza dermica coltivando biopsie cutanee in inserti di colture cellulari da 96 pozzetti. L'esperimento di co-coltura viene eseguita in modo esemplare MOCS endotelizzazione per dimostrare se un coculture tre tessuti in un circuito mediatico combinato può essere mantenuto vitale e metabolicamente attivo più di 28 giorni.
Analisi dell'attività LDH nei sovranatanti multimediali rivelato un livello costante diminuzione durante i primi otto giorni di coltura, che è rimasto costante a circa 80 U / l successivamente (Figura 5). Ciò indica un ricambio del tessuto artificiale ma stabile nel sistema in momenti successivi. Confrontando il coculture tre tessuto unico fegatoesperimenti co-coltura -tissue e fegato-endoteliale, un livello di LDH notevolmente diminuito potevano trovare, soprattutto durante i primi giorni di culture non compresa la pelle. La morte cellulare in questo primo periodo di alta attività LDH si è verificato soprattutto nel comparto cultura pelle, come la pelle dei tessuti singola culture MOC rivelato (dati non riportati). Questo potrebbe essere dovuto alla zona circostante la ferita biopsia a seguito della punzonatura della pelle.
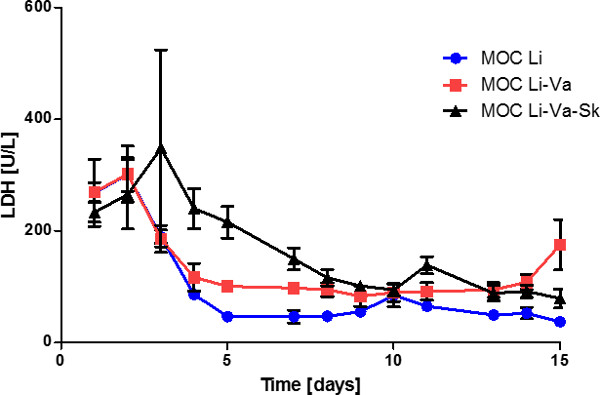
Figura 5: prestazioni tessuto Quindici giorni nell'attività LDH MOC nei sopranatanti dei media di colture di tessuti (fegato singolo MOC Li), culture di fegato in MOCS endotelizzazione (MOC Li-Va) e co-colture fegato-pelle a endotelizzazione MOC (MOC Li. -Va-Sk). I dati sono medie ± SEM (n = 4).
Durante il periodo di coltura di 28 giorni, sferoidi fegato rispettati fondo del MOC uncellule nd cresciuto fuori, formando un collegamento multistrato tra sferoidi adiacenti. Questo non ostacolare la funzionalità del tessuto. Analisi Endpoint mediante immunofluorescenza ha mostrato che sferoidi fegato erano ancora metabolicamente attivi dopo 28 giorni di co-coltura MOC, come mostrato dal citocromo P450 3A4 colorazione (figura 6A). HHSteC stati distribuiti nell'intero equivalente fegato, come mostrato dalla colorazione vimentina (Figura 6B). Un aumento di intensità di colorazione vimentina può essere osservato in aree in cui le cellule erano cresciute di sferoidi. Colorazione per il fattore di von Willebrand (vWF) hanno dimostrato che le cellule endoteliali non erano penetrati in profondità nel tessuto, ma erano in contatto diretto cellula-cellula con gli epatociti esterni (Figura 6c).
Immunoistochimica colorazione delle biopsie cutanee mostrava un'espressione di tenascin C e collagene IV nella membrana basale (Figura 6D), mentre la colorazione del controllo statico mostrato elevatlivelli ED di tenascin C (Figura 6E). Tenascin C ha dimostrato di essere sovraregolata durante la guarigione delle ferite, processi infiammatori e fibrosi, suggerendo indotto processi fibrotici in statico, ma non nelle culture dinamiche 14,15.
Vitalità cellulare stabile e funzionalità dei tessuti dopo una coculture 28 giorni MOC dimostrano che il sistema è in grado di mantenere una combinazione di fino a tre tessuti in un circuito comune media. Cellule primarie, nonché i modelli dei tessuti e biopsie, possono essere coltivate simultaneamente nel sistema MOC.
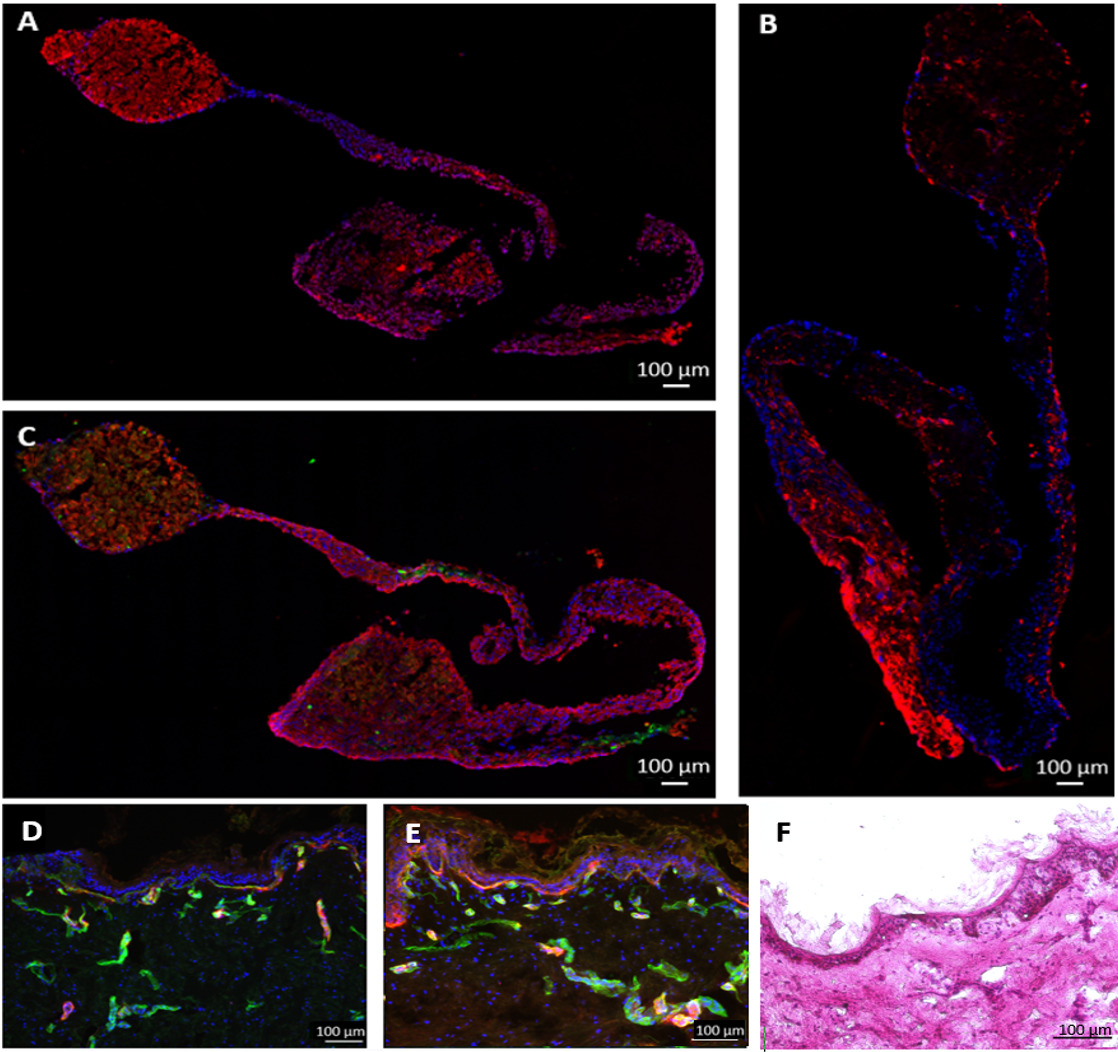
Figura 6:. Prestazioni di culture multi-tessuti oltre 28 giorni equivalenti fegato e biopsie cutanee sono stati coltivati in una funzionalità MOC e cellule endotelizzazione è stato dimostrato da immunocolorazione di (A) Fase I enzimi del citocromo P4503A4 (rosso), (B) vimentina (rosso), (C) citocheratina 8/18 (rosso) e vWF (verde) nel tessuto epatico. Biopsie cutanee cocultivated per 28 giorni (D) nel MOC o (E) in condizioni statiche sono state colorate per tenascin c (rosso) e collagene IV (verde), colorazione nucleare blu. (F) H & E colorazione della pelle dopo 28 giorni di coltura MOC. Bar Scala: 100 micron.
Discussione
La piattaforma MOC descritto rappresenta uno strumento stabile e potente per la coltivazione di tessuti di varia origine in condizioni di flusso medie dinamiche per periodi prolungati di coltura 10,16. In questo esempio, la piattaforma è stato usato per coltivare le cellule primarie (HDMEC), equivalenti tessuto generati da una linea cellulare (aggregati fegato), e un co-coltura del citato con una biopsia tissutale. La MOC è stato in grado di sostenere la co-coltura di tre tessuti fino a 28 giorni in un circuito medio combinato. Per quanto a conoscenza degli autori, questa è la prima volta un coculture multi-tessuto comprese biopsie, cellule primarie e linee cellulari è stata eseguita per quattro settimane.
Uno dei principali inconvenienti dei sistemi microfluidici è l'affinità di piccole molecole di aderire al materiale di superficie del circuito fluidico. Poiché il rapporto tra superficie e volume è particolarmente elevata in sistemi microfluidici, questo effetto diventa ancora più pronunciato 17 . La copertura HDMEC stabile dei canali, introdotto qui, potrebbe agire da barriera biologica impedire l'adesione delle molecole al MOC. Inoltre, può servire come un vaso emocompatibilità per tutta la circolazione sanguigna, impedendo la coagulazione del sangue. Tuttavia, l'uso del sangue intero come sostituzione terreno non è fattibile, come non è ancora stato raggiunto un vascolarizzazione completa degli equivalenti organi. Lavori per la vascolarizzazione dei tessuti -Generata in vitro esistente è promettente e guida la strada a ulteriori studi 18,19.
È ben noto che epatociti tendono a perdere le loro funzioni specifiche fegato nel tempo sotto statico bidimensionali in vitro condizioni di coltura 20. Enzimi del metabolismo, come la famiglia del citocromo P450, sono di particolare importanza se il metabolismo di un certo farmaco è da studiare. Citocromo P450 3A4, un enzima legato alla biotrasformazione di molti xenobiotici, e citocromo P450 7A, which è coinvolto nella sintesi degli acidi biliari, sono stati espressi nel fegato aggregati coltivate in MOC oltre 14 giorni. Ciò indica la conservazione di un fenotipo metabolicamente attiva, consentendo studi sul metabolismo farmaco. L'aumento del tasso di produzione di albumina di aggregati nel MOC rispetto alle culture statiche è un'indicazione supplementare per adeguate condizioni di coltura. I tassi di produzione di albumina osservati nel corso di questo studio sono stati paragonabili o addirittura superiori a quelli precedentemente riportati ottenuti da chip microfluidici tra cui cellule HepG2 21 - 23, invece, i valori non ha raggiunto quelli delle culture di epatociti umani primari 24. Inoltre, il sistema MOC, nella sua configurazione temporanea, non consente una separazione separata di bile. Le cellule in strutture aggregate canalicoli simili biliari polarizzati e formati, come mostrato dal MRP-2 colorazione. Tuttavia, tali canalicoli non erano collegati ad un canale tecnica raccolta della bile. Questo mix non-fisiologicazione della bile con il vano di sangue deve essere affrontata in un futuro riprogettazione del sistema.
La regolazione delle caratteristiche di flusso è di grande importanza 25, soprattutto per quanto riguarda i tessuti sensibili a sollecitazioni di taglio, come il fegato. La quantità di sollecitazione di taglio percepito dal tessuto può essere modificata in due modi: in primo luogo, la pressione dell'aria usata per spingere le membrane della pompa può essere abbassata, diminuendo valori di picco della tensione tangenziale nel sistema. In secondo luogo, i tessuti possono essere incorporati in una stratificazione matrice extracellulare o coltivati in inserti cultura transwell. Quest'ultimo schermare i tessuti della corrente sottostante con una membrana porosa. Queste regolazioni devono essere eseguite su base individuale per ogni equivalente organo prima di iniziare l'esperimento MOC. A un'operazione pulsatile di 2,4 Hz, per esempio, che corrisponde ad una elevata attività, ma ancora fisiologica cardiaca di 144 battiti / min nell'uomo, la sollecitazione di taglio misurata nelcanali del circuito microvascolare raggiunge circa 25 dine / cm 2. Ciò corrisponde ad una sollecitazione di taglio fisiologico alla fine più alto della scala in microcircolo ed è, quindi, ben applicabile per esperimenti compresa una endotelizzazione dei canali. Tuttavia, poiché la corrente di layout microfluidica del sistema MOC presentata consiste di un solo circuito di media che collega i due compartimenti organo, un tasso di sollecitazione di taglio e la velocità di pompaggio deve essere scelto per l'intero sistema. Pertanto, un adeguamento preciso delle caratteristiche di flusso alle esigenze di ogni singolo organo non è sempre fattibile.
Inoltre, la cura deve essere presa nella regolazione delle cellule per mezzo di comuni. Le cellule vengono coltivate in MOC in un circuito di media combinata, quindi, nessun individuo mezzi di coltura cellulare può essere utilizzato per ogni modello di tessuto, come è lo standard per coltura cellulare in vitro. Una formulazione dei media combinato minima deve essere definito in anticipo e tegli le cellule devono essere adeguate graduale a questo nuovo media. Una procedura di regolazione del 80% / 20% vecchio per nuovi media per due giorni, poi 50% seguita / 50% del 20% / 80%, e uno scambio sempre portato a una vitalità cellulare ragionevole e la funzionalità delle culture nelle nostre mani.
L'attuale assetto microfluidica del sistema MOC permette di co-coltura fino a tre tessuti. È necessaria una co-coltura di almeno il dieci organi più importanti del corpo umano per raggiungere omeostasi. Pertanto, il sistema presentato è in grado di predire interazioni tessuto tessuto specifici, ma non il vero risposta sistemica a una sostanza. Un ulteriore sviluppo del MOC per includere più cavità di organi è prevista. Inoltre, la validità del sistema deve essere mostrato utilizzando una serie di composti di riferimento. Preferibilmente, composti che hanno fallito durante gli studi clinici (come Troglitazone) devono essere testati per la loro performance nel MOC. Considerando che, una vera e propria convalida di tali sistemi complessi è ancora ostacolato by la mancanza di standardizzazione relativa biomarcatori e endpoint per la valutazione funzionale, raccogliendo più dati sulle prestazioni tossicologici di questa e simili sistemi amplierà la loro affidabilità e l'area di applicazione.
Divulgazioni
Uwe Marx è Amministratore Delegato di TissUse GmbH che produce e commercializza la piattaforma Multi-Organ chip utilizzati in questo articolo. Questa pubblicazione è stata finanziata con un premio concesso da Corning Inc.
Riconoscimenti
Il lavoro è stato finanziato dal Ministero federale tedesco per l'Istruzione e la ricerca, GO-Bio di Grant No. 0.315.569.
Materiali
| Name | Company | Catalog Number | Comments |
| HepaRG cells | Biopredic International | undifferentiated cells | |
| HHSteC | ScienCell Research Laboratories | cells and all culture supplements | |
| HepaRG Medium | Sigma-Aldrich | William's Medium E 10% FCS 100 U/ml penicillin 100 µg/ml streptomycin 5 µg/ml human insulin 2 mM L-glutamine 5 x 10-5 M hydrocortisone hemisuccinate | |
| HDMEC Medium | PromoCell | Endothelial Cell Growth Medium MV2 with Supplement-Pack MV2 and 1% penicillin-streptomycin | |
| Dimethyl sulfoxide | Carl Roth | add 2% to HepaRG media | |
| Trypsin/EDTA | Biowest | ||
| Trypsininhibitor | Carl Roth | ||
| MAXYMum Recovery Tips | Corning | 1,000 µl Pipet Tips Wide Bore | |
| 384-Well Hanging Drop Plate | 3D Biomatrix | Perfecta 3D 384-Well Hanging Drop Plate | |
| Tissue culture flasks | Corning | 75 cm2 | |
| Ultra-low attachment plate | Corning | 24-well | |
| Transwell cell culture inserts | Corning | 96-well unit, 0.4 µm pore size | |
| Deep well plates | Corning | 96-well, 1 ml | |
| Biopsy punch | Stusche | 4.5 mm | |
| Glass microscope slide | Menzel | footprint of 75 x 25 mm | |
| Polydimethylsiloxane | Dow Corning | Sylgard 184 | |
| Silicon rubber additive | Wacker Chemie | Wacker Primer G790 | |
| Tubes for air pressure | SMC Pneumatik GmbH | Polyurethan-Schlauch, metrisch | |
| Alumin ELISA | Bethyl Laboratories | Human Albumin ELISA Quantitation Set | |
| Lactate dehydrogenase assay | Stanbio Laboratory | LDH Liqui-UV kit | |
| Alexa Fluor 594 acetylated LDL | Invitrogen | 1 mg/ml |
Riferimenti
- Kelm, J. M., Fussenegger, M. Microscale tissue engineering using gravity-enforced cell assembly. Trends in biotechnology. 22 (4), 195-202 (2004).
- Marx, U., Walles, H., et al. Human-on-a-chip Developments: A Translational Cutting-edge Alternative to Systemic Safety Assessment and Efficiency Evaluation of Substances in Laboratory Animals and Man. ATLA. 40 (5), 235-257 (2012).
- Baudoin, R., Griscom, L., Prot, J. M., Legallais, C., Leclerc, E. Behavior of HepG2/C3A cell cultures in a microfluidic bioreactor. Biochemical Engineering Journal. 53 (2), 172-181 (2011).
- Dash, A., Inman, W., et al. Liver tissue engineering in the evaluation of drug safety. Expert opinion on drug metabolism & toxicology. 5 (10), 1159-1174 (2009).
- Materne, E. -M., Tonevitsky, A. G., Marx, U. Chip-based liver equivalents for toxicity testing--organotypicalness versus cost-efficient high throughput. Lab on a chip. 13 (18), 3481-3495 (2013).
- Huh, D., Torisawa, Y., Hamilton, G. a, Kim, H. J., Ingber, D. E. Microengineered physiological biomimicry: organs-on-chips. Lab on a chip. 12 (12), 2156-2164 (2012).
- Sin, A., Chin, K. C., Jamil, M. F., Kostov, Y., Rao, G., Shuler, M. L. The design and fabrication of three-chamber microscale cell culture analog devices with integrated dissolved oxygen sensors. Biotechnology progress. 20 (1), 338-345 (2004).
- Tatosian, D. a, Shuler, M. L. A novel system for evaluation of drug mixtures for potential efficacy in treating multidrug resistant cancers. Biotechnology and bioengineering. 103 (1), 187-198 (2009).
- Schimek, K., Busek, M., et al. Integrating biological vasculature into a multi-organ-chip microsystem. Lab on a chip. 13 (18), 3588-3598 (2013).
- Wagner, I., Materne, E. -M., et al. A dynamic multi-organ-chip for long-term cultivation and substance testing proven by 3D human liver and skin tissue co-culture. Lab on a chip. 13 (18), 3538-3547 (2013).
- Vieira, U., et al. HepaRG human hepatic cell line utility as a surrogate for primary human hepatocytes in drug metabolism assessment in vitro. Journal of pharmacological and toxicological methods. 63 (1), 59-68 (2010).
- Abu-Absi, S. F., Hansen, L. K., Hu, W. -S. Three-dimensional co-culture of hepatocytes and stellate cells. Cytotechnology. 45 (3), 125-140 (2004).
- Leite, S. B., Wilk-Zasadna, I., et al. Three-dimensional HepaRG model as an attractive tool for toxicity testing. Toxicological sciences. 130 (1), 106-116 (2012).
- Chiquet-Ehrismann, R. Tenascins. The international journal of biochemistry & cell biology. 36 (6), 986-990 (2004).
- Sidgwick, G. P., Bayat, A. Extracellular matrix molecules implicated in hypertrophic and keloid scarring. Journal of the European Academy of Dermatology and Venereology JEADV. 26 (2), 141-152 (2012).
- Ataç, B., Wagner, I., et al. Skin and hair on-a-chip: in vitro skin models versus ex vivo tissue maintenance with dynamic perfusion. Lab on a chip. 13 (18), 3555-3561 (2013).
- Wu, M. -H., Huang, S., Lee, G. -B. Microfluidic cell culture systems for drug research. Lab on a chip. 10 (8), 939-956 (2010).
- Schanz, J., Pusch, J., Hansmann, J., Walles, H. Vascularised human tissue models A new approach for the refinement of biomedical research. Journal of Biotechnology. 148 (1), 56-63 (2010).
- Holnthoner, W., Hohenegger, K., et al. Adipose-derived stem cells induce vascular tube formation of outgrowth endothelial cells in a fibrin matrix. J Tissue Eng Regen Med. , (2012).
- Dunn, J. C. Y., Yarmush, M. L., Koebe, H. G., Tompkins, R. G. Hepatocyte function and extracellular matrix geometry: long-term culture in a sandwich configuration. FASEB Journal. 3, 174-177 (1989).
- Leclerc, E., Sakai, Y., Fujii, T. Microfluidic PDMS (polydimethylsiloxane) bioreactor for large-scale culture of hepatocytes. Biotechnology progress. 20 (3), 750-755 (2004).
- Kim, M. S., Yeon, J. H., Park, J. -K. A microfluidic platform for 3-dimensional cell culture and cell-based assays. Biomedical microdevices. 9 (1), 25-34 (2007).
- Prot, J. -M., Aninat, C., et al. Improvement of HepG2/C3A Cell Functions in a Microfluidic Biochip. Biotechnology and bioengineering. 108 (7), 1704-1715 (2011).
- Riccalton-Banks, L., Liew, C., Bhandari, R., Fry, J., Shakesheff, K. Long-term culture of functional liver tissue: three-dimensional coculture of primary hepatocytes and stellate cells. Tissue engineering. 9 (3), 401-410 (2003).
- Powers, M. J., Domansky, K., et al. A Microfabricated Array Bioreactor for Perfused 3D Liver Culture. Biotechnology and Bioengineering. 78 (3), 257-269 (2002).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon