Method Article
O Chip Multi-organ - Uma plataforma microfluídica para longo prazo Coculture Multi-tecidos
Neste Artigo
Resumo
Here, we present a protocol to coculture primary cells, tissue models and punch biopsies in a microfluidic multi-organ chip for up to 28 days. Human dermal microvascular endothelial cells, liver aggregates and skin biopsies were successfully combined in a common media circulation.
Resumo
The ever growing amount of new substances released onto the market and the limited predictability of current in vitro test systems has led to a high need for new solutions for substance testing. Many drugs that have been removed from the market due to drug-induced liver injury released their toxic potential only after several doses of chronic testing in humans. However, a controlled microenvironment is pivotal for long-term multiple dosing experiments, as even minor alterations in extracellular conditions may greatly influence the cell physiology. We focused within our research program on the generation of a microengineered bioreactor, which can be dynamically perfused by an on-chip pump and combines at least two culture spaces for multi-organ applications. This circulatory system mimics the in vivo conditions of primary cell cultures better and assures a steadier, more quantifiable extracellular relay of signals to the cells.
For demonstration purposes, human liver equivalents, generated by aggregating differentiated HepaRG cells with human hepatic stellate cells in hanging drop plates, were cocultured with human skin punch biopsies for up to 28 days inside the microbioreactor. The use of cell culture inserts enables the skin to be cultured at an air-liquid interface, allowing topical substance exposure. The microbioreactor system is capable of supporting these cocultures at near physiologic fluid flow and volume-to-liquid ratios, ensuring stable and organotypic culture conditions. The possibility of long-term cultures enables the repeated exposure to substances. Furthermore, a vascularization of the microfluidic channel circuit using human dermal microvascular endothelial cells yields a physiologically more relevant vascular model.
Introdução
Em monocamada ou em suspensão actuais ensaios de cultura de células para o desenvolvimento de drogas não estão a emular o microambiente celular humano e, por conseguinte, levar a um desdiferenciação rápida e perda de função em culturas primárias de células humanas. Modelos de tecido com maior relevância fisiológica são necessários para prever a eficácia e segurança de compostos para os admitir ensaios clínicos. Recentemente, a norma de técnicas de cultura de células in vitro têm evoluído a partir de culturas de monocamadas bidimensionais para modelos multi-celulares tridimensionais, com o intuito de imitar o tecido microambiente in vivo. Estes sistemas já demonstraram melhorias importantes no sentido de predição mais precisa do modo de acção dos compostos 1,2. Além disso, adaptando as condições de cultura in vitro para as necessidades altamente especializados de células é de particular interesse.
Sob padrão em condições in vitro, uma variedade de cul importantetura parâmetros, tais como nutrientes e oxigénio de alimentação, a remoção de produtos de acumulação, e força mecânica que actuam sobre as células, muitas vezes não pode ser completamente controlada, na maioria dos casos. Muitos órgãos possuem gradientes de concentração fisiologicamente relevantes de substâncias e oxigênio dissolvido. No entanto, essas condições altamente regulamentados e otimizados estão em clara oposição aos gradientes de difusão incontroláveis em torno dos tecidos em condições in vitro, o que leva a um ambiente altamente instável e limitar o desenvolvimento celular 3. Deste modo, mais estável e mais especialmente quantificáveis em condições in vitro são necessários para manter as células viáveis e diferenciada ao longo de períodos de tempo prolongados. Sistemas de irrigação sanguínea, onde os componentes do meio são regularmente removidos e substituídos, são muitas vezes melhor caracterizado e controlável do que as culturas estáticas referentes à envolvente directa de tecidos. Em condições estáticas, gradientes de difusão de secreções celulares e nutrientes do meio de culturapode cercar as células cultivadas 3. Introduzindo bem caracterizados vazões médias em torno dos tecidos permitem que as secreções celulares para misturar com o meio rico através de perfusão. Isto permite a geração de micro-ambientes celulares definidas, assegurando um fenótipo celular estável e a expressão da enzima metabolizadora durante todo o período de ensaio 4.
Desenvolvimentos recentes no chip de múltiplos órgãos (MOC) à base de sistemas de combinar os benefícios de um fluxo médio controlada em torno de engenharia dos tecidos com as pequenas exigências de médio e massa celular de biorreatores em microescala, levando a uma diminuição da quantidade de substância necessária durante o teste. Vários sistemas microfluídicos para cultura de tecidos foram descritas até agora 5,6. Rácios dos tecidos para o fluido dentro destes sistemas desempenham um papel especialmente importante na simulação de crosstalk celular fisiologicamente relevante. No entanto, devido a limitações técnicas, como o uso de bombas e reservatórios externos de mídia, the global circulando volume de mídia na maioria dos sistemas é muito grande em comparação com os volumes de tecidos. O grupo de Shuler et al., Foram os primeiros a desenvolver um sistema que garanta tempos de residência adequados de substâncias no interior dos compartimentos de cultura de células e in vivo relevantes tecido-para-fluido rácios de 7,8. Isto foi conseguido dimensionando o reservatório externo para baixo para uma placa de 96 poços, também representando o compartimento "outros tecidos". A fim de minimizar o volume de mídia que circula dentro da nossa plataforma MOC, integramos uma micropump peristáltica on-chip, eliminando a necessidade de circuitos de mídia externa. Este micropump é capaz de operar o sistema em um número selecionável das velocidades de fluxo de mídia e as taxas de tensão de cisalhamento 9. Um sistema de canais de microfluidos de 500 mm de largura e 100 mm de altura interliga dois espaços de cultura de tecidos padronizados, cada um tendo o tamanho de um único poço de uma placa de 96 poços. Aderindo aos tamanhos de padrão da indústria bem placas permite a integração de tecido modelos já existentes produzidos no formato transwell. Além disso, a posição vertical de inserções Transwell de cultura de células é ajustável, permitindo o cultivo de modelos de tecido, que não somente são directamente expostos ao fluxo do fluido, mas também pode ser levantado e protegido contra a corrente subjacente. Da mesma forma, as culturas interface ar-líquido são viáveis utilizando este sistema.
A plataforma MOC é fabricada a partir de uma camada de polidimetilsiloxano (PDMS) 2 mm de altura e uma lâmina de microscópio de vidro com uma área de 75 x 25 mm 2, que está permanentemente ligada por baixo de oxidação de plasma à pressão para formar o circuito de microfluidos estanque a fluidos. A camada de PDMS contendo os respectivos canais e compartimentos de cultura de células é produzido por litografia macia padrão e réplica moldagem 9. O projeto de microfluídica do MOC usado durante este estudo consistiu de dois circuitos microfluídicos separados por chip, cada um segurando duas células cultura compartimentos interligados por um sistema de canal de 100 mm de altura. Isto permitiu que o desempenho de dois co-culturas de dois tecidos individuais utilizando um chip de múltiplos órgãos. Frequências de bombeamento foram ajustados para produzir vazões médias de 40 mL / min.
Este projeto MOC de dois tecido fornecido a capacidade de co-cultura um esferóide fígado e uma biópsia de pele em espaços de cultura, embora estejam em um circuito de mídia combinados sob condições de fluxo fisiológicas. Células diferenciadas HepaRG foram agregadas com células estreladas hepáticas humanas (HHSteC) na proporção de 24: 1, para formar esferóides homogéneas. Esta proporção foi encontrado para ser óptima, tal como observado em experiências anteriores 10, embora, quase o dobro do número de hepatócitos foram usadas em comparação com a situação in vivo. A pele foi cultivada a uma interface ar-líquido no interior de uma inserção de cultura de células Transwell, permitindo, assim, a exposição à substância tópica. Estes modelos de tecido foram co-cultivadas durante 28 days no MOC para demonstrar a abrangência deste sistema. Além disso, o circuito de microfluidos canal dos chips foi totalmente coberta com células endoteliais microvasculares dérmicas humanas (HDMEC) para simular mais de perto o sistema vascular.
Protocolo
NOTA: prepúcio juvenil humano foi obtido com o consentimento informado e aprovação ética (Comitê de Ética Charité University Medicine, Berlim, Alemanha), em conformidade com a legislação pertinente, a partir de uma cirurgia pediátrica após circuncisão de rotina.
1. Produção de equivalentes de tecidos para Cultivo no MOC
- Agregar HepaRG e HHSteC em pendurar placas gota para gerar esferóides de fígado.
- A fim de alcançar a tripsinização de células HepaRG cultivadas em frascos de cultura de células (75 cm2), remover o meio de confluência, culturas de monocamada diferenciadas, lavar duas vezes com PBS, e adicionar 3 ml de 0,05% de tripsina / EDTA. Incubar durante 3 a 5 min a 37 ° C e parar a reacção pela adição de 6 ml de inibidor de tripsina.
- Centrifugar as células HepaRG em 150 xg durante 5 minutos, remover o sobrenadante, ressuspender o sedimento de células em 1 ml de meio de cultura celular HepaRG, e contar as células. A viabilidade celular deve ser> 90%.
- EmPara atingir a tripsinização de células HHSteC, remover o meio de culturas em monocamada, lavar duas vezes com PBS, e adicionar 3 ml de 0,05% de tripsina / EDTA. Incubar durante 5 min a 37 ° C e parar a reacção pela adição de 6 ml de inibidor de tripsina.
- Centrifugar as células HHSteC a 150 xg durante 5 minutos, remover o sobrenadante, ressuspender o sedimento de células em 1 ml de meio de cultura celular HepaRG, e contar as células.
- Combinar HepaRG HHSteC e a uma razão de 24: 1 em HepaRG meio de cultura celular. Para fazer isso, ajustar o número de células por diluição de suspensões de células em meio de cultura celular HepaRG e adicionar 1 x 10 5 células / ml HHSteC a 4,8 x 10 6 células / ml de células HepaRG. Misture com cuidado.
- Prepara-se uma placa de gota em suspensão por adição de 2 ml de PBS para as gotas de suspensão e placa de receptor.
- Pipetar 20 ul da suspensão de células em cada poço da placa de gota em suspensão. Sempre preparar cerca de 10% a mais do que o enforcamento cai você precisa recuperar agregados, como alguns agregados são perdidos During do procedimento. Com cuidado, coloque a placa em um 37 ° C incubadora. Espere 48 horas para os esferóides a se formar.
- A fim de recuperar os esferóides, certifique-se de usar as pontas de pipeta com finais grande dica ou cortar as pontas de uma dicas ml de pipeta com uma faca estéril, a fim de alargar a abertura de cerca de 2 a 3 mm. Use essas dicas de pipetas para lidar com os esferóides, sem perturbar-los.
- Lavar cuidadosamente esferóides da placa de gota em suspensão adicionando repetidamente 1 ml de meio para o topo das cavidades da placa de gota em suspensão usando uma pipeta. Lava-se a placa até que todos os esferóides ter caído. Os esferóides são ligeiramente com um diâmetro médio de 300 a 400 mm e uma altura de 200 a 300 mm, neste ponto em forma de disco.
- Recolha os esferóides na placa receptor e transferi-los para placas de 24 poços ultra-baixas de ligação com um máximo de 20 esferóides por poço usando as pontas de pipeta preparadas. Ajuste os volumes de mídia em cada poço a 0,5 ml. Use 20 agregados para inocular um circuito MOC para obter uma taxa de miniaturização de 1 / 100.000 em relação a em números de células in vivo.
- Incubar os esferóides a 37 ° C e 5% de CO 2 até à sua utilização no MOC. Não guarde os esferóides mais de três dias antes do uso para garantir a comparabilidade. Cultive os agregados por pelo menos um dia em placas de ultra-baixas de fixação para recuperar os esferóides homogêneos.
- Prosseguir qualquer uma das duas abordagens para gerar equivalentes de tecido da pele: o uso de biópsias (1.2.1) ou o uso de ready-made em modelos de tecidos in vitro (1.3.1).
- Corte com uma faca transwells incandescente abaixo do suporte para preparar 96 poços inserções de cultura de células e armazenar em condições estéreis até à sua utilização.
- Esterilizar amostras prepúcio em etanol a 80% durante 30 segundos e cortar o anel aberto. As amostras devem ter uma altura média de 2 mm.
- Use um perfurador de biópsia para cortar biópsias de diâmetro de 4,5 mm para obter um miniaturiza igualproporção ção tanto para o fígado e pele. Coloque as biópsias para o preparado de 96 poços transwell insere com uma pinça. Tome cuidado para posicionar as biópsias com lado epidérmico voltado para cima.
- Cultura celular lugar insere com biópsias em uma placa de receptor contendo HepaRG meio de cultura de células e armazenar a 37 ° C e 5% de CO 2 até à sua utilização no MOC. Do armazenar amostras não mais do que 2 a 3 horas.
- Integrar ready-made em modelos in vitro de pele, comprado de vários fornecedores, para o MOC, certificando-se que eles estão em 96 poços transwell formato. Utilizar o meio de cultura de células fornecida pelo vendedor, ou, se uma co-cultura com outro tecido é concebida de uma nova etapa, usar um meio mínimo suportando ambos os tecidos. Testar o respectivo meio mínimo em experiências estáticas anteriores pela sua capacidade de suportar os tecidos.
- Recuperar modelos de pele da placa titular e cortar as inserções de 96 poços abaixo do suporte com uma faca incandescente.
- Coloque as pastilhas de volta para a placa de receptor e armazenamento a 37 ° C e 5% de CO 2 até à sua utilização no MOC. Não faça armazenar amostras com mais de um dia.
2. Fabrication MOC
- Misturar o PDMS e agente de cura, na proporção de 10: 1 (v / v) e coloca-se a mistura sob vácuo durante 15 min para remover as bolhas de ar.
- Enquanto isso, o tratamento de uma tampa de placa de policarbonato com o aditivo de borracha de silicone a 80 ° C durante 20 min.
- Inserir parafusos de teflon em furos respectivos da tampa de placa para criar os quatro PDMS-livres compartimentos de cultura de células e as membranas de seis PDMS, 500 mm de espessura, da microbomba.
- Conecte o cover-placa preparado para o molde mestre dos dois circuitos microvasculares e injetar os PDMS desgasificados. Tome cuidado para não integrar as bolhas de ar no sistema. Se as bolhas surgem, tentar removê-los pela inclinação do dispositivo.
- Incubar o sistema a 80 ° C durante 60 minutos para curar a camada de PDMS.
- Retirar o molde mestre e os parafusos de teflon do dispositivo e ligar a camada de PDMS de uma lâmina de vidro com uma pegada de 75 x 25 mm 2, utilizando a oxidação de plasma de baixa pressão.
- Parafuso adaptadores especiais MOC fio para todos os quatro compartimentos de cultura de células da tampa da placa.
- Conecte-se seringas contendo meio de cultura para Luer fêmea x ¼ de 28 adaptadores masculinos e aperte-os para os adaptadores MOC da tampa da placa.
- Injectar o meio para o circuito de microfluídica por várias vezes empurrando para baixo e puxando para cima os êmbolos seringas.
- Verificar o enchimento apropriado dos canais com meio sob o microscópio.
3. Endotelização do MOC
- Antes endothelializing MOC, lave cada circuito MOC com meio de crescimento de células endoteliais e incubar que estaticamente durante três dias a 37 ° C e 5% de CO 2.
- Esterilizar os MOCs usando um etanol limpar e colocá-los sob uma bancada de fluxo laminar. EUn disso, esterilizar dois pares de fórceps e duas chaves hexagonais para uso posterior.
- Solte as tampas do compartimento de cultura de tecidos do MOC utilizando as teclas hexagonais e remover as tampas usando a pinça. Depois de inserir a forma, as tampas de rosca de volta para os MOCs da mesma maneira.
- A fim de alcançar a tripsinização de células endoteliais microvasculares dérmicas humanas (HDMEC), remover o meio das culturas de monocamada, lavar duas vezes com PBS, e adicionar 3 ml de 0,05% de tripsina / EDTA. Incubar durante 5 min a 37 ° C e parar a reacção pela adição de 6 ml de inibidor de tripsina.
- Centrifugar a HDMEC a 220 xg durante 5 minutos, remover o sobrenadante, ressuspender o sedimento de células em 1 ml de meio de crescimento de células endoteliais, e contar as células. A viabilidade celular deve ser> 90%.
- Ajustar a contagem de células na suspensão de células para uma concentração final de 2 x 10 7 células / ml, diluindo-o com meio de crescimento de células endoteliais e transferir 250 ul do mesmo parauma seringa de 1 ml. Aplicar esta concentração de células para o MOC para manter a taxa de miniaturização de 1 / 100.000 para todos os órgãos.
- Conecte-se a seringa com uma fêmea Luer x ¼-28 adaptador macho, expulsar o ar para fora desta montagem, e aperte-o a um adaptador especial MOC discussão. Ligue o adaptador para um dos dois compartimentos de cada circuito MOC.
- Conectar uma seringa vazia, da mesma forma para o segundo compartimento do circuito de MOC.
- Injetar as células de maneira uniforme, empurrando para baixo e puxando para cima os dois êmbolos das seringas várias vezes de forma consecutiva. Controlar a infusão de células sob o microscópio.
- Incubar a MOC a 37 ° C e 5% de CO2, em condições estáticas, durante 3 horas para permitir que as células a aderir às paredes do canal.
- Retire o chip da incubadora, colocá-lo sob um banco de fluxo laminar, e substituir as seringas e as placas MOC com MOC fio câmaras de cultura de células especiais.
- Adicionar 400 ul de meio fresco a uma compartamento de cada circuito MOC e deixe lavar por meio dos canais por pressão hidrostática. Depois disso, substituir o meio em ambos os compartimentos com 300 ul de meio fresco.
- Feche os compartimentos usando bonés, conforme descrito no ponto 3.1.2.
- Ligue o chip para a unidade de controlo da bomba. Ajustar a velocidade de bombeamento a uma frequência de 0,475 Hz e cultivar o chip a 37 ° C e 5% de CO 2.
- Substituir o meio de cada compartimento MOC cada um a dois dias e monitorar a morfologia celular por microscopia de luz.
4. A carga do Chip
- Coloque a MOC sob a bancada de fluxo laminar e abri-la, tal como descrito no passo 3.1.2.
- Remova a mídia dos compartimentos de cultura de tecidos e substituí-la por 300 mL de fresco HepaRG meio de cultura celular.
- Transferir 20 esferóides pré-formados para o compartimento cultura um tecido de cada circuito MOC usando as pontas de pipeta com uma ampla abertura (veja os passos 1.1.8 / 9). Feche a cap usando uma pinça e chaves hexagonais.
- Transferência de 96 poços de cultura de células que contêm inserções de equivalentes de pele para o compartimento de cultura de tecidos remanescentes de cada circuito MOC usando uma pinça. Tome cuidado para evitar a formação de bolhas abaixo da membrana do equivalente de pele. A fim de fazer isso, insira transwells em um ângulo ligeiramente inclinado e empurrar para baixo suavemente. Remover o excesso de meio em torno do transwell sendo empurrada para cima a partir de baixo com uma pipeta.
- Feche a tampa com a pinça e chaves hexagonais.
5. Ligar o Chip para a Unidade de Controle de Bomba
- Parâmetros operacionais fixados nas unidades de controle para os valores desejados. Modificar a pressão do ar de 0 a 8000 mbar, de vácuo de 0 a -800 mbar, e bombeando frequência 0,24-2,4 Hz. Definir a direção de bombeamento no sentido horário ou anti-horário.
- Retire os MOC contendo equivalentes de tecido debaixo da bancada de fluxo laminar e conectá-lo às unidades de controle da bomba.
- Seguindo o numeratião sobre os tubos, inserir tubos de pressão de ar para as respectivas peças situadas no MOC.
- Cultivar a MOC a 37 ° C e 5% de CO 2 em uma incubadora ou, no caso de imagiologia de tecidos vivos, utilizar o suporte MOC para aquecer o chip a 37 ° C e cultivar o chip fora da incubadora. Utilizar o suporte aquecido para cultivar as células no MOC sob um microscópio padrão.
6. Realizar Exchanges Media, Amostragem de mídia e exposição a substâncias
- Realizar a troca de meios de rotina todos os dias ou em dias alternados, considerando o tipo de tecido cultivado e a actividade metabólica das células.
- Recuperar o MOC da incubadora e observá-lo sob o microscópio para controlar taxas de fluxo de mídia e verificar se há contaminação.
- Desligue o MOC da unidade de controle da bomba, retirando o tubo de pressão de ar. Esterilizar o MOC usando lenços de etanol e colocá-lo sob a bancada de fluxo laminar.
- Abra a cultura de tecidos compartment contendo os esferóides de fígado, tal como descrito no passo 3.1.2.
- Remove-se a 200 ul a partir do compartimento, utilizando uma pipeta, sem perturbar os esferóides e armazenar a forma de um poço de uma placa vazia de poços profundos. Analisar a amostra do meio directamente ou fechar a placa de poços profundos e armazenar as amostras de meio a -80 ° C para posterior análise.
- Substituir a forma do MOC com meio de cultura de células até 250 ul fresco e fechar a tampa. A diferença na quantidade de meio removido e contas para a perda substituído devido a pequenas quantidades vazando do chip ao fechar o sistema.
- Abra a tampa do compartimento de cultura de tecido que prende os equivalentes de pele neste momento para verificar se há intactness tecido. Tome cuidado para não introduzir bolhas de ar no sistema. Feche a tampa.
- Ligue a tubagem da unidade de controlo da bomba para o MOC, de acordo com o passo 5.3, e colocar o MOC numa incubadora.
7. Analisar amostras Diário Mídia e Realize On-line Análise
- Analisar o desempenho de cultura de tecidos on-line usando imagens de células vivas ou off-line, através da análise das amostras de mídia diárias. Realize o último por ensaios enzimáticos rotina padrão (por exemplo, lactato desidrogenase (LDH) de atividade) ou ELISA (eg concentração de albumina). Uma análise on-line é descrito a seguir.
- Remover os meios de comunicação do MOC endothelialized, como descrito nos passos 6.1.1 a 6.1.4, e substituí-lo em ambos os compartimentos de cultura de tecidos com 200 ul de solução de 10 ug / ml de conjugado fluoróforo acetilado lipoproteína de baixa densidade (LDL) (diluída em meios de cultura celular).
- Feche as tampas. Ligue o MOC para a unidade de controlo da bomba, de acordo com o passo 5.3, e bombeá-la durante 30 min a 0,475 Hz para distribuir a solução uniformemente dentro do circuito de microfluidos.
- Pare o bombeamento e incubar a MOC estaticamente durante 3,5 h a 37 ° C e 5% de CO 2.
- Similar to passo 7.2, remover a solução de LDL acetilada de ambos os compartimentos e substituí-la por 400 mL de meio fresco em um dos dois compartimentos.
- Espere por 3 a 5 minutos para deixar a pressão hidrostática conduzir o meio através do circuito canal microfluídicos.
- Substituir o meio que fluiu através com 300 mL de meio fresco e também preencher o segundo compartimento da cultura de tecidos com 300 mL de meio fresco.
- Feche o MOC, de acordo com o passo 3.1.2. Colocá-lo sob um microscópio de fluorescência e observar o crescimento e viabilidade celular.
- Coloque a MOC coradas volta na incubadora para continuar o cultivo. Remova a mancha vazando para fora das células com cada seguinte substituição da mídia.
8. Recuperar equivalentes de tecido do MOC e executar análises ponto final
- Recuperar os equivalentes de tecido a partir do MOC no final da experiência para análises de extremidade.
- A fim de recuperar o fígado e pele equivalents do MOC, remova a mídia de cada compartimento de cultura de tecidos, como descrito nos passos 6.1.1 a 6.1.4.
- Retirar as inserções de cultura de células de 96 poços contendo a pele do MOC usando uma pinça. Retire cuidadosamente a membrana a partir da inserção por agarrando-a de um lado com uma pinça e puxando-o para baixo. Tome cuidado para não perder o equivalente a pele neste momento.
- Congelar a membrana segurando o equivalente de pele em composto de incorporação crio e armazená-lo a -80 ° C até análise posterior.
- Retirar os equivalentes de fígado de forma semelhante a partir do compartimento cultura do tecido pipetando-los usando as pontas de pipeta de corte (veja o passo 1.1.8 / 9).
- Incorporar os esferóides de fígado em composto de incorporação crio. Tome cuidado para não transferir muito líquido e remover qualquer excesso de líquido com uma pipeta. Depois de colocar os esferóides sobre a incorporação de composto e remoção do meio, adicionar mais composto de crio sobre o topo dos esferóides para incluí-los totalmente.
- Congelar os equivalentes do fígado e armazená-lo a -80 ° C até análise posterior.
- Executar análise de ponto final por corte dos equivalentes de tecidos em um crio-microtomo para 8 mm e secções de coloração para marcadores específicos do tecido, tal como descrito nos protocolos anteriores 10.
Resultados
Padrão em culturas de tecidos in vitro são realizados sob condições estáticas, limitar a difusão do oxigénio e de nutrientes para os tecidos de alimentação. Sistemas fluídicos, mostrando características melhoradas de abastecimento, são muitas vezes dificultada pelas suas grandes necessidades de médias, possuindo não fisiologicamente médio alto com as taxas de tecido. Assim, os metabolitos são diluídos e células não são capazes de condicionar o meio envolvente. A MOC apresentada neste estudo conecta dois compartimentos de cultura de tecidos separados, cada um do tamanho de um único poço de uma placa de 96 poços padrão, por um sistema de canais de microfluidos. A pequena dimensão do sistema, bem como a integração da bomba sobre o chip permite que o sistema opere em volumes de suporte de apenas 200 a 800 ul. Isto corresponde a uma forma sistémica total à relação tecido de 8: 1 a 31: 1, respectivamente, para as co-culturas de tecido do fígado e da pele (que têm um volume de tecido total de cerca de 26 uL). O volume de líquido extra-celular total em um homem pesando 73 kg é de 14,6 L, da qual o volume de fluido intercapilar é de 5,1 L, que conduz a um fluido extracelular fisiológico a proporção de tecido de 1: 4. Portanto, a quantidade de material em todo o sistema de circulação no MOC é ainda maior em comparação com a situação fisiológica; e ainda assim, representa a menor media a relação tecido relatados até agora para os sistemas multi-órgãos 5. Como padrão da indústria formatos de cultura de tecidos são mantidas, os pesquisadores são capazes de combinar modelos de tecido estática existentes e já validados dentro de um fluxo de fluido comum. A Figura 1 mostra o esquema de um conjunto experimental de possíveis tecidos único MOC ou multi-tecido co-culturas. Biópsias de tecido primárias e in vitro -generated equivalentes de tecidos de linhas celulares ou células primárias podem ser cultivados utilizando qualquer um de 96 poços inserções de cultura de células ou colocando-os directamente para dentro dos compartimentos de cultura de tecidos. Como o sistema de canais de interligação dos compartimentos de cultura de células é de apenas 100 μm de altura, equivalentes de tecido superiores a essas dimensões serão mantidos dentro dos compartimentos de cultura. O Endotelização do circuito MOC com HDMECs primárias permite mais um passo em frente no sentido mais condições de cultura fisiológicas, proporcionando uma estrutura vascular biológico.
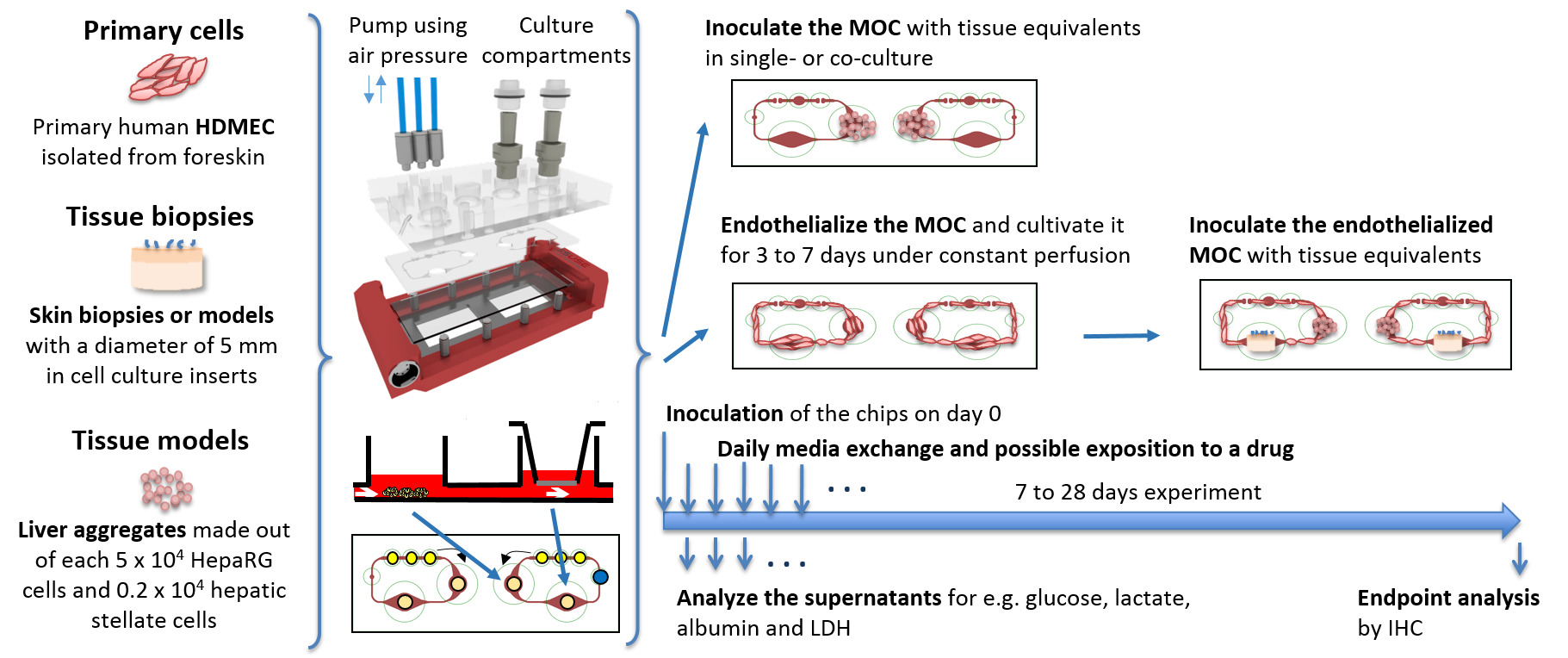
Figura 1: Representação esquemática. MOC equivalentes de culturas de tecidos são preparados sob condições in vitro padrão, inoculou-se o MOC e cultivadas como culturas individuais ou co-culturas sob condições dinâmicas. Amostras de mídia diários e análises de ponto de extremidade são executadas. A pressão do ar para accionar a bomba é aplicada através de três tubos azuis ligadas ao MOC de cima. Por favor, clique aqui para ver uma versão maior desta figura.
Seguindo o protocolo endotelização, uma cobertura confluente HDMEC do circuito de microfluidos de canal é obtida dentro de quatro dias de cultura dinâmica, como mostrado na Figura 2. Células facilmente aderir às paredes do canal MOC, criar uma monocamada confluente, e alongada ao longo do cisalhamento estresse (Figura 2B). Além disso, as células de cobrir toda a circunferência dos canais, como previamente relatado 9. Não existe mais nenhuma alteração na morfologia endotelial foi observada após quatro dias de cultura, até ao final da cultura.
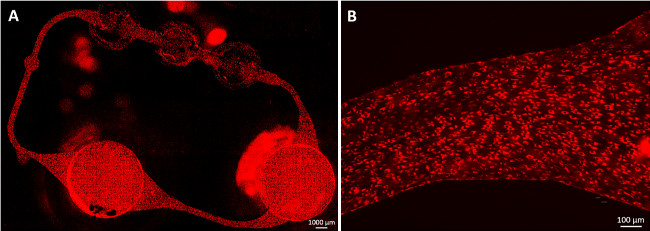
Figura 2:. Endothelialized canais MOC células endoteliais microvasculares da derme humana (HDMEC) formaram uma monocamada confluente no circuito de microfluidos. As células foram coradas com LDL acetilada após 23 dias de cultura MOC. (A) Toda a mcircuito icrovascular foi coberto com células e células alongadas (B) ao longo da tensão de cisalhamento. Barras de escala: (A) e 1000 um (B) de 100 um.
Numa outra experiência, esferóides de células hepáticas consistentes em forma de disco são formados a partir HepaRG e HHSteC durante dois dias de cultura pendurado gota, como este sistema modelo foi anteriormente relatado como sendo adequado para o metabolismo dos fármacos estuda 11-13. Para fins de demonstração, um compartimento de cultura de tecido de cada circuito MOC foi semeada com 20 esferóides em 96 poços inserções de cultura de células e tecidos foram cultivados mais de 14 dias, sob condições dinâmicas utilizando MOCs não endothelialized. Qualquer número de agregados ou quantidade de material primário pode ser integrado quer directamente para dentro dos compartimentos ou utilizando inserções de cultura de células. Coloração de imunofluorescência dos esferóides após a recuperação do MOC mostra uma expressão forte, homogênea para licitoqueratina ver-típico 8/18 e fase I de enzimas metabolizadoras do citocromo P450 3A4 e 7A1 (Figura 3A e 3B). Coloração de transporter canalicular proteína de resistência multi-droga 2 (MRP-2), revelou um fenótipo polarizada e a existência de redes de canalículos-like biliares rudimentar (Figura 3C).
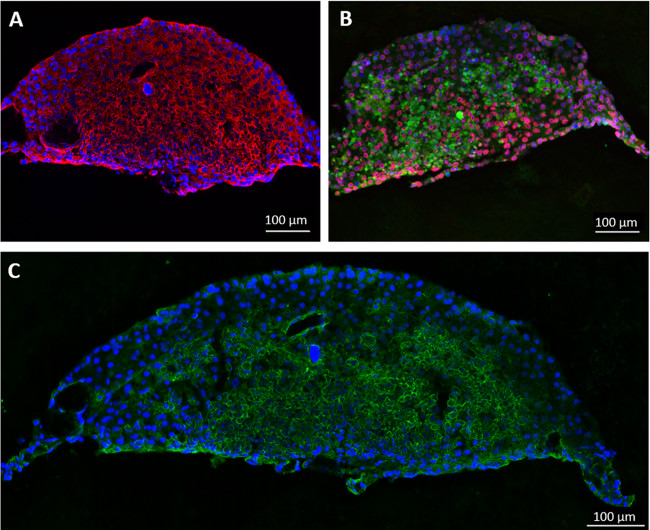
Figura 3 :. O cultivo de micro-tecidos do fígado artificial humanos nos agregados MOC. Fígado cultivadas por 14 dias no MOC foram coradas para (A) cytokeratin 8/18 (vermelho) e (B) do citocromo P450 3A4 (vermelho) e 7A1 (verde). (C) A expressão de canalicular transporter MRP-2 (verde), coloração nuclear azul. Barras de escala: 100 um.
Como a produção de albumina é um pré-requisito essencial de culturas de tecidos do fígado, que tem abelhan selecionado para monitorar a atividade do fígado típico no MOC. A análise de amostras diárias dos meios para a produção de albumina mostra um aumento significativo da taxa de produção em comparação com culturas MOC culturas estáticas (Figura 4) e para os valores reportados na literatura 11. O aumento da taxa de síntese de albumina pode ser atribuído ao aumento da oferta de oxigênio e de nutrientes em culturas MOC. Assim, o MOC é capaz de sustentar agregados de fígado ao longo de um período de cultura de 14 dias em um estado metabolicamente ativo, melhorando o comportamento fígado típica, como a produção de albumina.

Figura 4: Quatorze dias desempenho esferóide fígado no MOC produção Albumina de culturas de tecidos individuais hepáticas no MOC e na cultura estática.. Os dados são médias ± SEM (n = 4).
Subsystemic testes de toxicidade de doses repetidas de chedutos químicos e cosméticos em animais requer de 21 a 28 dias de exposição, tal como definido pela orientação da OCDE não. 410 "dose repetida Toxicidade Dérmica: 21/28 dias Study." Longo prazo co-culturas de pele de fígados são exemplificados aqui para até 28 dias para lidar com os requisitos regulamentares. Uma interface ar-líquido é fornecido para a exposição à substância dérmica depois, cultivando as biópsias da pele em 96 poços inserções de cultura de células. A experiência de co-cultura é realizada de forma exemplificativa em MOCs endothelialized para comprovar se uma co-cultura de tecido de três em um circuito combinado meios podem ser mantidos viáveis e metabolicamente activa ao longo de 28 dias.
Análise da actividade de LDH em sobrenadantes de meios revelou um nível constante diminuição nos primeiros oito dias de cultura, os quais se mantêm inalteradas em cerca de 80 U / l em seguida (Figura 5). Isso indica um volume de negócios de tecido artificial, mas estável no sistema em momentos posteriores. Comparando-se a co-cultura de três tecido a única fígadoexperimentos co-cultura -tissue e fígado-endotelial, um nível significativamente diminuída LDH poderia ser encontrado, especialmente durante os primeiros dias em culturas não incluindo a pele. A morte celular dentro deste primeiro período de elevada actividade de LDH ocorreu principalmente no compartimento de cultura de pele, como pele de tecido único culturas MOC revelou (dados não mostrados). Isto pode ser devido à área de ferida circundante da biópsia como resultado da perfuração da pele.
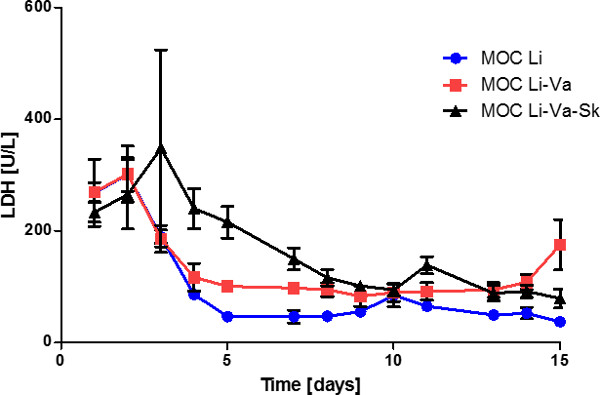
Figura 5: desempenho tecido de quinze dias na atividade LDH MOC nos sobrenadantes de meios de culturas de tecidos do fígado único (MOC Li), culturas de fígado em MOCs endothelialized (MOC Li-Va) e co-culturas de fígado de pele em endothelialized MOC (MOC Li. -Va-Sk). Os dados são médias ± SEM (n = 4).
Durante o período de cultura de 28 dias, esferóides hepáticos aderiram ao fundo do MOC umcélulas nd cresceu fora, formando uma conexão entre várias camadas esferóides adjacentes. Isso não impediu a funcionalidade do tecido. Análise de ponto final por imunofluorescência mostrou que os esferóides de fígado foram ainda metabolicamente activas após 28 dias de cocultura MOC, como mostrado por coloração de citocromo P450 3A4 (Figura 6A). HHSteC foram distribuídos por todo o fígado equivalente, como mostrado por coloração com vimentina (Figura 6B). Um aumento na intensidade de coloração vimentina poderia ser observada em áreas onde as células tinham crescido de esferóides. A coloração para o fator von Willebrand (vWF) demonstraram que as células endoteliais não tinha penetrado profundamente no tecido, mas estavam em contacto directo célula a célula com os hepatócitos exteriores (Figura 6C).
Coloração imuno-histoquímica das biópsias de pele mostrou uma expressão de tenascina C e colágeno IV na membrana basal (Figura 6D), ao passo que a coloração do controle estático mostrou elevated níveis de tenascin C (Figura 6E). A tenascina C tem sido mostrado para ser regulado positivamente durante a cicatrização da ferida, processo inflamatório e fibrose, sugerindo induzida processos fibróticos em estática, mas não em culturas dinâmicas 14,15.
Viabilidade celular estável e funcionalidade dos tecidos após uma co-cultura de 28 dias a MOC provar que o sistema é capaz de manter uma combinação de até três tecidos em um circuito de meios de comunicação comum. As células primárias, bem como modelos de tecido e biópsias, podem ser cultivadas simultaneamente no sistema MOC.
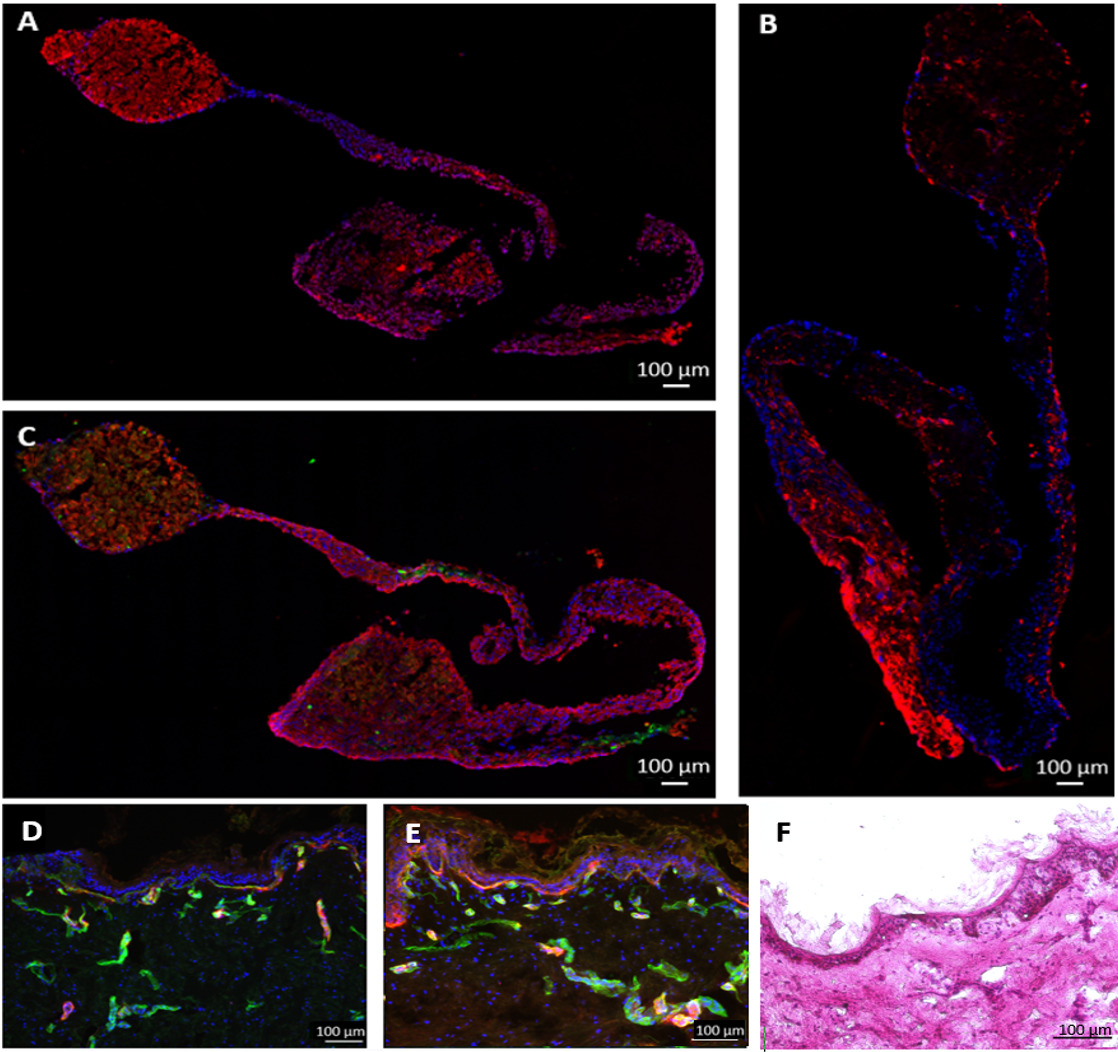
Figura 6:. Desempenho de culturas de tecidos de multi-equivalentes de mais de 28 dias do fígado e as biópsias da pele foram cultivadas em uma funcionalidade MOC e célula endothelialized foi mostrado por imunocoloração de (A) Fase I enzimas de citocromo P4503A4 (vermelho), (B) vimentina (vermelho), (C) citoqueratina 8/18 (vermelho) e vWF (verde) no tecido do fígado. As biópsias de pele co-cultivados por 28 dias (D) no MOC ou (E) em condições estáticas foram coradas para tenascin c (vermelho) e colágeno IV (verde), coloração nuclear azul. (F) H & E coloração da pele após 28 dias de cultura MOC. Barras de escala: 100 um.
Discussão
A plataforma MOC descrito aqui representa uma ferramenta estável e poderoso para o cultivo de tecidos de várias origens em condições de fluxo médio dinâmicas ao longo de períodos prolongados de cultura 10,16. Neste exemplo, a plataforma foi usado para cultivar as células primárias (HDMEC), os equivalentes de tecido gerados a partir de uma linha celular do fígado (agregados), e uma co-cultura do referido tecido com uma biópsia. O MOC foi capaz de sustentar a co-cultura de três tecido para até 28 dias em um circuito médio combinado. Para o melhor conhecimento dos autores, esta é a primeira vez que uma co-cultura de multi-tecido, incluindo biopsias, as células primárias e as linhas de células foi realizada ao longo de quatro semanas.
Uma das principais desvantagens dos sistemas de microfluidos é a afinidade de moléculas pequenas para aderir ao material da superfície do circuito de fluido. Como a superfície para razão de volume é especialmente elevada em sistemas de microfluidos, este efeito torna-se ainda mais pronunciada 17 . A cobertura HDMEC estável dos canais, introduzida aqui, pode actuar como uma barreira biológica prevenir a adesão de moléculas para o MOC. Além disso, pode servir como um recipiente para hemocompat�el circulação de sangue total, impedindo a coagulação do sangue. No entanto, a utilização de sangue completo, como um meio de substituição não é viável, não foi ainda conseguida uma vascularização completa dos equivalentes a órgão. Trabalho sobre a vascularização de tecidos in vitro -generated existente é promissor e orienta o caminho para outros estudos 18,19.
É bem sabido que os hepatócitos tendem a perder suas funções específicas do fígado ao longo do tempo sob estática bidimensionais cultura in vitro tem 20. Enzimas metabolizantes, tais como a família do citocromo P450, são de especial importância se o metabolismo de um determinado fármaco está a ser estudado. O citocromo P450 3A4, uma enzima relacionada com a biotransformação de xenobióticos muitos, e citocromo P450 7A, which está envolvida na síntese de ácidos biliares, foram expressos em fígado agregados cultivadas na MOC ao longo de 14 dias. Isto indica a preservação de um fenótipo metabolicamente activa, permitindo os estudos de metabolismo de drogas. O aumento da taxa de produção de albumina de agregados em comparação com o MOC culturas estáticas é uma indicação adicional para as condições de cultura adequadas. As taxas de produção de albumina observadas durante este estudo foram comparáveis ou mesmo superiores aos valores reportados anteriormente obtidos por chips microfluídicos, incluindo células HepG2 21-23, no entanto, os valores não atingem os de culturas de hepatócitos primários humanos 24. Além disso, o sistema MOC, na sua disposição temporária, não permitem uma separação separada da bílis. Células nas estruturas polarizadas e formaram agregados canalículos-like biliares, como mostrado por MRP-2 coloração. No entanto, esses canalículos não estavam ligados a um canal técnico cobrança da bile. Esta mistura não-fisiológicoing da bile com o compartimento de sangue tem de ser abordada em um redesign futuro do sistema.
O ajuste das características de fluxo é de grande importância 25, especialmente no que diz respeito aos tecidos sensíveis a forças de cisalhamento, tal como o fígado. A quantidade de tensão de cisalhamento percebida pelo tecido pode ser modificado de duas maneiras: em primeiro lugar, a pressão de ar utilizado para empurrar para baixo as membranas da bomba pode ser reduzido, diminuindo os valores de pico de tensão de cisalhamento no sistema. Em segundo lugar, os tecidos podem ser incorporados em camadas de uma matriz extracelular ou cultivados em inserções de cultura Transwell. O último proteger os tecidos subjacentes da corrente com uma membrana porosa. Esses ajustes devem ser realizados de forma individual para cada equivalente de órgão antes do início do experimento MOC. Numa operação pulsátil de 2,4 Hz, por exemplo, o que corresponde a uma actividade elevada, mas ainda fisiológico, coração de 144 batimentos / min em humanos, a tensão de cisalhamento medido nocanais do circuito de microvascular atinge cerca de 25 dines / cm 2. Isto corresponde a uma tensão de corte fisiológicas na extremidade superior da escala na microvasculatura e é, portanto, bem aplicável para ensaios, incluindo uma endotelização dos canais. No entanto, como a disposição de microfluidos actual do sistema MOC apresentado consiste em apenas um circuito de meios de comunicação que liga os dois compartimentos de órgãos, uma taxa de tensão de cisalhamento e velocidade de bombagem tem de ser escolhida para todo o sistema. Portanto, um ajuste exato de características de fluxo para as necessidades de cada órgão único nem sempre é viável.
Além disso, cuidado deve ser tomado no ajustamento das células para o meio comum. As células são cultivadas em MOC num circuito combinado meios, por conseguinte, qualquer meio de cultura de células individual pode ser utilizada para cada modelo de tecido, como é o padrão para a cultura celular in vitro. A formulação de mídia combinado mínimo precisa ser definido de antemão e tcélulas ele precisa ser ajustada gradualmente a esta nova mídia. Um procedimento de ajuste de 80% / 20% para novos meios de idade por dois dias, em seguida 50% / 50%, seguido de 20% / 80%, e uma troca completa sempre levou a uma viabilidade celular razoável e funcionalidade de culturas de nossas mãos.
O layout microfluídicos atual do sistema MOC permite que o co-cultura de até três tecidos. A co-cultura de pelo menos dez a órgãos mais importantes do corpo humano é necessário para alcançar a homeostase. Portanto, o sistema apresentado é capaz de prever as interacções específicas de tecido e tecido, mas não a verdadeira resposta sistémica a uma substância. Prevê-se um maior desenvolvimento do MOC para incluir mais cavidades de órgãos. Além disso, a validade do sistema é para ser mostrado utilizando um conjunto de compostos de referência. De preferência, os compostos que falharam durante ensaios clínicos (tais como troglitazona) estão a ser testados quanto ao seu desempenho na MOC. Considerando que, uma verdadeira validação desses sistemas complexos ainda é impedida by a falta de padronização relativo biomarcadores e parâmetros para avaliação funcional, coletando mais dados sobre o desempenho toxicológicas deste e sistemas semelhantes irá ampliar a sua fiabilidade e área de aplicação.
Divulgações
Uwe Marx é CEO da TissUse GmbH, que produz e comercializa a plataforma Multi-Organ Chip usado no artigo. Esta publicação foi financiada por um prêmio concedido pela Corning Inc.
Agradecimentos
O trabalho foi financiado pelo Ministério Federal Alemão de Educação e Pesquisa, GO-Bio Grant No. 0.315.569.
Materiais
| Name | Company | Catalog Number | Comments |
| HepaRG cells | Biopredic International | undifferentiated cells | |
| HHSteC | ScienCell Research Laboratories | cells and all culture supplements | |
| HepaRG Medium | Sigma-Aldrich | William's Medium E 10% FCS 100 U/ml penicillin 100 µg/ml streptomycin 5 µg/ml human insulin 2 mM L-glutamine 5 x 10-5 M hydrocortisone hemisuccinate | |
| HDMEC Medium | PromoCell | Endothelial Cell Growth Medium MV2 with Supplement-Pack MV2 and 1% penicillin-streptomycin | |
| Dimethyl sulfoxide | Carl Roth | add 2% to HepaRG media | |
| Trypsin/EDTA | Biowest | ||
| Trypsininhibitor | Carl Roth | ||
| MAXYMum Recovery Tips | Corning | 1,000 µl Pipet Tips Wide Bore | |
| 384-Well Hanging Drop Plate | 3D Biomatrix | Perfecta 3D 384-Well Hanging Drop Plate | |
| Tissue culture flasks | Corning | 75 cm2 | |
| Ultra-low attachment plate | Corning | 24-well | |
| Transwell cell culture inserts | Corning | 96-well unit, 0.4 µm pore size | |
| Deep well plates | Corning | 96-well, 1 ml | |
| Biopsy punch | Stusche | 4.5 mm | |
| Glass microscope slide | Menzel | footprint of 75 x 25 mm | |
| Polydimethylsiloxane | Dow Corning | Sylgard 184 | |
| Silicon rubber additive | Wacker Chemie | Wacker Primer G790 | |
| Tubes for air pressure | SMC Pneumatik GmbH | Polyurethan-Schlauch, metrisch | |
| Alumin ELISA | Bethyl Laboratories | Human Albumin ELISA Quantitation Set | |
| Lactate dehydrogenase assay | Stanbio Laboratory | LDH Liqui-UV kit | |
| Alexa Fluor 594 acetylated LDL | Invitrogen | 1 mg/ml |
Referências
- Kelm, J. M., Fussenegger, M. Microscale tissue engineering using gravity-enforced cell assembly. Trends in biotechnology. 22 (4), 195-202 (2004).
- Marx, U., Walles, H., et al. Human-on-a-chip Developments: A Translational Cutting-edge Alternative to Systemic Safety Assessment and Efficiency Evaluation of Substances in Laboratory Animals and Man. ATLA. 40 (5), 235-257 (2012).
- Baudoin, R., Griscom, L., Prot, J. M., Legallais, C., Leclerc, E. Behavior of HepG2/C3A cell cultures in a microfluidic bioreactor. Biochemical Engineering Journal. 53 (2), 172-181 (2011).
- Dash, A., Inman, W., et al. Liver tissue engineering in the evaluation of drug safety. Expert opinion on drug metabolism & toxicology. 5 (10), 1159-1174 (2009).
- Materne, E. -M., Tonevitsky, A. G., Marx, U. Chip-based liver equivalents for toxicity testing--organotypicalness versus cost-efficient high throughput. Lab on a chip. 13 (18), 3481-3495 (2013).
- Huh, D., Torisawa, Y., Hamilton, G. a, Kim, H. J., Ingber, D. E. Microengineered physiological biomimicry: organs-on-chips. Lab on a chip. 12 (12), 2156-2164 (2012).
- Sin, A., Chin, K. C., Jamil, M. F., Kostov, Y., Rao, G., Shuler, M. L. The design and fabrication of three-chamber microscale cell culture analog devices with integrated dissolved oxygen sensors. Biotechnology progress. 20 (1), 338-345 (2004).
- Tatosian, D. a, Shuler, M. L. A novel system for evaluation of drug mixtures for potential efficacy in treating multidrug resistant cancers. Biotechnology and bioengineering. 103 (1), 187-198 (2009).
- Schimek, K., Busek, M., et al. Integrating biological vasculature into a multi-organ-chip microsystem. Lab on a chip. 13 (18), 3588-3598 (2013).
- Wagner, I., Materne, E. -M., et al. A dynamic multi-organ-chip for long-term cultivation and substance testing proven by 3D human liver and skin tissue co-culture. Lab on a chip. 13 (18), 3538-3547 (2013).
- Vieira, U., et al. HepaRG human hepatic cell line utility as a surrogate for primary human hepatocytes in drug metabolism assessment in vitro. Journal of pharmacological and toxicological methods. 63 (1), 59-68 (2010).
- Abu-Absi, S. F., Hansen, L. K., Hu, W. -S. Three-dimensional co-culture of hepatocytes and stellate cells. Cytotechnology. 45 (3), 125-140 (2004).
- Leite, S. B., Wilk-Zasadna, I., et al. Three-dimensional HepaRG model as an attractive tool for toxicity testing. Toxicological sciences. 130 (1), 106-116 (2012).
- Chiquet-Ehrismann, R. Tenascins. The international journal of biochemistry & cell biology. 36 (6), 986-990 (2004).
- Sidgwick, G. P., Bayat, A. Extracellular matrix molecules implicated in hypertrophic and keloid scarring. Journal of the European Academy of Dermatology and Venereology JEADV. 26 (2), 141-152 (2012).
- Ataç, B., Wagner, I., et al. Skin and hair on-a-chip: in vitro skin models versus ex vivo tissue maintenance with dynamic perfusion. Lab on a chip. 13 (18), 3555-3561 (2013).
- Wu, M. -H., Huang, S., Lee, G. -B. Microfluidic cell culture systems for drug research. Lab on a chip. 10 (8), 939-956 (2010).
- Schanz, J., Pusch, J., Hansmann, J., Walles, H. Vascularised human tissue models A new approach for the refinement of biomedical research. Journal of Biotechnology. 148 (1), 56-63 (2010).
- Holnthoner, W., Hohenegger, K., et al. Adipose-derived stem cells induce vascular tube formation of outgrowth endothelial cells in a fibrin matrix. J Tissue Eng Regen Med. , (2012).
- Dunn, J. C. Y., Yarmush, M. L., Koebe, H. G., Tompkins, R. G. Hepatocyte function and extracellular matrix geometry: long-term culture in a sandwich configuration. FASEB Journal. 3, 174-177 (1989).
- Leclerc, E., Sakai, Y., Fujii, T. Microfluidic PDMS (polydimethylsiloxane) bioreactor for large-scale culture of hepatocytes. Biotechnology progress. 20 (3), 750-755 (2004).
- Kim, M. S., Yeon, J. H., Park, J. -K. A microfluidic platform for 3-dimensional cell culture and cell-based assays. Biomedical microdevices. 9 (1), 25-34 (2007).
- Prot, J. -M., Aninat, C., et al. Improvement of HepG2/C3A Cell Functions in a Microfluidic Biochip. Biotechnology and bioengineering. 108 (7), 1704-1715 (2011).
- Riccalton-Banks, L., Liew, C., Bhandari, R., Fry, J., Shakesheff, K. Long-term culture of functional liver tissue: three-dimensional coculture of primary hepatocytes and stellate cells. Tissue engineering. 9 (3), 401-410 (2003).
- Powers, M. J., Domansky, K., et al. A Microfabricated Array Bioreactor for Perfused 3D Liver Culture. Biotechnology and Bioengineering. 78 (3), 257-269 (2002).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados