Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Beurteilung der neuromuskulären Funktion Mit Perkutane elektrische Nervenstimulation
In diesem Artikel
Zusammenfassung
We present a protocol to assess changes in neuromuscular function. Percutaneous electrical nerve stimulation is a non-invasive method that evokes muscular responses. Electrophysiological and mechanical properties of these responses permit the evaluation of neuromuscular function from brain to muscle (supra-spinal, spinal and peripheral levels).
Zusammenfassung
Percutaneous electrical nerve stimulation is a non-invasive method commonly used to evaluate neuromuscular function from brain to muscle (supra-spinal, spinal and peripheral levels). The present protocol describes how this method can be used to stimulate the posterior tibial nerve that activates plantar flexor muscles. Percutaneous electrical nerve stimulation consists of inducing an electrical stimulus to a motor nerve to evoke a muscular response. Direct (M-wave) and/or indirect (H-reflex) electrophysiological responses can be recorded at rest using surface electromyography. Mechanical (twitch torque) responses can be quantified with a force/torque ergometer. M-wave and twitch torque reflect neuromuscular transmission and excitation-contraction coupling, whereas H-reflex provides an index of spinal excitability. EMG activity and mechanical (superimposed twitch) responses can also be recorded during maximal voluntary contractions to evaluate voluntary activation level. Percutaneous nerve stimulation provides an assessment of neuromuscular function in humans, and is highly beneficial especially for studies evaluating neuromuscular plasticity following acute (fatigue) or chronic (training/detraining) exercise.
Einleitung
Perkutane elektrische Nervenstimulation wird weithin verwendet, um die neuromuskuläre Funktion 1 zu bewerten. Das Grundprinzip besteht aus Induktion einer elektrischen Stimulus zu einer peripheren motorischen Nerven, um eine Muskelkontraktion hervorzurufen. Mechanische (Drehmomentmessung) und elektrophysiologische (elektromyographische Aktivität) Reaktionen werden gleichzeitig aufgezeichnet. Drehmoment an der betrachteten gemeinsame aufgezeichnet ist, wird unter Verwendung eines Ergometers bewertet. Elektromyographischen (EMG) Signal aufgezeichnet unter Verwendung von Oberflächenelektroden wurde gezeigt, dass die Aktivität des Muskels 2 stellen. Diese nicht-invasive Methode ist nicht schmerzhaft und leichter als intramuskuläre Aufnahmen realisiert. Sowohl monopolare als auch bipolare Elektroden verwendet werden. Die monopolaren Elektrodenkonfiguration wurde gezeigt empfindlicher auf Änderungen der Muskeltätigkeit 3, die kleine Muskeln nützlich sein kann ist. Jedoch haben bipolare Elektroden gezeigt wirksamer bei der Verbesserung des Signal-Rausch-r zu seintio 4 und werden am häufigsten als ein Verfahren zum Aufzeichnen und zur Quantifizierung Motoreinheit Aktivität verwendet. Die nachfolgend beschriebene Methodik wird auf bipolare Aufnahmen konzentrieren. EMG-Aktivität ein Indikator für die Wirksamkeit und die Integrität des neuromuskulären Systems. Die Verwendung von perkutanen Nervenstimulation bietet weitere Einblicke in die neuromuskuläre Funktion, dh Änderungen an Muskel-, Wirbelsäulen oder supra spinaler Ebene (Abbildung 1).

Abb. 1: Übersicht über die neuromuskuläre Messungen STIM: Nervenstimulation. EMG: Elektromyographie. VAL: Freiwillige Aktivierungsniveau. RMS: Root Mean Square. M max: Maximal M-Wellen-Amplitude.
Im Ruhezustand wird die Verbindung Muskelaktionspotential, auch als M-Welle, ist die kurze Latenzzeiten Reaktion nach Reizartefakt beobachtet und stellt erregbaren Muskelmasse durch die direkte activ ation von Motoraxonen die zur Muskel (Abbildung 2, Nummer 3). M-Wellenamplitude steigt mit der Intensität bis zum Erreichen einer Hochebene von seinem Maximalwert. Diese Antwort, die so genannte M max, stellt die Synchron Summierung aller unter den Oberflächen-EMG-Elektroden 5 aufgezeichneten Motoreinheiten und / oder Muskelfaser Aktionspotentiale. Die Entwicklung der Spitze-zu-Spitze-Amplitude oder Wellenbereich verwendet wird, um Änderungen der neuromuskulären Transmission 6 identifizieren. Veränderungen der mechanischen Reaktionen mit dem M-Welle, dh Spitzen Zucken Drehmoment / Kraft, verbunden sind, können aufgrund von Veränderungen im Muskel Erregbarkeit und / oder innerhalb der Muskelfasern 7 sein. Die Assoziation von M max Amplitude und Spitzen Zucken Drehmomentamplitude (Pt / M-Verhältnis) liefert einen Index von elektromechanischen Wirkungsgrad des Muskel 8, dh mechanische Reaktion für eine gegebene elektrische Motorbefehl.
52974 / 52974fig2.jpg "/>
Abb. 2: Motor und reflexive Pfade durch Nervenstimulation aktiviert elektrische Stimulation eines gemischten (Motor / sensorische) Nerven (STIM) induziert eine Depolarisation der beiden Motor Axon und Ia afferenten Brand. Depolarisation Ia Afferenzen Richtung des Rückenmarks aktiviert ein alpha Motoneuronen, die wiederum ruft eine H-Reflex-Reaktion (Bahn 1 + 2 + 3). In Abhängigkeit von der Reizstärke, Motor Axon Depolarisation evoziert eine direkte muskuläre Antwort: M-Welle (Weg 3). Bei maximaler M-Wellenintensität wird ein antidrome Strom auch generiert (3 ') und kollidiert mit Reflex volley (2). Diese Kollision teilweise oder vollständig bricht den H-Reflex auf.
Der H-Reflex ist eine elektrophysiologische Reaktion verwendet, um Veränderungen in der Ia-α Motoneuron Synapse 9 beurteilen. Dieser Parameter kann im Ruhezustand oder während der freiwilligen Kontraktionen bewertet werden. H-Reflex stellt eine Variante des Dehnungsreflex (Abbildung 2, number 1-3). Der H-Reflex aktiviert Motoreinheiten monosynaptisch von Ia afferente Bahnen 10,11 rekrutiert, und kann eine periphere und zentrale Einflüsse 12 unterzogen werden. Das Verfahren erinnert an einen H-Reflex ist bekannt, dass eine hohe intraindividuelle Zuverlässigkeit Rücken Erregbarkeit in Ruhe 13,14 und während isometrische Kontraktionen 15 zu beurteilen haben.
Während einer willkürlichen Kontraktion, kann der Betrag der freiwilligen neuronalen Antrieb mit der Amplitude des EMG-Signals beurteilt werden, mit Hilfe der Root Mean Square Allgemeinen quantifiziert (RMS). RMS-EMG wird häufig verwendet, ein Mittel zur Quantifizierung der Erregung des Motorsystems während einer willkürlichen Kontraktion (Abbildung 1). Wegen der intra- und interindividuelle Variabilität 16 hat RMS EMG zur Verwendung der EMG während eines muskelspezifischen maximalen willkürlichen Kontraktion (RMS EMGmax) aufgezeichnet normalisiert werden. Darüber hinaus, weil Änderungen in EMG-Signal be aufgrund von Veränderungen am peripheren Ebene, die Normalisierung unter Verwendung eines peripheren Parameter, wie beispielsweise M-Welle erforderlich ist, um nur die zentrale Komponente des EMG-Signals zu beurteilen. Dies kann durch Dividieren der RMS-EMG durch die maximale Amplitude oder der Effektivwert Mmax der M-Welle durchgeführt werden. Normalisierung mit RMS Mmax (dh RMS EMG / RMS Mmax) ist die bevorzugte Methode, da sie berücksichtigt die mögliche Änderung der M-Wellendauer 17.
Motor Befehle können auch durch die Berechnung der freiwilligen Aktivierungsniveau (VAL) ausgewertet werden. Diese Methode verwendet das Zucken Interpolationstechnik 18 durch Überlagerung einer elektrischen Stimulation an M max Intensität während einer maximalen willkürlichen Kontraktion. Das zusätzliche Drehmoment durch die Stimulierung der Nerven hervorgerufen wird, um eine gleich Nervenstimulation in entspannter potenziert Muskel 19 erzeugte Kontrollzuckungsstärke verglichen. Um maximale VAL, das ursprüngliche Zucken interpo bewertenvon Merton 18 beschrieben lation Technik beinhaltet einen einzelnen Stimulus über einen willkürlichen Kontraktion interpoliert. Kürzlich wurde die Verwendung von paarweisen Stimulation immer beliebter geworden, da die hervorgerufenen Drehmoment Inkrementen größer sind, leichter erkannt und weniger variabel gegenüber dem Einzelstimulationsantworten 20. VAL liefert einen Index der Leistungsfähigkeit des Zentralnervensystems bis maximal aktivieren die arbeitenden Muskeln 21. Derzeit VAL ausgewertet mit dem Zucken Interpolationstechnik ist das wertvollste Methode zur Beurteilung der Höhe der Muskelaktivierung 22. Darüber hinaus ist das maximale Drehmoment beurteilt Verwendung eines Ergometers die richtig studiert Festigkeitsprüfung Parameter erhoben der Einsatz in Forschung und klinischen Einrichtungen 23.
Elektrische Nervenstimulation kann in einer Vielzahl von Muskelgruppen (zB Ellbogenbeuger, Handgelenk Flexoren, Kniestrecker, Plantarflexoren) verwendet werden. Allerdings macht Nerven Zugänglichkeit derTechnik schwierig in einigen Muskelgruppen. Die Plantarflexoren, insbesondere Triceps surae (soleus und gastrocnemii) Muskeln, werden häufig in der Literatur 24 untersucht. In der Tat sind diese Muskeln in der Fortbewegung beteiligt sind, rechtfertigt ihre besonderen Interesse. Der Abstand zwischen den Stimulationsstelle und Aufzeichnungselektroden erlaubt die Identifizierung der verschiedenen hervorgerufenen Wellen des Triceps surae Muskeln. Die oberflächliche Teil des N. tibialis posterior in der Kniekehle und die große Anzahl von Spindeln erleichtern die Reflexreaktionen im Vergleich zu anderen Muskeln 24 aufzuzeichnen. Aus diesen Gründen konzentriert sich die aktuell präsentierten Reflex Methodik auf der Triceps surae Gruppe von Muskeln (soleus und gastrocnemius). Das Ziel des Protokolls ist es daher, perkutan Nervenstimulationstechnik zu beschreiben, die neuromuskuläre Funktion im Trizeps Surae untersuchen.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Die experimentellen Verfahren umrissen erhalten Institutional ethischen Zulassung und stehen im Einklang mit der Deklaration von Helsinki. Die Daten wurden von einem Vertreter Teilnehmer, der Kenntnis von den Verfahren war und gab sein schriftliches Einverständnis gesammelt.
1. Instrumentenaufbereitung
- Reinigen Sie die Haut an der Elektrode Ort durch Rasieren, und mit Alkohol zu niedrige Impedanz (<5 kOhm) zu erhalten, entfernen Sie den Schmutz.
- Stellen zwei AgCl Oberflächenelektroden (Aufzeichnungsdurchmesser von 10 mm) bei 2/3 der Strecke zwischen den medialen condylis des Femurs des Innenknöchels zur Soleusmuskel; auf der prominentesten Ausbuchtung der Muskel für den medialen gastrocnemius; bei 1/3 des Abstands entlang einer Linie zwischen dem Kopf des Wadenbeins und der Ferse zur lateralen Gastrocnemius; und 1/3 der Entfernung entlang einer Linie zwischen der Spitze der Fibula und der Spitze des Innenknöchels für den Tibialis anterior-Muskel mit einem interelectrode Abstand (Mitte zu Mitte) von 2 cm, nach den Empfehlungen SENIAM 30.
Hinweis: Die Soleusmuskel Elektroden unter der distalen Insertion gastrocnemii Muskeln positioniert, um sicherzustellen, dass sie nicht die Aufnahme-Aktivität aus den Köpfen der gastrocnemii Muskeln (Übersprechen) werden. - Legen Sie eine Referenzelektrode in einer zentralen Position auf dem gleichen Schenkel (zwischen Stimulation und Ableitung Websites).
- Stellen Sie die Höhe und die Tiefe des Stuhls auf eine Sprunggelenkwinkel von 90 ° (0 ° = volle Plantarflexion) zu erhalten, so dass die soleus und gastrocnemii Muskeln werden nicht gestreckt, und die H-Reflex nicht verändert 11,12.
- Stellen Sie die Kniewinkel bei 90 ° (0 ° = volle Kniestreckung) aufgrund der biarticular Natur der gastrocnemii Muskeln. Allerdings ist die optimale Fußgelenk-Winkel, um eine maximale willkürliche Drehmoment der Plantarflexoren zuführen (0 ° = full Plantarflexion) 26 70-80 °. Somit wird Fußgelenk-Winkel an der para hängenmeter von Interesse (elektrophysiologische gegen mechanische Aufnahmen).
Hinweis: Unabhängig von der gewählten Anfangswinkel, muss konstant bleiben während des gesamten Experiments die neuromuskuläre Erregbarkeit 11,12,27,28 standardisieren. - Achten Sie insbesondere bei der Überwachung der Probanden Körperhaltung während des Tests auf konstante cortico-vestibulären Einflüsse auf die Erregbarkeit der Fuhrpark 29 aufrecht zu erhalten.
- Stellen Sie die Kniewinkel bei 90 ° (0 ° = volle Kniestreckung) aufgrund der biarticular Natur der gastrocnemii Muskeln. Allerdings ist die optimale Fußgelenk-Winkel, um eine maximale willkürliche Drehmoment der Plantarflexoren zuführen (0 ° = full Plantarflexion) 26 70-80 °. Somit wird Fußgelenk-Winkel an der para hängenmeter von Interesse (elektrophysiologische gegen mechanische Aufnahmen).
- Fest Gurt des Sprunggelenks auf eine Ergometer, mit der anatomischen Achse des Gelenks (externe Malleolus) mit der Drehachse des Ergometers 25 ausgerichtet ist.
- Haben das Thema Druck ausüben auf einer Fußplatte mit dem Ergometer angebracht, um Plantarflexor Drehmoment aufzunehmen. Halten den Fuß unbeweglich während des Experiments, so dass kleine Änderungen des Drehmoments festgestellt werden kann.
- Hinweis: Unter bestimmten Umständen kann die Ferse etwas abseits der Kraftmessplatte anzuheben, wenn der Fuß und Knöchel sind nicht besichert, die Le MayAnzeige an einer unvollständigen Übertragung des Drehmoments an die Platte, Fig. 3 stellt eine Beschreibung des Versuchsaufbaus.
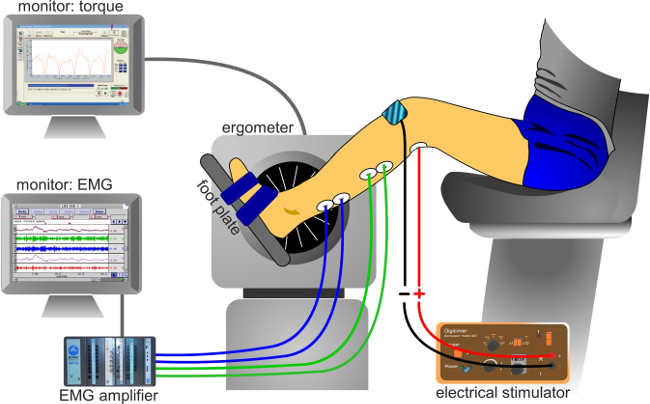
Abb. 3: Versuchsaufbau Klassische Versuchsaufbau Elektromyographie (EMG) und Drehmoment-Signale zu erfassen.
- Die Elektroden an den Verstärker mit Kabeln.
- Stellen Sie die Abtastrate für Drehmoment und EMG-Messungen, um 2-5 kHz. Notieren Sie sich die EMG-Signals mit Hilfe eines Analog-zu-Digital (AD) Umwandlungssystem. Das Signal wird auf einem Monitor mit einem Datenerfassungssystem, das augenblicklich ergibt Werte mehrerer Parameter angezeigt (zB Maximalwert, Spitze-zu-Spitze-Amplitude, Dauer). Das Spektrum des EMG-Signals kann zwischen 5 Hz und 2 kHz-Frequenzen liegen, liegt aber meist zwischen 10 Hz und 1 kHz 31 enthalten ist. So müssen Abtastfrequenz hoch genug, um die Signalform dur bewahrening EMG-Aufzeichnung. Verstärken und EMG-Signale (Verstärkung = 500-100) unter Verwendung eines Bandbreitenfrequenz zwischen 10 Hz und 1 kHz 8,21,32 filtern.
- Legen Sie die Anode für die elektrische Stimulation über der Patellasehne.
- Ermitteln Sie die beste Stimulationsstelle des N. tibialis posterior, um eine optimale soleus H-Reflex für eine gegebene Intensität zu erhalten, mit einem Handheld-Kathodenkugelelektrode in der Kniekehle. Testen mehrerer Stimulationsstellen mit der Kathodenkugelelektrode, bis ein Maximalwert der H-Reflex erreicht ist.
- Nehmen tibialis anterior EMG-Aktivität, um sicherzustellen, dass der N. peronaeus nicht aktiviert ist, um Einfluss zu vermeiden vom Antagonisten Ia-Afferenzen 12. Stellen Sie die Impulsbreite bei 1 ms, um eine optimale Aktivierung der Nervenfasern, insbesondere Afferenzen 10 bereitzustellen.
- Legen Sie eine selbstklebende AgCl Kathode an der Stelle der Stimulationsstelle zu konstanten Stimulus Zustand zu gewährleisten (zB Druck, orientation).
Hinweis: Alle diese Parameter (Subjektposition, Elektroden Lage und Stimulationsstelle) nicht für die Beurteilung der verschiedenen elektrophysiologischen Messungen ändern. Nur die Intensität der Stimulation und die Bedingung (Rest gegen Kontraktion) variieren.
2. Prüfverfahren im Ruhezustand
- Weisen Sie den Betreff entspannt zu bleiben und seine / ihre Muskeln in Ruhe zu halten.
- Stellen Sie die Stimulationsintensität, um eine maximale soleus H-Reflex-Amplitude (H max; üblichen Bereich: 20-50 mA) zu erhalten. Ein M-Welle der Soleusmuskel kann bei H max Intensität beobachtet werden.
Anmerkung: Für wiederholte Messungen (zB vor und nach einer ermüdenden Protokoll), der optimalen Intensität ein H max Reaktion kann während der Sitzung variieren, um zu erhalten. Wie halten eine konstante Intensität kann zu einer Unterschätzung H max Amplitude führen, ist es empfehlenswert, dass der Experimentator reevaluates regelmäßig H maxIntensität 33. - Nehmen Sie ein Minimum von 3 soleus H-Reflexantworten zu dieser Intensität mit einem Mindestabstand von 3 Sek Nachaktivierung Vertiefung 34 zu vermeiden.
Anmerkung: Obwohl die Aufzeichnung mehrere Antworten ist wegen der besonderen Empfindlichkeit der H-Reflex besser geeignet, kann eine einzelne Stimulations genug unter bestimmten Umständen, beispielsweise bei dem Versuch, die Auswirkungen der raschen Erholung (zB während einer ermüdenden Protokoll) zu vermeiden. - Erhöhen Sie die Stimulationsintensität, um eine maximale soleus M-Wellenamplitude (M max; üblichen Bereich: 40-100 mA) zu erhalten. In der Regel stellen Sie die Schrittweite in Stimulationsintensität bei 2-4 mA, mit einem Abstand von 8-10 sec zwischen zwei Stimuli 12,35. Die gewünschte Intensität erreicht, wenn Mmax erreicht wird, und keine H-Reflexreaktion beobachtet werden kann.
- Der Endwert Intensität auf 120-150% von Mmax Stimulusintensität, um sicherzustellen, dass die M-Welle erreicht ein Plateau der maximalen Wert. Dies intensiviertty wird als supra Intensität in den nachstehenden Anweisungen.
- Halten konstanter Stimulationsintensität für soleus M-Wave-Aufnahmen während der gesamten Sitzung.
- Nehmen Sie 3 soleus M-Wellen und 3 zugeordnet Zucken Drehmomente bei dieser Intensität.
3. Prüfverfahren Während willkürlichen Kontraktion
- Als Warm-up, ersucht den Patienten, 10 kurze und ermüdungsfreies submaximale Kontraktionen der Plantarflexoren durchzuführen, mit ein paar Sekunden Pause zwischen jedem der Kontraktionen. Am Ende der Aufwärm, werfen Sie einen Mindest 1 min Ruhe, alle ermüdenden Effekte 11 zu vermeiden.
- Kontinuierlich Rekord Triceps surae EMG-Aktivität. Aufzeichnung soleus und gastrocnemii Muskulatur ermöglicht die Analyse des Verhaltens von verschiedenen Muskel Typologien für einen einzigen Stimulationsstelle 24.
- Weisen Sie den Gegenstand eine isometrische maximalen willkürlichen Kontraktion (MVC) der Plantarflexoren durchzuführen. Das Thema muss so hart wie mög drückenBLE gegen das Ergometer durch Kontraktion seiner Plantarflexoren. Geben Sie eine visuelle Rückmeldung auf das Thema während der Anstrengung, und standardisierte verbale Ermutigung 19. Die MVC ist erreicht, wenn ein Plateau beobachtet.
- Liefern Sie eine gepaart Stimulation (100 Hz Frequenz) auf supraIntensität während der Hochebene des MVC (lagert Dublett), und ein anderes gepaart Stimulation, wenn der Muskel entspannt sofort nach dem Zusammenziehen (potenziert Dublett), die freiwillige Aktivierungsgrad zu bewerten. Liefern diese gepaart Stimulation durch ein bestimmtes Gerät (zB Digitimer D185 Multipulse Stimulator) oder über ein Stimulationsprogramm mit einem einzigen Impuls Stimulator verbunden.
- Weisen Sie den Betreff, um eine zweite MVC des Plantarflexor mit mindestens 1 min Pause zwischen jedem Versuch 11 durchzuführen. Wenn das Spitzendrehmoment von der zweiten Studie ist nicht innerhalb von 5% der ersten, müssen zusätzliche Prüfungen durchgeführt 36 werden. Die größte von Drehmoment erreichtGegenstand als MVC Drehmoment gemacht.
4. Datenanalyse
- Datenanalyse in Ruhe
- Wählen Sie ein Zeitfenster, einschließlich der EMG-Antwort mit dem Zucken im Ruhezustand (H-Welle oder M-Welle) verbunden.
- Messen des Spitze-zu-Spitze-Amplitude von Spitze zu Spitze der Dauer und / oder der Bereich der Wellen (4A). Wenn die Amplitude nicht direkt durch die Software zur Verfügung gestellt, subtrahieren das Minimum auf den Maximalwerten.
- Für die Dauer, messen Sie den Zeitrahmen ausgehend von der maximalen Spitzen und endend mit dem minimalen Spitzen. Für den Bereich, Berechnen des Integrals des EMG-Signals ausgehend von dem Beginn der Kurven und endend mit dem Ende der Welle.
Anmerkung: Spitze-zu-Spitze-Amplitude reflektieren kann: 1) die neuromuskuläre Übertragung, 2) Motoreinheit Aktionspotentialamplitude und / oder 3) zeitliche Dispersion der Motoreinheit Aktionspotential 37. M-Wellendauer spiegelt neuromuskuläre Ausbreitungs 37.
- Für die Dauer, messen Sie den Zeitrahmen ausgehend von der maximalen Spitzen und endend mit dem minimalen Spitzen. Für den Bereich, Berechnen des Integrals des EMG-Signals ausgehend von dem Beginn der Kurven und endend mit dem Ende der Welle.
- Für mehrere Studien, berechnen Sie den Mittelwert der Wellen. Wenn der Durchschnitt nicht direkt von der Software mit Tabellenkalkulations-Software zur Verfügung gestellt werden (beispielsweise die Formelfunktion in einem Tabellenkalkulationsprogramm), um diesen Wert von mehreren Versuchen (mindestens 3) zu berechnen.
- Wählen Sie den Ruhe zucken.
- Messung der Spitzendrehmoment mit dem ruhenden Zucken (4B) verbunden ist.
- Für mehrere Studien, Berechnung der durchschnittlichen maximalen Drehmoment von der Ruhe zuckt. Wenn der Durchschnitt nicht direkt von der Software mit Tabellenkalkulations-Software zur Verfügung gestellt werden (beispielsweise die Formelfunktion in einem Tabellenkalkulationsprogramm), um diesen Wert aus den verschiedenen Versuchen (mindestens 3) zu berechnen.
- Wiederholen Sie diese in Nummer 4.1.2 für die anderen gewünschten Parameter (Kontraktionszeit oder Halb Relaxationszeit) beschriebenen Verfahren. Die Analyse der zuckenden Parametern liefert Hinweise auf die elektromechanischen Kopplung Effizienz 17. Insbesondere VertragIonen-Zeit liefert einen Index der Kontraktion Kinetik 8, die von der gewählten Muskelgruppe 38 verlassen können.
- Berechnen Sie das Verhältnis zwischen dem maximalen Drehmoment und der Summe der M-Wellen unter Verwendung von Tabellenkalkulationsprogramm (zB Excel), um die elektromechanische Effizienz zu quantifizieren (P t / M). Da die mechanischen Reaktionen, die durch tibialis posterior Nervenstimulation evozierte entsprechen der Aktivierung des Triceps surae als Ganzes, Amplituden soleus und gastrocnemii M-Wellen müssen zusammenfassen 39.
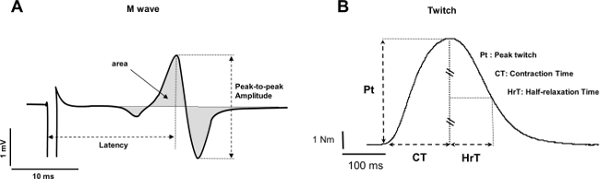
Abbildung 4: Erläuterung der elektrophysiologische und mechanische Reaktionen (A) Messung der Spitze-zu-Spitze-Amplitude (mV), Latenz (ms) und die Fläche (mV.ms) eines typischen M-Welle.. (B) Messung der Peak-twitch Drehmoment (Nm), Kontraktionszeit (ms) und die Halb Relaxationszeit (msec) eines Zucken. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
- Datenanalyse in Kontraktion
- Wählen Sie ein 500 ms Zeitfenster von soleus EMG-Aktivität während der Hochebene von MVC Drehmoment einschließlich der Spitzendrehmoment, nicht jedoch die Zeit zwischen der Stimulationsartefakt und Ende der Ruhephase der EMG. Die stille Periode entspricht der Unterdrückung der laufenden freiwilligen EMG-Aktivität nach Stimulation.
- Wenn der quadratische Mittelwert (RMS) ist nicht direkt von der Software zur Verfügung gestellt, berechnen Sie die RMS-EMG-Aktivität zu quantifizieren, mit der folgenden Formel 40: RMS-EMG
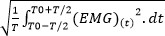
- Messung oder Berechnung des RMS von M max in Ruhe über die Laufzeit der Welle.
- Berechnen Sie die RMS EMG / RMS Mmax Verhältnis mit Tabellenkalkulations-Software.RMS EMG Wert und RMS-Wert Mmax müssen aus dem gleichen Muskel ausgewählt werden.
- Messung der maximalen Spitzendrehmoment MVC von der Grundlinie des Drehmoments im Ruhezustand auf den Maximalwert von MVC ohne überlagerte Drehmoment vom Dublett Stimulation (5) induziert.
- Messung der lagert Drehmoment vom Dublett Stimulation während der MVC induziert, aus der fakultativen Drehmomentwert zu Beginn der Stimulation, um die Spitze der evozierten Reaktion (Abbildung 5).
- Wählen Sie das potenziert Wams.
- Messen Sie die maximale Drehmoment mit dem potenzierten Wams verbunden.
- Berechnen Sie die freiwillige Aktivierungsniveau (VAL) anhand der folgenden Formel 40:

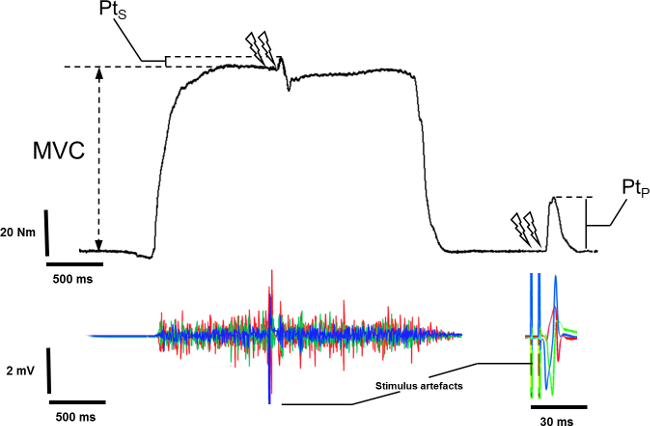
Figur 5: Messung überlagert undpotenziert Wams auf mechanisches Signal. Um das überlagerte Spitzendrehmoment (PTS) aufnehmen, wird die Stimulation Wams während der Hochebene von isometrischen Maximal willkürlichen Kontraktion (MVC) hervorgerufen. Um potenzierten Spitzendrehmoment (Pt P) aufzunehmen, wird die Stimulation Wams in Ruhe nach dem Offset von MVC hervorgerufen.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Zunehmender Reizstärke führt zu einer unterschiedlichen Entwicklung der Reaktionsamplituden zwischen H- und M-Wellen. Im Ruhezustand einen Maximalwert erreicht die H-Reflex, bevor sie von EMG-Signal völlig abwesend, während M Wellen schrittweise bis zum Erreichen einer Hochebene auf maximale Intensität erhöht (siehe Abbildung 4 eine graphische Darstellung der M-Welle und 6 für die Evolution der M-Wellen und H-Reflex mit Intensität). Für M. soleus, ist die Latenz zwischen dem Re...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Perkutane Nervenstimulation ermöglicht die Quantifizierung der zahlreiche Merkmale des neuromuskulären Systems nicht nur die grundlegende Steuerung der neuromotorischen Funktion bei gesunden Menschen zu verstehen, aber auch um akute oder chronische Anpassungen durch Materialermüdung oder Ausbildung 17 zu analysieren. Dies ist sehr vorteilhaft insbesondere für ermüdend Protokolle, wo Messungen sind nach der Übung, so schnell wie möglich durchgeführt werden, um die Auswirkungen der raschen Wiedergewinnu...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
The authors have no acknowledgements.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Biodex dynamometer | Biodex Medical System Inc., New York, USA | www.biodex.com | |
| MP150 Data Acquisition System | Biopac Systems Inc., Goleta, USA | ||
| Acknowledge 4.1.0 software | Biopac Systems Inc., Goleta, USA | www.biopac.com | |
| DS7A constant current high voltage stimulator | Digitimer, Hertfordshire, UK | www.digitimer.com | |
| Silver chloride surface electrodes | Control Graphique Medical, Brie-Comte-Robert, France | ||
| Computer | |||
| 1 Cable for connecting the Biodex to the MP150 | |||
| 1 Cable for connecting the Digitimer to the MP150 | |||
| 1 Cable for connecting the MP150 to the computer |
Referenzen
- Desmedt, J. E., Hainaut, K. Kinetics of myofilament activation in potentiated contraction staircase phenomenon in human skeletal muscle. Nature. 217 (5128), 529-532 (1968).
- Bouisset, S., Maton, B. Quantitative relationship between surface EMG and intramuscular electromyographic activity in voluntary movement. American Journal of Physical Medicine. 51 (6), 285-295 (1972).
- Gabriel, D. A. Effects of monopolar and bipolar electrode configurations on surface EMG spike analysis. Medical Engineering and Physics. 33 (9), 1079-1085 (2011).
- Merletti, R., Rainoldi, A., Farina, D. Surface electromyography for noninvasive characterization of muscle. Exercise and Sport Sciences Reviews. 29 (1), 20-25 (2001).
- Lepers, R. Aetiology and time course of neuromuscular fatigue during prolonged cycling exercises. Science, & Motricité. 52, 83-107 (2004).
- Baudry, S., Klass, M., Pasquet, B., Duchateau, J. Age related fatigability of the ankle dorsiflexor muscles during concentric and eccentric contractions. European Journal of Applied Physiology. 100 (5), 515-525 (2007).
- Place, N., Yamada, T., Bruton, J. D., Westerblad, H. Muscle fatigue From observations in humans to underlying mechanisms studied in intact single muscle fibres. European Journal of Applied Physiology. 110 (1), 1-15 (2010).
- Scaglioni, G., Narici, M. V., Maffiuletti, N. A., Pensini, M., Martin, A. Effect of ageing on the electrical and mechanical properties of human soleus motor units activated by the H reflex and M wave. The Journal of Physiology. 548 (Pt. 2), 649-661 (2003).
- Schieppati, M. The Hoffmann reflex a means of assessing spinal reflex excitability and its descending control in man. Progress in Neurobiology. 28 (4), 345-376 (1987).
- Pierrot Deseilligny, E., Burke, D. The circuitry of the human spinal cord: its role in motor control and movement disorders. , Cambridge University Press. (2005).
- Duclay, J., Pasquet, B., Martin, A., Duchateau, J. Specific modulation of corticospinal and spinal excitabilities during maximal voluntary isometric shortening and lengthening contractions in synergist muscles. The Journal of Physiology. 589 (Pt. 11), 2901-2916 (2011).
- Grosprêtre, S., Papaxanthis, C., Martin, A. Modulation of spinal excitability by a sub threshold stimulation of M1 area during muscle lengthening. Neuroscience. 263, 60-71 (2014).
- Mynark, R. G. Reliability of the soleus H reflex from supine to standing in young and elderly. Clinical Neurophysiology. 116 (6), 1400-1404 (2005).
- Palmieri, R. M., Hoffman, M. A., Ingersoll, C. D. Intersession reliability for H reflex measurements arising from the soleus peroneal and tibialis anterior musculature. The International Journal of Neuroscience. 112 (7), 841-850 (2002).
- Chen, Y. S., Zhou, S., Cartwright, C., Crowley, Z., Baglin, R., Wang, F. Test retest reliability of the soleus H reflex is affected by joint positions and muscle force levels. Journal of Electromyography and Kinesiology. 20 (5), 987-987 (2010).
- Lehman, G. J., McGill, S. M. The importance of normalization in the interpretation of surface electromyography A proof of principle. Journal of Manipulative and Physiological Therapeutics. 22 (7), 444-446 (1999).
- Lepers, R. Interest and limits of percutaneous nerve electrical stimulation in the evaluation of muscle fatigue. Science, & Motricité. 70 (70), 31-37 (2010).
- Merton, P. A. Voluntary strength and fatigue. The Journal of Physiology. 123, 553-564 (1954).
- Gandevia, S. C. Spinal and supraspinal factors in human muscle fatigue. Physiological Reviews. 81 (4), 1725-1789 (2001).
- Shield, A., Zhou, S. Assessing voluntary muscle activation with the twitch interpolation technique. Sports Medicine. 34 (4), 253-267 (2004).
- Rozand, V., Pageaux, B., Marcora, S. M., Papaxanthis, C., Lepers, R. Does mental exertion alter maximal muscle activation. Frontiers in Human Neuroscience. 8, 755(2014).
- Place, N., Maffiuletti, N. A., Martin, A., Lepers, R. Assessment of the reliability of central and peripheral fatigue after sustained maximal voluntary contraction of the quadriceps muscle. Muscle and Nerve. 35 (4), 486-495 (2007).
- Kannus, P. Isokinetic evaluation of muscular performance: implications for muscle testing and rehabilitation. International Journal of Sports Medicine. 15, Suppl 1. S11-S18 (1994).
- Tucker, K. J., Tuncer, M., Türker, K. S. A review of the H reflex and M wave in the human triceps surae. Human Movement Science. 24 (5-6), 667-688 (2005).
- Taylor, N. A., Sanders, R. H., Howick, E. I., Stanley, S. N. Static and dynamic assessment of the Biodex dynamometer. European Journal of Applied Physiology and Occupational Physiology. 62 (3), 180-188 (1991).
- Sale, D., Quinlan, J., Marsh, E., McComas, A. J., Belanger, A. Y. Influence of joint position on ankle plantarflexion in humans. Journal of Applied Physiology. 52 (6), 1636-1642 (1982).
- Cattagni, T., Martin, A., Scaglioni, G. Is spinal excitability of the triceps surae mainly affected by muscle activity or body position. Journal of Neurophysiology. 111 (12), 2525-2532 (2014).
- Gerilovsky, L., Tsvetinov, P., Trenkova, G. Peripheral effects on the amplitude of monopolar and bipolar H-reflex potentials from the soleus muscle. Experimental Brain Research. 76 (1), 173-181 (1989).
- Schieppati, M. The Hoffmann reflex a means of assessing spinal reflex excitability and its descending control in man. Progress in Neurobiology. 28 (4), 345-376 (1987).
- Hermens, H. J., Freriks, B., Disselhorst Klug, C., Rau, G. Development of recommendations for SEMG sensors and sensor placement procedures. Journal of Electromyography and Kinesiology. 10 (5), 361-374 (2000).
- Kamen, G., Sison, S. V., Du, C. C., Patten, C. Motor unit discharge behavior in older adults during maximal effort contractions. Journal of Applied Physiology. 79 (6), 1908-1913 (1995).
- Neyroud, D., Rüttimann, J., et al. Comparison of neuromuscular adjustments associated with sustained isometric contractions of four different muscle groups. Journal of Applied Physiology. 114, 1426-1434 (2013).
- Rupp, T., Girard, O., Perrey, S. Redetermination of the optimal stimulation intensity modifies resting H-reflex recovery after a sustained moderate-intensity muscle contraction. Muscle and Nerve. 41 (May), 642-650 (2010).
- Zehr, E. P. Considerations for use of the Hoffmann reflex in exercise studies. European Journal of Applied Physiology. 86 (6), 455-468 (2002).
- Gondin, J., Duclay, J., Martin, A. Soleus and gastrocnemii evoked V wave responses increase after neuromuscular electrical stimulation training. Journal of Neurophysiology. 95 (6), 3328-3335 (2006).
- Rochette, L., Hunter, S. K., Place, N., Lepers, R. Activation varies among the knee extensor muscles during a submaximal fatiguing contraction in the seated and supine postures. Journal of Applied Physiology. 95 (4), 1515-1522 (2003).
- Fuglevand, A. J., Zackowski, K. M., Huey, K. A., Enoka, R. M. Impairment of neuromuscular propagation during human fatiguing contractions at submaximal forces. The Journal of Physiology. 460, 549-572 (1993).
- Vandervoort, A. A., McComas, A. J. Contractile changes in opposing muscles of the human ankle joint with aging. Journal of Applied Physiology. 61 (1), 361-367 (1986).
- Grosprêtre, S., Martin, A. Conditioning effect of transcranial magnetic stimulation evoking motor evoked potential on V wave response. Physiological Reports. 2 (11), e12191(2014).
- Allen, G. M., Gandevia, S. C., McKenzie, D. K. Reliability of measurements of muscle strength and voluntary activation using twitch interpolation. Muscle and Nerve. 18 (6), 593-600 (1995).
- Cooper, M. A., Herda, T. J., Walter Herda, A. A., Costa, P. B., Ryan, E. D., Cramer, J. T. The reliability of the interpolated twitch technique during submaximal and maximal isometric muscle actions. Journal of Strength and Conditioning Research. 27 (10), 2909-2913 (2013).
- Froyd, C., Millet, G. Y., Noakes, T. D. The development of peripheral fatigue and short term recovery during self paced high intensity exercise. The Journal of Physiology. 591 (Pt 5), 1339-1346 (2013).
- Pierrot Deseilligny, E., Morin, C., Bergego, C., Tankov, N. Pattern of group I fibre projections from ankle flexor and extensor muscles in man. Experimental Brain Research. 42 (3-4), 337-350 (1981).
- Brooke, J. D., McIlroy, W. E., et al. Modulation of H reflexes in human tibialis anterior muscle with passive movement. Brain Research. 766 (1-2), 236-239 (1997).
- Hultborn, H., Meunier, S., Morin, C., Pierrot Deseilligny, E. Assessing changes in presynaptic inhibition of I a fibres a study in man and the cat. The Journal of Physiology. 389, 729-756 (1987).
- Meunier, S., Pierrot Deseilligny, E. Cortical control of presynaptic inhibition of Ia afferents in humans. Experimental Brain Research. 119 (4), 415-426 (1998).
- Aymard, C., Baret, M., Katz, R., Lafitte, C., Pénicaud, A., Raoul, S. Modulation of presynaptic inhibition of la afferents during voluntary wrist flexion and extension in man. Experimental Brain Research. 137 (1), 127-131 (2001).
- Abbruzzese, G., Trompetto, C., Schieppati, M. The excitability of the human motor cortex increases during execution and mental imagination of sequential but not repetitive finger movements. Experimental Brain Research. 111 (3), 465-472 (1996).
- Garland, S. J., Klass, M., Duchateau, J. Cortical and spinal modulation of antagonist coactivation during a submaximal fatiguing contraction in humans. Journal of Neurophysiology. 99, 554-563 (2008).
- Rodriguez Falces, J., Place, N. Recruitment order of quadriceps motor units Femoral nerve vs direct quadriceps stimulation. European Journal of Applied Physiology. 113, 3069-3077 (2013).
- Rodriguez Falces, J., Maffiuletti, N. A., Place, N. Spatial distribution of motor units recruited during electrical stimulation of the quadriceps muscle versus the femoral nerve. Muscle and Nerve. 48 (November), 752-761 (2013).
- Bathien, N., Morin, C. Comparing variations of spinal reflexes during intensive and selective attention (author’s transl). Physiology, & Behavior. 9 (4), 533-538 (1972).
- Earles, D. R., Koceja, D. M., Shively, C. W. Environmental changes in soleus H reflex excitability in young and elderly subjects. The International Journal of Neuroscience. 105 (1-4), 1-13 (2000).
- Paquet, N., Hui Chan, C. W. Human soleus H reflex excitability is decreased by dynamic head and body tilts. Journal of Vestibular Research Equilibrium, & Orientation. 9 (5), 379-383 (1999).
- Miyahara, T., Hagiya, N., Ohyama, T., Nakamura, Y. Modulation of human soleus H reflex in association with voluntary clenching of the teeth. Journal of Neurophysiology. 76 (3), 2033-2041 (1996).
- Pinniger, G. J., Nordlund, M. M., Steele, J. R., Cresswell, a GH reflex modulation during passive lengthening and shortening of the human triceps surae. Journal of Physiology. 534 (Pt 3), 913-923 (2001).
- Tallent, J., Goodall, S., Hortobágyi, T., St Clair Gibson, A., French, D. N., Howatson, G. Repeatability of corticospinal and spinal measures during lengthening and shortening contractions in the human tibialis anterior muscle). PLoS ONE. 7 (4), e35930(2012).
- Grospretre, S., Martin, A. H. reflex and spinal excitability methodological considerations. Journal of Neurophysiology. 107 (6), 1649-1654 (2012).
- Hugon, M. Methodology of the Hoffmann reflex in man. New Developments in Electromyography and Chemical Neurophysiology. 3m, 277-293 (1973).
- Bigland Ritchie, B., Zijdewind, I., Thomas, C. K. Muscle fatigue induced by stimulation with and without doublets. Muscle and Nerve. 23 (9), 1348-1355 (2000).
- Kent Braun, J. A., Le Blanc, R. Quantitation of central activation failure during maximal voluntary contractions in humans. Muscle and Nerve. 19 (7), 861-869 (1996).
- Herbert, R. D., Gandevia, S. C. Twitch interpolation in human muscles mechanisms and implications for measurement of voluntary activation. Journal of Neurophysiology. 82, 2271-2283 (1999).
- Miller, M., Downham, D., Lexell, J. Superimposed single impulse and pulse train electrical stimulation A quantitative assessment during submaximal isometric knee extension in young healthy men. Muscle and Nerve. 22 (8), 1038-1046 (1999).
- Button, D. C., Behm, D. G. The effect of stimulus anticipation on the interpolated twitch technique. Journal of Sports Science and Medicine. 7 (4), 520-524 (2008).
- Goss, D. a, Hoffman, R. L., Clark, B. C. Utilizing Transcranial Magnetic Stimulation to Study the Human Neuromuscular System. Journal of Visualized Experiments. (59), e3387(2012).
- Sartori, L., Betti, S., Castiello, U. Corticospinal excitability modulation during action observation. Journal Of Visualized Experiments: Jove. (82), 51001(2013).
- Rozand, V., Lebon, F., Papaxanthis, C., Lepers, R. Does a mental training session induce neuromuscular fatigue. Medicine and Science in Sports and Exercise. 46 (10), 1981-1989 (2014).
- Rozand, V., Cattagni, T., Theurel, J., Martin, A., Lepers, R. Neuromuscular fatigue following isometric contractions with similar torque time integral. International Journal of Sports Medicine. 36, 35-40 (2015).
- Belanger, A. Y., McComas, A. J. Extent of motor unit activation during effort. Journal of Applied Physiology. 51 (5), 1131-1135 (1981).
- Morse, C. I., Thom, J. M., Davis, M. G., Fox, K. R., Birch, K. M., Narici, M. V. Reduced plantarflexor specific torque in the elderly is associated with a lower activation capacity. European Journal of Applied Physiology. 92 (1-2), 219-226 (2004).
- Dalton, B. H., McNeil, C. J., Doherty, T. J., Rice, C. L. Age related reductions in the estimated numbers of motor units are minimal in the human soleus. Muscle and Nerve. 38 (3), 1108-1115 (2008).
- Hunter, S. K., Todd, G., Butler, J. E., Gandevia, S. C., Taylor, J. L. Recovery from supraspinal fatigue is slowed in old adults after fatiguing maximal isometric contractions. Journal of Applied Physiology. 105 (4), 1199-1209 (2008).
- Jakobi, J. M., Rice, C. L. Voluntary muscle activation varies with age and muscle group. Journal of Applied Physiology. 93 (2), 457-462 (2002).
- Lepers, R., Millet, G. Y., Maffiuletti, N. a Effect of cycling cadence on contractile and neural properties of knee extensors. Medicine and Science in Sports and Exercise. 33 (11), 1882-1888 (2001).
- Duchateau, J., Hainaut, K. Isometric or dynamic training differential effects on mechanical properties of a human muscle. Journal of Applied Physiology. 56 (2), 296-301 (1984).
- Millet, G. Y., Martin, V., Martin, A., Vergès, S. Electrical stimulation for testing neuromuscular function From sport to pathology. European Journal of Applied Physiology. 111, 2489-2500 (2011).
- Cattagni, T., Scaglioni, G., Laroche, D., Van Hoecke, J., Gremeaux, V., Martin, A. Ankle muscle strength discriminates fallers from non fallers. Frontiers in Aging Neuroscience. 6, 336(2014).
- Horstman, A. M., Beltman, M. J., et al. Intrinsic muscle strength and voluntary activation of both lower limbs and functional performance after stroke. Clinical Physiology and Functional Imaging. 28 (4), 251-261 (2008).
- Sica, R. E., Herskovits, E., Aguilera, N., Poch, G. An electrophysiological investigation of skeletal muscle in Parkinson’s disease. Journal of the Neurological Sciences. 18 (4), 411-420 (1973).
- Knikou, M., Mummidisetty, C. K. Locomotor Training Improves Premotoneuronal Control after Chronic Spinal Cord Injury. Journal of Neurophysiology. 111 (11), 2264-2275 (2014).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten