É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Avaliação da função neuromuscular Usando percutânea Estimulação Elétrica Nervosa
Neste Artigo
Resumo
We present a protocol to assess changes in neuromuscular function. Percutaneous electrical nerve stimulation is a non-invasive method that evokes muscular responses. Electrophysiological and mechanical properties of these responses permit the evaluation of neuromuscular function from brain to muscle (supra-spinal, spinal and peripheral levels).
Resumo
Percutaneous electrical nerve stimulation is a non-invasive method commonly used to evaluate neuromuscular function from brain to muscle (supra-spinal, spinal and peripheral levels). The present protocol describes how this method can be used to stimulate the posterior tibial nerve that activates plantar flexor muscles. Percutaneous electrical nerve stimulation consists of inducing an electrical stimulus to a motor nerve to evoke a muscular response. Direct (M-wave) and/or indirect (H-reflex) electrophysiological responses can be recorded at rest using surface electromyography. Mechanical (twitch torque) responses can be quantified with a force/torque ergometer. M-wave and twitch torque reflect neuromuscular transmission and excitation-contraction coupling, whereas H-reflex provides an index of spinal excitability. EMG activity and mechanical (superimposed twitch) responses can also be recorded during maximal voluntary contractions to evaluate voluntary activation level. Percutaneous nerve stimulation provides an assessment of neuromuscular function in humans, and is highly beneficial especially for studies evaluating neuromuscular plasticity following acute (fatigue) or chronic (training/detraining) exercise.
Introdução
Estimulação elétrica nervosa percutânea é amplamente utilizado para avaliar a função neuromuscular 1. O princípio básico consiste em induzir um estímulo eléctrico a um nervo motor periférico para evocar uma contracção muscular. Mecânica (medição de torque) e eletrofisiológicas (atividade eletromiográfica) respostas são gravados simultaneamente. Torque, registrado na junta considerada, é avaliada utilizando um ergômetro. O (EMG) eletromiográficas sinal gravado utilizando eléctrodos de superfície foi demonstrada para representar a actividade do músculo 2. Este método não-invasivo e não é doloroso mais facilmente implementado de gravações intramusculares. Ambos eléctrodos monopolares e bipolares podem ser usados. A configuração do eléctrodo monopolar tem sido mostrado para ser mais sensível a alterações na actividade muscular 3, que pode ser útil para pequenos músculos. No entanto, os eléctrodos bipolares têm mostrado ser mais eficaz na melhoria da r sinal-ruídoacio 4 e são mais comumente utilizado como um método de gravação e quantificação de actividade motora unitária. A metodologia descrita abaixo incidirá sobre gravações bipolares. Actividade de EMG é um indicador da eficácia e da integridade do sistema neuromuscular. O uso de estimulação nervosa percutânea oferece mais insights sobre a função neuromuscular, ou seja, alterações a nível muscular, medula, ou supra-espinhal (Figura 1).

Figura 1:. Visão geral das medições neuromusculares STIM: estimulação do nervo. EMG: A eletromiografia. VAL: nível de ativação voluntária. RMS: Root Mean Square. M máx: amplitude da onda M máxima.
Em repouso, o potencial de ação muscular composto, também chamado de M-ondas, é a resposta curta-latência observada após artefato de estímulo, e representa a massa muscular excitável pelo activ direta ção de axónios motores que conduzem ao músculo (Figura 2, número 3). Amplitude da onda-M aumenta com a intensidade até atingir um platô de seu valor máximo. Esta resposta, chamada M max, representa o somatório síncrono de todas as unidades motoras e / ou potenciais de ação das fibras musculares gravadas sob os eletrodos EMG de superfície 5. A evolução da amplitude da onda ou a área do pico-a-pico é utilizada para identificar alterações de transmissão neuromuscular 6. Alterações nas respostas mecânicas associadas com a onda-M, isto é, o pico de contração do binário / força, pode ser devido a alterações na excitabilidade muscular e / ou no interior das fibras musculares 7. A associação de M max amplitude e amplitude do torque de pico de contração (Pt rácio / M) fornece um índice de eficiência eletromecânica do músculo 8, ou seja, resposta mecânica para um determinado comando do motor elétrico.
52.974 / 52974fig2.jpg "/>
Figura 2:. Motor e vias reflexas ativadas por estimulação do nervo estimulação elétrica de um (/ sensorial motor) do nervo misto (STIM) induz a despolarização de ambos axônio motor e Ia aferentes de fuzilamento. A despolarização da Ia aferentes para a medula espinal de motoneurónios activa um alfa, que por sua vez provoca uma resposta do reflexo H (via 1 + 2 + 3). Dependendo da intensidade do estímulo, axônio motor de despolarização evoca uma resposta muscular direto:-ondas M (via 3). Na intensidade da onda M máxima, uma corrente antidrômica também é gerado (3 ') e colide com volley reflex (2). Esta colisão parcial ou totalmente cancela a resposta H-reflex.
O H-reflexo é uma resposta eletrofisiológica utilizado para avaliar mudanças no Ia-α motoneuron sinapse 9. Este parâmetro pode ser avaliada em repouso ou durante as contrações voluntárias. H-reflexo representa uma variante do reflexo de estiramento (Figura 2, NUmber 1-3). O reflexo H ativa unidades motoras monosynaptically recrutados por vias aferentes 10,11 Ia, e pode ser submetido a influências periféricas e centrais 12. O método de evocar um H-reflex é conhecido por ter uma confiabilidade intra-sujeito alta para avaliar a excitabilidade da medula em repouso 13,14 e durante contrações isométricas 15.
Durante uma contração voluntária, a magnitude da unidade neural voluntária pode ser avaliada usando a amplitude do sinal EMG, geralmente quantificada utilizando o Root Mean Square (RMS). RMS EMG é comumente utilizado um meio de quantificação do nível de excitação do sistema motor voluntário durante a contracção (Figura 1). Devido à variabilidade intra e inter-sujeito 16, RMS EMG tem de ser normalizados utilizando a EMG gravado durante uma contração voluntária máxima músculo-específica (RMS EMGmax). Além disso, porque as mudanças no sinal EMG pode be devido às alterações a nível periférico, utilizando um parâmetro de normalização periférico, tal como M-onda é obrigada a avaliar apenas o componente central do sinal EMG. Isto pode ser feito dividindo a RMS EMG por a amplitude máxima ou o RMS Mmax da onda-M. Normalização usando RMS Mmax (ie RMS EMG / RMS Mmax) é o método preferido, pois leva em consideração a possível alteração da duração da onda-M 17.
Comandos de motor pode também ser avaliada por cálculo do nível de activação voluntária (Val). Este método utiliza a técnica de interpolação contração de 18 por sobreposição de uma estimulação elétrica no M intensidade máxima durante uma contração voluntária máxima. O torque adicional induzida por estimulação do nervo é comparado com um tique controlo produzido por estimulação do nervo idêntica num músculo potenciada relaxado 19. Para avaliar máxima VAL, o interpo contração iniciallação técnica descrita por Merton 18 envolve um único estímulo interpolado sobre uma contração voluntária. Recentemente, o uso de estimulação emparelhados tornou-se mais popular porque os incrementos de torque evocados são maiores, mais facilmente detectada, e menos variável em comparação com as respostas individuais de estimulação 20. O VAL fornece um índice da capacidade do sistema nervoso central para activar ao máximo os músculos de trabalho 21. Atualmente, VAL avaliada usando a técnica de interpolação de contração é o método mais valioso de avaliar o nível de ativação muscular 22. Além disso, o pico de torque avaliada utilizando um ergômetro é o parâmetro de teste de força maior devidamente estudada aplicável de uso na pesquisa e na clínica 23.
Estimulação elétrica nervosa pode ser usado em uma variedade de grupos musculares (por exemplo, flexores do cotovelo, flexores do punho, extensores do joelho, flexores plantares). No entanto, faz com que a acessibilidade do nervotécnica difícil em alguns grupos musculares. Os músculos flexores plantares, especialmente tríceps sural (sóleo e gastrocnemii) músculos, são freqüentemente investigados na literatura 24. Na verdade, estes músculos estão envolvidos na locomoção, justificando o seu interesse particular. A distância entre local de estimulação e eletrodos de registro permite a identificação das diferentes ondas evocadas dos músculos tríceps sural. A parte superficial do nervo tibial posterior na fossa poplítea e do grande número de fusos tornar mais fácil para gravar as respostas reflexas comparado com outros músculos 24. Por estas razões, a metodologia reflexo atualmente apresentada incide sobre os tríceps sural grupo de músculos (sóleo e gastrocnêmio). O objectivo deste protocolo é, por conseguinte, para descrever técnica percutânea estimulação do nervo para investigar a função neuromuscular no tríceps sural.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Os procedimentos experimentais delineadas recebido aprovação ética institucional e estão em conformidade com a Declaração de Helsinki. Os dados foram coletados a partir de um participante representante que estava ciente dos procedimentos e deu o seu consentimento informado por escrito.
1. Instrumento Preparação
- Limpe a pele no local do eletrodo pelo barbear, e remover a sujeira com álcool para se obter baixa impedância (<5 kW).
- Coloque dois eletrodos de superfície AgCl (diâmetro de gravação de 10 mm) a 2/3 da linha entre as condylis medial do fêmur ao maléolo medial do músculo sóleo; no bojo mais proeminente do músculo gastrocnêmio medial para o; a 1/3 da distância ao longo de uma linha entre a cabeça da fíbula e do calcanhar para o gastrocnêmio lateral; e a 1/3 da distância ao longo de uma linha entre a ponta do perónio e a ponta do maléolo médio para o músculo tibial anterior, com um interelectrode distância (de centro-a-centro) de 2 cm, de acordo com as recomendações SENIAM 30.
Nota: Os eletrodos músculo sóleo tem que ser posicionado sob a inserção distal dos músculos gastrocnemii para garantir que eles não estão gravando atividade das cabeças dos músculos gastrocnemii (cross-talk). - Coloque um eléctrodo de referência numa posição central na mesma perna (entre a estimulação e locais de gravação).
- Ajustar a altura e a profundidade da cadeira para obter um ângulo de 90 ° do tornozelo (0 ° = flexão plantar cheio), de modo que o sóleo e músculos gastrocnemii não são esticadas e o reflexo H não é alterada 11,12.
- Definir o ângulo do joelho a 90 ° (0 ° = extensão do joelho completo), devido à natureza biarticular dos músculos gastrocnemii. No entanto, o ângulo do tornozelo ideal para executar um binário voluntária máxima dos flexores plantares é de 70-80 ° (0 ° = flexão plantar completa) 26. Assim, o ângulo do tornozelo irá depender do Parámedidor de interesse (eletrofisiológico contra gravações mecânicas).
Nota: Independentemente do ângulo inicial escolhido, ele deve permanecer constante durante todo o experimento para padronizar a excitabilidade neuromuscular 11,12,27,28. - Preste atenção especial ao monitorar a postura dos sujeitos durante o teste para manter influências córtico-vestibular constantes na excitabilidade do pool do motor 29.
- Definir o ângulo do joelho a 90 ° (0 ° = extensão do joelho completo), devido à natureza biarticular dos músculos gastrocnemii. No entanto, o ângulo do tornozelo ideal para executar um binário voluntária máxima dos flexores plantares é de 70-80 ° (0 ° = flexão plantar completa) 26. Assim, o ângulo do tornozelo irá depender do Parámedidor de interesse (eletrofisiológico contra gravações mecânicas).
- Firmemente cinta do tornozelo a um ergómetro, com o eixo da articulação anatómica (maléolo externo) alinhado com o eixo de rotação do 25 ergômetro.
- Ter a pressão assunto exercer sobre uma platina ligado ao ergômetro para gravar torque flexor plantar. Manter o pé imóvel ao longo da experiência de modo a que pequenas mudanças na binário pode ser detectada.
- Nota: Em determinadas circunstâncias, o salto pode levantar um pouco fora da plataforma de força, se o pé e tornozelo não são garantidos, o que pode lead a uma transmissão do binário incompleto contra a placa. A Figura 3 apresenta uma descrição da configuração experimental.
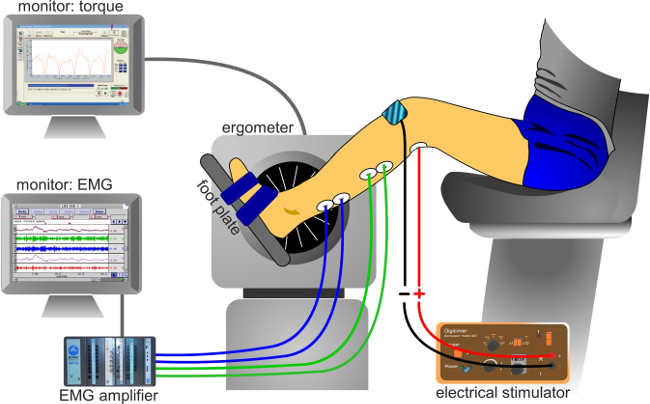
Figura 3:. Instalação Experimental configuração experimental clássica para gravar sinais (EMG) e torque eletromiográficas.
- Ligar os eléctrodos ao amplificador com cabos.
- Definir a taxa de amostragem para medições de torque e EMG para 2-5 kHz. Gravar o sinal EMG usando um (AD) sistema de conversão analógico-digital. O sinal é exibido num monitor com um sistema de aquisição de dados, que instantaneamente dá valores de vários parâmetros (por exemplo, o valor máximo, a amplitude pico-a-pico, duração). O espectro do sinal de EMG pode variar entre 5 Hz e 2 kHz, mas estão contidas principalmente entre 10 Hz e 1 kHz 31. Assim, frequência de amostragem deve ser alta o suficiente para preservar dur forma de sinaling gravação EMG. Amplificar e filtrar sinais EMG (ganho = 500-100), utilizando uma frequência de largura de banda entre 10 Hz e 1 kHz 8,21,32.
- Coloque o ânodo para a estimulação eléctrica sobre o tendão patelar.
- Determinar o melhor site de estimulação do nervo tibial posterior para obter um reflexo sóleo H ideal para uma determinada intensidade, usando um eletrodo de bola cátodo de mão na fossa poplítea. Teste vários sítios de estimulação com o eléctrodo de cátodo bola até um valor máximo do reflexo H é atingido.
- Registro de atividade EMG tibial anterior para garantir que o nervo fibular comum não é ativado para evitar a influência do antagonista Ia aferentes 12. Definir a largura de pulso em 1 mseg para proporcionar uma activação óptima das fibras nervosas, especialmente fibras aferentes 10.
- Coloque um auto-adesivo de AgCl cátodo na localização do local de estimulação para assegurar condições de estímulo constante (por exemplo, pressão, orienteção).
Nota: Todos estes parâmetros (posição de sujeito, a localização do eletrodo e estimulação do site) não mudam para a avaliação das diferentes medidas eletrofisiológicas. Apenas a intensidade da estimulação e a condição (resto contra contracção) variar.
2. Procedimentos de teste em repouso
- Instrua o assunto para permanecer relaxado e guardar os seus / suas músculos em repouso.
- Ajuste a intensidade de estimulação para obter sóleo máxima H-reflex amplitude (H max; gama de costume: 20-50 mA). Uma onda-M do músculo solear pode ser observado na H intensidade max.
Nota: Para as medições repetidas (por exemplo, antes e depois de um protocolo fatigante), a intensidade óptima para obter uma resposta máxima H pode variar durante a sessão. Como manter uma intensidade constante pode levar a uma subestimação da H max amplitude, recomenda-se que o experimentador reavalia regularmente H maxintensidade 33. - Grave um mínimo de 3 sóleo respostas H-reflex nesta intensidade com um intervalo mínimo de 3 segundos para evitar a depressão pós-ativação 34.
Nota: Embora a gravar várias respostas é mais apropriada devido a sensibilidade específica do H-reflexo, um único estímulo pode ser suficiente em algumas circunstâncias, por exemplo quando se tenta evitar os efeitos de recuperação rápida (por exemplo, durante um protocolo de fadiga). - Aumente a intensidade de estimulação para obter amplitude sóleo M-onda máxima (M max; habitual gama: 40-100 mA). Normalmente, definir o incremento na intensidade de estimulação em 2-4 mA, com um intervalo de 8-10 segundos entre dois estímulos 12,35. A intensidade desejada é atingida quando M max é obtido, e nenhuma resposta H-reflexo pode ser observada.
- Definir a intensidade final de 120-150% de H intensidade do estímulo máximo para assegurar que a onda-M atinge um patamar do seu valor máximo. Esta intensiTy é chamado intensidade supramaximal nas instruções abaixo.
- Mantenha intensidade de estimulação constante para sóleo gravações de ondas M durante toda a sessão.
- Ficha 3 sóleo M-ondas e 3 torques de contração associados a esta intensidade.
3. Procedimentos de teste durante a contração voluntária
- Como um warm-up, pergunte o assunto para executar 10 breves e não-fatigante contrações submáximas dos músculos flexores plantares, com um descanso de alguns segundos entre cada uma das contrações. No final do warm-up, ter um mínimo 1 min de descanso para evitar quaisquer efeitos fatigantes 11.
- Atividade EMG do tríceps sural continuamente recordes. Gravação e os músculos soleus gastrocnemii permite a análise do comportamento de diferentes tipologias musculares para um único local de estimulação 24.
- Instrua o assunto para realizar uma contração isométrica máxima voluntária (MVC) dos flexores plantares. O assunto tem que empurrar tão duro quanto possible contra o ergômetro contraindo os músculos flexores plantares. Dê feedback visual para o assunto durante o esforço, e incentivo verbal padronizado 19. O MVC é atingido quando se atingir um patamar.
- Fornecer um estímulo emparelhado (100 Hz de frequência) a intensidade supramáxima durante o planalto do MVC (dupleto, sobreposto), e uma outra estimulação emparelhados quando o músculo é completamente relaxado imediatamente após a contracção (dupleto potenciada) para avaliar o nível de activação voluntária. Entregue este estímulo emparelhado por meio de um dispositivo específico (por exemplo Digitimer D185 MULTIPULSE estimulador) ou através de um programa de estimulação associada com um único pulso estimulador.
- Instrua o assunto para executar um segundo MVC do flexor plantar com pelo menos 1 min de descanso entre cada ensaio 11. Se o pico de torque do segundo ensaio não está dentro de 5% da primeira, ensaios suplementares deve ser realizada 36. A maior binário conseguida poro sujeito é tomado como o torque MVC.
Análise 4. Dados
- Análise de dados em repouso
- Selecione uma janela de tempo, incluindo a resposta EMG associado à contração em repouso (H-onda ou M-onda).
- Medir a duração amplitude pico-a-pico, pico-a-pico, e / ou a área das ondas (Figura 4A). Se a amplitude não é directamente fornecida pelo software, subtrair o mínimo para os valores máximos.
- Para a duração, medir o tempo de quadro a partir do pico máximo e terminando ao pico mínima. Para a região, calcular o integral do sinal de EMG a partir do início da onda e que termina com o fim da onda.
Nota: amplitude pico-a-pico pode refletir: 1) a transmissão neuromuscular, 2) ação da unidade motora amplitude potencial e / ou 3) dispersão temporal de ação das unidades motoras potencial 37. A duração da onda M reflete propagação neuromuscular 37.
- Para a duração, medir o tempo de quadro a partir do pico máximo e terminando ao pico mínima. Para a região, calcular o integral do sinal de EMG a partir do início da onda e que termina com o fim da onda.
- Para vários ensaios, calcular a média das ondas. Se a média não pode ser diretamente fornecido pelo software, software de planilha uso (por exemplo, a função fórmula em um programa de planilha eletrônica) para calcular este valor a partir de vários estudos (pelo menos 3).
- Selecione a contração descansando.
- Medir o binário associado com o pico de contração repouso (Figura 4B).
- Para vários ensaios, o cálculo do pico de torque médio das contrações musculares descansando. Se a média não pode ser diretamente fornecido pelo software, software de planilha uso (por exemplo, a função fórmula em um programa de planilha eletrônica) para calcular este valor a partir dos vários estudos (pelo menos 3).
- Repita estes procedimentos descritos no ponto 4.1.2 para os outros parâmetros desejados (tempo de contração ou de tempo de meia relaxamento). A análise dos parâmetros de contração fornece indicações sobre a excitação-contracção eficiência de acoplamento 17. Em particular, o contratoião tempo fornece um índice da cinética de contracção 8, o qual pode depender do grupo muscular escolhido 38.
- Calcular a relação entre o pico de torque e a soma de m-ondas usando software de planilha eletrônica (por exemplo, Excel), para quantificar a eficiência eletromecânica (P t / M). À medida que as respostas mecânicas evocadas pela estimulação do nervo tibial posterior correspondem à activação do triceps sural 39 como um todo, as amplitudes de sóleo e gastrocnemii M-ondas deve ser somados.
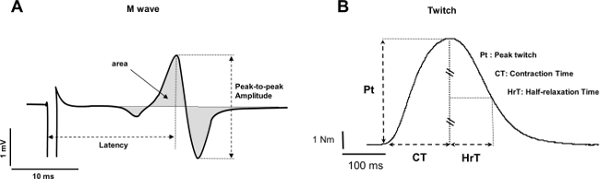
Figura 4: Explicação das respostas eletrofisiológicas e mecânicas (A) Medição da amplitude pico-a-pico (mV), latência (ms) e área (mV.ms) de uma onda M típico.. (B) A medição do binário de pico de contração (Nm), tempo de contracção (MS) e tempo de meia-relaxamento (ms) de um tique. Clique aqui para ver uma versão maior desta figura.
- A análise dos dados em contracção
- Selecione uma janela de tempo de 500 ms de atividade EMG sóleo durante o platô de torque MVC incluindo o pico de torque, mas excluindo o tempo entre o artefacto de estímulo e ao final do período de silêncio de EMG. O período de silêncio corresponde à supressão da atividade EMG voluntário em curso após a estimulação.
- Se a raiz quadrada (RMS) significa não é diretamente fornecido pelo software, calcular o RMS para quantificar atividade EMG através da seguinte fórmula 40: EMG RMS
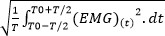
- Medir ou calcular o RMS de M max em repouso ao longo da duração da onda.
- Calcular a relação EMG RMS / RMS Mmax usando software de planilha.RMS valor EMG e valor RMS Mmax tem que ser selecionado a partir do mesmo músculo.
- Medir a pico do binário máximo do MVC a partir da linha de base de torque em repouso para o valor máximo do MVC excluindo o binário sobreposta induzida pela estimulação dupleto (Figura 5).
- Medir o binário sobreposta induzida pela estimulação dupleto durante o MVC, a partir do valor de torque voluntário no início da estimulação para o pico da resposta evocada (Figura 5).
- Selecione o gibão potenciado.
- Meça o pico de torque associado com o gibão potenciado.
- Calcular o nível de ativação voluntária (VAL), utilizando a seguinte fórmula 40:

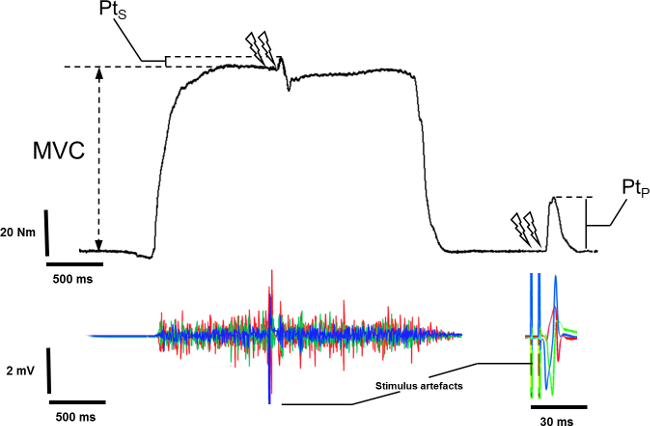
Figura 5: Medição da sobreposta epotenciado gibão em sinal mecânico. Para gravar o pico de torque sobreposta (Pts), a estimulação gibão é evocado durante o platô de contração voluntária máxima isométrica (MVC). Para gravar potencializado pico de torque (Pt P), a estimulação gibão é evocado em repouso após a compensação de MVC.
Access restricted. Please log in or start a trial to view this content.
Resultados
Aumentar a intensidade do estímulo leva a uma evolução diferente das amplitudes de resposta entre H e M-ondas. Em repouso, o reflexo H atinge um valor máximo antes de ser totalmente ausente do sinal de EMG, enquanto a M onda aumenta progressivamente até atingir um planalto a intensidade máxima (ver Figura 4 para uma representação gráfica da onda M e a Figura 6 para a evolução de M-ondas e H-reflex com intensidade). Para o músculo sóleo, a latência entre o ...
Access restricted. Please log in or start a trial to view this content.
Discussão
A estimulação do nervo percutânea permite a quantificação de várias características do sistema neuromuscular não só para compreender o controlo fundamental da função neuromotora em seres humanos saudáveis, mas também de ser capaz de analisar adaptações agudas ou crónicas através de formação 17 ou fadiga. Isto é muito benéfico especialmente para protocolos de fadiga, em que as medições devem ser realizadas tão depressa quanto possível após o final do exercício, para evitar os efeitos...
Access restricted. Please log in or start a trial to view this content.
Divulgações
The authors have nothing to disclose.
Agradecimentos
The authors have no acknowledgements.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Biodex dynamometer | Biodex Medical System Inc., New York, USA | www.biodex.com | |
| MP150 Data Acquisition System | Biopac Systems Inc., Goleta, USA | ||
| Acknowledge 4.1.0 software | Biopac Systems Inc., Goleta, USA | www.biopac.com | |
| DS7A constant current high voltage stimulator | Digitimer, Hertfordshire, UK | www.digitimer.com | |
| Silver chloride surface electrodes | Control Graphique Medical, Brie-Comte-Robert, France | ||
| Computer | |||
| 1 Cable for connecting the Biodex to the MP150 | |||
| 1 Cable for connecting the Digitimer to the MP150 | |||
| 1 Cable for connecting the MP150 to the computer |
Referências
- Desmedt, J. E., Hainaut, K. Kinetics of myofilament activation in potentiated contraction staircase phenomenon in human skeletal muscle. Nature. 217 (5128), 529-532 (1968).
- Bouisset, S., Maton, B. Quantitative relationship between surface EMG and intramuscular electromyographic activity in voluntary movement. American Journal of Physical Medicine. 51 (6), 285-295 (1972).
- Gabriel, D. A. Effects of monopolar and bipolar electrode configurations on surface EMG spike analysis. Medical Engineering and Physics. 33 (9), 1079-1085 (2011).
- Merletti, R., Rainoldi, A., Farina, D. Surface electromyography for noninvasive characterization of muscle. Exercise and Sport Sciences Reviews. 29 (1), 20-25 (2001).
- Lepers, R. Aetiology and time course of neuromuscular fatigue during prolonged cycling exercises. Science, & Motricité. 52, 83-107 (2004).
- Baudry, S., Klass, M., Pasquet, B., Duchateau, J. Age related fatigability of the ankle dorsiflexor muscles during concentric and eccentric contractions. European Journal of Applied Physiology. 100 (5), 515-525 (2007).
- Place, N., Yamada, T., Bruton, J. D., Westerblad, H. Muscle fatigue From observations in humans to underlying mechanisms studied in intact single muscle fibres. European Journal of Applied Physiology. 110 (1), 1-15 (2010).
- Scaglioni, G., Narici, M. V., Maffiuletti, N. A., Pensini, M., Martin, A. Effect of ageing on the electrical and mechanical properties of human soleus motor units activated by the H reflex and M wave. The Journal of Physiology. 548 (Pt. 2), 649-661 (2003).
- Schieppati, M. The Hoffmann reflex a means of assessing spinal reflex excitability and its descending control in man. Progress in Neurobiology. 28 (4), 345-376 (1987).
- Pierrot Deseilligny, E., Burke, D. The circuitry of the human spinal cord: its role in motor control and movement disorders. , Cambridge University Press. (2005).
- Duclay, J., Pasquet, B., Martin, A., Duchateau, J. Specific modulation of corticospinal and spinal excitabilities during maximal voluntary isometric shortening and lengthening contractions in synergist muscles. The Journal of Physiology. 589 (Pt. 11), 2901-2916 (2011).
- Grosprêtre, S., Papaxanthis, C., Martin, A. Modulation of spinal excitability by a sub threshold stimulation of M1 area during muscle lengthening. Neuroscience. 263, 60-71 (2014).
- Mynark, R. G. Reliability of the soleus H reflex from supine to standing in young and elderly. Clinical Neurophysiology. 116 (6), 1400-1404 (2005).
- Palmieri, R. M., Hoffman, M. A., Ingersoll, C. D. Intersession reliability for H reflex measurements arising from the soleus peroneal and tibialis anterior musculature. The International Journal of Neuroscience. 112 (7), 841-850 (2002).
- Chen, Y. S., Zhou, S., Cartwright, C., Crowley, Z., Baglin, R., Wang, F. Test retest reliability of the soleus H reflex is affected by joint positions and muscle force levels. Journal of Electromyography and Kinesiology. 20 (5), 987-987 (2010).
- Lehman, G. J., McGill, S. M. The importance of normalization in the interpretation of surface electromyography A proof of principle. Journal of Manipulative and Physiological Therapeutics. 22 (7), 444-446 (1999).
- Lepers, R. Interest and limits of percutaneous nerve electrical stimulation in the evaluation of muscle fatigue. Science, & Motricité. 70 (70), 31-37 (2010).
- Merton, P. A. Voluntary strength and fatigue. The Journal of Physiology. 123, 553-564 (1954).
- Gandevia, S. C. Spinal and supraspinal factors in human muscle fatigue. Physiological Reviews. 81 (4), 1725-1789 (2001).
- Shield, A., Zhou, S. Assessing voluntary muscle activation with the twitch interpolation technique. Sports Medicine. 34 (4), 253-267 (2004).
- Rozand, V., Pageaux, B., Marcora, S. M., Papaxanthis, C., Lepers, R. Does mental exertion alter maximal muscle activation. Frontiers in Human Neuroscience. 8, 755(2014).
- Place, N., Maffiuletti, N. A., Martin, A., Lepers, R. Assessment of the reliability of central and peripheral fatigue after sustained maximal voluntary contraction of the quadriceps muscle. Muscle and Nerve. 35 (4), 486-495 (2007).
- Kannus, P. Isokinetic evaluation of muscular performance: implications for muscle testing and rehabilitation. International Journal of Sports Medicine. 15, Suppl 1. S11-S18 (1994).
- Tucker, K. J., Tuncer, M., Türker, K. S. A review of the H reflex and M wave in the human triceps surae. Human Movement Science. 24 (5-6), 667-688 (2005).
- Taylor, N. A., Sanders, R. H., Howick, E. I., Stanley, S. N. Static and dynamic assessment of the Biodex dynamometer. European Journal of Applied Physiology and Occupational Physiology. 62 (3), 180-188 (1991).
- Sale, D., Quinlan, J., Marsh, E., McComas, A. J., Belanger, A. Y. Influence of joint position on ankle plantarflexion in humans. Journal of Applied Physiology. 52 (6), 1636-1642 (1982).
- Cattagni, T., Martin, A., Scaglioni, G. Is spinal excitability of the triceps surae mainly affected by muscle activity or body position. Journal of Neurophysiology. 111 (12), 2525-2532 (2014).
- Gerilovsky, L., Tsvetinov, P., Trenkova, G. Peripheral effects on the amplitude of monopolar and bipolar H-reflex potentials from the soleus muscle. Experimental Brain Research. 76 (1), 173-181 (1989).
- Schieppati, M. The Hoffmann reflex a means of assessing spinal reflex excitability and its descending control in man. Progress in Neurobiology. 28 (4), 345-376 (1987).
- Hermens, H. J., Freriks, B., Disselhorst Klug, C., Rau, G. Development of recommendations for SEMG sensors and sensor placement procedures. Journal of Electromyography and Kinesiology. 10 (5), 361-374 (2000).
- Kamen, G., Sison, S. V., Du, C. C., Patten, C. Motor unit discharge behavior in older adults during maximal effort contractions. Journal of Applied Physiology. 79 (6), 1908-1913 (1995).
- Neyroud, D., Rüttimann, J., et al. Comparison of neuromuscular adjustments associated with sustained isometric contractions of four different muscle groups. Journal of Applied Physiology. 114, 1426-1434 (2013).
- Rupp, T., Girard, O., Perrey, S. Redetermination of the optimal stimulation intensity modifies resting H-reflex recovery after a sustained moderate-intensity muscle contraction. Muscle and Nerve. 41 (May), 642-650 (2010).
- Zehr, E. P. Considerations for use of the Hoffmann reflex in exercise studies. European Journal of Applied Physiology. 86 (6), 455-468 (2002).
- Gondin, J., Duclay, J., Martin, A. Soleus and gastrocnemii evoked V wave responses increase after neuromuscular electrical stimulation training. Journal of Neurophysiology. 95 (6), 3328-3335 (2006).
- Rochette, L., Hunter, S. K., Place, N., Lepers, R. Activation varies among the knee extensor muscles during a submaximal fatiguing contraction in the seated and supine postures. Journal of Applied Physiology. 95 (4), 1515-1522 (2003).
- Fuglevand, A. J., Zackowski, K. M., Huey, K. A., Enoka, R. M. Impairment of neuromuscular propagation during human fatiguing contractions at submaximal forces. The Journal of Physiology. 460, 549-572 (1993).
- Vandervoort, A. A., McComas, A. J. Contractile changes in opposing muscles of the human ankle joint with aging. Journal of Applied Physiology. 61 (1), 361-367 (1986).
- Grosprêtre, S., Martin, A. Conditioning effect of transcranial magnetic stimulation evoking motor evoked potential on V wave response. Physiological Reports. 2 (11), e12191(2014).
- Allen, G. M., Gandevia, S. C., McKenzie, D. K. Reliability of measurements of muscle strength and voluntary activation using twitch interpolation. Muscle and Nerve. 18 (6), 593-600 (1995).
- Cooper, M. A., Herda, T. J., Walter Herda, A. A., Costa, P. B., Ryan, E. D., Cramer, J. T. The reliability of the interpolated twitch technique during submaximal and maximal isometric muscle actions. Journal of Strength and Conditioning Research. 27 (10), 2909-2913 (2013).
- Froyd, C., Millet, G. Y., Noakes, T. D. The development of peripheral fatigue and short term recovery during self paced high intensity exercise. The Journal of Physiology. 591 (Pt 5), 1339-1346 (2013).
- Pierrot Deseilligny, E., Morin, C., Bergego, C., Tankov, N. Pattern of group I fibre projections from ankle flexor and extensor muscles in man. Experimental Brain Research. 42 (3-4), 337-350 (1981).
- Brooke, J. D., McIlroy, W. E., et al. Modulation of H reflexes in human tibialis anterior muscle with passive movement. Brain Research. 766 (1-2), 236-239 (1997).
- Hultborn, H., Meunier, S., Morin, C., Pierrot Deseilligny, E. Assessing changes in presynaptic inhibition of I a fibres a study in man and the cat. The Journal of Physiology. 389, 729-756 (1987).
- Meunier, S., Pierrot Deseilligny, E. Cortical control of presynaptic inhibition of Ia afferents in humans. Experimental Brain Research. 119 (4), 415-426 (1998).
- Aymard, C., Baret, M., Katz, R., Lafitte, C., Pénicaud, A., Raoul, S. Modulation of presynaptic inhibition of la afferents during voluntary wrist flexion and extension in man. Experimental Brain Research. 137 (1), 127-131 (2001).
- Abbruzzese, G., Trompetto, C., Schieppati, M. The excitability of the human motor cortex increases during execution and mental imagination of sequential but not repetitive finger movements. Experimental Brain Research. 111 (3), 465-472 (1996).
- Garland, S. J., Klass, M., Duchateau, J. Cortical and spinal modulation of antagonist coactivation during a submaximal fatiguing contraction in humans. Journal of Neurophysiology. 99, 554-563 (2008).
- Rodriguez Falces, J., Place, N. Recruitment order of quadriceps motor units Femoral nerve vs direct quadriceps stimulation. European Journal of Applied Physiology. 113, 3069-3077 (2013).
- Rodriguez Falces, J., Maffiuletti, N. A., Place, N. Spatial distribution of motor units recruited during electrical stimulation of the quadriceps muscle versus the femoral nerve. Muscle and Nerve. 48 (November), 752-761 (2013).
- Bathien, N., Morin, C. Comparing variations of spinal reflexes during intensive and selective attention (author’s transl). Physiology, & Behavior. 9 (4), 533-538 (1972).
- Earles, D. R., Koceja, D. M., Shively, C. W. Environmental changes in soleus H reflex excitability in young and elderly subjects. The International Journal of Neuroscience. 105 (1-4), 1-13 (2000).
- Paquet, N., Hui Chan, C. W. Human soleus H reflex excitability is decreased by dynamic head and body tilts. Journal of Vestibular Research Equilibrium, & Orientation. 9 (5), 379-383 (1999).
- Miyahara, T., Hagiya, N., Ohyama, T., Nakamura, Y. Modulation of human soleus H reflex in association with voluntary clenching of the teeth. Journal of Neurophysiology. 76 (3), 2033-2041 (1996).
- Pinniger, G. J., Nordlund, M. M., Steele, J. R., Cresswell, a GH reflex modulation during passive lengthening and shortening of the human triceps surae. Journal of Physiology. 534 (Pt 3), 913-923 (2001).
- Tallent, J., Goodall, S., Hortobágyi, T., St Clair Gibson, A., French, D. N., Howatson, G. Repeatability of corticospinal and spinal measures during lengthening and shortening contractions in the human tibialis anterior muscle). PLoS ONE. 7 (4), e35930(2012).
- Grospretre, S., Martin, A. H. reflex and spinal excitability methodological considerations. Journal of Neurophysiology. 107 (6), 1649-1654 (2012).
- Hugon, M. Methodology of the Hoffmann reflex in man. New Developments in Electromyography and Chemical Neurophysiology. 3m, 277-293 (1973).
- Bigland Ritchie, B., Zijdewind, I., Thomas, C. K. Muscle fatigue induced by stimulation with and without doublets. Muscle and Nerve. 23 (9), 1348-1355 (2000).
- Kent Braun, J. A., Le Blanc, R. Quantitation of central activation failure during maximal voluntary contractions in humans. Muscle and Nerve. 19 (7), 861-869 (1996).
- Herbert, R. D., Gandevia, S. C. Twitch interpolation in human muscles mechanisms and implications for measurement of voluntary activation. Journal of Neurophysiology. 82, 2271-2283 (1999).
- Miller, M., Downham, D., Lexell, J. Superimposed single impulse and pulse train electrical stimulation A quantitative assessment during submaximal isometric knee extension in young healthy men. Muscle and Nerve. 22 (8), 1038-1046 (1999).
- Button, D. C., Behm, D. G. The effect of stimulus anticipation on the interpolated twitch technique. Journal of Sports Science and Medicine. 7 (4), 520-524 (2008).
- Goss, D. a, Hoffman, R. L., Clark, B. C. Utilizing Transcranial Magnetic Stimulation to Study the Human Neuromuscular System. Journal of Visualized Experiments. (59), e3387(2012).
- Sartori, L., Betti, S., Castiello, U. Corticospinal excitability modulation during action observation. Journal Of Visualized Experiments: Jove. (82), 51001(2013).
- Rozand, V., Lebon, F., Papaxanthis, C., Lepers, R. Does a mental training session induce neuromuscular fatigue. Medicine and Science in Sports and Exercise. 46 (10), 1981-1989 (2014).
- Rozand, V., Cattagni, T., Theurel, J., Martin, A., Lepers, R. Neuromuscular fatigue following isometric contractions with similar torque time integral. International Journal of Sports Medicine. 36, 35-40 (2015).
- Belanger, A. Y., McComas, A. J. Extent of motor unit activation during effort. Journal of Applied Physiology. 51 (5), 1131-1135 (1981).
- Morse, C. I., Thom, J. M., Davis, M. G., Fox, K. R., Birch, K. M., Narici, M. V. Reduced plantarflexor specific torque in the elderly is associated with a lower activation capacity. European Journal of Applied Physiology. 92 (1-2), 219-226 (2004).
- Dalton, B. H., McNeil, C. J., Doherty, T. J., Rice, C. L. Age related reductions in the estimated numbers of motor units are minimal in the human soleus. Muscle and Nerve. 38 (3), 1108-1115 (2008).
- Hunter, S. K., Todd, G., Butler, J. E., Gandevia, S. C., Taylor, J. L. Recovery from supraspinal fatigue is slowed in old adults after fatiguing maximal isometric contractions. Journal of Applied Physiology. 105 (4), 1199-1209 (2008).
- Jakobi, J. M., Rice, C. L. Voluntary muscle activation varies with age and muscle group. Journal of Applied Physiology. 93 (2), 457-462 (2002).
- Lepers, R., Millet, G. Y., Maffiuletti, N. a Effect of cycling cadence on contractile and neural properties of knee extensors. Medicine and Science in Sports and Exercise. 33 (11), 1882-1888 (2001).
- Duchateau, J., Hainaut, K. Isometric or dynamic training differential effects on mechanical properties of a human muscle. Journal of Applied Physiology. 56 (2), 296-301 (1984).
- Millet, G. Y., Martin, V., Martin, A., Vergès, S. Electrical stimulation for testing neuromuscular function From sport to pathology. European Journal of Applied Physiology. 111, 2489-2500 (2011).
- Cattagni, T., Scaglioni, G., Laroche, D., Van Hoecke, J., Gremeaux, V., Martin, A. Ankle muscle strength discriminates fallers from non fallers. Frontiers in Aging Neuroscience. 6, 336(2014).
- Horstman, A. M., Beltman, M. J., et al. Intrinsic muscle strength and voluntary activation of both lower limbs and functional performance after stroke. Clinical Physiology and Functional Imaging. 28 (4), 251-261 (2008).
- Sica, R. E., Herskovits, E., Aguilera, N., Poch, G. An electrophysiological investigation of skeletal muscle in Parkinson’s disease. Journal of the Neurological Sciences. 18 (4), 411-420 (1973).
- Knikou, M., Mummidisetty, C. K. Locomotor Training Improves Premotoneuronal Control after Chronic Spinal Cord Injury. Journal of Neurophysiology. 111 (11), 2264-2275 (2014).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados